Водород — Википедия
| Водород | |
|---|---|
| Гелий → | |
| Газ без цвета, запаха и вкуса | |
 Водород в разрядной трубке | |
| Название, символ, номер | Водород / Hydrogenium (H), 1 |
| Атомная масса (молярная масса) | [1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) |
| Электронная конфигурация | 1s1 |
| Радиус атома | 53 пм |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность | 2,20[2] (шкала Полинга) |
| Степени окисления | +1, 0, −1 |
| Энергия ионизации (первый электрон) | 1311,3 (13,595) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ |
| Температура плавления | 14,01 K; −259,14 °C |
| Температура кипения | 20,28 K; −252,87 °C |
| Уд. теплота плавления | 0,117 кДж/моль |
| Уд. теплота испарения | 0,904 кДж/моль |
| Молярная теплоёмкость | 28,47[3] Дж/(K·моль) |
| Молярный объём | 14,1 см³/моль |
| Структура решётки | гексагональная |
| a = 3,780 c = 6,167 Å | |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Номер CAS | 12385-13-6 |
 | |
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород[4][5].
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода[6][7].
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал[8]:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Во Вселенной[править | править код]
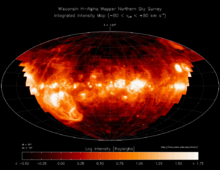
В настоящее время водород — самый распространённый элемент во Вселенной[9]. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[10]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы[править | править код]
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %[13].
В промышленности[править | править код]
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа.[14] Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO
- Ch5+h3O ⇄ CO+3h3{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- h3O+C ⇄ CO↑+h3↑{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}
- 2NaCl+2h3O → 2NaOH+Cl2↑+h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {}}\ 2NaOH+Cl_{2}\uparrow +H_{2}\uparrow }}}
- 2h3O→4e−2h3↑+O2↑{\displaystyle {\ce {2h3O ->[4e^{-}] 2h3 ^ + O2 ^}}}
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[15] (англ.).
- 2Ch5+O2⇄ 2CO+4h3{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
В лаборатории[править | править код]
- Zn+h3SO4→ZnSO4+h3↑{\displaystyle {\mathsf {Zn+H_{2}SO_{4}\rightarrow ZnSO_{4}+H_{2}\uparrow }}}
- Ca+2h3O→Ca(OH)2+h3↑{\displaystyle {\mathsf {Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}\uparrow }}}
- NaH+h3O→NaOH+h3↑{\displaystyle {\mathsf {NaH+H_{2}O\rightarrow NaOH+H_{2}\uparrow }}}
- 2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}\uparrow }}}
- Zn+2KOH+2h3O→K2[Zn(OH)4]+h3↑{\displaystyle {\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}}
- 2h4O++2e−→2h3O+h3↑{\displaystyle {\mathsf {2H_{3}O^{+}+2e^{-}\rightarrow 2H_{2}O+H_{2}\uparrow }}}
Очистка[править | править код]
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ)[16].
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость[править | править код]
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг.[17] В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
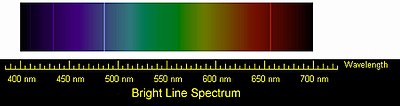
 Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии БальмераВодород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[18]. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
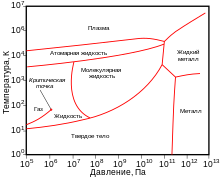
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2[⇨].
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[19]. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением[20][21].
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация параводорода в смеси в зависимости от температурыРазделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25[22]. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
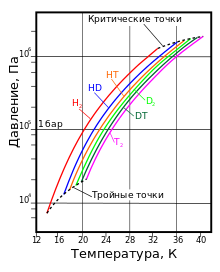 Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Термодинамическое состояние насыщенного пара водорода с различным изотопным составомНаиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2Н (ядро состоит из одного протона и одного нейтрона) и тритий 3Н (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно[23]. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3[23]. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[23].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[24].
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов[править | править код]
Свойства изотопов водорода представлены в таблице[23][25].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1⋅10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Доля диссоциировавших молекул водорода при атмосферном давлении в зависимости от температурыМолекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- h3→ 2H−432{\displaystyle {\mathsf {H_{2}\rightarrow {}\ 2H-432}}} кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
- Ca+h3→ Cah3{\displaystyle {\mathsf {Ca+H_{2}\rightarrow {}\ CaH_{2}}}}
и с единственным неметаллом — фтором, образуя фтороводород:
- F2+h3→ 2HF{\displaystyle {\mathsf {F_{2}+H_{2}\rightarrow {}\ 2HF}}}
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
- O2+2h3→ 2h3O{\displaystyle {\mathsf {O_{2}+2H_{2}\rightarrow {}\ 2H_{2}O}}}
Записанное уравнение отражает восстановительные свойства водорода.
- CuO+h3→
Урок 12. Водород и кислород – HIMI4KA

Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
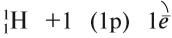
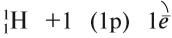
Природный водород состоит из трех изотопов: протий 1Н, дейтерий 2Н и тритий 3Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
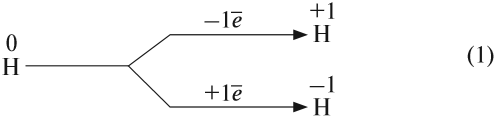

Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
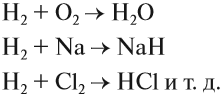
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
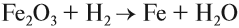
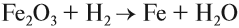
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
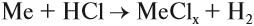
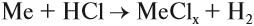
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
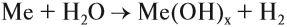
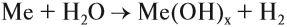
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
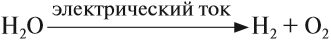
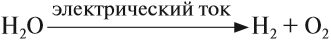
а также при пропускании паров воды через раскалённые железные опилки:
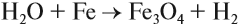
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.


Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
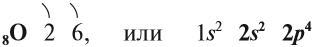
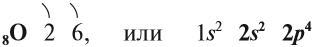
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
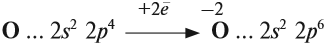
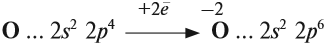
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
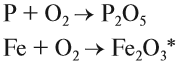
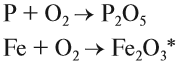
* Точнее, Fe3O4.
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
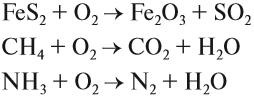
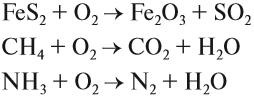
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
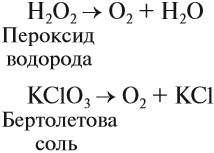
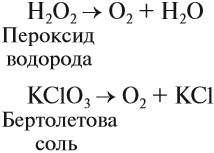
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.


Вода
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
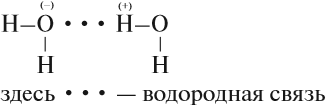
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.


Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Водород. Физические и химические свойства, получение » HimEge.ru
Водород H — самый распространённый элемент во Вселенной (около 75 % по массе), на Земле — девятый по распространенности. Наиболее важным природным соединением водорода является вода.
Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы. Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах h3O растворяется 2 объема h3). Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
В лаборатории:
1.Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие щелочных и щ-з металлов с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
4.Действие щелочей на цинк или алюминий или кремний:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
Si + 2NaOH + H2O → Na2SiO3 + 2H2
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
В сумме:
CH4 + 2 H2O → 4 H2 + CO2
2. Пары воды через раскаленный кокс при 1000оС:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
3. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
СH4 → С + 2Н2↑
4. Электролизом водных растворов KCl или NaCl, как побочный продукт:
2Н2О + 2NaCl→ Cl2↑ + H2↑ + 2NaOH
Химические свойства водорода
- В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1.
- Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н2
- Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж: Н2 = 2Н, ∆H° = 436 кДж/моль
- Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
- Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.
При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серойь(значительно труднее с селеном и теллуром):
Н2 + S → H2S (сероводород),
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
6) С щелочными и щелочноземельными металлами образует гидриды (водород – окислитель):
Н2 + 2Li → 2LiH
в гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na+H— построен подобно хлориду Na+Cl—
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
Fe3O4 + 4H2 → 3Fe + 4Н2О
8) с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие.
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.
Свойства водорода — урок. Химия, 8–9 класс.
Физические свойства
Водород имеет молекулярное строение. Его молекула h3 состоит из двух атомов, соединённых ковалентной неполярной связью.
При обычных условиях водород — газ без цвета, запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно \(0,9\) г/дм³. Водород в \(14,5\) раз легче воздуха.
В воде водород растворяется плохо (примерно \(2\) объёма на \(100\) объёмов воды), но может поглощаться некоторыми металлами. Например, \(1\) объём палладия может растворить до \(900\) объёмов водорода.
Температура кипения водорода низкая. Она равна \(–253\) °С. Ниже температура кипения только у гелия.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
Химические свойства
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов).
- Водород реагирует с кислородом. При этом образуется вода:
2h3+O2=t2h3O.
Смесь водорода с кислородом или с воздухом взрывоопасна.
- При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
h3+Cl2=hν2HCl.
Подобным образом водород реагирует и с другими галогенами: фтором, бромом, иодом.
- Если водород пропускать над нагретой серой, то образуется сероводород:
h3+S=th3S.
- В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
N2+3h3=t,p,k2Nh4.
Обрати внимание!
В реакциях с неметаллами водород является восстановителем.
2. Взаимодействие с простыми веществами-металлами.
При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:
2Na+h3=t2NaH,
Ca+h3=tCah3.
Обрати внимание!
В реакциях с металлами водород является окислителем.
3. Взаимодействие со сложными веществами.
- Водород способен реагировать с оксидами металлов (кроме оксидов щелочных и щелочноземельных металлов, бериллия, магния, алюминия):
WO3+3h3=tW+3h3O,
CuO+h3=tCu+h3O.
- Водород реагирует с угарным газом с образованием метилового спирта:
CO+2h3→Ch4OH.
- Водород вступает в реакции со многими органическими веществами.
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 137 с.
Молекула водорода — это… Что такое Молекула водорода?
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H
Модели молекулы водорода
Рис.1.Модель водорода по Бору и осевая проекция электронного кольцаН.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Н.Бора отражала кулоновскую электронную корреляцию — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
re2 = a02 — (d/2)2; re = 0,377 Å.
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
Рис.3.Модель молекулы водорода в теории валентных связейКвантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан
Гамильтониан молекулы водорода H2 записывается в виде
- ,
где M — масса протона, m — масса электрона, — координаты ядер, — координаты электронов.
В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках и .
Гамильтониан электронной подсистемы имеет вид
- ,
Гамильтониан молекулы водорода симметричен относительно переменных и , то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.
Волновые функции
 Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи 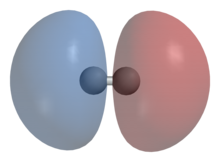 Схематическое изображение антисимметричной волновой функции молекулы водорода
Схематическое изображение антисимметричной волновой функции молекулы водородаИсходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода .
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
- .
Для двух возможных волновых функций основного состояния она приобретает вид
- ,
где — расстояние между ядрами, — значение энергии основного состояния атома водорода, — интеграл перекрытия, который определяется выражением
- ,
— кулоновский интеграл, определяемый как
- ,
— обменный интерграл, равный
- .
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь
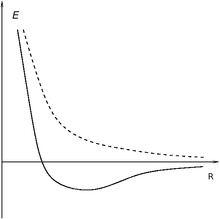 Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состоянийОбменный интеграл для молеклы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
- ,
где — приведённая масса двух ядер, — энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе), — оператор углового момента, описывающий вращение молекулы.
Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
- .
Вклад вращения в энергию молекулы равен
- .
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию можно разложить в ряд Тейлора, ограничившись только квадратичным членом.
- ,
где
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
- ,
где — колебательное квантовое число.
Низшая энергия колебания отвечает нулевым колебаниям.
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально , вращательное пропорционально . Поэтому
- .
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Пара- и ортоводород
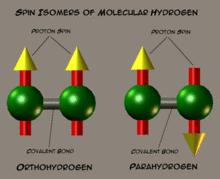 Схематическое изображене спиновых изомеров водорода
Схематическое изображене спиновых изомеров водородаЯдра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Характеристики молекулы водорода
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
См. также
Примечания
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
Литература
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973. (укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки. — Київ: Либідь, 2002.
- Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.
как вычислить массу одной молекулы водорода и кислорода?
если нужно вычислить массу одной молекулы в граммах (или кг) нужно для начала найти молярную массу вещества: для водорода М (Н2) = 2 г/моль для кислорода М (O2) = 32 г/моль теперь делим данную массу на число авогадро m(h3) = 2 / 6 * 10^23 = 3.33333 * 10^-24 гр m(O2) = 32 / 6 * 10^23 = 5.33333 * 10^-23 гр Ничего сложного))))))
Посмотреть в таблице Менделеева сколько весит атом и умножить на два.
глянь в таблицу менделева атом водорода весит 1 уе а молекула Н2=2уае атом кислорода весит 16 уе а молекула О2=32 уе
Мне кажется, что нужно решать так. Количество вещества определяется по формуле = количество молекул поделить на число Авогадро = 1/(6,02*10^23). Или массу поделить на молярную массу вещества. Отсюда масса молекулы равна количество вещества умножить на молярную массу вещества. Для водорода масса равна 1/(6,02*10^23). Для кислорода — 16/(6,02*10^23).
если нужно вычислить массу одной молекулы в граммах (или кг) нужно для начала найти молярную массу вещества: для водорода М (Н2) = 2 г/моль для кислорода М (O2) = 32 г/моль теперь делим данную массу на число авогадро m(h3) = 2 / 6 * 10^23 = 3.33333 * 10^-24 гр m(O2) = 32 / 6 * 10^23 = 5.33333 * 10^-23 гр Ничего сложного))))))

