строение в различных агрегатных состояниях
Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
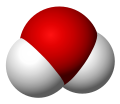
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.

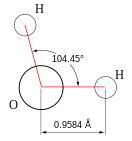
Молекула воды, картинка № 1
По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода.Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.

На картинке № 2 показано образование димера воды с одной водородной связью.
Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.

Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.

Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Список литературы
- Химия и микробиология воды. Учебное пособие В. В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ им. М.В. Ломоносова, 2016
Молекула воды Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 1 г/см3[2] | ||
| Твёрдость | 1,5[6] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| • кипения | 40,656 кДж/моль[3] и 40 655,928 Дж/моль[4] | ||
| Удельная теплота испарения | 2256,2 кДж/кг[5] | ||
| Удельная теплота плавления | 332,4 кДж/кг[5] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | 231-791-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Вода́ (оксид водорода, гидроксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[7][8].
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[9], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[10].
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[11][12]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озёрах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты[13][14].
Этимология
Происходит от др.-русск. вода, далее от праславянского *voda[15] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *wed-, родственно лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. get «река», фриг. βέδυ, др.-инд. udakám, uda-, udán— «вода», unátti «бить ключом», «орошать», ṓdman— «поток», алб. uj «вода»[16][17]. Также родственно русским словам ведро, выдра. В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и пр. словами, и реконструироваться как *wetV для праязыка[18].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
- Дигидромонооксид
Свойства
Физические свойства
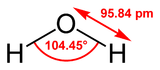
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[19]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[19]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °C, а замерзала при −100 °C[20].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[21]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[22][23][24]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[25]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
По состоянию различают:
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[26]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
Основная статья: ABC.es, Испания
ABC.es, Испания © CC0 / Public Domain, Anja / Pixabay | Перейти в фотобанк
© CC0 / Public Domain, Anja / Pixabay | Перейти в фотобанкВода очень необычно реагирует на очень низкие температуры. Существующие гипотезы, объясняющие это, вызывают ожесточенную полемику в научных кругах. Одна из них была сформулирована почти три десятилетия назад и заключалась в том, что существуют два вида воды. Совсем недавно итальянским ученым удалось найти доказательства в ее защиту.
Сформулированная почти 30 лет идея была доказана в лаборатории.
Хосе Мануэль Ньевес (José Manuel Nieves)Вода очень необычно реагирует на очень низкие температуры. Начнем с того, что при охлаждении, вопреки логике, вода не сжимается, а расширяется (именно поэтому лед имеет свойство плавучести). Холодная вода обладает меньшей сжимаемостью, чем горячая. Более того, при заморозке молекулы воды могут всячески менять свое расположение.
Всему этому сложно найти объяснения, причем существующие теории вызывают ожесточенную полемику в научных кругах. Одна из них была сформулирована почти три десятилетия назад и заключалась в том, что ледяная вода может существовать в двух разных жидких формах, одна из которых обладает менее плотной структурой. Другими словами, существует два вида воды, каждый из которых является отдельной жидкостью. Доказать эту теорию в лаборатории сложно, но итальянским ученым удалось найти доказательства в ее защиту. Исследование было недавно опубликовано в журнале Science.
В своем исследовании ученые Пабло Дебенедетти и Гюль Х. Зерце из Принстонского университета и Франческо Шортико из Ла Сапиенца в Риме предполагают, что «вторая критическая точка воды» возникает при температурах от —83 до —100 градусов и при атмосферном давлении почти в 2000 раз выше, чем давление над уровнем моря. Критическая точка — это единственное значение температуры и давления, при котором две фазы вещества становятся неразличимыми, и происходит это непосредственно перед тем, как вещество переходит из одной фазы в другую. Вода, например, имеет хорошо известную критическую точку при переходе от жидкости к пару.
«Только вообразите нашу радость, когда мы увидели, что критические колебания протекают именно так, как мы и предполагали, — объясняет Сортино, — теперь я могу спать спокойно, потому что спустя 25 лет моя идея наконец-то нашла подтверждение».
До сих пор эксперименты с использованием реальных молекул воды для проверки второй критической точки «суперохлаждения» воды не могли дать однозначных доказательств его существования. По словам Дебенедетти, это во многом связано с тем, что ледяная вода обычно превращается в лед.
По этой причине исследователи решили прибегнуть к использованию компьютерных моделей. Процесс по-настоящему трудоемкий: несмотря на высокую мощность современных суперкомпьютеров, для создания моделей ученые 18 месяцев занимались необходимыми вычислениями.
В симуляциях, когда температура была еще далека от точки замерзания, плотность воды начала сильно колебаться. В итоге ученым удалось обнаружить критическую точку, которую они искали в двух разных компьютерных моделях воды. При этом для поиска критической точки воды в обеих моделях были применены разные вычислительные подходы.
Как и при переходе от жидкой фазы к газовой фазе, ледяная вода может переходить в две разные фазы, в зависимости от того, как перегруппировались ее молекулы. Таким образом, в жидкости низкой плотности четыре молекулы группируются вокруг центральной молекулы, образуя тетраэдр. Однако в жидкости с более высокой плотностью в игру вступает шестая молекула, что приводит к увеличению ее плотности.
В своей статье исследователи пишут, что «в пределах наших вычислительных возможностей было доказано существование метастабильной критической точки в стадии глубокого охлаждения молекул воды».
Естественно, теперь этот вывод должен быть подтвержден другими экспериментами, «использующими более точные и дорогие вычислительные средства».
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ.
Подписывайтесь на наш канал в Telegram и получайте переводы самых ярких материалов зарубежных СМИ.Молекула воды
Химический состав воды отвечает на вопрос, из чего состоит молекула воды. А как эта молекула устроена — никто не знал вплоть до августа 1933 года.
Честь окончательного открытия строения молекулы воды, а на ее и структуры воды принадлежит двум английским ученым Дж. Берналу и Р. Фаулеру.
В августовском номере только что созданного международного журнала по химической физике «Journal of Chemical Physics» была опубликована их классическая работа о структуре воды, основанной на взаимодействии молекул воды с себе подобными молекулами и ионами разных сортов.
И что самое интересное, что свое открытие ученые сделали чисто умозрительно.
Правда, в своей научной прозорливости Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения молекул воды, структуры льда, строения простых жидкостей, на данные рентгеноструктурного анализа воды и водных растворов.
Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам в какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды (удельный вес) должна была бы быть не 1 г/см3, а более 1,8 г/см3. Это первое. Второе доказательство в пользу особой структуры молекулы воды состояло в том, что в отличие от других жидкостей вода — это было уже известно — обладает сильным электрическим моментом, составляющим ее дипольную структуру.
Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметричной конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.е. Н-О-Н.
Эти и другие экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды «однобока» и имеет «уголковую» конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода (рис.4).
Рис. 4. Форма молекулы воды:
а) электронное облако молекулы воды;
б) взаимное расположение ядер кислорода (О) и водорода (Н) в молекуле Н2O.
Только такая конструкция молекулы воды могла объяснить ажурный способ сцепления молекул друг с другом, структуру воды и необъятный мир ее аномальных свойств.
Дальнейшие многочисленные исследования интернационального мира ученых блестяще подтвердили открытие Дж. Бернала и Р. Фаулера.
В наше время информацию о форме и размерах молекулы воды можно получить, анализируя данные рентгеноструктурного и «машинного» эксперимента, спектра поглощения и других исследований.
Усилиями ученых всего мира, наконец, удалось «увидеть» это удивительное создание — молекулу воды!
На рис.4 показана форма молекулы воды в газообразной фазе и ее основные конструктивные параметры.
Оказалось, что это — шарик с двумя бугорками и с довольно упругой поверхностью, ограниченной электронным облаком. Это облако не однородно. В области «бугорков», где расположены ядра водорода, выявлен недостаток электронной плотности, а в диаметрально противоположной стороне ближе к ядру кислорода — избыток электронной плотности. Указанная структурная особенность предопределяет полярность молекулы воды.
Используя новейшие достижения науки и исследовательской техники, выдающийся датский ученый Н.Бьеррум пришел к выводу о тетраэдрическом взаимном расположении положительных и отрицательных зарядов в молекуле воды. Согласно Н. Бьерруму, если соединить прямыми линиями эпицентры положительных и отрицательных зарядов молекулы воды, то получается правильный тетраэдр, рис. 5.
Не трудно догадаться, что каждая молекула воды в кругу себе подобных должна как-то ориентироваться, притягиваясь разноименными зарядами и отталкиваясь одна от другой одноименными зарядами.
Страницы: 1 2 3 4 5
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 1 г/см3[2] | ||
| Твёрдость | 1,5[6] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| • кипения | 40,656 кДж/моль | ||
В эзотерике, мистике и даже вполне бытовых вопросах часто встречается термин «структурированная вода», подразумевающий некое сверхвещество, обладающее лекарственными и магическими свойствами, в том числе способностью переносить информацию. Есть люди, которые в это верят и тратят заметные деньги на «структурирование» воды и прочие оккультные действия. Давайте разберёмся, откуда появился этот миф и почему у воды не может быть памяти.

Денис Байгозин
Химик, преподаватель и автор блога о химии. Занимал должность ведущего разработчика компании «Аквафор».
Уникальна ли вода
В школьной программе за 8‑й класс есть урок под названием «Уникальные свойства воды». На нём рассказывают про «непредсказуемо экстремальные» температуры плавления и кипения, про диполи и ионные силы. К сожалению, этот урок, точнее плохое его усвоение, и закладывает первый фундамент для веры в мистическую структуру воды.
Уже много десятилетий прошло с тех пор, как учёные в деталях объяснили значительные отличия воды от соседей по группе: сероводорода, селеноводорода и теллуроводорода. Уникальные свойства h3O вызывает большой дипольный момент , помноженный на способность к образованию водородных связей.
 Водородные связи между молекулами воды. Иллюстрация: Лайфхакер
Водородные связи между молекулами воды. Иллюстрация: ЛайфхакерКонцы молекулы h3O сильно заряжены, а водороды легко становятся общими, объединяя две и более молекулы и не давая им расцепиться и улететь в виде пара. Всё просто. Вернее, сложно, но объяснимо в рамках науки, без обращения к мистике. И кстати, «магически точные» значения температур плавления (0 °С) и кипения (100 °С) воды не несут символизма, а выбраны людьми для удобства. Это шкалу Цельсия подстраивали под воду, а не наоборот.
Понятно, почему вода уникальна. Но почему ей приписывают наличие памяти, а не процессора, монитора или других частей компьютера?
Не шарлатан, но и не гений — кто такой Жак Бенвенист
На многих сайтах, посвящённых «структуре воды», упоминается имя Жака Бенвениста как отца‑основателя информационной теории воды. Что же он сделал? Этот французский учёный‑иммунолог в 1988 году исследовал разведение анти‑IgE‑антител и их влияние на человеческие базофильные клетки. То есть изучал иммунный ответ. Результаты, которые Бенвенист хотел опубликовать в журнале Nature, казалось, соответствовали идеям гомеопатии: при разведении в миллионы раз активность препарата сохранялась.
Однако статью в первой редакции отозвали с просьбой уточнить эксперимент или объяснить его теоретически. Вместо того чтобы перепроверить странные результаты, Бенвенист ввёл понятие «памяти воды» и «информационной структуры», которую можно скопировать с лекарства и бесконечно множить в воде, делая её активной. Крутая идея, которая могла бы спасти многие жизни.
К сожалению, попытки повторить эксперимент в других лабораториях ждал провал . Более того, при введении двойного слепого метода Бенвенист лично не смог воспроизвести свои результаты. В другой ситуации научное сообщество покачало бы головой, пожурило незадачливого экспериментатора да и забыло бы, но идея уже очень понравилась журналистам и некоторым фармкомпаниям. Ведь можно ничего не синтезировать, а разливать по пузырькам чистую воду! Поэтому про разоблачение опытов Бенвениста мало кто помнит. А вот термин и его производные как раз остались.
Что могут услышать снежинки
Одна из самых коммерчески успешных кампаний, связанных со «структурой воды», была у Эмото Масару. Он прославился благодаря рекламе с фотографиями красивых и уродливых снежинок, которым при замерзании была послана различная информация. Позитивная якобы даёт симметричные снежинки, а негативная — ассиметричные. Фирма Масару и его последователи широко и успешно продают «правильную воду», «структураторы», «музыку воды» и другие религиозно‑мифические продукты.
 Иллюстрация: Анна Гуридова / Лайфхакер
Иллюстрация: Анна Гуридова / ЛайфхакерК сожалению, в отличие от искренне заблуждавшегося Бенвениста, в данном случае это прямое жульничество. На таинство выбора одной из снежинок, образовавшихся под действием слов, допускали только посвящённых. Которые и выбирали подходящую среди тысяч. Двойной слепой метод грустно плачет в уголке.
Может ли звук влиять на воду и другие вещества? Да, но только высокой частоты и интенсивности. Этим даже занимается отдельная наука — сонохимия. Обычные же слова никак не влияют. Да и на каком языке говорить? Например, произнесённые слова «факт» или «Дед Мороз» в английском теряют свою позитивную эмоциональную окраску.
Что нужно знать о водных кластерах
Второе дыхание теория памяти воды получила в конце 90‑х — начале нулевых в связи с открытием водных кластеров. Это квазиструктуры, которые образуются в воде за счёт водородных связей. Сторонники структурирования сразу, не читая, подняли кластеры на знамя: «Вот так вода и запоминает! Кластеры — носители информации!» Но никто из них не прочитал в научных статьях время существования таких кластеров: 10-6–10-10 секунды.
 Водный кластер. Frank N. Keutsch / Richard J. Saykally / PNAS
Водный кластер. Frank N. Keutsch / Richard J. Saykally / PNASТак что, даже если предположить, что на воду можно что‑то записать, всё сотрётся после перераспределения кластеров. В лучшем случае такая «флешка» протянет 0,000001 секунды в переохлаждённой жидкой воде. Поэтому, к сожалению, предки были правы, когда говорили «вилами по воде писано».
Как связаны гомеопатия и память воды
Куда же без неё? Чтобы не писать ещё одну статью, думаю, стоит направить вас к материалам про гомеопатию и эффект плацебо на Лайфхакере. А о психосоматике лучше пусть расскажут медики.
За одно я благодарен гомеопатам: они вдохновили на отличную задачку, которую я предлагаю ученикам в Химическом центре в первый учебный год. Звучит она так: «Сколько тонн препарата ХХХ нужно употребить, чтобы в организм попала одна молекула действующего вещества?» Чаще всего ребята сами идут в аптеку и считают, исходя из указанного на коробке количества разведений и числа Авогадро. Попробуйте и вы, можно взять любой гомеопатический препарат.
Число Авогадро (молярная константа) — самая запрещённая константа в среде гомеопатов. Проверено. Дело в том, что, как только разведение чего‑либо превышает примерно 1023 раз, то исходное вещество в препарате попросту исчезает. И ничего с этим не сделать, приходится переходить к памяти воды, структуре и прочему. Ну или просто ругаться нехорошими словами на въедливого учёного.
Зачем всё это людям
Некоторые скажут: ну пишут же про структуру. Значит, что‑то нечисто, учёные скрывают, наука не всё может объяснить. Может, и какая‑то польза от «структураторов» всё-таки есть?
Чтобы что‑то долгое время существовало в условиях рыночной экономики, оно должно быть выгодно хотя бы кому‑то. Как раз выгода и поддерживает этот миф. Если на фильтре для воды написать, что он структурирует воду, продажи увеличатся. Почему? Знающий покрутит у виска — и всё равно купит, если фильтр хороший. Не знающий же на полке выберет как раз «структурирующий» фильтр.
Гомеопатия ещё выгоднее: для производства лекарства не нужна разработка, тестирование на клетках, мышах, добровольцах, сертификаты. Нужен только сахар, крахмал и маркетинг. Выгода огромна, затраты почти нулевые. Жаль только, что не работает.
Ну и, конечно, информационная теория воды — хлеб для конспирологов, нужно же о чём‑то разговаривать, когда уже слишком многие мистические теории безжалостно разрушены наукой.
Что делать с продуктами на основе «памяти воды»? Избегайте их. Либо это пустышки, либо попытка вытянуть из вас дополнительные деньги, не увеличивая ценности товара. В любом случае покупать лучше у честных компаний.
Читайте также 🧐
| Вода (H 2 O) | |
|---|---|
  | |
| Общая информация | |
| Систематическое название | Вода |
| Другие имена | Aqua Оксид водорода Гидроксид водорода Гидрат Оксидан Кислота водорода Окись водорода Гидроксикислота μ -Оксид дигидроген |
| Молекулярная формула | HOH или H 2 O |
| молярная масса | 18.01524 г · моль -1 |
| Внешний вид | прозрачная, почти бесцветная жидкость с слабым голубым оттенком [1] |
| номер CAS | [7732-18-5] |
| см. Также | Вода (страница данных) |
| свойства | |
| Плотность и фаза | 1000 кг · м −3 , жидкость (4 ° C) 917 кг · м −3 , твердое вещество |
| Точка плавления | 0 ° C, 32 ° F (273.15 К) [2] |
| Точка кипения | 100 ° С, 212 ° F (373,15 К) [2] |
| Тройной пункт | 273,16 К, 611,73 Па |
| Критическая точка | 647 К, 22,1 МПа |
| Удельная теплоемкость Мощность (газ) | c p = 1970 Дж · кг -1 · K -1 при 300 K c v = 1510 Дж · кг -1 · K -1 при 300 K [3] |
| Удельная теплоемкость емкость (жидкость) | 4186 Дж · кг -1 · K -1 |
| Удельная теплоемкость Мощность (твёрдое тело) | 2060 Дж · кг -1 · K -1 |
| (р К а ) | 15.74 |
| Базовость (p K b ) | 15,74 |
| Вязкость | 0,001 Па · с при 20 ° C |
| Поверхностное натяжение при 20 ° C | 7,28 Н · м -1 |
| Структура | |
| Молекулярная форма | нелинейный изогнутый |
| Кристаллическая структура | Гексагональная См. Лед |
| дипольный момент | 1.85 D |
| опасностей | |
| MSDS | Внешний MSDS |
| Основные опасности | тонущий |
| NFPA 704 | 0 0 0 |
| номер RTECS | ZC0110000 |
| Страница дополнительных данных | |
| структура и свойства | n , ε r и т. Д. |
| Термодинамические данные | Фазовое поведение Твердое вещество, жидкость, газ |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные растворители | ацетон метанол |
| Родственные соединения | водяной пар лед тяжелая вода |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа). Отказ от ответственности Infobox и ссылки | |
Вода (H 2 O, HOH) покрывает 70-75% поверхности Земли в жидком и твердом (ледяном) состоянии и присутствует в атмосфере в виде пара.Это самая распространенная молекула на поверхности Земли. [4]
При комнатной температуре это почти бесцветная жидкость без запаха и запаха. Многие вещества растворяются в воде, и это обычно рассматривается как универсальный растворитель ; из-за этого вода в природе и в использовании редко бывает чистой и может иметь некоторые свойства, отличные от лабораторных. Но есть много соединений, которые практически, если не полностью, нерастворимы в воде. Вода является единственным распространенным, чистым веществом, которое естественным образом содержится во всех трех состояниях вещества — для других веществ см. Химические свойства.
Чистая вода безвкусно. Это другие химические вещества в воде, которые могут придать воде аромат.
Обычно объем жидкости увеличивается при нагревании, однако объем воды уменьшается до при нагреве в диапазоне температур от 0 ° С до 4 ° С. Его объем увеличивается только при нагревании выше 4 ° С. Такое поведение является одним из ряда аномальных свойств воды.
Это свойство уменьшения объема позволяет рыбе и другим водным животным выживать в толще воды, когда лед замерзает на поверхности.В холодном климате, когда температура водоема достигает 4 ° C, слои воды вблизи верха, контактирующие с холодным воздухом, продолжают терять тепловую энергию, и их температура падает ниже 4 ° C. При охлаждении ниже 4 ° C эти слои скорее поднимаются, чем тонут, так как вода имеет максимальную плотность при 4 ° C. Таким образом, слой воды с температурой 4 ° C остается на дне, а слои воды 3 ° C, 2 ° C, 1 ° C и 0 ° C образуются выше. Поскольку лед является плохим проводником тепла, он не позволяет передавать тепловую энергию из жидкой воды под слоями льда, что препятствует замерзанию жидкой воды.Следовательно, водные существа выживают в таких местах.
- ↑ Braun C.L & Smitnov S.N. 1993. Почему вода синяя? J. Chem Ed . 70 , 612. [1]
- ↑ 2,0 2,1 Венская стандартная средняя вода океана (VSMOW), используемая для калибровки, плавится при 273,1500089 (10) К (0,000089 (10) ° С и кипит при 373,1339 К (99,9839 ° С)
- ↑ Serway, Raymond A. Физика для ученых и инженеров , 3-е издание
- chemistry Химия воды [2]
Молекула воды
Вода представляет собой химическое соединение и полярную молекулу, которая является жидкой при стандартной температуре и давлении. Имеет химическое вещество формула H 2 O, означая, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода. вода встречается почти везде на земле и требуется всем известная жизнь. Около 70% поверхности Земли покрыто вода.Вода, как известно, существует в виде льда на нескольких других тела в Солнечной системе и за ее пределами, и доказательство того, что она существует (или существовал) в жидкой форме где-нибудь, кроме Земли будет быть убедительным доказательством внеземной жизни.
Общее
Твердое состояние воды известно как лед; газообразное состояние известно как водяной пар (или пар). единицы температуры (ранее градус Цельсия, а теперь Кельвина) определяются в терминах тройной точки вода, 273.16 К (0,01 ° С) и 611,2 Па, температура и давление, при котором твердая, жидкая и газообразная вода сосуществуют в равновесии. Вода проявляет очень странное поведение, в том числе формирование состояний, таких как стекловидный лед, некристаллическое (стеклообразное) твердое состояние воды.
При температуре выше 647 К и давлении выше 22,064 МПа, совокупность молекул воды предполагает сверхкритическое условие , при котором жидкоподобные кластеры плавают в пределах парообразная фаза.
Путь жидкой воды — это мера количества жидкости вода в воздушном столбе.
Дипольная природа молекулы воды
Важной особенностью молекулы воды является ее полярная природа. молекула воды образует угол, с атомами водорода на советы и кислород в макушке. Так как кислород имеет более высокий электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд.Молекула с такой разницей заряда называется диполь. Заряд различия приводят к тому, что молекулы воды притягиваются к каждому другие (относительно положительные области, привлекаемые к относительно отрицательные области) и другие полярные молекулы. Это притяжение известно как водород склеивание.
водородная связь между двумя молекулами воды
Это относительно слабо (относительно ковалентных связей внутри сама молекула воды) притяжение приводит к физическому свойства, такие как относительно высокая температура кипения, потому что много тепловой энергии необходимо, чтобы сломать водород связи между молекулами.Например, сера является элементом ниже кислорода в периодической таблице, и его эквивалентное соединение, сероводород (H 2 S) не имеет водорода связи, и хотя он имеет в два раза больше молекулярного веса воды, это газ при комнатной температуре. Дополнительная связь между Молекулы воды также дает жидкую воду большой удельный теплоемкость.
Водородная связь также дает молекулы воды необычное поведение при замерзанииКак и большинство других материалов, жидкость становится более плотным с понижением температуры. Однако в отличие от большинство других материалов при охлаждении почти до точки замерзания, присутствие водородных связей означает, что молекулы, поскольку они перестраиваются, чтобы минимизировать свою энергию, формируют структуру это на самом деле более низкая плотность: следовательно, твердая форма, лед, будет плавать в воде. Другими словами, вода расширяется как он замерзает (большинство других материалов сжимаются при затвердевании).Жидкая вода достигает максимальной плотности при температуре 4 ° С. Это имеет интересное следствие для водной жизни зимой. Вода, охлажденная на поверхности, становится более плотной и раковины, образующие конвекционные потоки, которые охлаждают всю воду тело, но когда температура воды в озере достигает При температуре 4 ° C вода на поверхности при дальнейшем охлаждении становится на менее плотной на и остается в качестве поверхностного слоя, который в конце концов образует лед.Так как конвекция холоднее вода блокируется изменением плотности, любое большое тело вода, замерзшая зимой, будет иметь большую часть воды жидкость при 4 ° C под ледяной поверхностью, позволяя рыбе выжить. Это один из главных примеров тонко настроенных физические свойства, которые поддерживают жизнь на Земле, которая используется в качестве аргумента в пользу антропного принципа.
Другое Следствием этого является то, что лед будет таять при достаточном давлении.
Структура воды и льда
Показано выше сравнение бокса 10 Ангстрем в поперечнике. Это ясно показывает, что лед занимает больше места из-за водородной связи, которая возникает, когда состояние изменяется от жидкого к твердому. Во льду Ih каждая вода образует четыре водородные связи с расстояниями О — О 2,76 Ангстрем до ближайшего соседа по кислороду. Из-за упорядоченной структуры во льду в данном пространстве объема меньше молекул h30.
Вода в качестве растворителя
Вода также является хорошим растворителем благодаря своей полярности. Растворитель свойства воды жизненно важны в биологии, потому что многие биохимические реакции протекают только в водных растворах (например, реакции в цитоплазме и крови). Кроме того, вода используется для транспортировки биологических молекул.
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды. Относительно небольшой размер молекул воды обычно позволяет много молекул воды, чтобы окружить одну молекулу растворенного вещества . Частично отрицательные диполи воды притягиваются к положительно заряженным компонентам растворенное вещество, и наоборот для положительных диполей.
В общем, ионные и полярные вещества, такие как кислоты, спирты, и соли легко растворимы в воде, и неполярные вещества таких как жиры и масла нет.Неполярные молекулы остаются вместе в воде, потому что это энергетически более благоприятно для молекулы воды к водородной связи друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Пример ионного растворенного вещества — поваренная соль; натрий хлорид NaCl разделяется на катионы Na + и Cl — анионов, каждый из которых окружен молекулами воды.Ионы затем легко переносятся от их кристаллического решетка в раствор. Пример неионного растворенного вещества: столовый сахар. Водная дипольная водородная связь с дипольным области молекулы сахара и позволяют его переносить уйти в решение.
Сплоченность и поверхностное натяжение
Сильные водородные связи дают воде высокую когезию и, следовательно, поверхностное натяжение.Это очевидно, когда небольшое количество воды наносится на нерастворимую поверхность и вода остается вместе в виде капель. Эта функция важна когда вода проникает через ксилемные стебли в растения; сильные межмолекулярные притяжения удерживают толщу воды вместе, и предотвратить напряжение, вызванное потерей транспирации. Другие жидкости с более низким поверхностным натяжением имели бы более высокое склонность к «разрыву», образованию вакуумных или воздушных карманов и рендерингу сосуд ксилемы не работает.
Проводимость
Чистая вода на самом деле хороший изолятор (плохой проводник), Это означает, что он плохо проводит электричество. Так как вода — такой хороший растворитель, однако она часто растворенный в нем растворенный, чаще всего солевой. Если вода имеет такие примеси, то он может проводить электричество гораздо лучше, потому что примеси, такие как соль, содержат свободные ионы в водной решение, по которому может течь электрический ток.
Электролиз
Вода может быть разделена на составляющие ее элементы, водород и кислород, пропуская через него ток. Этот процесс называется , электролиз . Молекулы воды естественно диссоциировать на ионы H + и OH — , которые тянутся к катоду и аноду соответственно. На катоде два иона H + улавливают электроны и образуют H 2 газ.На аноде четыре иона ОН — объединяются и выделяют газ O 2 , молекулярную воду, и четыре электрона. Газы образуются пузырьком на поверхность, где их можно собрать.
Реакционная способность
Химически вода амфотерна: может действовать как кислота или база. Иногда термин гидроксикислоты является используется, когда вода действует как кислота в химической реакции.При рН 7 (нейтральный) концентрация гидроксид-ионов (OH — ) равен гидронию (H 3 O + ) или ионы водорода (H + ) ионы. Если равновесие нарушается, раствор становится кислым (более высокая концентрация ионов гидроксония) или основной (более высокая концентрация гидроксида ионы).
Вода может действовать как кислота или база в реакциях.Согласно системе Бренстеда-Лоури, определяется кислота как вид, который жертвует протон (ион Н +) в реакции, а основание как единое целое который получает протон. При взаимодействии с более сильной кислотой вода действует как основание; реагируя с более слабой кислотой, он действует как кислота. Например, он получает ион H + из HCl в равновесии:
HCl + H 2 O —> H 3 O + + Cl —
Здесь вода действует как основание, получая ион H +.Кислота отдает ион H +, и вода также может делать это, например, в реакции с аммиаком, Nh4:
NH 3 + H 2 O —> NH 4 + + OH —
pH на практике
В Теоретически, чистая вода имеет рН 7. На практике чистую воду очень трудно производить. Вода, оставленная на воздухе в течение длительного времени, быстро растворяется углекислый газ, образующий раствор углекислоты, с предельным рН ~ 5.7 (ссылка: Kendall, J. (1916), Journal of American Chemical Society 38 (11): 2460-2466).
Очищение вода
Очищенная вода необходима для многих промышленных применений, а также для потребления. Люди нуждаются в воде, которая делает не содержит слишком много соли или других примесей. Общие примеси включают химические вещества или вредные бактерии.Некоторые растворенные вещества приемлемо и даже желательно для ощутимого усиления вкуса. Вода, пригодная для питья, называется питьевой вода .
Шесть популярных методов Очищающая вода:
- Фильтрация : вода проходит через сито, которое улавливает мелкие частицы. Туже сетка сита, тем меньше частицы должны быть пройти через.Фильтрация недостаточна для полного очистить воду, но это часто является необходимым первым шагом, поскольку такие частицы могут мешать более тщательному методы очистки.
- Кипячение : Вода нагревается до кипения указать достаточно долго, чтобы инактивировать или убить микроорганизмы которые обычно живут в воде при комнатной температуре. В областях где вода «жесткая», (содержащая растворенный кальций соли), кипячение разлагает ион бикарбоната, в результате чего в части (но не во всех) растворенного кальция осаждается в форме карбоната кальция.Это так называемый «мех», который накапливается на элементах чайника и т. д. в жесткой воде области. За исключением кальция, кипячение не удалить растворенные вещества с более высокой температурой кипения, чем вода, и на самом деле увеличивает их концентрацию (из-за воды теряется как пар)
- Угольная фильтрация : Уголь, форма углерода с большой площадью поверхности из-за его режима препарат, адсорбирует многие соединения, в том числе некоторые токсичные соединения.Вода пропускается через активированный уголь удалить такие загрязнения. Этот метод чаще всего используется в бытовых фильтрах для воды и аквариумах. Домашнее хозяйство фильтры для питьевой воды иногда также содержат серебро, следовые количества ионов серебра, обладающих бактерицидным действием.
- Перегонка : перегонка включает кипячение вода для производства водяного пара. Водяной пар тогда поднимается к охлажденной поверхности, где он может конденсироваться обратно в жидкость и будет собрана.Потому что растворенные вещества не обычно испаряясь, они остаются в кипящем растворе. Даже дистилляция не полностью очищает воду, потому что загрязняющих веществ с одинаковыми точками кипения и каплями неиспаренной жидкости, перевозимой с паром. Тем не мение, 99,9% чистой воды можно получить дистилляцией.
- Обратный осмос : Механическое давление применяется к нечистому раствору, чтобы заставить чистую воду полупроницаемая мембрана.Термин обратного осмоса , потому что нормальный осмос приведет к движению чистой воды в другом направлении, чтобы разбавить примеси. Обеспечить регресс осмос теоретически является наиболее тщательным методом крупномасштабного доступна очистка воды, хотя она идеально полупроницаема мембраны сложно создать. в обмен хроматография : в этом случае вода проходит через колонку с заряженной смолой, которая имеет боковые цепи, которые улавливать кальций, магний и другие ионы тяжелых металлов.В во многих лабораториях этот метод очистки заменил дистилляция, так как она обеспечивает большой объем очень чистого вода быстрее и с меньшим потреблением энергии, чем другие процессы. Вода, очищенная таким образом, называется деионизированной вода .
Расточительная вода
Сточные воды — это злоупотребление водой, т.е. использовать его без необходимости.Примером является использование воды, в частности, вода, очищенная до стандартов безопасности для человека, в ненужном поливе. Кроме того, в домах вода может быть потрачено впустую, если туалет смывают без необходимости или бак Утечки. Причинение загрязнения воды может быть самым большим разовое злоупотребление водой. В той степени, в которой загрязняющее вещество ограничивает другие виды использования воды, она становится пустой тратой ресурса, независимо от пользы для загрязнителя.
Мифология
Вода является одним из четырех классических элементов наряду с огонь, земля и воздух, и был расценен как йлем, или основной вещи вселенной. Вода считалась холодной и влажной. В теории четырех телесных юморов вода ассоциировалась с мокротой. Вода была также одним из пяти элементов в Китайский даосизм, наряду с землей, огнем, деревом и металлом.
Вода права и развитие
Доклад ЮНЕСКО о развитии водных ресурсов мира (WWDR, 2003) от его Всемирная программа оценки водных ресурсов указывает, что в ближайшие 20 лет мир сталкивается с беспрецедентной нехваткой питьевой воды. Количество воды, доступное каждому Прогнозируется снижение на 30%. Причины загрязнения, глобальное потепление и политические проблемы.Более 2,2 миллиона люди умерли в 2000 году от болезней, связанных с потреблением загрязненной воды. В 2004 году британская благотворительная WaterAid сообщили, что ребенок умирает каждые 15 секунд из-за предотвратимые заболевания, связанные с водой. большие глобальные различия в необработанном объеме доступных вода: от 10 м³ на человека в год в Кувейте до 812,121 м³ во Французской Гвиане.Тем не менее, более богатые страны, такие как Кувейт может легче справиться с низкой доступностью воды. в Водное право Соединенных Штатов разделено на две правовые доктрины: прибрежные права на воду, используемые в восточной и южной частях штаты, где есть изобилие воды и ассигнований доктрина (или доктрина Колорадо), используемая в засушливой западной состояния.
,Тебе это нравится? Не любишь это ? Пожалуйста, подумайте над тем, чтобы поделиться с нами вашими отзывами. Спасибо!
Урок 5.1
Ключевые понятия
- Молекула воды, в целом, имеет 10 протонов и 10 электронов, поэтому она нейтральна.
- В молекуле воды атом кислорода и атомы водорода имеют общие электроны в ковалентных связях, но они не равны.
- В ковалентной связи между кислородом и водородом атом кислорода притягивает электроны немного сильнее, чем атомы водорода.
- Неравное распределение электронов дает молекуле воды небольшой отрицательный заряд вблизи атома кислорода и небольшой положительный заряд вблизи атомов водорода.
- Когда нейтральная молекула имеет положительный участок на одном конце и отрицательный участок на другом, это полярная молекула.
- Молекулы воды притягиваются друг к другу на основе притяжения между положительным концом одной молекулы воды и отрицательным концом другого.
Резюме
Учащиеся узнают, что вода имеет небольшой положительный заряд на одном конце молекулы и небольшой отрицательный заряд на другом (полярная молекула). Студенты просматривают анимацию, делают иллюстрации и используют свои собственные модели молекул воды, чтобы понять, как полярная природа молекул воды может помочь объяснить некоторые важные характеристики воды.
Цель
Студенты смогут объяснить на молекулярном уровне, что делает воду полярной молекулой.Студенты также смогут показать на рисунке, что полярная природа воды может объяснить некоторые интересные характеристики воды и помочь объяснить скорость ее испарения по сравнению с менее полярной жидкостью.
Оценка
Таблица заданий будет служить компонентом «Оценка» в каждом плане урока 5-E. Деятельности являются формирующей оценки успеваемости и понимания студентов.
Безопасность
Убедитесь, что вы и студенты носите правильно подобранные очки.Изопропиловый спирт огнеопасен. Держите его вдали от источников огня и искр. Прочитайте и следуйте всем предупреждениям на этикетке. Использовать в хорошо проветриваемом помещении. Утилизируйте небольшие количества в канализацию или в соответствии с местными правилами.
Материалы для каждой группы
- Модели молекул воды из пенопласта из главы 2, урок 2 (по две на студента)
- Перманентные маркеры (синий и красный)
- Изопропиловый спирт (70% или выше)
- Вода
- Коричневое бумажное полотенце
- капельницы
Примечание о материалах
Студенты сделали молекулярные модели молекулы воды, используя шарики из пенопласта и зубочистки в главе 2, урок 2.Дайте каждому студенту две модели молекул воды для этого занятия.
Покажите учащимся примеры притяжения молекул воды друг к другу.
Напомните студентам, что в главах 1 и 2 они исследовали поведение воды при различных температурах и исследовали изменения состояния воды. Многие объяснения были основаны на идее, что молекулы воды притягиваются друг к другу. Напомните студентам, что в главе 4 они рассмотрели ковалентную связь между кислородом и водородом, которая создает молекулу воды.Теперь студенты будут более внимательно изучать детали ковалентных связей в молекуле воды, чтобы понять, почему молекулы воды притягиваются друг к другу.
Проект видео Водный шар.
Это видео было показано в главе 1, урок 1, чтобы показать, что молекулы воды притягиваются друг к другу.
Проект видео Водный Фонтан.
Укажите, что вода может оставаться вместе в этих дугах, потому что молекулы воды очень притягиваются друг к другу.
Покажите анимацию молекулярной модели, которая иллюстрирует, почему молекулы воды притягиваются друг к другу.
Проект анимации Polar Water Molecule.
Первый кадр анимации
- Электроны распределяются между атомами в ковалентной связи.
- Напомните студентам, как общие электроны в молекуле воды притягиваются к протонам как в атомах кислорода, так и в атомах водорода.Эти достопримечательности удерживают атомы вместе.
- Молекулы воды являются нейтральными.
- Убедитесь, что студенты понимают, что протоны или электроны не получены и не потеряны. Молекула воды имеет в общей сложности 10 протонов и 10 электронов (8 от атома кислорода и 1 от каждого из двух атомов водорода). Поскольку он имеет одинаковое количество протонов и электронов, молекула воды является нейтральной.
Нажмите «Играть»
- Модель электронного облака показывает, где электроны находятся в молекуле.
- Скажите студентам, что другой способ увидеть разницу в расположении электронов — использовать модель электронного облака. Напомните студентам, что невозможно узнать точное местоположение электрона, поэтому иногда области, занятые электронами, отображаются в виде «облаков» вокруг ядра в атоме или молекуле.
- Неравное распределение электронов делает воду полярной молекулой.
- Скажите студентам, что атом кислорода притягивает электроны немного сильнее, чем водород.Таким образом, хотя электроны каждого атома притягиваются как кислородом, так и водородом, электроны немного больше притягиваются кислородом. Это означает, что электроны проводят немного больше времени на кислородном конце молекулы. Это делает кислородный конец молекулы слегка отрицательным. Поскольку электроны находятся не так близко к концу водорода, этот конец слегка положительный. Когда ковалентно связанная молекула имеет больше электронов в одной области, чем в другой, она называется полярной молекулой.
- Модель электронного облака может показать неравномерное распределение электронов.
- Отметьте, что электронное облако вокруг кислорода темнее электронного облака вокруг водорода. Это показывает, что электроны больше притягиваются к концу кислорода молекулы, чем к концу водорода, что делает молекулу воды полярной.
Нажмите «Далее»
- Цвет может быть добавлен к модели электронного облака, чтобы показать, где электроны более или менее вероятно.
- Скажите студентам, что это еще одна модель молекулы воды.В этой модели цвет используется для отображения полярных областей молекулы воды. Отрицательная область около атома кислорода — красная, а положительная область около атомов водорода — синяя.
Спроектируй анимацию Полярная вода вместе.
Задайте вопрос студентам:
- Что вы замечаете в том, как молекулы воды ориентируются?
- Красная (кислородная) область одной молекулы воды находится рядом с синим (водородным) концом другой молекулы воды.
- Почему молекулы воды так притягивают друг друга?
- Поскольку кислородный конец молекулы воды слегка отрицательный, а водородный конец слегка положительный, имеет смысл, что молекулы воды притягивают друг друга.
Дайте каждому ученику лист активности.
Учащиеся запишут свои наблюдения и ответят на вопросы о задании на листе заданий. Разделы «Объясните это с атомами и молекулами и возьмите его дальше» разделы таблицы упражнений будут заполнены в виде класса, в группах или индивидуально, в зависимости от ваших инструкций.Посмотрите на учебную версию листа с заданиями, чтобы найти вопросы и ответы.
Покажите студентам, что связи между атомами в молекуле отличаются от полярных притяжений между молекулами.
Проецируйте изображение Аттракционы на разных уровнях.
Студенты могут быть озадачены связями в молекуле воды и притяжением между молекулами воды.
Связи внутри молекул и полярные притяжения между молекулами.
Объясните студентам, что взаимодействие между кислородом одной молекулы воды и водородом другой отличается от распределения электронов между кислородом и атомами водорода внутри самой молекулы воды.
Это все о привлекательности между положительным и отрицательным.
Укажите учащимся, что притяжение между положительным и отрицательным работает на трех разных уровнях.
- Один атом остается вместе из-за притяжения между положительно заряженными протонами и отрицательно заряженными электронами.
- В молекуле два или более атомов остаются вместе из-за взаимного притяжения между положительно заряженными протонами из одного атома и отрицательно заряженными электронами из другого атома. Это вызывает ковалентную или ионную связь, которая удерживает атомы или ионы вместе.
- Две или более молекул воды остаются вместе, потому что положительные и отрицательные части молекул притягивают друг друга.
Предложите учащимся отметить положительные и отрицательные области молекулы воды с помощью цветовой маркировки своих моделей из пенополистирола.
Материалы для каждой группы
- Модели молекул воды из пенопласта из главы 2, урок 2 (по две на студента)
- Перманентные маркеры (синий и красный)
Процедура
- Нарисуйте синий «+» на каждом из атомов водорода.
- Нарисуйте два красных «-» в нижней части атома кислорода.
- Повторите это для другой молекулы воды.
- Расположите молекулы воды так, чтобы противоположные заряды были рядом друг с другом.
Задайте вопрос студентам:
- Как ваши модели шариков молекул воды из пенопласта соотносятся с моделью плотности заряда с цветовой кодировкой, показанной на анимации?
- Различные цвета показывают, что вода является полярной молекулой.
- Что означают красные знаки «-» на атоме кислорода?
- Красные знаки «-» представляют область, где больше электронов.
- Что означают синие знаки «+» на атомах водорода?
- Синие знаки «+» представляют область, где меньше электронов.
- Поскольку молекулы воды полярные, как они располагаются в жидкой воде?
- Положительная область одной молекулы воды притягивается к отрицательной области другой молекулы воды.
Попросите учащихся разработать тест для сравнения скорости испарения воды и спирта.
Напомните студентам, что молекулы воды очень полярны. Сильные притяжения между молекулами воды влияют на поверхностное натяжение воды, температуру кипения и скорость испарения. Скажите студентам, что они проведут эксперимент, чтобы сравнить скорости испарения воды и другой жидкости, которая не является полярной.
Задайте вопрос студентам:
- Как вы думаете, вещество, подобное воде с полярными молекулами, будет испаряться быстрее или медленнее, чем вещество, подобное алкоголю, с молекулами, которые не столь полярны?
- Более полярные молекулы будут больше слипаться и, вероятно, будут испаряться медленнее, чем менее полярные молекулы.Менее полярные молекулы должны испаряться быстрее, потому что они не так притягиваются друг к другу.
- Как вы могли бы разработать быстрый и простой тест на испарение, чтобы сравнить скорость испарения между водой и спиртом?
- Какие материалы вам понадобятся?
- Если вы используете одинаковое количество воды и алкоголя?
- Как вы узнаете, если один испаряется быстрее другого?
вода: структура молекулы воды
Многие физические и химические свойства воды обусловлены ее структурой. Атомы в молекуле воды располагаются с двумя связями Н – О под углом около 105 °, а не на прямо противоположных сторонах атома кислорода. Асимметричная форма молекулы возникает из-за тенденции четырех электронных пар в валентной оболочке кислорода симметрично располагаться в вершинах тетраэдра вокруг ядра кислорода.Две пары, связанные с ковалентными связями (см. Химическую связь), удерживающими атомы водорода, немного сближаются, в результате чего угол между этими связями составляет 105 °. Такое расположение приводит к полярной молекуле, так как имеется чистый отрицательный заряд к концу кислорода (вершине) V-образной молекулы и суммарный положительный заряд на конце водорода. Электрический диполь вызывает притяжения между соседними противоположными концами молекул воды, причем каждый кислород способен притягивать два соседних атома водорода двух других молекул воды.Такая водородная связь, как ее называют, наблюдалась и в других водородных соединениях. Хотя водородная связь значительно слабее, чем ковалентные связи, удерживающие молекулу воды вместе, она достаточно сильна, чтобы сохранять воду жидкой при обычных температурах; его низкая молекулярная масса, как правило, делает его газом при таких температурах.
Различные другие свойства воды, такие как ее высокая удельная теплоемкость, обусловлены этими водородными связями. Когда температура воды понижается, кластеры молекул образуются посредством водородных связей, причем каждая молекула связана с другими посредством до четырех водородных связей, причем каждый атом кислорода стремится окружить себя четырьмя атомами водорода в тетраэдрическом расположении.Гексагональные кольца атомов кислорода формируются таким образом, с альтернативными атомами в более высокой или более низкой плоскости, чем их соседи, чтобы создать изогнутую трехмерную структуру.
Колумбийская электронная энциклопедия, 6-е изд. Copyright © 2012, Columbia University Press. Все права защищены.
Другие статьи в энциклопедии: Соединения и элементы
.