|
Заглавная страница
КАТЕГОРИИ: Археология ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрации Техника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? Влияние общества на человека Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Балочные системы. Определение реакций опор и моментов защемления |
⇐ ПредыдущаяСтр 39 из 48Следующая ⇒ Ранее была рассмотрена витковая модель атома водорода. Теоретически возможна и орбитальная модель. По уточнениям Зоммерфельда, круговые орбиты электрона в атоме водорода, предложенные Бором, являются только частным случаем эллиптической орбиты. Так как масса протона почти в 2000 раз больше массы электрона, то взаимодействие протона и электрона приближенно сводится к вращению электрона вокруг протона. Рисунок 1. Вид электронных орбит атома водорода При таком представлении, чем длиннее эллипсоидальная орбита, тем больше вероятность соприкосновения с другими атомами, тем больше вероятность возникновения химической реакции. Теория Зоммерфельда показывает форму траектории движения электрона в атоме, но не раскрывает принципов превращения плоской формы атома в объемную форму. Рисунок 2. Изображение разрезов орбитальной модели атома водорода При слиянии торцевых вихрей протона и электрона они перестают воздействовать на окружающее пространство, то есть происходит взаимная компенсация зарядов. Электрон движется вокруг протона в плоскости, проходящей через экватор протона, в направлении вращения протона. Если траектория движения электрона круговая, то джеты формируют электронное облако в виде тороидальной поверхности. В этом случае форма поверхности атома будет полностью совпадать с формой модели атома, описанной ранее. Если траектория эллиптическая, то тороидальная поверхность имеет искаженную вытянутую форму. Рисунок 3. Изображение поверхности орбитальной модели атома водорода Таким образом, в любом случае, независимо от того, движется ли электрон в плоскости экватора протона (орбитальная модель, спин электрона=1/2) или наматывает витки, проходя при каждом витке через центральное отверстие протона (витковая модель, спин электрона=0), форма поверхности атома имеет торообразную форму. При такой форме слипание двух атомов водорода теоретически возможно либо полюсами, либо экваторами. Если в области соприкосновения электроны движутся в одном направлении, то атомы притягиваются друг к другу (потоки одного направления притягиваются), в противном случае — отталкиваются. Таким образом, теоретически возможны два типа атомов – витковой модели и орбитальной модели, две формы молекул водорода – экваториальная (атомы слипаются экваторами) и осевая (атомы слипаются полюсами). Каждая форма может иметь две разновидности – спины ядер параллельны и спины ядер антипараллельны. Рисунок 4. Теоретические способы слипания атомов водорода Экспериментаторы научились распознавать только две модификации молекул водорода. Молекулы с противоположно направленными спинами ядер называют пара-водородом, а с одинаковым направлением спина ядер – орто-водородом. 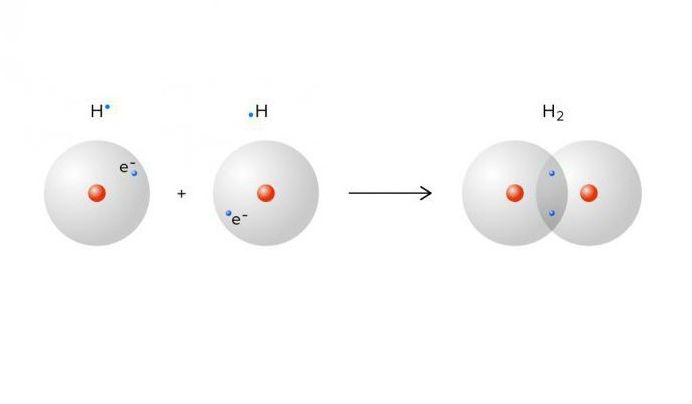 Рисунок 5. Экваториальная молекула орбитальной модели Из оставшихся двух вариантов подробно остановимся на варианте 2, который имеет очень интересную особенность. С одной стороны, в месте соприкосновения атомов электроны совместно с торцевыми вихрями создают общий поток, создающий силы притяжения между атомами. С другой стороны, вращение электрона и торцевых вихрей каждого атома создает перпендикулярные силам притяжения силы смещения, толкающие соседний атом. Такая молекула способна самостоятельно двигаться в пространстве без воздействия внешних сил, она как бы имеет собственный внутренний движитель. Такая способность вполне подходит под понятие сверхтекучести. Но сверхтекучесть водорода экспериментально не обнаружена. Рисунок 6. Фазовая диаграмма водорода Самое простое объяснение – конфигурации молекулы вариант 2 физически не существует. Подытожим наши рассуждения: чистая фракция жидкого параводорода, получаемая в настоящее время экспериментаторами при сверхнизких температурах, скорее всего, содержит только однородные молекулы экваториальной формы с атомами витковой модели. Пары молекулярного водорода могут содержать компоненты, обладающие свойством сверхлетучести. Такие молекулы имеют кинетическую энергию даже при температуре абсолютного нуля.
Владимир Яковлев, [email protected] , http://logicphysic.narod.ru , апрель 2010 года ⇐ Предыдущая34353637383940414243Следующая ⇒ Читайте также: Коммуникативные барьеры и пути их преодоления Рынок недвижимости. Сущность недвижимости Решение задач с использованием генеалогического метода История происхождения и развития детской игры |
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 46; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia. |
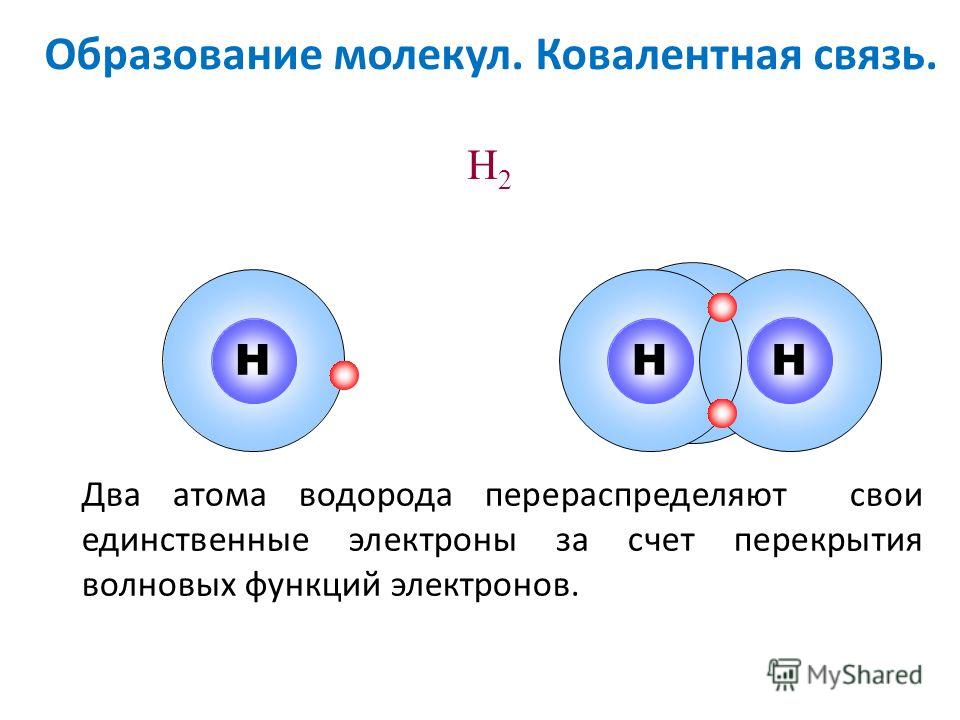
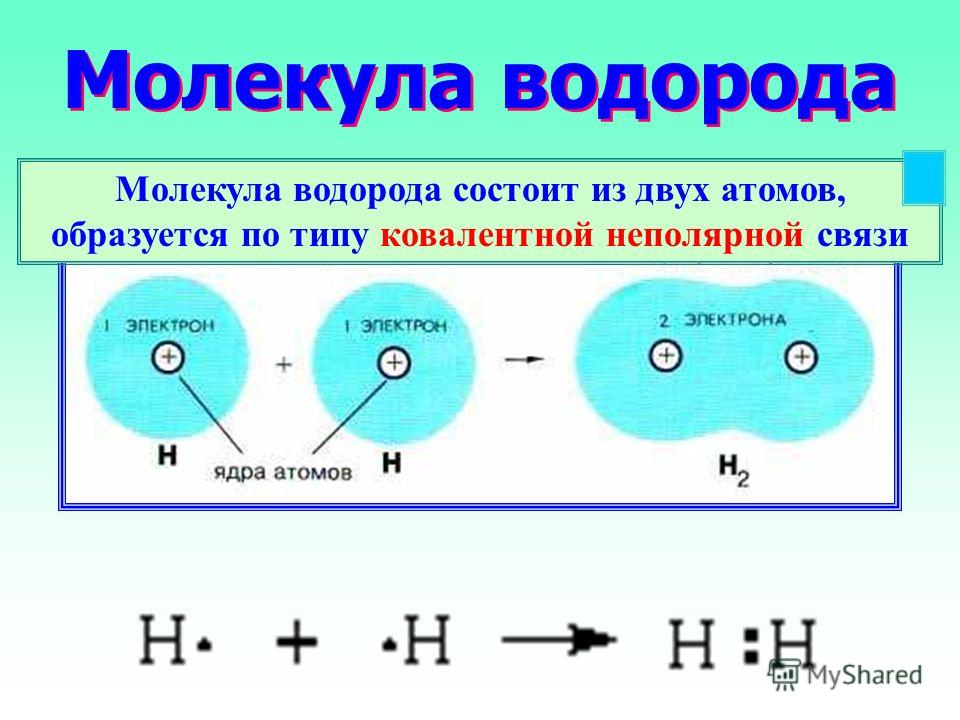
Молекула водорода
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
- 1Модели молекулы водорода
- 2Гамильтониан
- 3Волновые функции
- 4Энергия электронных состояний
- 5Зависимость энергии основного состояния от расстояния между ядрами
- 5.
 1Ковалентная связь
1Ковалентная связь - 5.2Насыщение ковалентной связи
- 5.
- 6Движение ядер в молекуле водорода
- 6.1Вращение
- 6.2Колебания атомов
- 6.3Молекулярный спектр водорода
- 7Пара- и ортоводород
- 8Характеристики молекулы водорода
- 9См. также
- 10Примечания
- 11Литература
Рис.1.Модель водорода по Бору и осевая проекция электронного кольца
Н.Бор ещё в 1913 году дал описание модели молекулы водорода. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Нильса Бора учитывала кулоновское отталкивание — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
При этом модель Нильса Бора учитывала кулоновское отталкивание — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода.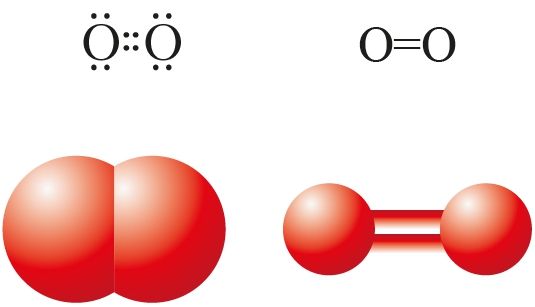 Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
- re2 = a02 — (d/2)2; re = 0,377 Å.
Рис.2.Контурная карта электронной плотности для молекулы водорода
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. {2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
{2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
Гамильтониан молекулы водорода симметричен относительно переменныхr1{\displaystyle \mathbf {r} _{1}} иr2{\displaystyle \mathbf {r} _{2}}, то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение антисимметричной волновой функции молекулы водорода
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водородаψ1s{\displaystyle \psi _{1s}} .
- ψsym=12(ψ1s1(r1)ψ1s2(r2)+ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{sym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})+\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
- ψasym=12(ψ1s1(r1)ψ1s2(r2)−ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{asym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})-\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
- E=∫ψ∗H^ψdV1dV2{\displaystyle {\mathcal {E}}=\int \psi ^{*}{\hat {H}}\psi dV_{1}dV_{2}}.
 {2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}
{2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}- −1|r1−R2|−1|r2−R1|]dV1dV2{\displaystyle \left.-{\frac {1}{|\mathbf {r} _{1}-\mathbf {R} _{2}|}}-{\frac {1}{|\mathbf {r} _{2}-\mathbf {R} _{1}|}}\right]dV_{1}dV_{2}}.
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле дляE{\displaystyle {\mathcal {E}}} следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
ВеличинаQ(R){\displaystyle Q(R)} — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». ВеличинаA(R){\displaystyle A(R)} определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Ковалентная связь
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Обменный интеграл для молекулы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм).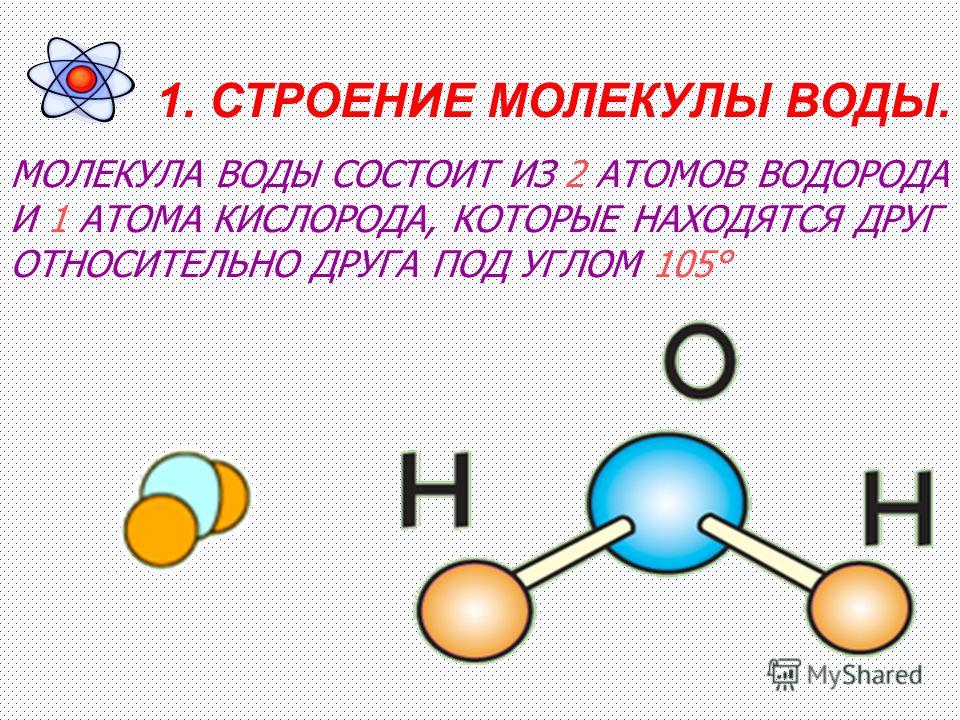 Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь. {2}}}+\hbar \omega \left(v+{\frac {1}{2}}\right)},
{2}}}+\hbar \omega \left(v+{\frac {1}{2}}\right)},
гдеv=0,1…{\displaystyle v=0,1\ldots } — колебательное квантовое число.
Низшая энергия колебанияℏω2{\displaystyle {\frac {\hbar \omega }{2}}} отвечает нулевым колебаниям.
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
- Es,n,l=Eel+Ev+Er{\displaystyle E_{s,n,l}=E_{el}+E_{v}+E_{r}}
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорциональноm/M{\displaystyle {\sqrt {m/M}}}, вращательное пропорциональноm/M{\displaystyle m/M}. Поэтому
- Eel≫Ev≫Er{\displaystyle E_{el}\gg E_{v}\gg E_{r}}.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные.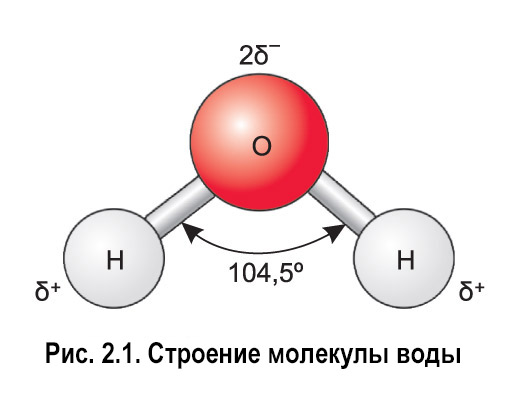 Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Молекулярный спектр водорода
Молекулярный спектр водорода описан в .
Схематическое изображение спиновых изомеров водорода
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
- Молекулярный ион водорода
- Рекомбинация (химия)
- Боровская модель химической связи
- Статистическая интерпретация волновой функции
- Теория молекулярных орбиталей
- Теория валентных связей
- Бор Н.
 Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с. - / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. . — 792 с.
- Richardson O.W. Molecular Hydrogen and its Spectrum. Yale University, New Haven, Connecticut. 1934. 343 p.//
- Справочник химика. — 2-е изд., перераб. и доп. — М.—Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- Справочник химика. — 2-е изд., перераб. и доп. — М.—Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973.(укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки.
 — Київ: Либідь, 2002.
— Київ: Либідь, 2002. - Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.
молекул в 3D
молекула в 3D| Молекулы в 3D |
Атомы и молекулы настолько малы, что мы не можем увидеть их невооруженным глазом. Для просмотра трехмерных структур молекул мы используем модели. Молекулярные модели, созданные компьютерными программами или физическими моделями, основаны на точных данных, полученных в результате экспериментов. на длины связей, валентные углы и атомные радиусы. Для различения атомов были назначены цвета. (Взгляните на цвета. Держите паутину страница открыта для дальнейшего использования.)
Различные молекулярные модели подчеркивают определенные особенности трехмерного расположения. Например, модель «шар и стержень» помогает визуализировать
точные валентные углы. На рисунке А ниже показана шаростержневая модель молекулы водорода. Атомы водорода, показанные белым цветом, соединены друг с другом коротким кусочком пластика.
который представляет собой связь между двумя атомами. На рис. B показана та же шаростержневая модель для воды. Как вы видете
атом кислорода в центре соединен с двумя атомами водорода. Угол между двумя атомами водорода точен.
Например, модель «шар и стержень» помогает визуализировать
точные валентные углы. На рисунке А ниже показана шаростержневая модель молекулы водорода. Атомы водорода, показанные белым цветом, соединены друг с другом коротким кусочком пластика.
который представляет собой связь между двумя атомами. На рис. B показана та же шаростержневая модель для воды. Как вы видете
атом кислорода в центре соединен с двумя атомами водорода. Угол между двумя атомами водорода точен.
| Рисунок А | Рисунок В |
Определите каждую из следующих двухатомных молекул. Напишите их названия и химические формулы в листе данных.
Обратите внимание, что эти молекулы показаны в модели заполнения пространства. Он показывает размеры атомов в молекуле. Этот тип модели дает нам представление о размере молекулы.
Атомы объединяются в трехмерные агрегаты с определенными молекулярными формами. На форму молекулы влияют следующие факторы: число
связей, несвязывающих электронов, атомных радиусов, длины связи и др. Первые два фактора являются результатом электрон-электронного отталкивания. Облигации
состоит из двух электронов. Если молекула состоит из 3 атомов, вероятно, что связи между атомами расположены как можно дальше друг от друга, что уменьшает отталкивание.
На форму молекулы влияют следующие факторы: число
связей, несвязывающих электронов, атомных радиусов, длины связи и др. Первые два фактора являются результатом электрон-электронного отталкивания. Облигации
состоит из двух электронов. Если молекула состоит из 3 атомов, вероятно, что связи между атомами расположены как можно дальше друг от друга, что уменьшает отталкивание.
Ниже показаны некоторые другие молекулярные формы. В листе данных напишите химическую формулу, название и молекулярную форму каждого из них.
| Линейный | Изогнутый | Тригональная планарная |
| Треугольная пирамида | Тетраэдрический |
В свой лист данных напишите химические формулы, названия и молекулярные формы молекул, перечисленных ниже.
Соединения, состоящие исключительно из углерода и водорода в цепи со всеми одинарными связями, называются алканы. Ниже приведены трехмерные формы первых восьми алканов.
Есть и другие молекулы, с которыми мы столкнемся в курсе. Полезно познакомиться с их формами. На листе данных нарисуйте их химическую структуру (не забудьте двойные связи) вместе с их названиями.
На листе данных нарисуйте их химическую структуру (не забудьте двойные связи) вместе с их названиями.
| Бензол | Этен или этилен |
| Метиламин | Уксусная кислота или этановая кислота |
Ссылки
Станицкий, К.Л., Юбэнкс, Л.П., Миддлкэмп, К.Х. and Stratton, W.J. Химия в контексте Применение химии в обществе Американское химическое общество, 2006 г.
30.057 молекула водорода Стоковые фото, картинки и изображения модель химической структуры, макрожидкие пузырьки, 3d визуализацияPREMIUM
Водородные связи. часть молекулы воды с частичным положительным зарядом притягивает часть другой молекулы воды с частичным отрицательным зарядом. ПРЕМИУМ
Структурные отличия атома от молекулы с кислородом и контурной диаграммой воды.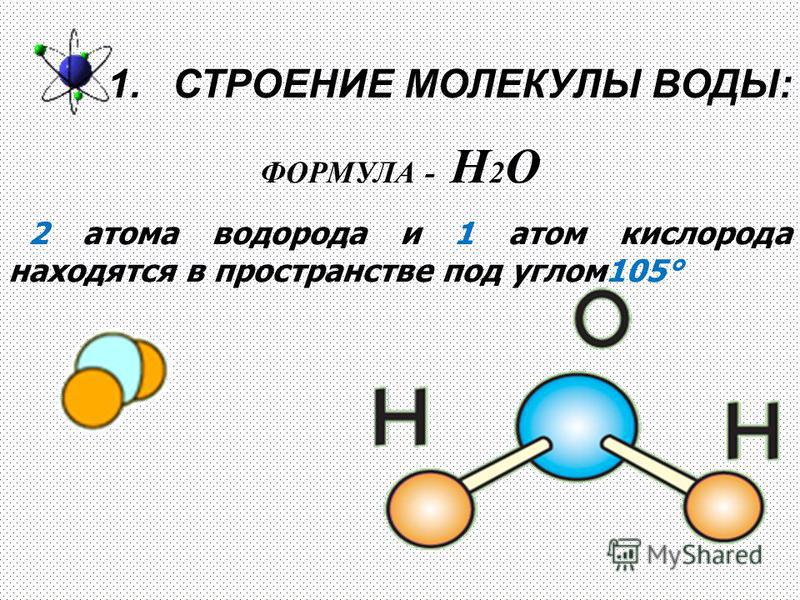 ПРЕМИУМ
ПРЕМИУМ
Катион аммония, молекула nh5 и аммиак, молекула nh4. структурная химическая формула и молекулярная модель. векторная иллюстрацияPREMIUM
Синяя молекула водорода в жидкости. 3d illustration.PREMIUM
Молекула воды. концепция экологии, биологии и биохимии. 3d-рендерингPREMIUM
Абстрактная молекула метана — 3d иллюстрацияPREMIUM
Молекула h3 в пузырьках жидкости. 3д иллюстрация.ПРЕМИУМ
Прозрачная вода Молекулы воды, плавающие в воде. абстрактная иллюстрация концепции науки и химии. одна молекула находится в фокусе, а другая нет. крупным планом, выборочный фокус. 3D визуализацияPREMIUM
Кислотно-основная реакция. нейтрализация химической реакции. три колбы с жидкостями. кислота и основание, образующие соль и воду. ПРЕМИУМ
Кислотно-основная реакция, которую можно использовать для определения рН, значка лакмусовой бумаги, логотипа и иллюстрации. ПРЕМИУМ
Фармация и химия. испытательная стеклянная колба с раствором в исследовательской лаборатории.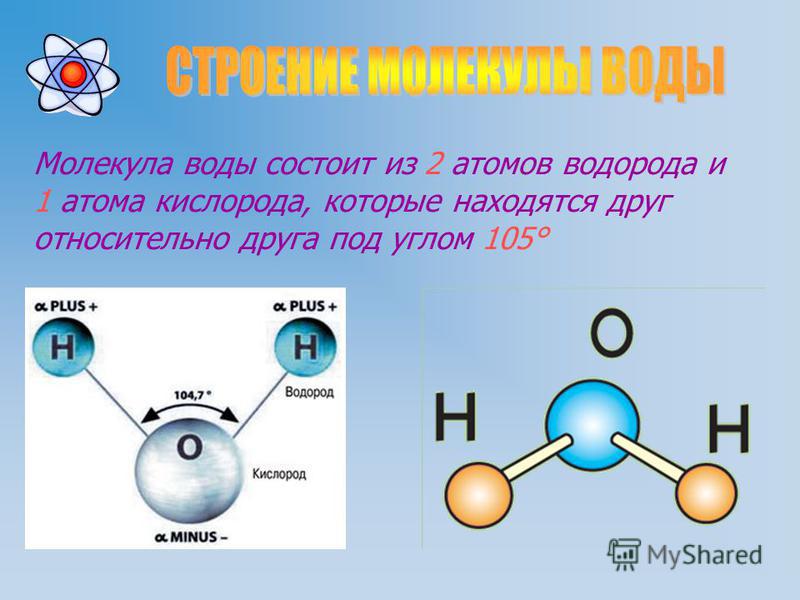 наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Сборник молекулярно-химических моделей соединений водорода, кислорода, натрия, углерода, азота и хлора. векторные молекулы набор иллюстраций на белом фоне. PREMIUM
Череп, образованный слиянием золотых атомов. 3d визуализацияPREMIUM
Молекулярная структура салициловой кислоты, абстрактные атомы и молекулы крупным планом 3d модель, имитация вида через микроскопPREMIUM
Биомолекулы или коллекция типов биологических молекул в контурной диаграммеPREMIUM
Реалистичная стеклянная молекула аммиака для красивого дизайна. химическая формула. PREMIUM
Ионные и ковалентные связи. в ионной связи отдается электрон. в ковалентной связи электрон является общим. примеры соединений с ионными связями с поваренной солью (nacl) и ковалентными связями с молекулой воды (h3o).PREMIUM
Органические соединения. бесшовная текстура. эскиз школьной доски с органическим соединением химии.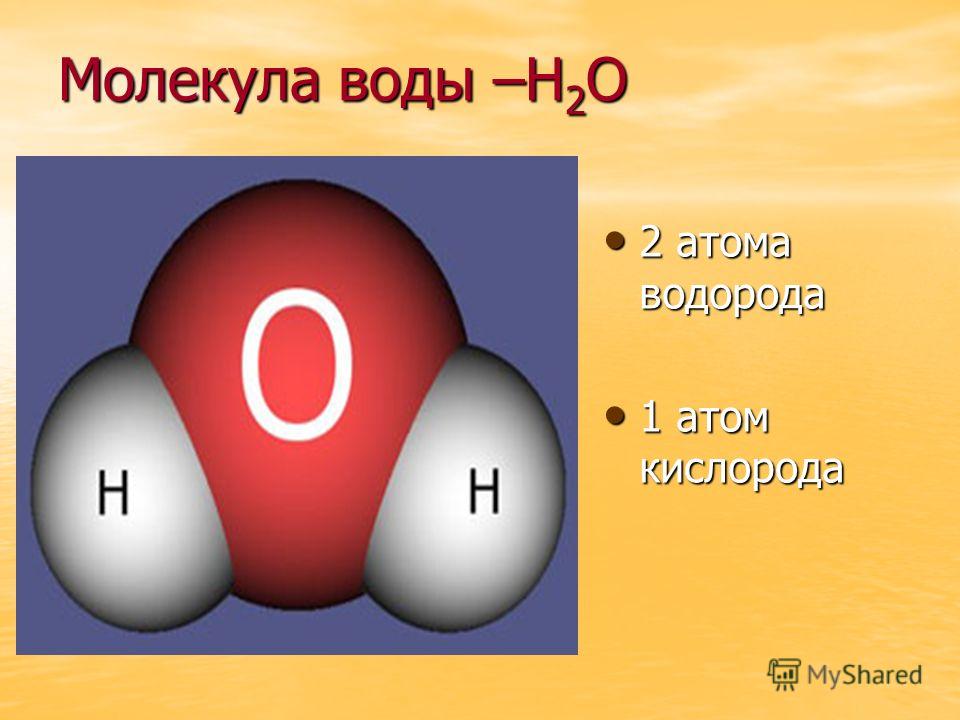 органическая -химия.ПРЕМИУМ
органическая -химия.ПРЕМИУМ
Фармация и химия на тему. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Пептидная связь. образование амидных связей из двух аминокислот в результате реакции биосинтеза белка. это процесс представляет собой реакцию синтеза дегидратации. векторная иллюстрацияPREMIUM
Немецкий текст wasserstoff, перевод водорода. 3d illustration.PREMIUM
Изолированная молекулярная модель ибупрофена с отражением на белом фонеPREMIUM
Молекулярная структура и химическая формула глутатионаPREMIUM
Концепция чистого зеленого водорода как возобновляемого источника энергииPREMIUM
Ионные и молекулярные соединения. классификация чистых веществ: атомарный (водород, кислород, хлор, натрий), молекулярный кислород (О2), вода (H3O) и поваренная соль или хлорид натрия (nacl). векторная иллюстрацияPREMIUM
Молекулярные структуры — вода, жидкие пузырьки, крупный план абстрактного 3D-рендеринга, атом под микроскопомPREMIUM
Индийский школьник или студент-естественник, использующий набор молекулярных моделей для изучения физики, селективный фокусPREMIUM
Символ H. химический элемент водорода с молекулой и сетью на зеленом фонеПРЕМИУМ
химический элемент водорода с молекулой и сетью на зеленом фонеПРЕМИУМ
Химическая структура молекулы кофеинаPREMIUM
Закон сохранения массы. принцип состояний сохранения массы. закон сохранения массы при химическом превращении материя не образуется и не разрушается. векторная диаграмма для использования в образовании, науке, химии и физике. PREMIUM
Синий фон молекул науки h. абстрактная структура 3d двойная молекула backgroundPREMIUM
Как хлорид натрия (nacl) растворяется в воде? ионы na притягивают отрицательные атомы кислорода молекулы воды. ионы cl притягивают положительные атомы водорода молекулы воды. ПРЕМИУМ
Молекула этилена этена. используется в производстве полиэтилена. растительный гормон. каркасная низкополигональная сетка векторная иллюстрация. PREMIUM
Бета-аланин, b-аланин, аминокислоты, молекулярные структуры, 3D-рендеринг, структурная химическая формула. PREMIUM
Абстрактный химический трехмерный фон с прозрачными молекулами. химические элементы с сильным увеличением. ПРЕМИУМ
химические элементы с сильным увеличением. ПРЕМИУМ
Тема фармации и химии. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Символ газового насоса h3 в пузыре. 3d illustration.PREMIUM
молекула водорода h3 в жидкости. 3d illustration.PREMIUM
Молекулы воды, молекулярная химическая формула h3o, без запаха, модель химической структуры шариков и палочек, макрожидкие пузырьки, 3d renderPREMIUM
Значок комплекса аминокислот — мономеры органических соединений, которые составляют белки и используются в пищевой промышленности, приправы , добавка для бодибилдинга, корм для животных. PREMIUM
Голубая научная молекула или атомный фон, абстрактная структура 3d двойная молекула backgroundPREMIUM
молекулы водорода h3 на сером фоне. 3d illustration.PREMIUM
Инфографическая диаграмма химических связей, показывающая типы связи, включая металлические водородные ионные полярные и неполярные ковалентные связи для образования в области химии. PREMIUM
PREMIUM
Процесс электролиза воды с анодом и катодом в воде и электрической батарее. отрицательные синие анионы и положительные красные катионы направляются к металлической трубе. 3d иллюстрацияPREMIUM
Кислотно-основная реакция. химическая реакция нейтрализует свойства кислоты и основания с образованием соли и воды. используется для определения ph. Бронстеда – теория Лоури. молекулы hcl, naoh, h3o и nacl, соль, водаPREMIUM
Футуристический научный веб-баннер со светящимися низкополигональными молекулами воды на темно-синем фоне. ПРЕМИУМ
Научная концепция. молекулы метана или аммония. 3d визуализации illustration.PREMIUM
Аптека и химия тема. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Чистый зеленый водород как возобновляемый источник энергииPREMIUM
Молекулярная структура фруктозы, атомы и молекулы крупным планом 3d модель, имитация вида через микроскопPREMIUM
Химическая молекулярная формула гормона прогестерона. иллюстрация биохимии и гинекологии. ПРЕМИУМ
иллюстрация биохимии и гинекологии. ПРЕМИУМ
Реалистичная стеклянная молекула аммиака для красивого дизайна. химическая формула. ПРЕМИУМ
Бор модель научного вектора атома водорода. Структура ядра атома состоит из протона и электрона, материальный состав конструкции. физика химия концепция реалистичная 3d иллюстрацияPREMIUM
Периодическая таблица химических элементов. изолированные на белом фоне. PREMIUM
молекула водорода h3 в жидкости. 3d illustration.PREMIUM
Молекула воды. Структура 3d-рендерингаPREMIUM
Аммиак, nh4, модель молекулы и химическая формула. химическое соединение азота и водорода. бесцветный газ. шаростержневая модель, геометрическая структура и структурная формула. иллюстрация. vector.PREMIUM
Молекула кофеина, 3d иллюстрация. кофеин содержится в кофе, чае, энергетических напитках, применяется в медицинеПРЕМИУМ
Иллюстрация модели молекулы. наука, медицинское образование с молекулами и атомами. 3D-рендерингPREMIUM
Фермент супероксиддисмутазы 1 (sod1). превращает супероксидный радикал в пероксид водорода. генные мутации вызывают БАС (боковой амиотрофический склероз). 3D-рендеринг, мультфильм + линейное представление. n-to-c градиентная окраска.PREMIUM
превращает супероксидный радикал в пероксид водорода. генные мутации вызывают БАС (боковой амиотрофический склероз). 3D-рендеринг, мультфильм + линейное представление. n-to-c градиентная окраска.PREMIUM
Поверхность пузырьков. очень крупный план структуры пены мыла на желтом, золотом фоне. ПРЕМИУМ
Молекула этилена этена. используется в производстве полиэтилена. растительный гормон. каркасная низкополигональная сетка векторная иллюстрация. ПРЕМИУМ
молекула водорода h3 в жидкости. 3d illustration.PREMIUM
Модели молекул метана, этана, пропана и химические формулы. органические химические соединения. природный газ. шаростержневая модель, геометрическая структура, структурная формула. иллюстрация над белой. vector.PREMIUM
3d иллюстрация молекулярной модели кофеина изолированный серый фон.PREMIUM
Красочная периодическая таблица элементов. простая таблица, включающая символ элемента. разделены на категории. Плакат на химическую и научную тему. векторная иллюстрация.ПРЕМИУМ
векторная иллюстрация.ПРЕМИУМ
Научная концепция. молекулы метана или аммония. 3D визуализация. ПРЕМИУМ
Нуклеотиды представляют собой органические молекулы. нуклеозиды представляют собой гликозиламиныPREMIUM
Рыбий жир, омега-3. молекула эйкозапентаеновой кислоты (ЭПК), докозагексаеновой кислоты (ДГК). полиненасыщенные жирные кислоты. vector illustrationPREMIUM
Глутатион или gsh является антиоксидантом в растениях, животных, грибах и некоторых бактериях и археях. 3d иллюстрацияPREMIUM
Молекулярная схема гиалуроната натрия. цифровая иллюстрацияPREMIUM
Скелетная формула никотинамида. химическая молекула витамина b3. PREMIUM
Молекула или сыворотка или атом, сывороточный жидкий крем, коллагеновая прозрачная кристально чистая сыворотка премиум-класса и витамин для ухода за кожей, абстрактная структура для науки или медицины, схематический водород, PREMIUM
Молекулы метана или аммония. концепция науки. 3d визуализации illustration.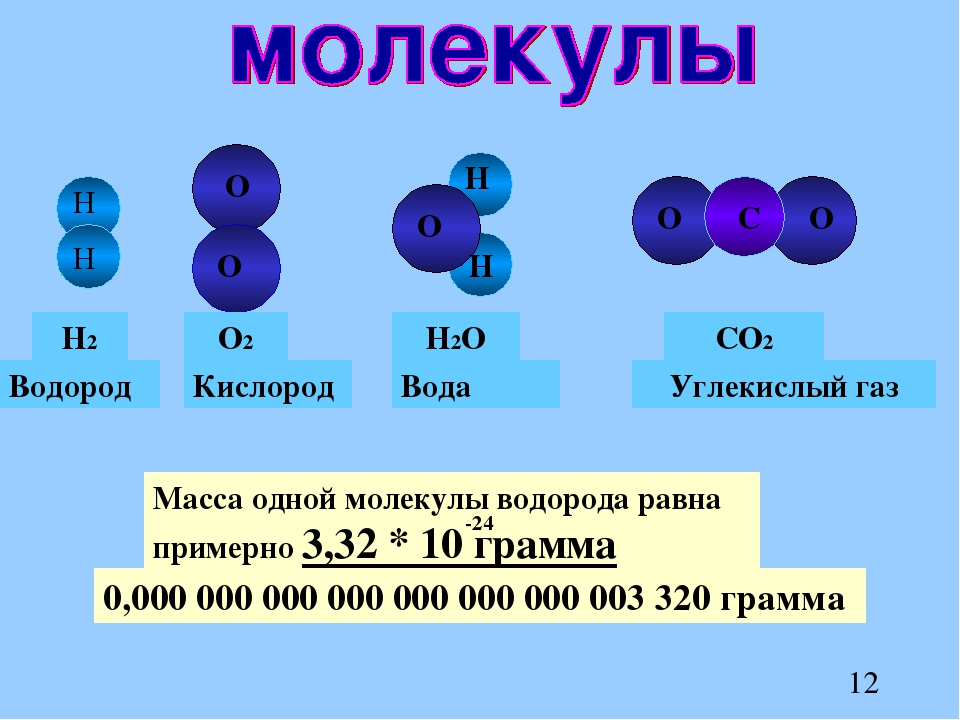 PREMIUM
PREMIUM
Аптека и химия тема. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Абстрактные прозрачные молекулы водорода h3 на синем фоне, концепция чистой энергии или химии, 3d illustrationPREMIUM
Абстрактный дизайн структуры атома или молекулы, атом или молекула из стеклянного материала. 3D рендеринг. ПРЕМИУМ
Молекула воды. структура 3d-рендерингPREMIUM
Прозрачные синие пузыри разного размера на белом фонеPREMIUM
Молекула или сыворотка или атом, сывороточный жидкий крем, коллагеновый прозрачный кристалл, сыворотка премиум-класса и витамины для ухода за кожей, абстрактная структура для науки или медицины, схематический водород, PREMIUM
Молекула этилена этена. используется в производстве полиэтилена. растительный гормон. каркасная низкополигональная сетка векторная иллюстрация. ПРЕМИУМ
Абстрактный дизайн структуры атома или молекулы, атом или молекула из стеклянного материала. 3D визуализация.ПРЕМИУМ
3D визуализация.ПРЕМИУМ
Метан, этан, пропан. молекулярные шарико-стержневые модели и химические формулы. органические химические соединения. природный газ. геометрические структуры и структурные формулы. иллюстрация над белой. vector.PREMIUM
Голубые пузыри водорода, изолированные на белом фоне.PREMIUM
Футуристическая концепция альтернативной энергетики с молекулами водорода и местом для текста на синем фонеPREMIUM
Тема фармации и химии. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Фармация и химия на тему. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Абстрактная молекула метана — 3d иллюстрацияPREMIUM
Молекула финастерида. он используется для лечения симптомов доброкачественной гипертрофии предстательной железы и мужского облысения. молекулярная модель. 3d рендеринг. illustrationPREMIUM
молекулярная модель. 3d рендеринг. illustrationPREMIUM
Синяя научная молекула или атомный фон, абстрактная структура 3d двойная молекула backgroundPREMIUM
Абстрактное соединение нескольких молекул плавает на синем прозрачном фоне с прозрачными пузырьками внутриPREMIUM
Ковалентная связь, например, молекула воды (h3o). представляет собой молекулярную (химическую) связь, которая включает в себя совместное использование электронных пар между атомами. структурная формула, модель шаров и палочек, водородная связь. векторная диаграмма для дизайна, образования, науки и медициныПРЕМИУМ
Фармация и химия. испытательная стеклянная колба с раствором в исследовательской лаборатории. наука и медицинское образование. лабораторные пробирки на абстрактном фоне облака взрыва. селективный фокусPREMIUM
Абстрактный дизайн структуры атома или молекулы, атом или молекула из стеклянного материала. 3d rendering.PREMIUM
Химическая молекулярная формула гормона прогестерона.


 Все правила по сольфеджио
Все правила по сольфеджио
 Модель автора устраняет этот недостаток. В этой модели объемную форму электронного облака формируют джеты – два гибких воронкообразных вихря, связывающих между собой электрон и протон. Вихри истекают из торцов (полюсов) электрона и втекают в торцы (полюса) протона. Наличие таких вихрей у частицы формирует свойство частицы, называемое зарядом.
Модель автора устраняет этот недостаток. В этой модели объемную форму электронного облака формируют джеты – два гибких воронкообразных вихря, связывающих между собой электрон и протон. Вихри истекают из торцов (полюсов) электрона и втекают в торцы (полюса) протона. Наличие таких вихрей у частицы формирует свойство частицы, называемое зарядом.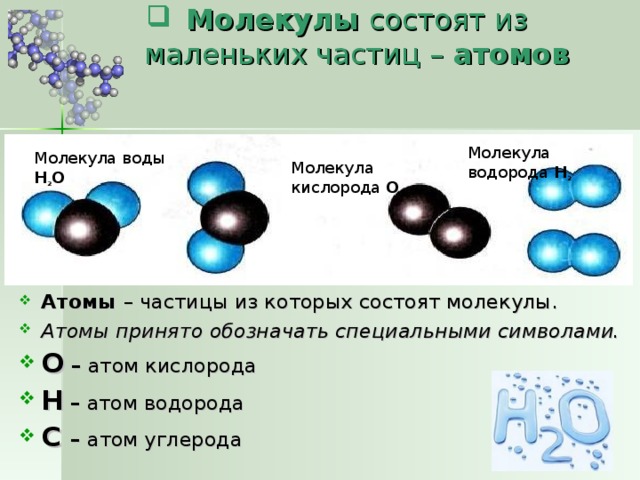

 В газовом состоянии при температуре 80К количество молекул пара-водорода и орто-водорода одинаково, при увеличении температуры увеличивается количество молекул орто-водорода, при уменьшении температуры увеличивается количество молекул пара-водорода. Повышение температуры сопровождается повышением средней кинетической энергии молекул. Столкновение молекул, соответственно, сопровождается усилением возбуждения атомов, что означает повышение вероятности эллиптической траектории электронов в атомах орбитальной модели. При круговой траектории торцевые вихри создают на полюсе атома правильную тороидальную поверхность, которая способна слипаться с полюсом другой правильной тороидальной поверхности любых размеров. А при эллиптической траектории движения электрона торцевые вихри создают на полюсе атома вытянутую тороидальную поверхность, которая способна слипаться только с точно такой же поверхностью и точно так же повернутой. Понятно, что вероятность соприкоснуться с точно такой же поверхностью ничтожна.
В газовом состоянии при температуре 80К количество молекул пара-водорода и орто-водорода одинаково, при увеличении температуры увеличивается количество молекул орто-водорода, при уменьшении температуры увеличивается количество молекул пара-водорода. Повышение температуры сопровождается повышением средней кинетической энергии молекул. Столкновение молекул, соответственно, сопровождается усилением возбуждения атомов, что означает повышение вероятности эллиптической траектории электронов в атомах орбитальной модели. При круговой траектории торцевые вихри создают на полюсе атома правильную тороидальную поверхность, которая способна слипаться с полюсом другой правильной тороидальной поверхности любых размеров. А при эллиптической траектории движения электрона торцевые вихри создают на полюсе атома вытянутую тороидальную поверхность, которая способна слипаться только с точно такой же поверхностью и точно так же повернутой. Понятно, что вероятность соприкоснуться с точно такой же поверхностью ничтожна.
 Второй вариант объяснения – жидкого молекулярного водорода не существует. На фазовой диаграмме водорода показано, что жидкий молекулярный водород существует, но только в узком диапазоне температур, а при температурах близких к абсолютному нулю становится твердым. Третье объяснение – вариант 2 существует, но в диапазоне температур, до которых экспериментаторы еще не добрались. Действительно, из фазовой диаграммы видно, что чем меньше давление, тем уже диапазон существования жидкого молекулярного водорода, тем труднее попасть в этот диапазон. Четвертое объяснение – молекулы варианта 2 существуют, но по причине наличия автономного движителя не конденсируются в жидкость, всегда остаются в газообразном состоянии. В жидкость же при сверхнизких температурах конденсируются лишь молекулы пара-водорода варианта 3 – молекулы экваториальной формы с атомами витковой модели. Но если четвертое объяснение верно, тогда таким молекулам не подходит свойство сверхтекучести. Правильней всего это свойство назвать сверхлетучестью.
Второй вариант объяснения – жидкого молекулярного водорода не существует. На фазовой диаграмме водорода показано, что жидкий молекулярный водород существует, но только в узком диапазоне температур, а при температурах близких к абсолютному нулю становится твердым. Третье объяснение – вариант 2 существует, но в диапазоне температур, до которых экспериментаторы еще не добрались. Действительно, из фазовой диаграммы видно, что чем меньше давление, тем уже диапазон существования жидкого молекулярного водорода, тем труднее попасть в этот диапазон. Четвертое объяснение – молекулы варианта 2 существуют, но по причине наличия автономного движителя не конденсируются в жидкость, всегда остаются в газообразном состоянии. В жидкость же при сверхнизких температурах конденсируются лишь молекулы пара-водорода варианта 3 – молекулы экваториальной формы с атомами витковой модели. Но если четвертое объяснение верно, тогда таким молекулам не подходит свойство сверхтекучести. Правильней всего это свойство назвать сверхлетучестью.
 su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь — 161.97.168.212 (0.004 с.)
su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь — 161.97.168.212 (0.004 с.) 1Ковалентная связь
1Ковалентная связь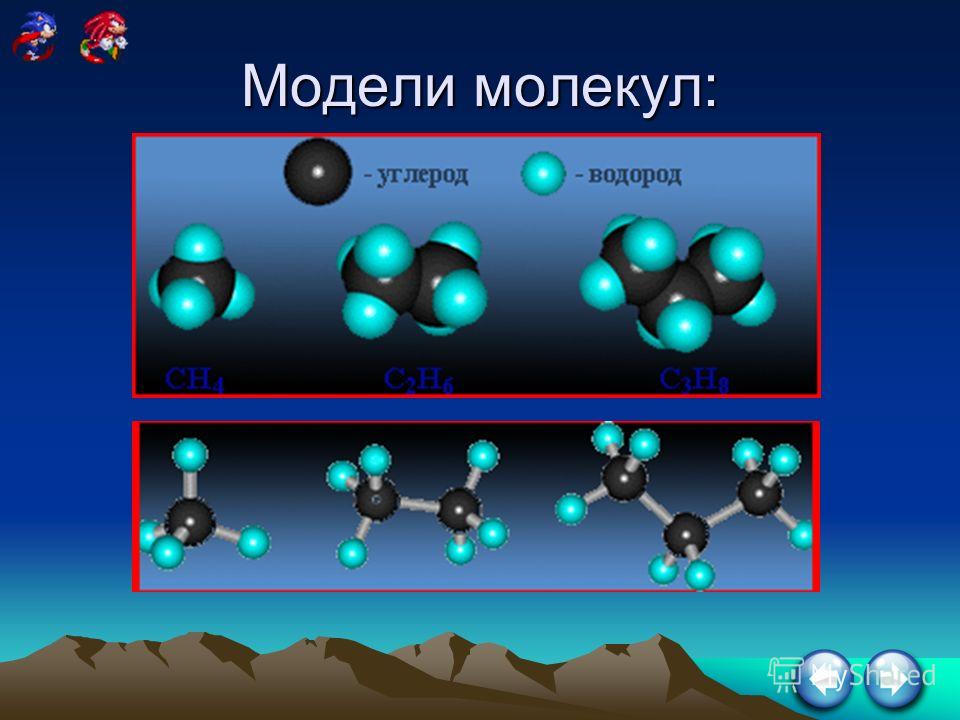 {2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}
{2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.} Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с. — Київ: Либідь, 2002.
— Київ: Либідь, 2002.