Литий ионный аккумулятор: конструкция, характеристики


Сейчас практически во всех портативных устройствах используются литий ионные аккумуляторы. Этот тип АКБ имеет ряд преимуществ перед своими предшественниками. С момента изобретения и до сегодняшних дней Li-ion прошел множество усовершенствований. Благодаря этому накопитель данного типа можно считать лучшим в своем роде. Но несмотря на это у нее присутствуют свои недостатки.
История появления
Первый литий ионный аккумулятор был выпущен в 1991 году. Ведущей компанией по производству данного типа АКБ стала Sony. Но батареи были разработаны в 70-х. Это были первые устройства с высокой энергоёмкостью, что сделало их востребованными. Но не было возможности применять их практически в массовом масштабе.
В составе батареи присутствует два электрода. На фольге из алюминия размещен катод, анод же поместили на медную. Их разделяет специальный сепаратор, который состоит из жидкого электролита, в некоторых случаях материал гелеобразный. Положительные заряды переносятся ионами лития. Они способы проникать внутрь других материалов и химических элементов, что провоцирует электрохимическую реакцию. Этим свойством они и обеспечивают заряд или питание устройств (телефонов, ноутбуков и т.д.).
В первые годы после создания литиево ионного накопителя они были известны своей взрывоопасностью. Это происходило из-за использования в конструкции накопителя металлического лития, а также по причине образования химических соединений в виде газа. При большом количестве разряда и заряда происходило замыкание, что влекло за собой взрыв аккумулятора.


Также взрывы происходили и потому, что ионы лития реагировали с другими соединениями и веществами в составе батарейки. Реакция была опасной и влекла за собой выделение большого количества тепла, после чего происходило возгорание и взрыв АКБ. В ходе улучшения было принято решение заменить анод на графитовый аналог. Такая рокировка позволила устранить проблему с взрывоопасностью аккумулятора. А производителю после выявления недостатка пришлось отозвать всю партию для мобильных телефонов.
Интересный факт! В зарядных устройствах, посредством которых накопители получают заряд, есть функция предохранения перегрева АКБ и защита от «переполнения» током.
Чтобы разработать полностью безопасную литий ионную батарейку понадобилось более чем 20 лет активных исследований и совершенствований. Это привело к выпуску более инновационного вида АКБ, а именно литий фосфатных. Они не перегреваются, а также в составе отсутствуют компоненты с опасными реакциями друг на друга. Также многие производители встраивают в корпус контроллер для заряда аккумуляторов во избежание эксцессов с возгоранием.
Принцип работы и устройство
Литий ионный аккумулятор имеет следующий принцип работы:
- После подачи тока на контакты АКБ, катионы лития переходят в анод;
- Во время использования и непосредственной разрядки, ионы лития перемещаются из анода и проникают в диэлектрик примерно на глубину до 50 нм.
Количество циклов зарядки за весь срок службы АКБ может исчисляться 1000. Интересно то, что при глубоком разряде окисление пластин источника не происходит. Но не все типы литий ионных аккумуляторов переносят процесс глубокой разрядки. Например, при установке в телефон или фотоаппарат, во время возникновения глубокого разряда плата блокирует возможность повторного заряда. Зарядить можно будет только с использованием специального устройства.
А вот тяговые литиевые батареи для лодочных моторов совсем не боятся полной потери заряда. Устройство литий ионного аккумулятора, как правило, состоит из некоторых источников энергии, которые соединены параллельно или последовательно.
Химические процессы на положительном и отрицательном электроде
Современные модели литий ионных АКБ содержат электрод из материала, в состав которого входит углерод. Природа этого материала и компоненты электролита влияют на процессы интеркаляции ионов лития в углерод. Матрица анода является слоистой. Она может быть, как частично, так и полностью упорядоченной
Во время протекания интеркаляции ионы от лития как бы раздвигают пласты углерода и встраиваются между ними. При внедрении и изъятии ионов объем матрицы не меняется. Положительный электрод выполняется из оксида никеля или кобальта. Также используются шпинели из лития и марганца.
Во время заряда происходят реакции, которые описываются следующими уравнениями:
- на положительном электроде;
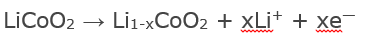
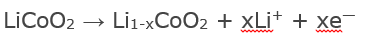
- на отрицательном электроде.
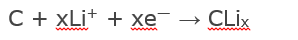
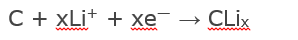
Принцип действия разряда описывается обратными уравнениями.
Виды литий ионных аккумуляторов
Литий ионные аккумуляторы стали востребованы во многих сферах. Помимо использования в гаджетах, бытовых устройствах и автомобилях, выпускают и АКБ для промышленного использования, который имеют высокое напряжение и емкость. Самыми востребованными считаются АКБ, представленные в таблице.


Две цифры первые в ряду указывают на размер диаметра батареи, вторые две на длину. Нуль ставится в случае цилиндрической формы. Также выпускаются АКБ подтипа «Крона» с напряжением в 9 Вольт.
Обозначения батареи указывают на содержание элементов, например, как:
- ICR – кобальта;
- IMR – марганца;
- INR – никеля и марганца;
- NCR –кобальта и никеля.
Виды li ion аккумуляторов в основном отличаются размерами, химическим составом, а также по емкости и напряжению.
Конструкция литий ионной батареи
Литиево ионные батареи изготавливаются в цилиндрическом и призматическом виде. Вариант в виде цилиндра является по сути рулоном из электродов с материалами для разделения разно полюсных. Корпус выполняется из стали или алюминия, с которым соединен минус. Плюс выводится на площадку, расположенную на торце корпуса.
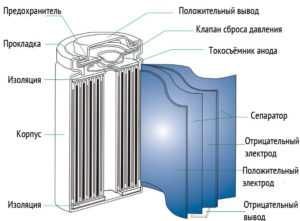

Призматическая конструкция выполняется путем складывания прямоугольных пластин друг на друга. Такой вариант позволяет сделать накопитель компактней.

Любая конструкция предусмотрена с герметичным корпусом. Вытекание электролита недопустимо, так как сразу же выводит батарею из строя.
Характеристики
Характеристики li ion аккумуляторов напрямую зависят от компонентов в составе накопителя. Параметры могут принимать значения в следующих диапазонах:
- Напряжение: номинальное – 3.7 В, макс. – 4.2-4.35 В, мин. – 2.5-3 В.
- Энергоемкость – 110-243 Втч/кг.
- Сопротивление – 5-15 Ом/Ач.
- Время скорого заряда – 15-60 минут.
- Рабочие температуры — -20-60 градусов.
Эксплуатация и срок службы
Батарея такое же сложное устройство, как и телефон, разве что выполняет только одну функцию. Именно поэтому, чтобы максимально эффективно использовать все возможности акб, рекомендуется ознакомиться с тем, как правильно пользоваться и хранить батарею. Это также поспособствует продлению срока службы.
Как правильно эксплуатировать
Необходимо стараться не допускать полного разряда батареи. Этот процесс легко контролировать. Но помимо этого также требуется следить за правильным ходом заряда.
При процессе заряда аккумуляторной батареи необходимо не допускать избыточного подключения к устройству зарядки. Литий ионный АКБ корректно работает и заряжается при напряжении до 3.6 В. Как правило, зарядные устройства подают 4.2 В. При превышении времени заряда в корпусе могут провоцироваться небезопасные электрохимические реакции. Это может повлечь за собой перегревание и вздутие.
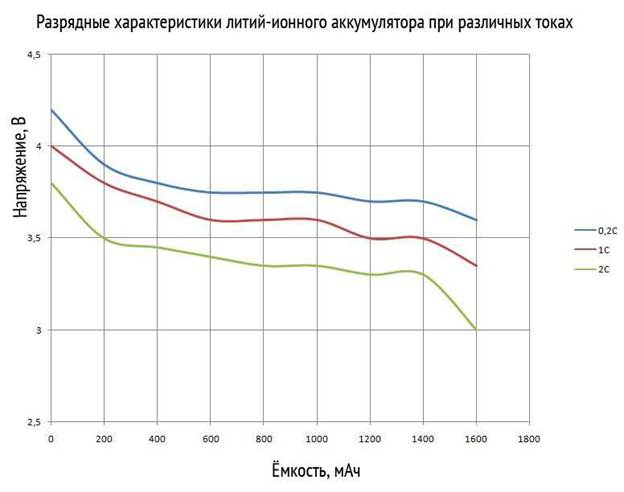

При разработке была учтена такая особенность и при превышении напряжения выше рекомендуемого показателя, процесс заряда останавливается. Также литиевые АКБ правильно заряжать именно двухступенчатым способом. Первым этапом происходит зарядка накопителя на постоянном токе, вторым постоянным напряжением с постепенным понижением тока. Данный алгоритм уже реализован во многих зарядных устройствах.
Срок службы
Срок службы батареи напрямую зависит от правильного использования. Например, при несоблюдении рекомендаций в эксплуатации литий ионных аккумуляторов этот период сокращается в 10 раз. Принято считать, что АКБ способны выдержать 500-1000 циклов заряд-разряд, в этом случае учтен фактор полного разряда. При остатке даже минимального процента заряда можно увеличить срок службы устройства на порядок.
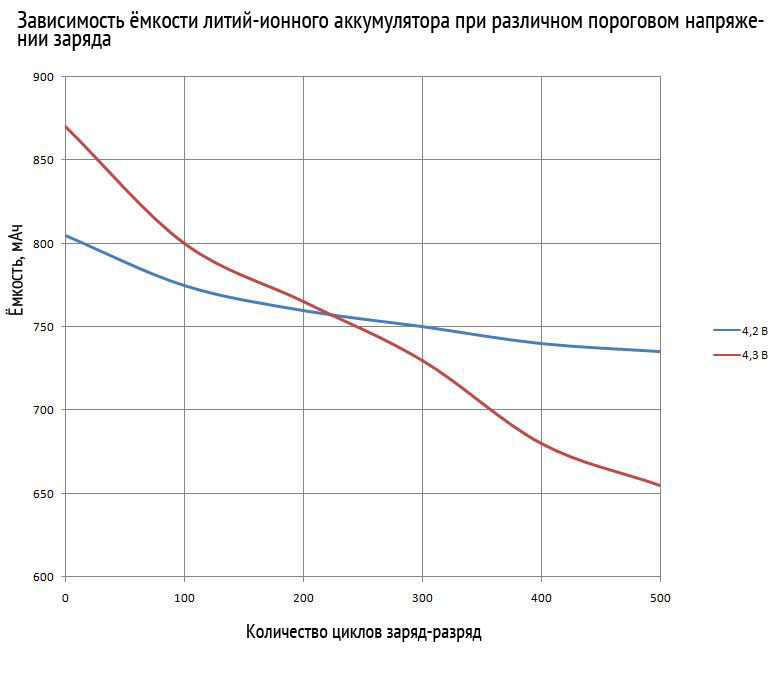

Нельзя назвать точный срок работоспособности данного типа устройств, так как длительность напрямую зависит от условий использования. Но все же ориентировочно одна литий ионная батарейка может корректно выполнять свои функции на протяжении 8-10 лет с учетом того, что ее использование будет происходить строго по рекомендациям.
Хранение и утилизация
Данный тип аккумуляторов достаточно просто хранить. Как правило, саморазряд при корректном хранении составляет около 10-15 % в год. Но этот показатель может меняться в большую или меньшую сторону в зависимости от условий консервации.
Важно! Даже при идеальных условиях хранения литий ионных аккумуляторов все равно будет происходить процесс деградации элементов.
При возникновении необходимости длительной консервации аккумулятора типа Li-ion требуется позаботиться о минимизации негативного воздействия на акб:
- Место для хранения должно быть сухим, с небольшим показателем влажности. Требуется исключить риск ударов, возникновения вибрации и непосредственное соседство с открытым огнем или нагревательными элементами.
- Температура хранения литий ионного аккумулятора не должна быть ниже нуля. Оптимально хранить устройство при 5-25 градусах.
- Перед консервацией устройства вынимают из прибора. Также предварительно заряжают полностью.
Главное учесть, что любой контакт с водой негативно скажется на состоянии аккумулятора. Хранить при соблюдении всех рекомендаций устройство можно в течение нескольких лет. Важно понимать, что это не убережет батарею от уменьшения емкости.


Утилизировать АКБ требуется путем сдачи в предприятия, которые на этом специализируются. Просто выбрасывать батарею строго запрещено. Дело в том, что более чем половина устройства, вышедшего из строя, используется повторно для производства новых батарей.
Безопасность
Основная проблемы по защите литий ионного аккумулятора на сегодняшний день решена. Специальная электронная защита в виде встроенного контролера держит под надзором все процессы, происходящие во время заряда и разряда (т.е. при использовании АКБ по назначению). Помимо этого, постоянно усовершенствуется материал для изготовления катода. Приоритетно сейчас стоит возможность сделать его термически стабильным.
Также Li-Ion оснащены специальной защитой, которая реагирует на внутреннее замыкание цепи. Помимо этого, немногие типы АКБ этого рода защищены от внешнего короткого замыкания. Защита внутри устройства состоит из двух слоев сепараторов. Один из слоев изготовлен из полипропилена, другой из аналогичного этому материалу вещества. В случае возникновения короткого замыкания второй из слоев просто плавится, что делает его непроницаемым. И рост дендритов лития, стремящихся к положительному электроду, прекращается.


Производители стали встраивать в корпус батареи контролеры заряда, чтобы избежать возможность самовозгорания. Это устройство держит под контролем температуру внутри корпуса батарейки, глубину заряда, а также количество тока, потребляемого АКБ.
Но несмотря на этот тип усовершенствований даже сегодня есть много сообщений о взрывах аккумуляторов. Довольно часто это случается в телефонах. Эти случаи объясняются тем, что не все производители литий ионных АКБ пользуются такими контролерами. Отказ мотивируется улучшением показателей емкости самой батареи, а также удешевлением производства. Так что, если батарея вздулась спустя некоторое время после эксплуатации — это верный признак того, что производитель сэкономил на производстве.
Но даже такая опасная возможность, как возгорание, которую можно устранить, делает литий ионные аккумуляторы лучше, чем предшествующие аналоги по всем характеристикам. Данный тип батареи работает намного дольше благодаря высокой емкости, низкий уровень пассивного разряда продляет срок годности. Также батареи типа Li-ion не нужно дополнительно обслуживать. А при выходе из строя устройства его дешевле заменить, чем отремонтировать.
Требования к режимам заряда/разряда
Требуется тщательно следить за уровнем разряда аккумулятора. Дело в том, что полный разряд батареи негативно сказывается на его характеристиках. Также возможен полный вывод из строя после глубокого разряда.
Помимо этого, на срок службы литий ионных аккумуляторов непосредственно сказывается уровень разряда перед зарядом и произведение зарядки при помощи токов номиналом выше рекомендованного производителем. Такой тип довольно чувствителен к напряжению зарядного устройства. Например, если использовать вспомогательный прибор с напряжением выше рекомендованного на 3-4 процента, то батарея потеряет емкость в два раза быстрее.
Ток заряда находится в непосредственной зависимости от разницы напряжения аккумулятора и устройства. А также от сопротивления АКБ и проводов, подводимых к нему. При простых расчетах выходит, что при увеличении напряжения зарядного устройство на 4%, ток заряда возрастет в 10 раз. Такой скачок негативно скажется на работоспособности аккумулятора. Также это увеличивает возможность перегрева.
Как восстановить литий ионный акб
Даже большой срок службы литий ионного аккумулятора не спасает от истощения батареи. В таком случае есть проверенный способ как восстановить литий ионный аккумулятор, но он проработает не долго.
Важно! Восстановить вздутую батарею невозможно. В этом случае она подлежит только утилизации.
Необходимо взять зарядку с напряжением в 5-12 В, а также резистор 330-1 кОм. Минус источника подключить к АКБ, плюс подключается аналогично только через резистор. После чего включить подачу тока и замерять рост показателей напряжения в следующие 10-20 минут. Как только показатель выдаст 3.31 В, смартфон покажет, что пошел процесс заряда. Повышение напряжения, а затем последующее его снижения до рекомендуемых параметров поможет немного восстановить емкость li ion аккумулятора.
Как проверить работоспособность АКБ
Для того, чтобы проверить работоспособность литий ионного аккумулятора, необходимо для начала полностью зарядить батарейку. После чего подключить ее одним концом к тестеру, а другим к нагрузочному резистору.
Тестер покажет емкость, ток и напряжение. Достаточно сравнить полученные показатели с базовыми параметрами батареи. Сильное отклонение в меньшую сторону будет означать, что устройство медленно выходит из строя.
Плюсы и минусы
У литий ионных аккумулятор есть свои преимущества и недостатки перед другими батареями. К плюсам относят такие моменты, как:
- высокий уровень энергоемкости;
- эффект памяти настолько минимален, что практически отсутствует;
- срок эксплуатации очень большой;
- нет нужды дополнительно обсуживать АКБ;
- корректно выполняет свои функции в большом диапазоне температур;
- уровень саморазряда очень низок.
Несмотря на все преимущества у литий ионных батарей есть и свои минусы, например, как:
- возможность самовозгорания и взрыва, вздутие и выход из строя;
- емкость понижается при температуре эксплуатации ниже нуля;
- стоимость продукта значительно выше чем у предшествующих АКБ;
- для повышения безопасности использования устройства необходим контроллер заряда;
- плохо переносит глубокий разряд.
Кстати, большинство минусов купируются. Например, при желании можно найти батарейку с контроллером, что уже устраняет возможность перегрева и самовозгорания. А при постоянной подзарядке, глубокий разряд также исключается. Также производители с каждым годом выпускают более совершенные варианты литий ионных аккумуляторов. Недостатки постепенно купируются и в скором времени возможно совсем исчезнут, что сделает этот тип совершенным.
Маркировка
Все параметры литий ионной батареи можно узнать из маркировки, нанесенной на корпус. Вариант маркировки может отличаться у каждого вида АКБ. Пока не существует единого стандарта маркирования. Но достаточно просто разобраться в ней, зная типовые параметры и обозначения:
- Буквы. Первой буквой всегда стоит I, так как обозначает тип технологии, т.е. литий ионную. Вторая буква дает уточнение по составу, встречаются маркировки такие как M, F, C, N. Третья буква дает обозначение того, что батарея является перезаряжаемой, маркировка R.


- Цифры. Цифровая маркировка означает размеры в миллиметрах. Таким образом первые 2 цифры — это диаметр, две последующие длина. Ноль на конце маркировки может означать цилиндрическую форму.
Для уточнения значений необходимо обратиться к документам батареи или производителю. У каждого из них может быть разные маркировки. Также отсутствует стандарт нанесения маркера даты производства.
Применение литий ионных аккумуляторов
Литий ионные аккумуляторы используются в большинстве мобильных устройств. Дело в том, что они не имеют аналогов в случаях, когда необходимо отдавать электричество практически в полном объеме. Также они необходимы для долгосрочного использования, так как способны выдержать большое количество циклов разряд-заряд, при этом не снижая свою емкость.
Преимуществами литий ионных АКБ является и малый вес, так как отсутствует необходимость использовать свинцовые решетки. Благодаря отличным характеристикам устройства применяются в разных ипостасях.
Как стартерные батареи
Аккумуляторы из лития становятся дешевле с каждым годом. Это происходит из-за новых разработок, снижающих затраты на производство. Но в данный момент литиево ионные батареи для автомобилей достаточно дорогостоящие и не все автовладельцы могут их приобрести. Также не рекомендуется использовать этот тип АКБ в северных регионах, так как мощность при низких температурах падает и использовать их будет непрактично.
Как тяговое устройство
Этот тип достаточно стойко переносит сильную разрядку хоть это и не рекомендуется. Их ставят на моторные лодки. Если двигатель не слишком мощный, батареи, как правило, хватает на 5-6 часов непрерывной работы. Также литий ионный АКБ устанавливают на погрузочную технику, которая работает в закрытом помещении.

 Бытовая техника.
Бытовая техника.
Частая практика у производителей делать устройства, где вместо пальчиковых батареек или других вынимаемых аналогов используется литий ионный акб. Существуют модели с напряжениями 3.6 вольт, которые заменяют солевые или щелочные батарейки на 1.5 вольта. В некоторых случаях встречаются li ion аккумуляторы в 3 вольта, их, как правило, используют для замены 2 стандартных батареек.


Литий ионные аккумуляторные батареи прочно вошли в мир технологий. Компактность этого вида акб позволяет использовать их в небольших мощных устройствах как, например, смартфоны.
Литий ионный аккумулятор. Что это, и как правильно эксплуатировать?
Здравствуйте, дорогие читатели! Сегодня поговорим про литий ионный аккумулятор, узнаем что это такое и как правильно эксплуатировать? И так…
Принцип работы любого электрического аккумулятора заключается в накоплении электрической энергии в процессе химической реакции, происходящей при протекании через аккумулятор зарядного электрического тока, и генерации электрической энергии при протекании разрядного тока в процессе обратной химической реакции.
Обратимость химической реакции в аккумуляторе позволяет многократно разряжать и заряжать аккумулятор. В этом и заключается преимущество аккумуляторов перед одноразовыми источниками тока, обычными батарейками, в которых возможен лишь разрядный ток.
В качестве среды для переноса заряда с одного электрода аккумулятора на другой, используется электролит – специальный раствор, благодаря химической реакции которого с материалом на электродах становятся возможными как прямая, так и обратная химические реакции в аккумуляторе, что и делает возможным как заряд аккумулятора, так и его разряд.
Устройство и принцип действия литий-ионного аккумулятора
Сегодня одним из наиболее перспективных типов аккумуляторов является литий ионный аккумулятор. В этих аккумуляторах в качестве отрицательного электрода (катода) выступает алюминий, а в качестве положительного электрода (анода) – медь. Электроды могут иметь различную форму, как правило, это фольга в форме цилиндра или продолговатого пакета.
На алюминиевую фольгу наносят катодный материал, которым чаще всего может быть один из трех:
- кобальтат лития LiCoO2
- литий-феррофосфат LiFePO4
- литий-марганцевая шпинель LiMn2O4
а на медную фольгу наносят графит.
Литий-феррофосфат LiFePO4 является единственным, на данный момент, безопасным катодным материалом с точки зрения опасности взрыва и экологичности в целом.

Литий-феррофосфат LiFePO4
Полимерные электролиты, способные внедрять в свой состав соли лития, в силу своей пластичности делают возможным изготовление литий-ионных аккумуляторов с большой внутренней поверхностью и почти любой формы, а это значительно повышает как технологичность производства, так и массогабаритные характеристики.
В процессе заряда такого аккумулятора, ионы лития перемещаются через электролит, и внедряются в кристаллическую решетку графита на аноде, образуя соединение графитит лития LiC6. При разряде происходит обратный процесс – от анода ионы лития движутся к катоду (окислителю), а во внешней цепи к катоду движутся электроны, в результате процесс приобретает электрическую нейтральность.
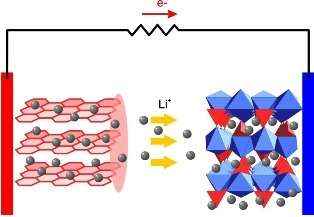
Устройство и принцип действия литий-ионного аккумулятора
Номинальное напряжение литий-ионного аккумулятора составляет 3,6 вольта, однако разность потенциалов при зарядке может достигать 4,23 вольта. В связи с этим фактом, заряд производится при максимально допустимом напряжении не более 4,2 вольта.
Некоторые соединения лития могут легко возгораться, если напряжение превышено, поэтому в литий-ионные аккумуляторы, традиционно, встраиваются контроллеры уровня заряда, не допускающие превышения критического напряжения. Еще одним способом обеспечения безопасности является встроенный клапан для сбрасывания избыточного давления внутри пакета.
Литий ионные аккумуляторы уже заняли свое достойное место на рынке портативной бытовой техники. Это элементы питания сотовых телефонов, фотоаппаратов, видеокамер, планшетов, плееров, и т.д.

Литий ионные аккумуляторы
Литий-феррофосфат LiFePO4 считается самым перспективным катодным материалом в силу своей экологичности. Кобальтат лития LiCoO2, в свою очередь, ядовит и экологически вреден, а у аккумуляторов на его основе лишь 50% ионов можно извлечь из структуры соединения, ведь если из него извлечь литий полностью, то структура станет нестабильной, кобальт перейдет в степень окисления +4 и сможет окислить кислород, а выделяющийся атомарный кислород станет окислять электролит, и произойдет взрыв. Аккумуляторы с повышенной емкостью (на основе LiCoO2) крайне взрывоопасны.
Литий-феррофосфат LiFePO4 был предложен в качестве катодного материала аккумуляторов для более мощных устройств в 1997 году Джоном Гуденафом.
Литий-феррофосфат есть в земной коре, и не создаст никаких экологических проблем в будущем. Из него не может выделяться кислород, так как он весь очень прочно связан фосфором с образованием устойчивого фосфат-иона. Однако, для возможности применения этого материала, его нужно было раздробить на мелкие частички, иначе он остался бы изолятором в силу очень малой проводимости. Частички сделали пластинчатыми с малыми размерами вдоль направления движения ионов лития, затем покрыли нанометровым слоем углерода.

Литий ионный аккумулятор для автомобиля
Такие наночастицы LiFePO4 способны заряжаться за 10 минут, а если еще модифицировать покрытие, то время заряда сократится до 1-3 минут. В перспективе, именно этот материал сможет обеспечить питание электромобилей в течение 10 лет. Уже сейчас технологически возможен цикл зарядки-разрядки за 5-10 минут при полной безопасности.
С точки зрения современной науки, разработка и выпуск даже портативного наноаккумулятора не заставит себя долго ждать, и слово лишь за широким технологическим внедрением разработок. Что касается перспектив электромобилей, то сейчас уже можно считать, что именно они станут основным видом транспорта в городах ближайшего будущего.
Правильная эксплуатация литий ионных аккумуляторов
Под правильной эксплуатацией литиевых аккумуляторов мы будем понимать соблюдение таких условий, в которых литий ионный аккумулятор портативного устройства сможет работать безопасно, прослужит долго, причем функционирование устройства останется полноценным.

Литий ионный аккумулятор для телефона
При правильной эксплуатации, литий ионный аккумулятор прослужит в 10-15 раз дольше, нежели при использовании как попало. Здесь будут приведены рекомендации для пользователей, соблюдение которых поможет сохранить литий ионный аккумулятор эффективным и емким на протяжении всего периода пользования портативным устройством, пока не придет время и решение приобрести новое на замену старому.
Часто аккумулятор смартфона вздувается, нередко деформируя и корпус. Вздутие — симптом накопления газов, продуктов реакций протекающих внутри аккумулятора при неправильной его эксплуатации, приводящего к повышению давления на корпус изнутри.
Если вовремя не заменить вздувшийся аккумулятор, он в какой-то момент полностью разрушится или в худшем случае взорвется. Но самое интересное в этой истории со смартфоном то, что описанную проблему легко можно предупредить и предотвратить, соблюдая простые правила эксплуатации устройства с литий ионным аккумулятором, и тогда ресурс аккумулятора сохранится максимально долго.
Не допускайте перегрева
Лишнее тепло, по какой бы причине оно не появилось, вредит литий ионной батарее сильнее всего. Причинами могут стать как внешний источник тепла, так и стрессовые режимы заряда и разряда. Так, если вы оставили смартфон на солнце, например на пляже или в держателе внутри автомобиля, это снизит как способность аккумулятора принимать заряд в процессе зарядки, так и способность удерживать его после.
Лучше всего для сохранения емкости литиевой батареи, если температура ее корпуса не поднимается выше 20°C. Ежели температура поднимется выше 30°C, то способность удержания заряда уже понизится с исходных 100% до 80%.
При нагреве до 45°C способность аккумулятора удерживать заряд ослабнет уже вдвое. Температура в 45°C, кстати, легко достигается, если оставить устройство на солнце или интенсивно использовать энергетически мощные приложения.

Испорченный литий ионный аккумулятор
То есть, если вы заметили, что устройство или аккумулятор ощутимо разогрелись, перейдите в прохладное место (если причина в температуре окружающей среды) или отключите ненужные приложения и службы, снизьте яркость дисплея, включите энергосберегающий режим — так вам удастся снизить потребляемую устройством мощность, и снизить ток, который течет через аккумулятор — аккумулятор начнет остывать.
Если это не поможет, выключите устройство, выньте батарею (если возможно) и подождите, пока она не охладится или пока не остынет устройство, если конструкция не позволяет извлечь аккумулятор.
Напротив, чрезвычайно холодная батарея, при температуре ниже -4°C, просто не сможет отдавать полную мощность пока не прогреется, лучше если до комнатной температуры.
Но вообще низкие температуры не способны причинить литиевой батарее такой необратимый ущерб, какой причиняют повышенные, поэтому после прогрева до комнатной температуры чрезвычайно холодного аккумулятора, свойства его электролита восстановятся. Выньте холодную батарею из устройства в помещении, или немного согрейте ее в руках, затем вставьте обратно.
Вовремя отключайте зарядное устройство
Если аккумулятор заряжается дольше чем положено, то есть если он остается подключен к источнику зарядного тока даже после того как полностью зарядился, это может убить аккумулятор, сильно понизив его емкость.
Суть в том, что рабочий уровень обычного литиевого аккумулятора не должен для безопасной работы превышать 3,6 вольта, однако зарядные устройства в процессе зарядки подают на клеммы 4,2 вольта. И если зарядное устройство вовремя не отключить (благо, некоторые отключаются автоматически сами), то внутри аккумулятора начнутся вредные реакции. В худшем случае пойдет чрезмерный перегрев, и цепная реакция в электролите не заставит себя долго ждать.

Вовремя отключайте зарядное устройство
Фирменные оригинальные зарядные устройства (которые идут в комплекте с самим гаджетом от производителя) отличаются высоким качеством, они сами способны снижать зарядный ток, взаимодействуя по правильному алгоритму с аккумулятором и со встроенным в гаджет контроллером.
С оригинальными зарядными устройствами опасность наступления перезаряда минимальна. Но лучше всего для верности сразу отключать заряжаемое устройство от зарядника, как только поступил сигнал (звук, световая индикация или пиктограмма на экране), что аккумулятор полностью заряжен. Не оставляйте очень надолго полностью заряженный смартфон подключенным к зарядному устройству.
Не беспокойтесь, что когда вы отключите смартфон от зарядника, он начнет разряжаться, ведь литиевые аккумуляторы отличаются от других типов аккумуляторов низким уровнем саморазряда. Если даже аккумулятором вообще не пользоваться после зарядки, то спустя сутки после отключения зарядки лишь 5% энергии, но все ровно убудет, а за следующий месяц — еще 2%.
В любом случае нет необходимости оставлять устройство на подзарядке (даже от фирменного зарядного устройства) до последнего момента, лучше отключить сразу, как только на дисплее (или индикатором) показан полный заряд.
Все современные мобильные устройства на литий-ионных аккумуляторах показывают 100% заряда, когда аккумулятор действительно полностью заряжен, нет никакой необходимости держать дольше.
Не допускайте глубокий разряд
Есть разные варианты использования ресурса аккумулятора. Если каждый раз разряжать батарею быстро и полностью, это будет регулярно сопровождаться выделением большого количества тепла, ведь разрядные токи через батарею будут течь немалые, а это разрушительная нагрузка на аккумулятор.
Если же небольшие разрядные циклы будут короткими, пусть даже потом аккумулятор будет дозаряжен, а затем снова разряжен несколькими порциями, ресурс аккумулятора сохранится дольше.
Современные литиевые аккумуляторы нормально выдерживают неполный разряд и дозаряд, не то что самые первые литиевые экземпляры!
И если рассмотреть влияние циклов разряда-заряда на общий жизненный ресурс аккумулятора, то на самом деле три цикла разряда до 66% и дозаряда до 100% принципиально эквивалентны по изнашивающему действию паре циклов разряда до 50% и затем дозаряда до 100%.

Не допускайте глубокий разряд
Много коротких циклов разряда-заряда не вреднее нескольких более длительных циклов. Вреден интенсивный разряд — он вызывает нагрев и ведет к необратимым процессам, если является глубоким (до 20% и ниже).
Нагрев и высокая токовая нагрузка однозначно снижают общий жизненный ресурс аккумулятора. Каждый глубокий разряд медленно но верно ведет к необратимым разрушениям, поэтому старайтесь вообще избегать глубокого разряда. Если смартфон сам выключился — это признак глубокого разряда — не следует до этого доводить. 20% достаточно для того, чтобы поставить устройство на подзарядку или вставить резервную батарею.
Разряжайте и заряжайте литиевый аккумулятор медленно
Как было сказано выше, интенсивная разрядка и зарядка сопровождаются большими токами через электролит аккумулятора, что и ведет к его перегреву, и следовательно — к разрушительным процессам.
Но даже если стрессовый режим был допущен, и аккумулятор сильно нагрелся, не спешите ставить его на зарядку. Подождите пока он остынет, и только после этого подключайте к зарядному устройству, тогда он сможет нормально и безопасно принимать заряд.
В процессе зарядки аккумулятор тоже не должен перегреваться, если такое происходит, значит через электролит текут слишком большие токи, а это вредно.
Некачественные зарядные устройства грешат так называемой «быстрой зарядкой», как и некоторые самодельные индукционные беспроводные зарядники. Такими «быстрыми» зарядными устройствами лучше не пользоваться. Дело в том, что безопасное зарядное устройство обязано реагировать на ток, потребляемый аккумулятором в процессе зарядки, и оперативно менять подаваемое напряжение, если нужно — снижать, когда нужно — повышать. Читайте нашу статью про беспроводные зарядки «Беспроводная зарядка для телефона. Как устроена и работает?«
Если зарядное устройство — это просто трансформатор с выпрямителем, то ваш аккумулятор скорее всего перегреется из-за перенапряжения и постепенно разрушится. Не все «быстрые» зарядники совместимы с литиевыми аккумуляторами.
Самый лучший вариант — оригинальное зарядное устройство от того же производителя, что и у заряжаемого устройства, идеально — зарядник из комплекта. Но если возможности применить оригинальный зарядник нет, то пользуйтесь тем, который дает меньший ток — это спасет аккумулятор от перегрева из-за подачи чрезмерной мощности.

Разряжайте и заряжайте литиевый аккумулятор медленно
Хорошая альтернатива оригинальному зарядному устройству — USB-порт компьютера. USB 2.0 даст 500mА, USB 3.0 — максимум 900mА. Этого достаточно для безопасной зарядки.
Некоторые из «быстрых» устройств способны вкачивать в батарею по 3-4 ампера, но это разрушительно для батарей небольшой емкости, коими являются аккумуляторы карманных мобильных гаджетов (см. документацию). Небольшой ток от USB – гарантия сохранности литий-ионного аккумулятора.
Имейте при себе резервный аккумулятор
Многие устройства допускают извлечение батареи, поэтому иметь запасной аккумулятор — совсем не проблема. Время работы устройства возрастет вдвое, исключается глубокий разряд (заранее установить резервный аккумулятор, не дожидаясь полного разряда основного), отпадает соблазн использовать вредный «быстрый» зарядник. 20% разряда основного аккумулятора — сигнал к тому чтобы установить резервный.

Имейте при себе резервный аккумулятор
Если первая батарея сильно нагрелась от интенсивной нагрузки или по причине внешнего нагрева (случайно оставили на солнце) — вставьте запасную, и пока первая будет остывать, вы продолжите пользоваться вашим устройством, сохранив оба аккумулятора невредимыми. Когда тот что нагрелся остынет, его можно будет поставить на дозарядку в оригинальное зарядное устройство (сетевое или автомобильное).
Итак, чтобы литий ионный аккумулятор прослужил долго и верно, необходимо:
- Не допускать разогрева аккумулятора выше 30°C, лучшая температура 20°C
- Исключить чрезмерный заряд аккумулятора и перенапряжение на клеммах, оптимально 3,6 В
- Избегать глубокого разряда аккумулятора — пусть 20% будет пределом
- Не допускать высокие токовые нагрузки во время заряда и разряда (см. документацию), использовать USB
- Иметь резервный аккумулятор
Будем рады, если подпишетесь на наш Блог!
[wysija_form id=»1″]
Литий-ионные аккумуляторы. Устройство и виды.Работа и применение
Сегодня именно литий-ионные аккумуляторы наиболее часто применяются в различных областях. Особенно широко они используются в мобильной электронике (КПК, мобильные телефоны, ноутбуки и многое другое), электромобилях и так далее. Это связано с их преимуществами в сравнении с ранее широко применявшимися никель-кадмиевыми (Ni-Cd) и никель-металлогидридными (Ni-MH) аккумуляторами. И если последние приблизились вплотную к своему теоретическому пределу, то технологии литий-ионные аккумуляторы находятся в начале пути.
Устройство
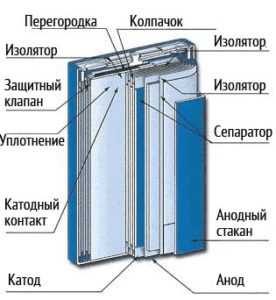
В литий-ионных аккумуляторах в качестве отрицательного электрода (катода) работает алюминий, а положительным электродом (анодом) выступает медь. Электроды могут быть выполнены в разной форме, однако, как правило, это фольга в форме продолговатого пакета или цилиндра.
- Анодный материал на медной фольге и катодный материал на алюминиевой фольге разделяются пористым сепаратором, который пропитан электролитом.
- Пакет электродов устанавливаются в герметичный корпус, а аноды и катоды подсоединяются к клеммам-токосъемникам
- Под крышкой аккумулятора могут быть специальные устройства. Одно устройство реагирует увеличением сопротивления на положительный температурный коэффициент. Второе устройство разрывает электрическую связь между положительной клеммой и катодом при повышении давления газов в аккумуляторе сверх допустимого предела. В некоторых случаях корпус оснащается предохранительным клапаном, который сбрасывает внутреннее давление при нарушениях условий эксплуатации или аварийных ситуациях.
- Для повышения безопасности эксплуатации в ряде аккумуляторов применяется и внешняя электронная защита. Она не допускает возможности чрезмерного разогрева, короткого замыкания и перезаряда аккумулятора.
- Конструктивно аккумуляторы производятся в призматическом и цилиндрическом вариантах. Свернутый в виде рулона пакет сепаратора и электродов в цилиндрических аккумуляторах помешен в алюминиевый или стальной корпус, с которым соединяется отрицательный электрод. Через изолятор на крышку выводится положительный полюс аккумулятора. Призматические аккумуляторы создаются складыванием прямоугольных пластин друг на друга.
Подобные литий-ионные аккумуляторы позволяют обеспечить более плотную упаковку, однако в них труднее поддерживать сжимающие усилия на электроды, чем в цилиндрических. В ряде призматических батарей используется рулонная сборка пакета электродов, скрученных в эллиптическую спираль.
Большая часть аккумуляторов производится в призматических вариантах, так как основное их назначение — обеспечение работы ноутбуков и мобильников. Конструкция Li-ion аккумуляторов отличается абсолютной герметичностью. Данное требование продиктовано недопустимостью вытекания жидкого электролита. Если пары воды или кислород попадут внутрь, то происходит реакция с электролитом и материалами электродов, что ведет к полному выводу аккумулятора из строя.
Принцип действия
- В литий-ионных аккумуляторах имеются два электрода в виде анода и катода, между ними находится электролит. На аноде при подключении батареи в замкнутую цепь образуется химическая реакция, которая приводит к образованию свободных электронов.
- Указанные электроны стремятся попасть на катод, где меньше их концентрация. Однако от прямого пути к катоду от анода удерживает их электролит, который находится между электродами. Остается единственный путь – через цепь, куда замыкается батарея. При этом электроны, двигаясь по указанной цепи, питают устройство энергией.
- Положительно заряженные ионы лития, которые были оставлены убежавшими электронами, в то же время через электролит направляются к катоду, дабы удовлетворить потребность в электронах на стороне катода.
- После перемещения всех электронов к катоду наступает «смерть» батарейки. Но литий-ионный аккумулятор является перезаряжаемым, то есть процесс можно обратить вспять.
При помощи зарядного устройства можно впустить энергию в цепь, тем самым будет запущена реакция протекания в обратном направлении. В результате будет получено скопление электронов на аноде. После перезаряда аккумулятора он по большей части будет оставаться таковым до момента приведения его в действие. Однако с течением времени батарея будет утрачивать часть своего заряда даже в режиме ожидания.
- Емкость батареи подразумевает количество ионов лития, которые могут внедриться в кратеры и крошечные поры анода или катода. Со временем, после многочисленных перезарядок катод и анод деградируют. В результате число ионов, которые они могут вместить, уменьшается. При этом аккумулятор более не может удерживать прежнее количество заряда. В конце концов, он полностью утрачивает свои функции.
Литий-ионные аккумуляторы выполнены так, что их зарядку нужно постоянно контролировать. С этой целью в корпус устанавливается специальная плата, она называется контроллер заряда. Чип на плате производит управление процессом зарядки аккумулятора.
Стандартная зарядка аккумулятора выглядит следующим образом:
- Контроллер в начале процесса заряда подает ток величиной 10% от номинального. В данный момент напряжение поднимается до 2,8 В.
- Затем ток заряда повышается до номинального. В данный период напряжение при постоянном токе растет до 4,2 В.
- В завершении процесса заряда ток падает при постоянном напряжении 4,2 В до момент 100% заряда батареи.
Стадийность может отличаться в виду применения разных контроллеров, что ведет к разной скорости зарядки и соответственно суммарной стоимости аккумулятора. Литий-ионные аккумуляторы могут быть без защиты, то есть контроллер находится в зарядном устройстве, либо со встроенной защитой, то есть контроллер располагается внутри батареи. Могут быть устройства, где плата защиты встроена непосредственно в аккумулятор.
Разновидности и применение
Существуют два форм-фактора литий-ионных аккумуляторов:
- Цилиндрические литий-ионные аккумуляторы.
- Таблеточные литий-ионные аккумуляторы.
Разные подвиды электрохимической литий-ионной системы называются по типу применяемого активного вещества. Объединяет все эти литий-ионные аккумуляторы то, что все они являются герметичными необслуживаемым аккумуляторам.
Можно привести 6 наиболее распространенных типов литий-ионных аккумуляторов:
- Литий-кобальтовый аккумулятор. Он является популярным решением для цифровых камер, ноутбуков и мобильных телефонов в виду высокого показателя удельной энергоемкости. Аккумулятор состоит из катода из оксида кобальта и графитового анода. Недостатки литий-кобальтовых аккумуляторов: ограниченные возможности нагрузки, низкая термическая стабильность и относительно короткий срок службы.
Области применения; мобильная электроника.
- Литий-марганцевый аккумулятор. Катод из кристаллической литий-марганцевой шпинели выделяется трехмерной каркасной структурой. Шпинель обеспечивает низкое сопротивление, однако отличается более умеренной удельной энергоемкостью, чем кобальт.
Области применения; электрические силовые агрегаты, медицинское оборудование, электроинструмент.
- Литий-никель-марганец-кобальт-оксидный аккумулятор. В катоде батареи сочетаются кобальт, марганец и никель. Никель славится высокой удельной энергоемкостью, однако низкой стабильностью. Марганец обеспечивает низкое внутреннее сопротивление, однако приводит к низкой удельной энергоемкости. Сочетание металлов позволяет компенсировать их минусы и задействовать сильные стороны.
Области применения; для частного и промышленного использования (источники бесперебойного питания, системы безопасности, солнечные электростанции, аварийное освещение, телекоммуникации, электромобили, электровелосипеды и так далее).
- Литий-железо-фосфатный аккумулятор. Его основные преимущества: длительный срок службы, высокие показатели силы тока, стойкость к неправильному использованию, повышенная безопасность и хорошая термическая стабильность. Однако у такого аккумулятора небольшая емкость.
Области применения; стационарные и портативные специализированные устройства, где нужны выносливость и высокие токи нагрузки.
- Литий-никель-кобальт-алюминий-оксидный аккумулятор. Его основные преимущества: высокие показатели плотности энергии и энергоемкости, долговечность. Однако показатели безопасности и высокая стоимость ограничивают его применение.
Области применения; электрические силовые агрегаты, промышленность и медицинское оборудование.
- Литий-титанатный аккумулятор. Его основные преимущества: быстрая зарядка, длительный срок службы, широкий температурный диапазон, отличные показатели производительности и безопасности. Это наиболее безопасная литий-ионная аккумуляторная батарея.
Однако у нее высокая стоимость и низкая удельная энергоемкость. На данный момент ведутся разработки по удешевлению производства и увеличению удельной энергоемкости.
Области применения; уличное освещение на солнечных элементах, электрические силовые агрегаты автомобилей (Honda Fit-EV, Mitsubishi i-MiEV), ИБП.
Типичные характеристики
В целом литий-ионные аккумуляторы имеют следующие типичные характеристики:
- Минимальное напряжение — не ниже 2,2-2,5В.
- Максимальное напряжение – не выше 4,25-4,35В.
- Время заряда: 2-4 часа.
- Саморазряд при комнатной температуре – порядка 7 % в год.
- Диапазон рабочих температур, начиная от −20 °C и заканчивая +60 °C.
- Число циклов заряд/разряд до достижения потери 20% емкости составляет 500-1000.
Достоинства и недостатки
К преимуществам можно отнести:
- Высокая энергетическая плотность при сравнении с щелочными аккумуляторами с применением никеля.
- Достаточно высокое напряжение одного аккумуляторного элемента.
- Отсутствие «эффекта памяти», что обеспечивает простую эксплуатацию.
- Значительное число циклов заряда-разряда.
- Длительный срок эксплуатации.
- Широкий температурный диапазон, обеспечивающий неизменные рабочие характеристики.
- Относительная экологическая безопасность.
Среди недостатков можно выделить:
- Умеренный ток разряда.
- Относительно быстрое старение.
- Сравнительно высокая стоимость.
- Невозможность работы без встроенного контроллера.
- Вероятность самовозгорания при высоких нагрузках и при слишком глубоком разряде.
- Конструкция требует существенных доработок, ведь она не доведена до совершенства.
Похожие темы:
Литий-ионный аккумулятор — это… Что такое Литий-ионный аккумулятор?
 Цилиндрические элементы перед сборкой (18650)
Цилиндрические элементы перед сборкой (18650)Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, который широко распространён в современной бытовой электронной технике и находит свое применение в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. Это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, электромобили, цифровые фотоаппараты и видеокамеры. Первый литий-ионный аккумулятор выпустила корпорация Sony в 1991 году.
Характеристики
В зависимости от электро-химической схемы литий-ионные аккумуляторы показывают следующие характеристики:
- Напряжение единичного элемента 3,6 В.
- Максимальное напряжение 4,2 В, минимальное 2,5–3,0 В. Устройства заряда поддерживают напряжение в диапазоне 4,05–4,2 В
- Энергетическая плотность: 110 … 230 Вт*ч/кг
- Внутреннее сопротивление: 5 … 15 мОм/1Ач
- Число циклов заряд/разряд до потери 20 % ёмкости: 1000—5000
- Время быстрого заряда: 15 мин — 1 час
- Саморазряд при комнатной температуре: 3 % в месяц
- Ток нагрузки относительно ёмкости (С):
- постоянный — до 65С, импульсный — до 500С
- наиболее приемлемый: до 1С
- Диапазон рабочих температур: −0 … +60 °C(при отрицательных температурах заряжание батарей невозможен)
Устройство
Литий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделенных пропитанными электролитом пористыми сепараторами. Пакет электродов помещен в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъемникам. Корпус имеет предохранительный клапан, сбрасывающий внутреннее давление при аварийных ситуациях и нарушении условий эксплуатации. Литий-ионные аккумуляторы различаются по типу используемого катодного материала. Переносчиком тока в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решетку других материалов (например, в графит, окислы и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, окислы (LiMO2) и соли (LiMRON) металлов. Первоначально в качестве отрицательных пластин применялся металлический литий, затем — каменноугольный кокс. В дальнейшем стал применяться графит. В качестве положительных пластин до недавнего времени применяли оксиды лития с кобальтом или марганцем, но они все больше вытесняются литий-ферро-фосфатными, которые оказались безопасны, дешевы и нетоксичны и могут быть подвержены утилизации, безопасной для окружающей среды. Литий-ионные аккумуляторы применяются в комплекте с системой контроля и управления — СКУ или BMS (battery management system) и специальным устройством заряда/разряда. В настоящее время в массовом производстве литий-ионных аккумуляторов используются три класса катодных материалов: — кобальтат лития LiCoO2 и твердые растворы на основе изоструктурного ему никелата лития — литий-марганцевая шпинель LiMn2O4 — литий-феррофосфат LiFePO4. Электро-химические схемы литий-ионных аккумуляторов: • литий-кобальтовые LiCoO2 + 6xC → Li1-xCoO2 + xLi+C6 • литий-ферро-фосфатные LiFePO4 + 6xC → Li1-xFePO4 + xLi+C6
Благодаря низкому саморазряду и большому количеству циклов заряда-разряда, Li-ion-аккумуляторы наиболее предпочтительны для применения в альтернативной энергетике. При этом помимо системы BMS (СКУ) они укомплектовываются инверторами (преобразователи напряжения).
Преимущества
- Высокая энергетическая плотность.
- Низкий саморазряд.
- Отсутствие эффекта памяти.
- Не требуют обслуживания.
Недостатки
Аккумуляторы Li-ion первого поколения были подвержены взрывному эффекту. Это объяснялось тем, что в них использовался анод из металлического лития, на котором в процессе многократных циклов зарядки/разрядки возникали пространственные образования (дендриты), приводящие к замыканию электродов и, как следствие, возгоранию или взрыву. Эту проблему удалось окончательно решить заменой материала анода на графит. Подобные процессы происходили и на катодах литий-ионных аккумуляторов на основе оксида кобальта при нарушении условий эксплуатации (перезарядке). Литий-ферро-фосфатные аккумуляторы полностью лишены этих недостатков. Кроме того, все современные литий-ионные аккумуляторы снабжаются встроенной электронной схемой, которая предотвращает перезаряд и перегрев вследствие слишком интенсивного заряда.
Аккумуляторы Li-ion при неконтролируемом разряде могут иметь более короткий жизненный цикл в сравнении с другими типами аккумуляторов. При полном разряде литий-ионные аккумуляторы теряют возможность заряжаться при подключении зарядного напряжения. Эта проблема решаема путем приложения импульса более высокого напряжения, но это отрицательно сказывается на дальнейших характеристиках литий-ионных аккумуляторов. Максимальный срок «жизни» Li-ion аккумулятора достигается при ограничении заряда сверху на уровне 95 % и разряда 15–20 %. Такой режим эксплуатации поддерживается системой контроля и управления BMS (СКУ), которая входит в комплект любого литий-ионного аккумулятора.
Оптимальные условия хранения Li-ion-аккумуляторов достигаются при заряде на уровне 40–70 % от ёмкости аккумулятора и температуре около 5 °C. При этом низкая температура является более важным фактором для малых потерь ёмкости при долговременном хранении.[1] Средний срок хранения (службы) литий-ионного АКБ составляет в среднем 36 месяцев, хотя может колебаться в интервале от 24 до 60 месяцев.
Потеря ёмкости при хранении[1]:
| температура | с 40 % зарядом | со 100 % зарядом |
|---|---|---|
| 0 ⁰C | 2 % за год | 6 % за год |
| 25 ⁰C | 4 % за год | 20 % за год |
| 40 ⁰C | 15 % за год | 35 % за год |
| 60 ⁰C | 25 % за год | 40 % за три месяца |
Согласно всем действующим регламентам хранения и эксплуатации литий-ионных аккумуляторов, для обеспечения длительного хранения необходимо подзаряжать их до уровня 70 % ёмкости 1 раз в 6–9 месяцев.
См. также
Примечания
Литература
- Хрусталёв Д. А. Аккумуляторы. М: Изумруд, 2003.
- Юрий Филипповский Мобильное питание. Часть 2. (RU). КомпьютерраLab (26 мая 2009). — Подробная статья о Li-ion аккумуляторах.. Проверено 26 мая 2009.
Ссылки
 |
Литий-ионный аккумулятор Википедия
 Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]
Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, который широко распространён в современной бытовой электронной технике и находит своё применение в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. Это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты, видеокамеры и электромобили.
История[ | ]
Основной источник: [2]Впервые принципиальная возможность создания литиевых аккумуляторов на основе способности дисульфид титана или дисульфид молибдена включать в себя ионы лития при разряде аккумулятора и экстрагировать их при зарядке была показана в 1970 году Майклом Стэнли Уиттингемом. Существенным недостатком таких аккумуляторов являлось низкое напряжение — 2,3 В и высокая пожароопасность вследствие образования дендритов металлического лития, замыкающих электроды.
Позднее Дж. Гуденафом были синтезированы другие материалы для катода литиевого аккумулятора — кобальтит лития LixCoO2(1980 год), феррофосфат лития LiFePO4 (1996 год). Преимуществом таких аккумуляторов является более высокое напряжение — около 4 В.
Современный вариант литий-ионного аккумулятора с анодом из графита и катодом из кобальтита лития изобрёл в 1991 году Акира Ёсино. Первый литий-ионный аккумулятор по его патенту выпустила корпорация Sony в 1991 году.
В настоящее время ведутся исследования по поиску материалов на основе кремния и фосфора, обеспечивающих повышенную емкость интеркалирования ионов лития и по замене ионов лития на ионы натрия.
Нобелевская премия по химии 2019 года была вручена троим перечисленным выше учёным «За создание литий-ионных батарей».
Характеристики[ | ]
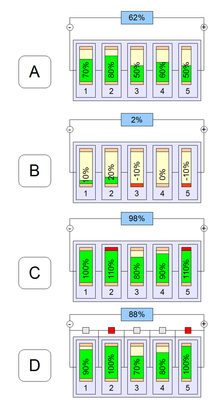 При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во вр
При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во врЛитий-ионным аккумуляторам исполнилось 25 лет. Почему за четверть века их активные материалы так мало изменились
В этом году исполнилось 25 лет с момента выхода в продажу первых литий-ионных аккумуляторов, которые изготовила корпорация Sony в 1991 году. За четверть века их ёмкость практически удвоилась с 110 Втч/кг до 200 Втч/кг, но, несмотря на такой колоссальный прогресс и на многочисленные исследования электрохимических механизмов, сегодня химические процессы и материалы внутри литий-ионных аккумуляторов практически те же, что и 25 лет назад. В этой статье будет рассказано, как шло становление и развитие данной технологии, а также с какими трудностями сталкиваются сегодня разработчики новых материалов.
Источник
1. Развитие технологии: 1980-2000
Ещё в 70х годах учёными было установлено, что существуют материалы под названием халькогениды (например, MoS2), которые способны вступать в обратимую реакцию с ионами лития, встраивая их в свою слоистую кристаллическую структуру. Тут же был предложен первый прототип литий-ионного аккумулятора, состоящий из халькогенидов на катоде и металлического лития на аноде. Теоретически, во время разрядки, ионы лития, «высвобождаемые» анодом, должны встраиваться в слоистую структуру MoS2, а при зарядке оседать обратно на аноде, возвращаясь в исходное состояние.
Но первые попытки создания таких аккумуляторов были неудачны, так как при зарядке ионы лития никак не хотели обратно превращаться в ровную пластину металлического лития, а оседали на аноде как попало, приводя к росту дендритов (цепочек металлического лития), короткому замыканию, и взрыву аккумуляторов. За этим следовал этап детального изучения реакции интеркаляции (встраивания лития в кристаллы с особой структурой), что позволило заменить металлический литий на углерод: сначала на кокс, а потом и на графит, который используется до сих пор и тоже имеет слоистую структуру, способную встраивать ионы лития.
Литий-ионный аккумулятор с анодом из металлического лития (а) и анодом из слоистого материала (b). Источник: nature.com
Начав использовать углеродные материалы на аноде, учёные поняли, что природа сделала человечеству большой подарок. На графите, при самой первой зарядке, образуется защитный слой из разложившегося электролита, названный SEI (Solid Electrolyte Interface). Точный механизм его формирования и состав еще не до конца изучены, но известно, что без этого уникального пассивирующего слоя электролит продолжал бы разлагаться на аноде, электрод бы разрушался, и аккумулятор приходил бы в негодность. Так появился первый работающий анод на основе углеродных материалов, который был выпущен в продажу в составе литий-ионных аккумуляторов в 90-х годах.
Одновременно с анодом видоизменялся и катод: выяснилось, что слоистой структурой, способной встраивать ионы лития, обладают не только халькогениды, но и некоторые оксиды переходных металлов, например LiMO2 ( M = Ni, Co, Mn), которые не только более стабильны химически, но и позволяют создавать ячейки с более высоким напряжением. И именно LiCoO2 был использован в катоде первого коммерческого прототипа аккумуляторов.
Источник: www.iycr2014.org
2. Новые реакции и мода на наноматериалы: 2000-2010
В 2000х в науке начался бум наноматериалов. Естественно, прогресс в нанотехнологиях не обошёл стороной и литий-ионные аккумуляторы. И именно благодаря им учёные сделали совершенно, казалось бы, непригодный для данной технологии материал, LiFePO4, одним из лидеров по использованию в катодах электромобильных аккумуляторов.
А дело всё в том, что обычные, объёмные частицы железофосфата очень плохо проводят ионы, да и электронная проводимость у них очень низкая. Но засчёт наноструктурирования литию не надо продвигаться на большие расстояния чтобы встроиться в нанокристалл, поэтому интеркаляция проходит гораздо быстрее, а покрытие нанокристаллов тонкой углеродной плёнкой улучшает их проводимость. В результате в продажу вышел не только менее опасный материал, который не выделяет кислород при высокой температуре (как оксиды), но и материал имеющий способность работать на более высоких токах. Именно поэтому такой катодный материал предпочитают производители автомобилей, несмотря на чуть меньшую ёмкость чем у LiCoO2.
В то же время учёные искали новые материалы, взаимодействующие с литием. И, как выяснилось, интеркаляция, или встраивание лития в кристалл- не единственный вариант реакции на электродах в литий-ионных аккумуляторах. Так, например, некоторые элементы, а именно Si, Sn, Sb, и т.д., формируют «сплав» с литием, если использовать их в аноде. Ёмкость такого электрода в 10 раз превышает ёмкость графита, но есть одно «но»: такой электрод во время формирования сплава сильно увеличивается в объёме, что приводит к его быстрому растрескиванию и приходу в негодность. И для того, чтобы уменьшить механическое напряжение электрода при таком увеличении объёма, элемент (например, кремний) предлагают использовать в виде наночастиц, заключённых в углеродную матрицу, которая «амортизирует» изменения объёма.
Источник: chargedevs.com
Но изменения объёма- не единственная проблема материалов, образующих сплавы, и препятствующая их широкому применению. Как было сказано выше, на графите образуется «подарок природы»- SEI. А на материалах, образующих сплав, электролит разлагается непрерывно и повышает сопротивление электрода. Но тем не менее, периодически мы видим в новостях, что в некоторых аккумуляторах используется «кремниевый анод». Да, кремний в нём действительно используется, но в очень маленьких количествах и смешанный с графитом, чтобы «побочные эффекты» не слишком были заметны. Естественно, когда количество кремния в аноде составляет всего несколько процентов, а остальное- графит, значительного увеличения ёмкости не получится.
И если тема анодов, образующих сплавы, сейчас развивается, то некоторые исследования, начатые в прошлом десятилетии, очень быстро заходили в тупик. Это касается, например, так называемых реакций конверсии. В этой реакции некоторые соединения металлов (оксиды, нитриды, сульфиды и т.д.) взаимодействуют с литием, превращаясь в металл, смешанный с соединениями лития:
MaXb ==> aM + bLinX
M: металл
X: O, N, C, S…
И, как можно себе представить, с материалом во время такой реакции происходят такие изменения, которые даже кремнию не снились. Например, оксид кобальта превращается в наночастицы металлического кобальта, заключённые в матрицу из оксидов лития:
Источник: J. Phys. Chem C 117, 14518 (2013)
Естественно, такая реакция плохо обратима, к тому же между зарядкой и разрядкой большая разница напряжений, что делает такие материалы бесполезными в применении.
Интересно заметить, что когда эта реакция была открыта, в научных журналах стали публиковаться сотни статей на эту тему. Но тут хочестся процитировать профессора Тараскона из Коллеж де Франс, который сказал, что «реакции конверсии были настоящим полем экспериментов для исследования материалов с наноархитектурой, что давало учёным возможность делать красивые картинки с помощью просвечивающего электронного микроскопа и публиковаться в известных журналах, несмотря на абсолютную практическую бесполезность этих материалов».
В общем, если подвести итог, то, несмотря на то, что в последнее десятилетие были синтезированы сотни новых материалов для электродов, в аккумуляторах до сих под используются практически те же материалы, что и 25 лет назад. Почему же так получилось?
3. Настоящее время: главные трудности в разработке новых аккумуляторов.
Как можно заметить, в вышеописанном экскурсе в историю литий-ионных аккумуляторов ни слова не было сказано об ещё одном, важнейшем элементе: электролите. И на это есть причина: электролит за 25 лет практически не изменился и работающих альтернатив предложено не было. Сегодня, как и в 90-е годы, в виде электролита используются соли лития (в основном LiPF6) в органическом растворе карбонатов (этилен карбонат (EC) + диметил карбонат (DMC)). А ведь именно из-за электролита прогресс в увеличении ёмкости аккумуляторов в последние годы замедлился.
Приведу конкретный пример: на сегодняшний день существуют материалы для электродов, которые могли бы значительно увеличить ёмкости литий-ионных аккумуляторов. К ним относится, например, LiNi0.5Mn1.5О4, который позволил бы сделать аккумулятор с напряжением ячейки в 5 Вольт. Но увы, в таких диапазонах напряжения электролит на основе карбонатов становится нестабильным. Или ещё один пример: как было сказано выше, сегодня, чтобы использовать значительные количества кремния (или других металлов, образующих сплавы с литием) в аноде, надо решить одну из главных проблем: образование пассивирующего слоя (SEI), который бы препятствовал непрерывному разложению электролита и разрушению электрода, а для этого надо разработать принципиально новый состав электролита. Но почему же так сложно найти альтернативу существующему составу, ведь солей лития полно, да и органических растворителей достаточно?!
А трудность заключаетя в том, что электролит должен одновременно обладать следующими характеристиками:
- Он должен быть химически стабилен во время работы аккумулятора, а точнее, он должен быть стойким по отношению к окисляющему катоду и восстанавливающему аноду. Это значит, что попытки увеличить энергоёмкость аккумулятора, то есть, использование ещё более окисляющих катодов и восстанавливающих анодов, не должны приводить к разложению электролита.
- Электролит также должен обладать хорошей ионной проводимостью и низкой вязкостью для транспортировки ионов лития в широком диапазоне температур. Именно для этого в вязкий этилен карбонат добавляют DMC начиная с 1994 года.
- Соли лития должны хорошо растворяться в органическом растворителе.
- Электролит должен формировать эффективный пассивирующий слой. У этилен карбоната это прекрасно получается, в то время как другие растворители, например пропилен карбонат, который был изначально опробован Sony, разрушает структуру анода, так как встраивается в него параллельно с литием.
Естественно, создать электролит, обладающий сразу всеми данными характеристиками очень сложно, но учёные не теряют надежды. Во-первых, ведутся активные поиски новых растворителей, которые бы работали в более широком диапазоне напряжений, чем карбонаты, что позволило бы использовать новые материалы и увеличить энергоёмкость аккумуляторов. В разработке находятся несколько видов органических растворителей: эстеры, сульфоны, сульфоксиды и т.д. Но увы, увеличивая устойчивость электролитов к окислению, уменьшается их устойчивость к восстановлению, и в результате напряжение ячейки никак не меняется. К тому же, не все растворители формируют на аноде защитный пассивирующий слой. Именно поэтому зачастую в электролит подмешивают специальные добавки, например, винилен карбонат, которые искусственно способствуют формированию этого слоя.
Параллельно с улучшением уже существующих технологий, учёные работают и над принципиально новыми решениями. И решения эти можно свести к попытке избавиться от жидкого растворителя на основе карбонатов. К таким технологиям относятся, к примеру, ионные жидкости. Ионные жидкости-это, по сути, расплавленные соли, у которых очень низкая температура плавления, и некоторые из них даже при комнатной температуре остаются жидкими. А всё из-за того, что у этих солей особенная, стерически затрудненная структура, которая усложнят кристаллизацию.
Источник: www.eurare.eu
Казалось бы, отличная идея- полностью исключить растворитель, который легко воспламеняется и вступает в паразитические реакции с литием. Но на деле, исключение растворителя создаёт на данный момент больше проблем, чем решает. Во-первых, в обычных электролитах часть растворителя «приносит себя в жертву» для построения защитного слоя на поверхности электродов. А компоненты ионных жидкостей с этой задачей пока не справляются (анионы, кстати, тоже могут вступать в паразитические реакции с электродами, как и растворители). Во-вторых, очень сложно подобрать ионную жидкость с правильным анионом, так как они влияют не только на температуру плавления соли, но и на электрохимическую стабильность. И увы, самые стабильные анионы формируют соли, которые плавятся при высоких температурах, и, соответственно, наоборот.
Ещё один способ избавиться от растворителя на основе карбонатов- использование твёрдых полимеров (например, полиэфиров), проводящих литий, которые, во-первых, минимизировали бы риск утечки электролита наружу, а также препятствовали бы росту дендритов при использовании металлического лития на аноде. Но главная сложность, стоящая перед создателями полимерных электролитов- их очень низкая ионная проводимость, так как ионам лития сложно передвигаться в такой вязкой среде. Это, конечно, сильно ограничивает мощность аккумуляторов. А понижения вязкости влечёт за собой прорастание дендритов.
Источник: www.polito.it
Также исследователи изучают твёрдые неорганические вещества, проводящие литий с помощью дефектов в кристалле, и пытаются применить их в виде электролитов для литий-ионных аккумуляторов. Такая система на первый взгляд идеальна: химическая и электрохимическая стабильность, устойчивость с повышению температуры и механическая прочность. Но у этих материалов, опять же, очень низкая ионная проводимость, и использовать их целесеобразно только в виде тонких плёнок. К тому же, работают такие материалы лучше всего при высокой температуре. И последнее, с твёрдым электролитом очень сложно создать механический контакт между электолитом и электродами (в этой области жидким электролитам нет равных).
4. Заключение.
С момента выхода в продажу литий-ионных аккумуляторов, попытки увеличить их ёмкость не прекращаются. Но в последние годы увеличение ёмкости замедлилось, несмотря на сотни новых предложенных материалов для электродов. А дело всё в том, что большинство этих новых материалов «лежат на полке» и ждут, пока не появится новый, подходящий им электролит. А разработка новых электролитов- на мой взгляд гораздо более сложная задача, чем разработка новых электродов, так как нужно учитывать не только электрохимические свойства самого электролита, но и все его взаимодействия с электродами. В общем, читая новости типа «разработан новый супер-электрод…» надо проверять, как такой электрод взаимодействует с электролитом, и есть ли для такого электрода подходящий электролит в принципе.
Источники:
Electrochem. Soc. Interface Fall 2016 volume 25, issue 3, 79-83
Chem. Rev., 2014, 114 (23), pp 11503–11618
Электрический аккумулятор — Википедия
 Зарядное устройство «Duracell», для заряжания как аккумуляторов типоразмеров AA и AAA (видны пружинные прижимы для них), так и аккумуляторные батареи типа «Крона». Во время зарядки горят индикаторы
Зарядное устройство «Duracell», для заряжания как аккумуляторов типоразмеров AA и AAA (видны пружинные прижимы для них), так и аккумуляторные батареи типа «Крона». Во время зарядки горят индикаторыЭлектри́ческий аккумуля́тор — химический источник тока, источник ЭДС многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования, а также для обеспечения резервных источников энергии в медицине, производстве, транспорте и в других сферах.
Термин «аккумулятор» используется для обозначения отдельного элемента: например, аккумулятор, аккумуляторная банка, аккумуляторная ячейка. Но, разговорной речи на бытовом уровне может также применяться в отношении нескольких отдельных элементов, соединённых последовательно (для увеличения напряжения) или параллельно (для увеличения силы тока) друг с другом, то есть для обозначения аккумуляторной батареи.
Первый прообраз аккумулятора, который, в отличие от батареи Алессандро Вольты, можно было многократно заряжать, был создан в 1803 году Иоганном Вильгельмом Риттером. Его аккумуляторная батарея представляла собой столб из пятидесяти медных кружочков, между которыми было проложено влажное сукно. После пропускания через данное устройство тока от вольтова столба оно само начинало вести себя как источник электричества[1].

Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде. Несколько аккумуляторов, объединённых в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
Свинцово-кислотный аккумулятор[править | править код]
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в растворе серной кислоты.
Химическая реакция (слева направо — разряд, справа налево — заряд):
- Pb+SO42−−2e−⇆PbSO4{\displaystyle Pb+SO_{4}^{2-}-2e^{-}\leftrightarrows PbSO_{4}}
- PbO2+SO42−+4H++2e−⇆PbSO4+2h3O{\displaystyle PbO_{2}+SO_{4}^{2-}+4H^{+}+2e^{-}\leftrightarrows PbSO_{4}+2H_{2}O}
Литий-ионный аккумулятор[править | править код]
Литий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделённых пропитанными электролитом пористыми сепараторами. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который внедряется (интеркалируется) в кристаллическую решетку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи (например: в графит с образованием LiC6, оксиды (LiMO2) и соли (LiMRON) металла).
Алюминий-ионный аккумулятор состоит из металлического алюминиевого анода, катода из графита в виде пены и жидкого ионного невоспламеняющегося электролита. Батарея работает по принципу электрохимического осаждения: происходит растворение алюминия на аноде, далее в среде жидкого электролита анионы хлоралюмината интеркалируют в графит. Количество возможных перезарядок батареи — более 7,5 тыс. циклов без потери мощности[2][3].
Ёмкость аккумулятора[править | править код]
За ёмкость аккумулятора чаще всего принимают количество электричества равное 1 Кл, при силе тока 1 А в течение 1 с, (при переводе времени в часы получаем 1 А*ч=3600 Кл). Однако принимают, а не измеряют. Существует распространенное заблуждение, что ёмкость аккумулятора измеряется в А*ч, это не совсем так, т. к. в 1 А*с=1 Кл или 1 А*ч=3600 Кл измеряется количество электричества или электрический заряд; по формуле Q= I*t, где Q -количество электричества или электрический заряд, I — сила тока, t — время протекания электрического тока. Например, обозначение «12 В на 55 А*ч» означает, что аккумулятор выдаёт количество электричества 198 кКл (килокулон) по какому-либо контуру, при токе разряда 55 А за 1 ч (3600 с) до порогового напряжения 10,8 В. Расчёт показывает, что при токе разряда в 255 А аккумулятор разрядится за 12,9 минут. Как видно 55 А*ч — это не ёмкость (электрическая ёмкость измеряется в Фарадах, 1 Ф= 1 Кл/В). Поэтому на аккумуляторе написано количество электричества Q, которое он выдаёт при определённом токе разряда и определённом времени его прохождения.[источник не указан 1085 дней]
Плотность энергии[править | править код]
Плотность энергии — количество энергии на единицу объёма или единицу веса аккумулятора (см. ст. Плотность энергии).
Саморазряд[править | править код]
Саморазряд — это потеря аккумулятором заряда после полной зарядки при отсутствии нагрузки. Саморазряд проявляется по-разному у разных типов аккумуляторов, но всегда максимален в первые часы после заряда, а после — замедляется.
Для Ni-Cd аккумуляторов считают допустимым не более 10 % саморазряда за первые 24 часа после проведения зарядки. Для Ni-MH саморазряд чуть меньше. У Li-ion он пренебрежимо мал и значительно себя проявляет только в течение нескольких месяцев.
В свинцово-кислотных герметичных аккумуляторах саморазряд составляет около 40 % за 1 год хранения при 20°С, 15 % — при 5°С. Если температуры хранения более высокие, то саморазряд возрастает: батареи при 40°С теряют ёмкости 40 % всего за 4-5 месяцев.
Температурный режим[править | править код]
Следует беречь аккумуляторы от огня и воды, чрезмерного нагревания и охлаждения, резких перепадов температур.
Не следует использовать аккумуляторы при температурах выше +50°С и ниже −25°С. При эксплуатации аккумулятора в условиях «холодной зимы» рекомендуется его снимать и хранить в тёплом помещении. Нарушение температурного режима может привести к сокращению срока службы или потере работоспособности.
Тип аккумулятора[править | править код]
Тип аккумулятора определяется используемыми материалами. Различают следующие:
- Cn-Po — Графен-полимерный аккумулятор.
- La-Ft — лантан-фторидный аккумулятор
- Li-Ion — литий-ионный аккумулятор (3,2-4,2 V), общее обозначение для всех литиевых аккумуляторов
- Li-Co — литий-кобальтовый аккумулятор, (3,6 V), на базе LiCoO2, технология в процессе освоения
- Li-Po — литий-полимерный аккумулятор (3,7 V), полимер в качестве электролита
- Li-Ft — литий-фторный аккумулятор
- Li-Mn — литий-марганцевый аккумулятор (3,6 V) на базе LiMn2O4
- LiFeS — литий-железно-сульфидный аккумулятор (1,35 V)[источник не указан 684 дня]
- LiFeP или LFP — Литий-железно-фосфатный аккумулятор (3,3 V) на базе LiFePO4
- LiFeYPO4 — литий-железо-иттрий-фосфатный (Добавка иттрия для улучшения свойств)
- Li-Ti — литий-титанатный аккумулятор (3,2 V) на базе Li4Ti5О12
- Li-Cl — литий-хлорный аккумулятор (3,99 V)
- Li-S — литий-серный аккумулятор (2,2 V)
- LMPo — литий-металл-полимерный аккумулятор
- Fe-air — железо-воздушный аккумулятор
- Na/NiCl — никель-солевой аккумулятор (2,58 V)
- Na-S — натрий-серный аккумулятор, (2 V), высокотемпературный аккумулятор
- Ni-Cd — никель-кадмиевый аккумулятор (1,2 V)
- Ni-Fe — железо-никелевый аккумулятор (1,2-1,9 V)
- Ni-H2 — никель-водородный аккумулятор (1,5 V)
- Ni-MH — никель-металл-гидридный аккумулятор (1,2 V)
- Ni-Zn — никель-цинковый аккумулятор (1,65 V)
- Pb — свинцово-кислотный аккумулятор (2 V)
- Pb-H — свинцово-водородный аккумулятор
- Ag-Zn — серебряно-цинковый аккумулятор (1,85 V)
- Ag-Cd — серебряно-кадмиевый аккумулятор (1,6 V)
- Zn-Br — цинк-бромный аккумулятор (1,8 V)
- Zn-air — цинк-воздушный аккумулятор
- Zn-Cl — цинк-хлорный аккумулятор
- RAM (Rechargeable Alkaline Manganese) — перезаряжаемая разновидность марганцево-цинкового щелочного гальванического элемента (1,5 V)[источник не указан 1012 дней]
- Ванадиевый аккумулятор (1,41 V)[источник не указан 1012 дней]
- Алюминиево-графитный аккумулятор (2 V)[источник не указан 1012 дней]
- Алюминиево-ионный аккумулятор (2 V)[4]
Электрические и эксплуатационные характеристики аккумулятора зависят от материала электродов и состава электролита. Сейчас наиболее распространены следующие аккумуляторы:
| Тип | ЭДС (В) | Область применения |
|---|---|---|
| свинцово-кислотные Pb | 2,1 | троллейбусы, трамваи, воздушные суда, автомобили, мотоциклы, электропогрузчики, штабелеры, электротягачи, аварийное электроснабжение, источники бесперебойного питания |
| никель-кадмиевые Ni-Cd | 1,2 | замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы, воздушные суда |
| никель-металл-гидридные Ni-MH | 1,2 | замена стандартного гальванического элемента, электромобили |
| литий-ионные Li‑ion | 3,7 | мобильные устройства, строительные электроинструменты, электромобили |
| литий-полимерные Li‑pol | 3,7 | мобильные устройства, электромобили |
| никель-цинковые Ni-Zn | 1,6 | замена стандартного гальванического элемента |
Форм-факторы[править | править код]
Литий-ионный аккумулятор форм-фактора 18650Внешний аккумулятор[править | править код]
Внешний аккумулятор (аккумуляторная батарея) (англ. power bank) — устройство для многократной подзарядки мобильного устройства (телефона, смартфона, планшетного компьютера) при отсутствии источника переменного тока (электросети).
Причиной появления этих устройств стало то, что при активном использовании современных смартфонов и планшетов заряда их аккумуляторов хватает на сравнительно короткое время — полдня или день. Для их зарядки в полевых условиях и были разработаны портативные аккумуляторы[5][6]. Типичный вес таких устройств — от нескольких сотен грамм, ёмкость от нескольких тысяч мА*ч до 10-20 А*ч[7]. С их помощью можно зарядить телефон 2-3 раза. Чаще всего они предоставляют для подключения порт USB. Некоторые из них имеют разъёмы или переходники для популярных разъёмов мобильных телефонов. Внешние аккумуляторы больших ёмкостей могут иметь переходники для зарядки ноутбуков. Иногда на внешних аккумуляторах имеется индикатор заряда или встроенный светодиодный фонарик.
В большинстве случаев возможность систематического использования аккумуляторов есть только в портативных устройствах радиосвязи и иной цифровой технике, где используются литий-ионные аккумуляторы и система контроля заряда-разряда встроена в устройство. В бюджетном сегменте «простые» никель-металл-гидридные и никель-кадмиевые аккумуляторы используются в качестве бюджетной замены щелочных элементов питания (батареек). В качестве источника тока для бюджетного аккумуляторного электроинструмента используются никель-кадмиевые аккумуляторы.
Если в первом случае обычно есть возможность выбирать между бюджетным устройством «стандартного» заряда и зарядным устройством с контролем заряда (капельный заряд, импульсный заряд, ускоренный заряд с контролем напряжения и т. д.), то во втором случае изделие комплектуется, как правило, с трансформаторным источником питания для зарядки постоянным током, что при несоблюдении технических условий эксплуатации аккумулятора снижает срок его службы.
По мере исчерпания химической энергии напряжение и ток падают, аккумулятор перестаёт действовать. Зарядить аккумулятор (батарею аккумуляторов) можно от любого источника постоянного тока с бо́льшим напряжением при ограничении тока. Наиболее распространённым считается зарядный ток (в амперах), пропорциональный 1/10 условной номинальной ёмкости аккумулятора (в ампер⋅часах).
Однако, основываясь на техническом описании, распространяемом изготовителями широко применяемых электрических аккумуляторов (NiMH, NiCd), можно сделать предположение о том, что данный режим заряда, обычно именуемый стандартным, рассчитывается исходя из продолжительности восьмичасового рабочего дня, когда разряженный в конце рабочего дня аккумулятор подключается к сетевому зарядному устройству до начала нового рабочего дня. Применение такого режима заряда для этих типов аккумуляторов при систематическом использовании позволяет соблюсти качественно-стоимостной баланс эксплуатации изделия. Таким образом, с подачи изготовителя данный режим можно применять только для никель-кадмиевых и никель-металл-гидридных аккумуляторов.
Многие типы аккумуляторов имеют различные ограничения, которые необходимо учитывать при зарядке и последующей эксплуатации, например NiMH-аккумуляторы чувствительны к перезаряду, литиевые — к переразряду, напряжению и температуре. NiCd- и NiMH-аккумуляторы имеют так называемый эффект памяти, заключающийся в снижении ёмкости в случае, когда зарядка осуществляется при не полностью разряженном аккумуляторе. Также эти типы аккумуляторов обладают заметным саморазрядом, то есть они постепенно теряют заряд, не будучи подключенными к нагрузке. Для борьбы с этим эффектом может применяться капельная подзарядка.
Методы заряда аккумуляторов[править | править код]
Для заряда аккумуляторов применяется несколько методов; как правило, метод заряда зависит от типа аккумулятора[8].
- Медленный заряд постоянным током
Заряд постоянным током, пропорциональным 0,1-0,2 условной номинальной ёмкости Q в течение примерно 15-7 часов соответственно.
Самый длительный и безопасный метод заряда. Подходит для большинства типов аккумуляторов.
- Быстрый заряд
Заряд постоянным током, пропорциональным 1/3 Q в течение примерно 3—5 часов.
- Ускоренный или «дельта-V» заряд
Заряд с начальным током заряда, пропорциональным величине условной номинальной ёмкости аккумулятора, при котором постоянно измеряется напряжение аккумулятора и заряд заканчивается после того, как аккумулятор полностью заряжен. Время заряда — примерно час-полтора. Возможен разогрев аккумулятора и даже его разрушение.
- Реверсивный заряд
Выполняется чередованием длинных импульсов заряда с короткими импульсами разряда. Реверсивный метод наиболее полезен для заряда NiCd и NiMH аккумуляторов, для которых характерен т. н. «эффект памяти».



