Тема 2.2. Химический состав клетки.
1. Дайте определения понятий.
Клетка – элементарная единица живого, обладающая всеми признаками организма: способностью к размножению, росту, обмену веществ и энергией с окружающей средой, раздражимостью, постоянством химического сотсава.
Макроэлементы – элементы, количество которых в клетке составляет до 0.001% от массы тела. Примеры – кислород, углерод, азот, фосфор, водород, сера, железо, натрий, кальций и др.
Микроэлементы – элементы, количество которых в клетке составляет от 0.001% до 0.000001% от массы тела. Примеры – бор, медь, кобальт, цинк, йод и др.
Ультрамикроэлементы – элементы, содержание которых в клетке не превышает 0.000001% от массы тела. Примеры – золото, ртуть, цезий, селен и др.
2. Составьте схему «Вещества клетки».
3. О чем говорит научный факт сходства элементарного химического состава живой и неживой природы?
Это указывает на общность живой и неживой природы.
Неорганические вещества. Роль воды и минеральных веществ в жизнедеятельности клетки.
1. Дайте определения понятий.
Неорганические вещества – это вода, минеральные соли, кислоты, анионы и катионы, присутствующие как в живых, так и в неживых организмах.
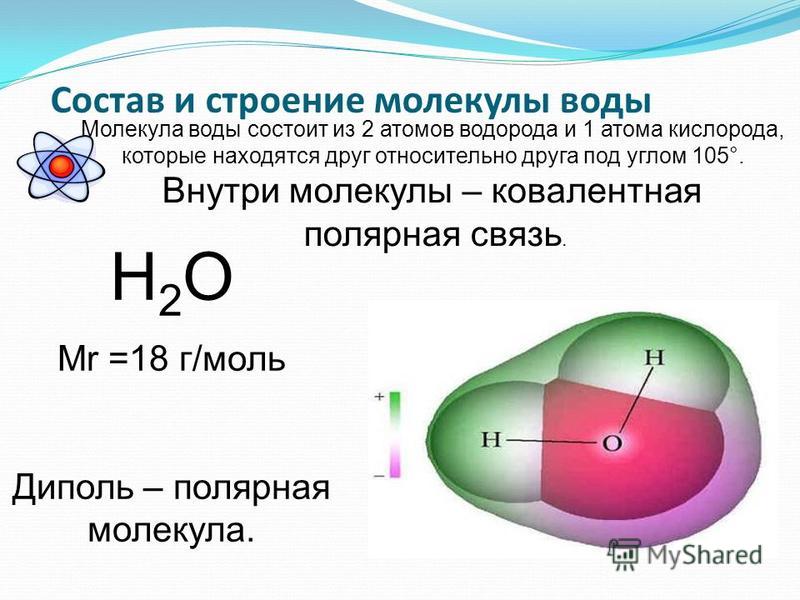
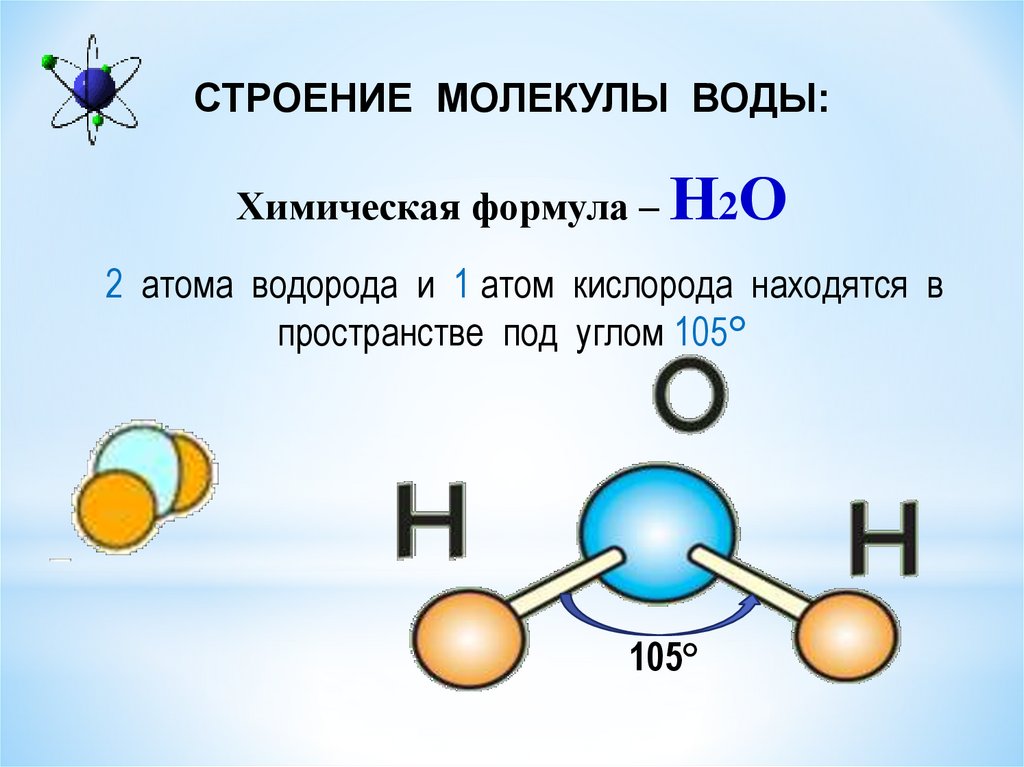
Вода – одно из самых распространенных неорганических веществ в природе, молекула которого состоит из двух атомов водорода и одного атом кислорода.
2. Нарисуйте схему «Строение воды».
3. Какие особенности строения молекул воды придают ей уникальные свойства, без которых невозможна жизнь?
Структура молекулы воды образована двумя атомами водорода и одним атомом кислорода, которые образуют диполь, то есть вода имеет две полярности «+»и»-«.Это способствует ее проницаемости через стенки мембраны, способностью растворять химические вещества. Кроме того, диполи воды связываются водородными связями друг с другом, что обеспечивает ее способность быть в различных агрегатных состояниях, а также — растворять или не растворять различные вещества.

4. Заполните таблицу «Роль воды и минеральных веществ в клетке».
5. Каково значение относительного постоянства внутренней среды клетки в обеспечении процессов ее жизнедеятельности?
Постоянство внутренней среды клетки называется гомеостазом. Нарушение гомеостаза влечёт к повреждению клетки или к её смерти, в клетке постоянно происходит пластический обмен и энергетический обмен, это две составляющие метаболизма, и нарушение этого процесса ведёт к повреждению или к гибели всего организма.
6. В чем состоит назначение буферных систем живых организмов и каков принцип их функционирования?
Буферные системы поддерживают определенное значение рН (показатель кислотности) среды в биологических жидкостях. Принцип функционирования заключается в том, что рН среды зависит от концентрации протонов в этой среде (Н+). Буферная система способна поглощать или отдавать протоны в зависимости от их поступления в среду извне или, напротив, удаления из среды, при этом рН не будет изменяться.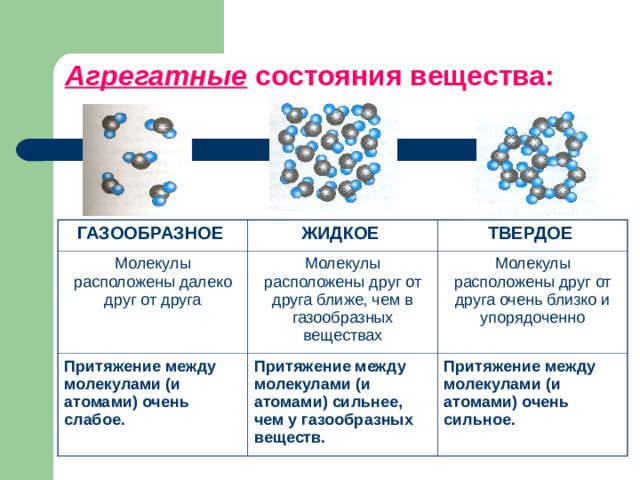
Примеры буферных систем:
карбонатно-гидрокарбонатная (смесь Na2СО3 и NaHCO3)
фосфатная (смесь K2HPO4 и Kh3PO4).
Органические вещества. Роль углеводов, липидов и белков в жизнедеятельности клетки.
1. Дайте определения понятий.
Органические вещества – это вещества, в состав которых обязательно входит углерод; они входят в состав живых организмов и образуются только при их участии.
Белки – высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Липиды – обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот, сложных — из спирта, высокомолекулярных жирных кислот и других компонентов.
Углеводы – это органические вещества, в своем составе имеющие карбонильную и несколько гидроксильных групп и иначе называемые сахарами.
2. Впишите в таблицу недостающую информацию «Строение и функции органических веществ клетки».
3. Что понимают под денатурацией белка?
Денатурация белка – это утрата белком своей природной структуры.
Нуклеиновые кислоты, АТФ и другие органические соединения клетки.
1. Дайте определения понятий.
Нуклеиновые кислоты – это биополимеры, состоящие из мономеров – нуклеотидов.
Нуклеотид – это мономер нуклеиновой кислоты, который состоит из фосфатной группы, пятиуглеродного сахара (пентозы) и азотистого основания.
Макроэргическая связь – это связь между остатками фосфорной кислоты в АТФ.

Комплементарность – это пространственное взаимное соответствие нуклеотидов.
2. Докажите, что нуклеиновые кислоты являются биополимерами.
Нуклеиновые кислоты состоят из большого количества повторяющихся нуклеотидов и имеют массу 10.000 до нескольких миллионов углеродных единиц.
3. Охарактеризуйте особенности строения молекулы нуклеотида.
Нуклеотид представляет собой соединение из трех компонентов: остатка фосфорной кислоты, пятиуглеродного сахара (рибозы), и одного из азотистых соединений (аденин, гуанин, цитозин, тимин или урацил).
4. Какое строение имеет молекула ДНК?
ДНК – двойная спираль, состоящая из множества нуклеотидов, которые последовательно соединяются между собой за счет ковалентных связей между дезоксирибозой одного и остатком фосфорной кислоты другого нуклеотида. Азотистые основания, которые располагаются по одну сторону от остова одной цепи, связаны Н-связями с азотистыми основаниями второй цепи по принципу комплементарности.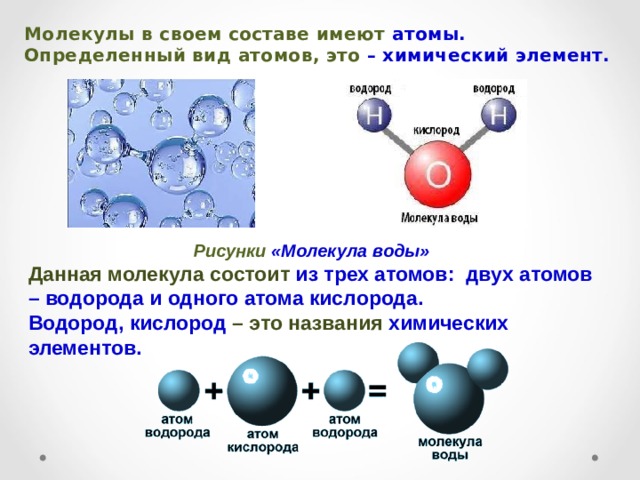
5. Применив принцип комплементарности, постройте вторую цепочку ДНК.
Т-А-Т-Ц-А-Г-А-Ц-Ц-Т-А-Ц
А-Т-А-Г-Т-Ц-Т-Г-Г-А-Т-Г.
6. Каковы основные функции ДНК в клетке?
При помощи четырех типов нуклеотидов в ДНК записана вся важная информация в клетке об организме, которая передается последующим поколениям.
7. Чем молекула РНК отличается от молекулы ДНК?
РНК представляет собой одинарную цепь меньшего, чем ДНК, размера. В нуклеотидах находится сахар рибоза, а не дезоксирибоза, как в ДНК. Азотистым основанием, вместо тимина, является урацил.
8. Что общего в строении молекул ДНК и РНК?
И РНК, и ДНК являются биополимерами, состоящими из нуклеотидов. В нуклеотидах общим в строении является наличие остатка фосфорной кислоты и оснований аденина, гуанина, цитозина.
9. Заполните таблицу «Типы РНК и их функции в клетке».
10. Что такое АТФ? Какова его роль в клетке?
Что такое АТФ? Какова его роль в клетке?
АТФ – аденозинтрифосфат, макроэргическое соединение. Его функции – универсальный хранитель и переносчик энергии в клетке.
11. Каково строение молекулы АТФ?
АТФ состоит из трех остатков фосфорной кислоты, рибозы и аденина.
12. Что представляют собой витамины? На какие две большие группы их разделяют?
Витамины – биологически активные органические соединения, играющие важную роль в процессах обмена веществ. Их разделяют на водорастворимые (С, В1, В2 и др.) и жирорастворимые (А, Е и др.).
13. Заполните таблицу «Витамины и их роль в организме человека».
Страница не найдена
Размер:
AAA
Цвет: C C C
Изображения Вкл. Выкл.
Обычная версия сайта
RUENBY
Гомельский государственный
медицинский университет
- Университет
- Университет
- История
- Устав и Символика
- Воспитательная деятельность
- Организация образовательного процесса
- Международное сотрудничество
- Система менеджмента качества
- Советы
- Факультеты
- Кафедры
- Подразделения
- Первичная профсоюзная организация работников
- Издания университета
- Гордость университета
- Выпускник-2021
- Первичная организация «Белорусский союз женщин»
- Одно окно
- ГомГМУ в международных рейтингах
- Структура университета
- Банк данных одаренной молодежи
- Абитуриентам
- Приёмная комиссия
- Университетская олимпиада по биологии
- Целевая подготовка
- Заключение, расторжение «целевого» договора
- Льготы для молодых специалистов
- Архив проходных баллов
- Карта и маршрут проезда
- Порядок приёма на 2023 год
- Специальности
- Контрольные цифры приёма в 2023 году
- Стоимость обучения
- Информация о ходе приёма документов
- Приём документов и время работы приёмной комиссии
- Порядок приёма граждан РФ, Кыргызстана, Таджикистана, Казахстана
- Горячая линия по вопросам вступительной кампании
- Студентам
- Первокурснику
- Расписание занятий
- Расписание экзаменов
- Информация для студентов
- Студенческий клуб
- Спортивный клуб
- Общежитие
- Нормативные документы
- Практика
- Стоимость обучения
- Безопасность жизнедеятельности
- БРСМ
- Профком студентов
- Учебный центр практической подготовки и симуляционного обучения
- Многофункциональная карточка студента
- Анкетирование студентов
- Выпускникам
- Интернатура и клиническая ординатура
- Докторантура
- Аспирантура
- Магистратура
- Распределение
- Врачам и специалистам
- Профессорский консультативный центр
- Факультет повышения квалификации и переподготовки
- Иностранным гражданам
- Факультет иностранных студентов
- Стоимость обучения
- Регистрация и визы
- Полезная информация
- Правила приёма
- Информация о возможностях и условиях приема в 2022 году
- Официальные представители ГомГМУ по набору студентов
- Страхование иностранных граждан
- Приём на Подготовительное отделение иностранных граждан
- Прием иностранных граждан для обучения на английском языке / Training of foreign students in English
- Повышение квалификации и переподготовка для иностранных граждан
- Научная деятельность
- Направления научной деятельности
- Научно-исследовательская лаборатория
- Научно-исследовательская часть
- Инновационные технологии в ГомГМУ
- Научно-педагогические школы
- Конкурсы, гранты, стипендии
- Научные мероприятия
- Работа комитета по этике
- В помощь исследователю
- Совет молодых ученых
- Студенчеcкое научное общество
- Диссертационный совет
- Патенты
- Инструкции на метод
- «Горизонт Европа»
- Госпрограмма (ЧАЭС)
- Главная
14.
 1: Вода — некоторые уникальные свойства
1: Вода — некоторые уникальные свойства- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 351312
ЦЕЛЬ УЧЕНИЯ
Описать различные свойства воды, связанные с ее полярностью и способностью образовывать водородные связи.
Взгляд поближе: вода, самая важная жидкость
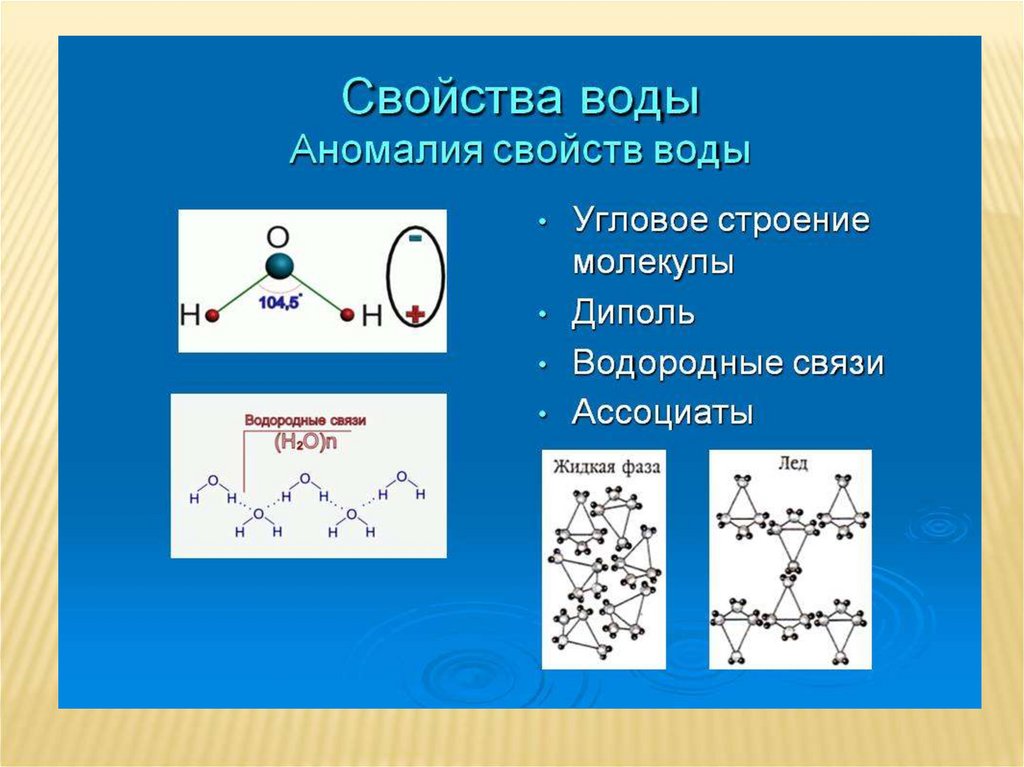
Земля — единственное известное тело в нашей Солнечной системе, на поверхности которого свободно существует жидкая вода. Это хорошо, потому что жизнь на Земле была бы невозможна без присутствия жидкой воды. Вода — это простая молекула, состоящая из одного атома кислорода, связанного с двумя разными атомами водорода (рис. \(\PageIndex{1}\)). Из-за более высокой электроотрицательности атома кислорода связи являются полярными ковалентными ( полярных связей 93\) гибридизованная атомная орбиталь.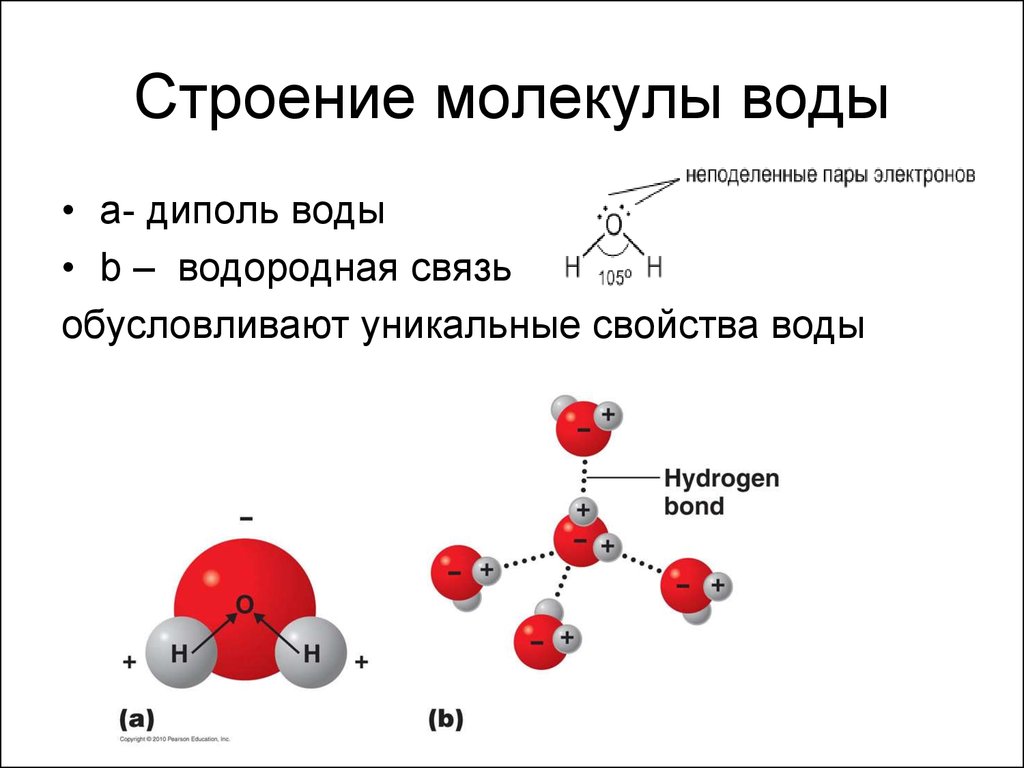 Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна.
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна.
Водородные связи
Из-за полярности воды каждая молекула воды притягивает другие молекулы воды, поскольку противоположно заряженные концы молекул притягиваются друг к другу. Когда это происходит, возникает слабое взаимодействие между положительный водородный конец одной молекулы и отрицательный кислородный конец другой молекулы. Это взаимодействие называется водородной связью . Эта водородная связь способствует следующим уникальным свойствам воды.
1. Вода – универсальный растворитель
2. В природе существует в твердом, жидком и газообразном состояниях
3. Плотность льда меньше плотности жидкой воды
4. 3 \right)\)»> 1.0000 9\text{o} \text{C}\), плотность постепенно уменьшается по мере того, как водородные связи начинают формировать сеть, характеризующуюся в целом -гексагональной -структурой с открытыми пространствами в середине шестиугольников (рис. \(\PageIndex{ 2}\) ).
3 \right)\)»> 1.0000 9\text{o} \text{C}\), плотность постепенно уменьшается по мере того, как водородные связи начинают формировать сеть, характеризующуюся в целом -гексагональной -структурой с открытыми пространствами в середине шестиугольников (рис. \(\PageIndex{ 2}\) ).
Лед менее плотный, чем жидкая вода, поэтому он плавает. Пруды или озера начинают замерзать у поверхности, ближе к холодному воздуху. Образуется слой льда, но он не тонет, как если бы вода не имела этой уникальной структуры, определяемой ее формой, полярностью и водородными связями. Если бы лед тонул, замерзая, целые озера замерзали бы. Поскольку лед не тонет, жидкая вода остается подо льдом всю зиму. Это важно, так как рыбы и другие организмы способны пережить зиму. Лед является одним из очень немногих твердых тел, которые менее плотны, чем его жидкая форма.
Если бы лед тонул, замерзая, целые озера замерзали бы. Поскольку лед не тонет, жидкая вода остается подо льдом всю зиму. Это важно, так как рыбы и другие организмы способны пережить зиму. Лед является одним из очень немногих твердых тел, которые менее плотны, чем его жидкая форма.
Растворяющая способность воды
Вода обычно растворяет многие ионные соединения и полярные молекулы. Неполярные молекулы, такие как содержащиеся в смазке или масле, не растворяются в воде. Сначала мы рассмотрим процесс, происходящий при растворении в воде ионного соединения, такого как поваренная соль (хлорид натрия).
Вода притягивается к кристаллу хлорида натрия, потому что вода полярна и имеет как положительный, так и отрицательный конец. Положительно заряженные ионы натрия в кристалле притягивают кислородный конец молекул воды, потому что они частично отрицательны. Отрицательно заряженные ионы хлора в кристалле притягивают водородные концы молекул воды, потому что они частично положительны. Действие полярных молекул воды разрывает кристаллическую решетку (см. рисунок \(\PageIndex{3}\)) . 9+}\) ионы окружены молекулами воды с атомом кислорода, ориентированным вблизи положительного иона. Точно так же ионы хлорида окружены молекулами воды с противоположной ориентацией. Гидратация — это процесс окружения частиц растворенного вещества молекулами воды, расположенными определенным образом. Гидратация помогает стабилизировать водные растворы, предотвращая повторное соединение положительных и отрицательных ионов и образование осадка.
Действие полярных молекул воды разрывает кристаллическую решетку (см. рисунок \(\PageIndex{3}\)) . 9+}\) ионы окружены молекулами воды с атомом кислорода, ориентированным вблизи положительного иона. Точно так же ионы хлорида окружены молекулами воды с противоположной ориентацией. Гидратация — это процесс окружения частиц растворенного вещества молекулами воды, расположенными определенным образом. Гидратация помогает стабилизировать водные растворы, предотвращая повторное соединение положительных и отрицательных ионов и образование осадка.
Столовый сахар представляет собой сахарозу \(\left( \ce{C_{12}H_{22}O_{11}} \right)\) и является примером молекулярного соединения. Твердый сахар состоит из отдельных молекул сахара, удерживаемых вместе силами межмолекулярного притяжения. Когда вода растворяет сахар, она разделяет отдельные молекулы сахара, разрушая силы притяжения, но не разрывая ковалентных связей между атомами углерода, водорода и кислорода. Молекулы растворенного сахара также гидратируются, но без такой четкой ориентации по отношению к молекулам воды, как в случае ионов. Молекулы сахара содержат много групп \(\ce{-OH}\), которые могут образовывать водородные связи с молекулами воды, способствуя образованию раствора сахарозы.
Молекулы сахара содержат много групп \(\ce{-OH}\), которые могут образовывать водородные связи с молекулами воды, способствуя образованию раствора сахарозы.
Амфотерная природа воды
Вода амфотерна: она может действовать как кислота или основание в химических реакциях. Согласно определению Бренстеда-Лоури, кислота является донором протона (H + ), а основание является акцептором протона. При взаимодействии с более сильной кислотой вода действует как основание; при взаимодействии с более сильным основанием действует как кислота. Например, вода получает ион H + из HCl при образовании соляной кислоты:
- HCl (кислота) + H 2 O (основание) ⇌ H 3 O + + Cl −
В реакции с аммиаком NH 3 вода отдает ион H + и, таким образом, действует как кислота: NH + 4 + OH −
Высокая теплоемкость и удельная теплоемкость воды
Различные вещества по-разному реагируют на тепло. Если металлический стул находится на ярком солнце в жаркий день, он может сильно нагреться на ощупь. Равная масса воды на том же солнце не станет такой же горячей. В таблице \(\PageIndex{2}\) перечислены удельные теплоемкости различных веществ по сравнению с водой. Вода имеет самые высокие 9\text{o} \text{C}\) для удельной теплоемкости.
Если металлический стул находится на ярком солнце в жаркий день, он может сильно нагреться на ощупь. Равная масса воды на том же солнце не станет такой же горячей. В таблице \(\PageIndex{2}\) перечислены удельные теплоемкости различных веществ по сравнению с водой. Вода имеет самые высокие 9\text{o} \text{C}\) для удельной теплоемкости.
Вода долго нагревается и долго остывает. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Прибрежный климат гораздо более умеренный, чем внутренний, из-за присутствия океана. Вода в озерах или океанах поглощает тепло из воздуха в жаркие дни и отдает его обратно в воздух в прохладные дни.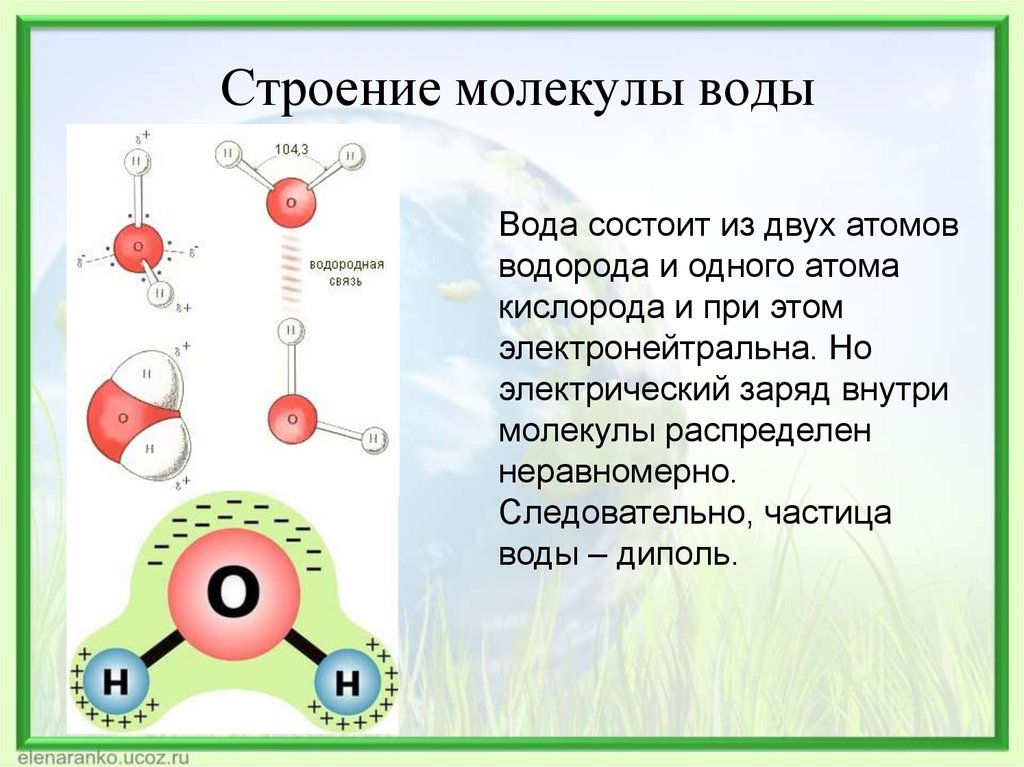 \text{o} \text{C} \right)\)»> 0,233
\text{o} \text{C} \right)\)»> 0,233
Высокая теплота испарения воды
Вода в жидкой форме имеет необычно высокую температуру кипения, значение близкое к 100°C. В результате наличия сети водородных связей между молекулами воды требуется большое количество энергии, чтобы преобразовать один грамм жидкой воды в водяной пар, потребность в энергии, называемая теплота парообразования. Вода имеет теплоту парообразования 40,65 кДж/моль . Для осуществления этого изменения в воде требуется значительное количество тепловой энергии (586 калорий). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель тепла или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Резюме
- Полярность воды и ее способность образовывать водородные связи способствуют ее уникальным свойствам. 9\text{o} \text{C}\).
- Диссоциация молекул жидкой воды, превращающая вещество в газ, требует много энергии.
Авторы и авторство
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
- источник[1]-хим-152224
2.5: Свойства воды — биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 74484
- OpenStax
- OpenStax
Развитие навыков
- Описать свойства воды, имеющие решающее значение для поддержания жизни
- Объясните, почему вода является отличным растворителем
- Приведите примеры когезионных и адгезивных свойств воды
- Обсудите роль кислот, оснований и буферов в гомеостазе
Почему ученые тратят время на поиски воды на других планетах? Почему вода так важна? Это потому, что вода необходима для жизни, какой мы ее знаем.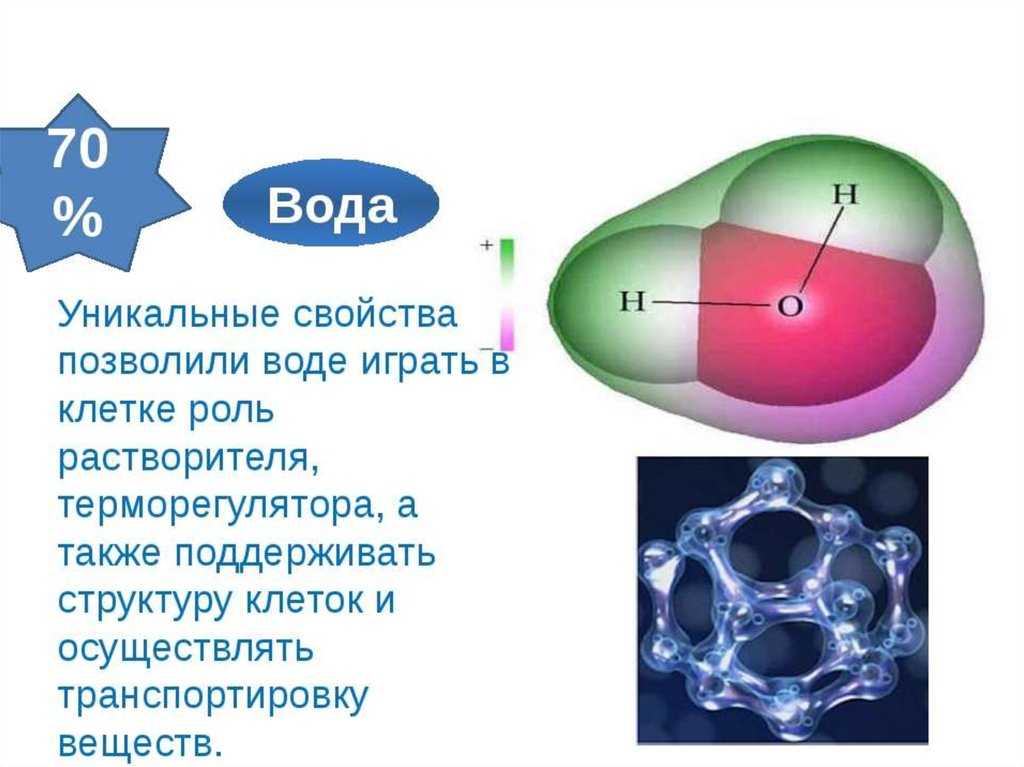 Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Полярность молекулы воды и образующаяся в результате водородная связь делают воду уникальным веществом с особыми свойствами, которые тесно связаны с процессами жизни. Первоначально жизнь развивалась в водной среде, и большая часть клеточной химии и метаболизма организма происходит внутри водянистого содержимого цитоплазмы клетки. К особым свойствам воды относятся ее высокая теплоемкость и теплота парообразования, способность растворять полярные молекулы, ее когезионные и адгезивные свойства, а также ее диссоциация на ионы, что приводит к образованию рН. Понимание этих характеристик воды помогает понять ее важность для поддержания жизни.
Полярность воды
Одним из важных свойств воды является то, что она состоит из полярных молекул: водород и кислород внутри молекул воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между молекулами воды, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рисунке \(\PageIndex{1}\), и отделяются от нее, а не растворяются в ней, как мы видим в заправках для салатов, содержащих масло.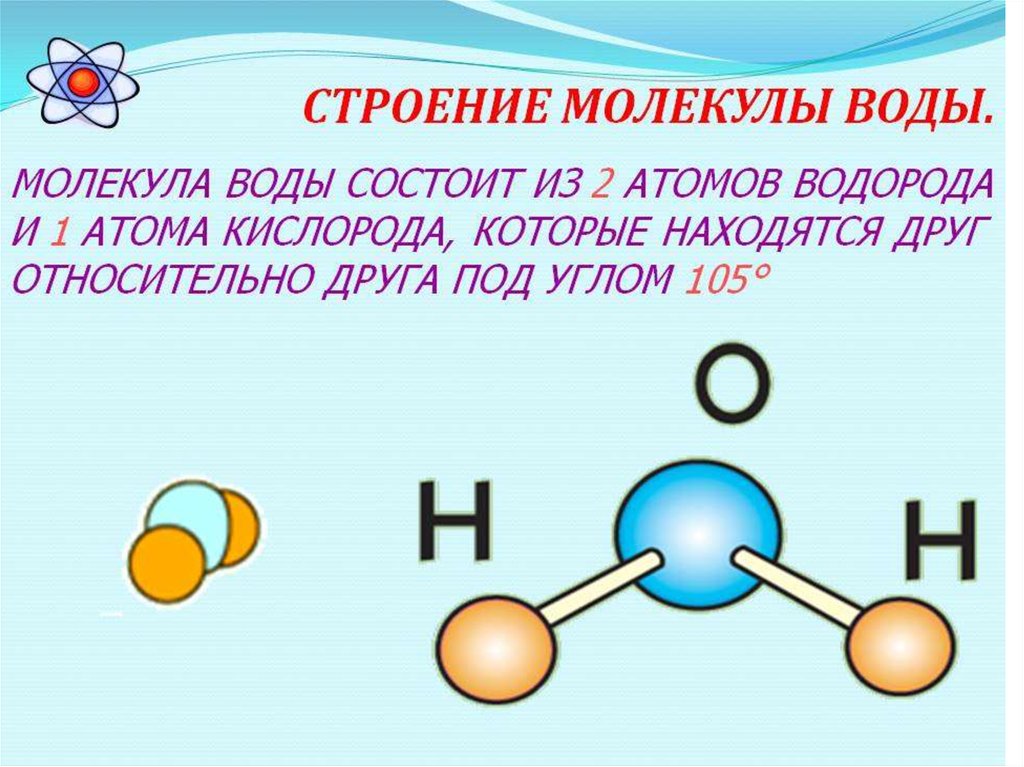 и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Образование водородных связей является важным свойством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, и, поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Более низкая плотность воды в твердом состоянии обусловлена тем, как ориентируются водородные связи при ее замерзании: молекулы воды раздвигаются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, показанная и изображенная на рисунке \(\PageIndex{2}\), является аномалией и заставляет его плавать на поверхности жидкой воды, например, в айсберге или в кубиках льда в стакане.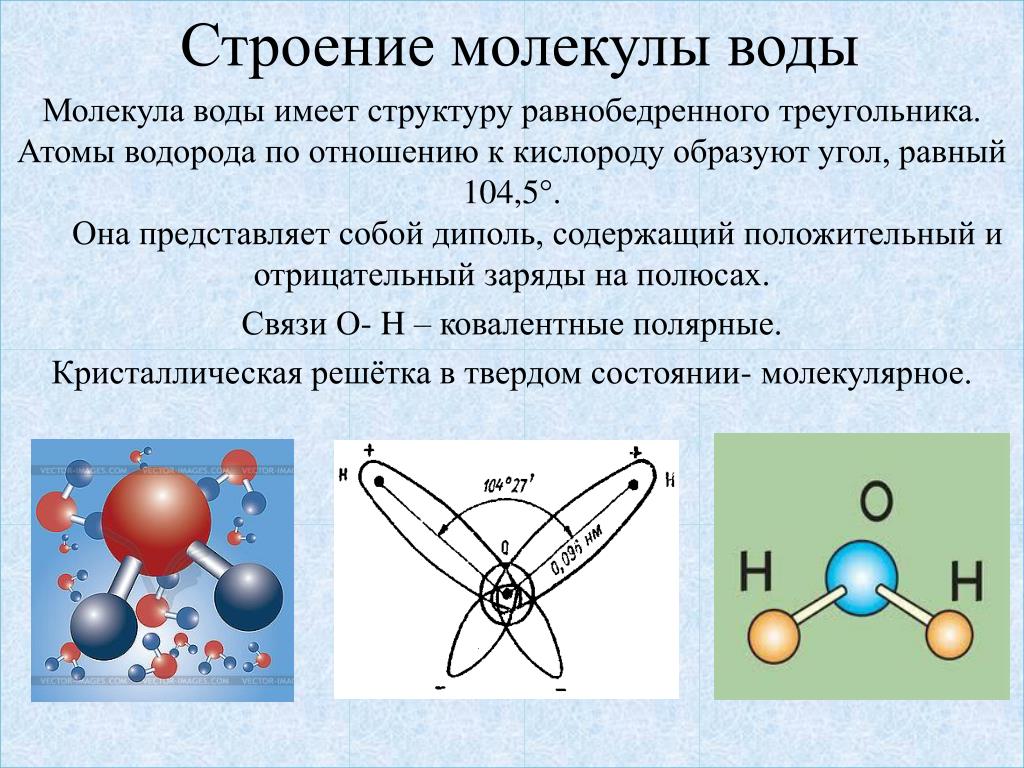 ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Ссылка на обучение
Видео: Нажмите здесь, чтобы увидеть трехмерную анимацию структуры ледяной решетки. (Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
(Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
Высокая теплоемкость воды
Высокая теплоемкость воды является свойством, обусловленным водородными связями между молекулами воды. Вода обладает наибольшей удельной теплоемкостью среди всех жидкостей. Удельная теплоемкость определяется как количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия. Для воды это количество составляет одну калорию. Поэтому вода долго нагревается и долго охлаждается. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Благодаря своей высокой теплоемкости вода используется теплокровными животными для более равномерного распределения тепла в их телах: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерная температура.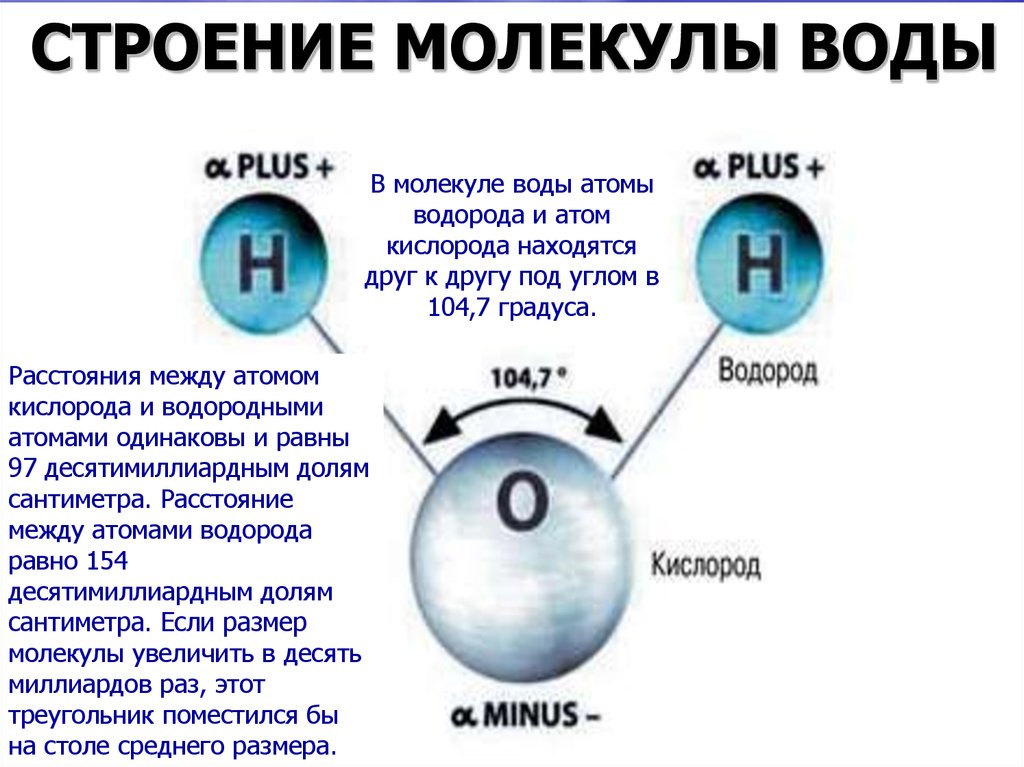
Теплота испарения воды
Вода также имеет высокую теплоту парообразования, количество энергии, необходимое для превращения одного грамма жидкого вещества в газ. Для осуществления этого превращения воды требуется значительное количество тепловой энергии (586 кал). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул жидкой воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: этот процесс известен как испарение.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Растворяющие свойства воды
Поскольку вода представляет собой полярную молекулу со слегка положительным и слегка отрицательным зарядом, ионы и полярные молекулы могут легко растворяться в ней. Поэтому воду называют растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Это называется сферой гидратации или гидратной оболочкой, как показано на рисунке \(\PageIndex{3}\), и служит для разделения или диспергирования частиц в воде.
При добавлении к воде ионных соединений отдельные ионы реагируют с полярными областями молекул воды, и их ионные связи разрываются в процессе диссоциации. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): когда кристаллы NaCl добавляют в воду, молекулы NaCl диссоциируют на ионы Na + и Cl – , а вокруг ионов образуются сферы гидратации, как показано на рисунке \( \ИндексСтраницы{3}\). Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды. Отрицательно заряженный ион хлора окружен частично положительным зарядом водорода на молекуле воды.
Рисунок \(\PageIndex{3}\): Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.Когезионные и адгезивные свойства воды
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Когезия допускает развитие поверхностного натяжения, способности вещества противостоять разрыву при воздействии на него напряжения или нагрузки. По этой же причине вода образует капли, когда ее кладут на сухую поверхность, а не расплющивают под действием силы тяжести. Когда небольшой клочок бумаги помещается на каплю воды, бумага плавает поверх капли воды, даже если бумага плотнее (тяжелее), чем вода. Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Можно даже «поплавать» иглой над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рисунке \(\PageIndex{4}\).
Рисунок \(\PageIndex{4}\): Вес иглы тянет поверхность вниз; в то же время поверхностное натяжение тянет его вверх, удерживая на поверхности воды и удерживая от погружения.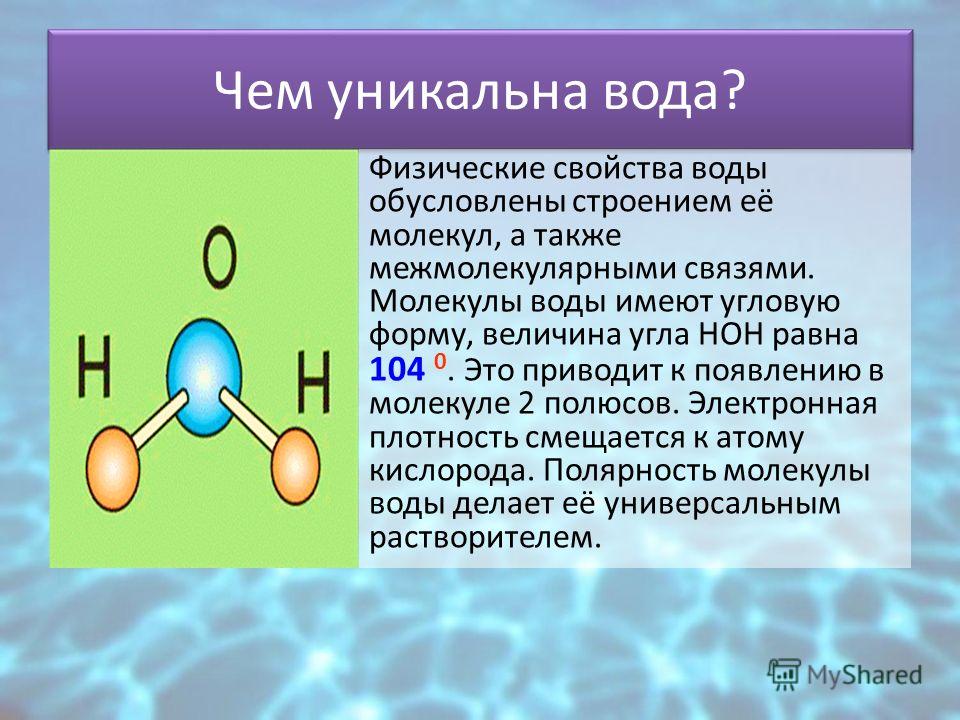 Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)Эти когезионные силы связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это притяжение иногда сильнее, чем силы сцепления воды, особенно когда вода подвергается воздействию заряженных поверхностей, таких как те, которые находятся внутри тонких стеклянных трубок, известных как капиллярные трубки. Адгезия наблюдается, когда вода «поднимается» вверх по трубке, помещенной в стакан с водой: обратите внимание, что вода кажется выше по бокам трубки, чем в середине. Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра сильнее, чем друг к другу, и поэтому прилипают к нему. Этот тип адгезии называется капиллярным действием и показан на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капиллярное действие в стеклянной трубке вызвано силами сцепления, создаваемыми внутренней поверхностью стекла, превышающими силы сцепления между самими молекулами воды.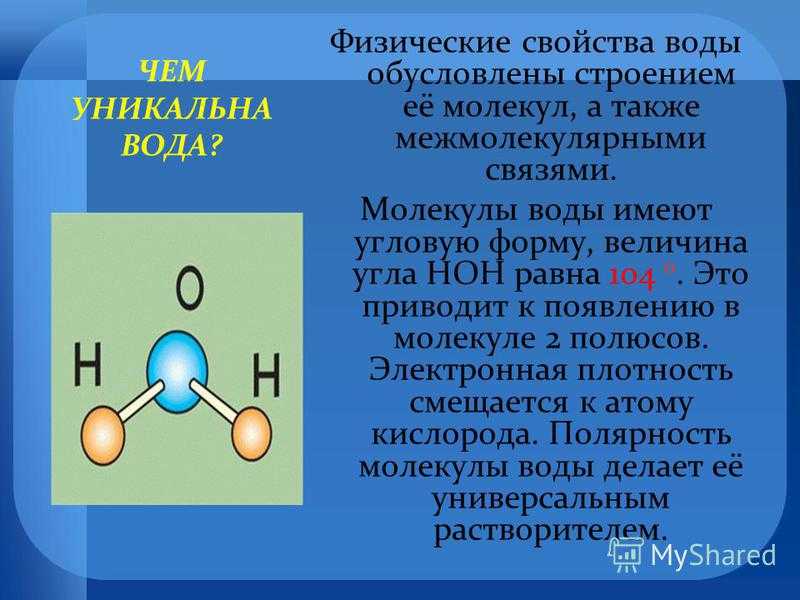 (кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
(кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)Почему когезионные и адгезионные силы важны для жизни? Когезионные и адгезионные силы важны для транспорта воды от корней к листьям растений. Эти силы создают «притяжение» к толще воды. Это притяжение возникает из-за тенденции молекул воды, испаряющихся на поверхности растения, оставаться связанными с молекулами воды под ними, и поэтому они притягиваются. Растения используют это природное явление, чтобы переносить воду от корней к листьям. Без этих свойств воды растения не смогли бы получать воду и растворенные минералы, которые им необходимы. В другом примере насекомые, такие как водомерка, показанная на рисунке \(\PageIndex{6}\), используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваются там. 9- (aq)} \nonumber\]
лакмусовая или pH-бумага, фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH для определения содержания кислоты (кислотности) или основания ( щелочность) существует в растворе. Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Ионы водорода спонтанно образуются в чистой воде путем диссоциации (ионизации) небольшого процента молекул воды на равное количество водорода (H + ) ионов и гидроксид (ОН — ) ионов. В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 0 + ). Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1 × 10 -7 молей H + ионов на литр воды. Моли (mol) — это способ выражения количества вещества (которым могут быть атомы, молекулы, ионы и т. д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные значения рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Кислота — это вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание обеспечивает либо гидроксид-ионы (OH —), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлорида и является очень кислой, тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и считаются слабыми кислотами. И наоборот, сильные основания — это те вещества, которые легко отдают OH – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и выделяют OH – 9.0157 быстро при помещении в воду, тем самым повышая рН. Примером слабощелочного раствора является морская вода с pH около 8,0, что достаточно близко к нейтральному pH, чтобы морские организмы, адаптированные к этой соленой среде, могли процветать в ней.
Шкала pH, как упоминалось ранее, является обратным логарифмом и находится в диапазоне от 0 до 14 (Рисунок \(\PageIndex{7}\)). Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Ссылка на обучение
Посмотрите это видео для простого объяснения pH и его логарифмической шкалы.
Так как же могут организмы, чьим телам требуется рН, близкий к нейтральному, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в узком диапазоне, необходимом для выживания. Поддержание постоянного рН крови имеет решающее значение для благополучия человека. Буфер, поддерживающий pH крови человека, включает угольную кислоту (H 2 CO 3 ), ион бикарбоната (HCO 3 – ) и диоксид углерода (CO 2 ). Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке \(\PageIndex{8}\), избыточная углекислота может быть преобразована в углекислый газ и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – вводится в систему, угольная кислота будет соединяться с ним с образованием бикарбоната, снижая рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Аналогично, если слишком много OH – вводится в систему, угольная кислота будет соединяться с ним с образованием бикарбоната, снижая рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Другими примерами буферов являются антациды, используемые для борьбы с избытком желудочной кислоты. Многие из этих безрецептурных лекарств действуют так же, как буферы крови, обычно с по крайней мере одним ионом, способным поглощать водород и снижать рН, принося облегчение тем, кто страдает от «изжоги» после еды. Уникальные свойства воды, которые способствуют этой способности уравновешивать pH, а также другие характеристики воды, необходимы для поддержания жизни на Земле.
Ссылка на обучение
Чтобы узнать больше о воде. Посетите Геологическую службу США. Наука о воде для школ. Все о воде! Веб-сайт.
Резюме
Вода обладает многими свойствами, которые необходимы для поддержания жизни. Это полярная молекула, допускающая образование водородных связей. Водородные связи позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды приводят к тому, что вода обладает высокой теплоемкостью, а это означает, что для повышения ее температуры требуется много дополнительного тепла. При повышении температуры водородные связи между водой постоянно разрываются и формируются заново. Это позволяет общей температуре оставаться стабильной, хотя в систему добавляется энергия. Вода также обладает высокой теплотой испарения, что является ключом к тому, как организмы охлаждаются за счет испарения пота. Силы сцепления воды учитывают свойство поверхностного натяжения, тогда как ее адгезионные свойства проявляются, когда вода поднимается внутри капиллярных трубок. Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Сноски
- 1 W. Humphrey W., A. Dalke, and K. Schulten, «VMD—Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke и K. Schulten, «VMD-Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
Глоссарий
- кислота
- молекула, отдающая ионы водорода и повышающая концентрацию ионов водорода в растворе
- адгезия
- притяжение между молекулами воды и другими молекулами
- база
- молекула, которая отдает ионы гидроксида или иным образом связывает избыток ионов водорода и снижает концентрацию ионов водорода в растворе
- буфер
- вещество, предотвращающее изменение pH за счет поглощения или выделения ионов водорода или гидроксида
- калорий
- количество теплоты, необходимое для изменения температуры одного грамма воды на один градус Цельсия
- капиллярное действие
- возникает из-за того, что молекулы воды притягиваются к зарядам на внутренних поверхностях узких трубчатых структур, таких как стеклянные трубки, притягивая молекулы воды к сторонам трубок
- сплоченность
- межмолекулярных сил между молекулами воды, вызванных полярной природой воды; отвечает за поверхностное натяжение
- диссоциация
- высвобождение иона из молекулы таким образом, что исходная молекула теперь состоит из иона и заряженных остатков исходной, например, когда вода диссоциирует на H + и ОХ —
- испарение
- выделение отдельных молекул с поверхности воды, листьев растений или кожи организма
- теплота парообразования воды
- требуется большое количество энергии для превращения жидкой воды в водяной пар
- гидрофильный
- описывает ионы или полярные молекулы, которые хорошо взаимодействуют с другими полярными молекулами, такими как вода
- гидрофобный
- описывает незаряженные неполярные молекулы, которые плохо взаимодействуют с полярными молекулами, такими как вода .
- лакмусовая бумага
- (также pH-бумага) фильтровальная бумага, обработанная натуральным водорастворимым красителем, который меняет свой цвет при изменении pH окружающей среды, поэтому ее можно использовать в качестве индикатора pH
- pH-бумага
- см. лакмусовую бумажку
- Шкала pH
- шкала от нуля до 14, что обратно пропорционально концентрации ионов водорода в растворе
- растворитель
- вещество, способное растворять другое вещество
- удельная теплоемкость
- Количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия
- сфера гидратации
- , когда полярная молекула воды окружает заряженные или полярные молекулы, удерживая их в растворенном состоянии и в растворе
- поверхностное натяжение
- напряжение на поверхности тела жидкости, препятствующее разделению молекул; создаваемые силами притяжения и сцепления между молекулами жидкости
Эта страница под названием 2.


