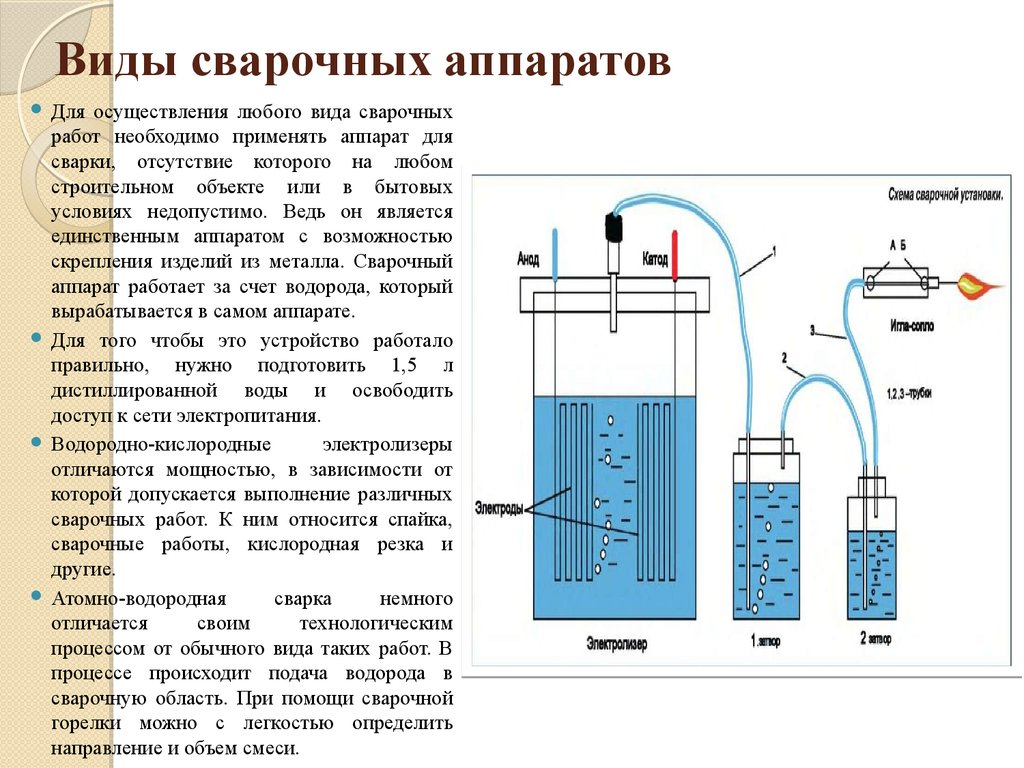
Электролиз воды в промышленных генераторах водорода
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:
- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.
Ниже представлена принципиальная схема промышленного щелочного электролизера.
Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОН—.
Деминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
 рисунок).
рисунок).Далее, чтобы получить чистый водород и кислород, требуется разделить газы образующиеся на электродах, и для этого применяют разделительные ионно-обменные мембраны (см. рисунок). Количество получаемого водорода в два раза больше получаемого кислорода и поэтому давление в водородной полости поднимается в два раза быстрее. Для уравнивания давления в полостях применяют уравнивающую давление мембрану на выходе из электролизера, которая предотвращает передавливание водорода в полость кислорода через каналы предназначенные для циркуляции электролита.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
Расщепление воды на водород и кислород в домашних условиях
Обыкновенная батарейка расщепляет воду на кислород и водород!
В отличии от классического топлива, которое выделяет вредные отработанные газы, загрязняющие атмосферу и которые приводят к изменению условий климата, водородное горючее полностью невредно для внешней среды.
Почему все средства транспортировки не применяют водород в качестве топлива?
До этих пор чистый в экологическом плане процесс получения водорода требовал приличного количества драгметаллов, что существенно увеличивает стоимость водородного топлива, тем более если сравнивать с обычным.
Путем химического взаимные действия атомов водорода с атомами кислорода, находящегося в воздухе, водородное горючее формирует достаточно энергии для автомобильного двигателя, а «выбросами» подобного мотора становится чистейшая вода. Но данный период времени почти что каждый «чистый» двигатель, работающий на водородном топливе, применяет водород, получившийся при помощи сетевого газа – процесс, чистота в экологическом плане которого находится под сомнением.
Но данный период времени почти что каждый «чистый» двигатель, работающий на водородном топливе, применяет водород, получившийся при помощи сетевого газа – процесс, чистота в экологическом плане которого находится под сомнением.
Как получить «чистый» водород?
При помощи электрических потоков воду можно поделить на атомы кислорода и водорода. Данный процесс просит приличного количества дорогих металлов, например как платина или иридий, – они отлично проводят электричество и не становятся хуже, находясь в водной массе очень долго.
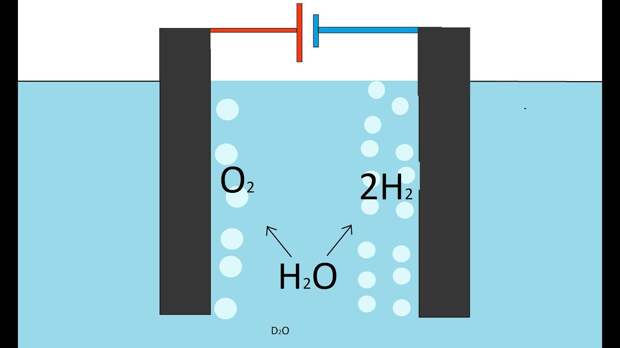
Процесс расщепления водяные молекулы на атомы водорода и кислорода именуется электролизом и проходит так: два электрода опускаются в воду, по ним ведется ток, под воздействием которого атомы водорода стремятся к отрицательно заряженному катоду, а атомы кислорода к благоприятно заряженному аноду.
Новый прорыв
Ученые мужи из Стэндфордского университета провели оригинальный эксперимент, из-за которого сделали процесс электролиза при помощи типовых никелевых электродов под рекордно невысоким напряжением — обыкновенная батарейка в 1. 5 Вольт.
5 Вольт.
Согласно данным ученых, конструкция электродов из никеля и его оксида позволила процессу удачно закончиться под таким невысоким напряжением. До этого никому не получалось сделать аналогичное. Современная технология в масштабах промышленности поможет изготовителям водородного топлива прекрасно сэкономить на электричестве и проводниках. Нынче ученые мужи работают над тем, как расширить длительность работы никелевых проводников в водной массе.
Теплоснабжение водородом дома, делаем собственными руками
Разработки новых и новых отопительных систем идут полным ходом, и одним из очень последних достижений в данной сферы считается возможность обогревать дома с помощью водорода, применяя его как горючее. Если понадобится можно провести отопление дома водородом собственными руками. Не обращая внимания на замечательные качества, система еще опоздала захватить востребовательность, но очень много домовладельцев наиболее тщательно присматриваются к ней.
Что такое водород и как он применяется
Водород известен людям в течении многих веков. В период средних веков проводилось приличное количество опытов, и при выполнении одного из них был замечен водород: при контакте серной кислоты с металлом выделялись пузырьки воздуха. Водород – это не тяжелый бесцветный газ, не имеющий выраженного аромата. При соединении с кислородом может образовать взрывоопасную смесь. Имеет особенность растворяться в этаноле, железе, платине, палладии и никеле. К тому же, водород совсем не токсичный.
В период средних веков проводилось приличное количество опытов, и при выполнении одного из них был замечен водород: при контакте серной кислоты с металлом выделялись пузырьки воздуха. Водород – это не тяжелый бесцветный газ, не имеющий выраженного аромата. При соединении с кислородом может образовать взрывоопасную смесь. Имеет особенность растворяться в этаноле, железе, платине, палладии и никеле. К тому же, водород совсем не токсичный.
Процесс получения водорода выполняется с помощью электричества и воды: используя способ электролиза, можно расщеплять воду на водород и кислород, что позволяет применять эти вещества в собственных целях. Согласно данным статистики водород считается очень распространенным веществом в мире.
Его можно отыскать почти что в самых разных природных ресурсах. Водород имеет определенные характеристики, которые достаточно сильно выделяют его от собратьев: в жидком виде он считается самой легкой жидкостью, а при затвердевании считается самым легким веществом. Все это вызвано мелкими размерами атомов водорода.
Все это вызвано мелкими размерами атомов водорода.
Водород часто используется при изготовлении разных веществ и материалов, к примеру, для получения нашатырного спирта или жидких жиров. Ценность водорода для пищевой промышленности тоже обуславливается его неповторимыми параметрами.
Такой элемент применяется и в технологиях: к примеру, кислородно-водородная горелка дает возможность создать температуру больше 2-ух тысяч градусов, что дает возможность плавить кварцевый песок. Задействовать водород можно даже дома: почти что в каждой домашней аптечке хранится перекись водорода. Для хранения подобного топлива, как водород, применяются специализированные балоны.
Водородное теплоснабжение
Если говорить в общем, то домашнее отопление водородом не считается революционной идеей. Проблема старых разработок была в том, что для сжигания водорода требовалась температуры более 1,7 тыс. градусов, что было не приемлимо, потому как простые материалы не выдерживали такой нагрузки, а применение термоустойчивых веществ неоднократно удорожило бы систему.
Современная система водородного теплоснабжения позволяет сжигать водород при температуре примерно 300 градусов, что позволяет создать теплоснабжение приватного дома водородом очень легко. Газообразные, жидкие и твердые вещества в данных устройствах никуда не выводятся, так как их нет: при возгорании водорода выделяется исключительно пар, который не оказывает никакого воздействия на экологию. Добыча водорода считается очень простым и не дорогим процессом, и все расходы при этом будут только на электричество, нужное для расщепления воды. Применяя альтернативные источники электрической энергии, можно уменьшить и данный показатель (прочтите: «Альтернативное теплоснабжение приватного дома — выбор очень большой»).
Самый первый разработанный водородный котел отопления имел мощность в 30 кВт. Это мало, однако даже подобного количества энергии достаточно для отапливания строения площадью до 300 метров квадратных.
Наибольшее распространение теплоснабжение водородом получило в качестве элемента нагрева для системы полов с подогревом, и в наше время есть очень большое количество комбинаций котлов, которые можно ставить собственными силами. Во многих государствах подобное отопление активно внедряется, потому как его приминение дает возможность существенно экономить натуральные ресурсы.
Во многих государствах подобное отопление активно внедряется, потому как его приминение дает возможность существенно экономить натуральные ресурсы.
В состав подобной систему входят котел и трубы с внутренним сечением от 25 до 32 мм. Трубы остальных диаметров, в основном, не применяются.
При монтаже трубопроводные системы нужно віполнять следующий метод:
- в первую очередь следует установить трубу Д32;
- следующей трубой будет Д25;
- на очередном разветвлении будет поставлена труба Д20;
- завершать установку нужно трубой Д16.
Если эта очередность будет выдерживаться, то система будет работать правильно и без перебоев.
Плюсы теплоснабжения водородом
Водородные котлы отопления обладают рядом плюсов если сравнивать с другими видами обогревательных приборов:
- Водород является материалом экологически чистым, благодаря этому ущерб внешней среде при эксплуатации водородных систем будет сводиться до нуля.
 Единственное вещество, какое будет попадать в атмосферу – это пар, являющийся водой в газообразном состоянии.
Единственное вещество, какое будет попадать в атмосферу – это пар, являющийся водой в газообразном состоянии. - Открытое пламя в водородных котлах отсутствует, а для выработки тепла применяется каталитическая реакция: при соединении водорода с кислородом образуется вода, а сам это процесс сопровождается выделением энергии тепла, которая и обеспечивает обогрев дома. Опыт говорит, что прекраснее всего водородные системы подойдут именно для обустраивания теплых полов.
- Залежи водорода почти что не имеют границ, благодаря этому в самом ближайшем будущем можно будет забыть о ставших привычными видах топлива: газе, дровах или нефти. Это окажет хорошее воздействие на внешнюю среду и экономическую обстановку.
- Водородные системы отопления очень продуктивны: при правильной установке КПД подобного теплоснабжения может дойти до 96%.
Заключение
Сегодня теплоснабжение водородом находится в зачаточной стадии, но данные системы развиваются, и работа над их совершенствованием идет.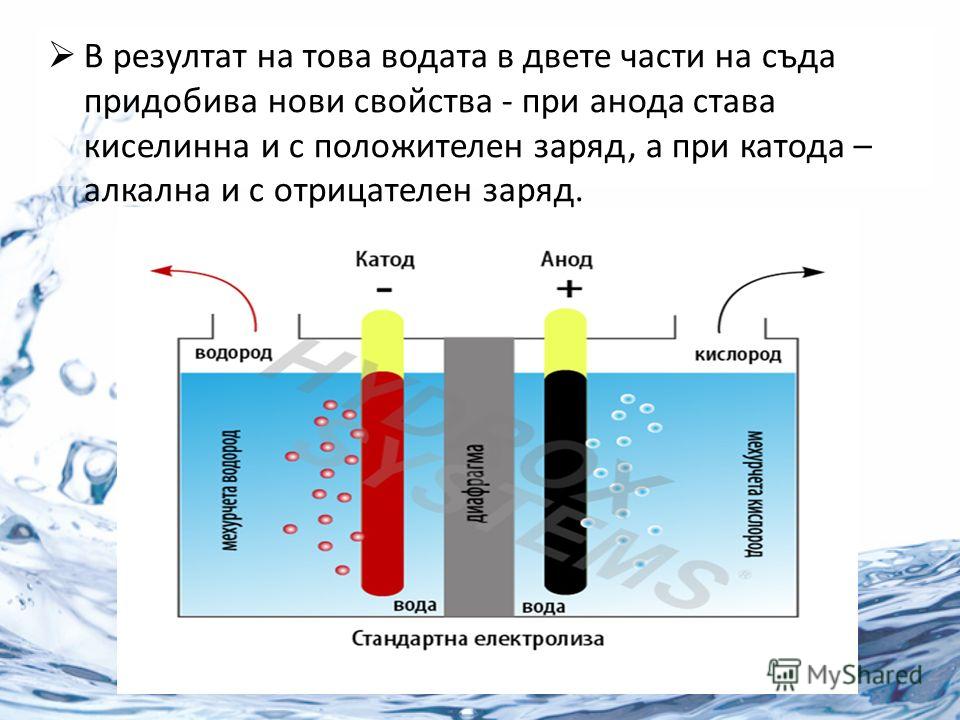 Натуральные ресурсы в скором будущем могут просто завершиться, и вот тогда водород везде придёт им на смену, потому как он может применяться в неограниченных объемах.
Натуральные ресурсы в скором будущем могут просто завершиться, и вот тогда водород везде придёт им на смену, потому как он может применяться в неограниченных объемах.
Dmitrii730 › Блог › ННО электролиз воды
3,5 куба, 3500 литров
В 1 литре воды:
1234,44 л водорода
604,69 л кислорода
186450 Известно, что грамм-атом численно равён атомной массе вещества, а грамм-молекула — молекулярной массе вещества. К примеру, грамм-молекула водорода в молекуле воды равна двум граммам, а грамм-атом атома кислорода — 16 граммам. Грамм-молекула воды равна 18 граммам. Так как масса водорода в молекуле воды составляет 2?100/18=11,11%, а масса кислорода — 16?100/18=88,89%, то это же соотношение водорода и кислорода содержится в одном литре воды. Это значит, что в 1000 граммах воды содержится 111,11 грамм водорода и 888,89 грамм кислорода.
Один литр водорода весит 0,09 гр., а один литр кислорода — 1,47 гр. Это значит, что из одного литра воды можно получить 111,11/0,09=1234,44 литра водорода и 888,89/1,47=604,69 литра кислорода. Это говорит о том, что один грамм воды имеет 1,23 литра водорода.
Это говорит о том, что один грамм воды имеет 1,23 литра водорода.
Расходы электрической энергии на получение 1000 литров водорода нынче составляют 4 кВтч, а на один литр — 4 Втч. Потому как из одного грамма воды можно получить 1,234 литра водорода, то на получение водорода из одного грамма воды нынче тратится 1,234?4=4,94 Втч.
Это полностью взято из патента RU2277138.
Однако у Мэйера движок 50 л.с. (1.3 л.) на сто километров брал 4.5 литра воды.
В общем определенных данных пока нет! =В патенте четко написано:
Voltage Intensifier Circuit
40,000 volts @ 1 ma = 40 wats of applied electrical power
40 watts + 12 volts battery = 3,3 amp/hr
Напряжение цепи усилителя яркости
40000 вольт при 1 мА = 40 Wats прикладных электрическая мощность
40 Вт 12 вольт батареи = 3,3 ампер / час
Отсюда вывод что это значит напряжение 40 кВ а это означает и ток вырастит но одно однако если нам даст возможность источник другими словами мы ему сделаем 40 кВ но источник намотаем на ту силу тока что нам необходимо . однако есть такой называимый холодный ток и напряжения получаемое с плоская бифилярная катушка тесла и он тоже не прекращает работу
однако есть такой называимый холодный ток и напряжения получаемое с плоская бифилярная катушка тесла и он тоже не прекращает работу
(
Вода это горючее по настоящему.
В 1 литре воды:
1234,44 л водорода
604,69 л кислорода
Разбрызгивание воды в холодный туман.
Подобная водно топливная смесь может гореть не только в двигателе внутреннего сгорания, но также и в любой теплогенерирующей установке, и также применяться на топливных электрических станциях взамен соляры. Перспективы забавные: только представьте, что все независимые электрические генераторы, силовые установки судов и мощные двигатели грузовиков, работающие теперь на топливе могут быть модернизированы для работы на воде. Теоретических преград для этого нет. В этом случае, рынок независимых источников энергии ждут большие положительные изменения.
Есть простой и прекрасный способ Фарадея.
Приспособят медный бак на выхлопной коллектор (нужно чтобы бак на него плотно прилегал по всем вывихах )И очень герметичный (что бы не засосало воду в мотор и за разгерметизации и самый прочный, что бы не разорвало от лишнего давления пара и не смяло при разряжении) и залей в бак воду. Выход от бака трубкой / трубочкой подвели к впускному коллектору и будет тебе счастье .
Выход от бака трубкой / трубочкой подвели к впускному коллектору и будет тебе счастье .
Это доказал Фарадея. когда пропускал в раскаленном железом стволе пушки, но одно но железо при крутится ржавчину . (Лавуазье опилок добавил ствол пушки для восстановления железа (Платон, вставил железяку вовнутрь трубы, для лучшего соприкасания молекул пара со стенкой внешней или внутренней трубы. ) если проникает смешанную с водой мочевину. в раскаленную трубку с нее выделяется нашатырный спирт, а оставшееся СО забирает кислород у оксида железа . Потом нашатырный спирт поступает в цилиндр и там разлагается на водород и азот.
При попадании пара перегретого в цилиндр при взрыве / детонации смеси бензиновых / соляровых паров определенное количество молекул воды расщепляется на кислород и водород, и здесь же горит, выделяя огромную энергию. Эта энергия дает возможность экономить бензин / солярку в довольно значительном количестве . На больших двигателях на дизеле экономия доходит до 25-30 % если система правильно создана.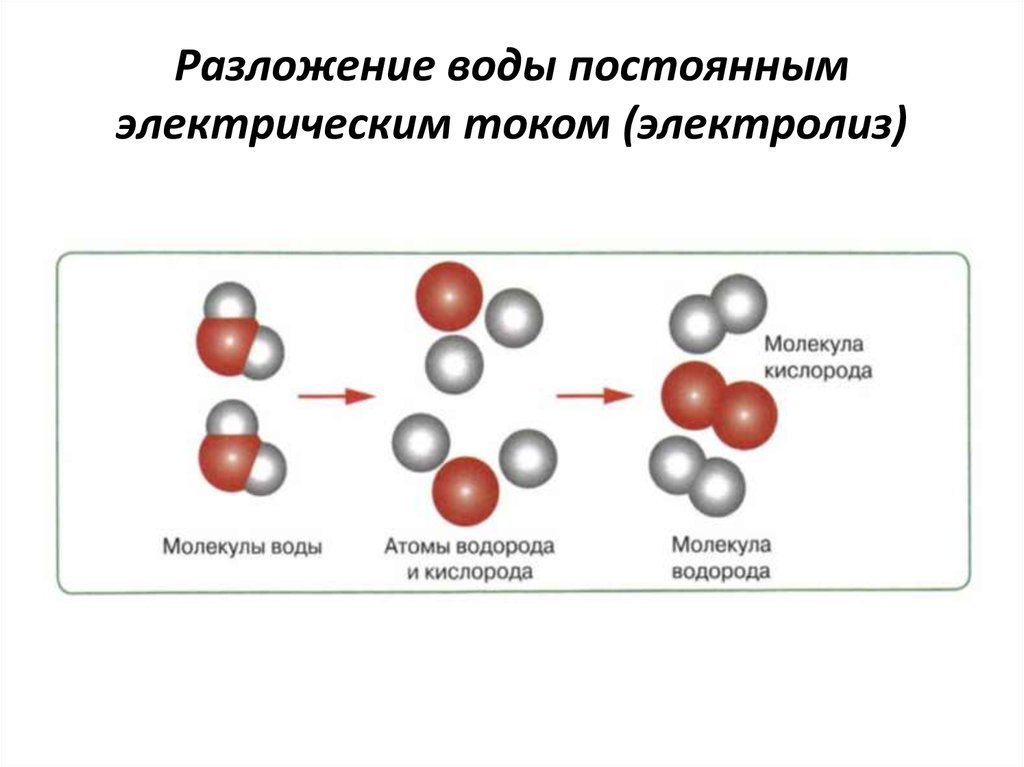
Мэйера доказал электролиз воды
( если взять постоянный импульс с частотой 923 гЦ для щелочной вод и для дистиллированной 926 КгЦ две трубки с зазором между ними 1 мм и подать и на плюс наружной трубки плюс, а на иную внутренней минус, то на минусе будет выделяться водород. а на плюсе кислород).
Подобным образом, аномальные и нестандартные свойства воды играют главную роль в ее многообразном взаимном действии с живой и неживой природой. Эти все оригинальные специфики параметров воды настолько «удачны» для всего живого, что выполняет воду незаменяемой основой существования жизни на Земля.
ГЕНЕРАТОР ВОДОРОДА своими руками. Производит водород отдельно от кислорода.
Нанокремний быстро расщепляет воду без света, тепла и электричества
Иллюстрация междисциплинарного подхода к производству водорода путем окисления кремния. Подход включает в себя синтез наночастиц кремния, реакцию кремний-вода, которая генерирует водород по требованию, и использование водорода в топливных элементах для портативных источников энергии. Авторы и права: Фоларин Эрогбогбо и др. ©2013 Американское химическое общество
Подход включает в себя синтез наночастиц кремния, реакцию кремний-вода, которая генерирует водород по требованию, и использование водорода в топливных элементах для портативных источников энергии. Авторы и права: Фоларин Эрогбогбо и др. ©2013 Американское химическое общество Исследователи Фоларин Эрогбогбо из Университета Буффало и соавторы опубликовали свою статью об использовании нанокремния для производства водорода в недавнем выпуске Nano Letters .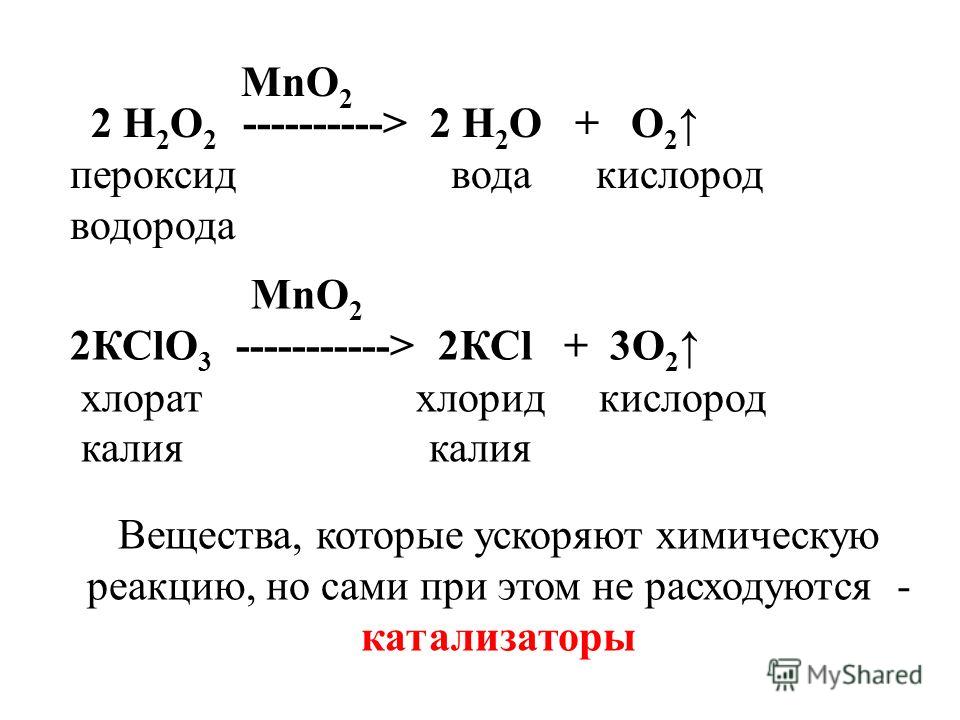
Если водород когда-либо будет использоваться для производства энергии для широкого коммерческого применения, одним из требований является поиск быстрого и недорогого способа производства водорода. Одним из наиболее распространенных способов получения водорода является расщепление воды на водород и кислород. Существует несколько способов расщепления воды, например, с помощью электрического тока (электролиз), нагревания, солнечного света или вещества, химически вступающего в реакцию с водой. К таким веществам относятся алюминий, цинк и кремний.
Как объяснили ученые, реакции окисления кремния и воды до сих пор были медленными и неконкурентоспособными по сравнению с другими методами расщепления воды. Тем не менее, у кремния есть некоторые теоретические преимущества, такие как распространенность, простота транспортировки и высокая плотность энергии. Далее, при окислении водой кремний теоретически может выделять два моля водорода на моль кремния, или 14% от собственной массы в водороде.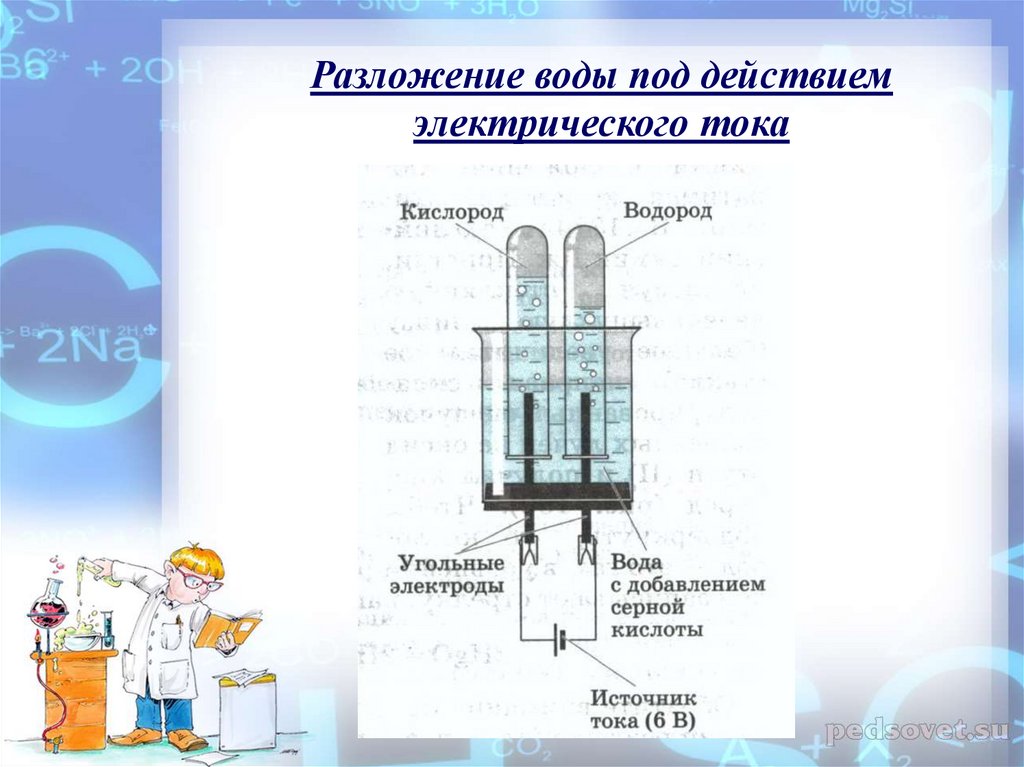
По этим причинам ученые решили более внимательно изучить кремний, а именно наночастицы кремния, которые ранее не изучались для получения водорода. Поскольку наночастицы кремния имеют большую площадь поверхности, чем более крупные частицы или объемный кремний, можно было бы ожидать, что наночастицы могут генерировать водород быстрее, чем более крупные кусочки кремния.
Но улучшения, обнаруженные учеными с помощью кремниевых наночастиц, намного превзошли их ожидания. Реакция частиц кремния размером 10 нм с водой произвела в общей сложности 2,58 моля водорода на моль кремния (даже превысив теоретические ожидания), при этом для получения 1 ммоль водорода потребовалось 5 секунд. Для сравнения, реакция с частицами кремния размером 100 нм дает в общей сложности 1,25 моля водорода на моль кремния, при этом на получение каждого ммоль водорода уходит 811 секунд. Для объемного кремния общее производство составляло всего 1,03 моль водорода на моль кремния, при этом на производство каждого ммоль водорода уходило полных 12,5 часов.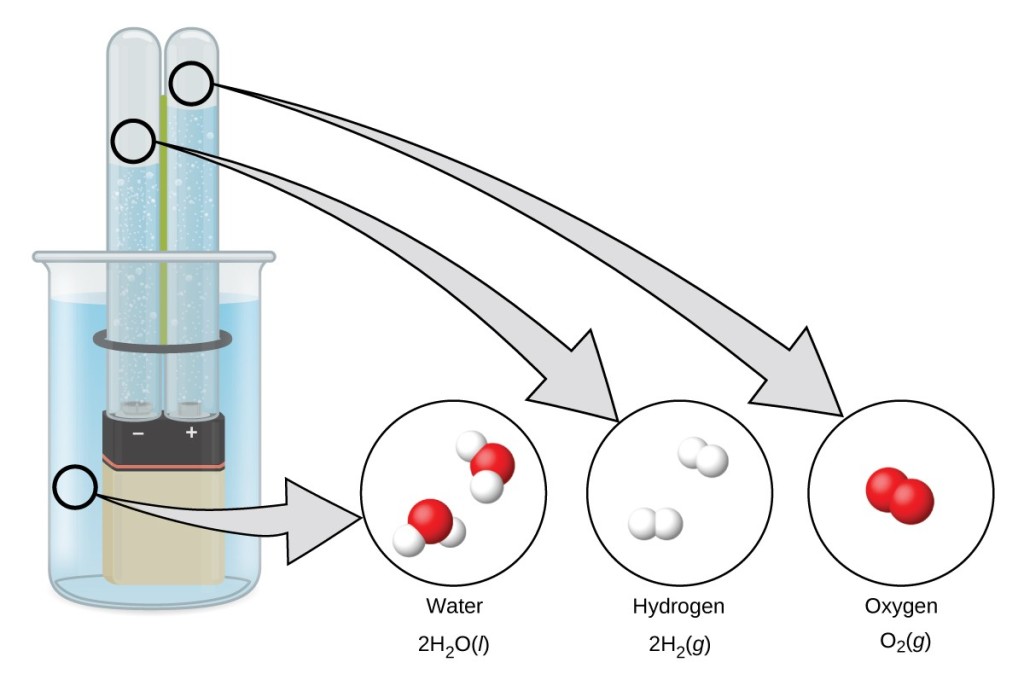
«Я считаю, что величайшее значение этой работы — демонстрация того, что кремний может реагировать с водой достаточно быстро, чтобы иметь практическое применение для производства водорода по запросу», — соавтор Марк Суихарт, профессор химической и биологической инженерии в Университете Буффало. , сообщил Phys.org . «Этот результат был как неожиданным, так и потенциально важным с практической точки зрения. Хотя я не верю, что окисление наночастиц кремния станет реальным методом для крупномасштабного производства водорода в ближайшее время, этот процесс может быть весьма интересен для небольших портативных приложений, где вода есть».
Сравнение скоростей генерации водорода для различных форм кремния. Максимальные ставки указаны в левой колонке с изображениями образцов на них. Средние ставки указаны в правой колонке. Красная линия указывает максимальную зарегистрированную скорость образования водорода из алюминия.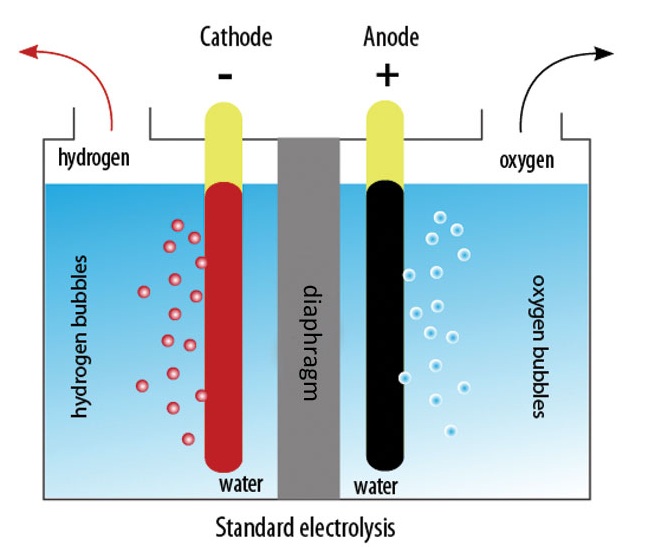
В дополнение к тому, что водород производится быстрее, чем более крупные кусочки кремния, 10-нм кремний также производит водород значительно быстрее, чем наночастицы алюминия и цинка. Как объяснил Суихарт, объяснение этого неравенства для двух материалов различается.
«По сравнению с алюминием кремний реагирует быстрее, потому что алюминий образует более плотный и прочный оксид (Al
Хотя большая площадь поверхности 10-нанометрового кремния по сравнению с более крупными кусочками кремния способствует высокой скорости производства водорода, одна только площадь поверхности не может объяснить огромное увеличение скорости, наблюдаемое учеными.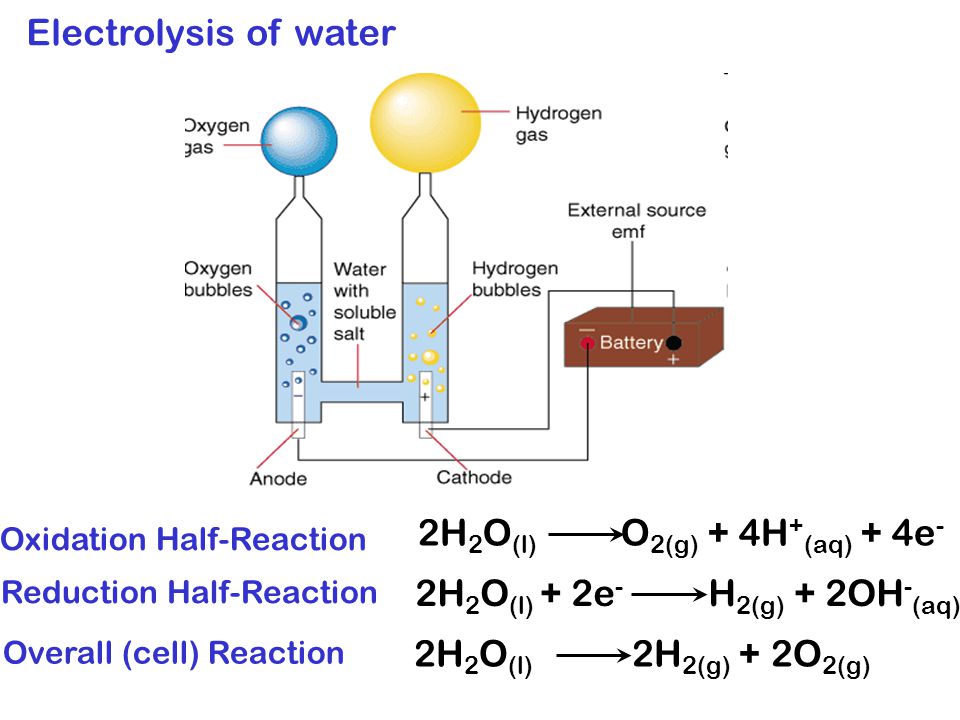
Чтобы понять, что вызывает гораздо большее увеличение скорости производства водорода, исследователи провели эксперименты в процессе травления кремния. Они обнаружили, что для частиц размером 10 нм травление включает удаление равного числа плоскостей решетки в каждом направлении (изотропное травление). Напротив, для частиц и микрочастиц размером 100 нм удаляется неравное количество плоскостей решетки в каждом направлении (анизотропное травление).
Исследователи связывают эту разницу в травлении с разной геометрией кристаллов разного размера. В результате этой разницы более крупные частицы принимают несферическую форму, которая обнажает менее реактивные поверхности по сравнению с более мелкими частицами, которые остаются почти сферическими, обнажая все грани кристалла для реакции. Более крупные частицы также образуют более толстые слои побочных продуктов окисления кремния, через которые должна диффундировать вода. Оба эти фактора ограничивают скорость реакции на более крупных частицах.
Оба эти фактора ограничивают скорость реакции на более крупных частицах.
Чтобы подтвердить, что 10-нм реакция кремний-вода генерирует водород без побочных продуктов, которые могли бы помешать приложениям, исследователи использовали водород, генерируемый кремнием, для работы топливного элемента. Топливный элемент работал очень хорошо, производя больше тока и напряжения, чем теоретическое количество чистого водорода, что связано с тем, что 10-нм частицы генерировали больше водорода, чем теоретические 14 мас.%.
Исследователи надеются, что эта удивительная способность кремниевых наночастиц быстро расщеплять воду и генерировать водород может привести к разработке технологии получения водорода по требованию, которая позволит использовать топливные элементы в портативных устройствах. Эта технология потребует крупномасштабного энергоэффективного метода производства кремниевых наночастиц, но может иметь некоторые преимущества по сравнению с другими методами производства водорода.
«Ключевым преимуществом окисления кремния для производства водорода является его простота», — сказал Суихарт. «При таком подходе водород производится быстро, при комнатной температуре и без необходимости в каком-либо внешнем источнике энергии. Энергия, необходимая для производства водорода, эффективно хранится в кремнии. Вся энергия, необходимая для производства кремния, может быть обеспечена. в центральном месте, а затем кремний можно использовать в портативных устройствах.
«Ключевым недостатком окисления кремния является его относительная неэффективность. Энергозатраты, необходимые для создания наночастиц кремния, намного превышают энергию, доступную из водорода, который в конечном итоге производится. Для крупномасштабных приложений это будет проблемой. Для портативных приложений это не так. Например, стоимость электроэнергии от обычной бытовой батареи легко может быть в 10-100 раз выше, чем стоимость электроэнергии от коммунального предприятия, но батареи по-прежнему играют важную роль в нашей жизни». 0003
0003
В будущем исследователи планируют еще больше увеличить мощность производства водорода при окислении кремния, экспериментируя с различными смесями.
«Одним из направлений, которым мы сейчас занимаемся, является использование смесей наночастиц кремния с гидридами металлов, которые также реагируют с водой с образованием водорода», — сказал Суихарт. «Такие соединения, как гидрид лития и гидрид натрия, реагируют с водой с образованием основания (LiOH или NaOH), необходимого для катализа окисления кремния. Однако они могут слишком быстро реагировать с водой (взрывоопасно) и нестабильны на воздухе. Смешивание их с кремниевыми наночастицами или покрытие их кремниевыми наночастицами может служить как для сдерживания их реакционной способности, так и для увеличения способности системы генерировать водород за счет замены добавленного основания (например, KOH в опубликованной статье) материалом, который также генерирует водород».
Дополнительная информация: Фоларин Эрогбогбо и др.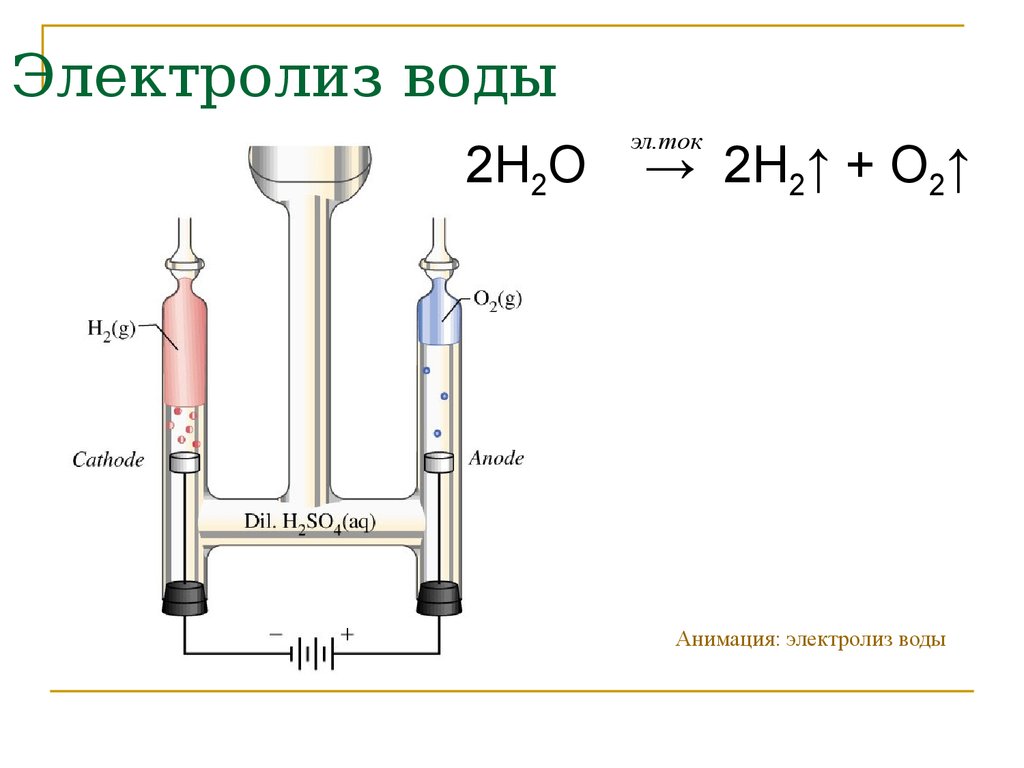 «Производство водорода по требованию с использованием нанокремния: расщепление воды без света, тепла или электричества». Нанобуквы . DOI: 10.1021/nl304680w
«Производство водорода по требованию с использованием нанокремния: расщепление воды без света, тепла или электричества». Нанобуквы . DOI: 10.1021/nl304680w
Copyright 2013 Phys.org
Все права защищены. Этот материал нельзя публиковать, транслировать, переписывать или распространять полностью или частично без письменного разрешения Phys.org.
Цитата : Нанокремний быстро расщепляет воду без света, тепла и электричества (2013, 24 января) получено 20 апреля 2023 г. с https://phys.org/news/2013-01-nanosilicon-rapidly-electricity.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Расщепление воды с помощью УФ-излучения теперь имеет почти 100% квантовую эффективность — ScienceDaily
Новости науки
от исследовательских организаций
- Дата:
- 3 июня 2020 г.

- Источник:
- Университет Шиншу
- Резюме:
- Ученые успешно разделили воду на водород и кислород, используя легкие и тщательно разработанные катализаторы, и они сделали это с максимальной эффективностью, то есть почти без потерь и нежелательных побочных реакций. Этот последний прорыв в производстве солнечного водорода делает вероятность масштабируемого и экономически жизнеспособного производства водорода более чем вероятным, прокладывая путь человечеству к переходу на чистую энергию.
- Поделиться:
Фейсбук Твиттер Пинтерест LinkedIN Электронная почта
ПОЛНАЯ ИСТОРИЯ
Налейте себе стакан воды и взгляните на него. Эта вода содержит обильный источник топлива, водород. Водород сгорает чисто, в отличие от энергетических продуктов на основе бензина. Звучит слишком хорошо, чтобы быть правдой? Ученые в Японии успешно разделили воду на водород и кислород, используя легкие и тщательно разработанные катализаторы, и они сделали это с максимальной эффективностью, то есть почти без потерь и нежелательных побочных реакций. Этот последний прорыв в производстве солнечного водорода делает вероятность масштабируемого и экономически жизнеспособного производства водорода более чем вероятным, прокладывая путь человечеству к переходу на чистую энергию.
Этот последний прорыв в производстве солнечного водорода делает вероятность масштабируемого и экономически жизнеспособного производства водорода более чем вероятным, прокладывая путь человечеству к переходу на чистую энергию.
реклама
Расщепление воды с использованием катализаторов и солнечного света, называемое фотокатализом, десятилетиями было многообещающим методом получения солнечного водорода. Однако большинство предыдущих попыток давали только внешнюю квантовую эффективность менее примерно 50%, что представляет собой сложность разработки эффективного катализатора для реального использования. Катализатор нужно было разработать лучше, чтобы каждый поглощенный фотон от источника света использовался для производства водорода. Ключом к повышению эффективности было стратегическое размещение сокатализаторов и предотвращение дефектов в полупроводнике.
Опубликовано в выпуске Nature от 27 мая, Tsuyoshi Takata of Shinshu University et al. открыла новые горизонты в производстве электроэнергии, используя титанат стронция, легированный алюминием, в качестве фотокатализатора, свойства которого были тщательно изучены и, следовательно, лучше всего изучены.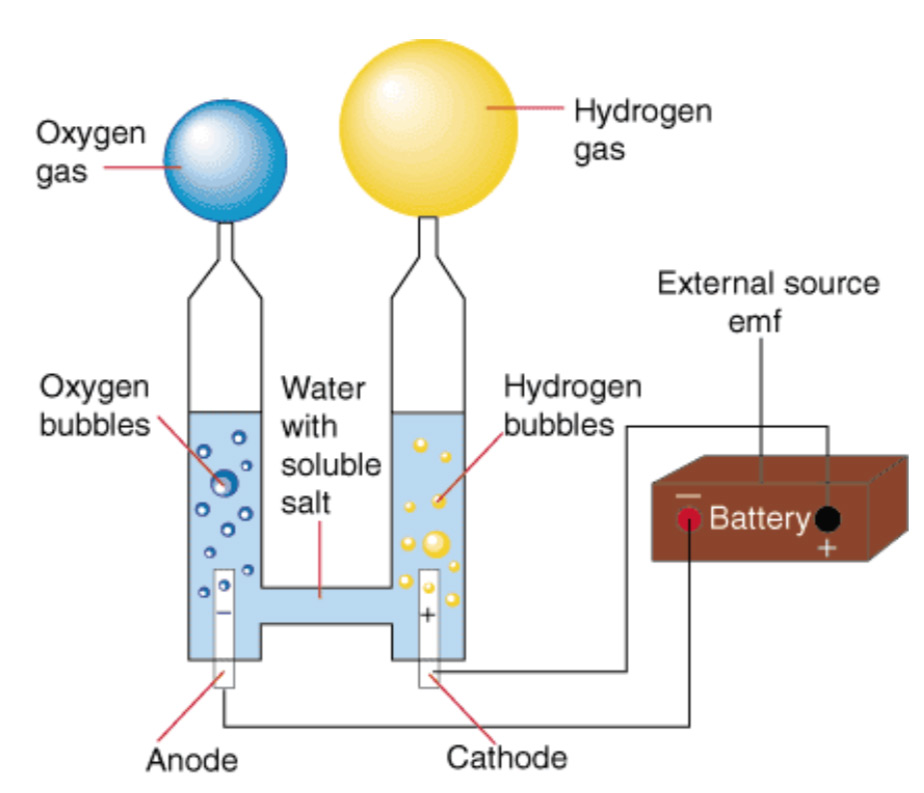 Они выбирают сокатализаторы родий для водорода с оксидом хрома и оксид кобальта для кислорода, настраивая их так, чтобы они участвовали только в желаемых реакциях. Этот метод позволил избежать рекомбинационных потерь в реакции.
Они выбирают сокатализаторы родий для водорода с оксидом хрома и оксид кобальта для кислорода, настраивая их так, чтобы они участвовали только в желаемых реакциях. Этот метод позволил избежать рекомбинационных потерь в реакции.
Эти новые открытия открывают двери для создания масштабируемого и экономически жизнеспособного производства солнечного водорода. Их стратегии проектирования позволили уменьшить дефекты, что привело к почти идеальной эффективности, и полученные знания будут применяться к другим материалам с интенсивным поглощением видимого света. Необходима дополнительная работа, прежде чем мы сможем запускать наши автомобили на водороде, потому что это исследование было сосредоточено на использовании ультрафиолетового света, а обильный видимый свет от солнца остался неиспользованным. Однако этот великий прорыв сделал эту возможность уже не слишком хорошей, чтобы быть правдой, но в теории это всего лишь вопрос времени. Надеемся, что это побудит ученых, исследователей и инженеров заняться этой областью, что значительно приблизит использование солнечной водородной энергии.
реклама
История Источник:
Материалы предоставлены Университетом Шиншу . Примечание. Содержимое можно редактировать по стилю и длине.
Справочник журнала :
- Цуёси Таката, Цзюньчжэ Цзян, Ёсихиса Саката, Мамико Накабаяси, Наоя Сибата, Викас Нандал, Казухико Секи, Такаси Хисатоми, Казунари Домен. Фотокаталитическое расщепление воды с квантовой эффективностью почти единица . Природа , 2020; 581 (7809): 411 DOI: 10.1038/s41586-020-2278-9
Цитировать эту страницу :
- MLA
- АПА
- Чикаго
Университет Шиншу. «Солнечное производство водорода: разделение воды с помощью УФ-излучения теперь имеет почти 100% квантовую эффективность». ScienceDaily. ScienceDaily, 3 июня 2020 г.


 Единственное вещество, какое будет попадать в атмосферу – это пар, являющийся водой в газообразном состоянии.
Единственное вещество, какое будет попадать в атмосферу – это пар, являющийся водой в газообразном состоянии.