«Можно ли искусственно создать воду?» — Яндекс Кью
Популярное
Сообщества
НаукаТеория науки+2
Анонимный вопрос
·
13,2 K
Ответить2УточнитьНиколай Панасецкий
Физика
4,3 K
Инженер-энергетик · 25 окт 2017 ·
gopak_shaman
Можно просто поджечь водород на воздухе.
На воздухе водород образует так называемый гремучий газ — смесь водорода с кислородом.
В итоге получаем воду и кучу энергии:
2h3+O2=2h3O
www.youtube.com/embed/nJK85-lPoO4?wmode=opaque
Пока Живой
24 февраля 2019
Вам формулу воды напомнить???
Задача получить воду а не «Тяжёлую воду».
Комментировать ответ…Комментировать…
Хомак Лев
4,4 K
Биология как хобби, научный подход как правило. · 25 окт 2017
Нет. Искусственно воду создать нельзя. Потому что я не могу придумать искусственный процесс, которым можно создать воду. Естественных процессов, продуктом которого является вода — бессчетное множество. Вода не даром является одной из самых распространенных молекул во вселенной. Бросили палку в огонь? А куда она делась? Она сгорела, хорошо. Но вещество просто так не… Читать далее
Иван Смирнов
Lev Khomak ! Прекратите вы уже это мракобесие. Мало того, что сами не в курсе, пишите с ошибками пятиклассника… Читать дальше
Комментировать ответ…Комментировать…
Первый
Илья Боруха
4
Просто челодой меловек · 31 янв 2021
Теоретически, сделать воду должно быть легко. Надо лишь взять два атома водорода и соединить с атомом кислорода — разве это может быть сложно? Оказывается, может — и даже очень.
Просто смешав водород с кислородом, воду вы не получите — для того, чтобы их соединить, нужна энергия. Проблема с добавлением в это уравнение энергии заключается в том, что масштабная химическая… Читать далее
Надо лишь взять два атома водорода и соединить с атомом кислорода — разве это может быть сложно? Оказывается, может — и даже очень.
Просто смешав водород с кислородом, воду вы не получите — для того, чтобы их соединить, нужна энергия. Проблема с добавлением в это уравнение энергии заключается в том, что масштабная химическая… Читать далее
Комментировать ответ…Комментировать…
Rost Zemlinsky
-3
8 апр 2019
После Большого Взрыва, атомы водорода и кислорода должны были как-то собраться в странную формулу h3O. Вопрос стоит, ученые в лаборатории могут повторить этот процесс? Идея залета астероидов, которые принесли на Землю воду, совершенно не объясняет процесс ее происхождения, собственно как и разумной жизни (инопланетяне переселились)).
Черняк А.
15 февраля 2020
Так это вы мрокобесничаете, дайте ответ, можно или нет?
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Расщепление воды – Наука – Коммерсантъ
3K
1 мин.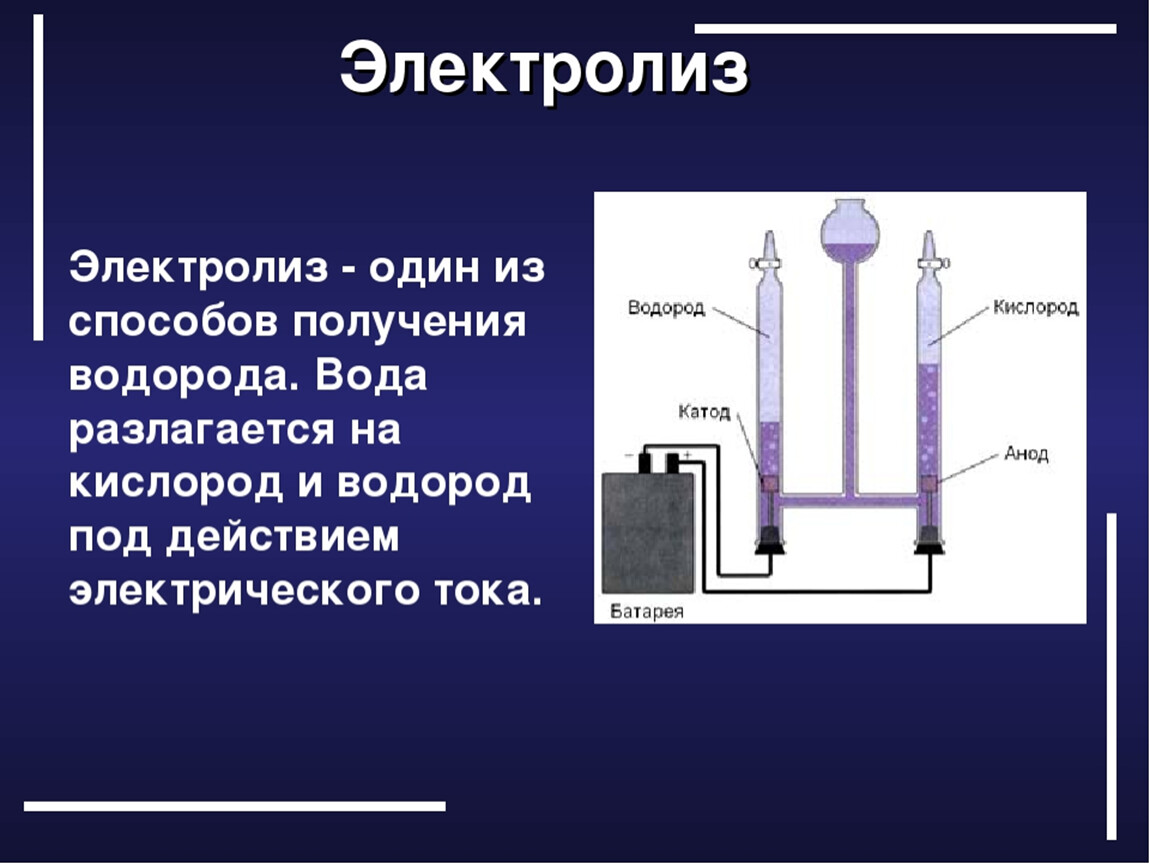
Опыт Карлайла и Николсона был простым, как все гениальное. Чуть раньше в том же 1800 году итальянец Вольта сделал первую в истории человечества химическую батарейку — вольтов столб из сложенных поочередно в столбик кружочков меди и цинка с прокладками между ними из сукна, смоченного в соленой воде. Карлайл и Николсон проводки от вольтова столба опустили в воду. На них образовались пузырьки газа, на одном проводке — водорода, а другом — кислорода.
Предыдущая фотография
Фото: Henry Bone
Фото:
T.
Следующая фотография
1 / 2
Фото: Henry Bone
Фото: T. Blood
Оценить всю глубину своего открытия Карлайл и Николсон не смогли и, соответственно, не сумели извлечь из него все крывшиеся в нем научные дивиденды.
Поначалу все были загипнотизированы самим фактом того, что электричество способно менять природу материи, на детали опыта всеобщий восторг не распространялся. Эти детали исследовали уже другие ученые, и в отличие от Карлайла и Николсона они остались в истории науки авторами фундаментальных открытий.
Первым был химик Хэмфри Дэви, который, неоднократно повторяя опыт и каждый раз получая из воды только водород и кислород, стал первооткрывателем химического состава воды. Он же, пропуская ток через растворы разных солей, получил на электродах химические элементы калий, натрий, магний, стронций, барий, кальций, бор и хлор. Открыл их!
Повторяя опыт Карлайла и Николсона, Гей-Люссак открыл закон объемных отношений газов, а Авогадро — свой «закон Авогадро». В конце концов, Берцелиус окончательно определил формулу воды Н2О. А Майкл Фарадей сформулировал законы электролиза — того явления, которое открыли Карлайл и Николсон в своем опыте и без которого немыслима современная промышленность.
В конце концов, Берцелиус окончательно определил формулу воды Н2О. А Майкл Фарадей сформулировал законы электролиза — того явления, которое открыли Карлайл и Николсон в своем опыте и без которого немыслима современная промышленность.
О них же самих сегодня никто не помнит, хотя последние лет тридцать их опыт во всевозможных вариантах со всевозможными катализаторами с упорством маньяков воспроизводят тысячи химиков по всему миру, пытаясь экономически рентабельно разложить воду на водород и кислород, чтобы создать водородный двигатель для автомобиля. А когда эта задача будет решена, о Карлайле и Николсоне опять «первооткрыватели» топлива из воды вряд ли вспомнят.
Сергей Петухов
Картина дня
Ученые открыли новый способ получения воды
Университет Иллинойса Урбана-Шампейн
Фото Л. Брайана Штауффера
Брайана ШтауффераШАМПЕЙН, Иллинойс — В знакомой школьной демонстрации химии преподаватель сначала использует электричество, чтобы разделить жидкую воду на составляющие ее газы, водород и кислород. Затем, объединив два газа и воспламенив их искрой, инструктор превращает газы обратно в воду с громким хлопком.
Ученые из Университета Иллинойса открыли новый способ приготовления воды, причем без шипучки. Мало того, что они могут производить воду из необычных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
«Мы обнаружили, что нетрадиционные гидриды металлов можно использовать для химического процесса, называемого восстановлением кислорода, который является неотъемлемой частью процесса производства воды», — сказал Захария Хейден, докторант и ведущий автор статьи, принятой к публикации в в журнале Американского химического общества и размещены на его веб-сайте.
Молекула воды (ранее известная как монооксид дигидрогена) состоит из двух атомов водорода и одного атома кислорода.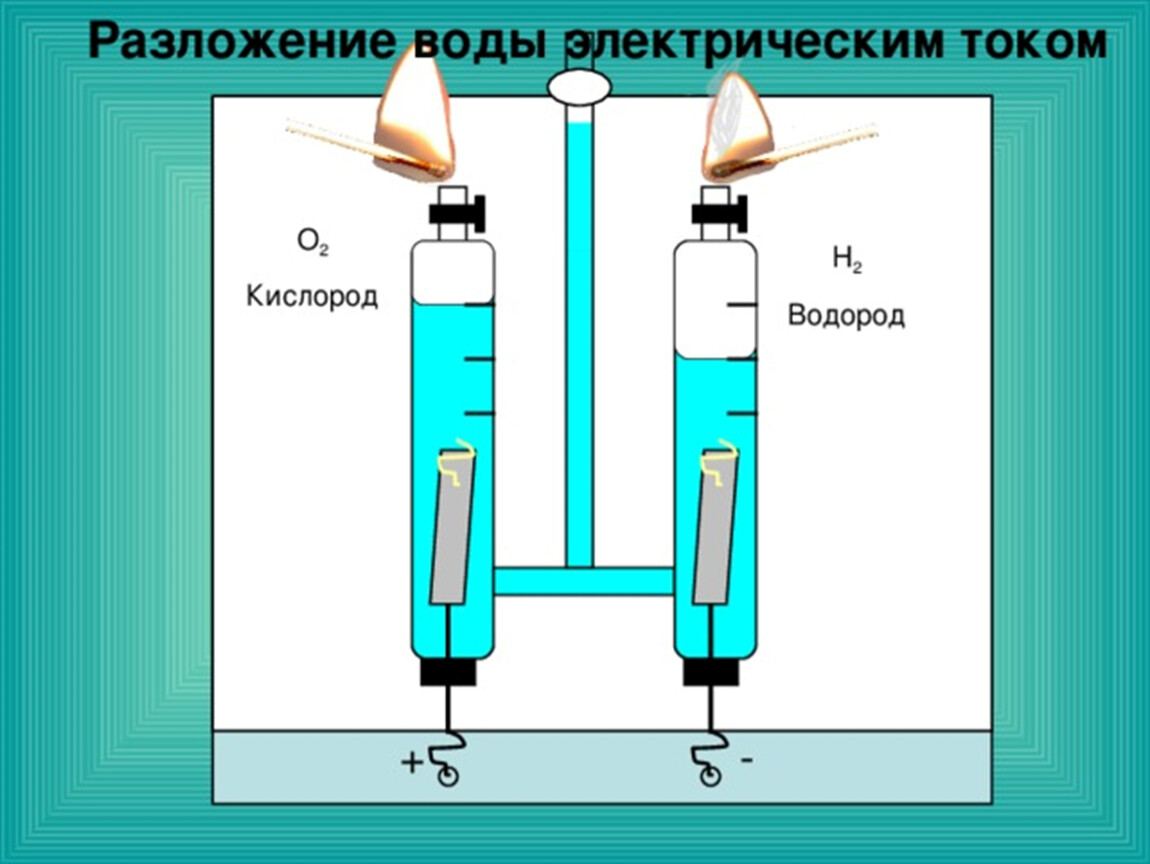 Но вы не можете просто взять два атома водорода и приклеить их к атому кислорода. Реальная реакция образования воды немного сложнее: 2ч3 + О2 = 2ч3О + Энергия.
Но вы не можете просто взять два атома водорода и приклеить их к атому кислорода. Реальная реакция образования воды немного сложнее: 2ч3 + О2 = 2ч3О + Энергия.
Уравнение на английском языке гласит: Чтобы получить две молекулы воды (h3O), две молекулы двухатомного водорода (h3) должны быть соединены с одной молекулой двухатомного кислорода (O2). Энергия будет высвобождаться в процессе.
«Эта реакция (2h3 + O2 = 2h3O + Energy) известна уже два столетия, но до сих пор никто не заставил ее работать в гомогенном растворе», — сказал Томас Раухфус, профессор химии и соответствующий автор статьи.
Хорошо известная реакция также описывает то, что происходит внутри водородного топливного элемента.
В типичном топливном элементе двухатомный водород входит в одну сторону элемента, двухатомный кислород входит в другую сторону. Молекулы водорода теряют свои электроны и становятся положительно заряженными в результате процесса, называемого окислением, в то время как молекулы кислорода получают четыре электрона и становятся отрицательно заряженными в результате процесса, называемого восстановлением. Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и высвобождая электрическую энергию.
«Трудной стороной» топливного элемента является реакция восстановления кислорода, а не реакция окисления водорода, сказал Раухфус. «Однако мы обнаружили, что новые катализаторы для восстановления кислорода могут также привести к новым химическим средствам для окисления водорода».
Rauchfuss и Heiden недавно исследовали относительно новое поколение катализаторов гидрогенизации с переносом для использования в качестве нетрадиционных гидридов металлов для восстановления кислорода.
В своей статье JACS исследователи сосредоточились исключительно на окислительной активности катализаторов гидрирования переноса на основе иридия в гомогенном неводном растворе. Они обнаружили, что комплекс иридия влияет как на окисление спиртов, так и на восстановление кислорода.
«Большинство соединений реагируют либо с водородом, либо с кислородом, но этот катализатор реагирует и с тем, и с другим», — сказал Хайден.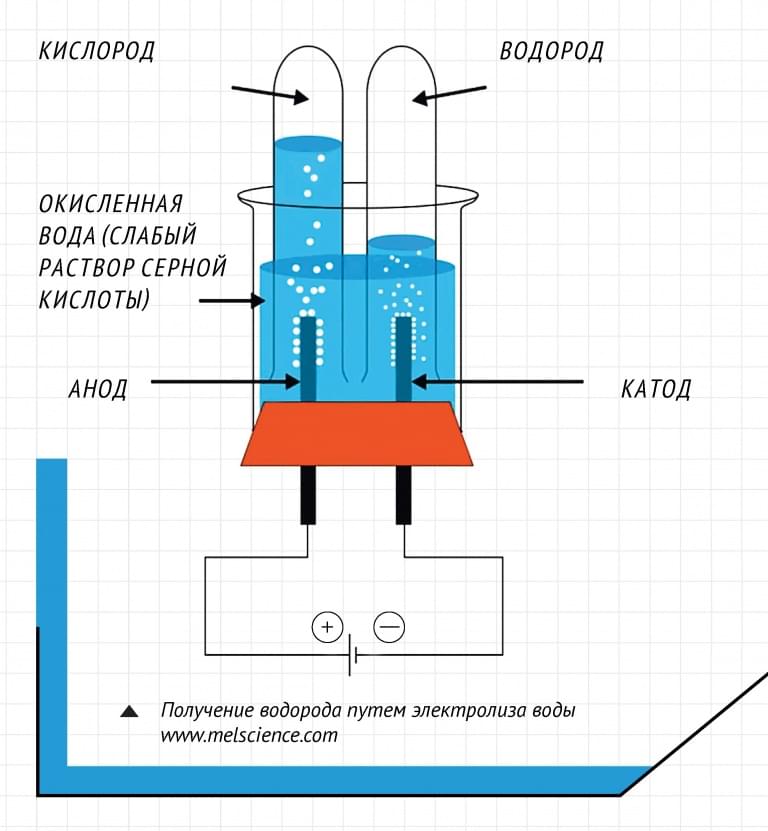 «Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
«Он реагирует с водородом, образуя гидрид, а затем реагирует с кислородом, образуя воду; и делает это в гомогенном неводном растворителе».
Новые катализаторы могут привести к разработке более эффективных водородных топливных элементов, что существенно снизит их стоимость, сказал Хейден.
Работа финансировалась Министерством энергетики США.
Чтобы связаться с Томасом Раухфусом, позвоните по номеру 217-333-7355; электронная почта: [email protected]
Чтобы связаться с Zachariah Heiden, позвоните по телефону 217-352-1559; электронная почта: [email protected]
Связанные лица
Похожие темы
- Факультет
- Неорганическая химия
Другие новости отдела
Свидлер привносит в CCIL опыт в области химических измерений отдельных клеток Онкологический центр в программе JumpStart штата Иллинойс. Он …
Читать полностью
Мэй Шен выбрана научным сотрудником Sloan Research Fellow 2023
Профессор химии Мей Шен входит в число 126 начинающих исследователей, получающих исследовательские стипендии Слоана 2023 года от Фонда Альфреда П.
 Слоана.
Слоана.Читать полностью
Лиза Ольшанский выбрана научным сотрудником Кавли Национальной академии наук
Профессор Ольшанский примет участие в симпозиумах Национальной академии наук Кавли «Границы науки», которые объединяют ученых в возрасте 45 лет и моложе для участия в исключительных исследованиях в различных областях. дисциплины.
Читать полностью
ученых из Стэнфорда обнаружили, что вода может превращаться в перекись водорода при конденсации на холодных поверхностях
23 ноября 2020 г.Исследовательская группа из Стэнфорда, которая недавно обнаружила неожиданное новое химическое поведение воды, когда крошечные капельки образуются из водяного пара, распространила свои выводы на естественную повседневную конденсацию воды.
Адам Хадхази
В жидкой форме, будь то в ванне или океане, вода является относительно безвредным веществом с небольшой химической активностью. Но в масштабе крошечных капелек вода может стать удивительно реактивной, как обнаружили исследователи из Стэнфорда.
Но в масштабе крошечных капелек вода может стать удивительно реактивной, как обнаружили исследователи из Стэнфорда.
На фото конденсат микрокапель воды, образовавшийся на поверхности стеклянного сосуда с холодной водой (слева), и изображение микрокапель воды, образовавшихся на полированной поверхности кремния (справа). (Изображение предоставлено: Джэ Кё Ли и Хён Су Хан)
В микрокаплях воды шириной всего в миллионные доли метра часть присутствующих молекул H 2 O может превращаться в близкого химического родственника, перекись водорода, H 2 O 2 , агрессивное химическое вещество, обычно используемое в качестве дезинфицирующее и отбеливающее средство для волос.
Стэнфордские ученые впервые сообщили об этом неожиданном поведении микрокапель воды, распыленных с применением силы, в прошлом году. Теперь в новом исследовании исследовательская группа показала, что такая же трансформация Джекила и Хайда происходит, когда микрокапли просто конденсируются из воздуха на холодные поверхности. Новые результаты показывают, что превращение воды в перекись водорода является общим явлением, происходящим в туманах, мгле, каплях дождя и везде, где микрокапли образуются естественным образом.
Новые результаты показывают, что превращение воды в перекись водорода является общим явлением, происходящим в туманах, мгле, каплях дождя и везде, где микрокапли образуются естественным образом.
Неожиданное открытие может привести к более экологичным методам дезинфекции поверхностей или стимулирования химических реакций. «Мы показали, что процесс образования перекиси водорода в каплях воды — широко распространенное и удивительное явление, которое происходит прямо у нас под носом», — сказал старший автор исследования Ричард Заре, профессор естественных наук и профессор химии Маргерит Блейк Уилбур. в Стэнфордской школе гуманитарных и естественных наук.
Исследователи также предполагают, что эта недавно обнаруженная химическая способность воды могла сыграть ключевую роль в запуске химии жизни на Земле миллиарды лет назад, а также в производстве первого атмосферного кислорода на нашей планете до возникновения жизни. «Это спонтанное производство перекиси водорода может быть недостающей частью истории о том, как формировались строительные блоки жизни на раннем этапе», — сказал Заре.
Соавторами нового исследования, опубликованного в журнале Proceedings of the National Academy of Sciences , являются штатные ученые из Стэнфорда Джэ Кью Ли и Хён Су Хан.
Вместе с Заре и другими коллегами из Стэнфорда Ли и Хан в прошлом году впервые открыли производство перекиси водорода в микрокаплях воды. По словам Заре, некоторые сторонние исследователи, изучавшие результаты исследования, скептически отнеслись к тому, что такое потенциально распространенное явление могло так долго оставаться незамеченным. Также последовали дебаты о том, как на самом деле образуется перекись водорода.
«Аргументом было то, что люди годами изучают водяные аэрозоли, и конечно вода вездесуща и интенсивно изучается с зари современной науки, так что если бы это образование перекиси водорода в микрокаплях было реальным, то наверняка кто-то бы это увидел уже, — сказал Заре. «Это привело к тому, что мы захотели глубже изучить это явление, посмотреть, при каких других обстоятельствах оно может произойти, а также узнать больше о фундаментальной химии».
Микрокапли сделаны другим способом
Zare и его коллеги решили исследовать конденсацию, сценарий, при котором микрокапли легко образуются естественным путем, без помощи внешней силы, такой как распылитель. Конденсация происходит, когда водяной пар (газ) в воздухе переходит в жидкость при контакте с более холодной поверхностью; например, когда зеркало в ванной запотевает после душа.
Команда из Стэнфорда превратила воду в несколько охлаждаемых материалов, включая кремний, стекло, пластик и металл. Затем исследователи протерли тест-полоску, которая меняет цвет в присутствии перекиси водорода, над конденсированной водой. Действительно, полоска стала синей. Небольшое, но поддающееся обнаружению количество образовавшегося перекиси водорода (порядка частей на миллион) варьировалось в зависимости от таких факторов, как температура поверхности и относительная влажность в испытательной камере. Исследователи также отметили, что перекись водорода, образующаяся в микрокаплях, разбавлялась по мере увеличения размера капель воды, что может объяснить, почему это химическое превращение так долго игнорировалось.
Новые эксперименты также подтверждают первоначальную гипотезу исследователей о том, как образуется перекись водорода. Они продемонстрировали, что сильное электрическое поле, генерируемое на границе раздела воды и воздуха, прямо на периферии микрокапли, по-видимому, активирует молекулы воды, образуя различные так называемые активные формы кислорода. Эти частицы представляют собой нестабильные молекулярные фрагменты, которые могут быстро реагировать с другими молекулами с образованием перекиси водорода.
Процесс всегда с нами и впереди нас
Химия такого рода на уровне микрокапель могла бы способствовать химическому переходу от неживого к жизни на Земле более четырех эонов назад, сказал Заре. Происхождение жизни связано с чем-то вроде дилеммы курицы или яйца, когда молекулы катализатора, ускоряющие химические реакции и необходимые для запуска химии жизни, в первую очередь требуют, чтобы сама жизнь создавала молекулы катализатора. Но естественное создание перекиси водорода могло вместо этого способствовать реакциям, ведущим к молекулярным строительным блокам, которые в конечном итоге собирались в сложные самовоспроизводящиеся объекты.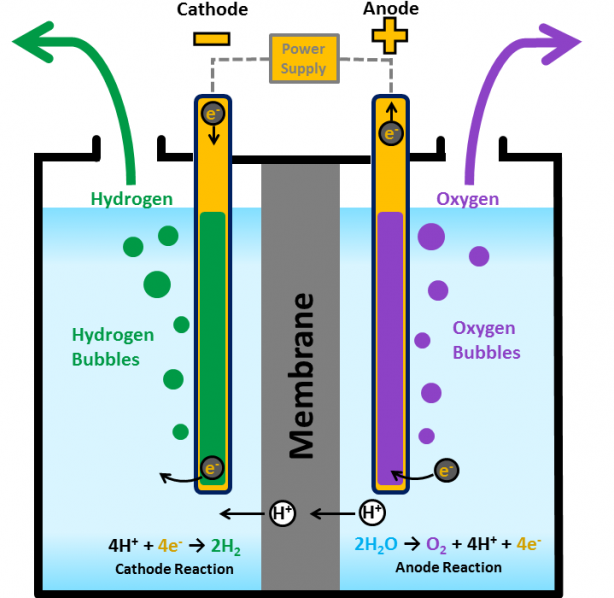
Заре предполагает, что эта древняя и широко распространенная химическая реакция могла даже обеспечить источник кислорода для ранней жизни (поскольку перекись водорода распадается на воду и молекулы кислорода) до появления организмов, которые могли сами производить кислород посредством фотосинтеза.
КомандаZare в настоящее время изучает, как производство перекиси водорода с помощью микрокапель можно использовать для очистки и дезинфекции. Одной интригующей возможностью, как предполагает Заре, является использование микрокапель и сопутствующих им H 9.0090 2 O 2 для устранения SARS-CoV-2 (вируса, вызывающего COVID-19) с поверхностей.
«С помощью этого нового исследования и нашей продолжающейся работы мы объясняем, как и почему капли воды так заметно отличаются от объемной воды с точки зрения химической реактивности», — сказал Заре. «Удивительно, что с точки зрения химии у воды все еще есть некоторые хитрости в рукаве».
Дополнительные авторы из Стэнфорда включают Роберта Уэймута , профессора химии Роберта Эклза Суэйна; Фриц Принц , профессор Леонардо и профессор машиностроения, материаловедения и инженерии; и аспиранты Сеттасит Чайкасетсин по машиностроению и Дэниел П.


 Слоана.
Слоана.