Модели молекул своими руками: Анкета исследования
- Укажите местоположение
Это поле обязательно для заполнения.
Перетащите маркер на карте, чтобы указать местоположение более точно.
Местоположение: ,
- Название вещества
В этой строке напишите название вещества, молекулы которого вы собираетесь моделировать, например, вода или аммиак, метан или бензол.

- Химическая формула вещества Запишите состав молекулы выбранного вами вещества в виде химической формулы. Сделайте фотографию записи и загрузите её в этом вопросе. Это поле обязательно для заполнения. Этот вопрос не является обязательным.
- Тип вещества
Принципиальных различий между органическими и неорганическими веществами нет.
 «Здесь, как и везде, разграничения и рубрики принадлежат не природе, не сущности, а человеческому суждению, которому они нужды для собственного удобства», – это сказал Александр Михайлович Бутлеров – создатель теории строения органических соединений.
Это поле обязательно для заполнения.
«Здесь, как и везде, разграничения и рубрики принадлежат не природе, не сущности, а человеческому суждению, которому они нужды для собственного удобства», – это сказал Александр Михайлович Бутлеров – создатель теории строения органических соединений.
Это поле обязательно для заполнения.- Органическое вещество
 В состав молекул всех органических веществ входит углерод. Уникальное свойство углерода образовывать цепочки из атомов даёт возможность образовывать огромное количество разнообразных соединений.
В состав молекул всех органических веществ входит углерод. Уникальное свойство углерода образовывать цепочки из атомов даёт возможность образовывать огромное количество разнообразных соединений. - Неорганическое вещество
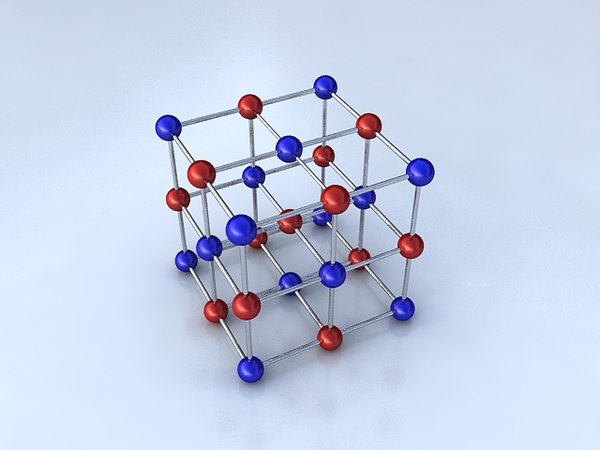
Большинство неорганических веществ имеет немолекулярное строение, поэтому они обладают высокими температурами плавления и кипения. Неорганические вещества не содержат углерода. К неорганическим веществам относятся: металлы (Ca, K, Na и др.

- Органическое вещество
- Структурная форма молекулы вещества
Структурная формула молекулы схематично изображает связи между атомами, но обычно не даёт информации о реальной форме молекулы. Это графическое изображение молекулы.
Нарисуйте структурную формулу молекулы выбранного вами вещества, сделайте фотографию или скан рисунка и загрузите полученное изображение в этом вопросе.
Это поле обязательно для заполнения.

Следует заполнить не меньше 1 изображений.
Требуется загрузить от 1 до 5 картинок.
Этот вопрос не является обязательным. - Фотография модели молекулы
Выберите материалы, которые помогут вам изготовить модель, передающую пространственную форму выбранной вами молекулы. Вы можете использовать специальные химические конструкторы, в состав которых входят шарики-атомы и палочки, моделирующие связи между ними. Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток.

- Описание строения молекулы
Опишите пространственное строение выбранной вами молекулы. Расскажите о том, как вы изготовили её модель и какие материалы при этом использовали.

- Относительная молекулярная масса молекулы
Посчитайте относительную молекулярную массу выбранного вами вещества.
Например, относительная молекулярная масса воды складывается из относительной атомной массы двух атомов водорода и относительной атомной массы атома кислорода:
2*1 + 16 = 18
Запишите подробный расчёт.
Это поле обязательно для заполнения.
Этот вопрос не является обязательным.

- Валентный угол Напишите, чему равен валентный угол между связями в молекуле. В это поле следует записать число Этот вопрос не является обязательным.
- Геометрическая конфигурация молекулы
Пространственная структура молекулы может напоминать определённую геометрическую фигуру.
Это поле обязательно для заполнения.
 Этот вопрос не является обязательным.
Этот вопрос не является обязательным. - Тип гибридизации
Гибридизация – это смешение орбиталей и выравнивание их по форме и энергии. Так, при смешении s- и p- орбиталей получаем тип гибридизации sp, s- и 2-х p-орбиталей – sp2, s- и 3-х p-орбиталей – sp3. Существуют и другие типы гибридизации, например, sp3d, sp3d2 и более сложные.
Это поле обязательно для заполнения.
Этот вопрос не является обязательным.

- Виды химической связи
Укажите, какие виды химической связи в вашей молекуле. Отметьте, если молекулы этого вещества включаются в дополнительные взаимодействия, как молекулы воды, в которой атомы водорода и кислорода связаны ковалентной полярной связью, а между молекулами существует водородная связь, влияющая на свойства этого вещества.
Это поле обязательно для заполнения.
- Ковалентная неполярная
Ковалентная неполярная связь возникает при образовании общих электронных пар и при перекрывании электронных облаков, равномерно расположенных между ядрами одноименных атомов.
 Она наблюдается в таких полимерно-кристаллических веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими свойствами.
Она наблюдается в таких полимерно-кристаллических веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими свойствами. - Ковалентная полярная
Ковалентная полярная связь возникает между атомами разных элементов. Возникающая область перекрывания электронных облаков смещена к более электроотрицательному элементу. Этот вид связи распространен в органических и элементорганических соединениях, имеющих связи C-O, C-H, C-N, C-S и другие.
- Ионная
Ионная связь характеризуется притяжением положительных и отрицательных ионов между собой.
 Обычно она возникает между металлами и неметаллами. Типичные ионные связи в щелочно-галоидных соединениях — NaCl
Обычно она возникает между металлами и неметаллами. Типичные ионные связи в щелочно-галоидных соединениях — NaCl - Донорно-акцепторная
Донорно-акцепторная связь. Характеризуется тем, что атомы примесей некоторых элементов отдают по одному электрону в кристаллическую решетку основного элемента. Такие атомы (имеющие пары электронов) называются донорами, а примесные атомы, которые захватывают электроны из основного элемента, называются акцепторами.
- Металлическая
У большинства металлов на внешней электронной оболочке малое число электронов (1, 2, 3) и большое число вакантных орбиталей.
 Поэтому энергетически выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в «электронный газ».
Поэтому энергетически выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в «электронный газ». - Межмолекулярная
Межмолекулярная связь (силы Ван-дер-Ваальса). Это наиболее общий вид связи. Характеризуется как силой притяжения молекул в веществе между собой, так и силой их отталкивания. При этом образуются молярные структуры (мицеллы, фибриллы, глобулы, микрокристаллы) за счет притяжения между низкомолекулярными и особенно высокомолекулярными молекулами, что имеет большое значение для диэлектрических, механических и физических свойств (прочность, твердость, эластичность, прозрачность, влагопроницаемость).
 Энергия Ван-дер-Ваальсовых взаимодействий невысока: от 10 до 60 кДж/моль.
Энергия Ван-дер-Ваальсовых взаимодействий невысока: от 10 до 60 кДж/моль.
- Ковалентная неполярная
- Мои расчёты
Напишите, как вы определили с помощью метода валентных связей тип гибридизации молекулы и её геометрическую структуру по методу Гиллеспи, чтобы ответить на вопросы 10 и 11.
Это поле обязательно для заполнения.
Этот вопрос не является обязательным.

- Отправить данные Сохранить и продолжить позже Удалить
- Укажите местоположение
Это поле обязательно для заполнения.
Протокол проведения исследования
- Выберите вещество, молекулярное строение которого вы собираетесь моделировать.
- Уточните название вещества.
- Запишите состав молекулы выбранного вами вещества в виде химической формулы. Сделайте фотографию (скан) записи, чтобы затем загрузить её в анкету проекта.
- Определите, к каким веществам относится выбранное вами вещество: к органическим или неорганическим.
- Подберите материалы и создайте модель вашей молекулы, передающую её пространственную структуру. Вы можете использовать специальные химические конструкторы, в состав которых входят шарики-атомы и палочки, моделирующие связи между ними.
 Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток. Вы можете даже собрать съедобную молекулу из фруктов или ягод!
Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток. Вы можете даже собрать съедобную молекулу из фруктов или ягод! - Сфотографируйте все этапы изготовления модели молекулы, а затем сделайте фотографии готовой модели с нескольких точек съёмки, чтобы хорошо было видно её пространственное строение.
- Заполните анкету проекта и опишите процесс изготовления модели. Таким образом вы примете участие в базовом варианте проекта.
- Если вы уже изучаете химию или просто интересуетесь ею, возможно, вы захотите ответить на дополнительные вопросы (более сложные).
- Посчитайте относительную молекулярную массу выбранного вами вещества.
- Нарисуйте структурную формулу молекулы выбранного вами вещества, сделайте фотографию или скан рисунка, чтобы разместить их в анкете проекта.
- Выясните величину валентного угла в молекуле.
- Определите тип химической связи.

- Выясните, какова гибридизация орбиталей.
- Определите геометрическую конфигурацию молекулы.
- Напишите, как вы определили с помощью метода валентных связей тип гибридизации молекулы и её геометрическую структуру по методу Гиллеспи.
- Заполните анкету полностью, включая необязательные вопросы, если вы выполняете более сложную версию проекта.
- Участвуйте в обсуждении результатов проекта.
Техника безопасности
Соблюдайте требования безопасности при работе с различными материалами и инструментами.
Бумажная модель ДНК (двойная спираль)
Из этой инструкции вы узнаете, как сделать модель днк из бумаги. Такую модель можно сделать для демонстрации на уроке биологии. Это не заняло много времени и принесло приятный результат.
Изготовление модели днк своими руками
Материалы
В любом случае вам потребуются:
• 1 лист бумаги 21 х 28 см
• Карандаш
• Линейка
Практически лист бумаги может быть любого размера. Лучше всего работается при ширине листа 20-22,5 см.
Лучше всего работается при ширине листа 20-22,5 см.
Использовать такую модель можно для занятного и недорогого изучения ДНК. Ученики усвоят, как четыре химических вещества (гуанин, аденин, тиамин и цитозин) объединяются в длинные сложные структуры для создания рабочего чертежа того, что делает клетка.
ПРИМЕЧАНИЕ: ДНК на фотографиях закручена влево. Как объяснили мне, фактически спираль ДНК направлена вправо. Именно из этого следует исходить, делая складки.
1. Примерно так выглядит конечный результат. Это можно сделать в цвете.
Шаг 1: Сделайте пометку в середине
Сделайте пометку в середине листа бумаги. На стандартном листе пометка будет примерно в 10,5 см от краев.
1. Это линия середины листа бумаги. Не обязательно делать сгиб по ней сейчас.
Шаг 2: Разметка сахаро-фосфатного остова
Отмеряем 1 см от каждого края и по 1 см с обеих сторон от средней линии. Эти линии ограничивают сахаро-фосфатный остов ДНК.
1. По 1 см от середины в каждую сторону
1. Вот что должно получиться.
Шаг 3: Разметка каждого азотистого основания
Теперь воспользуйтесь линейкой, чтобы провести линии через каждые 2,5 см поперек средней линии. Старайтесь провести их параллельно, иначе модель не получится.
Теперь проведите линии наискосок каждого получившегося у вас прямоугольника. Эти линии должны сойтись у середины, как буква «V». Посмотрите на снимке, как я случайно провел их неправильно.
Если вам хочется раскрасить модель, это нужно сделать именно в этом шаге. Просто разделите каждый прямоугольник пополам и раскрасьте их в соответствии с азотистыми основаниями.
Помните: аденин → тиамин, а гуанин → цитозин.
Чтобы раскрасить остов, разделите каждый участок по краям и в середине пополам и чередуйте черный и белый цвета.
1. По линии через каждые 2,5 см
1. Это нужно было сделать по-другому.
2. Это нужно было сделать по-другому.
Шаг 4: Сложите вдвое
Сложите просто прямо.
1. Сложено вдвое
Шаг 5: Отогните остов
Отогните края листа с обеих сторон, с одной — вверх, а с другой — вниз.
1. Вниз
2. Вверх
Шаг 6: Займитесь азотистыми основаниями
Отгибайте каждый прямоугольник назад по начерченным линиям. Лист должен свернуться в небольшую трубку.
1. Мило и кругло
Шаг 7: Прогните вверх
Прогибая, не слишком усердствуйте.
1. Смотри, прогнулось вверх!
Шаг 8: Согните по диагоналям
Согните назад по каждой диагональной линии. Сгибайте только диагонали прямоугольников. Модель должна скрутиться в спираль.
1. Согнуто назад
2. Согнуто по-другому
3. Не сгибайте дальше этой точки.
1. Заспиралило
Шаг 9: Сожмите модель ДНК
Бережно соберите всю модель, начиная сверху. Постарайтесь не смять ее! Сожмите , обязательно сгибая каждую складочку.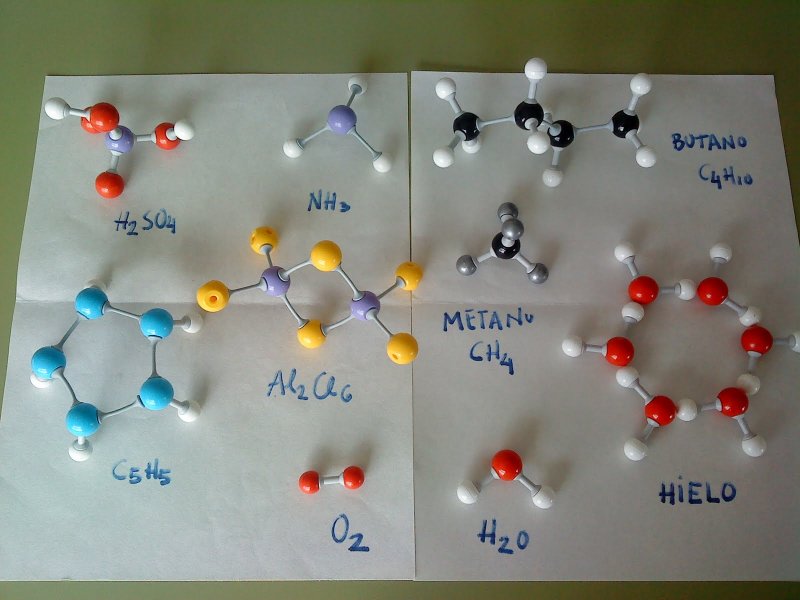
1. Полностью собрана
Шаг 10: Отпустите!
Отпустите сжатую полосу ДНК. Поздравляю! Вы у финиша!
1. Все сделано!
Шаг 11: Немного о ДНК
Для тех, кто не знает всех этих подробностей о ДНК.
ДНК означает дезоксирибонуклеиновая кислота. Она находится внутри ядрышка, которое является частью ядра эукариотических клеток. В прокариотических клетках ДНК свободно плавает из-за отсутствия в клетке мембраны.
Это рабочий чертеж для многого из того, что делает клетка. Каждый элемент ДНК называется нуклеотидом. Нуклеотид состоит из одной молекулы фосфата, одной молекулы сахара (деоксирибозы) и одного азотистого основания.
Существуют четыре типа азотистых оснований. Тиамин, аденин, гуанин и цитозин.
Тиамин соединяется только с аденином.
Цитозин соединяется только с гуанином. Особый порядок азотистых оснований определяет, что создает спираль.
Сахар (деоксирибоза) и фосфат образуют сахаро-фосфатный остов.
Причина закручивания ДНК — это способ соединения трех компонентов в нуклеотид. Совершенства в природе, как правило, нет, и трем компонентам для образования связи приходится перекрутиться.
1. Эта химическая структура изменяется в зависимости от типа азотистого основания.
Как построить молекулярную модель – DIY
DIY традиционно означает «сделай сам» и относится к культуре строительства или создания вещей, которые можно купить. На DIY.org мы даем несколько более широкое определение «сделай сам».
Наша миссия — создать безопасное интернет-сообщество, которым дети смогут пользоваться самостоятельно, без присмотра родителей, — место, где они смогут «сделать это сами». В этом сообществе мы поощряем их создавать, делиться и взаимодействовать друг с другом по общим интересам, не опасаясь негатива, запугивания или хищнического поведения, ограничивающих их. Для нас «сделай сам» означает расширение возможностей. С помощью нашего бесплатного сайта и приложения мы надеемся дать миллионам детей по всему миру возможность стать творцами, строителями и, самое главное, ответственными гражданами мира.
DIY идеально подходит для детей в возрасте от 6 до 13 лет. Учитывая, что это одни из самых важных лет развития, мы пытаемся затронуть как можно больше детей с положительным содержанием и практическим обучением.
Мы стремимся поощрять развитие навыков, воспитывая здоровый дух соперничества и создавая сообщество активных, уверенных в себе, стремящихся к обучению и, прежде всего, добрых детей. Мы надеемся, что эти дети станут взрослыми, обладающими такими же качествами.
Вы можете создать свой профиль DIY на https://diy.org/register. Единственные данные, которые нам нужны, это ваше имя, день рождения и адрес электронной почты. Если у вас есть приложение «Сделай сам», вы можете использовать его для создания своего профиля.
Чтобы взаимодействовать и делиться на DIY, дети должны подтвердить свою учетную запись DIY. Проверка — это способ получить согласие родителей в соответствии с COPPA. После подтверждения своей учетной записи дети могут:
 Вот несколько рекомендаций по созданию видео для проверки:
Вот несколько рекомендаций по созданию видео для проверки:После успешной загрузки видео проверка занимает до 72 часа. В это время мы проверяем видео, чтобы подтвердить согласие родителей, а также проверить возраст мастера. Это помогает нам защитить DIY от злоумышленников.
Мы стремимся поощрять развитие навыков, воспитывая здоровый дух соперничества и создавая сообщество активных, уверенных в себе, стремящихся к обучению и, прежде всего, добрых детей. Мы надеемся, что эти дети станут взрослыми, обладающими такими же качествами.
Если ваша проверка не удалась, возможно, ваше видео не соответствовало одному из этих требований.
 отправьте видео для проверки снова в любое время с помощью приложения DIY.
отправьте видео для проверки снова в любое время с помощью приложения DIY.4.1. Хиральность | Органическая химия 1: открытый учебник
Начните эту главу с просмотра этого видео, в котором дается обзор основных тем: Стереоизомеры — это изомеры, которые различаются пространственным расположением атомов, а не порядком соединения атомов. Один из наиболее интересных типов изомеров — стереоизомеры с зеркальным отображением, представляющие собой несовместимый набор из двух молекул, являющихся зеркальным отображением друг друга. Существование этих молекул определяется концепцией, известной как хиральность . Слово «хиральный» произошло от греческого слова «рука», потому что наши руки являются хорошим примером хиральности, поскольку они являются не накладываемыми друг на друга зеркальными отражениями. Обратимся теперь к концепции хиральности, открытой и исследованной Луи Пастером. Срок хиральный , от греческого слова «рука», относится ко всему, что не может быть наложено на собственное зеркальное отражение. Ваши руки, конечно, хиральны — вы не можете наложить левую руку на правую, и вы не можете втиснуть левую руку в правостороннюю перчатку (которая также является хиральным объектом). Другими словами, ваши руки не имеют зеркальной плоскости симметрии : вы не можете найти плоскость, которая делит вашу руку пополам таким образом, что одна сторона плоскости является зеркальным отражением другой стороны. Хиральные объекты не имеют плоскости симметрии .Ваше лицо, с другой стороны, ахирально – лишено хиральности – потому что, несмотря на некоторые небольшие отклонения, вы можете наложить свое лицо на его зеркальное отражение. Если бы кто-то показал вам фотографию вашего лица в зеркальном отображении, вы могли бы выровнять изображение, точка за точкой, с вашим настоящим лицом.
Обратимся теперь к концепции хиральности, открытой и исследованной Луи Пастером. Срок хиральный , от греческого слова «рука», относится ко всему, что не может быть наложено на собственное зеркальное отражение. Ваши руки, конечно, хиральны — вы не можете наложить левую руку на правую, и вы не можете втиснуть левую руку в правостороннюю перчатку (которая также является хиральным объектом). Другими словами, ваши руки не имеют зеркальной плоскости симметрии : вы не можете найти плоскость, которая делит вашу руку пополам таким образом, что одна сторона плоскости является зеркальным отражением другой стороны. Хиральные объекты не имеют плоскости симметрии .Ваше лицо, с другой стороны, ахирально – лишено хиральности – потому что, несмотря на некоторые небольшие отклонения, вы можете наложить свое лицо на его зеркальное отражение. Если бы кто-то показал вам фотографию вашего лица в зеркальном отображении, вы могли бы выровнять изображение, точка за точкой, с вашим настоящим лицом. Ваше лицо имеет плоскость симметрии, потому что левая сторона является зеркальным отражением правой стороны. Чего Пастер, Био и их современники еще не до конца поняли, когда Пастер сделал свое открытие молекулярной хиральности, так это источник хиральности на молекулярном уровне. Само собой разумелось, что хиральная молекула — это молекула, которая не содержит плоскости симметрии и, следовательно, не может быть наложена на свое зеркальное отражение. Теперь мы знаем, что хиральные молекулы содержат один или несколько хиральных центров , которые почти всегда представляют собой тетраэдрические ( sp 3 -гибридизированные) атомы углерода с четырьмя различными заместителями. Рассмотрим мультяшную молекулу А ниже: тетраэдрический углерод с четырьмя разными заместителями, обозначенными шариками четырех разных цветов (пока что не беспокойтесь о том, какими именно могут быть эти заместители — очень скоро мы увидим реальные примеры).
Ваше лицо имеет плоскость симметрии, потому что левая сторона является зеркальным отражением правой стороны. Чего Пастер, Био и их современники еще не до конца поняли, когда Пастер сделал свое открытие молекулярной хиральности, так это источник хиральности на молекулярном уровне. Само собой разумелось, что хиральная молекула — это молекула, которая не содержит плоскости симметрии и, следовательно, не может быть наложена на свое зеркальное отражение. Теперь мы знаем, что хиральные молекулы содержат один или несколько хиральных центров , которые почти всегда представляют собой тетраэдрические ( sp 3 -гибридизированные) атомы углерода с четырьмя различными заместителями. Рассмотрим мультяшную молекулу А ниже: тетраэдрический углерод с четырьмя разными заместителями, обозначенными шариками четырех разных цветов (пока что не беспокойтесь о том, какими именно могут быть эти заместители — очень скоро мы увидим реальные примеры). Зеркальное отражение А, которое мы будем называть Б, нарисовано в правой части рисунка, а воображаемое зеркало находится посередине. Обратите внимание, что каждая точка на A совпадает с той же точкой на B в зеркале: другими словами, если бы A посмотрела в зеркало, она увидела бы, что B смотрит назад.
Обратите внимание, что каждая точка на A совпадает с той же точкой на B в зеркале: другими словами, если бы A посмотрела в зеркало, она увидела бы, что B смотрит назад.
Теперь, если мы перевернем соединение A и попытаемся наложить его точку за точкой на соединение B, мы обнаружим, что не можем этого сделать: если мы наложим любые два цветных шара, то два других сместятся.
A не накладывается на свое зеркальное отображение (B), поэтому по определению A является хиральной молекулой. Отсюда следует, что B также не накладывается на своего зеркального отображения (A) и, таким образом, также является хиральной молекулой. Также обратите внимание на рисунок ниже (и убедитесь сами с помощью моделей), что ни A, ни B не имеют внутренней плоскости симметрии.
А и В представляют собой стереоизомеры : молекулы с одинаковой молекулярной формулой и одинаковым расположением связей, но с другим расположением атомов в пространстве . Существует два типа стереоизомеров: энантиомеры и диастереомеры. Энантиомеры представляют собой пары стереоизомеров, которые являются зеркальным отображением друг друга: таким образом, А и В являются энантиомерами. Должно быть самоочевидным, что хиральная молекула всегда будет иметь один (а только один) энантиомер: энантиомеры идут парами. Энантиомеры имеют одинаковые физические свойства (температура плавления, температура кипения, плотность и т. д.). Однако энантиомеры различаются по тому, как они взаимодействуют с поляризованным светом (мы скоро узнаем об этом больше), и они также могут совершенно по-разному взаимодействовать с другими хиральными молекулами, например с белками.
Энантиомеры представляют собой пары стереоизомеров, которые являются зеркальным отображением друг друга: таким образом, А и В являются энантиомерами. Должно быть самоочевидным, что хиральная молекула всегда будет иметь один (а только один) энантиомер: энантиомеры идут парами. Энантиомеры имеют одинаковые физические свойства (температура плавления, температура кипения, плотность и т. д.). Однако энантиомеры различаются по тому, как они взаимодействуют с поляризованным светом (мы скоро узнаем об этом больше), и они также могут совершенно по-разному взаимодействовать с другими хиральными молекулами, например с белками.
Диастереомеры представляют собой стереоизомеры, которые являются , а не зеркальными отображениями друг друга. Сейчас мы сконцентрируемся на понимании энантиомеров и вернемся к диастереомерам позже.
Мы определили хиральный центр как тетраэдрический углерод с четырьмя различными заместителями. Если вместо этого тетраэдрический углерод имеет два одинаковых заместителя (два черных атома на мультяшном рисунке ниже), то, конечно, он все же имеет зеркальное отражение ( все имеет зеркальное отображение, если только мы не говорим о вампире!) Однако , он накладывается на свое зеркальное отображение и имеет плоскость симметрии.
Эта молекула ахиральна (отсутствует хиральность). Используя те же рассуждения, мы можем видеть, что тригональный плоский ( sp 2 -гибридизированный) углерод также не является хиральным центром.
Обратите внимание, что структура E может быть наложена на F, ее зеркальное отображение — все, что вам нужно сделать, это взять E, перевернуть ее, и она будет такой же, как F. Эта молекула имеет плоскость симметрии и ахиральна.
Давайте применим наши общие рассуждения к реальным молекулам. Пока мы ограничим наше обсуждение молекулами с одним хиральным центром. Оказывается, винная кислота, предмет введения в нашу главу, имеет два хиральных центра , поэтому мы вернемся к этому позже.
Рассмотрим 2-бутанол, изображенный в двух измерениях ниже.
Углерод № 2 является хиральным центром: он sp 3 -гибридный и тетраэдрический (хотя выше он не изображен таким образом), и четыре вещи, связанные с ним, различны: водород, метил (- СН 3 ), этильную группу (-СН 2 СН 3 ) и гидроксильную (ОН) группу. Нарисуем склеивание на C 2 в трех измерениях и назовем эту структуру А. Мы также нарисуем зеркальное отражение А и назовем эту структуру В.
Нарисуем склеивание на C 2 в трех измерениях и назовем эту структуру А. Мы также нарисуем зеркальное отражение А и назовем эту структуру В.
Когда мы пытаемся наложить А на В, мы обнаруживаем, что не можем этого сделать. А и В являются хиральными молекулами и являются энантиомерами друг друга.
2-пропанол, в отличие от 2-бутанола, представляет собой , а не хиральную молекулу. Углерод № 2 связан с двумя идентичными заместителями (метальными группами), поэтому он не является хиральным центром.
Обратите внимание, что 2-пропанол накладывается на собственное зеркальное отражение.
Когда мы смотрим на очень простые молекулы, такие как 2-бутанол, нетрудно нарисовать зеркальное отражение и понять, что оно несовместимо. Однако с более крупными и сложными молекулами это может быть сложной задачей с точки зрения рисования и трехмерной визуализации. Самый простой способ определить, является ли молекула хиральной, — это просто посмотреть на наличие одного или нескольких хиральных центров: молекулы с хиральными центрами (почти всегда) будут хиральными. Мы вставляем здесь оговорку «почти всегда», потому что из этого правила можно сделать исключение.
Мы вставляем здесь оговорку «почти всегда», потому что из этого правила можно сделать исключение.
Вот еще один прием, облегчающий вашу стереохимическую жизнь: если вы хотите нарисовать энантиомер хиральной молекулы, нет необходимости утруждать себя рисованием зеркального отображения точка за точкой, как мы это делали до сих пор. в целях иллюстрации. Вместо этого сохраните углеродный скелет прежним и просто поменяйте местами сплошные и пунктирные клиновые связи в хиральном углероде: это приведет к тому же результату. Вы должны использовать модели, чтобы убедить себя в том, что это правда, а также убедить себя в том, что замена любые два заместителя у хирального углерода приведут к образованию энантиомера.
Вот еще четыре примера хиральных биомолекул, каждая из которых представлена парой энантиомеров с хиральными центрами, отмеченными красными точками.
Вот несколько примеров ахиральных биомолекул – убедитесь сами, что ни одна из них не содержит хирального центра:
При поиске хиральных центров важно осознавать, что вопрос о том, используется ли штриховая/сплошная линия клина, не имеет значения. Хиральные молекулы иногда рисуют без использования клиньев (хотя, очевидно, это означает, что стереохимическая информация опускается). И наоборот, клинья можно использовать на углях размером , а не хиральных центров — посмотрите, например, на рисунки глицина и цитрата на рисунке выше.
Хиральные молекулы иногда рисуют без использования клиньев (хотя, очевидно, это означает, что стереохимическая информация опускается). И наоборот, клинья можно использовать на углях размером , а не хиральных центров — посмотрите, например, на рисунки глицина и цитрата на рисунке выше.
Может ли хиральный центр быть чем-то иным, чем тетраэдрический углерод с четырьмя разными заместителями? Ответ на этот вопрос «да», однако эти альтернативные хиральные центры менее распространены и выходят за рамки нашего обсуждения здесь.
Вы, возможно, также задавались вопросом об аминах: не должны ли мы считать вторичный или третичный амин хиральным центром, поскольку они имеют тетраэдрическую форму и присоединены к четырем различным заместителям, если неподеленные пары электронов считаются «заместителями»? Иными словами, разве амин нельзя накладывать на свое зеркальное отражение?
Ответ: да, на статической картинке, но на самом деле азот амина быстро и обратимо инвертируется, или выворачивается наизнанку, при комнатной температуре.
Если вам сложно это представить, возьмите старый теннисный мяч и разрежьте его пополам. Затем возьмите одну из вогнутых половинок и выверните ее наизнанку, а затем обратно: это то, что делает амин. Конечным результатом является то, что два «энантиомера» амина на самом деле являются двумя быстро взаимопревращающимися формами одной и той же молекулы, и, таким образом, сам амин не является хиральным центром. Этот процесс инверсии делает , а не имеют место на тетраэдрическом углероде, который, конечно, не имеет неподеленной пары электронов.
Когда мы переходим к третьей строке в периодической таблице с такими элементами, как сера и фосфор, этот процесс перестановки неподеленных пар происходит намного медленнее, поэтому мы можем разделить энантиомеры для таких соединений, как фосфины (фосфорный аналог аминов).
Упражнения
1. Найдите все хиральные центры (их может быть больше одного в молекуле). Помните, что атомы водорода, связанные с углеродом, обычно не изображаются в линейной структуре, но они все еще там!
Показать раствор
2.
а) Нарисуйте два энантиомера i) мевалоната и ii) серина.
b) Являются ли две структуры 2-бутанола ниже энантиомеров?
Показать раствор
3. Обозначьте указанные ниже молекулы как хиральные или ахиральные и найдите все хиральные центры.
Показать решение
Видеоуроки Академии Хана
Основы хиральности
Стереоизомеры — это изомеры, которые различаются пространственным расположением атомов, а не порядком соединения атомов. Один из их наиболее интересных типов изомеров — стереоизомеры зеркального отображения, не накладывающийся набор двух молекул, которые являются зеркальным отображением друг друга. Существование этих молекул определяется концепцией, известной как хиральность . Слово «хиральный» произошло от греческого слова «рука», потому что наши руки представляют собой хороший пример хиральности, поскольку они являются несовместимыми зеркальными отображениями друг друга.
Существование этих молекул определяется концепцией, известной как хиральность . Слово «хиральный» произошло от греческого слова «рука», потому что наши руки представляют собой хороший пример хиральности, поскольку они являются несовместимыми зеркальными отображениями друг друга.
Введение
Противоположностью хирального является ахиральный . Ахиральные объекты накладываются друг на друга со своими зеркальными отображениями. Например, два листа бумаги ахиральны. Напротив, хиральные молекулы, такие как наши руки, не являются наложенными друг на друга зеркальными изображениями.
Постарайтесь идеально выровнять левую руку с правой так, чтобы обе ладони смотрели в одном направлении. Потратьте на это около минуты. Вы видите, что они не могут точно выстроиться в линию? То же самое относится и к некоторым молекулам.
Хиральная молекула имеет зеркальное отображение, которое не может идеально совпадать с ней — зеркальные изображения не накладываются друг на друга. Зеркальные изображения называются энантиомерами .
Зеркальные изображения называются энантиомерами .
Но чем так интересны хиральные молекулы? Хиральная молекула и ее энантиомер имеют одинаковые химические и физические свойства (температура кипения, точка плавления, полярность, плотность и т. д.). Оказывается, многие наши биологические молекулы, такие как ДНК, аминокислоты и сахара, являются хиральными молекулами.
Довольно интересно, что наши руки служат той же цели, но большинство людей могут писать только одной рукой. Точно так же это верно для хиральных биологических молекул и взаимодействий. Точно так же, как ваша левая рука не помещается должным образом в вашу правую перчатку, один из энантиомеров молекулы может не работать таким же образом в вашем теле. Это должно означать, что энантиомеры обладают свойствами, которые делают их уникальными для их зеркальных изображений. Одно из этих свойств заключается в том, что они не могут иметь план е симметрия или плоскость внутреннего зеркала. Итак, хиральная молекула не может быть разделена на две зеркальные половины. Еще одним свойством хиральных молекул является оптическая активность.
Итак, хиральная молекула не может быть разделена на две зеркальные половины. Еще одним свойством хиральных молекул является оптическая активность.
Свойства энантиомеров
Очень важно помнить о любой паре энантиомеров, что они будут иметь идентичные химические и физические свойства, за исключением знаков их оптических вращений, с одним важным условием: все свойства должны быть сравнение должно быть определено с использованием ахиральных реагентов в растворителе, состоящем из ахиральных молекул, или, короче говоря, в ахиральная среда . Таким образом, температуры плавления и кипения (но не оптическое вращение) [латекса] 5 [/латекса] и [латекса] 6 [/латекса] будут одинаковыми в ахиральной среде.
Как упоминалось ранее, хиральные молекулы очень похожи друг на друга, поскольку имеют одинаковые компоненты. Единственное, что явно отличается, это их расположение в пространстве. В результате этого сходства очень трудно отличить хиральные молекулы друг от друга, когда мы пытаемся сравнить их свойства, такие как температуры кипения, температуры плавления и плотности.
Однако мы можем различать их по оптической активности.
Оптическая активность
Хиральные молекулы, как мы узнали во введении к этой главе, обладают интересным оптическим свойством. Изучая физику, вы можете знать, что световые волны представляют собой колеблющиеся электрические и магнитные поля. В обычном свете колебания беспорядочно ориентированы в бесконечном числе плоскостей. Когда обычный свет проходит через поляризатор, все плоскости колебаний отфильтровываются, кроме одной, что приводит к плоскополяризованный свет .Пучок плоскополяризованного света при прохождении через образец хирального соединения взаимодействует с соединением таким образом, что угол колебаний изменяется. Это свойство называется оптической активностью .
Если соединение вращает плоскополяризованный свет по часовой стрелке (+), то оно называется правовращающим , а если оно вращает свет против часовой стрелки (-) — левовращающим . Величина наблюдаемой оптической активности зависит от температуры, длины волны используемого света, растворителя, концентрации хирального образца и длины пути в пробирке с образцом (длина пути — это длина, которую плоскополяризованный свет проходит через хиральный образец). образец). Как правило, измерения оптической активности проводятся в пробирке для образца с длиной оптического пути 1 дециметр (10 см) при 25 °C с использованием в качестве источника света так называемой «D-линии» натриевой лампы с длиной волны 589нм. Удельное вращение чистого хирального соединения при 25° выражается выражением:
Величина наблюдаемой оптической активности зависит от температуры, длины волны используемого света, растворителя, концентрации хирального образца и длины пути в пробирке с образцом (длина пути — это длина, которую плоскополяризованный свет проходит через хиральный образец). образец). Как правило, измерения оптической активности проводятся в пробирке для образца с длиной оптического пути 1 дециметр (10 см) при 25 °C с использованием в качестве источника света так называемой «D-линии» натриевой лампы с длиной волны 589нм. Удельное вращение чистого хирального соединения при 25° выражается выражением:
. . . где alpha (obs) — наблюдаемое вращение, l — длина пути в дециметрах, а c — концентрация образца в граммах на 100 мл. Другими словами, удельное вращение хирального соединения — это оптическое вращение, которое наблюдается, когда 1 г соединения растворяется в количестве данного растворителя, достаточном для получения 100 мл раствора, и вращение измеряется в кювете на 1 дм при 25°С. o C с использованием света натриевой лампы.
o C с использованием света натриевой лампы.
Каждая хиральная молекула имеет характерное удельное вращение, которое фиксируется в химической литературе как физическое свойство, такое же, как температура плавления или плотность. Различные энантиомеры соединения всегда будут вращать плоскополяризованный свет с одинаковой, но противоположной величиной. ( S )-ибупрофен, например, имеет удельное вращение +54,5 o (правостороннее вращение) в метаноле, в то время как ( R )-ибупрофен имеет удельное вращение -54,5 или . Нет никакой связи между обозначением R/S хирального соединения и направлением его удельного вращения. Например, энантиомер S ибупрофена является правовращающим, а энантиомер S глицеральдегида является левовращающим. Смесь двух энантиомеров в соотношении 50:50 (рацемическая смесь) не будет иметь заметной оптической активности, поскольку две оптические активности компенсируют друг друга.
Хиральные молекулы часто маркируют в зависимости от того, являются ли они правовращающими или левовращающими (их влияние на свет), а также их R/S обозначение (их абсолютная структура в 3D). Например, чистые энантиомеры ибупрофена обозначаются как ( S )-(+)-ибупрофен и ( R )-(-)-ибупрофен, тогда как (±)-ибупрофен относится к рацемической смеси, которая представляет собой форму в котором препарат продается потребителям.
Очень важно знать, что d , l , ([латекс] + [/латекс]) или ([латекс] — [/латекс]) не обозначают конфигурации. Таким образом, хотя ([латекс] + [/латекс])-2-бутанол на самом деле имеет конфигурацию [латекс] 5 [/латекс], а ([латекс] — [/латекс])-2-бутанол имеет конфигурацию [латекс] 6 [ /латекс], нет простого способа предсказать, что конкретный знак вращения будет связан с конкретной конфигурацией. Методы, используемые для определения истинных конфигураций энантиомеров, будут обсуждаться позже.
Схематическое изображение вращения плоскости поляризации поляризованного света оптически активным соединением. Плоскополяризованный свет отличается от обычного света тем, что его электрическая составляющая вибрирует в плоскости, а не во всех направлениях. Угол α представляет собой угол между плоскостью поляризации света, входящего в образец, и плоскостью поляризации выходящего света.
Плоскополяризованный свет отличается от обычного света тем, что его электрическая составляющая вибрирует в плоскости, а не во всех направлениях. Угол α представляет собой угол между плоскостью поляризации света, входящего в образец, и плоскостью поляризации выходящего света.
История энантиомеров и оптической активности
В начале девятнадцатого века было обнаружено, что многие соединения, будь то твердые, жидкие или газообразные, обладают свойством вращать плоскость поляризации поляризованного света и, можно сказать, «9».2[/латекс]
Вклад Пастера в стереохимию явился результатом его исследований формы кристаллов винной кислоты [латекс] НО_2С-СНОН-СНОН-СО_2Н [/латекс] и ее солей. Было известно, что винная кислота, побочный продукт виноделия, является оптически активной, и Пастер показал, что она и девятнадцать различных ее солей образуют кристаллы, которые , а не идентичны своим зеркальным отражениям. Было известно, что другое вещество, известное как «рацемическая кислота», для которого мы можем записать ту же сокращенную формулу [латекс] HO_2C-CHOH-CHOH-CO_2H [/латекс], оптически 9\text{o} [/latex] дал кристаллам две различные формы, и эти формы были зеркальными отображениями друг друга. Пастер тщательно разделил два вида кристаллов и показал, что один из них идентичен соответствующей соли винной кислоты, за исключением того, что он вращает плоскость поляризации поляризованного света в противоположном направлении. Это разделение рацемической кислоты на две оптически активные формы теперь называется «разделением рацемической кислоты».
Пастер тщательно разделил два вида кристаллов и показал, что один из них идентичен соответствующей соли винной кислоты, за исключением того, что он вращает плоскость поляризации поляризованного света в противоположном направлении. Это разделение рацемической кислоты на две оптически активные формы теперь называется «разделением рацемической кислоты».
На основании своих открытий Пастер постулировал, что «оптическая изомерия» должна быть связана с молекулярной диссимметрией веществ, так что могут существовать неидентичные формы зеркального отражения. Однако Вант-Гоффу и Ле Белю оставалось почти одновременно дать удовлетворительное объяснение на молекулярном уровне. В своей первой опубликованной работе о тетраэдрическом углероде ван’т Хофф сказал: «… все больше и больше кажется, что нынешние структурные формулы неспособны объяснить некоторые случаи изомерии; причиной этого, возможно, является тот факт, что нам нужно более определенное утверждение о фактическом положении атомов». в связи с оптической изомерией и геометрической, или цис-транс, изомерией.
в связи с оптической изомерией и геометрической, или цис-транс, изомерией.
Современному химику нелегко полностью оценить вклад этих ранних химиков, потому что мы давно приняли тетраэдрический углерод как экспериментально установленный факт. Однако в то время, когда эта концепция была провозглашена, даже существование атомов и молекул открыто подвергалось сомнению многими учеными, и приписывать «формы» тому, что изначально казалось метафизическими концепциями, было слишком сложно для многих.
Упражнение
1. Какая из 20 распространенных в природе L-аминокислот имеет R конфигурация? Обратитесь к таблице аминокислот для структур.
Показать раствор
Видеоруководство Академии Хана по оптической активности
Круговой дихроизм
Другое свойство хиральных молекул называется круговым дихроизмом (КД). Это относится к их дифференциальному поглощению света с левой и правой круговой поляризацией. При прохождении света с левой и правой круговой поляризацией через хиральные молекулы коэффициенты поглощения различаются так, что изменение коэффициентов поглощения не равно нулю.
Это относится к их дифференциальному поглощению света с левой и правой круговой поляризацией. При прохождении света с левой и правой круговой поляризацией через хиральные молекулы коэффициенты поглощения различаются так, что изменение коэффициентов поглощения не равно нулю.
, где ΔA — разница между поглощением света с левой круговой поляризацией (LCP) и с правой круговой поляризацией (RCP) (это то, что обычно измеряется). Где [Дж] = молярная концентрация образца, а л — длина пути.
КД-сигналы хиральных молекул могут дать важную информацию, и эта информация может быть использована для спектроскопии в видимой и ультрафиолетовой областях. Каждая хиральная молекула показывает определенный спектр КД. Глядя на отличительные спектры молекул, таких как белки и ДНК, мы можем получить полезную информацию об их вторичной структуре и увидеть, чем они отличаются.
Каталожные номера
- Аткинс, Питер и де Паула, Хулио. Физическая химия для наук о жизни.




 «Здесь, как и везде, разграничения и рубрики принадлежат не природе, не сущности, а человеческому суждению, которому они нужды для собственного удобства», – это сказал Александр Михайлович Бутлеров – создатель теории строения органических соединений.
Это поле обязательно для заполнения.
«Здесь, как и везде, разграничения и рубрики принадлежат не природе, не сущности, а человеческому суждению, которому они нужды для собственного удобства», – это сказал Александр Михайлович Бутлеров – создатель теории строения органических соединений.
Это поле обязательно для заполнения.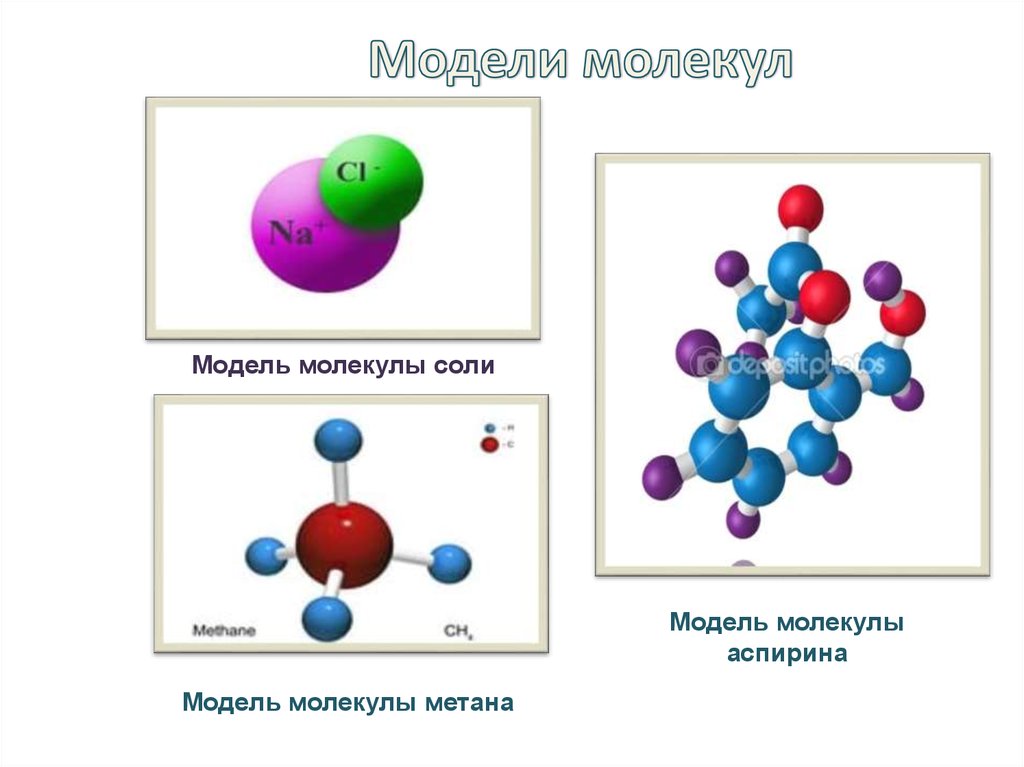 В состав молекул всех органических веществ входит углерод. Уникальное свойство углерода образовывать цепочки из атомов даёт возможность образовывать огромное количество разнообразных соединений.
В состав молекул всех органических веществ входит углерод. Уникальное свойство углерода образовывать цепочки из атомов даёт возможность образовывать огромное количество разнообразных соединений.




 Этот вопрос не является обязательным.
Этот вопрос не является обязательным.
 Она наблюдается в таких полимерно-кристаллических веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими свойствами.
Она наблюдается в таких полимерно-кристаллических веществах как, алмаз, сера. Такие вещества обладают высокими диэлектрическими свойствами. Обычно она возникает между металлами и неметаллами. Типичные ионные связи в щелочно-галоидных соединениях — NaCl
Обычно она возникает между металлами и неметаллами. Типичные ионные связи в щелочно-галоидных соединениях — NaCl Поэтому энергетически выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в «электронный газ».
Поэтому энергетически выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Согласно теории свободных электронов в узлах решетки металла находятся положительно заряженные ионы, которые погружены в «электронный газ».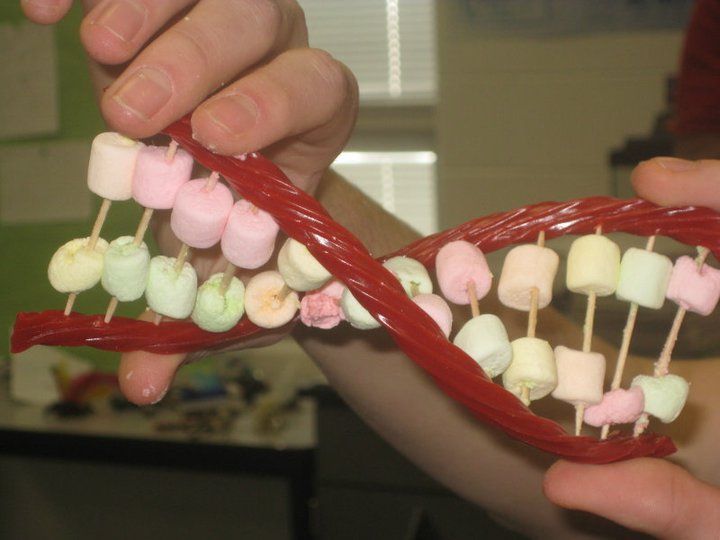 Энергия Ван-дер-Ваальсовых взаимодействий невысока: от 10 до 60 кДж/моль.
Энергия Ван-дер-Ваальсовых взаимодействий невысока: от 10 до 60 кДж/моль.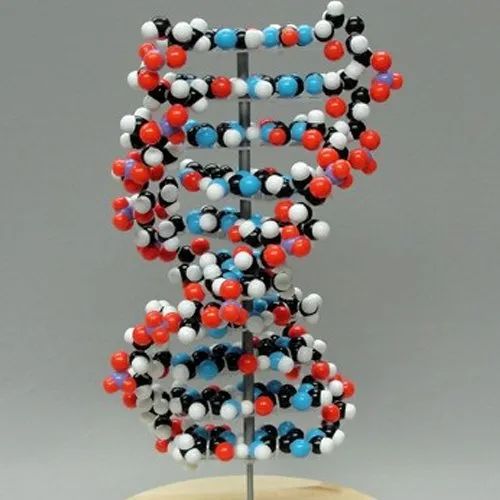
 Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток. Вы можете даже собрать съедобную молекулу из фруктов или ягод!
Вы можете использовать любые другие конструкторы, материалы для творчества, например, слепить атомы из пластилина или сделать их в виде небольших клубочков ниток. Вы можете даже собрать съедобную молекулу из фруктов или ягод!
