Солнечный водород как спасение — Федеральное министерство иностранных дел Германии
Революционная методика позволит превращать этот элемент в «чистое» топливо и использовать в качестве энергонакопителя в промышленных масштабах.
Водород признан незаменимым для экологичного и стабильного энергообеспечения, поскольку выработка тока и тепла с его помощью представляет собой практически неограниченный ресурс и не генерирует опасные побочные продукты. Специалисты давно делают ставку на производство этого элемента путем прямого расщепления воды солнечным светом. Однако из-за малой производительности фотокалитических систем водород до сих пор получают в основном из природного газа или из воды, которую расщепляют электролизом. А используемые в промышленном масштабе агрегаты пока не приспособлены работать исключительно на изменяющейся силе ветра или солнечной энергии.
Германо-американская команда исследователей совершила прорыв в фотогальванике, увеличив КПД при стопроцентном «солнечном» производстве водорода из воды до рекордных 19 %. Тем самым ученые вплотную приблизились к теоретически допустимому максимуму, составляющему 23 %, при котором вся поглощенная энергия света расходуется на разложение воды. Примечательно, что предыдущий рекорд (12,4 %) продержался целых 17 лет.
Тем самым ученые вплотную приблизились к теоретически допустимому максимуму, составляющему 23 %, при котором вся поглощенная энергия света расходуется на разложение воды. Примечательно, что предыдущий рекорд (12,4 %) продержался целых 17 лет.
Для своей революционной разработки Маттиас Май (Mattias May) из Центра материалов и энергии имени Гельмгольца, Томас Ханнапель (Thomas Hannappel) из Технического университета Ильменау и Ханс-Йоахим Леверенц (Hans-Joachim Lewerenz) из Калифорнийского технологического института использовали высокоэффективную тандемную солнечную батарею, состоящую из двух полупроводников смешанного типа.
Суперпродуктивность инновационной солярной энергосистемы (ISE) обеспечивает разработанный во Фрайбурге в Институте солнечных энергосистем им. Фрауэенгофера фотохимический элемент, который имеет фотоэлектрический КПД 30 процентов. Собственно, он и вырабатывает электроэнергию из солнечного света с тем, чтобы расщепить воду на водород и кислород. Для этого солнечная батарея помещается в заполненную водой электрохимическую ячейку. В процессе эксплуатации в области катода выделяется газообразный водород, тогда как в области анода возникает кислород.
В процессе эксплуатации в области катода выделяется газообразный водород, тогда как в области анода возникает кислород.
Три года назад Маттиасу Маю и его коллегам этим способом уже удавалось преобразовать 14 процентов падающего солнечного света в водород, что в то время тоже было лучшим в мире результатом. Однако энергопотери, вызванные процессами отражения и поглощения света на поверхности используемой тогда фотохимической ячейки, были слишком велики. К тому же коррозийный эффект, вызванный контактом с водой, сокращал срок службы электрохимических элементов.
Сейчас исследователи устранили слабые звенья конструкции. «Мы заменили антикоррозийный верхний слой кристаллическим слоем диоксида титана, который не только обладает отличными антибликовыми свойствами, но и притягивает наночастицы родия, из которых состоит катализатор нашей установки», – объясняет Ханс-Йоахим Леверенц.
Для получения частиц родия, ускоряющих процесс расщепления воды, исследователи также использовали новый электрохимический процесс. «Эти частицы всего 10 нанометров в диаметре и поэтому оптически почти прозрачны, что делает их идеальными для работы», – поясняют создатели высокопродуктивной новинки.
«Эти частицы всего 10 нанометров в диаметре и поэтому оптически почти прозрачны, что делает их идеальными для работы», – поясняют создатели высокопродуктивной новинки.
Кроме этого, на этот раз удалось обеспечить оптимальную транспортировку производимого в солнечной батарее электрического переносчика заряда в направлении катода. Все эти новшества позволили ученым обеспечить в кислотном водном растворе небывалую эффективность 19,3 %, тогда как в нейтральной воде КПД на данный момент составляет 18,5 %. С помощью дальнейших технических инноваций экспериментаторы рассчитывают перешагнуть 20-прецентный показатель производительности для фотокаталитической ячейки этого типа.
Среди ближайших задач – работа над увеличением срока эксплуатации тандемной батареи, который пока остается слабым звеном. Производительность системы падает после ста часов работы, в то время как для практического применения требуется несколько тысяч часов бесперебойной работы без снижения эффективности.
Также в планах – снизить затраты на материалы для прототипа, поскольку используемые в нем особые полупроводники делают конструкцию чересчур дорогой для коммерческого применения. Для этого специалисты Технического университета Ильменау вместе с коллегами из Института Фрауэнгофера работают над созданием фотогальванических элементов, в которых композиционные полупроводники будут скомбинированы с кремнием, который превосходит родий в экономичности.
Для этого специалисты Технического университета Ильменау вместе с коллегами из Института Фрауэнгофера работают над созданием фотогальванических элементов, в которых композиционные полупроводники будут скомбинированы с кремнием, который превосходит родий в экономичности.
Если удастся и впредь вести разработки с нынешними темпами, то, по оценкам ученых, уже через пять-десять лет тандемные солнечные батареи поступят на рынок, чтобы превращать энергию солнечного света в водород в промышленных масштабах.
Арина Попова
Ученые обнаружили простой способ получения водорода из воды. » DailyTechInfo
Разделение воды, с целью получения водорода, является «священным Граалем» многих ученых, ведущих работы в направлении разработки практически неисчерпаемого источника экологически чистой энергии. Теперь, благодаря исследования ученых университета Монаша (Monash University) в Австрии, этот процесс будет реализовать гораздо проще, чем считалось ранее. Согласно профессору Леоне Спиччиа (Leone Spiccia), ключом к водородной энергетике будущего может стать природный минерал бернессит (Birnessite), который в природе придает черную окраску некоторым горным породам.
«Камнем преткновения процесса получения водорода является собственно разложение воды на кислород и водород. Используя традиционные способы на разрушение химических связей требуется очень много энергии, что делает эти процессы экономически невыгодными. Наша команда разработала процесс расщепления молекулы воды, основанный на марганцесодержащем катализаторе и использующий для этого солнечный свет» — говорит профессор Спиччиа. — «Основой минерала бернессита является марганец, который, как и все элементы из середины периодической системы, может существовать в нескольких состояниях, которые химики называют степенями окисления. Это соответствует количеству атомов кислорода, с которыми связан атом вещества».
Изначально ученые пытались использовать весьма сложные катализаторы на основе того же марганца. После того, как им удалось получить достаточно эффективный каталитический процесс разложения воды на водород и кислород, используя электрический ток, они, используя совершенные спектроскопические методы анализа, обнаружили, что использованный ими сложный катализатор преобразовался в более простое соединение, аналогом которого является природный минерал бернессит.
«Эти исследования позволили нам проникнуть глубже в тайны природы и выяснить как в действительности в природе работает естественный марганцевый катализатор» — рассказывает доктор Розали Хокинг (Dr Rosalie Hocking) из Австралийского центра изучения электроматериалов (Australian Centre for Electromaterials Science). — «Ученые приложили большие усилия к созданию сложных марганцесодержащих молекул для того что бы получить эффективный катализатор. Но все оказалось гораздо проще, самой большой эффективностью в области расщепления воды обладает естественный материал, который достаточно устойчив, что бы выдержать жесткие физические и химические нагрузки во время его использования».
Ключевые слова:
Вода, Расщепление, Водород, Кислород, Энергия, Топливо, Марганец, Катализатор, Свет, Солнце, Электрический, Ток
Первоисточник
Другие новости по теме:
Добавить свое объявление
Загрузка…
ученых разработали самый эффективный катализатор для расщепления воды: ScienceAlert
VALex/Shutterstock.com
Ученые только что нашли новый способ расщепления воды на водород и кислород, который является дешевым и эффективным, и это может означать, что в будущем мы сможем производить в изобилии чистое водородное топливо.
Водород является фантастическим источником экологически чистой энергии, но задача состоит в том, чтобы сделать его достаточно эффективным и доступным по цене. Сообщается, что недавно разработанный катализатор решает обе проблемы, обеспечивая большую эффективность при меньшей стоимости, чем существующие решения, и может работать в течение 20 часов подряд.
По словам ученых Хьюстонского университета, разработавших катализатор, он отвечает всем требованиям с точки зрения долговечности и сохранения энергии, а также стоимости и эффективности.
«Водород — самый чистый первичный источник энергии на Земле», — говорит один из членов команды, Пол К. В. Чу. «Вода могла бы быть самым распространенным источником водорода, если бы можно было отделить водород от его прочной связи с кислородом в воде с помощью катализатора».
Чтобы разделить воду на водород и кислород, необходимы две реакции — по одной для каждого элемента. Основная проблема заключалась в том, чтобы получить эффективный катализатор для кислородной части уравнения, что, по словам этих исследователей, они теперь взломали.
Катализатор состоит из метафосфата железа и платформы из проводящей пены никеля, сочетание материалов, которое, по словам команды, является более эффективным и менее дорогим, чем существующие решения.
Он также показал впечатляющую долговечность в тестах, проработав более 20 часов и 10 000 циклов без сбоев.
Использование нового метода означает, что водород можно производить без образования углеродных отходов. Это то, чего не могут избежать существующие методы производства, такие как паровая конверсия метана и газификация угля.
До сих пор кислородные реакции часто полагались на электрокатализаторы, в которых используется иридий, платина или рутений — «благородные» металлы, которые трудно и дорого добывать. Эксперты говорят, что кислородные реакции стали узким местом всего процесса.
Никель, напротив, более распространен, и поэтому его легче и дешевле достать. Этот металл лежит в основе еще одного метода разделения воды, открытого в прошлом году, поэтому теперь у ученых есть несколько способов улучшить производство водорода.
Само расщепление обычно происходит за счет электрического тока или солнечной энергии, но поскольку вода улавливает лишь небольшую часть светового спектра, более продуктивно сначала преобразовать солнечный свет в энергию, а затем использовать электричество для выделения водорода.
Если ученые смогут разгадать формулу, водород в конечном итоге сможет питать все, от домов до автомобилей. И это гораздо лучший вариант для окружающей среды, чем ископаемое топливо, выделяющее CO2 — водородное топливо производит воду в качестве побочного продукта сгорания, что является экологически безопасным и не загрязняющим окружающую среду.
Хорошая новость: если метод электролиза воды не сработает, исследователи также изучают способы получения водорода из биомассы.
Чем меньше тепла и энергии мы тратим на подготовку водорода, тем лучше он для нашей планеты, а когда он будет готов, он станет намного чище и экологичнее, чем ископаемое топливо.
«Мы считаем, что наше открытие является гигантским шагом к практическому и экономичному производству водорода путем расщепления воды, что внесет значительный вклад в усилия по сокращению потребления ископаемого топлива», — говорят исследователи из Хьюстона.
Их выводы были опубликованы в PNAS .
Превращение морской воды в водородное топливо и кислород
Группа исследователей из Стэнфордского университета продемонстрировала новый способ разделения газообразного водорода и кислорода из морской воды с помощью электричества. Существующие методы разделения воды основаны на использовании высокоочищенной воды, которая является ценным ресурсом и требует больших затрат в производстве.
«Для питания городов и автомобилей вам потребуется столько водорода, что невозможно извлечь его из очищенной воды», — говорит Хунцзе Дай, профессор химии Стэнфордской школы гуманитарных наук и наук. «У нас едва хватает воды для наших текущих потребностей в Калифорнии».
По словам Дая, водород является привлекательным вариантом топлива, поскольку при сгорании не выделяет углекислого газа. Сжигание водорода создает только воду и должно облегчить усугубление проблемы изменения климата, если его широко использовать в качестве топлива.
Дай сказал, что его лаборатория продемонстрировала демонстрацию концепции, но исследователи оставят на усмотрение производителей масштабирование и массовое производство конструкции.
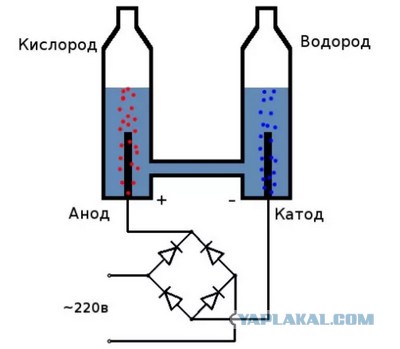
Разделение воды на водород и кислород с помощью электричества (также известное как электролиз) является простой и старой идеей. Источник питания подключается к двум электродам, помещенным в воду. Когда питание включено, газообразный водород выходит из отрицательного конца (катод), а пригодный для дыхания кислород выходит из положительного конца (анод).
Но отрицательно заряженный хлорид в соли морской воды разъедает анод, ограничивая срок службы устройства. Дай и его команда хотели найти способ предотвратить разрушение анода и снижение эффективности устройства.
Исследователи обнаружили, что если они покрывают анод слоями, богатыми отрицательными зарядами, слои отталкивают хлориды и замедляют распад анода. Итак, они нанесли слой гидроксида никеля-железа поверх сульфида никеля, который покрывает сердцевину из вспененного никеля. Пена никеля действует как проводник, передающий электричество от источника питания, в то время как гидроксид никеля и железа запускает электролиз, разделяя воду на кислород и водород. Во время электролиза сульфид никеля превращается в отрицательно заряженный слой, который защищает анод. Подобно тому, как отрицательные концы двух магнитов соприкасаются друг с другом, отрицательно заряженный слой отталкивает хлорид и не позволяет ему достичь металлического сердечника.
Во время электролиза сульфид никеля превращается в отрицательно заряженный слой, который защищает анод. Подобно тому, как отрицательные концы двух магнитов соприкасаются друг с другом, отрицательно заряженный слой отталкивает хлорид и не позволяет ему достичь металлического сердечника.
По словам аспиранта Стэнфордского университета Майкла Кенни, без отрицательно заряженного покрытия анод работает только около 12 часов в морской воде. «Весь электрод разваливается в крошку, — говорит Кенни. «Но с этим слоем он держится более тысячи часов».
Предыдущие попытки разделить морскую воду на водородное топливо использовали малое количество электрического тока, потому что коррозия возникает при более высоких токах. Но команда из Стэнфорда отправила в 10 раз больше электроэнергии через свое многослойное устройство, что позволило ему быстрее генерировать водород из морской воды. «Думаю, мы установили рекорд по скорости расщепления морской воды», — говорит Дай.
Члены команды проводили большинство испытаний в контролируемых лабораторных условиях, где они могли регулировать количество электричества, поступающего в устройство.

