Из чего состоит вода? Окружающий мир, 3 класс — Природа Мира
Содержание
- Состав воды
- Физические свойства
- Виды воды
- Таблица 1. Классификация воды по содержанию солей
- Интересные факты
- Что мы узнали?
Вода – источник жизни на нашей голубой планете. Она есть в клетках всех живых организмов. Это самое распространённое в мире вещество. Вода – один из важнейших факторов, определяющих природные условия на Земле, и влияет на формирование климата и рельефа территории.
Слово “вода” происходит от древнегерманского “текучий, мокрый”.
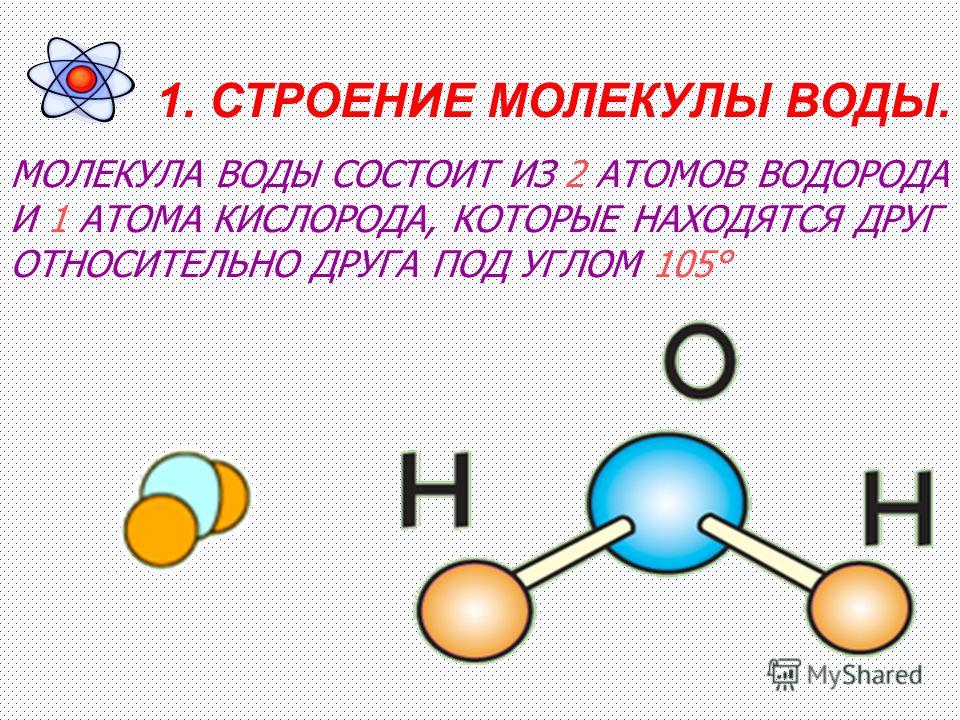
Состав воды
Схема структуры молекулы водыМолекула воды (H2O) складывается из 2-х атомов водорода и 1-го атома кислорода. Это два газообразных вещества, которые, соединяясь, образуют невероятно прочные связи. Главную роль в молекуле выполняет атом кислорода. Атомы водорода несут положительный заряд, а атом кислорода – отрицательный. Каждый из атомов водорода, крепко держась в образованной молекуле, одновременно притягивается к атому кислорода из соседней молекулы. Связи кислорода и водорода из соседних молекул гораздо слабее, чем внутри. Благодаря этим межмолекулярным связям, вода обладает рядом удивительных свойств.
Связи кислорода и водорода из соседних молекул гораздо слабее, чем внутри. Благодаря этим межмолекулярным связям, вода обладает рядом удивительных свойств.
Физические свойства
Дрейфующий ледВода – уникальное вещество на планете, способное быть в трех физических состояниях:
- Газообразное
- Жидкое
- Твердое
Если спросить человека, что такое вода, то самый популярный ответ будет: “Это жидкость” . Жидкое самое распространённое в природе состояние воды.
Изменение состояния воды возможно благодаря тому, что под действием температур меняется расстояние между молекулами. В твердой форме – молекулы наиболее близко расположены друг к другу. В жидкой – подальше. В газообразной – совсем далеко, что позволяет им отрываться. При температуре от 100°С и выше это пар. От 0°С до 100°С – это вода. А ниже 0°С – это лед.
Когда вода замерзает, ее молекулы выстраиваются в правильные шестигранные формы. Все кристаллы льда похожи друг на друга.
Лед обладает уникальным свойством – он легче самой воды, из которой получен, и никогда не тонет в ней. Поэтому этому водоемы всегда замерзают сверху, что позволяет сохранить жизнь на дне.
В атмосфере всегда есть мельчайшие капельки воды. Но присутствие влаги мы замечаем только тогда, когда её количество увеличивается, формируя облака и туман.
Виды воды
Морская водаВся вода делится на категории:
- Солёная (моря, океаны)
- Пресная (реки, озера, ледники, подземные воды)
- Дождевая
- Минеральная
- Вода, обработанная человеком (водопроводная, канализационная, дистиллированная, искусственная)
На планете примерно 96,5 % воды приходится на долю морской воды. Пресной – намного меньше. Её доля – около 2,5 %, причём большая часть – в ледниках и грунтовых водах. Менее 0,3 % от всей пресной воды содержится в реках, озёрах и атмосфере, а в живых организмах – всего 0,003 %.
У природных вод есть важный признак – прозрачность. От этого зависит, как глубоко смогут проникнуть солнечные лучи в толщу воды. Цветность определяется количеством растворенных органических соединений, которые окрашивают воду при прохождении её через торфяные и гумусные слои почвы.
От этого зависит, как глубоко смогут проникнуть солнечные лучи в толщу воды. Цветность определяется количеством растворенных органических соединений, которые окрашивают воду при прохождении её через торфяные и гумусные слои почвы.
Природная солёная вода содержит большое количество разных примесей минеральных и органических соединений. Количество этих веществ оказывает влияние на плотность воды. Самые плотные в природе это морская и минеральная воды. Самой плотной считается вода Мёртвого моря. По степени солёности вода делится на несколько категорий:
Таблица 1. Классификация воды по содержанию солей
| Наименование | Концентрация солей | Где встречаются |
|---|---|---|
| Рассолы | Более 50 г/л | Мертвое море, Озеро Ретба, Пруд Гаэтале |
| С повышенной солёностью | 10-35 г/л | Красное море, Средиземное море, Мировой океан |
| Солёные | 3-10 г/л | Мраморное море, Черное море |
| Солоноватые | 1-3 г/л | Азовское море, Белое море |
| С повышенной минерализацией | 0,5-0,1 г/л | Минеральная вода Боржоми, Нарзан |
В пресной воде тоже есть соли. В основном это кальций и магний. Для такой воды есть характеристика жёсткости. Чем больше содержание примесей, тем более жёсткой называют воду.
В основном это кальций и магний. Для такой воды есть характеристика жёсткости. Чем больше содержание примесей, тем более жёсткой называют воду.
Чистой воды в природе никогда не бывает. Вода хорошо растворяет в себе разные вещества – твердые, жидкие и газообразные. Даже дождевая вода пока падает на землю, захватывает из воздуха пыль и газы и растворяет их в себе.
Человек для своих нужд изменяет воду. В водопроводе течет пресная вода из рек и водохранилищ. Она проходит 5 стадий очистки, обеззараживается. В канализацию попадает вода загрязнённая примесями и частицами от человеческой жизнедеятельности. Прежде чем выпустить такую воду в окружающую среду, стоки очищают на специальных очистных сооружениях.
Дистиллированную воду используют в разных областях, чаще в научной и технической. Получают её, испаряя и затем осаждая пар на холодной поверхности. Примеси остаются в перегонном сосуде. Такая вода является наиболее чистой из всех возможных.
Пресная вода на планете распространена неравномерно.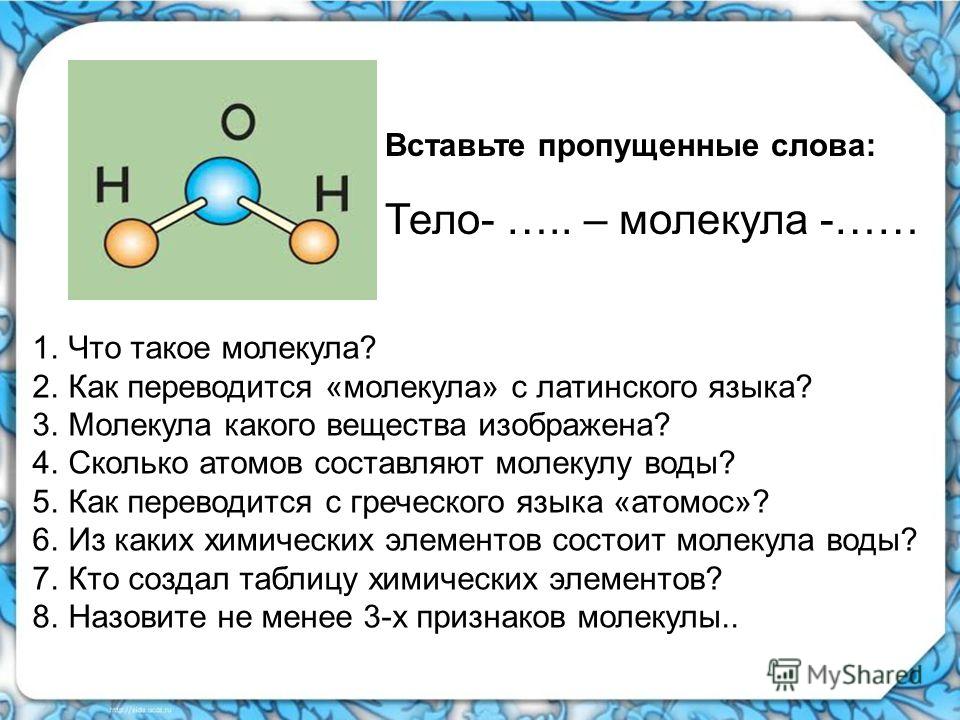 Есть области, где существует сильная её нехватка. Для решения проблемы в таких районах строят водоопреснительные станции. На этих станциях морскую воду выпаривают и получают дистиллированную воду, которая тоже непригодна для использования человеком. Её насыщают минеральными солями до показателей природной пресной воды.
Есть области, где существует сильная её нехватка. Для решения проблемы в таких районах строят водоопреснительные станции. На этих станциях морскую воду выпаривают и получают дистиллированную воду, которая тоже непригодна для использования человеком. Её насыщают минеральными солями до показателей природной пресной воды.
Интересные факты
Многие столетия вода считалась простым веществом. В 1783 году химик Лавуазье смог разложить воду на два вещества и предположить количественное их соотношение в молекуле.
В обычных условиях вода не имеет ни вкуса, ни запаха. Вода бесцветна, но при толщине более 2 метров она приобретает голубой цвет. Это происходит благодаря рассеиванию коротких лучей солнечного спектра.
Вода – сильный поглотитель солнечной энергии. У воды есть замечательное свойство – медленно нагреваясь, она и медленно остывает. Мировой океан планет накапливает тепло летом и отдаёт его зимой. Так сглаживаются скачки температуры на планете.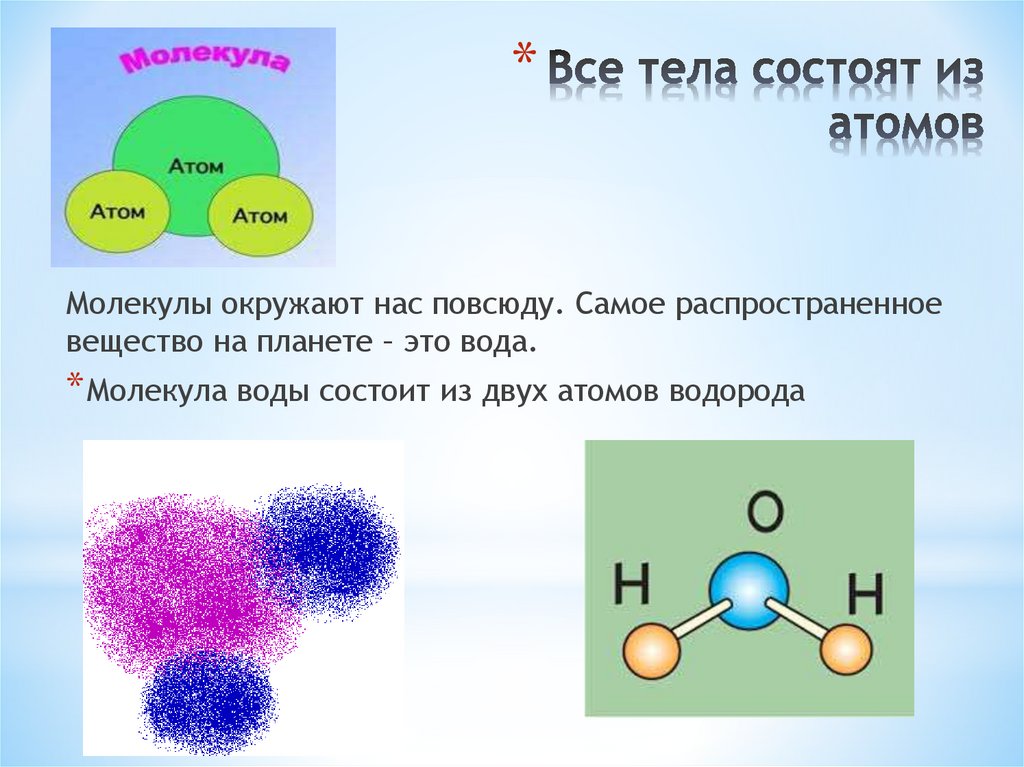 Суточные и сезонные колебания температуры уменьшаются вблизи водных объектов. Чем меньше в той или иной местности крупных водоемов, тем более резкоконтинентальный там климат.
Суточные и сезонные колебания температуры уменьшаются вблизи водных объектов. Чем меньше в той или иной местности крупных водоемов, тем более резкоконтинентальный там климат.
Что мы узнали?
Вот краткий список основных сведений о воде, ее составе и свойствах:
- Молекула воды состоит из 2-х атомов водорода и 1 атома кислорода
- Лед легче воды
- Вода – единственное на планете вещество, способное пребывать в трех агрегатных состояниях: газообразном, твердом, жидком
- В воде всегда присутствуют примеси
- Количество морской воды на планете гораздо больше, чем пресной
- Вода регулирует температуру планеты
Гугломаг
Спрашивай! Не стесняйся!
Задать вопрос
Не все нашли? Используйте поиск по сайту
Search for:Страница не найдена
Размер:
AAA
Цвет: C C C
Изображения
Вкл.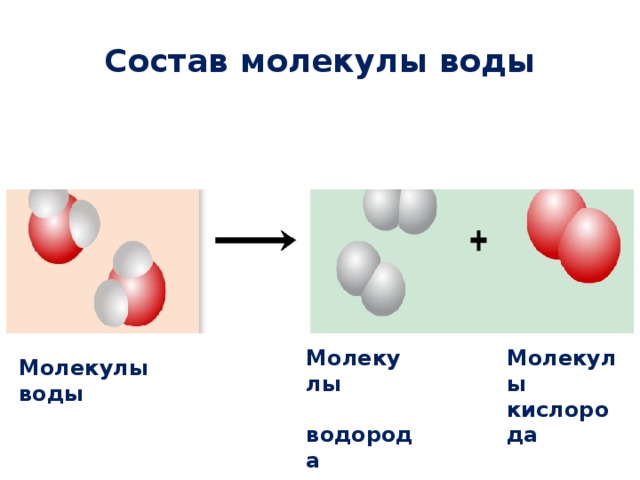 Выкл.
Выкл.
Обычная версия сайта
RUENBY
Гомельский государственный
медицинский университет
- Университет
- Университет
- История
- Руководство
- Устав и Символика
- Воспитательная деятельность
- Организация образовательного процесса
- Международное сотрудничество
- Система менеджмента качества
- Советы
- Факультеты
- Кафедры
- Подразделения
- Первичная профсоюзная организация работников
- Издания университета
- Гордость университета
- Первичная организация «Белорусский союз женщин»
- Одно окно
- ГомГМУ в международных рейтингах
- Структура университета
- Банк данных одаренной молодежи
- Абитуриентам
- Приёмная комиссия
- Университетская олимпиада по биологии
- Целевая подготовка
- Заключение, расторжение «целевого» договора
- Льготы для молодых специалистов
- Архив проходных баллов
- Карта и маршрут проезда
- Порядок приёма на 2023 год
- Специальности
- Контрольные цифры приёма в 2023 году
- Стоимость обучения
- Информация о ходе приёма документов
- Приём документов и время работы приёмной комиссии
- Порядок приёма граждан РФ, Кыргызстана, Таджикистана, Казахстана
- Горячая линия по вопросам вступительной кампании
- Студентам
- Расписание занятий
- Расписание экзаменов
- Информация для студентов
- Студенческий клуб
- Спортивный клуб
- Общежитие
- Нормативные документы
- Практика
- Стоимость обучения
- Безопасность жизнедеятельности
- БРСМ
- Профком студентов
- Учебный центр практической подготовки и симуляционного обучения
- Многофункциональная карточка студента
- Анкетирование студентов
- Волонтерский центр ГомГМУ
- Выпускникам
- Интернатура и клиническая ординатура
- Докторантура
- Аспирантура
- Распределение
- Врачам и специалистам
- Профессорский консультативный центр
- Факультет повышения квалификации и переподготовки
- Иностранным гражданам
- Факультет иностранных студентов
- Стоимость обучения
- Регистрация и визы
- Полезная информация
- Правила приёма
- Информация о возможностях и условиях приема в 2022 году
- Официальные представители ГомГМУ по набору студентов
- Страхование иностранных граждан
- Приём на Подготовительное отделение иностранных граждан
- Прием иностранных граждан для обучения на английском языке / Training of foreign students in English
- Повышение квалификации и переподготовка для иностранных граждан
- Научная деятельность
- Направления научной деятельности
- Научно-исследовательская лаборатория
- Научно-исследовательская часть
- Инновационные технологии в ГомГМУ
- Научно-педагогические школы
- Конкурсы, гранты, стипендии
- Научные мероприятия
- Работа комитета по этике
- В помощь исследователю
- Совет молодых ученых
- Студенчеcкое научное общество
- Диссертационный совет
- Патенты
- Инструкции на метод
- «Горизонт Европа»
- Госпрограмма (ЧАЭС)
- Главная
Из чего состоит вода? Атомы и свойства молекулы воды
Жизнь на нашей планете не продвинулась бы далеко без воды.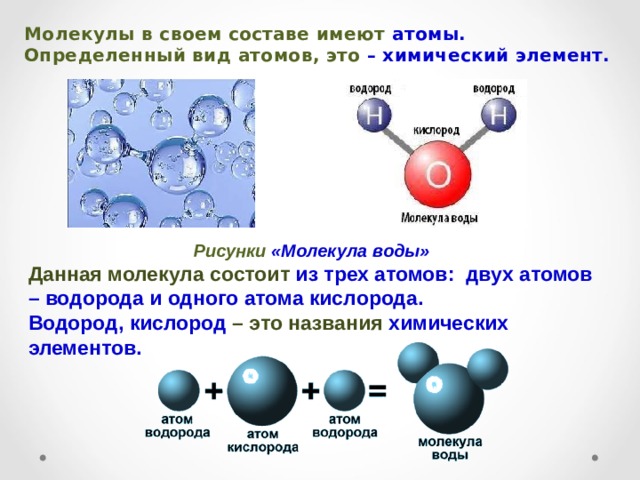 Его уникальные химические свойства позволяют ему легко склеиваться и растворять другие вещества — важнейшее поведение, которое сделало его пригодным для использования животными и растениями, которые быстро эволюционировали и распространились по всей планете.
Его уникальные химические свойства позволяют ему легко склеиваться и растворять другие вещества — важнейшее поведение, которое сделало его пригодным для использования животными и растениями, которые быстро эволюционировали и распространились по всей планете.
Но из чего именно состоит вода? И почему оно так себя ведет?
Вода состоит из двух атомов водорода и одного атома кислорода, связанных вместе. Вот почему он называется h3O. h3 соответствует двум атомам водорода, а O — одному атому кислорода.
Поскольку вода представляет собой группу различных атомов, связанных вместе, ее называют молекулой. Она образует (перевернутую) V-образную форму, как показано на изображении ниже:
Ширина молекулы воды составляет всего 0,27 нанометра, а в одной капле воды их содержится около 150 000 000 000 000 000 000. Это много молекул. Представьте, сколько вы используете в душе по утрам!
Атомы водорода и кислорода в молекуле воды связаны друг с другом при помощи так называемой ковалентной связи.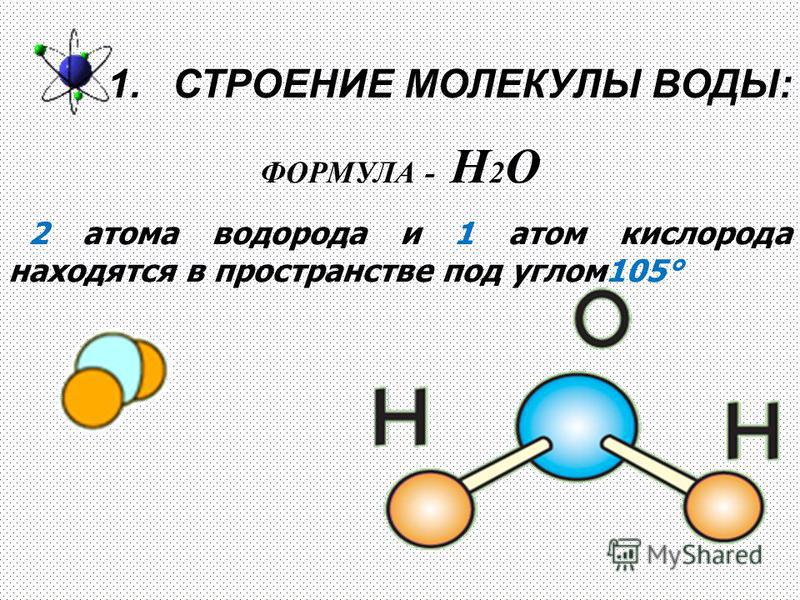 Это тип сильной связи, при которой атомы имеют одну или несколько общих пар электронов, но самое интересное в воде — это ее уникальный электромагнитный заряд, который является причиной ее невероятно полезных свойств.
Это тип сильной связи, при которой атомы имеют одну или несколько общих пар электронов, но самое интересное в воде — это ее уникальный электромагнитный заряд, который является причиной ее невероятно полезных свойств.
Атомы кислорода электроотрицательны и поэтому притягивают электроны в их общей связи с двумя атомами водорода. Это делает всю молекулу полярной, с отрицательными зарядами на стороне кислорода и положительными зарядами на стороне водорода. Из-за этой полярности два противоположных заряда притягиваются друг к другу, что создает слабый заряд, называемый водородной связью, и является причиной того, что вода при комнатной температуре является жидкостью. Невообразимое количество водородных связей, обнаруженных в капле воды, заставляет молекулы удерживаться вместе в течение крошечных долей секунды, что создает жидкое вещество, известное вам как вода. При нагревании до 100°С они превращаются в пар и пытаются разойтись, но водородные связи замедляют этот процесс, снова стягивая их вместе, а при охлаждении они конденсируются и снова превращаются в воду.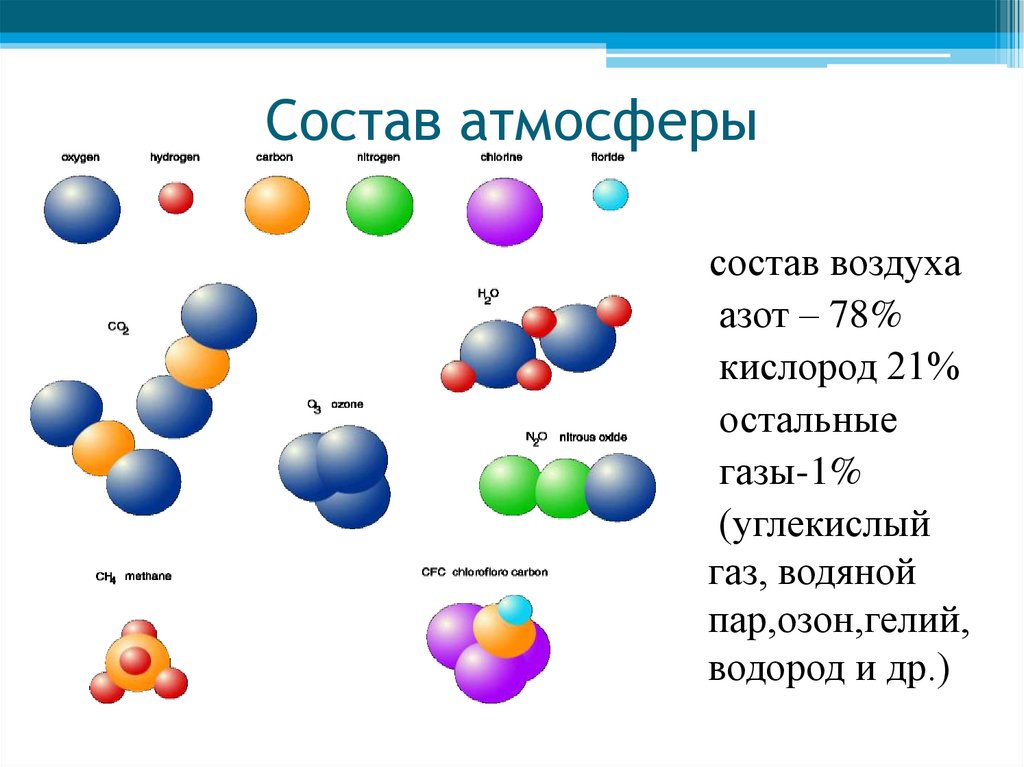 Поскольку молекулы воды таким образом всегда пытаются слипнуться, они могут образовывать большие водоемы, к которым могут получить доступ растения и животные.
Поскольку молекулы воды таким образом всегда пытаются слипнуться, они могут образовывать большие водоемы, к которым могут получить доступ растения и животные.
Как будто это было недостаточно полезно, полярность и обилие молекул воды также означает, что они легко притягиваются к другим молекулам, которые они окружают, переносят в другие места и растворяют. Это делает их «универсальным растворителем», который позволяет им переносить химические вещества, минералы и питательные вещества по телам животных и растений, где их можно использовать для поддержки организма.
Вот из чего состоит вода. А как же его атомы, водород и кислород?
Водород — это химический элемент с символом H. Это самый легкий из известных нам элементов и самый распространенный во Вселенной, составляющий около 75 % материи.1 Он бесцветен, не имеет запаха и вкуса и присутствует в почти все живое. Название «водород» происходит от греческих слов «гидро» и «гены», что означает «образование воды».
Кислород имеет химический символ O. Это самый распространенный элемент на Земле и третий по распространенности элемент во Вселенной. Его название также происходит от двух греческих слов: «окси» и «гены», что означает «кислотообразующий».
Это самый распространенный элемент на Земле и третий по распространенности элемент во Вселенной. Его название также происходит от двух греческих слов: «окси» и «гены», что означает «кислотообразующий».
Первоначально считалось, что вода образовалась из богатых водой минералов, которые расплавились во время формирования планеты, а также из ледяных комет, врезавшихся в Землю. Общий объем воды на Земле всегда остается одним и тем же, потому что добывать воду чрезвычайно сложно и дорого. Пока нас не столкнет другая ледяная комета или пока мы не разовьем технологии, позволяющие создавать новые молекулы воды, у нас всегда будет ограниченный драгоценный запас. Некоторые из молекул воды, которые вы пили сегодня, возможно, когда-то были в кишечнике Уильяма Шекспира или Стива Ирвина. Повезло тебе!
Ссылки
- https://en.wikipedia.org/wiki/Hydrogen
Соединения: факты (Научный путь: Общественное телевидение Айдахо)
- Домашний
- Факты
- Ссылки
- Игры
- Учителя
- Книги
- Глоссарий
- Видео
Атомы и элементы: строительные блоки всего
Все, что занимает место в нашем мире, является материей. Наука, изучающая материю, называется химией. Вся материя состоит из крошечных частиц, называемых атомами. Атомы составляют воздух, воду, ваше тело, одежду, пищу, которую вы едите, и стул, на котором вы сидите. Но вы не можете видеть атомы. Они настолько малы, что только в точке в конце этого предложения находятся миллиарды атомов. Существуют различные типы атомов, и они особым образом сочетаются друг с другом, чтобы составить всю материю в мире.
Наука, изучающая материю, называется химией. Вся материя состоит из крошечных частиц, называемых атомами. Атомы составляют воздух, воду, ваше тело, одежду, пищу, которую вы едите, и стул, на котором вы сидите. Но вы не можете видеть атомы. Они настолько малы, что только в точке в конце этого предложения находятся миллиарды атомов. Существуют различные типы атомов, и они особым образом сочетаются друг с другом, чтобы составить всю материю в мире.
Все атомы состоят из еще более мелких частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны собираются вместе в ядре или центре атома, в то время как электроны вращаются вокруг ядра.
Все во вселенной состоит из элементов. Нам известно о 92 элементах, встречающихся в природе, но учеными было создано еще несколько, всего их 118. Элемент — это чистое вещество, состоящее из атомов одного типа. Например, золото — это элемент, состоящий из атомов золота. Кислород – это элемент, состоящий из атомов кислорода. Периодическая таблица элементов используется для организации элементов по их атомному номеру или количеству протонов в ядре. Например, кислород имеет 8 протонов, поэтому его атомный номер равен 8. Химические символы обозначают каждый элемент. Вы можете узнать гораздо больше об атомах и элементах из периодической таблицы.
Периодическая таблица элементов используется для организации элементов по их атомному номеру или количеству протонов в ядре. Например, кислород имеет 8 протонов, поэтому его атомный номер равен 8. Химические символы обозначают каждый элемент. Вы можете узнать гораздо больше об атомах и элементах из периодической таблицы.
Соединения
Когда два или более атома соединяются вместе, мы называем это молекулой. Когда два или более атома различных элементов соединяются вместе, мы называем это соединением. Все соединения являются молекулами, но не все молекулы являются соединениями. Это потому, что молекула может состоять из двух атомов одного и того же типа, например, когда два атома кислорода соединяются вместе, образуя молекулу кислорода. Однако все соединения состоят из двух или более различных типов атомов.
Элементы редко встречаются в чистом виде; соединения встречаются гораздо чаще. Существует чуть более 100 различных видов атомов, но существуют миллионы различных видов веществ, состоящих из разных типов молекул. Вероятно, все, что вы видите вокруг себя, является каким-то соединением. Когда атомы разных видов объединяются, образуя соединение, создается новое вещество. Новые соединения не обладают такими же физическими или химическими свойствами, как исходные элементы. У них своя новая жизнь.
Вероятно, все, что вы видите вокруг себя, является каким-то соединением. Когда атомы разных видов объединяются, образуя соединение, создается новое вещество. Новые соединения не обладают такими же физическими или химическими свойствами, как исходные элементы. У них своя новая жизнь.
Соединения записываются с помощью формул, показывающих, какие элементы из таблицы Менделеева объединяются. Одним из очень знакомых соединений является вода. Когда два атома водорода (h3) соединяются с одним атомом кислорода (O), образуется соединение h3O, известное нам как вода. Все молекулы воды имеют одну и ту же комбинацию атомов. Вода не водород и не кислород. Нельзя подливать атомы кислорода и водорода в огонь и ожидать, что он потухнет. Но когда они связаны друг с другом как молекулы воды, они ведут себя как вода. Соединение — это совершенно новое вещество со своими свойствами.
Одни и те же элементы могут образовывать очень разные соединения. Если вы возьмете эти два атома водорода и соедините их с двумя атомами кислорода (вместо одного), вы получите не воду, а h3O2, совсем другое соединение, называемое перекисью водорода, — вы не захотите его пить!
- Есть много других соединений, которые вам уже знакомы:
- Когда один атом натрия (Na) соединяется с одним атомом хлора (Cl), образуется соединение NaCl, известное нам как соль.

- Каждый раз, когда вы выдыхаете, ваше дыхание содержит CO2, соединение одного атома углерода (C) и двух атомов кислорода (O2), которое мы называем двуокисью углерода.
- Иногда более двух элементов составляют соединение. Молекула сахара (глюкозы) представляет собой соединение из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, обозначаемое как C6h22O6. Эти конкретные атомы в точном количестве составляют молекулу сахара.
- Когда четыре разных вида атомов (натрий, водород, углерод и кислород) объединяются определенным образом, мы получаем NaHCO3, известный вам как пищевая сода. Если бы эти атомы были объединены по-другому, это не была бы пищевая сода.
Химические связки
Как образуются эти соединения? Что удерживает атомы в молекуле вместе? Ответ заключается в том, что соединения образуются, когда элементы соединяются и удерживаются вместе сильными силами, называемыми химическими связями. В этих связях участвуют электроны, вращающиеся вокруг ядра атома. Электроны располагаются на энергетических уровнях, находящихся на определенных расстояниях от ядра, называемых оболочками. Каждая из этих оболочек может нести определенное количество электронов (например, 2 в первой оболочке, 8 во второй и т. д.). оболочка не заполнена, атомы пытаются соединиться с другими атомами, отдавая или приобретая электроны. Атомы с почти пустой внешней оболочкой захотят отдать электроны, в то время как атомы с почти полной внешней оболочкой захотят получить электроны, чтобы заполнить ее.
Электроны располагаются на энергетических уровнях, находящихся на определенных расстояниях от ядра, называемых оболочками. Каждая из этих оболочек может нести определенное количество электронов (например, 2 в первой оболочке, 8 во второй и т. д.). оболочка не заполнена, атомы пытаются соединиться с другими атомами, отдавая или приобретая электроны. Атомы с почти пустой внешней оболочкой захотят отдать электроны, в то время как атомы с почти полной внешней оболочкой захотят получить электроны, чтобы заполнить ее.
Существует два основных типа связей, которые удерживают вместе большинство соединений. Ионные связи образуются, когда один атом отдает или отдает электрон другому, чтобы оба имели полную внешнюю оболочку. При этом атомы соединяются и создают соединение. Ковалентные связи делят электроны между атомами, чтобы заполнить их электронные оболочки. В соединении молекулы удерживаются вместе за счет притяжения между ядром и общими электронами.
Соединения и смеси
Часто вещества могут соединяться, не образуя соединения. Чтобы создать соединение, должна произойти химическая реакция, в ходе которой образуются связи и создается совершенно новое вещество. Без этой химической реакции объединенные вещества могут вместо этого образовывать смесь.
Чтобы создать соединение, должна произойти химическая реакция, в ходе которой образуются связи и создается совершенно новое вещество. Без этой химической реакции объединенные вещества могут вместо этого образовывать смесь.
Компоненты смеси сохраняют свои первоначальные свойства и легко разделяются. Например, смесь фруктов в салате можно снова разделить на группы разных видов фруктов. Соль и воду можно соединить в смесь, но вода остается водой, а соль остается солью. Чтобы разделить два компонента, воду можно выпарить, чтобы можно было собрать соль. Песок и воду можно разделить с помощью фильтра. Океан, скалы, кровь и даже воздух, которым мы дышим, представляют собой смеси, а не соединения.
С другой стороны, компоненты соединения не могут быть разделены физическими средствами. Узнайте больше о соединениях и смесях.
Физические и химические изменения
Физические изменения не разрушают соединения. Физические изменения влияют на размер, форму или состояние вещества, но не на химические свойства. Вы можете изменить состояние материи, но соединение не изменится. Если вы оставите кубик льда на солнце, он растает и превратится в жидкую воду, но в любом состоянии он по-прежнему состоит из молекул воды. Вы можете приложить физическую силу к твердому стеклу и разбить его, но молекулы, из которых состоит стекло, останутся.
Вы можете изменить состояние материи, но соединение не изменится. Если вы оставите кубик льда на солнце, он растает и превратится в жидкую воду, но в любом состоянии он по-прежнему состоит из молекул воды. Вы можете приложить физическую силу к твердому стеклу и разбить его, но молекулы, из которых состоит стекло, останутся.
Химические изменения в соединениях происходят при создании или разрушении химических связей. Затем меняется молекулярная структура; формируются новые молекулы и создается новое вещество. Часто тепло используется для начала химического превращения, например, при выпечке пирога. Другой пример химической реакции — ржавление металлического мусорного бака. Ржавление происходит из-за того, что железо (Fe) в металле соединяется с кислородом (O2) в воздухе. Химические связи создаются и разрушаются, в конечном итоге образуя оксид железа (Fe2O3), который мы называем ржавчиной.
Разорвать химические связи непросто, но это можно сделать в ходе химических реакций, используя энергию для разрыва связей. Например, электрический ток, проходящий через воду, может вызвать химическое изменение, при котором вода расщепляется на водород и кислород. Когда химик смешивает различные соединения в химической реакции, соединения могут объединяться в одно соединение или превращаться в несколько новых соединений. Некоторыми признаками химической реакции являются изменение температуры, образование газа или изменение цвета.
Например, электрический ток, проходящий через воду, может вызвать химическое изменение, при котором вода расщепляется на водород и кислород. Когда химик смешивает различные соединения в химической реакции, соединения могут объединяться в одно соединение или превращаться в несколько новых соединений. Некоторыми признаками химической реакции являются изменение температуры, образование газа или изменение цвета.
Названия соединений
У ученых есть особый способ называть соединения. Есть несколько сложных правил, но давайте сосредоточимся на простых. Для молекул с двумя элементами название соединения состоит из двух слов: название первого элемента и название второго элемента, изменяющее свое окончание на «ide». Например, если вторым элементом в соединении является кислород, он становится «оксидом». Если хлор является вторым элементом, он становится «хлоридом».
Если один из элементов имеет более одного атома, к началу названия элемента добавляется префикс в зависимости от количества атомов.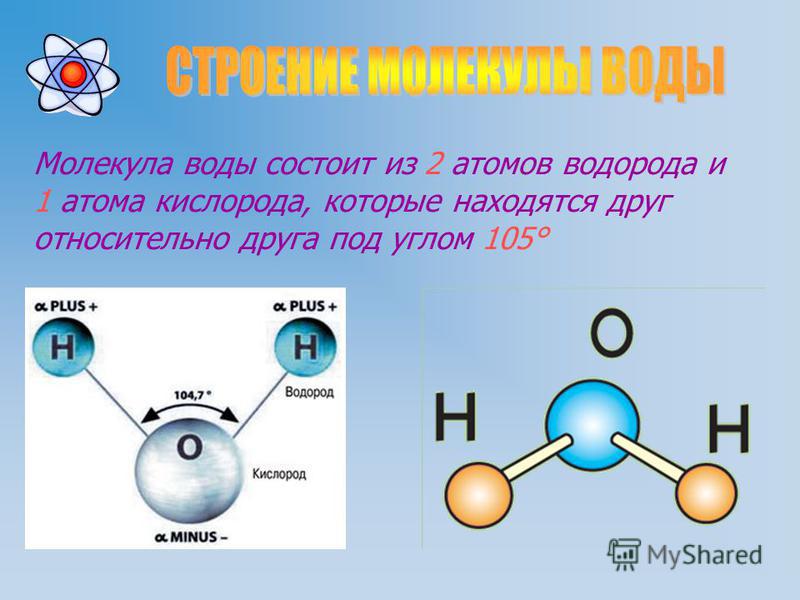


 Лед обладает уникальным свойством – он легче самой воды, из которой получен, и никогда не тонет в ней. Поэтому этому водоемы всегда замерзают сверху, что позволяет сохранить жизнь на дне.
Лед обладает уникальным свойством – он легче самой воды, из которой получен, и никогда не тонет в ней. Поэтому этому водоемы всегда замерзают сверху, что позволяет сохранить жизнь на дне.