Оценка эффективности индукции родов в стационаре | Гурьев Д.Л., Охапкин М.Б., Гурьева Д.Д., Кабанов И.В., Гурьева М.С., Нидерштрат Л.Н., Сорокина Т.А.
Индукция родов (ИР) проводится с целью скорейшего завершения беременности при наличии какой-либо патологии у матери и/или плода. Цель ИР — предотвращение неблагоприятных материнских и перинатальных исходов при родах через естественные родовые пути (ЕРП) в клинических ситуациях, когда продолжение беременности и ожидание спонтанного начала родовой деятельности представляют собой более высокий риск, чем процедура родовозбуждения.
Частота ИР в странах с высоким уровнем доходов постоянно увеличивается и составляет в Австралии 26%, в Великобритании и США — по 23,3% [1]. В хорошо спланированном проспективном исследовании, которое не потеряло своей актуальности и сегодня, установлено, что при пролонгировании беременности более определенного срока увеличивается частота осложнений, таких как мертворождение, макросомия, наличие мекония в околоплодных водах, госпитализация новорожденного в отделение реанимации и интенсивной терапии [2].
При этом данные о влиянии ИР на частоту кесарева сечения (КС) в мире очень противоречивы. Большие наблюдательные исследования показали, что ИР повышает частоту абдоминального родоразрешения. Так, по данным D.B. Ehrenthal et al. [4], при применении ИР у первородящих с расположением плода в головном предлежании частота КС была в 1,87 раза выше, чем у беременных без применения ИР — 25,5% против 13,6% соответственно. Однако в одном из последних систематических обзоров, в который вошли 37 рандомизированных контролируемых исследований, продемонстрировано, что риск КС при ИР у беременных с интактными плодными оболочками достоверно ниже, чем при выжидательной тактике ведения [5]. Также интересны данные исследования ARRIVE, в котором на 6106 женщинах продемонстрировано у первородящих низкого перинатального риска снижение частоты КС при ИР в сроке 39 нед.
В 2015 г. T.A. Nippita et al. [1] предложили классификацию беременных с показаниями к ИР. Классификация создана с учетом паритета, срока беременности, КС в анамнезе, предлежания плода и количества плодов с целью оценки эффективности ИР в однородной группе. Мы применили данную классификацию в ГБУЗ ЯО «Областной перинатальный центр» (далее — Перинатальный центр), являющемся стационаром уровня 3А.
Цели исследования — оценка эффективности ИР, проведенной по одинаковым методикам в различных группах, определение категории беременных с наилучшим и наихудшим ответом на ИР, а также поиск клинико-анамнестических факторов снижения эффективности ИР в отдельных группах беременных.
Материал и методы
Ретроспективный анализ историй родов пациенток отделения патологии беременности Перинатального центра, которым проведена индукция родовой деятельности по локальному протоколу «Подготовка шейки матки к родам и родовозбуждение», разработанному в 2013 г.
Из исследования исключены случаи ИР, проведенной после преждевременного излития околоплодных вод, и случаи антенатальной гибели плода до начала родовозбуждения. Сформированы 10 групп в соответствии с международной классификацией эффективности ИР, предложенной T.A. Nippita.
Эффективной считалась ИР при завершении родов через ЕРП и отсутствии перинатальной смертности и тяжелой асфиксии у новорожденного.
В своем исследовании мы проанализировали распределение беременных по группам, частоту КС в группах с головным предлежанием плода и доношенным сроком беременности в зависимости от паритета и зрелости шейки матки на момент начала ИР по шкале Бишопа в модификации RCOG, применяемой в настоящее время во всем мире [7]. Были также проанализированы группы с тазовым предлежанием плода и анамнезом КС с головным предлежанием плода с целью выявления факторов, ухудшающих прогноз самопроизвольного окончания родов при их индукции. Все результаты были сопоставлены с данными, полученными в исследовании T.A. Nippita et al. [1]. Кроме того, оценивали показатели перинатальной смертности, частоту тяжелой асфиксии новорожденных при ИР и без ИР.
Контрольную группу составили беременные и роженицы, которые в это же время родоразрешались без применения ИР (2565 человек).
Для статистической обработки результатов применена программа Statistica 10. Достоверными считались различия при р<0,05.
Результаты и обсуждениеРаспределение пациенток по группам в соответствии с классификацией T.A. Nippita приведено в таблице 1.
Показаниями к ИР были: гестационный сахарный диабет (ГСД) — 271 беременная (35,4%), гипертензивные расстройства — 204 (26,7%), тенденция к перенашиванию беременности — 103 (13,5%), синдром задержки роста плода (СЗРП) — 58 (7,6%), крупный плод — 33 (4,3%), мало- и многоводие — 31 (4,1%), многоплодие — 18 (2,4%), акушерский холестаз — 13 (1,7%), резус-конфликт — 11 (1,4%), другие показания — 22 (2,9%).
Как видно из таблицы 1, наибольшую группу составили повторнородящие в сроке 39–40 нед. с головным предлежанием плода (5-я группа). При этом частота КС в этой группе была одной из самых низких — 6,6%. Наибольшая частота КС зарегистрирована в 8-й группе (беременные с КС в анамнезе и головным предлежанием плода) — 44,0%.
В целом при ИР частота КС составила 15,5% (119 пациенток из 765), тогда как частота абдоминального родоразрешения в Перинатальном центре за этот же период времени (с 01.04.2018 по 31.12.2018) у пациенток, не включенных в исследование, составила 20,7% (531 из 2565), что достоверно выше (р=0,04).
Мы не установили достоверного различия в частоте КС между группами 1, 2, 3, в которые вошли первородящие женщины с одним плодом в головном предлежании в сроках беременности от 37 до ≥41 нед. У повторнородящих женщин с одним плодом в головном предлежании частота КС в сроки 37–38 нед. (4-я группа) и 39–40 нед. (5-я группа) была абсолютно одинакова и составляла 6,6%, а в сроке 41 нед. и более (6-я группа) — 2,4%, что, однако, не имеет статистически достоверного отличия от 4-й и 5-й групп (р=0,66 и р=0,47 соответственно).
При сравнении частоты КС в группах перво- и повторнородящих с одинаковым сроком беременности установлена достоверно меньшая частота КС у повторнородящих, начиная со срока 39 нед.
Мы провели сравнение частоты КС в 1, 2, 3-й группах (первородящие в сроках от 37 до ≥41 нед. с головным предлежанием плода) и в 4, 5, 6-й группах (повторнородящие в сроках от 37 до ≥41 нед. с головным предлежанием плода) в зависимости от зрелости шейки матки на момент начала родовозбуждения.
На рисунке 1 приведена частота КС при ИР при доношенной одноплодной беременности с головным предлежанием плода в зависимости от зрелости шейки матки и паритета. При зрелости шейки матки 4 балла и менее частота КС в группах перво- и повторнородящих не различалась. При зрелости шейки матки от 5 до 9 баллов и 10 и более баллов частота успешной ИР была достоверно выше у повторнородящих женщин в сравнении с первородящими.
T. Nakano et al. [8] показали, что у 44% возрастных (35 лет и старше) первородящих попытка ИР при доношенном сроке беременности заканчивается неудачно и роды завершаются экстренным КС.
[8] показали, что у 44% возрастных (35 лет и старше) первородящих попытка ИР при доношенном сроке беременности заканчивается неудачно и роды завершаются экстренным КС.
Основными факторами риска неудачной попытки ИР и проведения экстренного КС в данном исследовании были гипертензивное расстройство и незрелая шейка матки.
В группе преждевременных родов с головным предлежанием плода (7-я группа) частота КС составила 28,3%. В целом в Перинатальном центре частота КС припреждевременных родах с головным предлежанием плода в последние годы составляет 23,8–26% независимости от того, являются они спонтанными или индуцированными, и независимо от наличия КС в анамнезе [9]. Таким образом, применение ИР при недоношенной беременности, по нашим данным, не ассоциировано с увеличением частоты КС при преждевременных родах.
У пациенток с одним КС в анамнезе (8-я группа) доля КС при ИР составила всего 44%, тогда как, по данным нашего предыдущего исследования [9], среди всех беременных
с КС в анамнезе и головным предлежанием плода частота абдоминального родоразрешения составила 63,6%. Безусловно, при ИР происходит более тщательный отбор беременных для самостоятельных родов, с чем и связана более низкая частота КС при ИР. Однако, по нашему мнению, несмотря на это, группа беременных с КС в анамнезе и ИР остается резервом для снижения частоты КС в клинике, поскольку, по данным Американского общества акушеров-гинекологов (ACOG), в случае принятия решения о вагинальном родоразрешении у беременных с КС в анамнезе частота успешных родов составляет не менее 60–80% [10].
Безусловно, при ИР происходит более тщательный отбор беременных для самостоятельных родов, с чем и связана более низкая частота КС при ИР. Однако, по нашему мнению, несмотря на это, группа беременных с КС в анамнезе и ИР остается резервом для снижения частоты КС в клинике, поскольку, по данным Американского общества акушеров-гинекологов (ACOG), в случае принятия решения о вагинальном родоразрешении у беременных с КС в анамнезе частота успешных родов составляет не менее 60–80% [10].
В таблице 2 приведены показатели женщин из 8-й группы (с КС в анамнезе), у которых попытка ИР была удачной и роды завершились через ЕРП, и женщин с КС в анамнезе, у которых попытка ИР была неудачной, в связи с чем пришлось проводить абдоминальное родоразрешение.
Как видно из таблицы 2, наиболее значимыми факторами неудачной ИР у женщин с КС в анамнезе были достоверно меньшая зрелость шейки матки и применение мифепристона. При начале родовозбуждения с амниотомии частота успешной индукции была существенно, но статистически недостоверно выше. Эффективность остальных способов подготовки шейки матки к родам и ИР в группе успешного окончания родов и в группе КС достоверно не различалась. При родовозбуждении у пациенток с рубцом на матке нами был применен окситоцин: в 32,1% случаев вагинальных родов и в 22,7% случаев родов, закончившихся повторным КС. Также в 7,1 и 4,5% случаев соответственно окситоцин применялся для родоусиления.
Эффективность остальных способов подготовки шейки матки к родам и ИР в группе успешного окончания родов и в группе КС достоверно не различалась. При родовозбуждении у пациенток с рубцом на матке нами был применен окситоцин: в 32,1% случаев вагинальных родов и в 22,7% случаев родов, закончившихся повторным КС. Также в 7,1 и 4,5% случаев соответственно окситоцин применялся для родоусиления.
При применении окситоцина все пациентки с КС в анамнезе подписывали информированное добровольное согласие, а окситоцин назначался консилиумом врачей по согласованию с врачебной комиссией.
Основным показанием к КС в процессе проведения ИР при ее неудаче была дистоция родов, включающая в себя неэффективность родовозбуждения, первичную или вторичную слабость родовой деятельности, дискоординацию родовой деятельности. Безусловно, при КС в анамнезе рубец на матке является сдерживающим фактором применения адекватной терапии аномалий родовой деятельности, прежде всего инфузии окситоцина. Каждый 4-й случай КС при ИР выполнен по показанию «дистресс плода». Следует отметить, что при проведении ИР у пациенток с КС в анамнезе проводилась кардиотокография (непрерывный КТГ-мониторинг), что способствовало своевременной регистрации признаков внутриутробного страдания плода. Кроме того, при появлении децелераций у беременной и роженицы с рубцом на матке решение о родоразрешении абдоминальным путем принималось быстрее и чаще, чем в аналогичной ситуации у женщины без КС в анамнезе. Это связано с тем, что дистресс плода является начальным симптомом расхождения матки по рубцу. При этом в проведенном анализе случаев расхождения матки по рубцу (разрыва матки) не зарегистрировано.
Каждый 4-й случай КС при ИР выполнен по показанию «дистресс плода». Следует отметить, что при проведении ИР у пациенток с КС в анамнезе проводилась кардиотокография (непрерывный КТГ-мониторинг), что способствовало своевременной регистрации признаков внутриутробного страдания плода. Кроме того, при появлении децелераций у беременной и роженицы с рубцом на матке решение о родоразрешении абдоминальным путем принималось быстрее и чаще, чем в аналогичной ситуации у женщины без КС в анамнезе. Это связано с тем, что дистресс плода является начальным симптомом расхождения матки по рубцу. При этом в проведенном анализе случаев расхождения матки по рубцу (разрыва матки) не зарегистрировано.
Диагноз хориоамнионита как показание к КС был зарегистрирован только у одной беременной. Этот диагноз выставлен в соответствии с федеральными клиническими рекомендациями «Септические осложнения в акушерстве», утвержденными 06.02.2017. Хориоамнионит развился на фоне длительности безводного промежутка 7 ч при наличии Escherichia coli в результатах бактериологического исследования из цервикального канала.
В таблице 2 приведены данные пациенток 9-й группы (с тазовым предлежанием плода), у которых попытка ИР была удачной и роды завершились через ЕРП, и женщин, у которых попытка ИР была неудачной, в связи с чем проводилось родоразрешение путем КС.
В таблице 2 продемонстрировано, что наиболее значимым фактором, позволяющим прогнозировать успешное завершение родов через ЕРП после ИР при тазовом предлежании плода, как и при КС в анамнезе, является зрелость шейки матки. На момент начала ИР в группе успешного окончания родов шейка матки была более зрелой, чем в группе женщин, у которых роды в процессе индукции завершились абдоминальным родоразрешением. Также фактором успешного окончания родов через ЕРП было наличие СЗРП как показания к ИР. Основным показанием к КС у женщин с ИР при тазовом предлежании плода был переход чисто-ягодичного или смешанно-
ягодичного предлежания в ножное в процессе индукции. Дистоция родов была показанием к КС в каждом 4-м случае, наименьшее число абдоминальных родоразрешений выполнено по показанию «дистресс плода» и при отказе женщины от родов через ЕРП. Федеральные клинические рекомендации «Тазовое предлежание плода (ведение беременности и родов)», утвержденные 18.05.2017, разрешают выполнять КС при отказе пациентки от родов через ЕРП.
Федеральные клинические рекомендации «Тазовое предлежание плода (ведение беременности и родов)», утвержденные 18.05.2017, разрешают выполнять КС при отказе пациентки от родов через ЕРП.
Частота успешного окончания родов через ЕРП при индукции у женщин с тазовым предлежанием плода составила 56,2%.
В таблице 3 приведено сравнение эффективности ИР, проводимой в Перинатальном центре (г. Ярославль) и в клинике T.A. Nippita. В Перинатальном центре ИР была более эффективной, чем в клинике T.A. Nippita, у беременных всех групп, за исключением групп с КС в анамнезе и повторнородящих в сроках 39–40 нед. с одноплодной беременностью и головным предлежанием плода. Возможно, в группе с КС в анамнезе в нашей клинике сказалось сдержанное отношение к инфузии окситоцина у женщин с рубцом на матке. В Российской Федерации отсутствуют федеральные рекомендации по родоразрешению беременных с КС в анамнезе. Практика большинства родовспомогательных учреждений нашей страны предполагает проведение повторного КС при наличии даже одного рубца на матке. В связи с этим акушер-гинеколог, ведущий индуцированные роды у женщины с КС в анамнезе, оказывается в ситуации психологического дисбаланса, который выдерживают не все. Зачастую это приводит к ускоренному принятию решения о выполнении КС по экстренным показаниям в той ситуации, в которой женщина без рубца на матке, возможно, продолжила бы рожать самостоятельно и успешно родила через ЕРП.
В связи с этим акушер-гинеколог, ведущий индуцированные роды у женщины с КС в анамнезе, оказывается в ситуации психологического дисбаланса, который выдерживают не все. Зачастую это приводит к ускоренному принятию решения о выполнении КС по экстренным показаниям в той ситуации, в которой женщина без рубца на матке, возможно, продолжила бы рожать самостоятельно и успешно родила через ЕРП.
Более высокая частота КС при ИР у повторнородящих является резервом для снижения частоты КС в нашей клинике, в т. ч. при индуцированных родах. Частота тяжелой асфиксии новорожденного при ИР составила 5,4‰, без ИР — 6,5‰ (р=0,94). Перинатальная смертность при ИР не зарегистрирована. Частота тяжелой асфиксии в обеих группах достоверно не различалась, что указывает на отсутствие значимого влияния ИР на состояние плода. Важно также подчеркнуть, что перинатальной смертности при применении ИР во всех исследуемых группах не зарегистрировано.
Заключение
Применение ИР в Перинатальном центре следует считать эффективным, поскольку, во-первых, при ИР частота КС была ниже, чем без ИР, во-вторых, частота тяжелой асфиксии при ИР была сопоставима с таковой без ИР.
По нашим данным, факторами, повышающими эффективность ИР, следует считать повторные роды, головное предлежание плода, срок беременности более 38 нед., многоплодную беременность, а также отсутствие КС в анамнезе. Наиболее часто успешная ИР была зафиксирована у беременных с многоплодной беременностью.
Также следует отметить, что все методики ИР, которые применялись в Перинатальном центре, продемонстрировали высокую эффективность в клинических исследованиях. Так, R. Frydman et al. [11], которые провели единственное на сегодняшний день рандомизированное плацебо-контролируемое исследование эффективности применения мифепристона для ИР, показали, что частота самопроизвольных родов при его применении достоверно выше, чем в группе плацебо (54% против 18% соответственно, р<0,01). Авторы считают мифепристон безопасным, эффективным и подходящим для ИР при доношенной беременности. S. Delaney et al. [12] продемонстрировали более высокую эффективность применения катетера Фолея, наполненного 60 мл жидкости, чем при наполнении его 30 мл жидкости. Авторы рекомендуют применять у первородящих женщин для ИР только катетер Фолея, наполненный 60 мл жидкости. Мы в своей работе придерживались данных рекомендаций, что позволило добиться более высокой частоты спонтанных родов у первородящих женщин во все сроки доношенной беременности в сравнении с данными T.А. Nippita. Таким образом, классификация T.A. Nippita позволяет объективно проанализировать эффективность ИР в различных группах беременных и сопоставить эти данные с результатами работы других клиник.
Авторы рекомендуют применять у первородящих женщин для ИР только катетер Фолея, наполненный 60 мл жидкости. Мы в своей работе придерживались данных рекомендаций, что позволило добиться более высокой частоты спонтанных родов у первородящих женщин во все сроки доношенной беременности в сравнении с данными T.А. Nippita. Таким образом, классификация T.A. Nippita позволяет объективно проанализировать эффективность ИР в различных группах беременных и сопоставить эти данные с результатами работы других клиник.
Сведения об авторах:
1,2Гурьев Дмитрий Львович — к.м.н., главный врач, доцент кафедры акушерства и гинекологии, ORCID iD 0000-0002-3728-8840;
2Охапкин Михаил Борисович — д.м.н., профессор, заведующий кафедрой акушерства и гинекологии, ORCID iD 0000-0001-6277-2987;
2Гурьева Дарья Дмитриевна — студентка 5 курса лечебного факультета, ORCID iD 0000-0002-1245-7521;
2Кабанов Иван Владимирович — студент 5 курса лечебного факультета, ORCID iD 0000-0002-4412-2195;
1Гурьева Марина Сергеевна — к.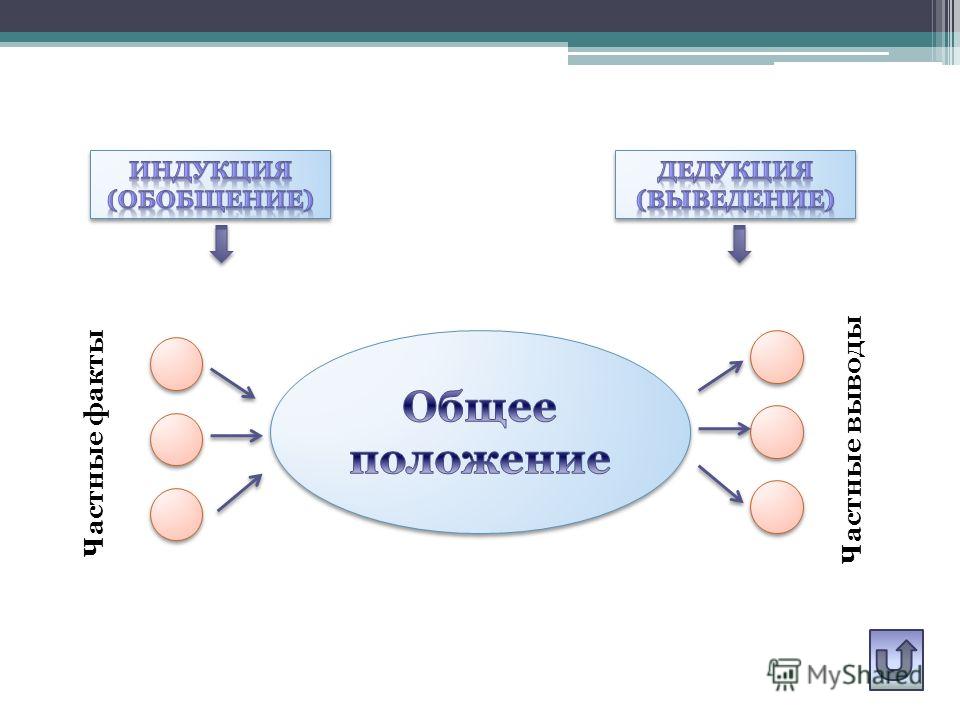 м.н., заместитель директора по клинико-экспертной работе, ORCID iD 0000-0003-4362-3171;
м.н., заместитель директора по клинико-экспертной работе, ORCID iD 0000-0003-4362-3171;
1Нидерштрат Любовь Николаевна — акушер-гинеколог отделения патологии беременности, ORCID iD 0000-0003-4212-4266;
1Сорокина Татьяна Александровна — акушер-гинеколог акушерского физиологического отделения, ORCID iD 0000-0001-8249-4785.
1ГБУЗ ЯО «Областной перинатальный центр». 150042,
г. Ярославль, Тутаевское ш., д. 31в.
2ФГБОУ ВО «Ярославский государственный медицинский университет». 150000, г. Ярославль, ул. Революционная, д. 5.
Контактная информация: Гурьев Дмитрий Львович, e-mail: [email protected]. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.11.2019.
About the authors:
1,2Dmitry L. Guryev — MD, PhD, Head Doctor, Associate Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-3728-8840;
Guryev — MD, PhD, Head Doctor, Associate Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-3728-8840;
2Mikhail B. Okhapkin — MD, PhD, Professor, Head of the Department of Obstetrics and Gynecology, ORCID iD 0000-0001-6277-2987;
2Darya D. Guryeva — student of 5th course of the Medical Faculty, ORCID iD 0000-0002-1245-7521;
2Ivan V. Kabanov — student of 5th course of the Medical Faculty, ORCID iD 0000-0002-4412-2195;
1Marina S. Guryeva — MD, Deputy of the Head physician, ORCID iD 0000-0003-4362-3171;
1Luobov N. Nidershtrat — MD, obstetrician of the Department of Pathological Pregnancy, ORCID iD 0000-0003-4212-4266;
1Tatiana A. Sorokina — MD, obstetrician of Physiological Obstetrical Department, ORCID iD 0000-0001-8249-4785.
1Regional Perinatal Center. 31V, Tutaevskoe shosse, Yaroslavl, 150042, Russian Federation.
31V, Tutaevskoe shosse, Yaroslavl, 150042, Russian Federation.
2Yaroslavl State Medical University. 5, Revolutsyonnaya str., Yaroslavl, 150000, Russian Federation.
Contact information: Dmitry L. Guryev, e-mail: [email protected]. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.11.2019.
Результаты этапа: Для выполнения первой задачи гранта – выяснения того, каким образом альфа1- и бета-адренорецепторы регулируют дифференцировку МСК в белый и бурый жир – на первом этапе было проведено исследование динамики появления и изменения концентрации мРНК ключевых маркеров адипогенной дифференцировки МСК. Клетки направляли в адипогенную дифференцировку при помощи редуцированного дифференцировочного коктейля для адипогенной дифференцировки МСК – смеси инсулина (10 нг/мл), ингибитора фосфодиэстеразы изобутиметилксантина (IBMX, 0,5 мМ) и глюкокортикоида дексаметазона (1 мкМ). Стандартный коктейль адипогенной дифференцировки обычно также включает в себя индометацин (100 мкМ). Это прямой активатор мастер-гена адипогенной дифференцировки PPARg. Мы его намеренно не добавляли в дифференцировочный коктейль, поскольку по нашим данным, индометацин, активируя напрямую PPARg, в обход инсулин-зависимых сигнальных путей, нивелирует тонкую настройку процесса адипогенной дифференцировки, обусловленную гормональной регуляцией МСК. МСК, направленные в адипогенную дифференцировку при помощи редуцированного дифференцировочного коктейля, дифференцируются на уровне, сравнимом со стандартным коктейлем. Как видно на Рис 1, в процессе адипогенной дифференцировки МСК накапливают жировые капли, эффективность дифференцировки достаточно высокая – порядка 90% клток подвергаетсяадипогенной дифференцировке. Клетки направляли в адипогенную дифференцировку при помощи редуцированного дифференцировочного коктейля для адипогенной дифференцировки МСК – смеси инсулина (10 нг/мл), ингибитора фосфодиэстеразы изобутиметилксантина (IBMX, 0,5 мМ) и глюкокортикоида дексаметазона (1 мкМ). Стандартный коктейль адипогенной дифференцировки обычно также включает в себя индометацин (100 мкМ). Это прямой активатор мастер-гена адипогенной дифференцировки PPARg. Мы его намеренно не добавляли в дифференцировочный коктейль, поскольку по нашим данным, индометацин, активируя напрямую PPARg, в обход инсулин-зависимых сигнальных путей, нивелирует тонкую настройку процесса адипогенной дифференцировки, обусловленную гормональной регуляцией МСК. МСК, направленные в адипогенную дифференцировку при помощи редуцированного дифференцировочного коктейля, дифференцируются на уровне, сравнимом со стандартным коктейлем. Как видно на Рис 1, в процессе адипогенной дифференцировки МСК накапливают жировые капли, эффективность дифференцировки достаточно высокая – порядка 90% клток подвергаетсяадипогенной дифференцировке. Еще один важный момент – накапливающиеся жировые капли возможно наблюдать под микроскопом без специальной окраски клеток, что будет крайне полезно при выполнении второй задачи гранта – наблюдении за адипогенной дифференцировкой в режиме реального времени. Для контроля того, что наблюдаемые в цитоплазме дифференцирующихся клеток капли – это действительно триглицериды, нейтральные липиды, мы воспользовались красителем, специфичным к нейтральным липидам – OilRed O. Жировые капли при этом окрашиваются в красный цвет (Рис 2).
Для выполнения первой задачи гранта мы оценили, как предварительная обработка клеток норадреналином влияет на адипогенную дифференцировку. Обработку норадреналином мы производили в двух вариантах: однократная обработка клеток гормоном и с предварительной инициацией гетерологической сенситизации клеток. Во втором случае клетки за 6 часов до постановки на адипогенную дифференцировку предобрабатывали норадреналином в течение 1 часа с последующей тщательной отмывкой от гормона. Еще один важный момент – накапливающиеся жировые капли возможно наблюдать под микроскопом без специальной окраски клеток, что будет крайне полезно при выполнении второй задачи гранта – наблюдении за адипогенной дифференцировкой в режиме реального времени. Для контроля того, что наблюдаемые в цитоплазме дифференцирующихся клеток капли – это действительно триглицериды, нейтральные липиды, мы воспользовались красителем, специфичным к нейтральным липидам – OilRed O. Жировые капли при этом окрашиваются в красный цвет (Рис 2).
Для выполнения первой задачи гранта мы оценили, как предварительная обработка клеток норадреналином влияет на адипогенную дифференцировку. Обработку норадреналином мы производили в двух вариантах: однократная обработка клеток гормоном и с предварительной инициацией гетерологической сенситизации клеток. Во втором случае клетки за 6 часов до постановки на адипогенную дифференцировку предобрабатывали норадреналином в течение 1 часа с последующей тщательной отмывкой от гормона. Непосредственно перед запууском адипогенной дифференцировки в обоих случаях клетки обрабатывали ноардреналином в течение 1 часа (см схему на Рис 2). Далее клетки отмывали и помещали в коктейль для адипогенной дифференцировки. Коктейль меняли на свежий каждые три-четыре дня (два раза в неделю). Таким образом, норадреналин действовал на клетки только в течение короткого времени перед запуском дифференцировки. Как видно из третьей и четвертой фотографии клеток, сделанных на 14 день адипогенной дифференцировки, однократная и двукратная предобработка МСК норадреналином приводит к снижению числа клеток, накапливающих жировые капли.
Для числовой оценки эффекта норадреналина на адипогенную дифференцировку МСК, а также для выяснения наиболее оптимальной временной точки регистрации уровня дифференцировки мы воспользовались методом ПЦР в реальном времени. Для этого мы останавливали на 1, 3 или 7 день адипогенную дифференцировку и в лизатах клеток измеряли относительный уровень мРНК маркеров адипогенной дифференцировки в белый жир. Непосредственно перед запууском адипогенной дифференцировки в обоих случаях клетки обрабатывали ноардреналином в течение 1 часа (см схему на Рис 2). Далее клетки отмывали и помещали в коктейль для адипогенной дифференцировки. Коктейль меняли на свежий каждые три-четыре дня (два раза в неделю). Таким образом, норадреналин действовал на клетки только в течение короткого времени перед запуском дифференцировки. Как видно из третьей и четвертой фотографии клеток, сделанных на 14 день адипогенной дифференцировки, однократная и двукратная предобработка МСК норадреналином приводит к снижению числа клеток, накапливающих жировые капли.
Для числовой оценки эффекта норадреналина на адипогенную дифференцировку МСК, а также для выяснения наиболее оптимальной временной точки регистрации уровня дифференцировки мы воспользовались методом ПЦР в реальном времени. Для этого мы останавливали на 1, 3 или 7 день адипогенную дифференцировку и в лизатах клеток измеряли относительный уровень мРНК маркеров адипогенной дифференцировки в белый жир. Ключевые маркеры дифференцированных адипоцитов – это мастер-ген адипогенной дифференцировки транскрипционный фактор PPARg адипокин, специфичный для дифференцированных жировых клеток – адипонектин. Как показано на Рис 3, уровень мРНК PPARg при адипогенной дифференцировке МСК повышается, но не более чем в 10 раз по сравнению с недифференцированными клетками. Это может быть связано с тем, что МСК находятся в преддифференцированном (коммитированном) состоянии с предварительно повышенным уровнем этого мастер-гена, что согласуется с литературными данными (Robey, 2017). При этом как однократная, так и двукратная предварительная стимуляция клеток норадреналином приводит к подавлению роста уровня мРНК PPARg. В случае мРНК адипонектина изменения оказываются гораздо значительнее. Недифференцирвоанные МСК вообще не содержат мРНК адипонектина, на третий день он появляется на детектируемом уровне, а уже на 7 день уровень его экспрессии более чем в сто раз превышает значения третьего дня (Рис 4). Подавление адипогенной дифференцировки, вызываемое норадреналином, наиболее хорошо видно на 7 день диференцировки. Ключевые маркеры дифференцированных адипоцитов – это мастер-ген адипогенной дифференцировки транскрипционный фактор PPARg адипокин, специфичный для дифференцированных жировых клеток – адипонектин. Как показано на Рис 3, уровень мРНК PPARg при адипогенной дифференцировке МСК повышается, но не более чем в 10 раз по сравнению с недифференцированными клетками. Это может быть связано с тем, что МСК находятся в преддифференцированном (коммитированном) состоянии с предварительно повышенным уровнем этого мастер-гена, что согласуется с литературными данными (Robey, 2017). При этом как однократная, так и двукратная предварительная стимуляция клеток норадреналином приводит к подавлению роста уровня мРНК PPARg. В случае мРНК адипонектина изменения оказываются гораздо значительнее. Недифференцирвоанные МСК вообще не содержат мРНК адипонектина, на третий день он появляется на детектируемом уровне, а уже на 7 день уровень его экспрессии более чем в сто раз превышает значения третьего дня (Рис 4). Подавление адипогенной дифференцировки, вызываемое норадреналином, наиболее хорошо видно на 7 день диференцировки. При этом, так же как и уровень мРНК PPARg, уровень адипонектина при двукратной стимуляции клеток норадреналином с интервалом в 6 часов, лишь усиливал эффект подавления. Вызванный однократной стимуляцией, но не производил существенно отличных от подавления эффектов. В дальнейшем для проведения ингибиторного анализа и влияния различных изоформ адренорецепторов мы лизировали клетки именно на 7 день.
Для выяснения того, как активация альфа1- и бета-адренорецепторов при поочередной стимуляции в различных комбинациях повлияют на адипогенную дифференцировку МСК, мы выполнили эксперимент, схема которого показана на Рис 5. Клетки стимулировали агонистом альфа1-адренорецепторов фенилэфрином (10-4М), либо агонистом бета-адренорецепторов добутамином (10-6М). В случае ингибиторного анализа клетки обрабатывали норадреналином в присутствии селективного ингибитора ключевого сигнального фермента, активируемого бета-адренорецепторами аденилат-циклазы SQ22536 (10-6М), либо норадреналином в присутствии 2-APB, ингибитора рецептора инозитол-(1,4,5)трис-фосфата (IP3R), ключевого действующего лица передачи сигнала от рецепторов, сопряженных с Gq-белком и кальциевой сигнализацией (в случае совместной с норадреналином стимуляции ингибируется сигнализация от альфа1-адренорецепторов). При этом, так же как и уровень мРНК PPARg, уровень адипонектина при двукратной стимуляции клеток норадреналином с интервалом в 6 часов, лишь усиливал эффект подавления. Вызванный однократной стимуляцией, но не производил существенно отличных от подавления эффектов. В дальнейшем для проведения ингибиторного анализа и влияния различных изоформ адренорецепторов мы лизировали клетки именно на 7 день.
Для выяснения того, как активация альфа1- и бета-адренорецепторов при поочередной стимуляции в различных комбинациях повлияют на адипогенную дифференцировку МСК, мы выполнили эксперимент, схема которого показана на Рис 5. Клетки стимулировали агонистом альфа1-адренорецепторов фенилэфрином (10-4М), либо агонистом бета-адренорецепторов добутамином (10-6М). В случае ингибиторного анализа клетки обрабатывали норадреналином в присутствии селективного ингибитора ключевого сигнального фермента, активируемого бета-адренорецепторами аденилат-циклазы SQ22536 (10-6М), либо норадреналином в присутствии 2-APB, ингибитора рецептора инозитол-(1,4,5)трис-фосфата (IP3R), ключевого действующего лица передачи сигнала от рецепторов, сопряженных с Gq-белком и кальциевой сигнализацией (в случае совместной с норадреналином стимуляции ингибируется сигнализация от альфа1-адренорецепторов). Для того чтобы ингибиторы достоверно подействовали их добавляли за 30 минут до стимуляции клеток норадреналином. Первая стимуляция гормонами и агонистами длилась 1 час, после чего клетки тщательно отмывали трехкратной заменой среды и помещали в полную среду роста. Через 5 часов клетки повторно стимулировали агонистами или норадреналином в присутствии ингибиторов также в течение 1 часа. Комбинации первой и второй стимуляций указаны на рисунках через стрелку под соответствующим столбиком диаграммы.
Как видно на Рис 5,Б, Норадреналин подавляет адипогенную дифференцировку МСК действуя через бета-адренорецепторы. Стимуляция бета-адренорецепторов в любых комбинациях с альфа1-адренорецепторами подавляет дифференцировку, но сами альфа1-адренорецепторы на дифференцировку не влияют. Двукратная стимуляция бета-адренорецепторов подавляет дифференцировку сильнее, чем однократная. Как показано на Рис 6, Б, норадреналин оказывал схожие эффекты на дифференцировку МСК, характеризуемую уровнем экспрессии PPARg. Для того чтобы ингибиторы достоверно подействовали их добавляли за 30 минут до стимуляции клеток норадреналином. Первая стимуляция гормонами и агонистами длилась 1 час, после чего клетки тщательно отмывали трехкратной заменой среды и помещали в полную среду роста. Через 5 часов клетки повторно стимулировали агонистами или норадреналином в присутствии ингибиторов также в течение 1 часа. Комбинации первой и второй стимуляций указаны на рисунках через стрелку под соответствующим столбиком диаграммы.
Как видно на Рис 5,Б, Норадреналин подавляет адипогенную дифференцировку МСК действуя через бета-адренорецепторы. Стимуляция бета-адренорецепторов в любых комбинациях с альфа1-адренорецепторами подавляет дифференцировку, но сами альфа1-адренорецепторы на дифференцировку не влияют. Двукратная стимуляция бета-адренорецепторов подавляет дифференцировку сильнее, чем однократная. Как показано на Рис 6, Б, норадреналин оказывал схожие эффекты на дифференцировку МСК, характеризуемую уровнем экспрессии PPARg. Ингибиторный анализ норадреналин-зависимой регуляции адипогенной дифференцировки МСК показал менее однозначные результаты. С одной стороны, блокирование сигнальных каскадов, активируемых бета-адренорецепторами при помощи SQ22536 привело к нивелированию эффекта норадреналина на подавление дифференцировки. Это полностью согласуется с результатами, показанными при помощи специфических агонистов адренорецепторов. В то же время, подавляющий эффект норадреналина нивелировался при ингибировании кальций-зависимых сигнальных каскадов при помощи 2-APB. Более того, уровень экспрессии мРНК адипонектина показывал даже тенденцию к некоторому росту. Можно предположить, что кальциевая сигнализация необходима для подавления норадреналином дифференцировки МСК, но тогда возникает вопрос, почему стимуляция входа кальция фенилэфрином не влияла на дифференцировку. Возможное объяснение может быть следующее. Для подавляющего действия цАМФ-зависимых сигнальных путей, активируемых через бета-адренорецепторы, требуется синергичное действие кальциевых сигнальных путей, активируемых на базальном уровне.
Ингибиторный анализ норадреналин-зависимой регуляции адипогенной дифференцировки МСК показал менее однозначные результаты. С одной стороны, блокирование сигнальных каскадов, активируемых бета-адренорецепторами при помощи SQ22536 привело к нивелированию эффекта норадреналина на подавление дифференцировки. Это полностью согласуется с результатами, показанными при помощи специфических агонистов адренорецепторов. В то же время, подавляющий эффект норадреналина нивелировался при ингибировании кальций-зависимых сигнальных каскадов при помощи 2-APB. Более того, уровень экспрессии мРНК адипонектина показывал даже тенденцию к некоторому росту. Можно предположить, что кальциевая сигнализация необходима для подавления норадреналином дифференцировки МСК, но тогда возникает вопрос, почему стимуляция входа кальция фенилэфрином не влияла на дифференцировку. Возможное объяснение может быть следующее. Для подавляющего действия цАМФ-зависимых сигнальных путей, активируемых через бета-адренорецепторы, требуется синергичное действие кальциевых сигнальных путей, активируемых на базальном уровне. При их блокировании цАМФ перестает действовать. Объяснение данного феномена требует дальнейших экспериментов .
Для выяснения участия гетерологической сенситизации в регуляции дифференцирвоки МСК в бурые адипоциты мы измеряли уровень экспрессии мРНК разобщающего белка митохондрий, UCP1. Сбрасывая трансмембранный электрохимический потенциал протонов на внутренней мембране митохондрий в результате чего выделяется тепло, этот белок является специфическим маркером бурых адипоцитов бурой жировой ткани и образующихся бурых (бежевых) адипоцитов белой жировой ткани. Одно- и двукратная обработка МСК норадреналином показала (Рис 7, Б), что что только при двукратной обработке с интервалом в 6 часов повышается уровень экспрессии UCP1. Это значит, что программа по активации синтеза UCP1 запускается только после реализации гетерологической сенситизации в МСК. Это существенно контрастирует с градуальным снижением уровня маркеров адипогенной дифференцировки адипонектина и PPARg. Двукратное действие добутамина подавляло экспрессию UCP1, что опять же контрастирует с влиянием агонистов на маркеры белого жира, когда эффект норадреналина полностью воспроизводился бета-агонистами. При их блокировании цАМФ перестает действовать. Объяснение данного феномена требует дальнейших экспериментов .
Для выяснения участия гетерологической сенситизации в регуляции дифференцирвоки МСК в бурые адипоциты мы измеряли уровень экспрессии мРНК разобщающего белка митохондрий, UCP1. Сбрасывая трансмембранный электрохимический потенциал протонов на внутренней мембране митохондрий в результате чего выделяется тепло, этот белок является специфическим маркером бурых адипоцитов бурой жировой ткани и образующихся бурых (бежевых) адипоцитов белой жировой ткани. Одно- и двукратная обработка МСК норадреналином показала (Рис 7, Б), что что только при двукратной обработке с интервалом в 6 часов повышается уровень экспрессии UCP1. Это значит, что программа по активации синтеза UCP1 запускается только после реализации гетерологической сенситизации в МСК. Это существенно контрастирует с градуальным снижением уровня маркеров адипогенной дифференцировки адипонектина и PPARg. Двукратное действие добутамина подавляло экспрессию UCP1, что опять же контрастирует с влиянием агонистов на маркеры белого жира, когда эффект норадреналина полностью воспроизводился бета-агонистами. Различные комбинации агонистов адренорецепторов показали, что только комбинация добутаминфенилэфрин, которая специфически имитирует гетерологическую сенситизацию, вызывает эффект, аналогичный двукратному действию норадреналина. Таким образом, гетерологическая сенситизация МСК, осуществляемая перед запуском адипогенной дифференцировки, направляет клетки в сторону дифференцировки в бурый жир.
Ингибиторный анализ бурой дифференцировки МСК показал (Рис 6, В), что для коммитирования клеток в этом направлении требуется действие норадреналина в присутствии подавленной активности аденилат-циклазы и активация кальциевой сигнализации. При блокировании выхода кальция из эндоплазматического ретикулума стимулирующий эффект норадреналина пропадает. При действии норадреналина или агонистов добутаминфенилэфрин ингибирование активности аденилат-циклазы может происходить за счет десенситизации бета-адренорецепторов, которую мы наблюдали ранее (Tyurin-Kuzmin et al., 2016). Таким образом, гетерологическая сенситизация альфа1-адренорецепторов вызывает коммитирование клеток в направлении бурой дифференцировки. Различные комбинации агонистов адренорецепторов показали, что только комбинация добутаминфенилэфрин, которая специфически имитирует гетерологическую сенситизацию, вызывает эффект, аналогичный двукратному действию норадреналина. Таким образом, гетерологическая сенситизация МСК, осуществляемая перед запуском адипогенной дифференцировки, направляет клетки в сторону дифференцировки в бурый жир.
Ингибиторный анализ бурой дифференцировки МСК показал (Рис 6, В), что для коммитирования клеток в этом направлении требуется действие норадреналина в присутствии подавленной активности аденилат-циклазы и активация кальциевой сигнализации. При блокировании выхода кальция из эндоплазматического ретикулума стимулирующий эффект норадреналина пропадает. При действии норадреналина или агонистов добутаминфенилэфрин ингибирование активности аденилат-циклазы может происходить за счет десенситизации бета-адренорецепторов, которую мы наблюдали ранее (Tyurin-Kuzmin et al., 2016). Таким образом, гетерологическая сенситизация альфа1-адренорецепторов вызывает коммитирование клеток в направлении бурой дифференцировки. Второй задачей, запланированной на первый год реализации проекта, был подбор условий для анализа адипогенной дифференцировки МСК в режиме реального времени на уровне одиночных клеток. Для выполнения этой задачи мы ставили эксперимент, схема которого показана на Рис 8. Клетки высаживали на культуральные планшеты в плотности, необходимой для прохождения адипогенной дифференцировки. Клетки красили кальций-чувствительным красителем Fluo8 (4 мкМ) в течение 1 часа и после этого под микроскопом стимулировали клетки норадреналином и регистрировали кальциевые ответы на уровне одиночных клеток (Рис 9, верхняя строка). Индивидуальные клетки, ответившие на норадреналин кальциевой сигнализацией, указаны белыми стрелками. После приблизительно 1 часа инкубации с норадреналином клетки отмыли и перевели в среду для адипогенной дифференцирвки. После этого планшет был возвращен под микроскоп, оснащенный инкубатором с увлажнением и подводом газовой смеси. Планшет был позиционирован так, чтобы он вернулся точно на те же позиции, в которых производилась съемка сигнализации.
Второй задачей, запланированной на первый год реализации проекта, был подбор условий для анализа адипогенной дифференцировки МСК в режиме реального времени на уровне одиночных клеток. Для выполнения этой задачи мы ставили эксперимент, схема которого показана на Рис 8. Клетки высаживали на культуральные планшеты в плотности, необходимой для прохождения адипогенной дифференцировки. Клетки красили кальций-чувствительным красителем Fluo8 (4 мкМ) в течение 1 часа и после этого под микроскопом стимулировали клетки норадреналином и регистрировали кальциевые ответы на уровне одиночных клеток (Рис 9, верхняя строка). Индивидуальные клетки, ответившие на норадреналин кальциевой сигнализацией, указаны белыми стрелками. После приблизительно 1 часа инкубации с норадреналином клетки отмыли и перевели в среду для адипогенной дифференцирвки. После этого планшет был возвращен под микроскоп, оснащенный инкубатором с увлажнением и подводом газовой смеси. Планшет был позиционирован так, чтобы он вернулся точно на те же позиции, в которых производилась съемка сигнализации. После этого планшет находился под микроскопом в течение двух недель. При этом каждые 3-4 дня фильм останавливали, под ламинаром заменяли среду на новую адипогенную и ставили планшет обратно под микроскоп. Фотографии клеток делали с интервалом 30 мин. Этот интервал был выбран таким, чтобы отдельные клетки не успевали далеко уползти или изменить форму так, что их было бы невозможно идентифицирвать. После окончания съемки фильма мы проследили за дифференцировочной судьбой клеток, ответивших на норадреналин кальцием. Как видно из Рис 10, ни одна клетка, ответившая кальцием на норадреналин, не накопила большое количество жировых капель. Цитоплазма большинства клеток осталась свободной от капель. Таким образом, клетки, отвечающие кальциевой сигнализацией на действие норадреналина. Не дифференцируются в белые адипоциты. Появление в некоторых клетках небольшого количества мелких жировых капель может свидетельствовать о дифференцировке этих клеток в бурые адипоциты, но проверка этого предположения будет произведена во втором году реализации проекта. После этого планшет находился под микроскопом в течение двух недель. При этом каждые 3-4 дня фильм останавливали, под ламинаром заменяли среду на новую адипогенную и ставили планшет обратно под микроскоп. Фотографии клеток делали с интервалом 30 мин. Этот интервал был выбран таким, чтобы отдельные клетки не успевали далеко уползти или изменить форму так, что их было бы невозможно идентифицирвать. После окончания съемки фильма мы проследили за дифференцировочной судьбой клеток, ответивших на норадреналин кальцием. Как видно из Рис 10, ни одна клетка, ответившая кальцием на норадреналин, не накопила большое количество жировых капель. Цитоплазма большинства клеток осталась свободной от капель. Таким образом, клетки, отвечающие кальциевой сигнализацией на действие норадреналина. Не дифференцируются в белые адипоциты. Появление в некоторых клетках небольшого количества мелких жировых капель может свидетельствовать о дифференцировке этих клеток в бурые адипоциты, но проверка этого предположения будет произведена во втором году реализации проекта. Таким образом, мы показали, что гетерологическая сенситизация МСК, вызываемая стимуляцией бета-адренорецепторов, которая приводит к потенциации клеток к кальций-зависимому ответу через альфа1А-адренорецепторы, приводит, во-первых, к подавлению дифференцировки МСК в белые адипоциты, которая выражается в снижении уровня экспрессии PPARg и адипонектина и блокировке накопления жировых капель в цитоплазме, во-вторых, к активации дифференцировки клеток в бурые адипоциты, которая выражается в повышении уровня экспрессии UCP1. На уровне одиночных клеток была показана прямая корреляция между кальциевым ответом на норадреналин и отсутствием адипогенной дифференцировки в белый жир.
Таким образом, мы показали, что гетерологическая сенситизация МСК, вызываемая стимуляцией бета-адренорецепторов, которая приводит к потенциации клеток к кальций-зависимому ответу через альфа1А-адренорецепторы, приводит, во-первых, к подавлению дифференцировки МСК в белые адипоциты, которая выражается в снижении уровня экспрессии PPARg и адипонектина и блокировке накопления жировых капель в цитоплазме, во-вторых, к активации дифференцировки клеток в бурые адипоциты, которая выражается в повышении уровня экспрессии UCP1. На уровне одиночных клеток была показана прямая корреляция между кальциевым ответом на норадреналин и отсутствием адипогенной дифференцировки в белый жир.
|
Медицинские причины для стимуляции родов
Стимулирование родов (также называемое стимуляцией родов) — это когда ваш поставщик дает вам лекарство или отводит воду, чтобы вызвать роды.
Ваш лечащий врач может порекомендовать стимуляцию родов, если ваше здоровье или здоровье вашего ребенка находятся под угрозой, или если срок родов истек на 2 недели или больше.

Стимулировать роды можно только по медицинским показаниям. Если ваша беременность протекает нормально, лучше подождать, пока роды не начнутся сами по себе.
Если ваш лечащий врач рекомендует стимуляцию родов, спросите, можно ли подождать до 39 недель, чтобы индуцировать ее, чтобы у вашего ребенка было время развиваться в утробе матери.
Что вызывает роды?
Стимулирование родов (также называемое индукцией родов) — это когда ваш лечащий врач дает вам лекарство или использует другие методы, например разрыв вод (амниотического мешка), чтобы начать роды. Амниотический мешок (также называемый водяным мешком) — это мешок внутри матки (матки), в котором находится ваш растущий ребенок. Мешок заполнен амниотической жидкостью. Схватки — это когда мышцы матки напрягаются, а затем расслабляются. Схватки помогают вытолкнуть ребенка из матки.
Ваш лечащий врач может порекомендовать стимуляцию родов, если ваше здоровье или здоровье вашего ребенка находятся под угрозой, или если срок родов истек на 2 недели или более.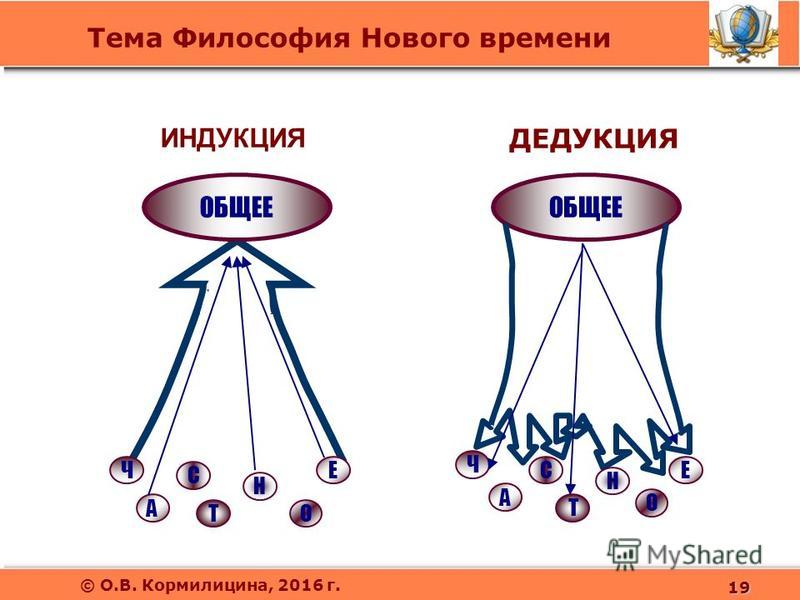 Для некоторых женщин стимуляция родов — лучший способ сохранить здоровье мамы и ребенка. Стимулировать роды следует только по медицинским показаниям.
Для некоторых женщин стимуляция родов — лучший способ сохранить здоровье мамы и ребенка. Стимулировать роды следует только по медицинским показаниям.
Если есть медицинские причины для стимуляции родов, поговорите со своим врачом о том, чтобы подождать как минимум до 39 недель беременности. Это дает вашему ребенку время, необходимое ему для роста и развития до рождения. Планирование индукции родов должно осуществляться только по медицинским показаниям.
Каковы медицинские показания для стимуляции родов?
Ваш врач может порекомендовать стимуляцию родов, если:
- Срок вашей беременности превышает 41–42 недели. После 42 недель плацента может работать не так хорошо, как раньше во время беременности. Плацента растет в вашей матке (матке) и снабжает вашего ребенка пищей и кислородом через пуповину.
- Ваша плацента отделяется от матки (также называемая отслойкой плаценты) или у вас инфекция в матке.
- У вас отходят воды до начала родов.
 Это называется преждевременным разрывом плодных оболочек (также называемым PROM).
Это называется преждевременным разрывом плодных оболочек (также называемым PROM). - У вас есть проблемы со здоровьем, такие как диабет, высокое кровяное давление или преэклампсия, или проблемы с сердцем, легкими или почками. Диабет — это когда в крови слишком много сахара (называемого глюкозой). Это может привести к повреждению органов в вашем теле, включая кровеносные сосуды, нервы, глаза и почки. Высокое кровяное давление — это когда давление крови на стенки кровеносных сосудов слишком велико и нагружает сердце. Преэклампсия — это серьезное нарушение артериального давления, которое может возникнуть после 20-й недели беременности или после родов (так называемая послеродовая преэклампсия).
- Ваш ребенок перестал расти. Или у вашего ребенка маловодие. Это означает, что у вашего ребенка недостаточно амниотической жидкости.
- У вас резус-фактор, из-за которого у вашего ребенка возникают проблемы с кровью.
Каковы риски планирования индукции родов по немедицинским причинам?
Планирование индукции родов может вызвать проблемы для вас и вашего ребенка, поскольку ваш срок родов может быть не совсем точным. Иногда трудно точно определить, когда вы забеременели. Если вы запланировали родовозбуждение, а срок родов сдвинулся на неделю или две, ваш ребенок может родиться раньше срока. Дети, рожденные раньше срока (так называемые недоношенные дети), могут иметь больше проблем со здоровьем при рождении и в более позднем возрасте, чем дети, рожденные в срок. Вот почему важно дождаться как минимум 39 лет.недель, чтобы вызвать роды.
Иногда трудно точно определить, когда вы забеременели. Если вы запланировали родовозбуждение, а срок родов сдвинулся на неделю или две, ваш ребенок может родиться раньше срока. Дети, рожденные раньше срока (так называемые недоношенные дети), могут иметь больше проблем со здоровьем при рождении и в более позднем возрасте, чем дети, рожденные в срок. Вот почему важно дождаться как минимум 39 лет.недель, чтобы вызвать роды.
Если ваша беременность протекает нормально, лучше всего позволить родам начаться самостоятельно. Если ваш поставщик говорит с вами о стимуляции родов, спросите, можете ли вы подождать, по крайней мере, до 39 недель, чтобы индуцировать роды. Это дает легким и мозгу вашего ребенка все время, необходимое для полного роста и развития до его рождения.
Если у вас есть проблемы с беременностью или здоровьем вашего ребенка, вам может потребоваться родить ребенка до 39 недель. В этих случаях ваш врач может порекомендовать ранние роды, потому что преимущества перевешивают риски. Стимулирование родов до 39 летнедель беременности рекомендуется только в том случае, если есть проблемы со здоровьем, которые затрагивают вас и вашего ребенка.
Стимулирование родов до 39 летнедель беременности рекомендуется только в том случае, если есть проблемы со здоровьем, которые затрагивают вас и вашего ребенка.
Если ваш врач рекомендует стимуляцию родов, задайте следующие вопросы:
- Зачем нам стимуляция родов?
- Есть ли проблемы с моим здоровьем или здоровьем моего ребенка, которые могут потребовать стимуляции родов до 39 недель? Могу ли я дождаться рождения ребенка ближе к 39 неделе?
- Как вы будете вызывать у меня роды?
- Что я могу ожидать, когда вы вызываете роды?
- Увеличит ли стимуляция родов вероятность того, что мне потребуется кесарево сечение?
- Какие есть варианты обезболивающих?
Последнее рассмотрение: сентябрь 2018 г.
См. также : инфографика за 39 недель
Стимуляция родов: Медицинская энциклопедия MedlinePlus
Стимулирование родов относится к различным видам лечения, используемым для начала родов. Лечение также может быть использовано для увеличения ваших родов, что означает их ускорение. Цель состоит в том, чтобы вызвать схватки или сделать их сильнее.
Лечение также может быть использовано для увеличения ваших родов, что означает их ускорение. Цель состоит в том, чтобы вызвать схватки или сделать их сильнее.
Несколько методов могут помочь начать роды.
Амниотическая жидкость — это вода, которая окружает вашего ребенка в утробе матери. Он содержит мембраны или слои ткани. Один из методов стимуляции родов — «разорвать водяной мешок» или разорвать плодные оболочки.
- Ваш лечащий врач проведет гинекологический осмотр и проведет небольшой пластиковый зонд с крючком на конце через шейку матки, чтобы создать отверстие в мембране. Это не повредит ни вам, ни вашему ребенку.
- Ваша шейка матки уже должна быть раскрыта, а головка ребенка опустилась в таз.
В большинстве случаев схватки начинаются от нескольких минут до нескольких часов после родов. Если роды не начались через несколько часов, вам могут ввести лекарство через вену, чтобы помочь начать схватки. Это связано с тем, что чем дольше начинаются роды, тем выше вероятность заражения.
В начале беременности шейка матки должна быть твердой, длинной и закрытой. Прежде чем ваша шейка матки начнет расширяться или открываться, она должна сначала стать мягкой и начать «истончаться».
У некоторых этот процесс может начаться до начала родов. Но если ваша шейка матки еще не начала созревать или истончаться, ваш лечащий врач может использовать лекарство, называемое простагландинами.
Лекарство вводится во влагалище рядом с шейкой матки. Простагландины часто созревают или смягчают шейку матки, и могут даже начаться схватки. В течение нескольких часов будет контролироваться частота сердечных сокращений вашего ребенка. Если роды не начинаются, вам может быть разрешено покинуть больницу и прогуляться.
Окситоцин — это лекарство, которое вводят через вену (в/в или внутривенно), чтобы либо вызвать схватки, либо усилить их. Небольшое количество поступает в ваше тело через вену с постоянной скоростью. Доза может быть медленно увеличена по мере необходимости.
Частота сердечных сокращений вашего ребенка и сила ваших схваток будут тщательно контролироваться.
- Это делается для того, чтобы ваши схватки не были настолько сильными, чтобы причинить вред вашему ребенку.
- Окситоцин нельзя использовать, если тесты показывают, что ваш будущий ребенок не получает достаточного количества кислорода или пищи через плаценту.
Окситоцин часто вызывает регулярные схватки. Как только ваше собственное тело и матка «заработают», ваш поставщик может уменьшить дозу.
Есть много причин, по которым вам может понадобиться индукция родов.
Индукция родов может быть начата до появления каких-либо признаков родов, если:
- Околоплодные оболочки или околоводный мешок порвались, но роды еще не начались (после того, как ваша беременность прошла от 34 до 36 недель).
- Срок родов истекает чаще всего, когда срок беременности составляет от 41 до 42 недель.
- В прошлом у вас были мертворождения.

- У вас такое заболевание, как высокое кровяное давление или диабет во время беременности, которое может угрожать вашему здоровью или здоровью вашего ребенка.
Окситоцин также можно начинать вводить после того, как у женщины начались роды, но ее схватки были недостаточно сильными для раскрытия шейки матки.
Индукция родов; Беременность — стимуляция родов; Простагландины — вызывающие роды; Окситоцин – стимуляция родов
Levine LD, Srinivas SK. Индукция родов. В: Landon MB, Galan HL, Jauniaux ERM и др., ред. Акушерство Габбе: нормальная и проблемная беременность . 8-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 12.
Торп Дж.М., Гранц К.Л. Клинические аспекты нормальных и патологических родов. В: Резник Р., Локвуд С.Дж., Мур Т.Р., Грин М.Ф., Копел Дж.А., Сильвер Р.М., ред. Медицина матери и плода Кризи и Резника: принципы и практика . 8-е изд. Филадельфия, Пенсильвания: Elsevier; 2019: глава 43.
Обновлено: Джон Д.


 Это называется преждевременным разрывом плодных оболочек (также называемым PROM).
Это называется преждевременным разрывом плодных оболочек (также называемым PROM).