Химическая связь — основные виды, типы и характеристики
Поможем понять и полюбить химию
Начать учиться
193.3K
Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой.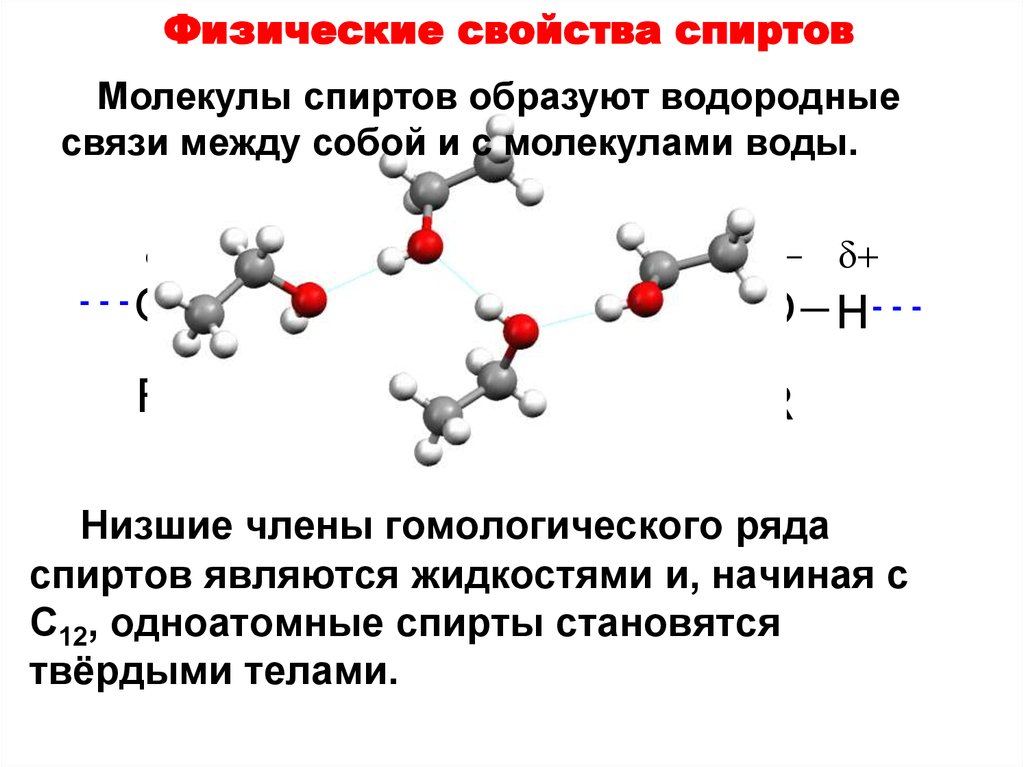 Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов.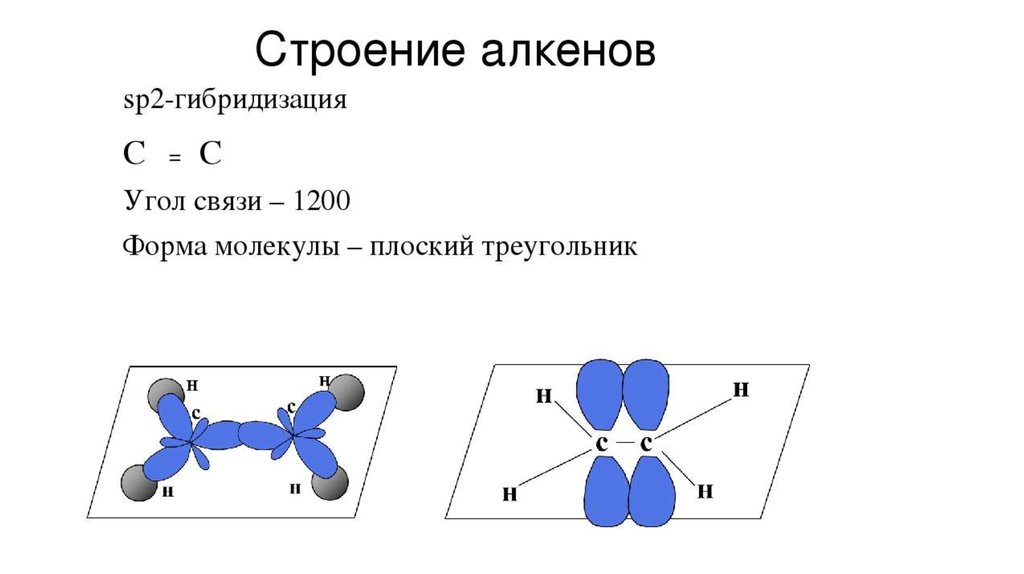 Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.

Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно.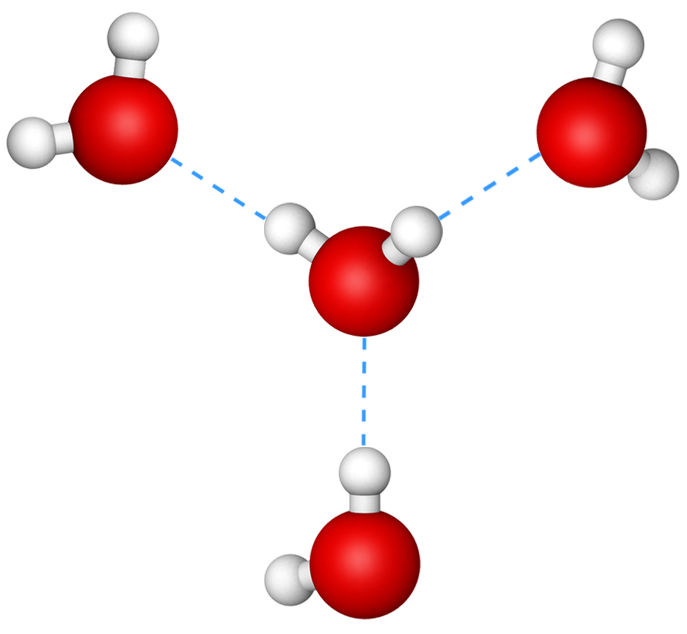
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.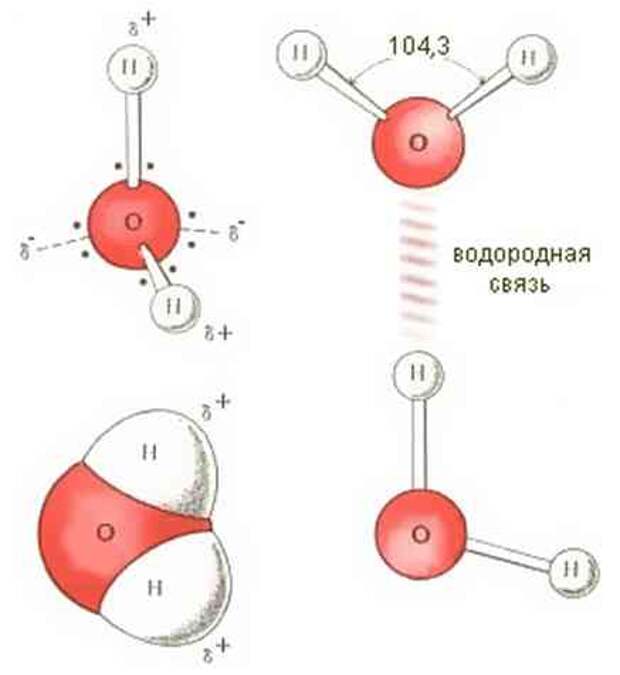
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
ненаправленность,
делокализованный характер,
многоэлектронность.

Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
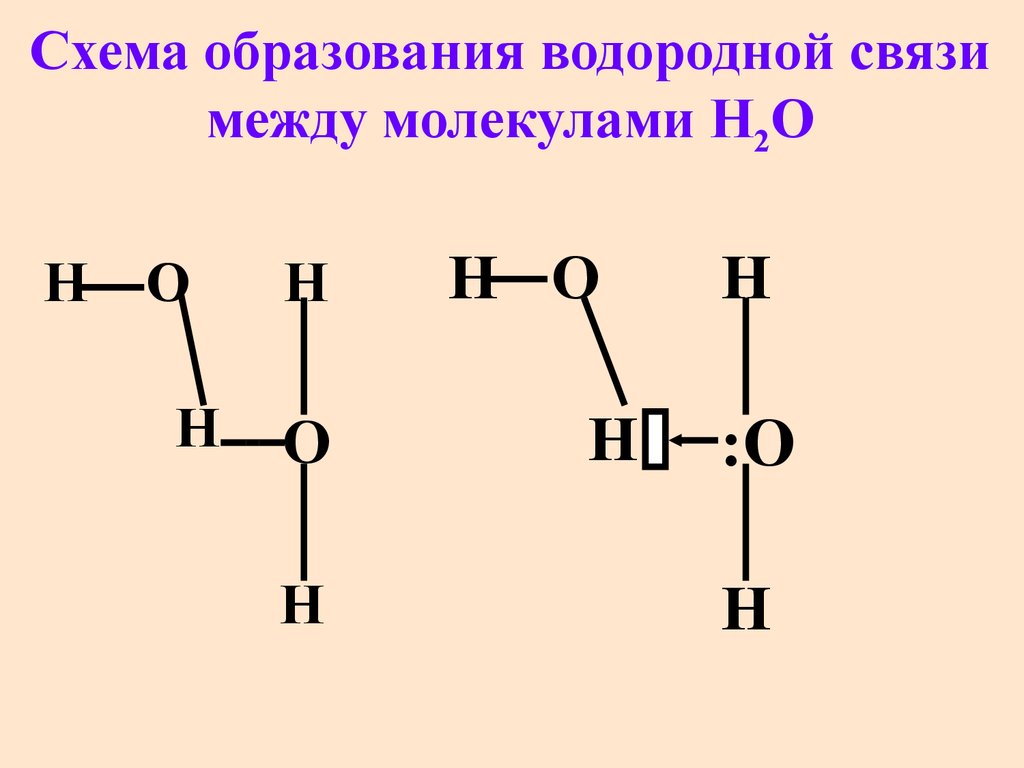
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Важно!
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
д.
Характеристики водородной связи:
насыщенная,
направленная.
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.

Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Состав вещества | Элементы в составе вещества | Химическая связь | Тип кристаллической решетки |
|---|---|---|---|
Простой | Металл | Металлическая | Металлическая |
Неметалл с одинаковой ЭО | Ковалентная неполярная | Молекулярная или атомная | |
Сложный | Металл и неметалл | Ионная | Ионная |
Неметалл с разной ЭО | Ковалентная полярная | Молекулярная или атомная |
Вопросы для самоподготовки
Какие структуры могут появляться в результате химической связи?
Назовите два основных механизма ковалентной связи.

В каком случае ковалентная связь будет полярной, а в каком — неполярной?
От чего зависит энергия химической связи? Назовите минимум 2 фактора.
Что определяет прочность химической связи?
Как определить вид химической связи, если нам известны элементы в составе вещества?
К какому виду кристаллической решетки приводит ковалентная связь между атомами?
Какие элементы взаимодействуют в молекуле вещества в ходе образования металлической связи?
О чем говорит количество связей, которые может образовывать один атом в молекуле вещества?
Назовите характеристики ионной связи.
В каких веществах из перечисленных имеет место ковалентная полярная связь: SrO, PBr3, CsCl, P4, NH4NO3?
Определите, в какую сторону смещается электронная пара в соединениях HCl, HBr, HI, HS, HP.

Яна Кононенко
К предыдущей статье
102.9K
Гидролиз
К следующей статье
Кристаллическая решетка
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
1.1. Основные виды химической связи — ЗФТШ, МФТИ
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее.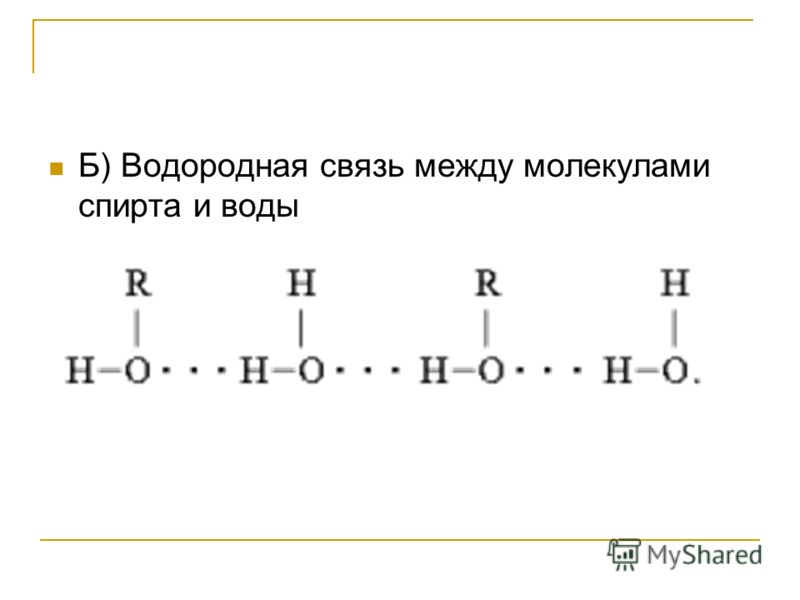 Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершённым и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершённым и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химических связей: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
`»H»+»H»=»H»_2`; `Delta»H»=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном.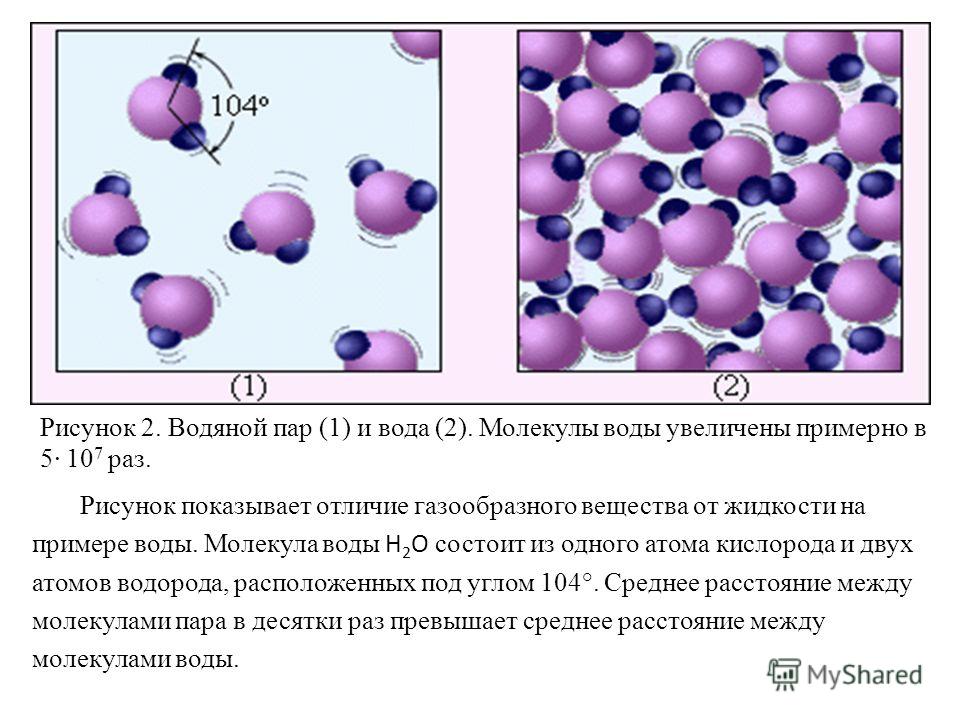 При сближении атомов до определённого расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
При сближении атомов до определённого расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическую связь можно изобразить:
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
`»H»* + *»H»=»H»:»H»` где `:` означает `sigma`-связь
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают чёрточкой, которая символизирует пару электронов: `»H» — «H»`.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
:Cl·····+·Cl····: → :Cl····:Cl····::\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподелённых пар, а `1` — неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x`.
Если в реагирующих атомах имеется `2` или `3` неспаренных электрона, то могут образоваться не `1`, а `2` или `3` связи, т. е. общих электронных пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две — двойной, если три — тройной. Они обозначаются соответственно = или `-=` штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`.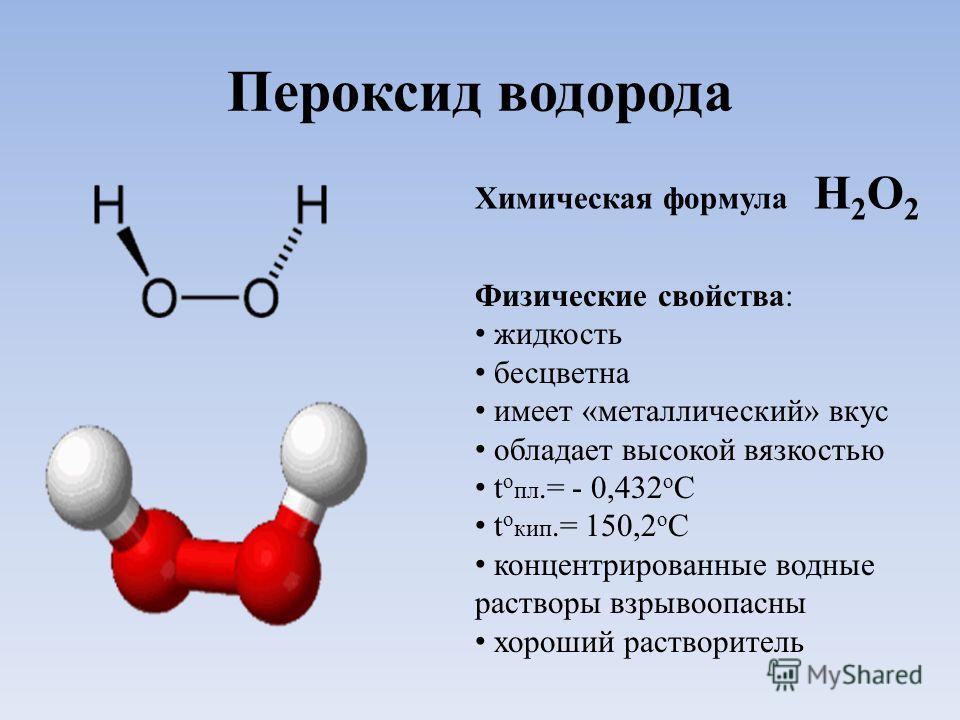 В ней атомы имеют три общие пары электронов:
В ней атомы имеют три общие пары электронов:
:N···+·N··: → :N⋮⋮N::\overset\cdot{\underset\cdot{\mathrm N}}\cdot+\cdot\overset\cdot{\underset\cdot{\mathrm N}}:\;\rightarrow\;:\mathrm N\vdots\vdots\mathrm N:
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `sigma`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны линии, связывающей центры соединяющихся атомов. Такая
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x+pi_y+pi_z)` придают молекуле `»N»_2` большую прочность, поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется одинарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные — `pi`-связи. И `sigma`-, и `pi`-связи — это разновидности ковалентной связи.
И `sigma`-, и `pi`-связи — это разновидности ковалентной связи.
В общем случае
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора.
H·+·Cl····: → H:Cl····:\mathrm H\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;\mathrm H:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе. Электрический момент диполя таких молекул (`»H»_2`, `»F»_2`, `»Cl»_2` и др.) равен нулю. Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещённым в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону.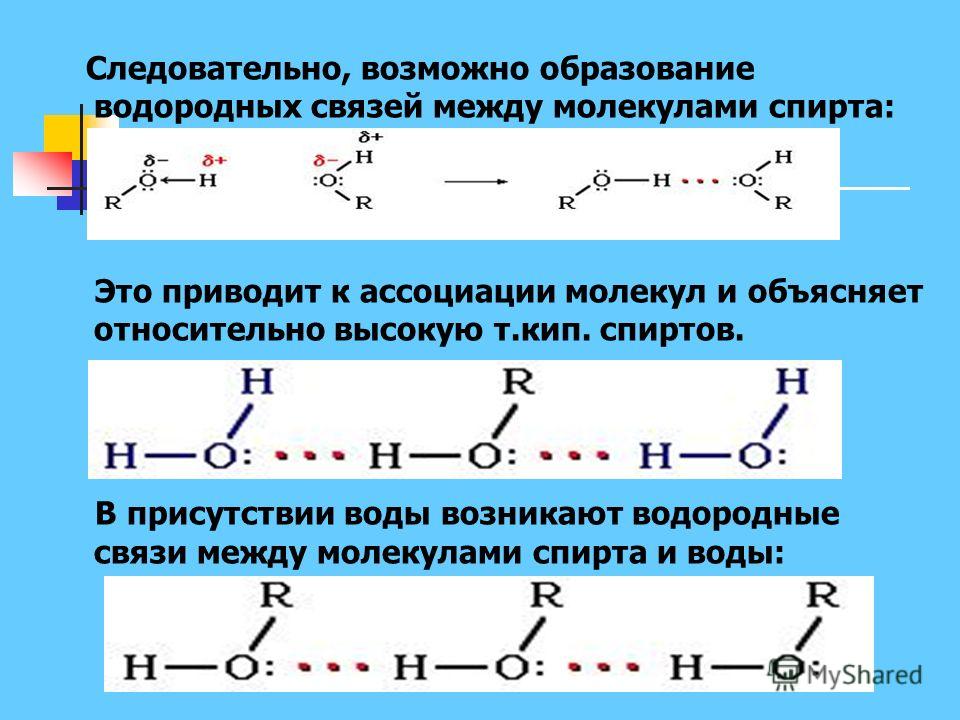 -`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
-`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например, атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой — алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними — отрицательно заряженный «электронный газ». Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в её основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединённых атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придаёт кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород – полный электронный аналог воды – газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электроотрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды.
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `»HF»` в обычных условиях существует в жидком состоянии (`»t»_»кип»=19,5^@»C»`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `»F»^-`, так и гидродифторид-аниона `»HF»_2^-`.
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Водородные связи в воде: свойства и значение
Вы когда-нибудь задумывались, почему вода прилипает к вашим волосам после душа? Или как вода поднимается вверх по корневой системе растений? Или почему летние и зимние температуры в прибрежных районах кажутся менее суровыми?
Вода — одно из самых распространенных и важных веществ на Земле. Его многочисленные уникальные свойства позволяют ему поддерживать жизнь от клеточного уровня до экосистемы. Многие уникальные свойства воды обусловлены полярностью ее молекул, особенно их способностью образовывать водородные связи друг с другом и с другими молекулами.
Здесь мы дадим определение водородной связи в воде , подробно рассмотрим ее механизмы и обсудим различные свойства воды, придаваемые водородной связью.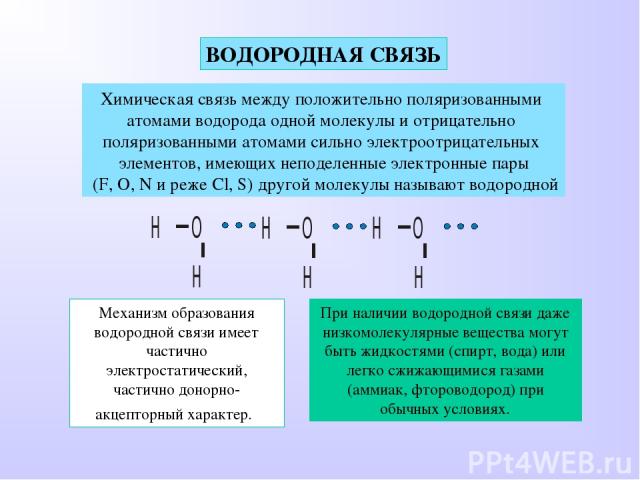
А водородная (Н) связь представляет собой связь, которая образуется между частично положительно заряженным атомом водорода и электроотрицательным атомом, обычно фтора (F) , азота (N) или кислорода (O) .
Примеры водородных связей включают молекулы воды, аминокислоты в белковых молекулах и азотистые основания, образующие нуклеотиды в двух цепях ДНК.
Как образуются водородные связи?Когда атомы имеют общие валентные электроны, образуется ковалентная связь . Ковалентные связи бывают либо полярными , либо неполярными в зависимости от электроотрицательности атомов (способность атома притягивать электроны, когда он находится в связи).
Из-за неравного распределения электронов полярная молекула имеет частично положительную область на одной стороне и частично отрицательный регион с другой. Из-за этой полярности атом водорода с полярной ковалентной связью с электроотрицательным атомом (например, азота, фтора и кислорода) притягивается к электроотрицательным ионам или отрицательно заряженным атомам других молекул.
Из-за этой полярности атом водорода с полярной ковалентной связью с электроотрицательным атомом (например, азота, фтора и кислорода) притягивается к электроотрицательным ионам или отрицательно заряженным атомам других молекул.
Это притяжение приводит к образованию водородной связи.
Водородные связи не являются «настоящими» связями в том же смысле, что и ковалентные, ионные и металлические связи. Ковалентные, ионные и металлические связи представляют собой внутримолекулярное электростатическое притяжение, то есть они удерживают атомы вместе внутри молекулы. С другой стороны, водородных связей 9.0007 межмолекулярные силы означают, что они возникают между молекулами . Хотя притяжение водородных связей слабее, чем реальные ионные или ковалентные взаимодействия, они достаточно сильны, чтобы создать основных свойств , которые мы обсудим позже.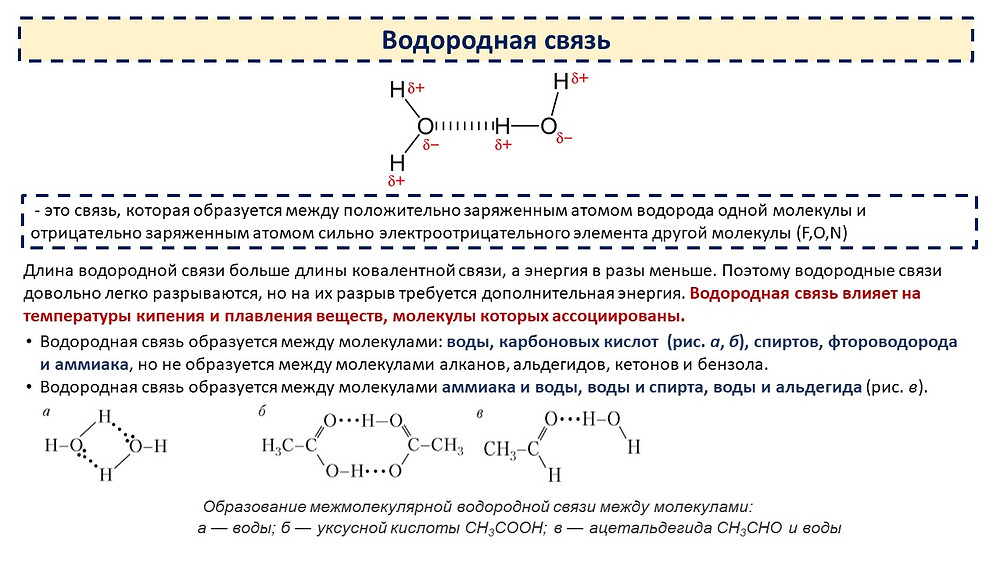
Водородная связь в воде: биология
Вода состоит из двух атомов водорода , присоединенных ковалентными связями к одному атому кислорода (H-O-H) . Вода представляет собой полярных молекул , потому что его атомы водорода и кислорода делят электроны неравномерно из-за различий в электроотрицательности .
Каждый атом водорода содержит ядро, состоящее из одиночных положительно заряженных протонов и одного отрицательно заряженного электрона, вращающегося вокруг ядра . С другой стороны, каждый атом кислорода содержит ядро, состоящее из восьми положительно заряженных протонов и восьми незаряженных нейтронов , с восемью отрицательно заряженными электронами, вращающимися вокруг ядра .
Атом кислорода имеет на более высокую электроотрицательность, чем атом водорода , поэтому электронов притягиваются к кислороду и отталкиваются водородом . Когда образуется молекула воды, десять электронов объединяются в пары на пять орбиталей, распределенных следующим образом:
Когда образуется молекула воды, десять электронов объединяются в пары на пять орбиталей, распределенных следующим образом:
Одна пара связана с атомом кислорода.
Две пары связаны с атомом кислорода в виде внешних электронов.
Две пары образуют две ковалентные связи OH.
При образовании молекулы воды остаются две неподеленные пары. Две неподеленные пары связывают себя с атомом кислорода . В результате атомы кислорода имеют частично отрицательных (δ-) зарядов , а атомы водорода имеют частичных положительных (δ+) зарядов .
Это означает, что молекула воды не имеет суммарного заряда , но атомы водорода и кислорода имеют частичные заряды.
Поскольку атомы водорода в молекуле воды частично заряжены положительно, они притягиваются к частично отрицательно заряженным атомам кислорода в близлежащих молекулах воды, позволяя водородным связям образовывать между соседними молекулами воды или другими молекулами с отрицательный заряд .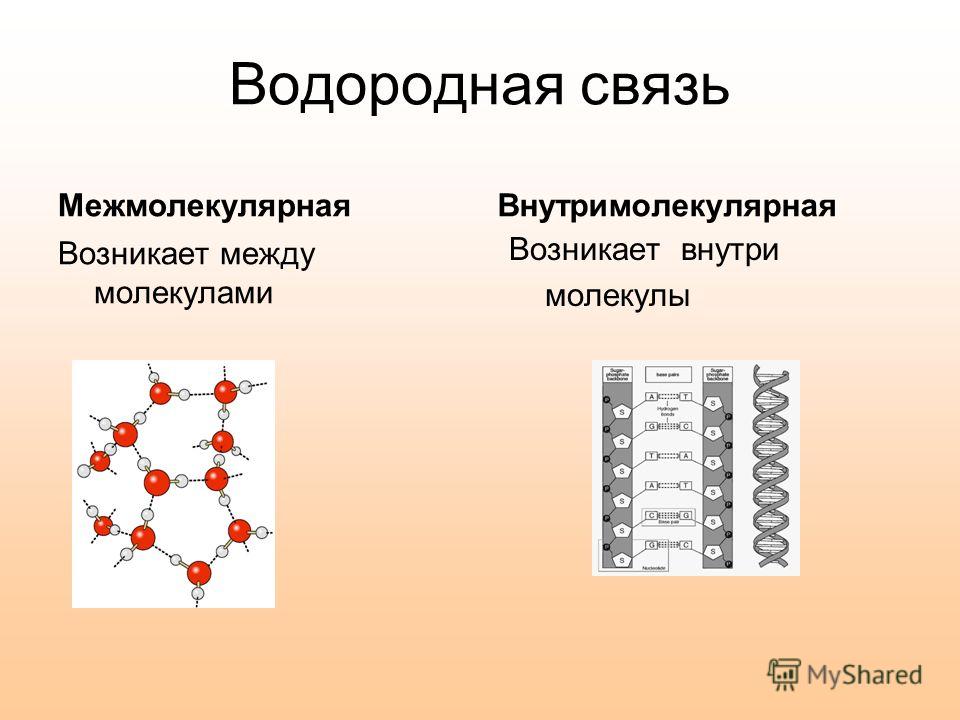 Между молекулами воды постоянно возникают водородные связи. Хотя отдельные водородные связи имеют тенденцию быть слабыми , они создают значительное влияние , когда они образуются в больших количествах, что обычно имеет место для воды и органических полимеров .
Между молекулами воды постоянно возникают водородные связи. Хотя отдельные водородные связи имеют тенденцию быть слабыми , они создают значительное влияние , когда они образуются в больших количествах, что обычно имеет место для воды и органических полимеров .
Вода молекул содержат две неподеленные пары и два атома водорода , все из которых соединены с сильно электроотрицательным атомом кислорода . Это означает, что каждая молекула воды может образовать до четырех связей (две, где он является принимающим концом н-связи, и две, где он является отдающим в н-связи).
Однако, поскольку водородные связи слабее, чем ковалентные связи, они образуют , разрывают и легко восстанавливают в жидкой воде. В результате точное число водородных связей, созданных на молекулу, варьируется.
В результате точное число водородных связей, созданных на молекулу, варьируется.
Водородная связь в воде придает несколько свойств, важных для поддержания жизни. В следующем разделе мы поговорим о некоторых из этих свойств.
Свойство растворителяМолекулы воды являются превосходными растворителями . Полярные молекулы — это гидрофильных («водолюбивых») веществ.
Гидрофильные молекулы взаимодействуют с водой и легко растворяются в ней.
Это происходит потому, что отрицательный ион растворенного вещества будет притягивать положительно заряженную область молекулы воды и наоборот, вызывая растворение ионов .
Хлорид натрия (NaCl) , также известный как поваренная соль, является примером полярной молекулы.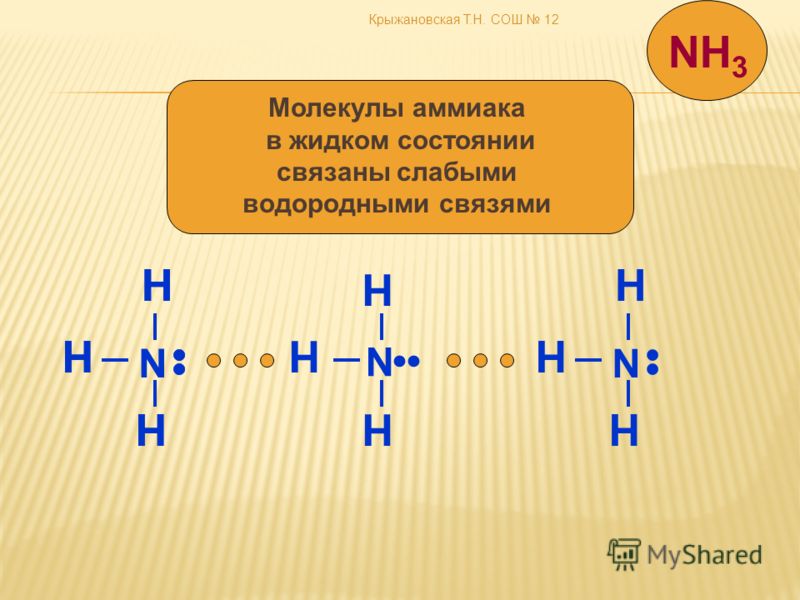 Он легко растворяется в воде, так как частично отрицательный атом кислорода молекулы воды притягивается к частично положительным ионам Na+. С другой стороны, частично положительные атомы водорода притягиваются к частично отрицательным ионам Cl-. Это заставляет молекулу NaCl растворяться в воде.
Он легко растворяется в воде, так как частично отрицательный атом кислорода молекулы воды притягивается к частично положительным ионам Na+. С другой стороны, частично положительные атомы водорода притягиваются к частично отрицательным ионам Cl-. Это заставляет молекулу NaCl растворяться в воде.
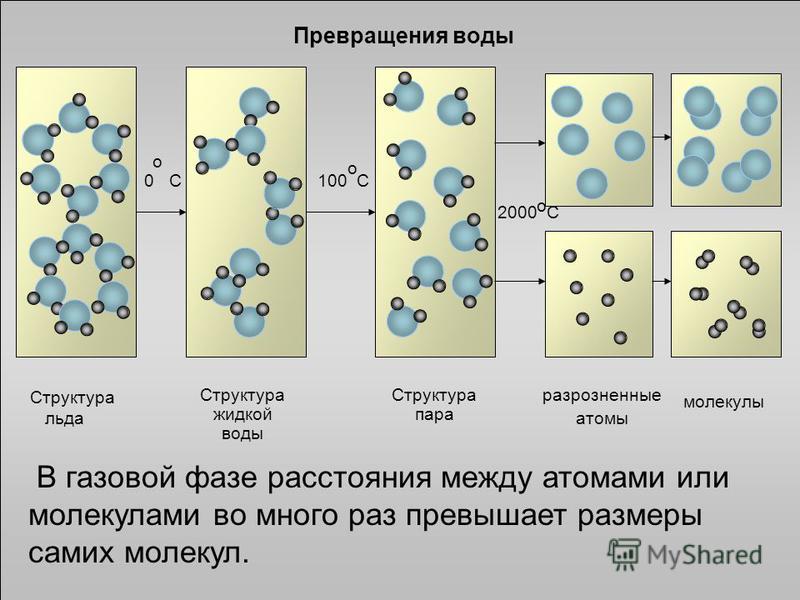
Водородные связи в молекулах воды реагируют на изменения температуры, придавая воде ее уникальные характеристики в твердом, жидком и газообразном состояниях.
В своем жидком состоянии молекулы воды постоянно движутся мимо друг друга, поскольку водородные связи постоянно разрываются и рекомбинируют.
В состоянии газа молекулы воды обладают более высокой кинетической энергией, вызывая разрыв водородных связей.
В своем твердом состоянии молекулы воды расширяются, потому что водородные связи раздвигают молекулы воды.
 В то же время водородные связи удерживают молекулы воды вместе, образуя кристаллическую структуру. Это дает льду (твердой воде) более низкую плотность по сравнению с жидкой водой.
В то же время водородные связи удерживают молекулы воды вместе, образуя кристаллическую структуру. Это дает льду (твердой воде) более низкую плотность по сравнению с жидкой водой.
Водородная связь в молекулах воды придает высокой удельной теплоемкости .
Удельная теплоемкость относится к количеству тепла, которое должно быть поглощено или потеряно одним граммом вещества, чтобы его температура изменилась на один градус Цельсия.
высокая удельная теплоемкость воды означает, что требуется много энергии чтобы вызвать изменения температуры. Высокая удельная теплоемкость воды позволяет ей сохранять стабильная температура , необходимая для поддержания жизни на Земле.
Аналогично, водородная связь дает воду high h теплота парообразования ,
теплота парообразования – это количество энергии, необходимое для превращения жидкого вещества в газообразное.
Фактически, для превращения одного грамма воды в газ требуется 586 кал тепловой энергии. Это связано с тем, что водородные связи должны быть разорваны , чтобы жидкая вода могла перейти в газообразное состояние. Как только вода достигает точки кипения (100 ° C или 212 ° F), водородные связи в воде разрываются, в результате чего вода нагревается до испариться .
КогезияВодородная связь заставляет молекулы воды оставаться близко друг к другу, что делает воду очень когезионным веществом .
Это то, что делает воду «липкой».
Когезия относится к притяжению сходных молекул, в данном случае воды, удерживающих вещество вместе.
Вода слипается, образуя «капли» из-за своей способности связываться. Сплоченность приводит к еще одному свойству воды: поверхностное натяжение .
Поверхностное натяжение Поверхностное натяжение — это свойство, позволяющее веществу сопротивляться натяжению и предотвращать разрыв .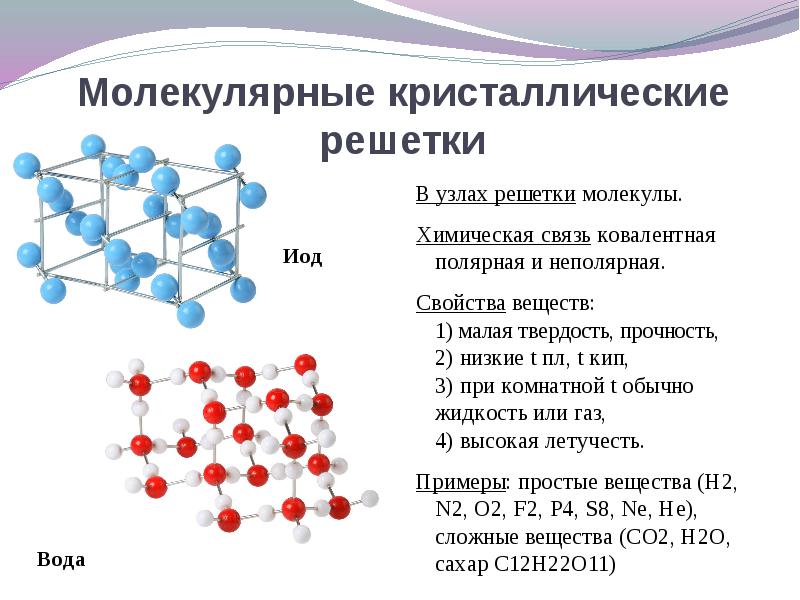
Поверхностное натяжение, создаваемое водородными связями в воде, похоже на людей, образующих человеческую цепь, чтобы не дать другим вырваться из их соединенных рук.
Как сцепление воды с самой собой, так и сильное прилипание воды к поверхности, с которой она соприкасается, заставляют молекулы воды, находящиеся близко к поверхности, двигаться вниз и в сторону.
С другой стороны, подтягивающий воздух воздействует на поверхность воды с небольшой силой. В результате между молекулами воды на поверхности создается чистая сила притяжения , в результате чего образуется очень плоский тонкий слой молекул . Молекулы воды на поверхности прилипают друг к другу, предотвращая погружение предметов, лежащих на поверхности .
Поверхностное натяжение — вот почему скрепка для бумаг, которую вы осторожно кладете на поверхность воды, может плавать. В этом случае тяжелый предмет или предмет, который вы не положили на поверхность воды осторожно, может нарушить поверхностное натяжение, заставив его утонуть.
Адгезия относится к притяжению между различными молекулами.
Вода сильно клейкая ; он придерживается широкого круга различных вещей. Вода прилипает к другим вещам по той же причине, по которой она прилипает к самой себе, — она полярна ; таким образом, притягивается к заряженным веществам . Вода прикрепляет к различным поверхностям, включая растения, посуду и даже ваши волосы, когда они мокрые после душа.
В каждом из этих сценариев адгезия является причиной того, что вода прилипает к чему-либо или смачивает его.
КапиллярностьКапиллярность (или капиллярное действие) — это тенденция воды подниматься вверх по поверхности против силы тяжести из-за ее адгезионных свойств.
Эта тенденция связана с тем, что молекулы воды сильнее притягиваются к таким поверхностям, чем другие молекулы воды.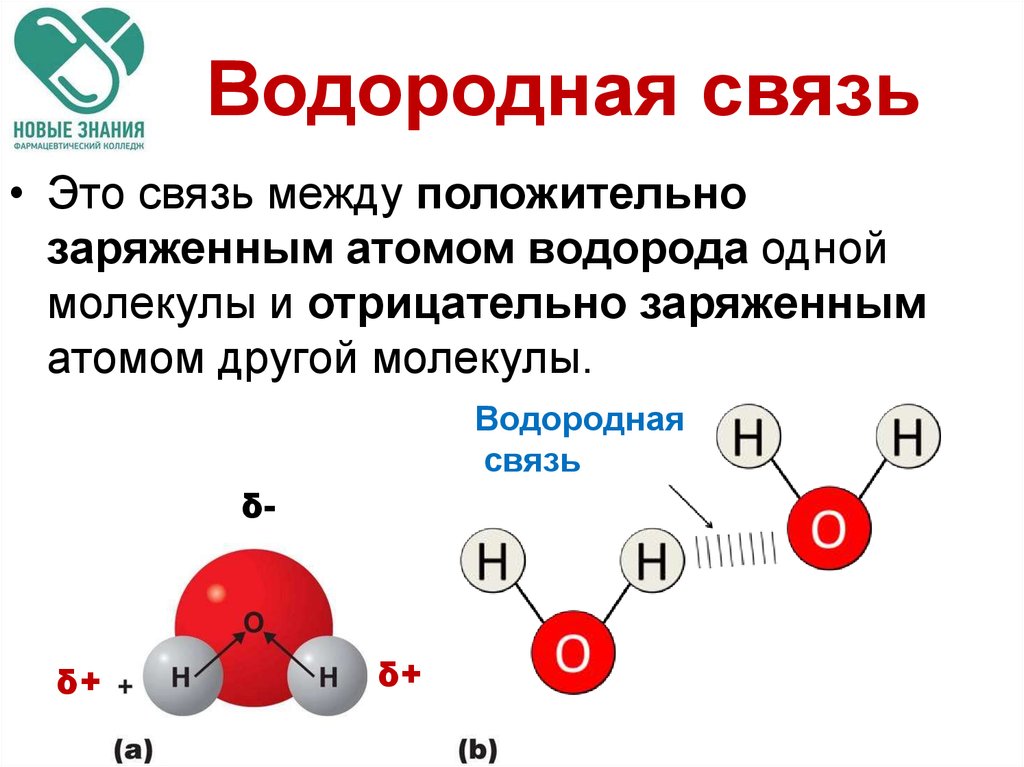
Если вы раньше опускали бумажное полотенце в воду, вы могли заметить, что вода «поднимается» вверх по бумажному полотенцу против силы тяжести; это происходит благодаря капиллярности. Точно так же мы можем наблюдать капиллярность в ткани, почве и других поверхностях, где есть небольшие пространства, через которые может двигаться жидкость.
Какое значение имеют водородные связи в воде в биологии?В предыдущем разделе мы обсуждали свойства воды. Как эти биохимические и физические процессы необходимы для поддержания жизни на Земле? Давайте обсудим некоторые конкретные примеры .
Вода, являющаяся отличным растворителем , означает, что она может растворять широкий спектр соединений . Поскольку наиболее важные биохимические процессы происходят в водной среде внутри клеток, это свойство воды имеет решающее значение для обеспечения протекания этих процессов. Вода высокая удельная теплоемкость позволяет регулировать температуру больших водоемов .
Например, в прибрежных районах летние и зимние температуры менее суровые, чем на больших массивах суши, поскольку наземные массивы теряют тепло быстрее, чем вода.
Точно так же высокая теплота испарения воды означает, что в процессе перехода из жидкого состояния в газообразное потребляется много энергии, что приводит к охлаждению окружающей среды .
Например, потоотделение у многих живых организмов (включая человека) представляет собой механизм, поддерживающий гомеостаз температуры тела путем его охлаждения.
Когезия, адгезия и капиллярность являются важными свойствами воды, которые обеспечивают поглощение воды растениями. Вода может подниматься по корням благодаря капиллярности. Он также может перемещаться по ксилеме, чтобы доставлять воду к ветвям и листьям.
Водородные связи в воде — основные выводы
- Водородная связь представляет собой связь, которая образуется между частично положительно заряженным атомом водорода и электроотрицательным атомом.

- Вода представляет собой полярную молекулу : ее атомы кислорода имеют частичный отрицательный (δ-) заряд, а атомы водорода имеют частичный положительный (δ+) заряд.
- Эти частичные заряды позволяют образовать водородных связей между молекулой воды и соседними молекулами воды или другими молекулами с отрицательным зарядом.
- Благодаря водородным связям молекулы воды обладают свойствами, важными для поддержания жизни.
- Эти свойства включают растворяющую способность, замедление температуры, когезию, поверхностное натяжение, адгезию и капиллярность.
Ссылки
- Zedalis, Julianne, et al. Учебник по биологии продвинутого уровня для курсов AP. Техасское агентство по образованию.
- Рис, Джейн Б. и др. Кэмпбелл Биология. Одиннадцатое изд., Pearson Higher Education, 2016.
- Гавайский университет в Маноа, Изучение нашей жидкой Земли. Водородные связи делают воду липкой.
- «15.
 1: Структура воды». Chemistry LibreTexts, 27 июня 2016 г.
1: Структура воды». Chemistry LibreTexts, 27 июня 2016 г. - Белфорд, Роберт. «11.5: Водородные связи». Chemistry LibreTexts, 3 января 2016 г.
- Школа водных наук. «Сцепление и сцепление воды». Геологическая служба США, 22 октября 2019 г.
- Школа водных наук. «Капиллярное действие и вода». Геологическая служба США, 22 октября 2019 г.
Ковалентные облигации | Биология для специальностей I
Результаты обучения
- Описывать характеристики ковалентных связей и различать полярные и неполярные связи
Другим способом соблюдения правила октета является разделение электронов между атомами с образованием ковалентных связей . Эти связи гораздо более распространены, чем ионные связи в молекулах живых организмов. Ковалентные связи обычно встречаются в органических молекулах на основе углерода, таких как наша ДНК и белки. Ковалентные связи также встречаются в неорганических молекулах, таких как H 2 О, СО 2 и О 2 . Одна, две или три пары электронов могут быть общими, образуя одинарную, двойную и тройную связи соответственно. Чем больше ковалентных связей между двумя атомами, тем прочнее их соединение. Таким образом, тройные связи являются самыми прочными.
Одна, две или три пары электронов могут быть общими, образуя одинарную, двойную и тройную связи соответственно. Чем больше ковалентных связей между двумя атомами, тем прочнее их соединение. Таким образом, тройные связи являются самыми прочными.
Прочность различных уровней ковалентной связи является одной из основных причин, по которой живые организмы с трудом получают азот для использования в построении своих молекул, даже несмотря на то, что молекулярный азот, N 2 — самый распространенный газ в атмосфере. Молекулярный азот состоит из двух атомов азота, соединенных тройной связью друг с другом, и, как и во всех молекулах, совместное использование этих трех пар электронов между двумя атомами азота позволяет заполнить их внешние электронные оболочки, что делает молекулу более стабильной, чем индивидуальную. атомы азота. Эта сильная тройная связь мешает живым системам расщеплять этот азот, чтобы использовать его в качестве составных частей белков и ДНК.
Образование молекул воды является примером ковалентной связи.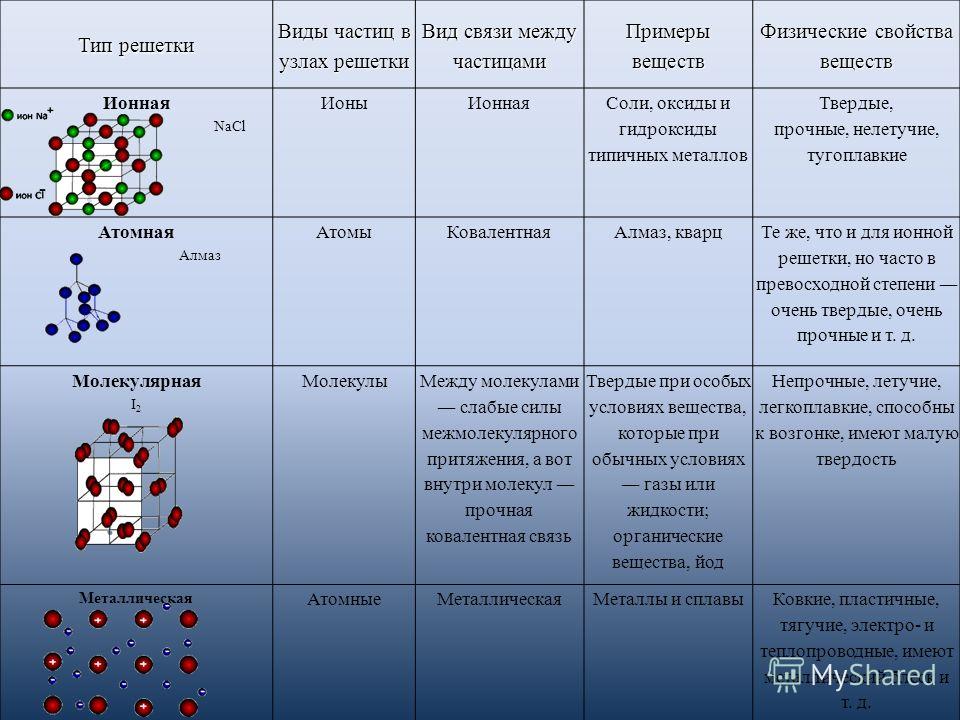 Атомы водорода и кислорода, которые объединяются, образуя молекулы воды, связаны друг с другом ковалентными связями. Электрон из водорода разделяет свое время между незавершенной внешней оболочкой атомов водорода и незавершенной внешней оболочкой атомов кислорода. Чтобы полностью заполнить внешнюю оболочку кислорода, который имеет шесть электронов во внешней оболочке, но который был бы более стабильным с восемью, необходимы два электрона (по одному от каждого атома водорода): отсюда известная формула H 2 O. Электроны распределяются между двумя элементами, чтобы заполнить внешнюю оболочку каждого из них, что делает оба элемента более стабильными.
Атомы водорода и кислорода, которые объединяются, образуя молекулы воды, связаны друг с другом ковалентными связями. Электрон из водорода разделяет свое время между незавершенной внешней оболочкой атомов водорода и незавершенной внешней оболочкой атомов кислорода. Чтобы полностью заполнить внешнюю оболочку кислорода, который имеет шесть электронов во внешней оболочке, но который был бы более стабильным с восемью, необходимы два электрона (по одному от каждого атома водорода): отсюда известная формула H 2 O. Электроны распределяются между двумя элементами, чтобы заполнить внешнюю оболочку каждого из них, что делает оба элемента более стабильными.
Посмотрите это короткое видео, чтобы увидеть анимацию ионной и ковалентной связи.
Вы можете просмотреть расшифровку «Анимации ионной и ковалентной связи» здесь (откроется в новом окне).
Полярные ковалентные связи
Ковалентные связи бывают двух типов: полярные и неполярные. В полярной ковалентной связи , показанной на рисунке 1, электроны неравномерно распределены между атомами и притягиваются к одному ядру больше, чем к другому. Из-за неравномерного распределения электронов между атомами разных элементов слегка положительный ( δ +) или слегка отрицательный ( δ –) заряд. Этот частичный заряд является важным свойством воды и объясняет многие ее характеристики.
Из-за неравномерного распределения электронов между атомами разных элементов слегка положительный ( δ +) или слегка отрицательный ( δ –) заряд. Этот частичный заряд является важным свойством воды и объясняет многие ее характеристики.
Вода представляет собой полярную молекулу, в которой атомы водорода приобретают частичный положительный заряд, а кислород — частичный отрицательный заряд. Это происходит потому, что ядро атома кислорода сильнее притягивает электроны атомов водорода, чем ядро водорода — к электронам кислорода. Таким образом, кислород имеет более высокое электроотрицательность , чем водород, и общие электроны проводят больше времени вблизи ядра кислорода, чем вблизи ядра атомов водорода, придавая атомам кислорода и водорода слегка отрицательный и положительный заряд соответственно. Другой способ заявить об этом состоит в том, что вероятность найти общий электрон вблизи ядра кислорода более вероятна, чем найти его вблизи ядра водорода. В любом случае относительная электроотрицательность атома способствует возникновению частичных зарядов всякий раз, когда один элемент значительно более электроотрицательный, чем другой, и заряды, генерируемые этими полярными связями, могут затем использоваться для образования водородных связей на основе притяжения противоположных частичных зарядов. обвинения. (Водородные связи, которые подробно обсуждаются ниже, представляют собой слабые связи между слегка положительно заряженными атомами водорода и слегка отрицательно заряженными атомами в других молекулах.) Поскольку макромолекулы часто содержат внутри себя атомы с различной электроотрицательностью, в органических молекулах часто присутствуют полярные связи. .
В любом случае относительная электроотрицательность атома способствует возникновению частичных зарядов всякий раз, когда один элемент значительно более электроотрицательный, чем другой, и заряды, генерируемые этими полярными связями, могут затем использоваться для образования водородных связей на основе притяжения противоположных частичных зарядов. обвинения. (Водородные связи, которые подробно обсуждаются ниже, представляют собой слабые связи между слегка положительно заряженными атомами водорода и слегка отрицательно заряженными атомами в других молекулах.) Поскольку макромолекулы часто содержат внутри себя атомы с различной электроотрицательностью, в органических молекулах часто присутствуют полярные связи. .
Неполярные ковалентные связи
Рисунок 1. Является ли молекула полярной или неполярной, зависит как от типа связи, так и от формы молекулы. И вода, и углекислый газ имеют полярные ковалентные связи, но углекислый газ является линейным, поэтому частичные заряды на молекуле компенсируют друг друга.
Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые имеют одинаковые электроны. Например, молекулярный кислород (O 2 ) неполярен, потому что электроны будут равномерно распределены между двумя атомами кислорода.
Другим примером неполярной ковалентной связи является метан (CH 4 ), также показанный на рисунке 1. У углерода есть четыре электрона на внешней оболочке, и для ее заполнения требуется еще четыре электрона. Он получает эти четыре из четырех атомов водорода, каждый атом дает по одному, образуя стабильную внешнюю оболочку из восьми электронов. Углерод и водород не имеют одинаковой электроотрицательности, но похожи; таким образом, образуются неполярные связи. Каждый атом водорода нуждается в одном электроне для своей внешней оболочки, которая заполняется, когда содержит два электрона. Эти элементы делят электроны поровну между атомами углерода и водорода, создавая неполярную ковалентную молекулу.






 В то же время водородные связи удерживают молекулы воды вместе, образуя кристаллическую структуру. Это дает льду (твердой воде) более низкую плотность по сравнению с жидкой водой.
В то же время водородные связи удерживают молекулы воды вместе, образуя кристаллическую структуру. Это дает льду (твердой воде) более низкую плотность по сравнению с жидкой водой.
 1: Структура воды». Chemistry LibreTexts, 27 июня 2016 г.
1: Структура воды». Chemistry LibreTexts, 27 июня 2016 г.