Синильная кислота — Википедия
| Синильная кислота | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Традиционные названия | циановодород, синильная кислота | ||
| Хим. формула | CHN | ||
| Рац. формула | HCN | ||
| Состояние | бесцветный газ или бесцветная легколетучая жидкость | ||
| Молярная масса | 27,0253 г/моль | ||
| Плотность | 0,687 г/см³ | ||
| Динамическая вязкость | 0,201 Па·с | ||
| Энергия ионизации | 13,6 ± 0,1 эВ[1] | ||
| Температура | |||
| • плавления | −13,4 °C | ||
| • кипения | 26,7 °C | ||
| • вспышки | −17,8 °C | ||
| Пределы взрываемости | 5,6 ± 0,1 об.%[1] | ||
| Мол. теплоёмк. | (средняя для газа и жидкости) 1,97 Дж/(моль·К) | ||
| 630 ± 1 мм рт.ст.[1] | |||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 9,21 | ||
| Растворимость | |||
| • в воде | в любых пропорциях | ||
| Показатель преломления | 1,2675 | ||
| Дипольный момент | 2,98 Д | ||
| Рег. номер CAS | 74-90-8 | ||
| PubChem | 768 | ||
| Рег. номер EINECS | 200-821-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW6825000 | ||
| ChEBI | 18407 | ||
| Номер ООН | 1051 | ||
| ChemSpider | 748 и 19951400 | ||
| ЛД50 | 3,7 мг/кг (мыши, перорально) | ||
| Токсичность | Чрезвычайно токсична, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Сини́льная (циа́нистоводородная) кислота́, цианистый водород,
Синильная кислота содержится в некоторых растениях, коксовом газе, табачном дыме, выделяется при термическом разложении нейлона, полиуретанов. Смешивается во всех соотношениях с водой, этанолом, диэтиловым эфиром.
Химические[править | править код]
Молекула HCN имеет линейное строение[4][5] с межатомными расстояниями H—C 0,107 нм и C—N 0,115 нм[5] и сильно полярна (μ = 0,96⋅10−29 Кл·м).
Безводный цианистый водород является сильно ионизирующим растворителем, растворённые в нём электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25 °C равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счёт образования водородных связей.
Очень слабая одноосновная кислота К = 1,32⋅10−9 (18 °C). Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов.
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО и N2. В смеси кислорода со фтором горит с выделением большого количества тепла:
- 2HCN+O2+F2→2HF+2CO+N2+1020{\displaystyle {\mathsf {2HCN+O_{2}+F_{2}\rightarrow 2HF+2CO+N_{2}+1020}}} кДж.
Синильная кислота широко применяется в органическом синтезе. Она реагирует с карбонильными соединениями, образуя циангидрины:
- RR′C=O+HCN→RR′C(OH)CN.{\displaystyle {\mathsf {RR’C\!=\!O+HCN\rightarrow RR’C(OH)CN}}.}
С хлором, бромом и иодом прямо образует циангалогениды:
- X2+HCN→XCN+HX.{\displaystyle {\mathsf {X_{2}+HCN\rightarrow XCN+HX}}.}
С галогеналканами — нитрилы (реакция Кольбе):
- RX+HCN→R−CN+HX.{\displaystyle {\mathsf {RX+HCN\rightarrow R\!-\!CN+HX}}.}
С алкенами и алкинами реагирует, присоединяясь к кратным связям:
- HCN+CH≡CH→Cu+Ch3=CHCN.{\displaystyle {\mathsf {HCN+CH\!\equiv \!CH{\xrightarrow {Cu^{+}}}CH_{2}\!=\!CHCN}}.}
- HCN+Ch3=Ch3 →Pd/Al2O3 Ch4Ch3CN.{\displaystyle {\mathsf {HCN+CH_{2}\!=\!CH_{2}\ {\xrightarrow {Pd/Al_{2}O_{3}}}\ CH_{3}CH_{2}CN}}.}
- HCN+RCH=NH→Cu+RCH(Nh3)CN.{\displaystyle {\mathsf {HCN+RCH\!=\!NH{\xrightarrow {Cu^{+}}}RCH(NH_{2})CN}}.}
Легко полимеризуется в присутствии основания (часто со взрывом). Образует аддукты, например, HCN-CuCl.
При разложении водой даёт формиат аммония, либо формамид
HCN+2h3O⟶HCOONh5{\displaystyle {\ce {HCN + 2h3O -> HCOONh5}}}
HCN+h3O⟶HCONh3{\displaystyle {\mathsf {HCN+H_{2}O\longrightarrow HCONH_{2}}}}
Физиологические[править | править код]
Синильная кислота является веществом, вызывающим кислородное голодание тканевого типа.[6] При этом наблюдается высокое содержание кислорода как в артериальной, так и в венозной крови и уменьшение таким образом артерио-венозной разницы, резкое понижение потребления кислорода тканями с уменьшением образования в них углекислоты. Синильная кислота и её соли, растворённые в крови, достигают тканей, где вступают во взаимодействие с трёхвалентной формой железа цитохромоксидазы. Соединившись с цианидом, цитохромоксидаза теряет способность переносить электроны на молекулярный кислород. Вследствие выхода из строя конечного звена окисления блокируется вся дыхательная цепь и развивается тканевая гипоксия. С артериальной кровью кислород доставляется к тканям в достаточном количестве, но не усваивается ими и переходит в неизмененном виде в венозное русло. Одновременно нарушаются процессы образования макроэргов, необходимых для нормальной деятельности различных органов и систем. Активизируется гликолиз, то есть обмен с аэробного перестраивается на анаэробный. Также подавляется активность и других ферментов — каталазы, пероксидазы, лактатдегидрогеназы.
Действие на нервную систему[править | править код]
В результате тканевой гипоксии, развивающейся под влиянием синильной кислоты, в первую очередь нарушаются функции центральной нервной системы.
Действие на дыхательную систему[править | править код]
В результате острого отравления наблюдается резкое увеличение частоты и глубины дыхания. Развивающуюся одышку следует рассматривать как компенсаторную реакцию организма на гипоксию. Стимулирующее действие синильной кислоты на дыхание обусловлено возбуждением хеморецепторов каротидного синуса и непосредственным действием яда на клетки дыхательного центра. Первоначальное возбуждение дыхания по мере развития интоксикации сменяется его угнетением вплоть до полной остановки. Причинами этих нарушений являются тканевая гипоксия и истощение энергетических ресурсов в клетках каротидного синуса и в центрах продолговатого мозга.
Действие на сердечно-сосудистую систему[править | править код]
Проникая в кровь, синильная кислота снижает способность клеток воспринимать кислород из притекающей крови. А так как нервные клетки больше остальных нуждаются в кислороде, они первыми страдают от её действия. В начальном периоде интоксикации наблюдается замедление сердечного ритма. Повышение артериального давления и увеличение минутного объёма сердца происходят за счёт возбуждения синильной кислотой хеморецепторов каротидного синуса и клеток сосудодвигательного центра с одной стороны, и выброса катехоламинов из надпочечников и вследствие этого спазма сосудов — с другой. В дальнейшем артериальное давление падает, пульс учащается, развивается острая сердечно-сосудистая недостаточность и наступает остановка сердца.
Изменения в системе крови[править | править код]
Содержание в крови эритроцитов увеличивается, что объясняется рефлекторным сокращением селезёнки в ответ на развивающуюся гипоксию. Цвет венозной крови становится ярко-алым за счёт избыточного содержания кислорода, не поглощённого тканями. Артерио-венозная разница по кислороду резко уменьшается. При угнетении тканевого дыхания изменяется как газовый, так и биохимический состав крови. Содержание CO2 в крови снижается вследствие меньшего образования и усиленного его выделения при гипервентиляции. Это приводит в начале развития интоксикации к газовому алкалозу, который меняется метаболическим ацидозом, что является следствием активации процессов гликолиза. В крови накапливаются недоокисленные продукты обмена. Увеличивается содержание молочной кислоты, нарастает содержание ацетоновых тел, отмечается гипергликемия. Нарушение окислительно-восстановительных процессов в тканях приводит к гипотермии. Таким образом, синильная кислота и её соли вызывают явления тканевой гипоксии и связанные с ней нарушения дыхания, кровообращения, обмена веществ, функции центральной нервной системы, выраженность которых зависит от тяжести интоксикации.
Показано, что нейроны способны вырабатывать эндогенную синильную кислоту (цианистый водород, HCN) после их активации эндогенными или экзогенными опиоидами и что образование нейронами эндогенной синильной кислоты повышает активность NMDA-рецепторов и, таким образом, может играть важную роль в передаче сигнала между нейронами (нейротрансмиссии). Более того, образование эндогенного цианида оказалось необходимым для проявления в полном объёме анальгетического действия эндогенных и экзогенных опиоидов, а вещества, снижающие образование свободной HCN, оказались способны уменьшать (но не полностью устранять) анальгетическое действие эндогенных и экзогенных опиоидов. Выдвинуто предположение, что эндогенная синильная кислота может являться нейромодулятором[7].
Известно также, что стимуляция мускариновых холинорецепторов клеток феохромоцитомы в культуре повышает образование ими эндогенной синильной кислоты, однако стимуляция мускариновых холинорецепторов ЦНС в живом организме крысы приводит, наоборот, к снижению образования эндогенной синильной кислоты[8].
Также показано, что синильная кислота выделяется лейкоцитами в процессе фагоцитоза и способна убивать патогенные микроорганизмы[7].
Возможно, что вазодилатация, вызываемая нитропруссидом натрия, связана не только с образованием окиси азота (механизм, общий для действия всех сосудорасширяющих препаратов группы нитратов, таких как нитроглицерин, нитросорбид), но и с образованием цианида. Возможно, что эндогенный цианид и образующийся при его обезвреживании в организме тиоцианат играют роль в регуляции функций сердечно-сосудистой системы, в обеспечении вазодилатации и являются одними из эндогенных антигипертензивных веществ[9].
В настоящий момент существуют три наиболее распространённых метода получения синильной кислоты в промышленных масштабах:
2Nh4+2Ch5+3O2→Pt2HCN+6h3O.{\displaystyle {\mathsf {2NH_{3}+2CH_{4}+3O_{2}{\xrightarrow {Pt}}2HCN+6H_{2}O}}.}
- Метод BMA (Blausäure aus Methan und Ammoniak), запатентованный фирмой Degussa: прямой синтез из аммиака и метана без воздуха в присутствии платинового катализатора при высокой температуре:
Nh4+Ch5→PtHCN+3h3.{\displaystyle {\mathsf {NH_{3}+CH_{4}{\xrightarrow {Pt}}HCN+3H_{2}}}.}
KCN+h3O+CO2⟶HCN+KHCO3{\displaystyle {\mathsf {KCN+H_{2}O+CO_{2}\longrightarrow HCN+KHCO_{3}}}}
2h4[Fe(CN)6] →T Fe[Fe(CN)6]+6HCN{\displaystyle {\mathsf {2H_{3}[Fe(CN)_{6}]\ {\xrightarrow {T}}\ Fe[Fe(CN)_{6}]+6HCN}}}
3h5[Fe(CN)6] →100oC Fe2[Fe(CN)6]+12HCN{\displaystyle {\mathsf {3H_{4}[Fe(CN)_{6}]\ {\xrightarrow {100^{o}C}}\ Fe_{2}[Fe(CN)_{6}]+12HCN}}}(в присутствии влаги)
HCl+NaCN⟶HCN+NaCl{\displaystyle {\ce {HCl + NaCN->HCN + NaCl}}}
H++NaCN⟶HCN+Na+{\displaystyle {\ce {H+ + NaCN ->HCN + Na+}}}
Эта реакция иногда является основой случайных отравлений, потому что кислота превращает нелетучую цианидную соль в газообразный циановодород.
- Реакцией монооксида углерода с аммиаком:
Nh4+CO→ThO2HCN+h3O.{\displaystyle {\mathsf {NH_{3}+CO{\xrightarrow {ThO2}}HCN+H_{2}O}}.}
- Фотолиз метана в бескислородной атмосфере:
2Ch5+N2⟶2HCN+3h3{\textstyle {\mathsf {2CH_{4}+N_{2}\longrightarrow 2HCN+3H_{2}}}}
В химическом производстве[править | править код]
Является сырьём для получения акрилонитрила, метилметакрилата, адипонитрила и других соединений. Большое число её производных используются при извлечении благородных металлов из руд, при гальванопластическом золочении и серебрении, в производстве ароматических веществ, химических волокон, пластмасс, каучука, органического стекла, стимуляторов роста растений, гербицидов.
Как отравляющее веществo[править | править код]
Впервые в роли боевого отравляющего вещества синильная кислота была использована французской армией 1 июля 1916 года на реке Сомме[11]. Однако из-за отсутствия кумулятивных свойств и малой стойкости на местности её последующее использование в этом качестве прекратилось.
Синильная кислота являлась основной составляющей препарата «Циклон Б», который был наиболее популярным в Европе во время Второй мировой войны инсектицидом, а также использовался нацистами для убийства людей в концентрационных лагерях. В некоторых штатах США синильная кислота использовалась в газовых камерах в качестве отравляющего вещества при исполнении приговоров смертной казни; в последний раз это было сделано в Аризоне в 1999 году[12]. Смерть, как правило, наступает в течение 5—15 минут.
Соли синильной кислоты называются цианидами. Все цианиды, как и сама кислота, очень ядовиты. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:
- KCN+h3O+CO2⟶HCN+KHCO3{\displaystyle {\mathsf {KCN+H_{2}O+CO_{2}\longrightarrow HCN+KHCO_{3}}}}
- KCN+2h3O⟶Nh4+HCOOK{\displaystyle {\mathsf {KCN+2H_{2}O\longrightarrow NH_{3}+HCOOK}}}
Ион CN− (изоэлектронный молекуле СО) входит как лиганд в большое число комплексных соединений d-элементов. Комплексные цианиды в растворах очень стабильны.
Цианиды тяжёлых металлов термически неустойчивы; в воде, кроме цианида ртути (Hg(CN)2), нерастворимы. При окислении цианиды образуют соли — цианаты:
- 2KCN+O2⟶2KOCN{\displaystyle {\mathsf {2KCN+O_{2}\longrightarrow 2KOCN}}}
Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:
- 8NaCN+4Au+O2+2h3O⟶4Na[Au(CN)2]+4NaOH{\displaystyle {\mathsf {8NaCN+4Au+O_{2}+2H_{2}O\longrightarrow 4Na[Au(CN)_{2}]+4NaOH}}}
Токсичность и биологические свойства[править | править код]

Синильная кислота — сильнейший яд общетоксического действия, блокирует клеточную цитохромоксидазу, в результате чего возникает выраженная тканевая гипоксия. Половинные летальные дозы (LD50) и концентрации для синильной кислоты[13]:
- Мыши:
- перорально (ORL-MUS LD50) — 3,7 мг/кг;
- при вдыхании (IHL-MUS LC50) — 323 м.д.;
- внутривенно (IVN-MUS LD50) — 1 мг/кг.
- Кролики, внутривенно (IVN-RBT LD50) < 1 мг/кг;
- Человек, минимальная опубликованная смертельная доза перорально (ORL-MAN LDLo) < 1 мг/кг.
При вдыхании синильной кислоты в небольших концентрациях наблюдается царапанье в горле, горький вкус во рту, головная боль, тошнота, рвота, боли за грудиной. При нарастании интоксикации уменьшается частота пульса, усиливается одышка, развиваются судороги, наступает потеря сознания. При этом цианоз отсутствует (содержание кислорода в крови достаточное, нарушена его утилизация в тканях).
При вдыхании синильной кислоты в высоких концентрациях или при попадании её внутрь появляются клонико-тонические судороги и почти мгновенная потеря сознания вследствие паралича дыхательного центра. Смерть может наступить в течение нескольких минут.
В организме человека метаболитом синильной кислоты является роданид (тиоцианат) SCN−, образующийся при её взаимодействии с серой под действием фермента роданазы.
Для лечения отравлений синильной кислотой известно несколько антидотов, которые могут быть разделены на две группы. Лечебное действие одной группы антидотов основано на их взаимодействии с синильной кислотой с образованием нетоксичных продуктов. К таким препаратам относятся, например, коллоидная сера и различные политионаты, переводящие синильную кислоту в малотоксичную роданистоводородную кислоту, а также альдегиды и кетоны (глюкоза, диоксиацетон и др.), которые химически связывают синильную кислоту с образованием циангидринов. К другой группе антидотов относятся препараты, вызывающие образование в крови метгемоглобина: синильная кислота связывается метгемоглобином и не доходит до цитохромоксидазы. В качестве метгемоглобинообразователей применяют метиленовую синь, а также соли и эфиры азотистой кислоты.
Сравнительная оценка антидотных средств: метиленовая синь предохраняет от двух смертельных доз, тиосульфат натрия и тетратиосульфат натрия — от трёх доз, нитрит натрия и
| Формула (название) | Пространственная конфигурация | Характеристика связей, строение молекул |
|---|---|---|
| Н2О (вода) | Молекула имеет угловое строение (α = 105°), полярная (диполь), 2σ-связи по обменному механизму | |
| NH3 (аммиак) | Молекула имеет пирамидальное строение (α = 107°), полярная (диполь), 3σ-связи по обменному механизму | |
| CO2 (оксид углерода(IV)) | Молекула имеет линейное строение1 (α = 180°), неполярная, 4 связи (2σ+ 2π) по обменному механизму | |
| CH4 (метан) | Молекула имеет тетраэдрическое строение2 (α = 109°), неполярная, 4σ-связи по обменному механизму | |
| H2O2 (пероксид водорода) | Молекула полярная, 3 σ-связи по обменному механизму, 2 из них полярные (связи Н–О) | |
| P4 (белый фосфор) | Тетраэдрическое строение (α = 60°), молекула неполярная, 6 σ-связей по обменному механизму | |
| S8 (ромбическая и моноклинная сера) | Структура в виде «короны», молекула неполярная, 8 σ-связей по обменному механизму | |
| N2H4 (гидразин) | Молекула полярная, 5 σ-связей, 4 из них полярные (все по обменному механизму) | |
| NH2OH (гидроксиламин) | Молекула полярная. 4 σ-связи (все по обменному механизму) | |
| CS2 (сероуглерод) | Молекула имеет линейное строение (α = 180°), неполярная, 4 связи (2σ + 2π), все по обменному механизму | |
| COF2 | Молекула треугольная (ядра всех атомов находятся в одной плоскости), полярная, 4 связи (3σ + 1π), все по обменному механизму | |
| SO2 (оксид серы(IV)) | Молекула имеет угловое строение (α = 120°), полярная, 4 связи (2σ + 2π), все по обменному механизму | |
| SO3 (оксид серы(VI)) | Молекула имеет вид треугольника (α = 120°), все атомы лежат в одной плоскости4, неполярная, 6 связей (3σ + 3π), все по обменному механизму | |
| HCN (циановодород) | Молекула имеет линейное строение (α = 180°), полярная, 4 связи (2σ + 2π), все по обменному механизму | |
| H3O+(ион гидроксония) | Ион имеет пирамидальное строение (как NH3), α = 107°, 3 σ-связи: одна по донорно-акцепторному, две — по обменному механизму | |
| Nh5+ (ион аммония) | Ион имеет тетраэдрическое строение (α = 109°), 4 σ-связи: одна по донорно-акцепторному, три — по обменному механизму | |
| С6Н6 (бензол) | Валентный угол α равен 120°. Молекула неполярная | |
| SiC (карборунд) | Тетраэдрическое расположение атомов в пространстве5 (валентный угол 109°) | |
| Графит | В графите длина связи С–С, 0,142 нм, валентный угол равен 120° | |
| Карбин | Валентный угол 180°, длина связи углерод — углерод равна 0,120 нм |
Диполь. Дипольный момент молекулы | Задачи 254
Задача 254.
Дипольный момент молекулы HCN равен 2,9D. Вычислить длину диполя.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на
расстояние l между центрами положительного и отрицательного зарядов в диполе:
Отсюда
Учитывая, что 1D = 3,33 . 10-30 Кл . м, находим длину диполя:
Ответ: 6,04
Задача 255.
Длина диполя молекулы фтороводорода равна 4 . 10-11 м. Вычислить ее дипольный момент в дебаях и в кулон-метрах.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе:
Дипольный момент измеряют в дебаях (D), 1D = 3,33 .10-30 Кл . м).
Находим дипольный момент молекулы в кулон-метрах:
Вычисляем дипольный момент молекулы в дебаях:
Ответ: 6,04 .10-30 Кл . м = 1,92D.
Задача 256.
Дипольные моменты молекул Н2О и Н2S равны соответственно 1,84 и 0,94D. Вычислить длины диполей. В какой молекуле связь более полярна? Указать направления дипольных моментов связей в этих молекулах.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе:
Дипольный момент измеряют в дебаях (D), 1D = 3,33 . 10-30Кл . м).
Вычислим длину связи молекулы Н2О:
Вычислим длину связи молекулы H2S:
Так как дипольный момент молекулы Н2О больше, чем молекулы H2S, то в молекуле Н2О связь более полярна. Учитывая, что атомы кислорода и серы более электроотрицательнее атома водорода, то дипольные моменты связей будут направлены от атома водорода соответственно к атому кислорода и серы (Н→ О, H →S).
Ответ: 0,038 и 0,020 нм.
Задача 257.
Описать пространственное строение неполярной молекулы ВеСI2. Какие АО бериллия участвуют в образовании связей Ве—С1?
Решение:
В молекуле BeCl2 валентный электронный слой атома бериллия содержит две электронных пары:
Поэтому электронные облака атома бериллия будут максимально удалены друг от друга при sp-гибридизации, когда их оси совпадают и направлены противоположно друг к другу, что приводит к нулевому значению дипольного момента, молекула приобретает линейное строение:
При образовании молекулы BeCl2 в образовании связей Be—Cl участвуют две sp-гибридные АО бериллия.
Задача 258.
Дипольный момент молекулы SO2 равен 1,бID, молекулы СО2 — нулю. Одинаковы ли валентные углы ОSО и ОСО? Ответ мотивировать.
Решение:
Дипольный момент – величина векторная, направленная от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как некоторую сумму дипольных моментов связей; она зависит не только от полярности каждой связи, но и от взаимного расположения этих связей.
В линейных молекулах типа АВ2, в нашем случае в молекуле СО2, дипольные моменты связей С=О направлены друг к другу и поэтому взаимно компенсируются, что и приводит к нулевому значению суммарного диполя молекулы. Поэтому углы ОСО равны 1800. Схема молекулы СО2 имеет вид:
Так как дипольный момент молекулы SO2 имеет значение больше нуля, то дипольные моменты связей S—O направлены друг к другу под углом, молекула имеет угловую структуру:
Взаимное расположение связей в молекуле SO2 угловое, т.е. молекула построена в форме треугольника. Поэтому валентные углы ОSО и ОСО не одинаковы.
Задача 259.
Дипольный момент молекулы СS2 равен нулю. Каким типом гибридизации АО углерода описывается образование этой молекулы?
Решение:
Электронная конфигурация атома углерода 1s22s22р2. Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Электронное строение валентных орбиталей атома углерода в возбужденном состоянии представлено следующей схемой:
Четыре неспаренных электрона возбуждённого атома углерода могут участвовать в образовании четырёх ковалентных связей по обычному механизму с другими атомами химических элементов. Так как дипольный момент молекулы CS2 равен нулю, то молекула имеет линейное строение. В CS2 валентный электронный слой содержит четыре пары электронов, по две пары с двух сторон атома углерода:
Поэтому в молекуле CS2 углерод находится в состоянии sp-гибридизации. Образовавшиеся равноценные sp-гибридные орбитали образуют одинарные — связи C—S, а два неспаренных р-облака, перекрываясь образуют — связь с атомами серы. Поэтому в молекуле CS2 sp-гибридные облака ориентируются в противоположных направлениях, молекула имеет линейное строение. В линейных молекулах типа АВ2, в нашем случае в молекуле CS2, дипольные моменты связей С=S направлены друг к другу и поэтому взаимно компенсируются, что и приводит к нулевому значению суммарного диполя молекулы. Поэтому углы SСS равны 1800. Схема молекулы СS2 имеет вид:
S → C ← S
Задача 260.
Дипольные моменты молекул ВF3 и NF3 равны соответственно О и 0,2D. Какими типами гибридизации AO бора и азота описывается образование этих молекул?
Решение:
а) В молекуле BF3 валентный электронный слой атома бора содержит три пары электронов:
Электронные облака атома бора будут максимально удалены друг от друга при sp2-гибридизации, когда оси связей
B—F направлены друг к другу под углом 1200 (т.е. в направлениях к вершинам правильного треугольника), молекула будет иметь форму:
Такое расположение связей взаимно компенсирует их дипольные моменты, так что суммарное значение дипольного момента молекулы трифторида бора равно нулю.
б) В молекуле NF3 валентный электронный слой атома азота содержит четыре пары электронов:
Поэтому электронные облака атома азота будут максимально удалены друг от друга при sp3-гибридизации, когда оси связей N—F будут направлены к вершинам тетраэдра (углы между этими направлениями составляют 109028’). При образовании молекулы NF3 атом азота расположен в центре тетраэдра, а атомы фтора расположены в трёх вершинах тетраэдра, к четвёртой вершине направлено электронное облако неподелённой пары электронов атома азота. Образовавшаяся фигура – тригональная пирамида. Дипольный момент такой молекулы будет иметь значение больше нуля.
Химическая связь и строение молекул | Задания 61
Механизм образования ковалентной связи
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Молекула воды Н2О имеет дипольный момент, значит, она имеет нелинейное строение. В образовании связей между атомами кислорода и водорода участвуют один атом кислорода и два атома водорода. Кислород – цейтральный атом в молекуле воды, и он имеет четыре электронные пары, две пары неподелённые и две – поделённые, которые образованы одним s-электроном и одним р-электроном кислорода. Такая молекула имеет тетраэдрическое строение в центре тетраэдра находится атом кислорода, а по углам тетраэдра два атома водорода и две неподелённые электронные пары кислорода. В такой молекуле угол между связями должен быть равен 109,50. Если бы молекула воды была плоская, то угол НОН должен быть 900. Но рентгеноструктурный анализ молекул воды показывает, что угол НОН равен 104,50. Это объясняет, что молекула воды имеет не линейное форму, а имеет форму искажённого тетраэдра. Объясняется это тем, что атом кислорода претерпевает sp3— гибридизацию, когда одна s-орбиталь и три р-орбитали атома кислорода гибридизируются, образуя четыре равноценные sp3-гибридные орбитали. Из четырёх sp3-гибридных орбиталей две заняты s-орбиталями атома водорода. Разница между значениями валентного угла и тетраэдрическим углом объясняется тем, что отталкивание между неподелёнными электронными парами больше, чем между связывающими.
Полярная ковалентная связь
Задание 62.
Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HCl, IСl, ВгF наиболее полярна.
Решение:
Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени. В H : Cl общая электронная пара смещена в сторону наиболее электроотрицательного атома хлора. Полярность связи количественно оценивается дипольным моментом (), который является произведением длины диполя (l) – расстояния между двумя равными по величине и противоположными по знаку зарядами +g и –g на абсолютную величину заряда: = lg. Дипольные моменты НСI, НВг, НI равны, соответственно 1,04; 0,79; 0,38 D. Дипольные моменты молекул обычно измеряют в дебаях (D)* : 1D = 3,33 . 10-30 Кл .м.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Наряду с дипольным моментом , для оценки степени полярности связи используют характеристику, называемую электроотрицательностью элемента (ЭО). ЭО – это способность атома притягивать к себе валентные электроны других атомов. Значения ЭО элементов приведены в специальных шкалах (таблицах).
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
Задание 63.
Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор.
Решение:
Донорно-акцепторная связь – это ковалентная связь, в которой обобществлённую пару электронов предоставляет только один из участвующих в связи атомов. При этом один из атомов является донором – поставщиком электронной пары, а другой – акцептором – поставщиком свободной квантовой орбитали.
Катион аммония NH4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой которая направлена от донора к акцептору.
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
р — р связь и s — p могут располагаться друг относительно друга под углом, т. е. молекула BeCl2 должна быть угловой, но точно установлено, что молекула BeCl2 имеет линейное строение, причём обе — связи равны по энергии и по длине. Для объяснения геометрии молекулы BeCl2 привлекается концепция гибридизации атомных орбиталей. Суть концепции атомных орбиталей заключается в том, что атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов и, следовательно, наибольший выигрыш в энергии. Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. Так в атоме Ве s-орбиталь и р-орбиталь вступают во взаимодействие, их энергии выравниваются и образуются две одинаковые по форме sp-гибридные орбитали. Два образовавшихся sp-гибридных электронных облака имеют одинаковую энергию и ассиметричную форму, которая обеспечивает большее перекрывание р-электронными облаками атома хлора, чем перекрывание с участием чистых негибридизированных s- и р-облаков. Два гибридных sp-облака располагаются относительно друг друга и ядра атома под углом 1800:
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Из четырёх связей в молекуле СН4 должны быть одна s — s и три s — p связи, образованные за счёт перекрывания орбиталей атома углерода с s-орбиталью атомов водорода. В результате этого перекрывания должна образоваться связь s — s, отличная от трёх s — p связей длиной и энергией и, расположенная к любой из них под углом около 1250. Однако точно установлено, что молекула СН4 имеет форму тетраэдра с углом между связями 109,50, причём все связи равноценны по длине и энергии. Объяснить тетраэдрическое строение молекулы СН4 можно sp3-гибридизацией. Атом углерода содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации s-орбитали и трёх p-орбиталей. Четыре sp3-гибридные орбитали располагаются друг относительно друга под углом 109,50. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 2.).
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Таким образом, в молекуле СН4 образуются четыре равноценные химические -связи за счёт перекрывания sp3-гибридных орбиталей атома углерода с s-орбиталями атомов углерода.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют -связью и какую -связью? Разберите на примере строения молекулы азота.
Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют -связью (любая простая связь) или «Если перекрывание атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь ( -связь). Сигма-связь образуется за счёт перекрывания двух s-орбиталей (s — s связь), одной s- и одной р-орбиталью (s — p связь), двумя р-орбиталями (р — р связь), одной s- и одной d-орбиталью (s — d связь), одной p- и одной d-орбиталью (p — d связь).
Варианты перекрывания атомных орбиталей, приводящие к образованию -связи (рис.1.):
Рис. 1.Схемы образования -связей
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется -связью. Вариантов образования -связи немного (рис. 2.):
Рис. 1.Схемы образования -связей
Она не так прочна как сигма-связь, поскольку перекрывание в -связи намного слабее. -связи никогда не образуются , если нет -связи. Иными словами, -связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну -связь и две -связи: . Атом азота на внешнем энергетическом уровне содержит пять электронов: два на s-орбитали и три неспаренных электрона на р-орбиталях. За счёт перекрывания р-электрона одного атома и р-электрона другого атома азота образуется
-связь. Две другие связи являются -связями, которые образовались за счёт перекрывания двух р-электронов одного атома и двух р-электронов другого ниже и выше и перпендикулярно друг другу по отношению плоскости -связи.
Монооксид углерода — Википедия
| Монооксид углерода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Монооксид углерода | ||
| Хим. формула | CO | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 28,01 г/моль | ||
| Плотность | 0,001250°C; 0,814-195°C г/см³ | ||
| Энергия ионизации | 14,01 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | −205 °C | ||
| • кипения | −191,5 °C | ||
| Пределы взрываемости | 12,5 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | −110,52 кДж/моль | ||
| Давление пара | 35 ± 1 атм[2] | ||
| Растворимость | |||
| • в воде | 0,0026 г/100 мл | ||
| Рег. номер CAS | 630-08-0 | ||
| PubChem | 281 | ||
| Рег. номер EINECS | 211-128-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | FG3500000 | ||
| ChEBI | 17245 | ||
| Номер ООН | 1016 | ||
| ChemSpider | 275 | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой » :C≡O: «.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2
Oσ2
zπ4
x, y σ2
C. Тройная связь образована σ-связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π-связям. Электроны на несвязывающих σC-орбитали и σO-орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, её электрический дипольный момент μ = 0,04⋅10−29 Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Энергия ионизации 14,0 эВ, силовая константа связи k = 18,6.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции
- h3O+CO⇄CO2+h3{\displaystyle {\mathsf {H_{2}O+CO\rightleftarrows CO_{2}+H_{2}}}}
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета[3] (температура начала реакции 700 °C) на воздухе:
- 2CO+O2→2CO2{\displaystyle {\mathsf {2CO+O_{2}\rightarrow 2CO_{2}}}} (ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[4].
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
- CO+Cl2→hνCOCl2.{\displaystyle {\mathsf {CO+Cl_{2}{\xrightarrow {h\nu }}COCl_{2}}}.}
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
- (FCO)2O2+2KI→2KF+I2+2CO2.{\displaystyle {\mathsf {(FCO)_{2}O_{2}+2KI\rightarrow 2KF+I_{2}+2CO_{2}.}}}
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
- CO+S→COS{\displaystyle {\mathsf {CO+S\rightarrow COS}}} (ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K).
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
- 2CO+SO2→2CO2+S.{\displaystyle {\mathsf {2CO+SO_{2}\rightarrow 2CO_{2}+S.}}}
C переходными металлами образует горючие и ядовитые соединения — карбонилы, такие как [Fe(CO)5], [Cr(CO)6], [Ni(CO)4], [Mn2(CO)10], [Co2(CO)9] и др. Некоторые из них летучие.
- nCO+Me→[Me(CO)n]{\displaystyle {\mathsf {nCO+Me\rightarrow [Me(CO)_{n}]}}}
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
- CO+KOH→HCOOK.{\displaystyle {\mathsf {CO+KOH\rightarrow HCOOK.}}}
Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
- 2K+2CO→K2C2O2.{\displaystyle {\mathsf {2K+2CO\rightarrow K_{2}C_{2}O_{2}.}}}
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
- CO+Nh4→h3O+HCN.{\displaystyle {\mathsf {CO+NH_{3}\rightarrow H_{2}O+HCN.}}}
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
- xCO+yh3→{\displaystyle {\mathsf {xCO+yH_{2}\rightarrow }}} спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Токсичность[править | править код]
Угарный газ очень токсичен.
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017 %).
В выхлопе бензинового автомобиля допускается до 1,5-3 % (допустимая концентрация сильно различается в зависимости от страны/применяемых стандартов; а 3% — много даже для старого карбюраторного автомобиля без катализатора).
По классификации ООН оксид углерода(II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть.[5] Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, учащённое сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, обморочное отношение к людям, кома[6][3].
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом (оксигемоглобином)[6]. Таким образом, блокируются процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[6].
Опыты на молодых крысах показали, что концентрация CO в воздухе 0,02 % замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении оксидом углерода(II)[править | править код]
Соединение окиси углерода с гемоглобином обратимо. При отравлении рекомендуются следующие действия[6]:
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких, О2-терапия, в том числе в барокамере.
- Ацизол, хромосмон внутривенно.
Мировой медицине неизвестны надежные антидоты для применения в случае отравления угарным газом[7].
Защита от оксида углерода(II)[править | править код]
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[3].
Эндогенный монооксид углерода[править | править код]
Эндогенный монооксид углерода вырабатывается в норме клетками организма человека и животных и выполняет функцию сигнальной молекулы. Он играет известную физиологическую роль в организме, в частности, является нейротрансмиттером и вызывает вазодилатацию[8]. Ввиду роли эндогенного угарного газа в организме, нарушения его метаболизма связывают с различными заболеваниями, такими, как нейродегенеративные заболевания, атеросклероз кровеносных сосудов, гипертоническая болезнь, сердечная недостаточность, различные воспалительные процессы[8].
Эндогенный угарный газ образуется в организме благодаря окисляющему действию фермента гемоксигеназы на гем, являющийся продуктом разрушения гемоглобина и миоглобина, а также других гемосодержащих белков. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом (всегда содержащим небольшие количества экзогенного угарного газа), а чистым кислородом или смесью азота с кислородом.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный угарный газ является нормальным нейротрансмиттером в организме человека[9][10], а также одним из трёх эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота (II) и сероводород), эндогенный угарный газ привлёк значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез[11]. Однако не всё так просто и однозначно. Ангиогенез — не всегда полезный эффект, поскольку он, в частности, играет роль в росте злокачественных опухолей, а также является одной из причин повреждения сетчатки при макулярной дегенерации. В частности, курение (основной источник угарного газа в крови, дающий в несколько раз большую концентрацию его, чем естественная продукция) повышает риск макулярной дегенерации сетчатки в 4-6 раз.
Существует теория о том, что в некоторых синапсах нервных клеток, где происходит долговременное запоминание информации, принимающая клетка в ответ на принятый сигнал вырабатывает эндогенный угарный газ, который передаёт сигнал обратно передающей клетке, чем сообщает ей о своей готовности и в дальнейшем принимать сигналы от неё и повышая активность клетки-передатчика сигнала. Некоторые из этих нервных клеток содержат гуанилатциклазу, фермент, который активируется при воздействии эндогенного угарного газа[10].
Исследования, посвящённые роли эндогенного угарного газа как противовоспалительного вещества и цитопротектора, проводились во множестве лабораторий по всему миру. Эти свойства эндогенного угарного газа делают воздействие на его метаболизм интересной терапевтической мишенью для лечения таких разных патологических состояний, как повреждение тканей, вызванное ишемией и последующей реперфузией (а это, например, инфаркт миокарда, ишемический инсульт), отторжение трансплантата, атеросклероз сосудов, тяжёлый сепсис, тяжёлая малярия, аутоиммунные заболевания. Проводились в том числе и клинические испытания на человеке, однако результаты их пока ещё не опубликованы[12].
На 2015 год о роли эндогенного угарного газа в организме известно следующее[13]:
- Эндогенный угарный газ — одна из важных эндогенных сигнальных молекул;
- Эндогенный угарный газ модулирует функции ЦНС и сердечно-сосудистой системы;
- Эндогенный угарный газ ингибирует агрегацию тромбоцитов и их адгезию к стенкам сосудов;
- Влияние на обмен эндогенного угарного газа в будущем может быть одной из важных терапевтических стратегий при ряде заболеваний.
Токсичность дыма, выделяющегося при горении угля, была описана ещё Аристотелем и Галеном.
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках[14].
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.[15]
Промышленный способ[править | править код]
Влияние температуры на равновесие реакции: CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}}- 2C+O2→2CO{\displaystyle {\mathsf {2C+O_{2}\rightarrow 2CO}}} (тепловой эффект этой реакции 220 кДж),
- CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}} (ΔH = 172 кДж, ΔS = 176 Дж/К)
Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода(II) вследствие своей ядовитости вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[3].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода(II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ[править | править код]
- HCOOH→h3SO4oth3O+CO.{\displaystyle {\mathsf {HCOOH{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}H_{2}O+CO.}}}
- Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
- HCOOH+ClSO3H→h3SO4+HCl+CO↑.{\displaystyle {\mathsf {HCOOH+ClSO_{3}H\rightarrow H_{2}SO_{4}+HCl+CO\uparrow .}}}
- h3C2O4→h3SO4otCO↑+CO2↑+h3O.{\displaystyle {\mathsf {H_{2}C_{2}O_{4}{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}CO\uparrow +CO_{2}\uparrow +H_{2}O.}}}
- K4[Fe(CN)6]+6h3SO4+6h3O→ot2K2SO4+FeSO4+3(Nh5)2SO4+6CO↑.{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+6H_{2}SO_{4}+6H_{2}O{\xrightarrow[{}]{^{o}t}}2K_{2}SO_{4}+FeSO_{4}+3(NH_{4})_{2}SO_{4}+6CO\uparrow .}}}
- Mg+ZnCO3→otMgO+ZnO+CO↑.{\displaystyle {\mathsf {Mg+ZnCO_{3}{\xrightarrow[{}]{^{o}t}}MgO+ZnO+CO\uparrow .}}}
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
- PdCl2+CO+h3O→Pd↓+CO2+2HCl.{\displaystyle {\mathsf {PdCl_{2}+CO+H_{2}O\rightarrow Pd\downarrow +CO_{2}+2HCl.}}}
Эта реакция очень чувствительная. Стандартный раствор: 1 грамм хлорида палладия на литр воды.
Количественное определение оксида углерода(II) основано на иодометрической реакции:
- 5CO+I2O5→5CO2+I2.{\displaystyle {\mathsf {5CO+I_{2}O_{5}\rightarrow 5CO_{2}+I_{2}.}}}
- Оксид углерода(II) является промежуточным реагентом, используемым в реакциях с водородом в важнейших промышленных процессах для получения органических спиртов и неразветвлённых углеводородов.
- Оксид углерода(II) применяется для обработки мяса животных и рыбы, придаёт им ярко-красный цвет и вид свежести, не изменяя вкуса (технологии Clear smoke[en] и Tasteless smoke[en]). Допустимая концентрация CO равна 200 мг/кг мяса.
- Оксид углерода(II) является основным компонентом генераторного газа, использовавшегося в качестве топлива в газогенераторных автомобилях.
- Угарный газ от выхлопа двигателей применялся нацистами в годы Второй мировой войны для массового умерщвления людей путём отравления.
 Содержание CO в атмосфере Земли по данным MOPITT
Содержание CO в атмосфере Земли по данным MOPITTРазличают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Оксид углерода(II) образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение оксида углерода(II) за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв оксид углерода(II) выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % оксида углерода(II). В коммунальной сфере не применяется в виду наличия значительно более дешёвого и энергоэффективного аналога — природного газа.
Поступление CO от природных и антропогенных источников примерно одинаково.
Оксид углерода(II) в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года. Основной канал потери CO — окисление гидроксилом до диоксида углерода.
Строение молекул. НАГЛЯДНАЯ БИОХИМИЯ. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
Строение молекул
Физические
и химические свойства молекул определяются их строением. Поэтому многие
свойства могут быть предсказаны на основании структурной формулы. К таким свойствам
относятся размеры, форма, до некоторой степени конформация молекул (т.е.
взаимное расположение отдельных атомов) при нахождении вещества в растворе и,
наконец, реакционная способность. В этом разделе сведены параметры, на основании
которых можно прогнозировать свойства соединений. Здесь также представлена пространственная
структура одного из органических соединений — L-дигидроксифенилаланина [L-дофа
(L-Dopa)], промежуточного продукта в биосинтезе катехоламинов (см. с. 342).
Подобные пространственные структуры приводятся и в последующих разделах книги.
А. Длина связей
Для обозначения расстояний между атомами в молекуле используется
понятие ковалентный радиус. Длина простой связи является величиной аддитивной:
она примерно равна сумме ковалентных радиусов двух атомов. Двойная связь на
10-20% короче простой связи. В последнее время атомные радиусы и расстояние
между атомами принято выражать в пикометрах (пм, 1 пм = 10-12 м).
Ранее длину связей представляли в ангстремах (Ǻ, 1Ǻ=100 пм).
Б. Поляризация связей
В зависимости от положения в периодической системе (см. с. 10) химические элементы обладают различной способностью притягивать дополнительные электроны. Такое свойство — электроотрицательность — выражается в условных единицах. У элементов, представленных на схеме, электроотрицательность меняется в пределах от 2 до 4. Чем выше это число, тем большей способностью притягивать электроны обладает химический элемент. При взаимодействии двух различных атомов пара электронов смещается в сторону более электроотрицательного атома, образуя поляризованную ковалентную связь. Мерой поляризуемости химической связи является величина дипольного момента (единица измерения: дебай, 1 Д = 3,3· 10-30 Кл∙м).
Среди важных в биохимическом отношении элементов наиболее электроотрицательным
является кислород, а наиболее поляризованной — двойная связь карбонильной группы
С=О. Образующийся на углеродном атоме частичный положительный заряд облегчает
часто встречающееся в биохимических реакциях нуклеофильное замещение по карбонильной
группе (см. с. 20).
В. Водородные связи
Особый тип нековалентной связи — водородная связь — имеет в
биохимии исключительно важное значение. В образовании водородной связи принимают
участие атомы водорода ОН-, NH- и SH-гpупп (так называемых доноров водородной
связи), которые взаимодействуют со свободной парой электронов атомов-акцепторов
(например, О, N или S). Энергия водородной связи составляет 10-40 кДж/моль,
что значительно меньше энергии ковалентной связи (>400 кДж/моль). Однако
многочисленные водородные связи вносят существенный вклад в стабилизацию структуры
многих макромолекул (см. сc. 74, 90).
Например, L-дофа может образовывать две внутримолекулярные водородные
связи. На шаро-стержневой модели L-дофа водородные мостики указаны штрихами.
Г. Эффективные атомные радиусы
Размеры атома или иона определяются его электронной оболочкой.
Однако оболочка не ограничена определенной поверхностью, поэтому эффективный
радиус атома задается вандерваальсовым радиусом. Этот радиус определяется
на основании наименьшего энергетически выгодного расстояния между двумя атомами,
не связанными ковалентной связью. На таком расстоянии энергия взаимодействия,
определяемая силами притяжения и отталкивания, достигает минимального значения.
Это расстояние соответствует сумме вандерваальсовых радиусов двух атомов. Форма
и величина молекул в наиболее наглядном виде демонстрируется с помощью вандерваальсовой
модели, где каждый атом занимает часть (сегмент) сферы соответствующего
радиуса.
Описать электронное строение молекул CO и CN с помощью метода валентных связей (ВС) и метода молекулярных орбиталей. Какая из молекул характеризуется большей кратностью связей.
Описать электронное строение молекул CO и CN с помощью метода валентных связей (ВС) и метода молекулярных орбиталей. Какая из молекул характеризуется большей кратностью связей.
Решение: По методу валентных связей (Дж.Льюис,1916) возникновение связи осуществляется за счет образования общей электронной пары между двумя атомами, в которую входит по одному электрону от каждого атома.
Электронные строения атомов:
6С – 1s22s22p2
7N – 1s22s22p3
8O – 1s22s22p4
Распределение электронов по квантовым ячейкам в основном и возбужденном состояниях:
6С – 1s22s22p2
s p
n=2 | ↑↓ | ↑ | ↑ |
|
n=1 | ↑↓ |
|
|
|
В = 2
6С* – возбужденное состояние
s p
n=2 | ↑ | ↑ | ↑ | ↑ |
n=1 | ↑↓ |
|
|
|
В = 4
7N – 1s22s22p3
В основном состоянии:
s p
n=2 | ↑↓ | ↑ | ↑ | ↑ |
n=1 | ↑↓ |
|
|
|
На внешнем энергетическом уровне нет свободных орбиталей, поэтому для азота В=3, аналогично для кислорода:
8O – 1s22s22p4
s p
n=2 | ↑↓ | ↑↓ | ↑ | ↑ |
n=1 | ↑↓ |
|
|
|
В=2
: С : : Ö : H : C : : : N : (CN– )
С = О С ≡ N
Связи ковалентные полярные, смещены в сторону более электроотрицательных элементов (С →О; С →N)
Кратность связи равна 2 в молекуле СО и 3 в ионе СN– .
По методу молекулярных орбиталей при образовании из отдельных атомов многоатомной частицы электроны попадают в зону притяжения нескольких атомных ядер, т.е. становятся общими для всей частицы. В результате атомные орбитали трансформируются в молекулярные орбитали (МО).
Заполнение МО в молекулах и ионах и характеристики связи можно представить в виде табл. 4.
Таблица 4 – Заполнение МО в молекуле СО и ионе CN–
Тип МО | CN– | CO |
σх разр π yразр πzразр π yсв πzсв σх св σs разр σs св | __ __ __ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ | __ __ __ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ |
Кратность связи | 3 | 3 |
Многоатомные частицы, имеющие одинаковое расположение электронов в молекулярных орбиталях, называются изоэлектронными. Такие частицы имеют близкие по значению параметры связи. К таким частицам относятся N2, CN–, CO и NO+.


 (
(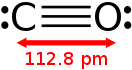
 (
(