Простые молекулы в нашей жизни — учебный курс
- Автор: Еремин Вадим Владимирович
- Год создания: 2017
- Организация: МГУ имени М.В. Ломоносова
- Дистанционный курс
- Описание:
Курс рассказывает о веществах, которые состоят из очень простых молекул, но играют огромную роль в жизни человека и общества. Эти вещества участвуют в биохимических процессах в организме человека, определяют свойства окружающей его природной среды и служат источником многих материалов, которые приносят пользу человеку и делают его жизнь более комфортной. К таким веществам относятся, в первую очередь, вода, газы – компоненты атмосферы (кислород, азот, углекислый газ, озон), а также газы и жидкости, используемые в крупных промышленных процессах (водород, хлор, аммиак, угарный газ, этилен, бензол).




- Добавил в систему: Еремин Вадим Владимирович
Преподавание курса
- 7 февраля 2022 — 31 мая 2022 Еремин Вадим Владимирович
- МГУ имени М.
 В. Ломоносова, Химический факультет
В. Ломоносова, Химический факультет - обязательная, по выбору (межфакультетский курс), лекции, 24 часов
- Автор: Еремин Вадим Владимирович
- 7 февраля 2019 — 31 мая 2019 Еремин Вадим Владимирович
- МГУ имени М.В. Ломоносова, Химический факультет
- обязательная, по выбору (межфакультетский курс), лекции, 24 часов
- Автор: Еремин Вадим Владимирович
Сероводород как сигнальная молекула в сердечно-сосудистой системе | Тихомирова
1. Wang R. Physiological implications of hydrogen sulfide: a whiff exploration that blossomed. Physiol Rev. 2012; (92):791–896. Doi: 10.1152/physrev.00017.2011.
2012; (92):791–896. Doi: 10.1152/physrev.00017.2011.
2. Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator. J. Neurosci. 1996;(16):1066– 1071. Doi: 10.1523/JNEUROSCI.16-03-01066.1996.
3. Huang S, Li H, Ge J. A cardioprotective insight of the cystathionine γ-lyase/hydrogen sulfide pathway. IJC Heart & Vasculature. 2015;7(1):51–57. Doi: org/10.1016/j.ijcha.2015.01.010.
4. Mustafa AK, Gadalla MM, Snyder SH. Signaling by Gasotransmitters. Sci. Signal. 2009;2(68):1–8. Doi: 10.1126/scisignal.268re2.
5. Ситдикова Г. Ф., Яковлев А. В., Зефиров А. Л. Газомедиаторы: от токсических эффектов к регуляции клеточных функций и использованию в клинике // Бюлл. cибир. мед. – 2014. – T. 13, № 6. – C. 185–200.
6. Колесников С. И., Власов Б. Я., Колесникова Л. И. Сероводород как третья эссенциальная газовая молекула живых тканей // Вестн. РАМН. – 2015. – Т. 70, № 2. – С. 237–241. Doi: 10.15690/vramn.v70i2.1318).
7. Shibuya N, Milkanai Y, Kimura Y, Nagahara N, Kimura H. Vascular endothelium expresses 3-mercaptopyruvate sulfurtransferase and produces hydrogen sulfide. J. Biochem. Adv. Access. 2009;(146):623–626. Doi: 10.1093/jb/mvp111.
Vascular endothelium expresses 3-mercaptopyruvate sulfurtransferase and produces hydrogen sulfide. J. Biochem. Adv. Access. 2009;(146):623–626. Doi: 10.1093/jb/mvp111.
8. Elsey DJ, Fowkes RC, Baxter GF. L-Cysteine stimulates hydrogen sulfide synthesis in myocardium associated with attenuation of ischemia-reperfusion injury. J Cardiovasc Pharmacol Ther. 2010;(15):53–59. Doi: 10.1177/1074248409357743.
9. Rushing AM, Donnarumma E, Polhemus DJ, Au KR, Victoria SE, Schumacher JD, Li Z, Jenkins JS, Lefer DJ, Goodchild TT. Effects of a novel hydrogen sulfide prodrug in a porcine model of acute limb ischemia. J Vasc Surg. 2019; (69):1924–1935. Doi: 10.1016/j.jvs.2018.08.172.
10. Chatzianastasiou A, Bibli SI, Andreadou I, Efentakis P, Kaludercic N, Wood ME, Whiteman M, Di Lisa F, Daiber A, Manolopoulos VG, Szabo C, Papapetropoulos A. Cardioprotection by h3 S donors: Nitric oxide-dependent and independent mechanisms. J Pharmacol Exp Ther. 2016; (358):431–440. Doi: 10.1124/jpet. 116.235119.
116.235119.
11. Karwi QG, Whiteman M, Wood ME, Torregrossa R, Baxter GF. Pharmacological postconditioning against myocardial infarction with a slow-releasing hydrogen sulfide donor, GYY4137. Pharmacol Res. 2016;(111):442–451. Doi: 10.1016/j.phrs.2016.06.028.
12. Xu M, Wu YM, Li Q, Wang X, He RR. Electrophysiological effects of hydrogen sulfide on pacemaker cells in sinoatrial nodes of rabbits. 2008;(60):175–180. PMID: 18425303.
13. Zhao W, Wang R. h3 S induced vasorelaxation and underlying cellular and molecular mechanisms. Am. J. Physiol. Heart. Circ. Physiol. 2002;(283):474–480. Doi: 10.1152/ajpheart.00013.2002.
14. Kohno M, Tanaka E, Nakamura T, Shimojo N, Misawa S. Influence of short-term inhalation of hydrogen sulfide in rats. Eisei Kagaku Jpn J Toxicol Environ Health. 1991;(37): 103–106.
15. Higuchi Y. Behavioral studies on toxicity of hydrogen sulfide by means of conditioned avoidance responses in rats. Nippon Yakurigaku Zasshi. 1977;(73):307–319. Doi: 10. 1254/fpj.73.307.
1254/fpj.73.307.
16. Sivarajah A, Collino M, Yasin M, Benetti E, Gallicchio M, Mazzon E, Cuzzocrea S, Fantozzi R, Thiemermann C. Antiapoptotic and anti-inflammatory effects of hydrogen sulfide in a rat model of regional myocardial I/R. Shock. 2009;(31):267– 274. Doi: 10.1097/SHK.0b013e318180ff89.
17. Elsey DJ, Fowkes RC, Baxter GF. Regulation of cardiovascular cell function by hydrogen sulfide (H(2)S). Cell Biochem Funct. 2010;28(2):95–106. Doi: 10.1002/cbf.1618. PMID: 20104507.
18. Yong QC, Hu LF, Wang S, Huang D, Bian JS. Hydrogen sulfide interacts with nitric oxide in the heart: possible involvement of nitroxyl. Cardiovasc Res. 2010;(88):482–491. Doi: 10.1093/cvr/cvq248.
19. Yong QC, Pan TT, Hu LF, Bian JS. Negative regulation of beta-adrenergic function by hydrogen sulfide in the rat hearts. J Mol Cell Cardiol. 2008;(44):701–710. Doi: 10.1016/j.yjmcc.2008.01.007.
20. Yang G, Wu L, Jiang B, Yang W, Qi J, Cao K, Meng Q, Mustafa AK, Mu W, Zhang S, Snyder SH, Wang R. h3 S as a physiologic vasorelaxant: hypertension in mice with deletion of cystathionine gamma-lyase. Science. 2008;322(5901):587– 590. Doi: 10.1126/science.1162667.
h3 S as a physiologic vasorelaxant: hypertension in mice with deletion of cystathionine gamma-lyase. Science. 2008;322(5901):587– 590. Doi: 10.1126/science.1162667.
21. Skovgaard N, Gouliaev A, Aalling M, Simonsen U. The Role of Endogenous h3S in Cardiovascular Physiology. Curr. Pharm. Biotechnol. 2011;(12):1385–1393. Doi: 10.2174/138920111798280956.
22. Lowicka E, Beltowski J. Hydrogen sulfide – the third gas of interest for pharmacologists. Pharmacol. Reports. 2007; (59):4–24. PMID: 17377202.
23. Du J, Yan H, Cheung Y, Geng B, Jiang H, Chen X, Tang C. The possible role of hydrogen sulfide as a smooth musсle cell proliferation inhibitor in rat cultured cells. Heart Vessels. 2004; (19):75–80. Doi: 10.1007/s00380-003-0743-7.
24. Brandes RP, Schmitz-Winnenthal FH, Félétou M, Gödecke A, Huang PL, Vanhoutte PM, Fleming I, Busse R. An endothelium-derived hyperpolarizing factor distinct from NO and prostacyclin is a major endothelium-dependent vasodilator in resistance vessels of wild-type and endothelial NO synthase knockout mice. Proc Natl Acad Sci USA. 2000;(97):9747– 9752. Doi: 10.1073/pnas.97.17.9747.
Proc Natl Acad Sci USA. 2000;(97):9747– 9752. Doi: 10.1073/pnas.97.17.9747.
25. Zhao X, Zhang L, Zhang C, Zeng X, Yan H, Jin HF, Tang C, Du JB. Regulatory effect of hydrogen sulfide on vascular collagen content in spontaneously hypertensive rats. Hypertens Res. 2008;(31):1619–1630. Doi: 10.1291/hypres.31.1619.
26. Cheng Y, Ndisang JF, Tang G, Cao K, Wang R. Hydrogen sulfide-induced relaxation of resistance mesenteric artery beds of rats. Am J Physiol Heart Circ Physiol. 2004;(287):h3316– h3323. Doi: 10.1152/ajpheart.00331.2004.
27. Koenitzer JR, Isbell TS, Patel HD, Benavides GA, Dickinson DA, Patel RP, Darley-Usmar VM, Lancaster JR, Doeller JE, Kraus DW. Hydrogen sulfide mediates vasoactivity in an O2 -dependent manner. Am J Physiol Heart Circ Physiol. 2007;(292):h2953–h2960. Doi: 10.1152/ajpheart.01193.2006.
28. Yuan S, Shen X, Kevil CG. Beyond a Gasotransmitter: Hydrogen Sulfide and Polysulfide in Cardiovascular Health and Immune Response Antioxid. Redox Signal. 2017;(27):634– 653. Doi: 10.1089/ars.2017.7096.
2017;(27):634– 653. Doi: 10.1089/ars.2017.7096.
29. Possomato-Vieira JS, Goncalves-Rizzi VH, Graca TU, Nascimento RA, Dias-Junior CA. Sodium hydrosulfide prevents hypertension and increases in vascular endothelial growth factor and soluble fms-like tyrosine kinase-1 in hypertensive pregnant rats. Naunyn Schmiedebergs Arch Pharmacol. 2016;(389):1325–1332. Doi: 10.1007/s00210-016-1296-5.
30. Snijder PM, Frenay AR, de Boer RA, Pasch A, Hillebrands JL, Leuvenink HG, van Goor H. Exogenous administration of thiosulfate, a donor of hydrogen sulfide, attenuates angiotensin II-induced hypertensive heart disease in rats. Br J Pharmacol. 2015;(172):1494–1504. Doi: 10.1111/bph.12825.
31. Olson KR, Dombkowski RA, Russell MJ, Doellman MM, Head SK, Whitfield NL, Madden JA. Hydrogen sulfide as an oxygen sensor/transducer in vertebrate hypoxic vasoconstriction and hypoxic vasodilation. J Exp Biol. 2006;(209): 4011–4023. Doi: 10.1242/jeb.02480.
32. Semenza GL. Hypoxia. Cross talk between oxygen sensing and the cell cycle machinery, The American Journal of Physiology ‒ Cell Physiology. 2011;301(3):C550–C552. Doi: 10.1152/ajpcell.00176.2011.
2011;301(3):C550–C552. Doi: 10.1152/ajpcell.00176.2011.
33. Wu B, Teng H, Yang G, Wu L, Wang R. Hydrogen sulfide inhibits the translational expression of hypoxia-inducible factor1alpha. British Journal of Pharmacology. 2012;167(7):1492– 1505. Doi: 10.1111/j.1476-5381.2012.02113.x.
34. Wu B, Teng H, Zhang L, Li H, Li J, Wang L, Li H. Interaction of Hydrogen Sulfide with Oxygen Sensing under Hypoxia. Oxid Med Cell Longev. 2015;758678. Doi: 10.1155/2015/758678.
35. Coletta C, Papapetropoulos A, Erdelyi K, Olah G, Modis K, Panopoulos P, Asimakopoulou A, Gero D, Sharina I, Martin E, Szabo C. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation. Proc Natl Acad Sci USA. 2012;(109):9161–9166. Doi: 10.1073/pnas.1202916109.
36. Wang MJ, Cai WJ, Li N, Ding YJ, Chen Y, Zhu YC. The hydrogen sulfide donor NaHS promotes angiogenesis in a rat model of hind limb ischemia. Antioxid Redox Signal. 2010;(12): 1065–1077. Doi: 10.1089/ars.2009.2945.
Doi: 10.1089/ars.2009.2945.
37. Bolton SG, Cerda MM, Gilbert AK, Pluth MD. Effects of sulfane sulfur content in benzyl polysulfides on thiol-triggered h3S release and cell proliferation. Free Radic Biol Med. 2019; (131):393–398. Doi: 10.1016/j.freeradbiomed.2018.12.025.
38. Yuan S, Pardue S, Shen X, Alexander JS, Orr AW, Kevil CG. Hydrogen sulfide metabolism regulates endothelial solute barrier function. Redox Biol. 2016;(9):157–166. Doi: 10.1016/j.redox.2016.08.004.
39. Yuan S, Yurdagul AJr, Peretik JM, Alfaidi M, Al Yafeai Z, Pardue S, Kevil CG, Orr AW. Cystathionine γ-lyase modulates flow-dependent vascular remodeling. Arterioscler Thromb Vasc Biol. 2018;(38):2126–2136. Doi: 10.1161/ATVBAHA.118.311402.
40. Bibli SI, Hu J, Sigala F, Wittig I, Heidler J, Zukunft S, Tsilimigras DI, Randriamboavonjy V, Wittig J, Kojonazarov B, Schürmann C, Siragusa M, Siuda D, Luck B, Abdel Malik R, Filis KA, Zografos G, Chen C, Wen Wang D, Pfeilschifter J, Brandes RP, Szabo C, Papapetropoulos A, Fleming I. Cystathionine γ lyase sulfhydrates the RNA binding protein human antigen R to preserve endothelial cell function and delay atherogenesis. Circulation. 2019;(139):101–114. Doi: 10.1161/CIRCULATIONAHA.118.034757.
Cystathionine γ lyase sulfhydrates the RNA binding protein human antigen R to preserve endothelial cell function and delay atherogenesis. Circulation. 2019;(139):101–114. Doi: 10.1161/CIRCULATIONAHA.118.034757.
41. Bearden SE, Beard RS, Jr, Pfau JC. Extracellular transsulfuration generates hydrogen sulfide from homocysteine and protects endothelium from redox stress. Am J Physiol Heart Circ Physiol. 2010;299(5):h2568–h2576. Doi: 10.1152/ajpheart.00555.2010.
42. Zagli G, Patacchini R, Trevisani M, Abbate R, Cinotti S, Gensini GF, Masotti G, Geppetti P. Hydrogen sulfide inhibits human platelet aggregation. Eur J Pharmacol. 2007; 559(1):65–68. Doi: 10.1016/j.ejphar.2006.12.011.
43. Truss NJ, Warner TD. Gasotransmitters and platelets. Pharmacology & Therapeutics. 2011;(132)2;196-203. Doi: 10.1016/j.pharmthera.2011.07.001.
44. Olas B. Hydrogen sulfide in hemostasis: friend or foe? Chem Biol Interact. 2014;25(217):49–56. Doi: 10.1016/j.cbi.2014.04.006.
45. Morel A, Malinowska J, Olas B. Hydrogen sulfide changes adhesive properties of fibrinogen and collagen in vitro. Platelets. 2014;25(2):147–149. Doi: 10.3109/09537104.2012.737490.
Hydrogen sulfide changes adhesive properties of fibrinogen and collagen in vitro. Platelets. 2014;25(2):147–149. Doi: 10.3109/09537104.2012.737490.
46. Essex DW. The role of thiols and disulfides in platelet function. Antioxid Redox Signal. 2004;6(4):736–746. Doi: 10.1089/1523086041361622.
47. Grambow E, Mueller-Graf F, Delyagina E, Frank M, Kuhla A, Vollmar B. Effect of the hydrogen sulfide donor GYY4137 on platelet activation and microvascular thrombus formation in mice. Platelets. 2014;25(3):166–174. Doi: 10.3109/09537104.2013.786823.
48. Grambow E, Leppin C, Leppin K, Kundt G, Klar E, Frank M, Vollmar B. The effects of hydrogen sulfide on plateletleukocyte aggregation and microvascular thrombolysis. Platelets. 2017;28(5):509–517. Doi: 10.1080/09537104.2016.1235693.
49. Leigh J, Saha MN, Mok A, Champsi O, Wang R, Lobb I, Sener A. Hydrogen Sulfide Induced Erythropoietin Synthesis is Regulated by HIF Proteins. J Urol. 2016;196(1):251–260. Doi: 10.1016/j.juro.2016.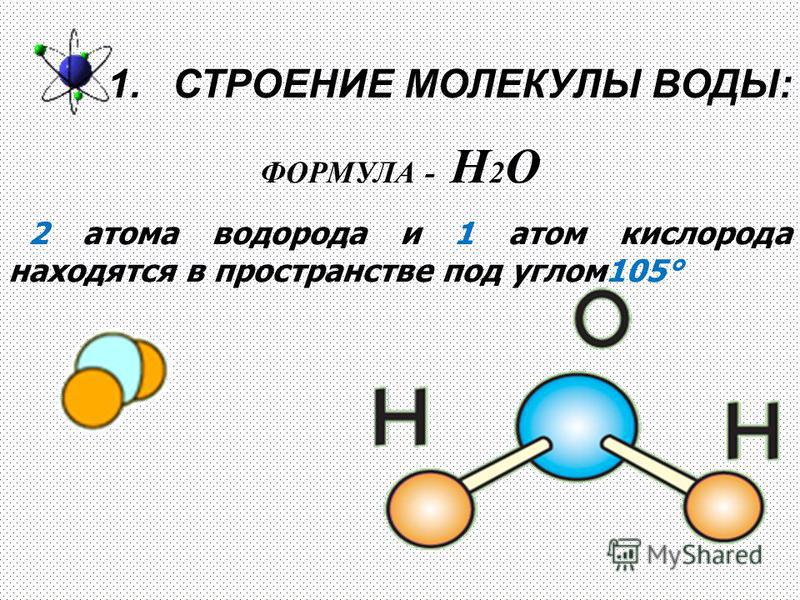 01.113.
01.113.
50. Morrison ML, Blackwood JE, Lockett SL, Iwata A, Winn RK, Roth MB. Surviving blood loss using hydrogen sulfide. J Trauma. 2008;(65):183–188. Doi: 10.1097/TA.0b013e3181507579.
51. Mok YYP, Shirhan M, Cheong YP, Wang ZJ, Bhatia M, Moochhala S, Moore PK. Role of hydrogen sulfide in haemorrhagic shock in the rat: protective effect of inhibitors of hydrogen sulfide biosynthesis. Br J Pharmacol. 2004;(143):881– 889. Doi: 10.1038/sj.bjp.0706014.
52. Baskurt OK, Ulker P, Meiselman HJ. Nitric oxide, erythrocytes and exercise. Clin Hemorheol Microcirc. 2011; 49(1–4):175–81. Doi: 10.3233/CH-2011-1467.
53. Grau M, Pauly S, Ali J, Walpurgis K, Thevis M, Bloch W, Suhr F. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 2013;8(2):e56759. Doi: 10.1371/journal.pone.0056759.
54. Muravyov AV, Tikhomirova IA, Avdonin PV, Bulaeva SV, Malysheva YV, Kislov NV. Cellular models of erythrocytes for studying the effect of gasotransmitters on their microrheology. Journal of Cellular Biotechnology. 2019;(5):3–10. Doi: 10.3233/JCB-189009.
Journal of Cellular Biotechnology. 2019;(5):3–10. Doi: 10.3233/JCB-189009.
55. Муравьев А. В., Авдонин П. В., Тихомирова И. А. и др. Влияние газотрансмиттеров на мембранную эластичность и микрореологию эритроцитов // Биологические мембраны. – 2019. – Т. 36, № 4. – С. 281–289. Doi: 10.1134/S0233475519040091.
56. Muravyov AV, Antonova N, Tikhomirova IA. Red blood cell micromechanical responses to hydrogen sulfide and nitric oxide donors: Analysis of crosstalk of two gasotransmitters (h3S and NO). Series on Biomechanics. 2019;33(2):34–40.
57. Тихомирова И. А., Кислов Н. В., Малышева Ю. В. и др. Влияние газотрансмиттера сероводорода на микрореологические свойства эритроцитов здоровых лиц и больных сахарным диабетом второго типа // Тромбоз, гемостаз и реология. – 2020. – № 1 (81). – С. 21–26. Doi: 10.25555/THR.2020.
58. Vandiver MS, Snyder SH. Hydrogen Sulfide: A gasotransmitter of clinical relevance. J Mol Med (Berl). 2012; 90(3):255–263. Doi: 10.1007/s00109-012-0873-4.
59. Kolluru GK, Shen X, Kevil CG. Reactive Sulfur Species: A New Redox Player in Cardiovascular Pathophysiology. Arterioscler Thromb Vasc Biol. 2020;40(4):874–884. Doi: 10.1161/ATVBAHA.120.314084.
60. King AL, Polhemus DJ, Bhushan S, Otsuka H, Kondo K, Nicholson CK, Bradley JM, Islam KN, Calvert JW, Tao YX, Dugas TR, Kelley EE, Elrod JW, Huang PL, Wang R, Lefer DJ. Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent. Proc Natl Acad Sci USA. 2014;(111):3182–3187. Doi: 10.1073/pnas.1321871111.
61. Calvert JW, Elston M, Nicholson CK, Gundewar S, Jha S, Elrod JW, Ramachandran A, Lefer DJ. Genetic and pharmacologic hydrogen sulfide therapy attenuates ischemiainduced heart failure in mice. Circulation. 2010;(122):11–19. Doi: 10.1161/CIRCULATIONAHA.109.920991.
62. Ситдикова Г. Ф., Зефиров А. Л. Газообразные посредники в нервной системе // Рос. физиолог. журн. им. И. М. Сеченова. – 2006. – Т. 97, № 7.– С. 872–882.
63. Huang B, Chen CT, Chen CS, Wang YM, Hsieh HJ, Wang DL. Laminar shear flow increases hydrogen sulfide and activates a nitric oxide producing signaling cascade in endothelial cells. Biochem Biophys Res Commun. 2015;(464):1254– 1259. Doi: 10.1016/j.bbrc.2015.07.115.
Huang B, Chen CT, Chen CS, Wang YM, Hsieh HJ, Wang DL. Laminar shear flow increases hydrogen sulfide and activates a nitric oxide producing signaling cascade in endothelial cells. Biochem Biophys Res Commun. 2015;(464):1254– 1259. Doi: 10.1016/j.bbrc.2015.07.115.
64. Bucci M, Papapetropoulos A, Vellecco V, Zhou Z, Pyriochou A, Roussos C, Roviezzo F, Brancaleone V, Cirino G. Hydrogen sulfide is an endogenous inhibitor of phosphodiesterase activity. Arterioscler Thromb Vasc Biol. 2010;30(10):1998– 2004. Doi: 10.1161/ATVBAHA.110.209783.
65. Whiteman M, Moore PK. Hydrogen sulfide and the vasculature: a novel vasculoprotective entity and regulator of nitric oxide bioavailability? J Cell Mol Med. 2009;13(3):488– 507. Doi: 10.1111/j.1582-4934.2009.00645.x.
66. Kimura H. Signaling Molecules: Hydrogen Sulfide and Polysulfide. Antioxidants & Redox signaling. 2015;22(5). Doi: 10.1089/ars.2014.5869.
67. Yamamoto T, Takano N, Ishiwata K, Suematsu M. Carbon monoxide stimulates global protein methylation via its inhibitory action on cystathionine beta-synthase. J Clin Biochem Nutr. 2011;48(1):96–100. Doi: 10.3164/jcbn.11-011FR.
J Clin Biochem Nutr. 2011;48(1):96–100. Doi: 10.3164/jcbn.11-011FR.
молекул водорода
молекула водородаКлассический случай ковалентной связи, молекула водорода образуется за счет перекрытия волновых функций электронов соответствующих атомов водорода при взаимодействии, которое характеризуется как обменное взаимодействие. Характер этой связи совершенно отличен от ионной связи, образующейся с хлоридом натрия NaCl. Если вы измерите энергетический баланс при образовании ионов Н+ и Н- и исследуете силу притяжения между ними, то требуемая энергия положительна для любого значения разделения ионов. То есть нет расстояния, на котором происходит чистое взаимодействие притяжения, поэтому связь не может быть ионной. Распределение электронов вокруг протонов водорода описывается квантово-механической волновой функцией, а волновая функция, описывающая два электрона для пары атомов, может быть симметричной или антисимметричной по отношению к обмену одинаковыми электронами. Как показано ниже, когда атомы водорода сближены, симметричная пространственная волновая функция приводит к конфигурации связи электронов, а антисимметричная — нет. Фактическая плотность электронного заряда определяется квадратом величины волновой функции, и можно видеть, что симметричная волновая функция дает высокую плотность электронов между ядрами, что приводит к чистой силе притяжения между атомами (связь).
| Индекс Типлер Элемент. Современная физика, гл. 5 | |||
| Вернуться |
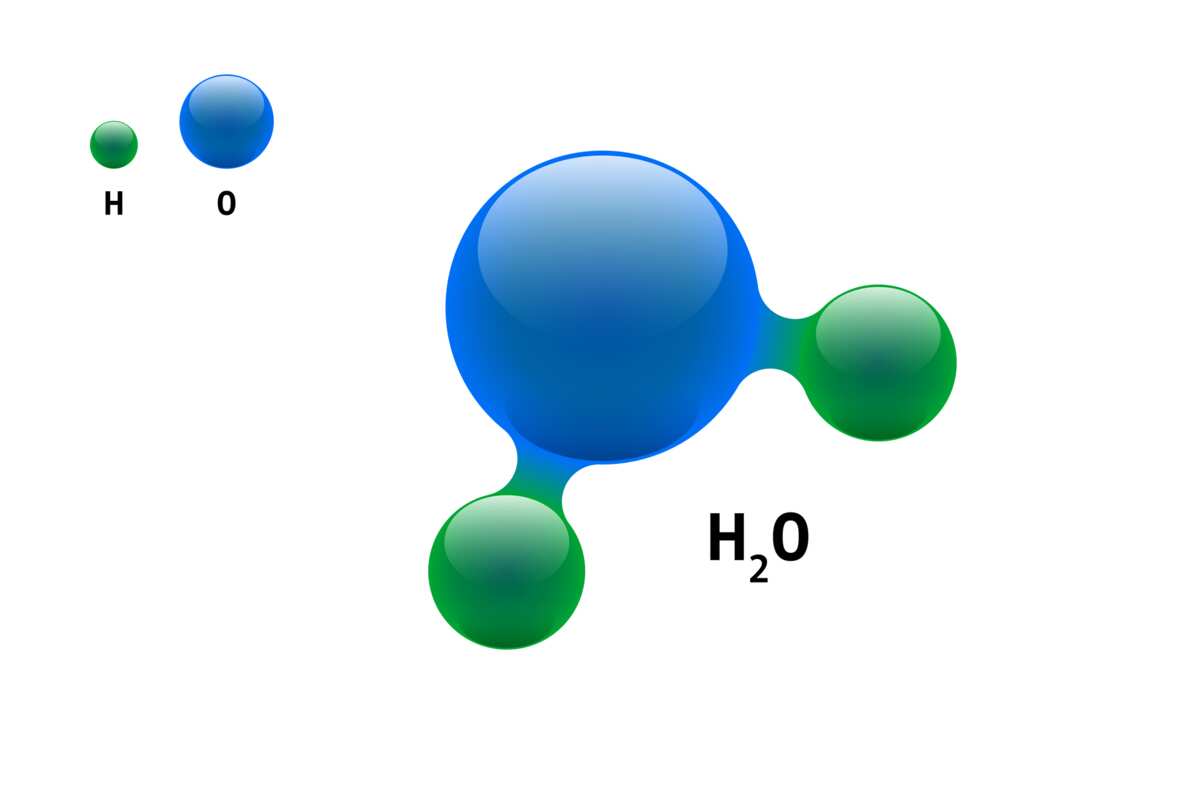
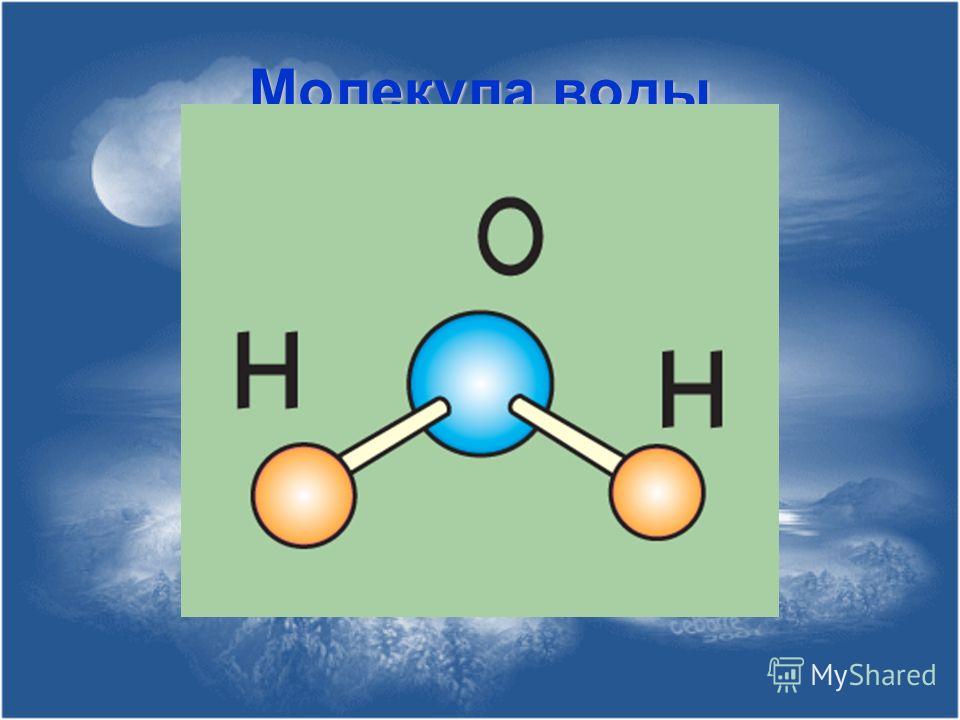
Знакомство с молекулой водорода — водород
Знакомство с молекулой водорода
- водород
- 4 марта 2019 г.

- API / Новости
2018 год был захватывающим, о чем свидетельствуют наши обзоры года.
Мы были одними из первых разработчиков протоколов с открытым исходным кодом Hydro в 2018 году и наблюдали, как сообщество росло… и росло… и РАСТЕТ еще больше!
Project Hydro создала собственную организацию и управление, GitHub, учетные записи в социальных сетях и избрала собственных руководителей по всему миру. Они даже создали свою собственную торговую площадку dApp, где будут жить захватывающие dApps, обеспечивающие безопасность и идентификацию.
Поскольку Hydrogen является лишь одним из многих разработчиков, помимо Hydro, мы посчитали, что ярлык «Hydro API» больше не подходит для нашего каталога продукции. Что может быть лучше для дополнения водорода , атома , чем водород , молекула , которая в химии представляет собой группу атомов, связанных вместе!
Звучит знакомо? Он выглядит и ощущается очень похожим на блокчейн —
Образец структуры молекулыОсобенности молекулы
Добавляйте финансовые компоненты блокчейна в любое приложение.
Этот слоган является ключевым для запоминания. Наша библиотека Hydrogen Atom позволяет любой фирме по всему миру создавать сложные финансовые приложения, а Hydrogen Molecule добавит компоненты блокчейна, чтобы сделать эти приложения еще сильнее! Hydrogen | MoleculeПлатформа Hydrogen Molecule API включает в себя модули для добавления финансовых компонентов блокчейна в любое приложение по всему миру. Они будут представлены в виде виджетов, приложений с белой этикеткой или пользовательских приложений, которые клиенты могут создавать поверх Molecule совместно с Atom и Element.
Интеграции
Библиотека интеграции Hydrogen будет общей как для Hydrogen Atom, так и для Hydrogen Molecule. Это позволит нашим замечательным разработчикам продуктов соединять сервисы, платформы и API на базе блокчейна и неблокчейн вместе с общей аутентификацией и учетными данными. Это новаторский способ слияния двух технологий, который еще не реализован.
С помощью Molecule многие интеграции позволят создать платформу, которая будет использовать лучшее из лучших, которые разрабатываются во многих аспектах технологии:
- Payments
- Remittance
- Privacy
- Identity
- Trading
- Security Tokens
- Infrastructure
- iOT
- Hardware
- Logistics
The Hydrogen team had dozens of meetings in 2018 to lay the groundwork for many этих интеграций.




 В. Ломоносова, Химический факультет
В. Ломоносова, Химический факультет