Закон Фарадея для электролиза – формула и примеры
4.3Средняя оценка: 4.3
Всего получено оценок: 184.
4.3
Средняя оценка: 4.3
Всего получено оценок: 184.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Рис. 1. Майкл Фарадей.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.

Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Рис. 2. Первый закон Фарадея.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.
Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.
Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).

Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Рис. 3. Второй закон Фарадея.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Приложения постоянной Фарадея
Если вам интересно, что практическое применение У вас может быть эта постоянная Фарадея, правда в том, что у вас их довольно много, вот некоторые примеры:
- Гальваника / анодирование: для процессов в металлургической промышленности, где один металл покрывается другим путем электролиза. Например, когда сталь оцинкована слоем цинка, чтобы придать ей большую устойчивость к коррозии. В этих процессах покрываемый металл используется в качестве анода, а электролит представляет собой растворимую соль анодного материала.

- Очистка металлов: он также может применяться к формулам, используемым для очистки металлов, таких как медь, цинк, олово и т. д. Также с помощью процедур электролиза.
- Химическое производство: для образования химических соединений также обычно используется эта константа.
- Химический анализ: с помощью электролиза также может быть определен химический состав.
- Добыча газа: газы, такие как кислород или водород, полученные из воды путем электролиза, также используют эту константу для расчетов.
- Медицина и эстетикаЭлектролиз также можно использовать для стимуляции определенных нервов или лечения определенных проблем в дополнение к удалению нежелательных волос. Без константы невозможно было бы разработать множество инструментов этого типа.
- Печать: В принтерах для некоторых элементов также используются процессы электролиза.
- Электролитические конденсаторы: хорошо известный электронный компонент, состоящий из тонкой пленки оксида алюминия и алюминиевого анода между электродами.
 Электролит представляет собой смесь борной кислоты, глицерина и гидроксида аммония. И вот как достигаются эти великие способности …
Электролит представляет собой смесь борной кислоты, глицерина и гидроксида аммония. И вот как достигаются эти великие способности …
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Кулонометры. Классификация кулонометров.
Наиболее точное определение количества электричества, проходящего через электрохимическую систему можно получить с помощью серебряного кулонометра. В этом случае точность определения составляет 0,005% .
В серебряном кулонометре определяется масса серебра, выделяющаяся из водного раствора нитрата серебра. Платиновая чаша служит Имеются системы, в которых весь ток расходуется только на одну электрохимическую реакцию. Такие электрохимические системы используются для измерения количества электричества и называются кулонометрами.
Платиновая чаша служит Имеются системы, в которых весь ток расходуется только на одну электрохимическую реакцию. Такие электрохимические системы используются для измерения количества электричества и называются кулонометрами.
Известны три основных типа кулонометров: весовые (гравиметрические), объемные (волюметрические) и титрационные.
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Медный кулонометр наиболее распространен в практике лабораторных исследований, т.к. он является простым в изготовлении и достаточно точным. Точность определения количества электричества составляет 0,1 %. Кулонометр состоит из двух медных анодов и катода из тонкой медной фольги, расположенного между ними. Электролитом в медном кулонометре служит водный раствор состава: CuSO4 ∙ 5h3O, h3SO4 и этанол C2H5OH.Серная кислота повышает электрическую проводимость электролита и, кроме того, препятствует образованию основных соединений меди в прикатодном пространстве, которые могут адсорбироваться на катоде, увеличивая тем самым его массу. h3SO4в электролите медного кулонометра необходима для предотвращения накопления соединений Cu1+, которые могут образовываться в результате реакции диспропорционирования:
Кулонометр состоит из двух медных анодов и катода из тонкой медной фольги, расположенного между ними. Электролитом в медном кулонометре служит водный раствор состава: CuSO4 ∙ 5h3O, h3SO4 и этанол C2H5OH.Серная кислота повышает электрическую проводимость электролита и, кроме того, препятствует образованию основных соединений меди в прикатодном пространстве, которые могут адсорбироваться на катоде, увеличивая тем самым его массу. h3SO4в электролите медного кулонометра необходима для предотвращения накопления соединений Cu1+, которые могут образовываться в результате реакции диспропорционирования:
Cu0+ Cu2+ → 2Cu+
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза. Катодом, а анод готовится из чистого серебра.
В качестве электролита в серебряном кулонометре используется нейтральный или слабокислый 30% раствор нитрата серебра.
Газовый водородно-кислородный кулонометр применяется для приближенных измерений малых количеств электричества. В нем измеряют общий объем водорода и кислорода, выделяющихся при электролизе водного раствора h3SO4или NaOH, а из этой величины вычисляют количество прошедшего электричества. Применяют эти кулонометры сравнительно редко, т.к. точность их небольшая, а в работе они менее удобны, чем весовые кулонометры.
К объемным кулонометрам относится также ртутный кулонометр. Он применяется главным образом в промышленности для измерений количества электричества. Точность ртутного кулонометра составляет 1%, но он может работать при больших плотностях тока. Анодом служит ртуть. Уголь – катод. Электролитом служит раствор иодида ртути и иодида калия. По уровню ртути в трубке рассчитывают количество электричества.
Наиболее распространенные из титрационных кулонометров – йодный и кулонометр Кистяковского.
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиново-иридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
Кулонометр Кистяковского — это стеклянный сосуд. Анодом служит серебряная проволока, впаянная в стеклянную трубку со ртутью, для обеспечения контакта. Сосуд заполняют раствором нитрата калия (15-20%). В этот раствор погружают платиново-иридиевый катод. При пропускании тока происходит анодное растворение серебра. И также по результатам титрования раствора рассчитывают количество электричества.
Правило Ленца
Чтобы определить направление индукционного тока, нужно воспользоваться правилом Ленца.
Академически это правило звучит следующим образом: индукционный ток, возбуждаемый в замкнутом контуре при изменении магнитного потока, всегда направлен так, что создаваемое им магнитное поле препятствует изменению магнитного потока, вызывающего индукционный ток.
Давайте попробуем чуть проще: катушка в данном случае — это недовольная бабуля. Забирают у нее магнитный поток — она недовольна и создает магнитное поле, которое этот магнитный поток хочет обратно отобрать.
Дают ей магнитный поток, забирай, мол, пользуйся, а она такая — «Да зачем сдался мне ваш магнитный поток!» и создает магнитное поле, которое этот магнитный поток выгоняет.
Джеймс Клерк Максвелл математически описал основные законы электричества и магнетизма
Джеймс Клерк Максвелл
Математическая формулировка электромагнитной индукции была разработана немецким физиком и математиком Францем Эрнстом Нейманом (1798-1895) в 1945 году. Эти открытия проложили путь к фундаментальной теоретической композиции, выполненной Джеймсом Клерком Максвеллом (1831-1879), начиная с “силовых линий Фарадея”. Однако работа Максвелла изначально вызывала недоверие у большинства физиков и игнорировалась инженерами.
Только к концу XIX века, после памятного эксперимента с электромагнитными волнами, проведенного Генрихом Герцем в 1887 году, теория Максвелла стала общепринятой и позволила обратиться как к физике, так и к технике.
Закон Фарадея для электролиза: формулы
Электрический ток, проходящий через растворы электролитов, способствует разложению веществ и дает возможность получать химически чистые материалы. Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного. С помощью него осуществляется очистка металлов от примесей и выполняется нанесение тонких покрытий, защищающих металлические поверхности.
Содержание
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.
Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.
Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.
Таким образом, на катоде и аноде происходит накопление так называемых суммарных продуктов, состоящих из электрически нейтральных веществ. Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Существует определенная связь между количеством электричества, протекавшего через раствор, и количеством вещества, выделенного в период электролитической реакции. Данное явление было описано английским физиком Фарадеем и оформлено в виде двух законов.
Первый закон Фарадея
Данный закон был выведен ученым экспериментальным путем. Он определяет пропорциональную зависимость между массой вещества, образующегося на электроде и зарядом, проходящим через электролитический раствор.
Эту пропорцию наглядно отображает формула m=k х Q=k х I х t, где k является коэффициентом пропорциональности или электрохимическим эквивалентом, Q – заряд, прошедший через электролит, t – время прохождения заряда, m – масса вещества, образовавшегося на электроде в результате реакции.
Первый закон Фарадея служит для определения количества первичных продуктов, образовавшихся в процессе электролиза на электродах. Масса этого вещества составляет суммарную массу всех ионов, попавших на электрод. Это подтверждается формулой m=m0 х N = m0 х Qq0 = m0q0 х I х t, в которой m0 и q0 соответственно являются массой и зарядом единичного иона. N=Qq0 – определяет количество ионов, попавших на электрод за время прохождения заряда Q через раствор электролита.
Следовательно, величина электрохимического эквивалента k представляет собой соотношение массы иона m0 используемого вещества и заряда q0 этого иона. Известно, что величина заряда иона составляет произведение валентности n этого вещества и элементарного заряда е, то есть, q0 = n х e. Исходя из этого, электрохимический эквивалент k будет выглядеть следующим образом: k = m0q0 = m0 х NAn х e х NA = 1F х μn. В этой формуле NA является постоянной Авогадро, μ – молярной массой данного вещества. F = e х NA является постоянной Фарадея и составляет 96485 Кл/моль.
Числовое значение данной величины равняется заряду, который должен быть пропущен через раствор электролита, для того чтобы на электроде выделился 1 моль вещества с одинаковой валентностью. Рассматриваемый закон Фарадея для электролиза примет вид еще одной формулы: m = 1F х μn х I х t.
Второй закон Фарадея
Следующий закон ученого Фарадея описывает, как электрохимический эквивалент будет зависеть от атомной массы вещества и его валентности. У этого коэффициента будет прямая пропорциональная зависимость с атомным весом и обратно пропорциональная – с валентностью вещества. С введением данной величины, второй закон Фарадея формулируется как пропорция электрохимических эквивалентов вещества и собственных химических эквивалентов этих веществ.
У этого коэффициента будет прямая пропорциональная зависимость с атомным весом и обратно пропорциональная – с валентностью вещества. С введением данной величины, второй закон Фарадея формулируется как пропорция электрохимических эквивалентов вещества и собственных химических эквивалентов этих веществ.
Если значения электрохимических эквивалентов взять за k1, k2, k3…kn, а химические эквиваленты принять за х1, х2, х3…xn, то k1/x1 = k2/x2 = k3/x3…kn/xn. Данное соотношение является постоянной величиной, одинаковой для любых используемых веществ: с = k/x и составляет 0,01036 мг-экв/к. Именно такое количество вещества в миллиграмм-эквивалентах выделяется на электродах за период прохождения в электролите электрического заряда, равного одному кулону.
Следовательно, второй закон Фарадея можно представить в виде формулы: k = cx. Если данной выражение использовать вместе с первым законом Фарадея, то в результате получится следующее выражение: m = kq = cxq = cxlt. Здесь категория с представляет собой универсальную постоянную, в размере 0,00001036 г-экв/к.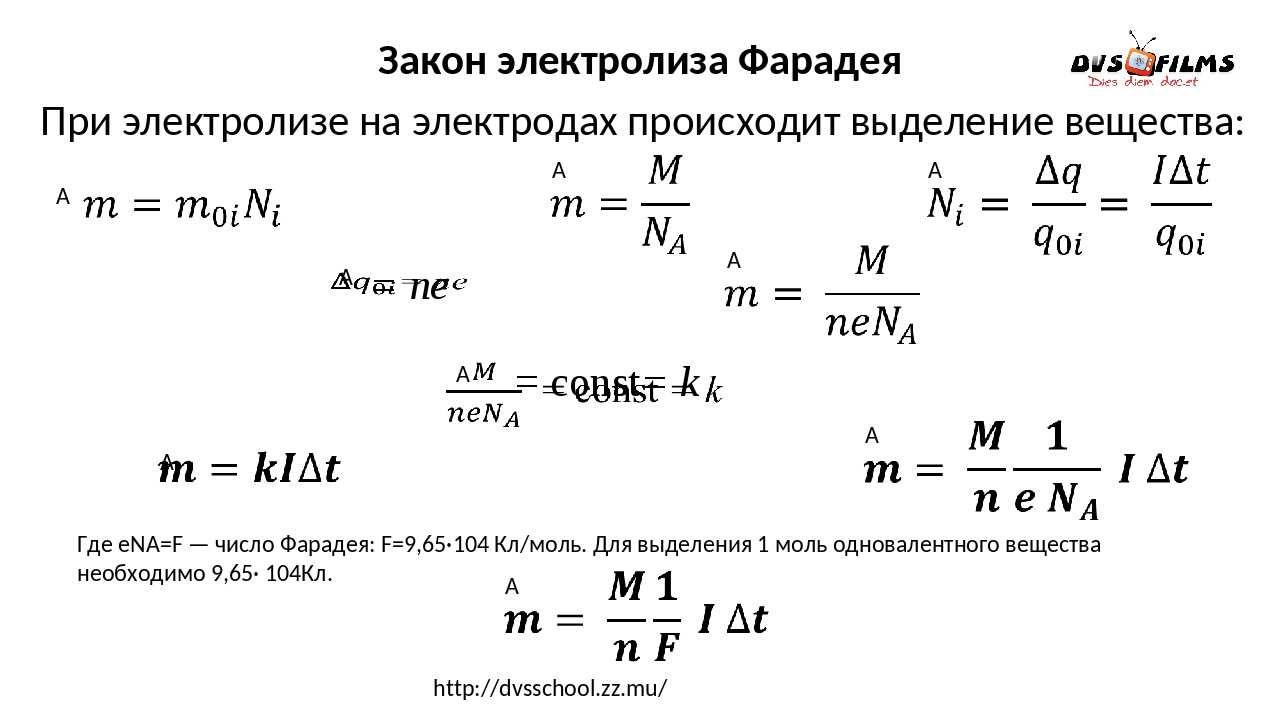 Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента.
Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента.
Поскольку x = A/n, то масса выделяемого вещества будет выглядеть как m = cA/nlt, с соблюдением прямой пропорции с атомным весом и обратной пропорции с валентностью.
Что такое постоянная Фарадея? (Определение, формула)
Мы используем постоянную Фарадея для расчета количества электрического заряда, проходящего через цепь в единицу времени. Постоянная Фарадея равна электрическому заряду на моль элементарных зарядов (например, электронов). Один моль определяется как количество атомов или молекул ровно в 12 граммах чистого углерода-12. Это число называется числом Авогадро (
Это число называется числом Авогадро ( N A ) и примерно равно 6,022 x 10 23 9.0009 атомов или молекул.
Что такое постоянная Фарадея в математических терминах?
F = N A *e
Где:
-
F= постоянная Фарадея -
N A 9 0005= постоянная Авогадро (приблизительно6,022 x 10 23электронов на моль) -
e= заряд одного электрона (приблизительно1,602 x 10 -19кулонов)
Итак, определим постоянную Фарадея как заряд одного моля электронов, который равен числу Авогадро ( N A ) электронов.
Еще от Артема ОпперманнаЧто такое глубокое обучение и как оно работает?
Как работает постоянная Фарадея?
Чтобы понять, как работает постоянная Фарадея, давайте посмотрим, как работает электролитическая ячейка.
Типичная электролитическая ячейка состоит из двух электродов, погруженных в раствор электролита. Когда мы подаем электрический ток на электроды, один электрод действует как анод, а другой электрод действует как катод. На аноде происходит окисление, и анод теряет электроны. На катоде происходит восстановление и к катоду присоединяются электроны. Электроны, потерянные на аноде, текут через внешнюю цепь к катоду, где они присоединяются. Этот процесс изображен на рисунке ниже.
Изображение типичного электролизера, состоящего из двух электродов, погруженных в раствор электролита. На аноде электроны теряются из-за окисления. На катоде электроны приобретаются за счет восстановления, при этом электроны перетекают от анода к катоду по внешней цепи. | Изображение: Артем ОпперманнКоличество электрического заряда, прошедшего через клетку, связано с количеством вещества, которое окисляется или восстанавливается на электродах.
Постоянная Фарадея определяет количество электрического заряда, прошедшего через клетку ( Q ) к количеству вещества, участвующего в реакции ( n ) по уравнению:
Q = нФ
Здесь Q — электрический заряд, прошедший через ячейку, n 900 06 это количество вещества, участвующего в реакции, а F – постоянная Фарадея.
Значение постоянной Фарадея установлено на уровне 96 485,3399 кулонов на моль электронов, что означает, что один моль электронов эквивалентен 96 485.3399 Кулоны электрического заряда.
Мы можем использовать это уравнение для расчета количества вещества, участвующего в реакции, путем измерения электрического заряда, прошедшего через клетку, и умножения его на обратную величину постоянной Фарадея.
Почему важна постоянная Фарадея?
Постоянная Фарадея — это фундаментальная константа в науке, которую мы используем для понимания и количественной оценки количества электрического заряда, связанного со многими химическими и физическими явлениями.
Произошла ошибка.
Невозможно выполнить JavaScript. Попробуйте посмотреть это видео на сайте www.youtube.com или включите JavaScript, если он отключен в вашем браузере.
Закон Фарадея Введение. | Видео: Академия Хана
Применение постоянной Фарадея
Мы используем постоянную Фарадея в различных областях, от электрохимии до термодинамики, аккумуляторной технологии, аналитической химии и многих других. Вот некоторые варианты использования:
Вот некоторые варианты использования:
Электрохимия
Мы используем постоянную Фарадея в электрохимии для расчета количества электрического заряда, участвующего в химической реакции, а также для расчета электрохимического эквивалента вещества. Мы используем эту константу, чтобы определить взаимосвязь между количеством электрического заряда, прошедшего через электролитическую ячейку, и количеством материала, осажденного или растворенного на электродах.
Электрохимические элементы
Мы используем постоянную Фарадея при теоретическом изучении электрохимических элементов для расчета разности потенциалов между электродами и количества материала, участвующего в окислительно-восстановительных реакциях.
Термодинамика
В термодинамике мы используем постоянную Фарадея для расчета свободной энергии Гиббса электрохимических реакций, что важно для понимания термодинамики электрохимических систем.
Аккумуляторная технология
Постоянная Фарадея важна для определения емкости батареи. Мы используем константу при расчете количества заряда, необходимого для производства одного моля вещества, что имеет решающее значение для определения количества энергии, хранящейся в батарее.
Мы используем константу при расчете количества заряда, необходимого для производства одного моля вещества, что имеет решающее значение для определения количества энергии, хранящейся в батарее.
Аналитическая химия
В аналитической химии мы используем постоянную Фарадея во многих различных методах, таких как вольтамперометрия, для расчета количества вещества, участвующего в электрохимической реакции. Затем мы можем использовать этот расчет для обнаружения и количественной оценки концентрации различных видов в растворах.
Постоянная Фарадея – определение и формула
Постоянная Фарадея чаще всего используется в физической химии. Постоянная Фарадея, которую чаще всего обозначают символом F, указывает заряд, переносимый одним молем электронов. Вы можете думать об этом как о факторе сохранения между молем и кулонов. По этой причине он используется в электрохимии.
Наиболее часто эта постоянная Фарадея используется в электролизе. В электролизе вы можете просто разделить один кулон заряда на постоянную Фарадея, и вы найдете химическое количество вещества, подвергшегося электролизу в процессе электролиза. Если объяснить закон Фарадея простым языком, то он гласит, что в электрохимической реакции живости (которую мы рассматриваем) масса вещества, которое осаждается или высвобождается на поверхности электродов, прямо пропорциональна заряду или количеству электричества ( измеряется в кулонах), которая проходит через него.
В электролизе вы можете просто разделить один кулон заряда на постоянную Фарадея, и вы найдете химическое количество вещества, подвергшегося электролизу в процессе электролиза. Если объяснить закон Фарадея простым языком, то он гласит, что в электрохимической реакции живости (которую мы рассматриваем) масса вещества, которое осаждается или высвобождается на поверхности электродов, прямо пропорциональна заряду или количеству электричества ( измеряется в кулонах), которая проходит через него.
Обсуждая Единицу Фарадея, то это единица электрического заряда. В то время как колонна используется в основном, этот заряд менее распространен и используется меньше по сравнению с зарядом кулона. Один заряд Фарадея – это заряд, который создается одним молем электронов. Фарадей в основном используется в электрохимии вместо кулоновского заряда
В этой статье вы получите краткую информацию о постоянной Фарадея и ряд тем, которые она включает, то есть связь между законом Фарадея и кулонами, постоянной Фарадея и Разница в единицах измерения Фарадея, взаимосвязь между постоянной закона Фарадея и законом электролиза Фарадея, уравнения константы Фарадея и граничных условий. В конце этой статьи вам предоставляется специально разработанный список часто задаваемых вопросов, который поможет вам хорошо разобраться в теме. сомнения, связанные с этой темой, будут у вас сняты, вместе с этим вы сможете прояснить большинство вопросов, с которыми вы можете столкнуться при чтении этой статьи о постоянной Фарадея.
В конце этой статьи вам предоставляется специально разработанный список часто задаваемых вопросов, который поможет вам хорошо разобраться в теме. сомнения, связанные с этой темой, будут у вас сняты, вместе с этим вы сможете прояснить большинство вопросов, с которыми вы можете столкнуться при чтении этой статьи о постоянной Фарадея.
Постоянное число Фарадея
Постоянное число Фарадея можно определить как количество электрического заряда, переносимого одним молем, или согласно числу Авогадро. Его актуальность можно найти в различных предметах, таких как химия, физика и электроника. Как правило, постоянная Фарадея представлена курсивом в верхнем регистре F и имеет единицу измерения - кулоны на моль (смоль⁻¹).
Это значение, созданное в честь ученого XIX века Майкла Фарадея, может быть использовано для получения дополнительных сведений об электрохимических реакциях. Значение постоянной Фарадея, как выяснилось, составляет:90,6485333289 × 10⁴ Смоль⁻¹ или 6,022140857 × 10²³ электронов.
Взаимосвязь между кулонами и постоянной Фарадея
Чтобы понять и определить постоянную Фарадея, вы должны сначала понять кулоны. Кулоны обычно признаются мерой количества электричества, т. е. часто представляются в виде ампер и секунд.
1 Кулон = Ток (в амперах) × Время (в секундах)
Примером того же может быть, если система имеет ток 5 ампер в час, общее количество кулонов будет = 5 × 3600 (поскольку в часе 60 минут, а в каждой минуте 60 секунд) = 18000 кулонов.
Электричество – это коллективное движение электронов, движущихся как проточная система. Поскольку каждый электрон несет заряд 1,602176634 × 10⁻¹⁹ кулонов, 1 моль электронов будет составлять заряд, равный значению числа Авогадро:
F = eNA (где F = постоянная Фарадея, NA = число Авогадро, e = заряд одного электрона)
F = 6,02214076 x 10²³ × 1,602176634 × 10⁻¹⁹ кулон
F = 96485,3321233100184 Смоль⁻¹.
Существует много других единиц, в которых может быть выражена постоянная Фарадея. Это:
In 96485 Джоулей на вольт-грамм
23,061 ккал на вольт-грамм
26,801 А.ч/моль.
Постоянная Фарадея и единица Фарадея
Фарадей представляет собой единицу электрического заряда, которая равна величине заряда каждого моля электронов. Следовательно, постоянная Фарадея может быть эквивалентна всего одному Фарадею, который обозначается строчной буквой f.
Обратите внимание, что постоянную Фарадея не следует путать с фарадом, который представлен как 1 фарад = 1 кулон на каждый вольт. Это служит единицей измерения емкости, которая также была названа в честь английского физика Майкла Фарадея.
Связь между постоянной Фарадея и законами электролиза Фарадея
В 1833 году, прежде чем выяснить значение числа Авогадро, Майкл Фарадей обнаружил, что в процессе электролиза количество заряда F (постоянная Фарадея), которое требуется для осаждения одного моль ионов одинаковой валентности на электроде, будь то анионы на аноде или катионы на катоде; он всегда остается постоянным, несмотря на типы используемых ионов. Таким образом, именно из-за постоянной Фарадея количество серебра, которое должно быть использовано при электролизе катиона Ag+ (то есть для осаждения на электроде), было определено с помощью этого метода.
Таким образом, именно из-за постоянной Фарадея количество серебра, которое должно быть использовано при электролизе катиона Ag+ (то есть для осаждения на электроде), было определено с помощью этого метода.
Так как первый закон Фарадея гласит, что для электрохимической реакции вещество, имеющее массу (m) осаждается или высвобождается на электроде, прямо пропорционально количеству прошедшего через него заряда. Следовательно, математическое уравнение процесса может быть выражено как:
m = Z . Вопрос;
где Q = заряд в кулонах,
Z = пропорциональность, выраженная в гС⁻¹.
Следовательно, число пропорциональности также можно назвать электрохимическим эквивалентом (Е) и определить как массу, потребляемую электродами на единицу заряда. Таким образом, Z можно представить в виде:
Z = \[\frac{E}{96,845}\]
Поскольку мы это уже знаем,
Q = I.t (где I – сила тока в амперах, t – время в секундах)
Следовательно, замена в приведенном выше уравнении получается:
m = \[\frac{E. I.t}{F} =\frac{M.I.t}{F.z}\]
I.t}{F} =\frac{M.I.t}{F.z}\]
, где M - молярная масса вещества в г моль⁻¹, I — сила тока в амперах, t — время в секундах, F — постоянная Фарадея, z — количество одновалентных ионов на вещество.
Постоянная Фарадея и уравнения граничных условий
Несколько уравнений могут помочь понять поток ионов типа с помощью уравнения Нернста-Планка:
j\[_{t}\] = -D\[\frac{dc_{i}}{dx}-\frac {ez_{i}c_{i}D}{k_{B}T}\frac{d\Psi }{dx}\] ;где i = 1, 2
\[D_{1}=D_{2} =D,z_{1}\]=-z
Здесь скалярная форма счета, которая используется для симметрии в задаче, зависит от электрода. Следовательно, концентрации могут быть измерены в моль м-3, а разница между плотностью электрического тока может быть измерена с помощью постоянной Фарадея по следующей формуле
i = zF(j₁ - j₂), где j₁ и j₂ — адсорбция или десорбция соли в электроде.
Даже сегодня ведется множество исследований, направленных на повышение точности постоянной Фарадея.
Заключение
Постоянная Фарадея – это заряд, переносимый одним молем электронов. Хотя это используется реже, в основном оно находит применение в области электрохимии. Это коэффициент преобразования моля в кулон. Если вы хотите получить краткую информацию о константе Фарадея по этой теме, вы можете посетить официальный сайт Vedantu или воспользоваться приложением Vedantu. Основным мотивом Веданту является прояснение концепций ученика, и наряду с этим Веданту помогает им увеличить свои баллы и улучшить свои результаты. Таким образом, информация, предоставленная в приложении, перепроверяется многими экспертами по конкретному предмету и обсуждается должным образом, прежде чем сделать ее доступной для учащихся, чтобы учащиеся могли понять тему наилучшим образом, тогда только они могут получить оценку. хорошо в их рассмотрении. В этих темах, таких как тема константы Фарадея, рассматриваются основные понятия, формирующие основу для дальнейшего класса, и поэтому они в основном хорошо объясняются Веданту.





 Электролит представляет собой смесь борной кислоты, глицерина и гидроксида аммония. И вот как достигаются эти великие способности …
Электролит представляет собой смесь борной кислоты, глицерина и гидроксида аммония. И вот как достигаются эти великие способности …