Где врут? : Химия
| Effectx01 |
| ||
08/12/15 |
| ||
|
| |||
| photon |
| |||
23/12/05 |
| |||
|
| ||||
| EUgeneUS |
| ||
11/12/16 |
| ||
|
| |||
| Effectx01 |
| ||
08/12/15 |
| ||
|
| |||
| EUgeneUS |
| ||
11/12/16 |
| ||
|
| |||
| Effectx01 |
| ||
08/12/15 |
| ||
|
| |||
| madschumacher |
| |||
28/04/16 |
| |||
|
| ||||
| arseniiv |
| |||
27/04/09 |
| |||
|
| ||||
| PETIKANTROP |
| ||
15/04/15 |
| ||
|
| |||
| EUgeneUS |
| ||
11/12/16 |
| ||
|
| |||
| Andrey_Kireew |
| ||
07/10/15 |
| ||
|
| |||
| madschumacher |
| |||
28/04/16 |
| |||
|
| ||||
| Показать сообщения за: Все сообщения1 день7 дней2 недели1 месяц3 месяца6 месяцев1 год Поле сортировки АвторВремя размещенияЗаголовокпо возрастаниюпо убыванию |
| Страница 1 из 1 | [ Сообщений: 12 ] |
Модераторы: photon, Toucan, Супермодераторы
«Почему на электрических схемах ток течет от + к -, а в реальном проводнике электроны движутся к аноду?» — Яндекс Кью
ПопулярноеСообществаТехнологииФизика+3
Nickolay Sheremetiev 794Z»>3 сентября 2016 ·16,9 KОтветитьУточнитьАнна СинельниковаФизика
5,2 KФизик-теоретик, PhD студент в Университете Уппсалы, Швеция · 4 сент 2016
Это пример самой большой исторической неудачи в физических обозначениях! И, к сожалению, это уже никак не исправить. Давайте посмотрим как же так получилось.
Наверно в любом учебнике по физике глава про электричество начинается с описания двух экспериментов: трения эбонитовой палочки о шерсть, и стеклянной палочки о бумагу или шелк. Это ровно то, как и началось изучение этого явления. Далее происходило следующее:
1) К середине XVIII века становится понятно, что существует два типа электричества: смоляное и стеклянное. Пока никакой речи о зарядах и знаках не идет.
2) Далее Бенжамин Франклин на основе своих многочисленных экспериментов строит первую (неправильную, как стало ясно позднее) теорию электричества, как жидкости. Но что самое важное, он вводит понятие положительного и отрицательного заряда, и определяет направление тока: от плюса к минусу.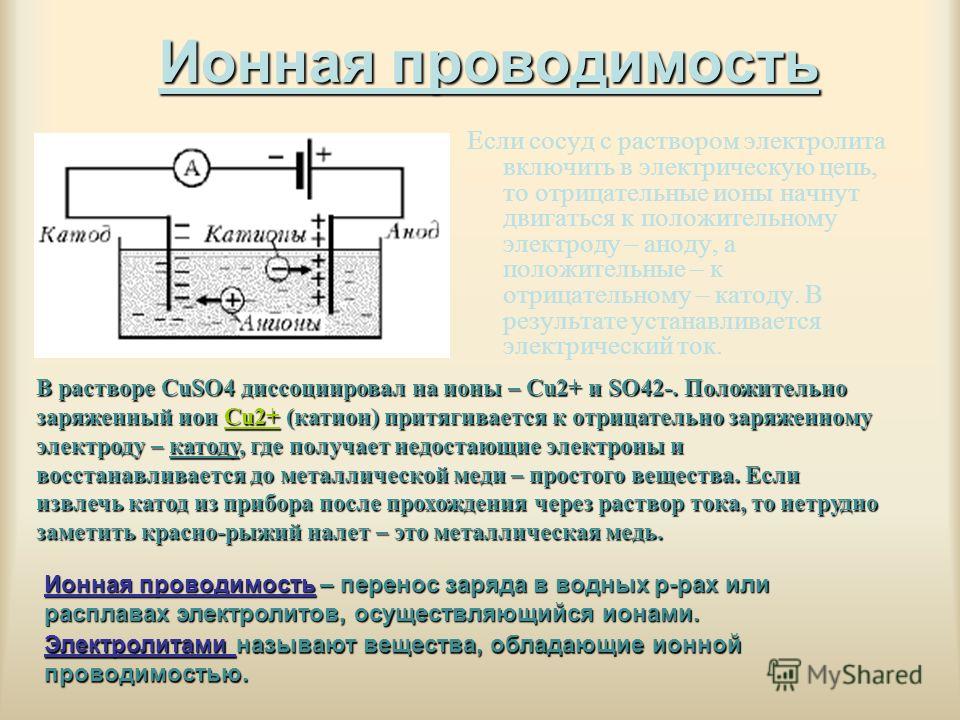 Все это происходит за век до появления идей об электроне.
Все это происходит за век до появления идей об электроне.
3) В конце того же XVIII века появляется первый количественный закон — закон Кулона. В него уже входят заряды, хотя по прежнему и не известно, что именно является их переносчиком. Однако, ясно, что они могут быть положительными и отрицательными. Начинается эпоха активного изучения электричества.
4) Майкл Фарадей, изучая электролиз вводит понятие «ион» для обозначения заряда. А Джордж Стони рассчитывает заряд одного такого иона и предлагает термин «электрон» для минимального неделимого заряда. Электрон в переводе с греческого значит «янтарь», что отсылает нас к представлениям о «смоляном токе».
5) Спустя век после появления закона Кулона, Джозеф Томпсон, изучая катодные лучи, экспериментально обнаруживает частицы меньше чем атомы (Нобелевская премия 1906 года). А другой эксперимент (Жана Перрена) показывает, что катодные лучи состоят из отрицательно заряженных частиц.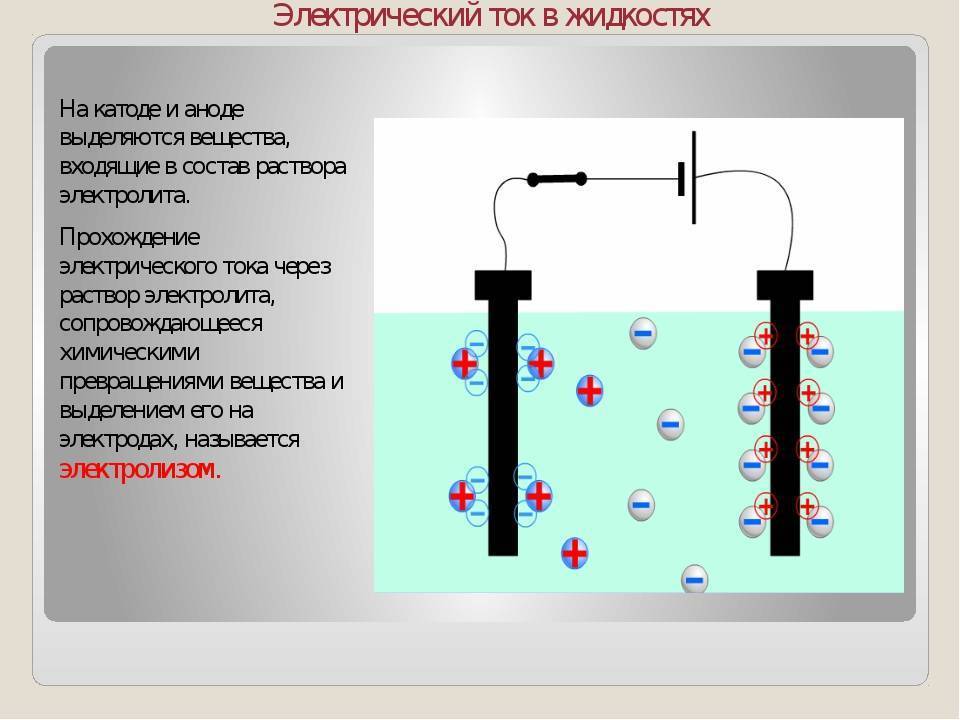
Наконец картинка собралась воедино. Направление тока было выбрано очень давно: от плюса к минусу, то есть от анода к катоду. А в последствии оказалось, что существует минимальный (неделимый) дискретный заряд — электрон— который движется от катода к аноду, а значит является отрицательным.
Теперь, надеюсь видно, что такое несоответствие движения электрона и направления тока не более чем досадная случайность. Если бы Бенжамин Франклин в свое время выбрал другое направлен тока, то есть от минуса к плюсу (от катода к аноду), то электрон бы имел положительный заряд, и у нас не было множества проблем с этим несчастным минусом.
В каком-то смысле отрицательный заряд электрона — это самая неестественная вещь в физике.
Владимир Козлов6 октября 2020То есть это сложилось исторически. И после этого некоторые уверяют, будто бы технари не могут быть гуманитариями!
)
Комментировать ответ…Комментировать…Asutpp1,3 K⚡Информационный сайт «ASUTPP». Статьи и рекомендации по ремонту электрооборудования… · 16 февр 2020 · asutpp.ru
Статьи и рекомендации по ремонту электрооборудования… · 16 февр 2020 · asutpp.ru
кандидат технических наук · 3 сент 2016
Это условности. Общепринятое направление тока — от плюса к минусу. Но это не значит, что носители заряда обязаны двигатся от плюса к минусу по направлению тока.
Исторически положительно заряженные ионы считались ответственными за ток, а электроны еще не были открыты. Поэтому за направление тока берется направление движения положительного заряда. Это ничего не меняет… Читать далее
Это ничего не меняет… Читать далее
Nickolay Sheremetiev
3 сентября 2016А как тогда схемотехники рисуют на схеме диоды, с учетом условно принятого неправильного направления тока, если… Читать дальше
Комментировать ответ…Комментировать…Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопросЭлектролизеры — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 270
Вольтовы элементы приводятся в действие спонтанной химической реакцией, которая производит электрический ток через внешнюю цепь. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является самопроизвольной и требует электрической энергии.
Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является самопроизвольной и требует электрической энергии.
Введение
Общая форма реакции может быть записана как: rightleftharpoons \text{Продукты} + \text{Электроэнергия}}}\]
Можно сконструировать ячейку, которая будет воздействовать на химическую систему, пропуская через нее электрический ток. Эти клетки называются 9Электролизер 0026. Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один полуэлемент восстановительный, другой полуэлемент окислительный. Однако направление потока электронов в гальванических элементах может быть обратным направлению спонтанного потока электронов в гальванических элементах, но определение как катода, так и анода остается прежним, когда на катоде происходит восстановление, а на аноде происходит окисление. . Поскольку направления обеих полуреакций были изменены на противоположные, изменился знак, но не величина клеточного потенциала.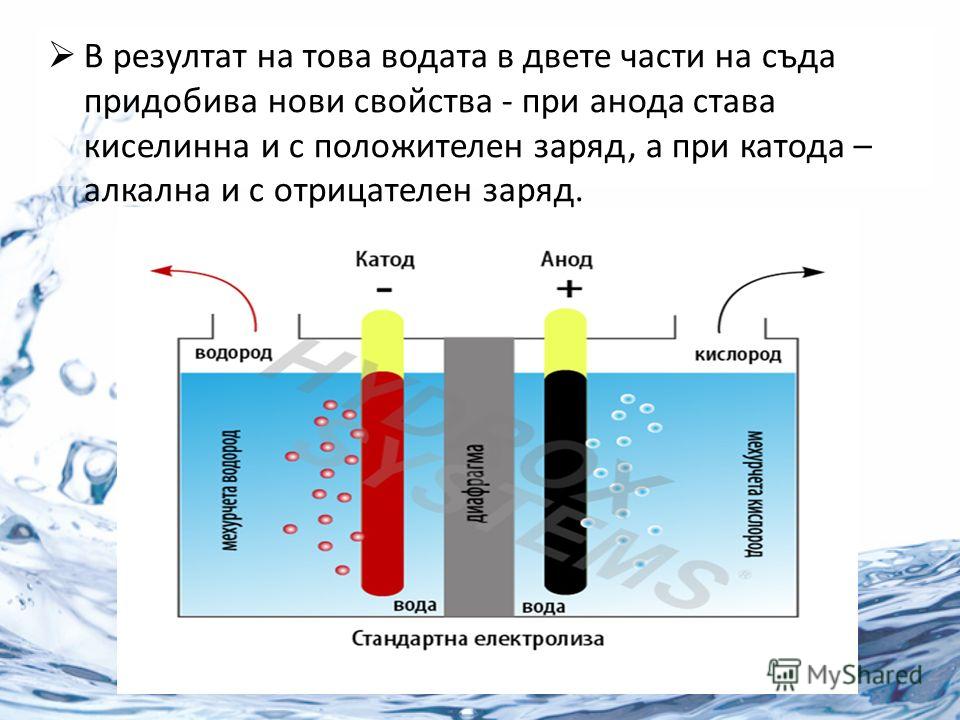
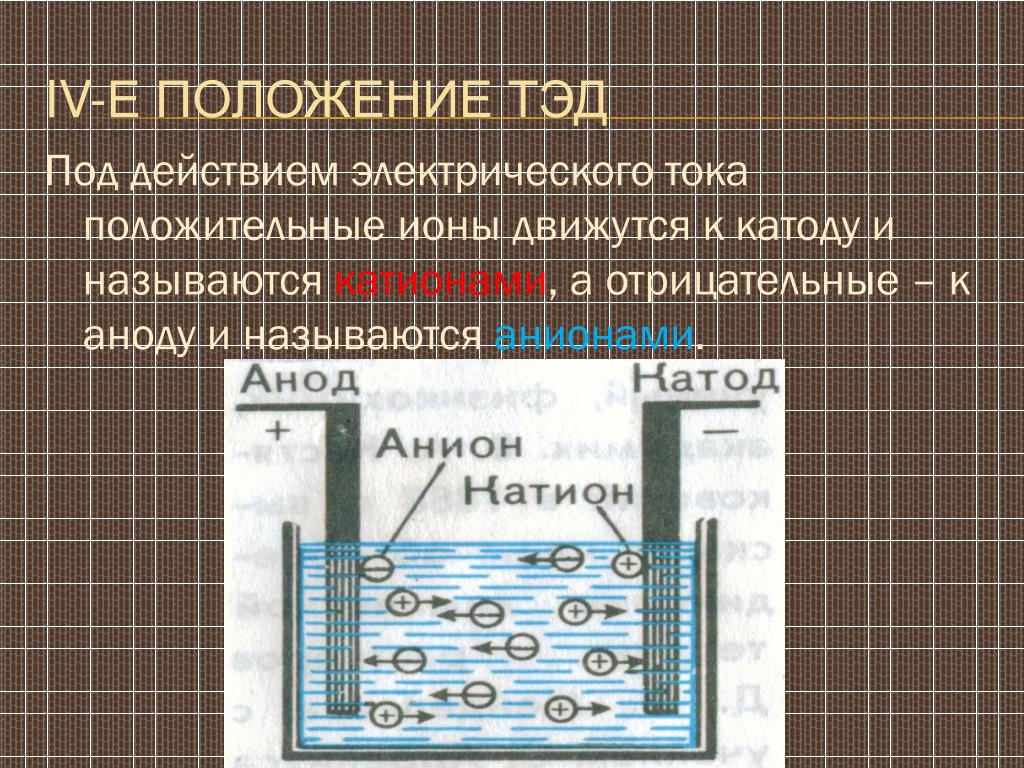
Электролитические элементы очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевого мостика, оба имеют катод и анод, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя клетками есть и поразительные различия. Основные отличия представлены ниже:
Рисунок \(\PageIndex{1}\): Электрохимические ячейки . Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, соединенных внешней электрической цепью; кроме того, для поддержания электрической нейтральности необходимо второе соединение, позволяющее ионам течь между отсеками (показанное здесь вертикальной пунктирной линией для обозначения пористого барьера). Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электрической энергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только одно отделение. В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
В электролитической ячейке (справа) внешний источник электрической энергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только одно отделение. В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Электролитическая ячейка |
|---|---|
Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
| Здесь окислительно-восстановительная реакция протекает самопроизвольно и отвечает за производство электроэнергии. | Окислительно-восстановительная реакция не является самопроизвольной, и для запуска реакции необходимо подать электрическую энергию. |
| Две полукамеры установлены в разных контейнерах, соединенных через соляной мост или пористую перегородку. | Оба электрода помещаются в одну емкость в раствор расплавленного электролита. |
Здесь анод отрицательный, а катод положительный электрод. Реакция на аноде – окисление, на катоде – восстановление. | Здесь анод положительный, а катод отрицательный. Реакция на аноде – окисление, на катоде – восстановление. |
| Электроны поставляются окисляющимися частицами. Они движутся от анода к катоду во внешней цепи. | Внешняя батарея поставляет электроны. Они входят через катод и выходят через анод. |
Электролизеры
Чтобы объяснить, что происходит в электролизере, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Самопроизвольный (электролитическая ячейка) | ||||
2 NaCl (л) | \(\rightleftharpoons\) | 2 На (ы) | + | Класс 2 (г) |
<--------- самопроизвольный (электрохимический элемент) | ||||
Если расплавленный \(NaCl_{(l)}\) поместить в контейнер и вставить инертные электроды \(C_{(s)}\), прикрепленные к положительному и отрицательному полюсам батареи, произойдет электролитическая реакция. 9-\]
9-\]
Прогнозирование реакции электролиза
Существует четыре основных фактора, определяющих, будет ли происходить электролиз, даже если внешнее напряжение превышает расчетное значение: поверхность.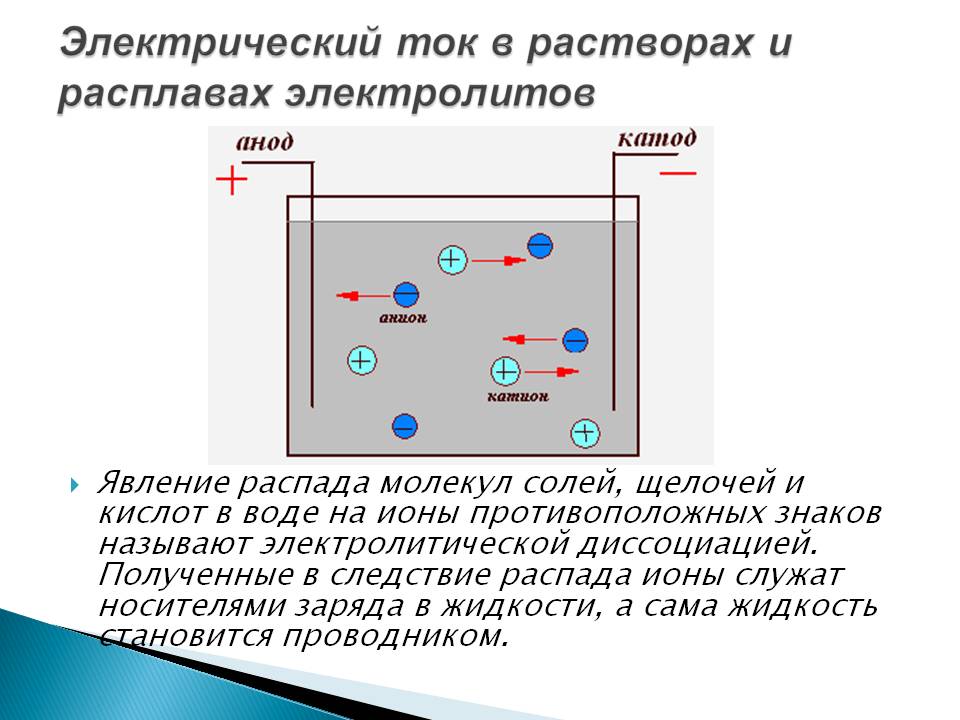 Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
- Концентрация иона хлорида = 5,5M, а не единица активности 1M. Это означает, что восстановление хлорида = 1,31 В, а не 1,36 В
- Стандартным условием является pH 4 в анодной полуэлементе, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.

Если учесть все четыре фактора, мы можем успешно прогнозировать электродные полуреакции и общие реакции при электролизе.
Упражнение \(\PageIndex{1}\)
Предскажите электродные реакции и общую реакцию, когда анод сделан из меди (а) и платины (б).
Количественные аспекты электролиза
Майкл Фарадей в 1833 году открыл, что всегда существует простая зависимость между количеством вещества, образующегося или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , прошедшего через ячейку. Например, полууравнение 9– \rightarrow Ag\]
говорит нам, что когда 1 моль Ag + высеивается как 1 моль Ag, 1 моль e – должен поступать с катода. Поскольку известно, что отрицательный заряд одного электрона составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется постоянной Фарадея , символ F :
F = 1,6022 × 10 –19 C × 6,0221 × 10 23 9-}\) и \(Q\).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулонов определяется как количество заряда, которое проходит через фиксированную точку электрической цепи, когда в течение одной секунды протекает ток в один ампер, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\[Q = It\]
В этом уравнении I представляет ток, а t представляет время. Если вы помните, что
кулон = 1 ампер × 1 секунда 1 Кл = 1 А с
, вы можете настроить единицы времени, чтобы получить правильный результат. Теперь, когда мы можем предсказать электродные полуреакции и общие реакции при электролизе, также важно иметь возможность рассчитать количество потребленных реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 Кл
заряд ( Кл ) = ток ( Кл/с ) x время (с)
( Кл/с 90 027 ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа задач:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) за секунды, [1 c = (A)/(s)]
- Наконец, используйте стехиометрическую конверсию 1 моль электрона = 9-\].
 Какую массу брома можно выделить за 3,00 ч при силе тока 1,18 А?
Какую массу брома можно выделить за 3,00 ч при силе тока 1,18 А?Решение :
3,00 часа x 60 мин/час x 60 с/1 мин x 1,18 C(A) / 1 с x 1 моль e — /96,485 C
= 0,132 моль e —
Задачи
1) Предсказать продукты электролиза, заполнив график:
Cl — , Br — , I — , H + , OH — , Cu 2+ , Pb 2+ , Ag+, K + , На + ,
2 ) Рассчитайте количество электрического заряда, необходимого для электролиза 1,386 моль Cr из кислого раствора K 2 Cr 2 O 7 в соответствии с полууравнением
H 2 Cr 2 О 7 ( водный раствор ) + 12H + ( водный раствор ) + 12 e – → 2Cr( s ) + 7 H 2 O( l )
3) Перекись водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты кислота.
 Реакция на аноде:
Реакция на аноде:2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 9002 4 e –
Когда образуется пероксидисерная кислота, Н 2 С 2 O 8 , кипятится при пониженном давлении, разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при протекании тока 0,893 в течение 1 часа.
4) Электролиз образца растворенного хлорида можно использовать для определения содержания хлорида в образце. На катоде идет полуреакция восстановления Cl 2 + (водн.) + 2 e — -> 2 Кл — . Какая масса хлорида может быть осаждена за 6,25 ч током силой 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______ ; химическое изменение, происходящее на этом электроде, называется _______.

- анод, оксидирование
- анод, редуктор
- катод, оксидирование
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток силой 5,0 ампер для гальванического осаждения 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5,9 часа
- 7) Сколько времени в часах потребуется для гальванического покрытия 78 г платины из раствора [PtCl 6 ] 2 — , используя средний ток 10 ампер при эффективности электрода 80%?
- 8.4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев требуется для превращения 1,00 г алюминия(III) в металлический алюминий?
- 1,00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал гальванического элемента с помощью следующей реакции элемента.

Zn(s) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu(s)
Ответы
1) . Cl — хлор H + водород
Cl — хлор Cu 2+ медь
I — йод H + Hводород
2) 12 моль e – is требуется для нанесения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e – /Cr). Затем по константе Фарадея можно найти количество заряда.
n Cr n e – Q
Q = 1,386 моль Cr × × = 8 .024 × 10 5 C
3) Произведение тока на время дает нам количество электроэнергии, Q . Зная это, мы легко вычисляем количество электронов, n e –. Тогда из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, m h3O2 .

= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
9 0023 4) 0,259 моль д —5) г
6) d
7) b
8) d
9) Напишите полуреакции для каждого процесс.
Zn(s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu(s)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2+ = + 0,339 В
E o восстановление Zn2+ = — 0,762 В
Определить общий стандартный клеточный потенциал.
E o ячейка = + 1,101 В
Ссылки
- Petrucci, et al. Общая химия: принципы и современные приложения.
 9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. .
9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. . - Кольбе, Герман. Электролиз органических соединений. Эдинбург: Э. и С. Ливингстон, 1947. .
- Стюарт, А.Т. «Электролиз воды». Производство водорода 2001 13 мая
- А также все упомянутые «внешние ссылки».
Авторы и ссылки
- Жасмин Брионес, Калифорнийский университет в Дэвисе, 2012 г.
Electrolytic Cells распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- электрохимическая ячейка
- гальванический элемент
- Батареи Вольта
электричество — Прибывают ли электроны к аноду с некоторой кинетической энергией? Куда это идет?
спросил
Изменено 3 года, 7 месяцев назад
Просмотрено 610 раз
$\begingroup$Я изучаю электронику и схемы.
Я пытаюсь понять, как ведут себя электроны, двигаясь по цепи, но кое-что меня все еще беспокоит.
Электроны имеют некоторую потенциальную энергию (напряжение между клеммами), покидая катод батареи, но по мере их движения в цепи под действием электрического поля она преобразуется в кинетическую энергию (или тепло/звук. ..) .
..) .
Теперь, всегда ли электрон достигает анода с нулевой кинетической энергией (они потребляют ее)? или у них еще есть?
Постараюсь аргументировать лучше с помощью аналогии.
Предположим, я рассматриваю гидравлическую аналогию с насосом, который заставляет работать и перекачивать молекулы воды при более высоком (гравитационном) потенциале.
Если я представлю трубу с очень низким коэффициентом трения, почти вся потенциальная энергия будет преобразована в кинетическую энергию. Молекулы воды будут прибывать к насосу со скоростью, и насос будет толкать их.
Похоже, они будут двигаться все быстрее и быстрее, пока не достигнут предельной скорости из-за формы трубы.
Будет ли тот же аргумент иметь смысл для электронов? Что, если они не поглотят всю свою кинетическую энергию?
Я читал интересный связанный вопрос, и в одном комментарии говорилось, что: «Вакуумная лампа — это почти идеальное «место без трения», чтобы «сбрасывать» электрический заряд». Когда электроны ударяются об анод, они движутся очень быстро — и превращаются в тепло.



 В целом, они движутся к катоду (аноду), однако
В целом, они движутся к катоду (аноду), однако

 01.2018, 18:21
01.2018, 18:21 
 А то вам уже всё написали, что могло иметься в виду (раз — терминология и два — тепловое движение; по последней же причине в металлическом проводнике под напряжением вот тоже не все электроны двигаются от минуса к плюсу в каждый конкретный момент времени) — что ещё обсуждать?
А то вам уже всё написали, что могло иметься в виду (раз — терминология и два — тепловое движение; по последней же причине в металлическом проводнике под напряжением вот тоже не все электроны двигаются от минуса к плюсу в каждый конкретный момент времени) — что ещё обсуждать? А то вам уже всё написали, что могло иметься в виду (раз — терминология и два — тепловое движение; по последней же причине в металлическом проводнике под напряжением вот тоже не все электроны двигаются от минуса к плюсу в каждый конкретный момент времени) — что ещё обсуждать?
А то вам уже всё написали, что могло иметься в виду (раз — терминология и два — тепловое движение; по последней же причине в металлическом проводнике под напряжением вот тоже не все электроны двигаются от минуса к плюсу в каждый конкретный момент времени) — что ещё обсуждать? 01.2018, 11:22
01.2018, 11:22  04.2018, 22:41
04.2018, 22:41 


 Какую массу брома можно выделить за 3,00 ч при силе тока 1,18 А?
Какую массу брома можно выделить за 3,00 ч при силе тока 1,18 А? Реакция на аноде:
Реакция на аноде:

 9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007.
9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007.
 ..) .
..) . 