Молекула воды
Вода (оксид водорода) Н2О – простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород – 88,81%.
Как
ранее говорилось, в природе существует
три изотопа водорода – легкий водород
Н1,
дейтерий D
(Н2)
и тритий (Н3)
и три изотопа кислорода – О16,
О17 и О18.
Искусственно получены в ускорителях
сверхтяжелые изотопы водорода Н4 и Н5 и шесть изотопов кислорода: три легких
– О13,
О14,
О15,
два тяжелых – О19,
О20 и один сверхтяжелый – О24.
Теоретически пять изотопов водорода и
девять изотопов кислорода могут
образовать 135 разновидностей молекулы
воды, из которых устойчивыми являются
девять, включающих стабильные изотопы.
В природной воде на долю 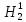
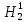 О18 – 0,2%, на
О18 – 0,2%, на 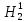 О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять
разновидностей присутствуют в ничтожных
количествах [4].
О17 – 0,04% и на Н1Н2О16 – примерно 0,093%; остальные пять
разновидностей присутствуют в ничтожных
количествах [4].Строение воды
Молекула воды имеет угловое строение: входящие в её состав ядра образуют равнобедренный треугольник, в основании которого находятся два водорода, а в вершине – атом кислорода. Межъядерные расстояния О – Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм. Из шести электронов, составляющих внешний электронный слой атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две неподелённые электронные пары (рисунок 1).
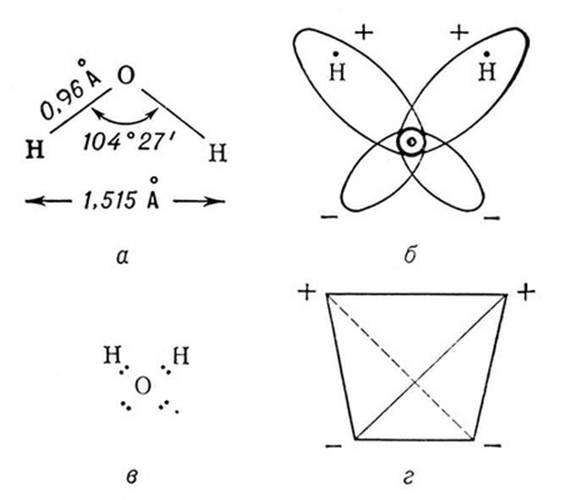
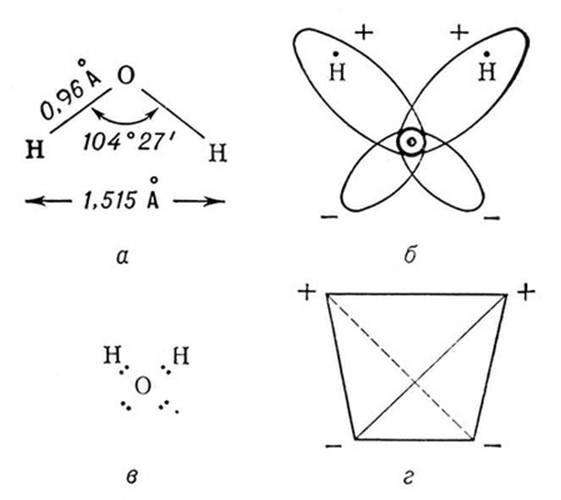
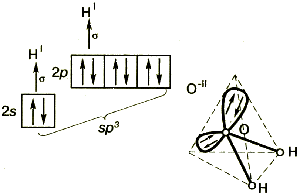
Рисунок 1 – Модели строения молекулы воды [3]
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов, получится объемная геометрическая фигура – правильный тетраэдр (рисунок 1) [19,20].
С
позиций метода валентных связей
образование химических связей в молекуле
воды можно объяснить за счёт перекрывания
двух одноэлектронных p-облаков
атома кислорода и одноэлектронных
s-облаков
двух атомов водорода. Ввиду того что
участвующие в образовании химических
связей p-облака
кислорода расположены относительно
друг друга под углом в 90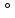
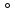 .
Отклонение валентного угла от ожидаемого
можно объяснить с двух позиций.
.
Отклонение валентного угла от ожидаемого
можно объяснить с двух позиций. Согласно
одной из них увеличение валентного угла
с 90 до 104,5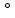
С
точки зрения концепции гибридизации
атом кислорода должен находится в
состоянии sp3-гибридизации,
в которой принимают участие две орбитали
с неподелёнными электронными парами и
две орбитали, осуществляющие связи с
водородом. В соответствии с этим валентный
угол между тетраэдрически расположенными
в пространстве орбиталями кислорода
должен составить порядка 109,5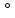
Особенности строения молекулы воды имеют важные следствия.
Во-первых,
из-за неравномерности распределения
электронной плотности валентных
электронов молекула Н2О
представляет собой диполь с отрицательным
полюсом на кислороде и положительным
со стороны атома водорода. Дипольный
момент воды составляет 6,17
 м.
Это достаточно большая величина. Для
сравнения, дипольный момент метана
равен 0, аммиака – 4,44
м.
Это достаточно большая величина. Для
сравнения, дипольный момент метана
равен 0, аммиака – 4,44 10-30 Кл
10-30 Кл м.
м.Во-вторых, большой дипольный момент воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах.
В-третьих, молекула воды образует водородные связи.
В-четвёртых, неподелённые электронные пары кислорода позволяют Н2О выступать в качестве лиганда с образованием комплексных соединений [3].
Вода
имеет очень высокие температуры
замерзания (0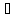 )
и кипения (100
)
и кипения (100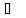 )
(рисунок 2). Это позволяет ей существовать
во всех агрегатных состояниях: твердом
(лед), жидком (вода) и газообразном (пар)
(рисунок 3).
)
(рисунок 2). Это позволяет ей существовать
во всех агрегатных состояниях: твердом
(лед), жидком (вода) и газообразном (пар)
(рисунок 3).
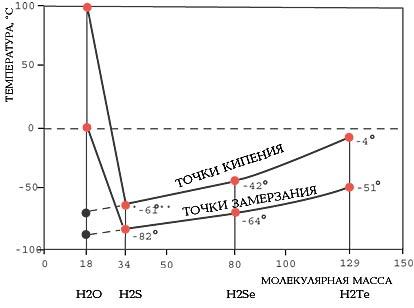
Рисунок 2 – Аномалии точек кипения и замерзания воды

Рисунок 3 – Агрегаты состояния воды: а – лед, б – вода, в – пар [2]
Из
одиночных молекул вода состоит в
парообразном состоянии. При температуре
ниже температуры кипения, когда
кинетическая энергия молекул становится
ниже их потенциальной энергии
взаимодействия, вода, как и любое вещество
в этом случае, переходит в жидкое
состояние. Но температура этого фазового
перехода для воды почти на 200
Высокая полярность воды является лишь одной из причин ассоциации молекул воды, которые могут комбинироваться по две, три и более вследствие взаимного притяжения противоположно заряженных концов диполя [3].
Главной
причиной образования ассоциатов (Н2О)х являются водородные связи [3]. В твердом
состоянии атом кислорода каждой молекулы
воды образует две водородные связи
(показаны пунктиром) с соседними
молекулами по схеме (рисунок 4) [4].
Благодаря им жидкая вода – это не
разупорядоченное движение молекул, а
состояние, близкое к аморфному. В нём
молекулы воды ассоциированы в агрегаты
(Н )
до 130 молекул воды при 0
)
до 130 молекул воды при 0 ,
до 90 – при 20
,
до 90 – при 20 ,
до 60 – при 72
,
до 60 – при 72 (рисунок 5) [3].
(рисунок 5) [3].
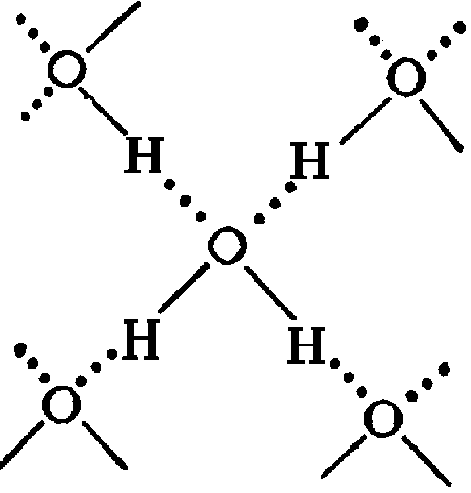
Рисунок 4 – Схема образования водородных связей [4]
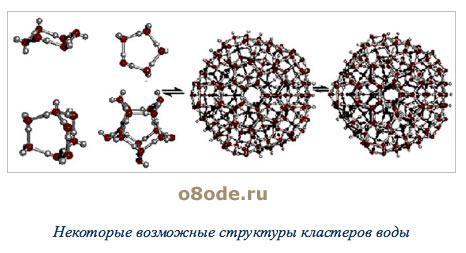
Рисунок 5 – Некоторые возможные структуры кластеров воды
Время
жизни таких кластеров небольшое (10-11 – 10-10 с). В их образовании участвуют не все
молекулы, иначе бы их плотность в жидком
состоянии должна была бы составить не  1
г/см3,
а 1,84 г/см3.
Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38
1
г/см3,
а 1,84 г/см3.
Последняя величина рассчитана из
предположения плотной упаковки молекул
Н2О
с радиусом, равным 1,38 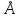
Схема кристаллической решетки льда представлена на рисунке 6. Каждая молекула Н2О (черные шарики) окружена тетраэдрически четырьмя другими молекулами – тремя из того же слоя и одной из соседнего слоя молекул. Структура льда является наименее плотной структурой. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул Н2О. При плавлении льда часть водородных связей разрушается, и в пустотах оставшихся агрегатов могут разместиться отдельные молекулы воды, вследствие чего достигается более плотная упаковка молекул. Поэтому при плавлении льда объем воды уменьшается, а плотность возрастает.
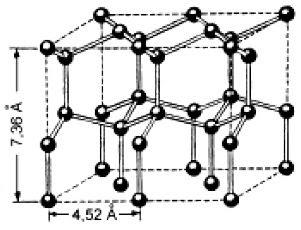
Рисунок 6 – Кристаллическая решетка льда [4]
Диполь — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Диполь — вода
Cтраница 1
Диполи воды имеют угловую форму, так как ядра атомов в них образуют равнобедренный треугольник. В основании его расположены два протона, а в вершине — ядро атома кислорода. При этом в молекуле воды две s / Я-гибридные орбитали атома кислорода образуют две ко-валентные связи О — Н ( длина которых около 0 1 нм) и остаются еще две неподеленные пары электронов. [2]
Диполи воды соединены с гидрофильными группами белков водородными связями. Учитывая явления гидратации, можно объяснить рассмотренный нами процесс высаливания белков из растворов. При прибавлении к раствору белка высоких концентраций солей или таких органических растворителей, как спирт или ацетон, возникает конкуренция за молекулы воды между солью или спиртом, с одной стороны, и молекулами белка — с другой. При определенных концентрациях ионы солей, молекулы спирта или ацетона связывают такое большое количество молекул воды, что несвязанной воды недостаточно для растворения белка, и он выпадает в осадок. [3]
Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер ионов, тем быстрее и легче они отрываются диполями воды от поверхности элементарных кристаллов. Связь между листочками в пачках нарушается, и глина распускается в воде. [4]
Диполи воды, поляризуясь, образуют оболочку вокруг капли ртути, которая мешает адсорбироваться на поверхности капли новым ионам деполяризатора и предельный ток будет поддерживаться только диффузией деполяризатора через водную оболочку. [6]
Если диполи воды ориентированы в поверхностном слое кристаллической решетки цементных минералов, то расстояния между поверхностными ионами практически не изменяются. [7]
Постепенно диполи воды проникают между ионами Na и С1 — в твердой фазе, отрывая их от кристалла. [9]
При этом диполи воды Б поверхностном слое ориентированы таким образом, что кислород обращен в сторону газовой фазы, а водород — в сторону соли. [10]
Окружающие кристаллик диполи воды сразу же ориентируются так, что их отрицательные полюса подходят к положительным ионам натрия, а положительные полюса — ближе к отрицательным ионам хлора. Таким образом, вокруг каждого иона поверхностного уровня кристалла образуется оболочка из молекул полярного растворителя — воды. Этот процесс называется сольватацией ( отлат. Если растворителем является вода, то такая сольватация называется гидратацией. [12]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, СО — две молекулы, NH — две молекулы, Nh3 — три молекулы. [13]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, С О — две молекулы, NH — две молекулы, МН2 — три молекулы. [14]
Знак минус означает, что диполи воды обращены положительным концом наружу. [15]
Страницы: 1 2 3 4 5
Электрический дипольный момент — Википедия
Электри́ческий дипо́льный моме́нт — векторная физическая величина, характеризующая, наряду с суммарным зарядом (и реже используемыми высшими мультипольными моментами), электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ими поля и действия на неё внешних полей. Главная после суммарного заряда и положения системы в целом (её радиус-вектора) характеристика конфигурации зарядов системы при наблюдении её издали.
Дипольный момент — первый[прим 1]мультипольный момент.
Простейшая система зарядов, имеющая определенный (не зависящий от выбора начала координат) ненулевой дипольный момент — диполь (две точечные частицы с одинаковыми по величине разноимёнными зарядами). Электрический дипольный момент такой системы по модулю равен произведению величины положительного заряда на расстояние между зарядами и направлен от отрицательного заряда к положительному, или:
- p=ql,{\displaystyle \mathbf {p} =q\mathbf {l} ,}
где q — величина положительного заряда, l{\displaystyle \mathbf {l} } — вектор с началом в отрицательном заряде и концом в положительном.
Для системы из N частиц электрический дипольный момент равен
- p=∑i=1Nqiri,{\displaystyle \mathbf {p} =\sum _{i=1}^{N}q_{i}\mathbf {r_{i}} ,}
где qi{\displaystyle q_{i}} — заряд частицы с номером i,{\displaystyle i,} а ri{\displaystyle \mathbf {r_{i}} } — её радиус-вектор; или, если суммировать отдельно по положительным и отрицательным зарядам:
- p=∑i=1N+qi+ri−∑i=1N−|qi−|ri=Q+R+−|Q−|R−,{\displaystyle \mathbf {p} =\sum _{i=1}^{N^{+}}q_{i}^{+}\mathbf {r_{i}} -\sum _{i=1}^{N^{-}}\left|q_{i}^{-}\right|\mathbf {r_{i}} =Q^{+}\mathbf {R} ^{+}-|Q^{-}|\mathbf {R} ^{-},}
где N±{\displaystyle N^{\pm }} — число положительно/отрицательно заряженных частиц, N=N++N−,{\displaystyle N=N^{+}+N^{-},} qi±{\displaystyle q_{i}^{\pm }} — их заряды; Q+,R+,Q−,R−{\displaystyle Q^{+},\mathbf {R} ^{+},Q^{-},\mathbf {R} ^{-}} — суммарные заряды положительной и отрицательной подсистем и радиус-векторы их «центров тяжести»[прим 2].
Электрический дипольный момент нейтральной системы зарядов не зависит от выбора начала координат, а определяется относительным расположением (и величинами) зарядов в системе.
Из определения видно, что дипольный момент аддитивен (дипольный момент наложения нескольких систем зарядов равен просто векторной сумме их дипольных моментов), а в случае нейтральных систем это свойство приобретает ещё более удобную форму в силу изложенного в абзаце выше.
Подробности определения и формальные свойства
Дипольный момент ненейтральной системы зарядов, вычисленный по приведенному выше определению, может выбором начала координат быть сделан равным любому наперед заданному числу (например, нулю). Однако и в этом случае, если мы хотим избежать такого произвола, при желании может быть использована какая-нибудь процедура внесения однозначности (которая будет тоже представлять собой предмет произвольного условного соглашения, но всё же будет формально фиксирована).
Но и при произвольном выборе начала координат (ограничивающемся тем условием, чтобы начало координат находилось внутри данной системы зарядов или, по крайней мере, близко от неё, и уж во всяком случае не попадая в ту область, в которой мы вычисляем дипольную поправку к полю единственного точечного заряда или дипольный член мультипольного разложения) все вычисления (дипольной поправки к потенциалу или напряженности поля, создаваемого системой, действующий на неё со стороны внешнего поля вращающий момент или дипольная поправка к потенциальной энергии системы во внешнем поле) проходят успешно.
Пример:
Интересной иллюстрацией мог бы быть следующий пример:
Рассмотрим систему, состоящую из единственного точечного заряда q, однако начало координат выберем не совпадающим с его положением, хотя и очень близко от него (т.е. много ближе, чем расстояние, для которого мы хотим вычислить потенциал, создаваемый этой нашей простой системой). Таким образом, радиус вектор нашего точечного заряда будет rq;rq<<r,{\displaystyle \mathbf {r} _{q};r_{q}<<r,} где r — модуль радиус-вектора точки наблюдения. Тогда формально нулевым приближением будет кулоновский потенциал ϕ0=q/r{\displaystyle \phi _{0}=q/r}; однако это приближение содержит маленькую ошибку за счет того, что на самом деле расстояние от заряда до точки наблюдения не равно r, а равно |r−rq|{\displaystyle |\mathbf {r} -\mathbf {r} _{q}|}. Именно эту ошибку в первом порядке (т.е. тоже приближенно, но с лучшей точностью) исправляет добавление потенциала диполя с дипольным моментом, равным qrq{\displaystyle q\mathbf {r} _{q}}. Наглядно это выглядит так: мы накладываем на заряд q, находящийся в начале координат, диполь так, что его отрицательный заряд -q в точности попадает на q в начале координат и его «уничтожает», а его положительный заряд (+q) — попадает в точку rq{\displaystyle \mathbf {r} _{q}}, то есть именно туда, где заряд должен находиться на самом деле — т.е. заряд передвигается из условного начала координат в правильное положение (хотя и близкое к началу координат). Используя суперпозицию дипольной поправки с нулевым приближением ϕ0{\displaystyle \phi _{0}}, мы получаем более точный ответ, т.е. дипольная поправка в нашем примере вызывает эффект, (приближенно) эквивалентный тому, чтобы сдвинуть заряд из условного начала координат в его правильное положение.
Электрический дипольный момент (если он ненулевой) определяет в главном приближении электрическое[прим 3] поле диполя (или любой ограниченной системы с суммарным нулевым зарядом) на большом расстоянии от него, а также воздействие на диполь внешнего электрического поля.
Физический и вычислительный смысл дипольного момента состоит в том, что он дает поправки первого порядка (чаще всего — малые) в положение каждого заряда системы по отношению к началу координат (которое может быть условным, но приближенно характеризует положение системы в целом — система при этом подразумевается достаточно компактной). Эти поправки входят в него в виде векторной суммы, и везде, где при вычислениях такая конструкция встречается (а в силу принципа суперпозиции и свойства сложения линейных поправок — см.Полный дифференциал — такая ситуация встречается часто), там в формулах оказывается дипольный момент.
Дипольный момент для атома с квантовой точки зрения[править | править код]
Из квантовой теории известно, что если система была в состоянии k{\displaystyle k}, то вероятность найти её в состоянии l{\displaystyle l} через время t{\displaystyle t} после вынужденного излучательного перехода под действием внешнего поля E0{\displaystyle E_{0}} частотой ν{\displaystyle \nu } будет равна
- al(t)=|dkl|24π2E02tsin2(π(ν−ν0)t)π(ν−ν0)t{\displaystyle a_{l}(t)={\cfrac {|d_{kl}|^{2}}{4\pi ^{2}}}\;E_{0}^{2}\;t\;{\cfrac {\sin ^{2}(\pi (\nu -\nu _{0})t)}{\pi (\nu -\nu _{0})t}}}
Если мы наблюдаем за системой продолжительное время, то последняя дробь перестаёт зависеть от времени, и выражение приведётся к виду
- al(t)=|dkl|24π2E02tδ(ν−ν0){\displaystyle a_{l}(t)={\cfrac {|d_{kl}|^{2}}{4\pi ^{2}}}\;E_{0}^{2}\;t\;\delta (\nu -\nu _{0})}
- где
- δ(ν−ν0){\displaystyle \delta (\nu -\nu _{0})} — дельта-функция Дирака.
- где
В указанной формуле dkl{\displaystyle d_{kl}} — это элементы матричного оператора дипольного момента d^{\displaystyle {\hat {d}}} по время перехода k−l.{\displaystyle k\!-\!l.}, которые определяются как
- dkl=e∫VΨk∗(x,y,z)⋅x⋅Ψl(x,y,z)dV{\displaystyle d_{kl}=e\;\int _{V}\Psi _{k}^{*}(x,y,z)\cdot x\cdot \Psi _{l}(x,y,z)\;dV}
- где
В частности, очевидно, что если k=l{\displaystyle k=l}, то интеграл обнулится.
Соответственно, сам матричный оператор дипольного момента представляет собой матрицу размера [количество энергетических уровней x количество энергетических уровней], в которой элементы, лежащие на главной диагонали, равны нулю, а не лежащие — в общем случае не равны.
Для фиксированных угловых координат (то есть на луче, идущем из центра электрического диполя на бесконечность) напряжённость статического[прим 4] электрического поля диполя или в целом нейтральной системы зарядов, имеющей ненулевой дипольный момент,[прим 5] на больших расстояниях r асимптотически приближается к виду r−3, электрический потенциал — к r−2. Таким образом, статическое поле диполя убывает на больших расстояниях быстрее, чем поле простого заряда (но медленнее, чем поле любого более старшего мультиполя).
Напряжённость электрического поля и электрический потенциал неподвижного или медленно движущегося диполя (или в целом нейтральной системы зарядов, имеющей ненулевой дипольный момент) с электрическим дипольным моментом p{\displaystyle \mathbf {p} } на больших расстояниях в главном приближении выражаются как:
- в СГСЭ: E=3n(n⋅p)−pr3,φ=−p⋅∇1r,{\displaystyle \mathbf {E} ={\frac {3\mathbf {n} (\mathbf {n} \cdot \mathbf {p} )-\mathbf {p} }{r^{3}}},\qquad \varphi =-\mathbf {p} \cdot \mathbf {\nabla } {\frac {1}{r}},}
- в СИ: E=3n(n⋅p)−p4πε0r3,φ=−p⋅∇14πε0r,{\displaystyle \mathbf {E} ={\frac {3\mathbf {n} (\mathbf {n} \cdot \mathbf {p} )-\mathbf {p} }{4\pi \varepsilon _{0}r^{3}}},\qquad \varphi =-\mathbf {p} \cdot \mathbf {\nabla } {\frac {1}{4\pi \varepsilon _{0}r}},}
где n=rr{\displaystyle \mathbf {n} ={\frac {\mathbf {r} }{r}}} — единичный вектор из центра диполя в направлении точки измерения, а точкой обозначено скалярное произведение.
В декартовых координатах, ось x которых направлена вдоль вектора дипольного момента, а ось y выбрана так, чтобы точка, в которой рассчитывается поле, лежала в плоскости xy, компоненты этого поля записываются так:
- Ex=pr3(3cos2θ−1),{\displaystyle E_{x}={\frac {p}{r^{3}}}(3\cos ^{2}\theta -1),}
- Ey=3pr3cosθsinθ,{\displaystyle E_{y}={\frac {3p}{r^{3}}}\cos \theta \sin \theta ,}
- Ez=0,{\displaystyle E_{z}=0,}
где θ{\displaystyle \theta } — угол между направлением вектора дипольного момента и радиус-вектором в точку наблюдения (формулы приведены в системе СГС; в СИ аналогичные формулы отличаются только множителем 14πε0{\displaystyle {\frac {1}{4\pi \varepsilon _{0}}}}).
Достаточно просты выражения (в том же приближении, тождественно совпадающие с формулами, приведенными выше) для продольной (вдоль радус-вектора, проведенного от диполя в данную точку) и поперечной компонент напряженности электрического поля:
- E||=2pr3cosθ,{\displaystyle E_{||}={\frac {2p}{r^{3}}}\cos \theta ,}
- E⊥=pr3sinθ.{\displaystyle E_{\perp }={\frac {p}{r^{3}}}\sin \theta .}
Третья компонента напряженности электрического поля — ортогональная плоскости, в которой лежат вектор дипольного момента и радиус-вектор, — всегда равна нулю. Формулы также в СГС, в СИ, как и формулы выше, отличаются лишь множителем 14πε0.{\displaystyle {\frac {1}{4\pi \varepsilon _{0}}}.}
Вывод
Имеем:
- E||=(E⋅n)=3(n⋅p)−(n⋅p)r3=2(n⋅p)r3=2pcosθr3,{\displaystyle E_{||}=(\mathbf {E} \cdot \mathbf {n} )={\frac {3(\mathbf {n} \cdot \mathbf {p} )-(\mathbf {n} \cdot \mathbf {p} )}{r^{3}}}={\frac {2(\mathbf {n} \cdot \mathbf {p} )}{r^{3}}}={\frac {2p\cos \theta }{r^{3}}},}
Теперь:
- E⊥=E−nE||{\displaystyle \mathbf {E_{\perp }} =\mathbf {E} -\mathbf {n} E_{||}}
Простой также оказывается связь угла между вектором E и радиус-вектором (или вектором n):
- tgβ=12tgθ.{\displaystyle \mathrm {tg} \beta ={\frac {1}{2}}\mathrm {tg} \theta .}
Абсолютная величина напряженности электрического поля (в СГС):
- E=pr33cos2θ+1.{\displaystyle E={\frac {p}{r^{3}}}{\sqrt {3\cos ^{2}\theta +1}}.}
- Во внешнем электрическом поле E→{\displaystyle {\vec {E}}} на электрический диполь действует момент сил p→×E→,{\displaystyle {\vec {p}}\times {\vec {E}},} который стремится повернуть его так, чтобы дипольный момент развернулся вдоль направления поля.
- Потенциальная энергия электрического диполя в электрическом поле равна −E→⋅p→.{\displaystyle -{\vec {E}}\cdot {\vec {p}}.}
- Со стороны неоднородного поля на диполь действует сила (в первом приближении): Σi∂E→∂xipi.{\displaystyle \Sigma _{i}{\frac {\partial {\vec {E}}}{\partial x_{i}}}p_{i}.}
Об условиях корректности приближенных (в общем случае) формул данного параграфа — см.ниже.
Единицы измерения электрического дипольного момента[править | править код]
Системные единицы измерения электрического дипольного момента не имеют специального названия. В Международной системе единиц (СИ) это просто Кл·м.
Электрический дипольный момент молекул принято измерять в дебаях:
- 1 Д = 10−18 единиц СГСЭ момента электрического диполя,
- 1 Д = 3,33564·10−30 Кл·м.
Дипольный момент единицы объёма (поляризованной) среды (диэлектрика) называется вектором электрической поляризации.
Дипольный момент элементарных частиц[править | править код]
Многие экспериментальные работы посвящены поиску электрического дипольного момента (ЭДМ) фундаментальных и составных элементарных частиц, а именно электронов и нейтронов. Поскольку ЭДМ нарушает как пространственную (Р), так и временну́ю (T) чётность, его значение даёт (при условии ненарушенной СРТ-симметрии) модельно-независимую меру нарушения CP-симметрии в природе. Таким образом, значения ЭДМ дают сильные ограничения на масштаб CP-нарушения, которое может возникать в расширениях Стандартной Модели физики элементарных частиц.
Действительно, многие теории, несовместимые с существующими экспериментальными пределами на ЭДМ частиц, уже были исключены. Стандартная Модель (точнее, её сектор — квантовая хромодинамика) сама по себе разрешает гораздо большее значение ЭДМ нейтрона (около 10−8 дебая), чем эти пределы, что привело к так называемой сильной CP-проблеме и вызвало поиски новых гипотетических частиц, таких как аксион.
Текущее поколение экспериментов по поиску ЭДМ частиц достигает чувствительности в диапазоне, где могут проявляться эффекты суперсимметрии. Эти эксперименты дополняют поиск эффектов суперсимметрии на LHC.
В 2018 г. установлено, что ЭДМ электрона не превышает 1,1⋅10−29{\displaystyle 1{,}1\cdot 10^{-29}} e ⋅ см.[1]
Дипольный член (определяемый дипольным моментом системы или распределения зарядов) является лишь одним из членов бесконечного ряда, называемого мультипольным разложением, дающего при полном суммировании точное значение потенциала или напряженности поля в точках, находящихся на конечном расстоянии от системы зарядов-источников. В этом смысле дипольный член выступает как равноправный с остальными, в том числе и высшими, членами мультипольного разложения (хотя зачастую он и может давать больший вклад в сумму, чем высшие члены). Этот взгляд на дипольный момент и дипольный вклад в создаваемое системой зарядов электрическое поле обладает существенной теоретической ценностью, но в деталях довольно сложен и довольно далеко выходит за рамки необходимого для понимания существенных физического смысла свойств дипольного момента и большинства областей его использования.
Для прояснения физического смысла дипольного момента, так же как и для большинства его приложений, достаточно ограничиться гораздо более простым подходом — рассматривать дипольное приближение.
Широкое использование дипольного приближения основывается на той ситуации, что очень во многих, в том числе теоретически и практически важных случаях можно не суммировать весь ряд мультипольного разложения, а ограничиться только низшими его членами — до дипольного включительно. Часто этот подход дает вполне удовлетворительную или даже очень маленькую погрешность.
Дипольное приближение для системы источников[править | править код]
В электростатике достаточное условие применимости дипольного приближения (в смысле задачи определения электрического потенциала или напряженности электрического поля, создаваемого системой зарядов, имеющей определенный суммарный заряд и определенный дипольный момент) описывается весьма просто: хорошим это приближение является для областей пространства, удаленных от системы-источника на расстояние r, много большее, чем характерный (а лучше — чем максимальный) размер d самой этой системы. Таким обра
Структура молекул воды и их ассоциатов :: Живая вода
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Вода начинается с молекулы
Итак, молекула воды (1H216O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
Рис. 1.5. Строение молекулы воды
а – угол между связями O-H;
б – расположение полюсов заряда;
в – внешний вид электронного облака молекулы воды.
Электронное строение молекулы воды
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно – в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2 (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра – ядра O2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны – оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Вода — диполь: полярность водыПочти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом – 1,87 дебая (Дебай – внесистемная единица электрического дипольного 3,33564·1030 Кл·м). Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Также, последние исследования установили полярность кластеров воды.
Вода растворяет все!
Во многом благодаря диэлектрической проницаемости, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Минеральный состав воды
В пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
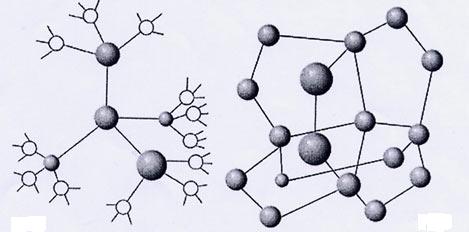
Формирование кластеров воды
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H2O)x
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
x·H2O↔ (H2O)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные «рои» довольно стабильного состава. Пространства между «роями» заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Распространение воды в природе. Строение молекул воды — урок. Химия, 8–9 класс.
Вода в природе
Вода (оксид водорода) h3O — самое распространённое вещество на Земле. Это единственное вещество, которое существует на планете одновременно в трёх агрегатных состояниях. Жидкая вода покрывает \(75\) % земной поверхности реками, озёрами, морями и океанами. Большое количество твёрдой воды в виде льда сосредоточено на Северном и Южном полюсах. Газообразная вода содержится в атмосфере.

Вода входит в состав всех живых организмов. Например, организм человека содержит \(70\) % воды, рыбы — \(80\) %. В живой клетке вода представляет собой среду, в которой протекают жизненно важные процессы. Она участвует во многих биохимических реакциях (фотосинтез, гидролиз сложных органических веществ). Ни один организм не может обходиться без воды. Так, большое дерево для обеспечения всех жизненных потребностей летом поглощает из почвы и испаряет в течение суток \(500\)–\(700\) дм³ воды, а человек без воды не может прожить более \(4\) дней.
Живым организмам требуется пресная вода. Её запасы на планете ограничены. Поэтому важное значение приобретает проблема охраны водных источников от загрязнения и экономного расходования пресной воды.
В природе абсолютно чистой воды не бывает. В ней всегда содержатся примеси. Для получения особо чистой воды используют дистилляцию (перегонку). Воду испаряют, а затем пары конденсируют в приёмнике. Полученная таким способом вода называется дистиллированной и применяется для приготовления лекарств, лабораторных растворов и т. д.
Строение воды
В молекуле воды — две ковалентные полярные связи O−H и две неподелённые электронные пары на атоме кислорода. Структурная формулы воды:
H−O|H
Электронная формула:
H:O….:H
Молекула воды имеет угловое строение. Угол между связями составляет \(104,5\)°. Молекула представляет собой диполь. В ней атом кислорода несёт отрицательный заряд, а атомы водорода — положительный:
Полярность молекул воды часто представляется упрощённо в виде эллипса с двумя полюсами:
Полярность молекулы воды оказывает сильное влияние на её физические и химические свойства.
Диполь — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Диполь — вода
Cтраница 1
Диполи воды имеют угловую форму, так как ядра атомов в них образуют равнобедренный треугольник. В основании его расположены два протона, а в вершине — ядро атома кислорода. При этом в молекуле воды две s / Я-гибридные орбитали атома кислорода образуют две ко-валентные связи О — Н ( длина которых около 0 1 нм) и остаются еще две неподеленные пары электронов. [2]
Диполи воды соединены с гидрофильными группами белков водородными связями. Учитывая явления гидратации, можно объяснить рассмотренный нами процесс высаливания белков из растворов. При прибавлении к раствору белка высоких концентраций солей или таких органических растворителей, как спирт или ацетон, возникает конкуренция за молекулы воды между солью или спиртом, с одной стороны, и молекулами белка — с другой. При определенных концентрациях ионы солей, молекулы спирта или ацетона связывают такое большое количество молекул воды, что несвязанной воды недостаточно для растворения белка, и он выпадает в осадок. [3]
Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер ионов, тем быстрее и легче они отрываются диполями воды от поверхности элементарных кристаллов. Связь между листочками в пачках нарушается, и глина распускается в воде. [4]
Диполи воды, поляризуясь, образуют оболочку вокруг капли ртути, которая мешает адсорбироваться на поверхности капли новым ионам деполяризатора и предельный ток будет поддерживаться только диффузией деполяризатора через водную оболочку. [6]
Если диполи воды ориентированы в поверхностном слое кристаллической решетки цементных минералов, то расстояния между поверхностными ионами практически не изменяются. [7]
Постепенно диполи воды проникают между ионами Na и С1 — в твердой фазе, отрывая их от кристалла. [9]
При этом диполи воды Б поверхностном слое ориентированы таким образом, что кислород обращен в сторону газовой фазы, а водород — в сторону соли. [10]
Окружающие кристаллик диполи воды сразу же ориентируются так, что их отрицательные полюса подходят к положительным ионам натрия, а положительные полюса — ближе к отрицательным ионам хлора. Таким образом, вокруг каждого иона поверхностного уровня кристалла образуется оболочка из молекул полярного растворителя — воды. Этот процесс называется сольватацией ( отлат. Если растворителем является вода, то такая сольватация называется гидратацией. [12]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, СО — две молекулы, NH — две молекулы, Nh3 — три молекулы. [13]
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, С О — две молекулы, NH — две молекулы, МН2 — три молекулы. [14]
Знак минус означает, что диполи воды обращены положительным концом наружу. [15]
Страницы: 1 2 3 4 5
Диполь — вода — Большая Энциклопедия Нефти и Газа, статья, страница 4
Диполь — вода
Cтраница 4
Неорганическое вещество ( твердая соль или ее концентрированный раствор), поступая в водный раствор газа, ионизируется, образуя ионы с положительным и отрицательным зарядами, которые притягивают к себе диполи воды, окружая при этом ионы. Молекулярная структура раствора при высоких концентрациях соли, постепенно приближается к структуре кристаллогидрата соли. Взаимодействие между диполями воды и ионами ингибитора носит электростатический характер, обладая при этом более сильным взаимодействием между молекулами газа и воды. Существующая при этом квазикристаллическая структура воды нарушается, и растворимость газа падает. Данное явление называется высаливанием и проявляется, когда полярности компонентов раствора отличаются. [46]
Так как диэлектрическая постоянная твердых частиц сильно отличается от диэлектрической постоянной воды, то при соприкосновении частиц грунта с водой возникает электрическое поле с избыточной энергией на поверхности частиц грунта и диполи воды притягиваются к поверхности минеральных частиц. [47]
При достижении критического солесодержания котловой воды на поверхности паровых пузырьков образуются проточные квазитвердые пленки, в создании которых участвуют коллоидные частицы определенной степени дисперсности ( окислы железа, соли жесткости), ионы солей и диполи воды. Эти пленки не позволяют пузырькам сливаться, в результате чего эмульсия состоит из большого количества мелких медленно всплывающих пузырьков, что и приводит к увеличению набухания уровня и образованию пены. Кроме того, увеличение давления внутри пузырьков, обусловленное уменьшением их диаметра, наряду с общим увеличением поверхности раздела фаз приводит к уменьшению размера капель влага, выбрасываемой в паровое пространство барабана, и общему увеличению ее количества. [48]
Согласно Б о р н у, чем меньше диаметр свободного иона, тем он сильнее гидратирован и следовательно тем больше диаметр гидратированного иона, так как электрическое поле сосредоточено в меньшем объеме и сильнее при-тйгивает диполи воды. [49]
При погружении куска металла в воду, в раствор должны переходить преимущественно ионы металла, так как они подвергаются не только кинетическому воздействию ударяющих о поверхность металла молекул воды, но и гидратации, которая облегчается как наличием положительного заряда, так и тем, что ориентированные по отношению к этому заряду диполи воды могут подойти к нему значительно ближе, чем к незаряженному атому. [51]
В случае использования водорастворимых КПАВ при насыщении двух обратноориентированных слоев ПАВ на электрохимических флокулах они смачиваются водой. Диполи воды ориентируются нормально к поверхности флокул, поэтому плотность воды в пленке повышена и структурная составляющая расклинивающего давления Па положительна. В результате этого, даже в случае резкого утончения водных прослоек, они все равно препятствуют слипанию пленочных флокул. [52]
Молекулы воды, ориентированные вокруг заряженной глинистой частицы, образуют пленку адсорбционно связанной водой, которая находится в ином физическом состоянии, чем капель-но-жидкая. Диполи воды, соприкасающиеся с поверхностью кристаллов, взаимодействуют с электрическими зарядами на этой поверхности и располагаются в определенном порядке, приближающемся к порядку расположения кислородных атомов на поверхности, вследствие чего структура слоя воды становится близкой к структуре данного кристалла. Толщина такого слоя ( нежидкой воды) изменяется от 1 до 10 нм и составляет от 4 до 40 молекулярных слоев. Пленка нежидкой воды, входящей в диффузный слой, обладает свойствами псевдотвердого тела. Она не способна увеличивать текучесть шлама и создает дополнительное сопротивление. [54]
Ионы кристалла взаимодействуют с дипольными молекулами воды: к ионам натрия молекулы воды притягиваются своими отрицательными полюсами, а к ионам хлора-положительными. Постепенно диполи воды проникают между ионами Na и СГ. В результате образуются свободные гидрати-рованные ионы натрия и хлора, которые и обеспечивают электропроводность водного раствора NaCl и другие свойства, характерные для жидкого электролита. [56]
Другая родственная адсорбции область поверхностных явлений была исследована акад. При адсорбции диполи воды в поверхностном слое ориентированы так, что кислород обращен в сторону газообразной фазы, а водород-в сторону соли. [57]
При высокочастотной сушке паковки помещаются в пространство между двумя электродами. Расположенные вначале хаотично диполи воды под действием токов высокой частоты ориентируются в пространстве в соответствии с электрическим полем, располагаясь перпендикулярно к электродам. Вследствие возникающего при этом трения нагревается материал, причем степень нагрева в данном случае зависит от диэлектрических характеристик волокна. [59]
Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов иа кристалла раствор. [60]
Страницы: 1 2 3 4 5

