Молекулы диполь — Справочник химика 21
Расстояния между электрическими центрами тяжести противоположных зарядов и величина этих зарядов у разных молекул различны, в связи с чем различна и их полярность, которая характеризуется дипольным моментом молекулы. Диполем называется система из двух одинаковых по величине разноименных электрических зарядов д, расположенных на некотором расстоянии I друг от друга. За меру полярности принимается величина дипольного момента х, который представляет собой произведение заряда д на расстояние I, т. е. 1 = д1. У неполярных молекул дипольный момент равен нулю, так как при совпадении электрических центров тяжести расстояние I между зарядами равно нулю. У полярных молекул дипольный момент больше нуля. [c.50]Индукционный эффект связан с процессами поляризации молекул диполями окружающей среды. При этом в неполярной молекуле центры тяжести положительных и отрицательных зарядов перестают совпадать. Возникает наведенный, или индуцированный, диполь. Подобное явление может наблюдаться и для полярных частиц. Тогда индукционный эффект накладывается на диполь-дипольное взаимодействие, в результате чего увеличивается взаимное притяжение. Индукционное взаимодействие возрастает с ростом электрического момента диполя и поляризуемости, быстро уменьшается пр>и увеличении расстояния. В то же время Е инд от температуры не зависит, так как наведение диполей происходит при любом пространственном расположении молекул.Более или менее ощутимое влияние индукционного взаимодействия наблюдается для частиц, обладающих сравнительно большой поляризуемостью.
Полярные и неполярные многоатомные молекулы. Диполи связей. Симметричные неполярные молекулы.
Дисперсионные силы (силы Лондона) — единственный источник энергии взаимодействия при растворении неполярных соединений в неполярных же растворителях, хотя они проявляются и в других случаях растворения. Обусловлены эти силы тем, что неполярные молекулы обладают виртуальными диполями, индуцирующими у других неполярных молекул диполи такого же рода. [c.170]
Силы притяжения между молекулами с насыщенными валентными связями могут иметь различную природу (природа этих связей еще мало изучена). Наиболее просто поддается количественному описанию сила взаимодействия (притяжение) между молекулами-диполями
Иначе протекает диссоциация полярных молекул (рис. 8.2). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов — поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы [c.234]
Частицы А и В только в первом приближении можно рассматривать как жесткие шары. На самом деле это молекулы, между которыми при сближении возникают силы притяжения, а при более тесном сближении— отталкивания. Если молекулы — диполи, то возникает диполь-дипольное взаимодействие. Если одна из частиц — ион, то сечение соударений больше л (гд + гв) если обе частицы — одноименно заряженные ионы, то, наоборот, сечение соударений меньше л (гд + Гв). Согласно кинетической теории газов
Ориентационное взаимодействие (эффект В. Кеезома, 1912) проявляется в случае полярных молекул (диполь-дипольное взаимодействие). Электростатическое вза- имодействие полярных молекул (рис. Ау [c.125]
Если молекула В не полярна, но способна к поляризации при контакте с молекулой-диполем А (рис. 11, б), то в ней возникает индуцированный (наведенный) диполь того же направления и с тем большим моментом, чем выше поляризуемость а. Энергия индукционного взаимодействия определяется равенством
Если электроотрицательность атомов, образующих молекулу, неодинакова, то связующая пара электронов смещается из симметричного положения в сторону более электроотрицательного атома. Следовательно, электронная пара становится более или менее односторонне оттянутой одним из соединяющихся атомов. Орбитали электронов этой пары остаются связанными с обоими ядрами. В результате такого частичного смещения, называемого поляризацией, центры тяжести электрических зарядов в молекуле не будут совпадать, между ними появится некоторое расстояние. Такая ковалентная связь называется полярной (рис. 11), а молекула — диполем.
Индукционный эффект связан с процессами поляризации молекул диполями окружающей среды. При этом в неполярной молекуле центры тяжести положительных и отрицательных зарядов перестают совпадать, так как электронное облако и ядро атома смещаются в противоположные стороны. Образуется наведенный или индуцированный диполь. Подобное явление может наблюдаться и для полярных частиц. Тогда индукционный эффект накладывается на диполь-дипольное взаимодействие, в результате чего увеличивается взаимное притяжение. Для двух одинаковых полярных молекул энергия индукционного взаимодействия может быть рассчитана по формуле (Дебай, 1920)
Свойство ассоциировать вообще присуще молекулам-диполям (рис. 79). Но ассоциация молекул воды происходит главным образом за счет водородных связей (см. гл. HI, 4, 10). [c.279]
Энергия индукционного взаимодействия между полярной и неполярной молекулами может быть вычислена исходя из представлений П. Дебая (1920), создавшего модель индуцирования (наведения) диполя в неполярной молекуле диполем полярной. Согласно этой модели энергию индукционного взаимодействия определяют из соотношения [c.349]
Для полярных молекул наряду с дисперсионным взаимодействием характерно диполь-дипольное, или ориентационное, взаимодействие При взаимодействии полярных молекул (диполей) с неполярными последние могут поляризоваться в поле диполей. Между постоянным и наведенным диполями возникают силы, называемые индукционными. Энергия дисперсионных Ои), ориентационных ( Уор) индукционных (СУ ) связей может быть оценена из соотношений.
Считается, что такое взаимодействие существенно только между молекулой-диполем в газовой фазе и поверхностью (твердой или жидкой), обладающей достаточным количеством свободных электронов. Энергию подобного взаимодействия с неионной поверхностью оце-
диполь — Dipole — qwe.wiki
Электромагнитные явления

В электромагнетизма , есть два вида вибраторов :
Диполи могут быть охарактеризованы по их дипольному моменту, величины вектора. Для простого электрического диполя , приведенного выше, электрический дипольный момент указывает от отрицательного заряда в сторону положительного заряда, и имеет величину , равную силе каждый раз заряда разделения между зарядами. (Чтобы быть точным: для определения дипольного момента, следует всегда рассматривать «дипольный предел», где, например, расстояние зарядов , генерирующих должны
Для текущего цикла, магнитный дипольный момент указывает через петлю ( в соответствии с правилу правой руки захвата ), с величиной , равной тока во времена цикла больше площади контура.
В дополнении к токовой петле, то электрон , среди других фундаментальных частиц , имеет магнитный дипольный момент. Это потому , что он генерирует магнитное поле , которое идентично тому, порожденной очень малой токовой петлей. Тем не менее, магнитный момент электрона не происходит из — за текущий цикл, но вместо этого внутреннего свойства электрона. Также возможно , что электрон имеет
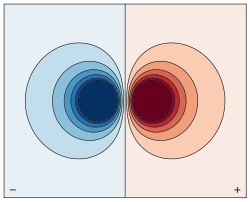 Контур график электростатического потенциала горизонтально ориентированной электрического диполя конечных размеров. Сильные цвета указывают на высокий и низкий потенциал (там , где противоположные заряды диполя расположены).
Контур график электростатического потенциала горизонтально ориентированной электрического диполя конечных размеров. Сильные цвета указывают на высокий и низкий потенциал (там , где противоположные заряды диполя расположены).Постоянный магнит, такие как стержневой магнит, обязан свой магнетизм собственного магнитные дипольного момента электрона. Два конца стержневого магнита называются полюсами (не следует путать с монополей ), и могут быть помечены «север» и «юг». С точки зрения магнитного поля Земли, они соответственно «север-искание» и «Юго-ищет» полюса: если магнит свободно подвешенный в магнитном поле Земли, ищущая север полюс будет указывать на север и юго- ищет полюс будет указывать на юг. Дипольный момент точек стержневого магнита от его магнитного юга к его магнитному северному полюсу . Северный полюс стержневого магнита в компасе севере точек. Тем не менее, это означает , что геомагнитный северный полюс Земли является
Единственные известные механизмы для создания магнитных диполей с помощью токовых петель или квантово-механического спина , так как существование магнитных монополей никогда не было продемонстрировано экспериментально.
Термин происходит от греческого δίς ( диса ), «дважды» и πόλος ( польос ), «ось».
классификация
 Электрические силовые линии двух противоположных зарядов, разделенных конечное расстояние.
Электрические силовые линии двух противоположных зарядов, разделенных конечное расстояние.  Магнитные силовые линии кольцевого тока конечного диаметра.
Магнитные силовые линии кольцевого тока конечного диаметра.  Полевые линии точечного диполя любого типа, электрические, магнитные, акустические и т.д.
Полевые линии точечного диполя любого типа, электрические, магнитные, акустические и т.д.Физические дипольный состоит из двух одинаковых и противоположных точечных зарядов: в буквальном смысле, два полюса. Его поле на больших расстояниях (то есть, расстояния велики по сравнению с разделением полюсов) почти полностью зависит от дипольного момента , как определено выше. Точка (электрический) дипольный является пределом , полученный, позволяя разделение , как правило, 0, сохраняя при этом дипольный момент фиксированной. Поле точечного диполя имеет особенно простую форму, а термин порядок-1 в мультипольном разложении именно точка дипольного поля.
Хотя нет никаких известных магнитных монополей в природе существует магнитные диполи в виде квантово-механического спина , связанный с частицами , такие как электроны (хотя точное описание таких эффектов выходит за пределы классического электромагнетизма). Теоретический магнитное точечный диполь имеет магнитное поле точно такой же форме, что и электрическое поле электрического точечного диполя. Очень небольшая токопроводящая петля примерно магнитная дипольная точка; магнитный дипольный момент такого цикла является произведением тока , протекающего в петле и (вектор) площади петли.
Любая конфигурация зарядов или токов имеет «дипольный момент», который описывает дипольное поле которого является наилучшим приближением, на больших расстояниях, к тому , что в данной конфигурации. Это просто один член в разложении мультипольного , когда суммарный заряд ( «монополь момент») 0- , как это всегда для магнитного случае, так как нет магнитных монополей. Диполь является доминирующим на больших расстояниях: Его поле убывает пропорционально 1 / г 3 , по сравнению с 1 / г 4 для следующего ( квадрупольного ) срока и более высокие степени 1 / г для высших членов, или 1 / г 2 на срок монопольного.
Молекулярные диполи
Многие молекулы имеют такие дипольные моменты из — за неравномерных распределений положительных и отрицательных зарядов на различных атомах. Так обстоит дело с полярными соединениями , такими как фтористый водород (HF), где плотность электронов является общим неодинаково между атомами. Поэтому дипольный Молекула является электрическим диполем с присущим электрическим полем , которое не следует путать с магнитным диполем , который генерирует магнитное поле.
Физикохимик Питер JW Дебая был первым ученым , чтобы изучить молекулярные диполи широко, и, как следствие, дипольные моменты измеряются в единицах , названных Дебаю в его честь.
Для молекул существует три типа вибраторов:
- Постоянные диполи
- Это происходит , когда два атома в молекуле имеет существенно различную электроотрицательность : один атом притягивает электроны больше , чем другие, становится все более отрицательным, в то время как другой атом становится более положительным. Молекула с постоянным дипольным моментом называется полярной молекулой. См диполь-дипольных достопримечательностей .
- Мгновенные диполи
- Это происходит из — за случайно , когда электроны случится быть более концентрированным в одном месте , чем другой в молекуле , создавая временный диполь. Эти диполи меньше по величине , чем постоянные диполи, но по- прежнему играют большую роль в химии и биохимии из — за их распространенность. См мгновенного диполя .
- Индуцированные диполи
- Это может произойти , если одна молекула с постоянным диполем отталкивает электроны другой молекулы, в индуцирующего дипольный момент в этой молекуле. Молекула поляризованная , когда она несет индуцированный диполь. См наведенного дипольного притяжения .
В более общем смысле , наведенный дипольный из любого поляризуемого распределения заряда р (напомним , что молекула имеет распределение зарядов) обусловлено электрическим полем внешнего по отношению к р . Это поле может, например, происходить из иона или полярной молекулы в окрестностях ρ или может быть макроскопическими (например, молекула между пластинами заряженного конденсатора ). Размер индуцированного дипольного момента равен произведению силы внешнего поля и дипольная поляризуемость от р .
Дипольные значения момента могут быть получены из измерения диэлектрической проницаемости . Некоторые типовые значения газовой фазы в дебаевских единицах являются:
 Линейная молекула СО 2 имеет нулевой диполь как два диполя облигаций отмены.
Линейная молекула СО 2 имеет нулевой диполь как два диполя облигаций отмены.Калий бромид (KBr) имеет одну из самых высоких дипольных моментов , поскольку он представляет собой ионное соединение , которое существует в виде молекулы в газовой фазе.
Согнуты молекулы Н 2 О имеет чистый диполь. Два диполи облигаций не отменяют.Общий дипольный момент молекулы может быть аппроксимирована в виде векторной суммы из связей дипольных моментов . В качестве векторной суммы зависит от относительной ориентации связей, так что из информации дипольного момента может быть выведено о молекулярной геометрии .
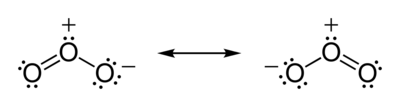
Например, нулевой дипольные СО 2 означает , что две С = О дипольных моментов связи отменить , так что молекула должна быть линейной. Для H 2 O моменты O-H связей не отменяют , потому что молекула сгибается. Для получения озона (O 3 ) , который также является согнуты молекулы, связь дипольных моментов не равны нулю , даже при том , что О-O облигаций между аналогичными атомами. Это согласуется со структурами Льюиса для резонансных форм озона , которые показывают положительный заряд на центральном атоме кислорода.
Цис — изомер, дипольный момент 1,90 Д
Транс — изомер, дипольный момент равен нулю
Пример в органической химии роли геометрии в определении дипольного момента является цис и транс — изомеров из 1,2-дихлорэтен . В цис — изомера двух полярных связей С-Cl находятся на одной и той же стороне двойной св зи С = С и дипольного момента молекулярного является 1.90 Д. В транс — изомера, дипольный момент равен нулю , так как два С-Cl облигации на противоположных сторонах C = C и отменить (и два момента облигаций для гораздо менее полярных с-Н — связей и отмена).
Другим примером роли молекулярной геометрии является трифторид бора , который имеет три полярные связи с разницей в электроотрицательности больше , чем традиционно цитируемого порог 1.7 для ионной связи . Однако, в связи с равносторонним треугольным распределением ионов фтора о катионном центре боры, молекула в целом не обладает каким — либо идентифицируемым полюсом: один не может построить плоскость , которая делит молекулы в чистую отрицательную часть и чистую положительную часть.
Квантовомеханический оператор дипольного
Рассмотрим набор N частиц с зарядами д я и векторы положения R I . Например, эта коллекция может быть молекула , состоящая из электронов, все с зарядом — е , и ядер с зарядом Ez я , где Z я является атомным номером от I — го ядра. Дипольный наблюдаемая (физическая величина) имеют квантово — механический оператор дипольный :
- пзнак равноΣязнак равно1NQяря,{\ Displaystyle {\ mathfrak {р}} = \ сумма _ {я = 1} ^ {N} \, q_ {я} \, \ mathbf {г} _ {я} \ ,.}
Обратите внимание на то, что это определение справедливо только для незаряженных диполей, т.е. суммарный заряд, равный нулю. Для заряженного диполя мы имеем следующее уравнение:
- пзнак равноΣязнак равно1NQя(ря-рс),{\ Displaystyle {\ mathfrak {р}} = \ сумма _ {я = 1} ^ {N} \, q_ {я} \, (\ mathbf {г} _ {я} — \ mathbf {г} _ {с }) \ ,.}
где находится центр массы молекулы / групп частиц. рс{\ Displaystyle \ mathbf {г} _ {с}}
Атомные диполи
Невырожденный ( S -state) атом может иметь только нулевой постоянный диполь. Этот факт следует квантовомеханически из инверсионной симметрии атомов. Все 3 компоненты оператора дипольного антисимметричны при инверсии относительно ядра,
- япя-1знак равно-п,{\ Displaystyle {\ mathfrak {Я}} \; {\ mathfrak {р}} \; {\ mathfrak {Я}} ^ {- 1} = — {\ mathfrak {р}}}
где дипольный оператор , а оператор инверсии. п{\ Displaystyle {\ mathfrak {р}}}я{\ Displaystyle {\ mathfrak {I}}}
Постоянный дипольный момент атома в невырожденном состоянии (см вырожденного уровня энергии ) определяются как ( в среднем) среднего значение оператора дипольного,
- ⟨п⟩знак равно⟨S|п|S⟩,{\ Displaystyle \ влево \ Лангле {\ mathfrak {р}} \ право \ rangle = \ влево \ Лангле \ S \, | {\ mathfrak {р}} | \, S \, \ правый \ rangle}
где представляет собой S -state, невырожденной, волновая функция, которая является симметричной или антисимметричной относительно инверсии: . Так как произведение волновой функции (в кет) и комплексно сопряженное (в бюстгальтере) всегда симметрична относительно инверсии и его обратного, |S⟩{\ Displaystyle | \, S \, \ rangle}я|S⟩знак равно±|S⟩{\ Displaystyle {\ mathfrak {I}} \, | \, S \, \ rangle = \ ч | \, S \, \ rangle}
- ⟨п⟩знак равно⟨я-1S|п|я-1S⟩знак равно⟨S|япя-1|S⟩знак равно-⟨п⟩{\ Displaystyle \ влево \ Лангле {\ mathfrak {р}} \ право \ rangle = \ влево \ Лангле \ {\ mathfrak {I}} ^ {- 1} \, S \, | {\ mathfrak {р}} | \, {\ mathfrak {I}} ^ {- 1} \, S \, \ право \ rangle = \ влево \ Лангле \ S \, | {\ mathfrak {I}} \, {\ mathfrak {р} } \ {\ mathfrak {I}} ^ {- 1} | \, S \, \ право \ rangle = — \ влево \ Лангле {\ mathfrak {р}} \ право \ rangle}
отсюда следует , что изменение значения ожидания знак при инверсии. Мы использовали здесь тот факт , что , будучи оператором симметрии, является унитарным : и по определению , сопряженный Эрмитова может быть перемещены из бюстгальтера на KET , а затем становится . Так как только количество, равное минус само по себе является нулевым, значение ожидания равно нулю, я{\ Displaystyle {\ mathfrak {I}}}я-1знак равноя*{\ Displaystyle {\ mathfrak {I}} ^ {- 1} = {\ mathfrak {I}} ^ {*} \}я*{\ Displaystyle {\ mathfrak {I}} ^ {*} \}я**знак равноя{\ Displaystyle {\ mathfrak {I}} ^ {**} = {\ mathfrak {I}} \}
- ⟨п⟩знак равно0.{\ Displaystyle \ влево \ Лангле {\ mathfrak {р}} \ право \ rangle = 0.}
В случае атомов открытой оболочки с вырожденными уровнями энергии, можно было бы определить дипольный момент от помощи первого порядка эффекта Штарка . Это дает неисчезающем диполь (по определению пропорционален неисчезающий первый порядок Старк сдвига) только тогда , когда некоторые из волновых функций , принадлежащих к вырожденным энергиям имеют противоположную четность ; т.е. имеют различное поведение при инверсии. Это редкое явление, но бывает в возбужденном H-атома, где 2s и 2р — состояний являются «случайно» вырожденными (см статью Лапласа-Рунге-Ленца вектор для возникновения этого вырождения) и имеют противоположную четность (2s даже и 2p нечетно).
Область статического магнитного диполя
величина
Силы дальнего поля, B , дипольного магнитного поля дается
- В(м,р,λ)знак равноμ04πмр31+3грех2(λ),{\ Displaystyle В (т, г, \ лямбда) = {\ гидроразрыва {\ му _ {0}} {4 \ пи}} {\ гидроразрыва {т} {г ^ {3}}} {\ SQRT {1+ 3 \ грех ^ {2} (\ Lambda)}} \ ,,}
где
- В это напряженность поля, измеренная в тесле
- г является расстояние от центра, измеряется в метрах
- λ представляет магнитную широту (равную 90 ° — θ ) , где θ магнитная коширота, измеренная в радианах или градусах от оси диполя
- м дипольный момент, измеренный в ампер -квадрат метров или джоулей на тесла
- μ 0 является проницаемость свободного пространства , измеряется в генри на метр.
Преобразование в цилиндрических координатах достигается с помощью г 2 = г 2 + ρ 2 и
- λзнак равноагсзш(ZZ2+ρ2){\ Displaystyle \ Lambda = \ агсзш \ влево ({\ гидроразрыва {г} {\ SQRT {г ^ {2} + \ Rho ^ {2}}}} \ справа)}
где ρ представляет собой перпендикулярное расстояние от г оси х. Затем,
- В(ρ,Z)знак равноμ0м4π(Z2+ρ2)321+3Z2Z2+ρ2{\ Displaystyle В (\ Rho, г) = {\ гидроразрыва {\ му _ {0} т} {4 \ р \ слева (г ^ {2} + \ Rho ^ {2} \ справа) ^ {\ гидроразрыва { 3} {2}}}} {\ SQRT {1 + {\ гидроразрыва {3z ^ {2}} {г ^ {2} + \ Rho ^ {2}}}}}}
Вектор форма
Само поле является векторной величиной:
- В(м,р)знак равноμ04π(3(м⋅р^)р^-мр3)+2μ03мδ3(р){\ Displaystyle \ mathbf {B} (\ mathbf {т}, \ mathbf {г}) = {\ гидроразрыва {\ му _ {0}} {4 \ пи}} \ влево ({\ гидроразрыва {3 (\ mathbf {т} \ CDOT {\ шлем {\ mathbf {г}}}) {\ шлем {\ mathbf {г}}} — \ mathbf {т}} {г ^ {3}}} \ справа) + {\ гидроразрыва {2 \ му _ {0}} {3}} \ mathbf {т} \ дельта ^ {3} (\ mathbf {г})}
где
- В этом поле
- г есть вектор из положения диполя в положение , где поле измеряется
- г абсолютная величина г : расстояние от диполя
- г = г / г единичный вектор , параллельный г ;
- м является (вектор) дипольный момент
- μ 0 является проницаемость свободного пространства
- δ 3 представляет собой трехмерную дельта — функция .
Это именно то поле точечного диполя, именно этот термин диполя в мультипольном разложении произвольного поля, и приблизительно поле любого типа дипольной конфигурации на больших расстояниях.
Магнитный векторный потенциал
Векторный потенциал магнитного диполя
- A(р)знак равноμ04πм×р^р2{\ Displaystyle \ mathbf {A} (\ mathbf {г}) = {\ гидроразрыва {\ му _ {0}} {4 \ пи}} {\ гидроразрыва {\ mathbf {т} \ раз {\ шлем {\ mathbf {г}}}} {г ^ {2}}}}
с теми же определениями, как указано выше.
Поле от электрического диполя
Электростатический потенциал в позиции г из — за электрический диполь в начале координат определяются по формуле:
- Φ(р)знак равно14πε0п⋅р^р2{\ Displaystyle \ Phi (\ mathbf {г}) = {\ гидроразрыва {1} {4 \ р \ varepsilon _ {0}}} \, {\ гидроразрыва {\ mathbf {р} \ CDOT {\ шлем {\ mathbf {г}}}} {г ^ {2}}}}
где
- р^{\ Displaystyle {\ Шляпа {\ mathbf {г}}}}единичный вектор в направлении г , р представляет собой (вектор) дипольный момент , а ε 0 является диэлектрической проницаемостью свободного пространства .
Этот термин появляется в качестве второго члена в мультипольном разложении произвольной электростатического потенциала Ф ( г ). Если источник Ф ( г ) является дипольным, так как предполагаются , здесь, этот термин является единственным неисчезающим членом в мультипольном разложении Ф ( г ). Электрическое поле от диполя может быть найдено из градиента этого потенциала:
- Езнак равно-∇Φзнак равно14πε0(3(п⋅р^)р^-пр3)-13ε0пδ3(р){\ Displaystyle \ mathbf {E} = — \ набла \ Phi = {\ гидроразрыва {1} {4 \ р \ эпсилон _ {0}}} \ влево ({\ гидроразрыва {3 (\ mathbf {р} \ CDOT { \ шлем {\ mathbf {г}}}) {\ шлем {\ mathbf {г}}} — \ mathbf {р}} {г ^ {3}}} \ справа) — {\ гидроразрыва {1} {3 \ эпсилон _ {0}}} \ mathbf {р} \ дельта ^ {3} (\ mathbf {г})}
где Е представляет собой электрическое поле , и δ 3 представляет собой 3-мерной дельта — функцией . Это формально совпадает с магнитным H поля точечного магнитного диполя лишь несколько имен изменились.
Крутящий момент на диполь
Поскольку направление в электрическом поле определяются как направление силы , действующие на положительный заряд, электрические силовые линии направлены от положительного заряда и к отрицательному заряду.
При помещении в электрическом или магнитном поле , равные , но противоположные силы возникают на каждой стороне диполя , создающий крутящий момент т }:
- τзнак равноп×Е{\ Displaystyle {\ boldsymbol {\ тау}} = \ mathbf {р} \ раз \ mathbf {Е}}
для электрических дипольного момента р (в кулоновских метрах), или
- τзнак равном×В{\ Displaystyle {\ boldsymbol {\ тау}} = \ mathbf {т} \ раз \ mathbf {B}}
для магнитного дипольного момента м (в ампер-квадратных метров).
В результате чего крутящий момент будет иметь тенденцию выравнивания диполь с приложенным полем, которое в случае электрического диполя, дает потенциальную энергию
- Uзнак равно-п⋅Е{\ Displaystyle U = — \ mathbf {р} \ CDOT \ mathbf {Е}},
Энергия магнитного диполя аналогично
- Uзнак равно-м⋅В{\ Displaystyle U = — \ mathbf {т} \ CDOT \ mathbf {B}},
Диполь излучение
В дополнении к диполям в электростатиках, это также общее рассматривать электрический или магнитный диполь , который осциллирующий во время. Это расширение, или более физический следующий шаг, чтобы сферической волны излучения.
В частности, рассмотрим гармонически осциллирующий электрический диполь, с угловой частотой со и дипольным моментом р 0 по Z направлению форме
- п(р,T)знак равноп(р)е-яωTзнак равноп0Z^е-яωT,{\ Displaystyle \ mathbf {р} (\ mathbf {г}, т) = \ mathbf {р} (\ mathbf {г}) е ^ {- я \ Omega T} = р- {0} {\ шлем {\ mathbf {г}}} е ^ {-. я \ Omega т}}
В вакууме, точное поле , создаваемое этим колеблющегося диполь может быть получено с использованием запаздывающего потенциала композиции , как:
- Езнак равно14πε0{ω2с2р(р^×п)×р^+(1р3-яωср2)(3р^[р^⋅п]-п)}еяωрсе-яωTВзнак равноω24πε0с3(р^×п)(1-сяωр)еяωр/сре-яωT,{\ Displaystyle {\ начинаются {выровнен} \ mathbf {Е} & = {\ гидроразрыва {1} {4 \ р \ varepsilon _ {0}}} \ слева \ {{\ гидроразрыва {\ Omega ^ {2}} { с ^ {2} г}} \ влево ({\ шлем {\ mathbf {г}}} \ раз \ mathbf {р} \ справа) \ раз {\ шлем {\ mathbf {г}}} + \ слева ({ \ гидроразрыва {1} {R ^ {3}}} — {\ гидроразрыва {я \ Omega} {сг ^ {2}}} \ справа) \ влево (3 {\ шлем {\ mathbf {г}}} \ слева [{\ шлем {\ mathbf {г}}} \ CDOT \ mathbf {р} \ право] — \ mathbf {р} \ справа) \ вправо \} е ^ {\ гидроразрыва {я \ Omega г} {C}} е ^ {- я \ Omega T} \\\ mathbf {B} = {& \ гидроразрыва {\ Omega ^ {2}} {4 \ пи \ varepsilon _ {0} с ^ {3}}} ({\ шлем {\ mathbf {г}}} \ раз \ mathbf {р}) \ влево (1 — {\ гидроразрыва {C} {я \ Omega R}} \ вправо) {\ гидроразрыва {е ^ {я \ Omega г / с }} {г}} {е ^ -. я \ Omega T} \ {конец выровнен}}}
Для rω / с »1, в дальнем поле имеет более простую форму излучающей«сферической»волны, но с угловой зависимостью , встроенной в поперечном продукте:
- Взнак равноω24πε0с3(р^×п)еяω(р/с-T)рзнак равноω2μ0п04πс(р^×Z^)еяω(р/с-T)рзнак равно-ω2μ0п04πсгрех(θ)еяω(р/с-T)рφ^Езнак равносВ×р^знак равно-ω2μ0п04πгрех(θ)(φ^×р^)еяω(р/с-T)рзнак равно-ω2μ0п04πгрех(θ)еяω(р/с-T)рθ^,{\ Displaystyle {\ начинаются {выровнены} \ mathbf {B}, & = {\ гидроразрыва {\ Omega ^ {2}} {4 \ р \ varepsilon _ {0} с ^ {3}}} ({\ шлем {\ mathbf {г}}} \ раз \ mathbf {р}) {\ гидроразрыва {е ^ {я \ Omega (г / кт)}} {г}} = {\ гидроразрыва {\ Omega ^ {2} \ му _ { 0} р- {0}} {4 \ пи с}} ({\ шлем {\ mathbf {г}}} \ раз {\ шлем {\ mathbf {Z}}}) {\ гидроразрыва {е ^ {я \ Omega (г / кт)}} {г}} = — {\ гидроразрыва {\ Omega ^ {2} \ му _ {0} р- {0}} {4 \ пи с}} \ Sin (\ тета) {\ гидроразрыва {е ^ {я \ Omega (г / Ct)}} {г}} \ mathbf {\ {шлем \ Phi}} \\\ mathbf {е} & = с \ mathbf {B}, \ раз {\ {шлем \ mathbf {г}}} = — {\ гидроразрыва {\ Omega ^ {2} \ му _ {0} р- {0}} {4 \ пи}} \ Sin (\ тета) \ влево ({\ шлем {\ Phi }} \ раз \ mathbf {\ шлем {г}} \ справа) {\ гидроразрыва {е ^ {я \ Omega (г / кт)}} {г}} = — {\ гидроразрыва {\ Omega ^ {2} \ му _ {0} р- {0}} {4 \ пи}} \ Sin (\ тета) {\ гидроразрыва {е ^ {я \ Omega (г / кт)}} {г}} {\ шлем {\ тета} }. \ {конец выровнен}}}
Усредненный по времени вектор Пойнтинга
- ⟨S⟩знак равно(μ0п02ω432π2с)грех2(θ)р2р^{\ Displaystyle \ Лангле \ mathbf {S} \ rangle = \ влево ({\ гидроразрыва {\ му _ {0} р- {0} ^ {2} \ Omega ^ {4}} {32 \ пи ^ {2} с }} \ справа) {\ гидроразрыва {\ грешить ^ {2} (\ Theta)} {г ^ {2}}} \ mathbf {\ шляпа {г}}}
не распределены изотропно, но сконцентрированы вокруг направлений , лежащих перпендикулярно к дипольного момента, в результате несферических электрических и магнитных волн. В самом деле, сферическая гармоника функции (син θ ) отвечает за такой тороидальной угловое распределение именно л = 1 «р» волны.
Общее время средней мощность, излучаемое поле, то может быть получена из вектора Пойнтинга как
- пзнак равноμ0ω4п0212πс,{\ Displaystyle Р = {\ гидроразрыва {\ му _ {0} \ Omega ^ {4} р- {0} ^ {2}} {12 \ пи с}}.}
Обратите внимание на то, что зависимость мощности от четвертой степени частоты излучения в соответствии с рассеянием Рэлея и основные эффекты , почему небо состоит преимущественно синего цвета.
Круговой поляризованный диполь описывается в виде суперпозиции двух линейных диполей.
Смотрите также
Заметки
Рекомендации
внешняя ссылка
Молекула дипольный момент — Справочник химика 21
Расстояния между электрическими центрами тяжести противоположных зарядов и величина этих зарядов у разных молекул различны, в связи с чем различна и их полярность, которая характеризуется дипольным моментом молекулы. Диполем называется система из двух одинаковых по величине разноименных электрических зарядов д, расположенных на некотором расстоянии I друг от друга. За меру полярности принимается величина дипольного момента х, который представляет собой произведение заряда д на расстояние I, т. е. 1 = д1. У неполярных молекул дипольный момент равен нулю, так как при совпадении электрических центров тяжести расстояние I между зарядами равно нулю. У полярных молекул дипольный момент больше нуля. [c.50]Полярные молекулы. Дипольные моменты [c.99]
Дипольный момент характеризует расположение зарядов в молекуле дипольный момент тем больше, чем меиее симметрично расположение зарядов. Поскольку носителями зарядов в молекуле могут быть отдельные полярные группы, например группы N02, ОН, или отдельные атомы и ионы, например С1, Вг, I, величина дипольного момента связана с положением этих групп, атомов пли ионов в молекуле. Отдельным полярным группам, входящим в состав молекулы, можно приписать определенные значения дипольного момента. Так, дипольные моменты предельных одноатомных спиртов примерно одинаковы, как это видно из следующих данных. [c.410]
У атомов и полярных молекул дипольный момент возникает при действии электрического поля. Действительно, в электрическом поле ядра и электронные оболочки смещаются в разных направлениях и средние координаты положительного и отрицательного зарядов перестают совпадать, т. е. у частицы возникает электрический диполь. Величина наведенного дипольного момента (Ре)нав пропорциональна силе, действующей на электрические заряды частицы, [c.83]
Полярность. Дипольный момент возникает в том случае, если электрический центр связи не совпадает с центром масс. Полярность определяют как величину дипольного момента, выраженную в дебаях. Однако на практике к полярным относят лишь те молекулы, дипольный момент которых превышает 1 Д, поскольку некоторые характерные особенности полярных соединений при более низких величинах дипольного момента не проявляются. Данные о дипольных моментах некоторых веществ представлены в табл. 1.7 и приложении Г. [c.34]
Результирующий динольный момент молекулы является векторной суммой динольных моментов всех связей. Аддитивная векторная модель дает возможность выяснения пространственной структуры молекул. Дипольные моменты связей в молекулах углеводородов имеют следующие значения 0,4 О —С—II, -СНз) 1,58Д(0—Н) 1,6б1)(—К—Н) 0,12Д(С—О) [113]. [c.63]
Низкая реакционная способность молекул азота N2 при обычных условиях связана с большой энергией диссоциации и возбуждения молекул N2, с отсутствием мультиплетного расщепления наиболее глубокого энергетического состояния молекулы, дипольного момента и парамагнетизма, а также с малыми массами и зарядами азотных ядер. [c.361]
В пользу этой формулы свидетельствует наличие у молекулы дипольного момента, 1,00 направление его определено в результате исследования дипольных моментов производных. [c.82]
Полярные молекулы обычно обладают структура молекул дипольным моментом, отличным от нуля. Из-мерение дипольных моментов имеет большое значение для характеристики свойств молекул и установления полярной структуры их. Молекулы, построенные симметрично, обладают дипольным моментом, равным нулю, даже в том случае, если отдельные связи между атомами в молекуле полярны. Например, в молекуле СОг две двойные связи углеродного атома располагаются симметрично, на одной прямой, О = С = О. Несмотря на то, что каждая из связей С = 0 обладает некоторой полярностью, молекула в целом оказывается неполярной ( .1 = 0) ввиду полной взаимной компенсации дипольных моментов. [c.31]
В многоатомной молекуле дипольный момент равен геометрической сумме дипольных моментов отдельных связей. Следовательно, дипольный момент является вектором с направлением от отрицательного к положительному полюсу. Так, дипольный момент связи ОН равен 1,58 О, тогда как для Н2О дипольный момент 1,84 О. Несмотря на относительно большой дипольный момент связи С=0 (ц = 2,7 О), дипольный момент молекулы СО2 равен нулю при валентном угле 180° векторы дипольных моментов [c.116]
Подобное поведение наблюдается и во многих других случаях. Значит, дипольный момент молекул существенно влияет на энергию межмолекулярного взаимодействия. Иначе свойства жидкости не замечали бы имеют или не имеют молекулы дипольный момент. Природа влияния дипольного момента молекул следующая. [c.37]
Характерно, что изоэлектронные линии рис. 173 имеют более плавный ход, чем на рис. 172, что свидетельствует о большом проявлении индивидуальности в случае окислов ВеО и СО. Для ВеО это отклонение от плавности в сторону уменьшения прочности связи приписать необходимости возбуждения валентности закрытого атома Ве, который не имеет в основном состоянии непарных электронов. Для СО, имеющего отклонение в сторону упрочнения связи, возможно объяснение в свете осуществления донорно-акцепторной л-связи, приводящей к появлению в молекуле дипольного момента и, может быть, частичного использования d-электронного состояния, а также влияния корреляций движения электронов. [c.311]
Изменение электронной структуры атомов и молекул при переходе из основного в В. с. приводит к изменению их геометрии, т.е. равновесных расстояний между атомами в молекулах, дипольных моментов и поляризуемости, хим. св-в. Электронные B. . могут быть стабильными или диссоциативными (нестабильными). Для первых характерно наличие полного минимума на поверхности потенциальной энергии, для вторых-монотонное понижение энергии при увеличении расстояния между к.-л. атомами или атомными группами. Изменение структуры молекулы при переходе в B. . можно проиллюстрировать на примере формальдегида. Его основное состояние является плоским, длина связи С—О составляет 0,122 нм. Синглетное и триплетное п,п В. с.-пирамидальные с углом между С—О связью и плоскостью СН J-группы 20 и 35 соотв. длина С—О связи увеличивается до 0,132 и 0,131 нм дипольный момент молекулы в основном состоянии 2,30, в возбужденном синглетном-1,60. [c.409]
диполь — это… Что такое молекула-диполь?
- молекула-диполь
молекула-диполь, молекулы-диполя
Слитно или раздельно? Орфографический словарь-справочник. — М.: Русский язык. Б. З. Букчина, Л. П. Какалуцкая. 1998.
- молекула-акцептор
- молекула-изомер
Смотреть что такое «молекула-диполь» в других словарях:
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
ДИПОЛЬ — ДИПОЛЬ, молекула с разделенным электрическим зарядом. В КОВАЛЕНТНОЙ СВЯЗИ между двумя атомами пары электронов не обязательно равномерно распределены между атомами. В хлориде водорода (НСl) электроны притягиваются к атому хлора, имеющему больший… … Научно-технический энциклопедический словарь
МОЛЕКУЛА — (от лат. molecula маленькая частица), наименьшая частица вещества, сохраняющая все его химич. свойства. М. является пределом раздробления вещества как такового: при попытках дальнейшего измельчения М. должны разделиться на свои составные части… … Большая медицинская энциклопедия
Молекула — Схема ковалентных связей между атомами в молекуле кислорода … Википедия
Двухатомная молекула — Компьютерное представление Молекулы Азота N2 Двухатомная молекула молекула, составленная из двух атомов одного или разных элементов. Атомы связаны при помощи ковалентной связи. Всего восемь элементов могут существовать в в … Википедия
Комбинационное рассеяние света — Атомно силовой микроскоп со спектрометром, позволяющие изучать комбинационное рассеяние Комбинационное рассеяние света (эффект Рамана) неупругое рассеяние оптического излучения на молекулах вещества (твёрдого, жидкого или газообразного),… … Википедия
ПЕРЕНОС ЭНЕРГИИ — совокупность безызлучат. процессов в в ве, при которых энергия электронного возбуждения передаётся от возбуждённой ч цы (молекулы, атома, иона) к невозбуждённой, находящейся от первой на расстоянии, меньшем длины волны возбуждающего излучения. П … Физическая энциклопедия
ван-дер-ваальсово взаимодействие — Термин ван дер ваальсово взаимодействие Термин на английском van der Waals interaction Синонимы van der Waals force Аббревиатуры Связанные термины клатрат, протеомика, самособирающиеся монослои, супрамолекулярная химия, нанодиапазон,… … Энциклопедический словарь нанотехнологий
КОНФОРМАЦИОННЫЙ АНАЛИЗ — раздел стереохимии, изучающий конформации молекул, их взаимопревращения и зависимость физ. и хим. св в от конформац. характеристик. Конформации молекулы разл. пространств. формы молекулы, возникающие при изменении относит. ориентации отдельных ее … Химическая энциклопедия
СПЕКТРОСКОПИЯ — раздел физики, посвященный изучению спектров электромагнитного излучения. Здесь мы рассмотрим оптическую спектроскопию часто называют просто спектроскопией. Свет это электромагнитное излучение с длиной волны l от 10 3 до 10 8 м. Этот диапазон… … Энциклопедия Кольера
Дипольные молекулы — Справочник химика 21
Все галогеноводороды хорошо растворимы в воде. Водные растворы их обладают кислотными свойствами и носят название галогеноводородных кислот. Объясняется это сильной полярностью связей Н — Г, приводящей к диссоциации под действием дипольных молекул воды по этой связи НГ + (п + т) Нр -> Н+ пИЛ + Г- тН О = НЧ- Г. [c.63]Твердые вещества, при растворении которых в воде и других полярных растворителях, образуются электролиты, являются, как правило, кристаллическими телами, имеющими ионные или близкие к ионным решетки. В чисто ионных решетках не существует молекул вещества, и кристалл любой величины можно рассматривать как одну огромную молекулу. Ионы противоположных знаков, составляющие такую решетку, связаны между собой большими электростатическими силами. При переходе ионов Е раствор, энергии электростатического взаимодействия ионов в решетке противопоставляется энергия взаимодействия ионов с дипольными молекулами растворителя, который втягивает ионы решетки в раствор. При этом ионы окружаются молекулами растворителя, образующими вокруг иона сольватную (в частном случае — гидратную) оболочку. Энергия взаимодействия ионов различных знаков, перешедших в раствор и окруженных сольватными оболочками, уменьшается по сравнению с энергией их взаимодействия в решетке (при равных расстояниях г между ионами) обратно пропорционально диэлектрической проницаемости растворителя О в соответствии с законом Кулона [c.391]
Дипольные молекулы таких веществ, как, например, органические галоидопроизводные, эфиры, кетоны, нитросоединения и другие, будут притягиваться электростатическим полем, суще- [c.36]
Ориентированная адсорбция незаряженных полярных или поляризуемых частиц на границе раздела фаз с образованием двойного электрического слоя в пределах одной фазы адсорбция молекул воды (рис. 106, э) на металле ориентация дипольных молекул у поверхности раздела жидкость —газ (рис. 106, и) — адсорбционный потенциал. [c.150]
Взаимодействие дипольных молекул растворителя с элементами кристаллической решетки может привести к образованию электролита даже при растворении веществ, имеющих молекулярную решетку, решетку промежуточного типа или находя щихся в газообразном состоянии» (атомы в молекулах газа связаны ковалентно). [c.392]
Каждое вещество в данном растворителе и при данных условиях характеризуется определенной степенью ионизации. Степенью ионизации вещества в растворе называется отношение числа ионизированных молекул к общему числу растворенных. Степень ионизации в основном определяется электроно-донорными и электроно-акцеп-торными свойствами растворенного вещества и растворителя. Для многих соединений наиболее сильно ионизирующими растворителями являются вода, жидкие аммиак и фторид водорода. Эти соединения состоят из дипольных молекул и склонны к донорно-акцепторному взаимодействию и образованию водородной связи. Например, НС1 хорошо ионизируется в воде, что связано с превращением водородной связи НаО- -H l в донорно-акцепторную [НгО—Н] + [c.161]
Поверхность твердого вещества всегда заряжена, хотя часто по совершенно разным причинам благодаря тому, что она образована ионами, входящими в состав твердого вещества, вследствие ориентированной адсорбции дипольных молекул или ионов, или же, наоборот, вследствие, ухода с нее ионов одного знака в окружающую среду (раствор), или, наконец, в результате эмиссии или присоединения электронов под влиянием тех или иных условий, включая все виды воздействий, вызывающих появление статического электричества. Чистая поверхность слюды, например, заряжена положительно, так как она образована ионами К+, а поверхность каолинита, построенная из ионов кислорода или гидроксила — отрицательно. Адсорбция противоположно заряженных ионов может нейтрализовать заряд поверхности или изменить его знак. При адсорбции кислорода на металлах образуется полярная связь М — О, причем кислородная поверхность приобретает отрицательный заряд, а примыкающий слой атомов металла — положительный. Адсорбция воды на металлах вызывает противоположный эффект на поверхности образуется двойной электрический слой, обращенный к окружающей среде слоем не отрицательных, а положительных зарядов. [c.113]
Сложность точных математических решений затрудняет применение электростатической теории к более концентрированным растворам, но она развивается в этом направлении. Основным недостатком электростатической теории является то, что почти не учитывается взаимодействие ионов с молекулами растворителя. Использование диэлектрической проницаемости как макроскопической характеристики раствора не позволяет учесть электрическое взаимодействие ионов с дипольными молекулами растворителя на малых расстояниях. Этот недостаток также ограничивает применимость теории Дебая — Гюккеля областью разбавленных растворов, в которых взаимодействие каждого иона с молекулами растворителя проявлено полностью и остается практически неизменным при дальнейшем уменьшении концентрации (разбавлении). [c.416]
При деформации вязкопластичных диэлектрических материалов, содержащих дипольные молекулы, может наблюдаться мозаичное распределение зарядов. Оно объясняется тем, что макромолекулы, которые обычно содержат много полярных групп, обладающих дипольными моментами, не могут перемещаться как единый диполь. Дипольные моменты полярных групп могут ориентироваться вдоль их осей, и, таким образом, представленная схема может иметь смысл. [c.133]
Подбираемые эмпирически величины а уравнения (XVI, 49) обычно имеют значения одного порядка с диаметром ионов в кристаллических решетках, но часто они больше этих диаметров, иногда меньше или даже отрицательны. Для учета поляризации дипольных молекул растворителя вокруг ионов растворен- [c.414]
Технические неполярные жидкости представляют собой растворы полярных молекул и ионов в неполярной среде. Концентрация полярных молекул может меняться в зависимо сти от химической природы и степени очистки жидкости. Указанные технические жидкости можно считать разбавленными растворами полярных молекул, наличие которых в техническом масле МВП, бензине Б-70 установлено в связи с уменьшением диэлектрической проницаемости жидкостей после обработки силикагелем. Уменьшение содержания дипольных молекул, например в жидкостях, прошедших очистку, не было обнаружено, вероятно, из-за недостаточной [c.26]
В неполярной среде ион отличается значительным дальнодействием по сравнению с полярными жидкостями в отличие от водных растворов, где ион полностью нейтрализуется полярными молекулами, в неполярной среде происходит лишь частичная компенсация его заряда вследствие малого содержания дипольных молекул и, по-вндимому, из-за сложного строения дифильных молекул. Носители тока в неполярных средах могут иметь переменную величину подвижность таких ассоциатов меньше, чем у исходного иона. Возможно, при электрической проводимости большую роль играют именно такие системы с центральным ионом. Электростатическое диполь-дипольное взаимодействие молекул невелико и, по-видимому, не имеет большого значения при образовании молекулярных димеров, г
Постоянный дипольный момент
Процесс возникновения диполя
В процессе образования ковалентной полярной связи один из атомов сильнее притягивает к себе электроны, в результате чего общая электронная пара смещается к его ядру. Возникает ковалентная полярная связь. Способность атома притягивать электроны является критерием его электроотрицательности (ЭО). Чем выше электроотрицательность у атома, тем больше вероятность смещения электронной пары в сторону ядра данного атома. Разность ЭО атомов характеризует полярность связи.
В результате смещения электронной пары к ядру одного из атомов, повышается плотность отрицательного заряда у данного атома и он получает эффективный заряд атома $\delta ^-$. У другого атома увеличивается плотность положительного заряда $\delta ^+$. Возникает диполь — электрически нейтральная система с двумя одинаковыми по величине, но разными по знаку зарядами, находящимися на определенном расстоянии (длина диполя $l_д$) друг от друга.
Постоянный дипольный момент
Мерой полярности является дипольный момент $\mu $. Его величина равна произведению эффективного заряда $\delta $ на длину диполя $l_д$:
Единица измерения постоянного дипольного момента — кулон на метр ($Кл \cdot м$), или внесистемная единица измерения — дебай $D$, равная $3,34 \cdot 10-30 Кл \cdot м$.
Пример 1
Предположим, что в молекуле фтороводорода $HF$ — ионная связь. То есть на атомах водорода и фтора сосредоточены заряды $+1$ и $-1$, соответственно. Заряды ионов кратны заряду электрона, равному $1,60 \cdot 10^{-19}$ Кл. Расстояние между зарядами составляет $9,17\cdot 10^{-11}$ м. Постоянный дипольный момент, исходя из этих данных, равен:
$\mu = q \cdot r =1,60 \cdot 10^{-19} Кл \cdot 9,17 \cdot 10^{-11} м = 1,47 \cdot 10{-29} Кл \cdot м$.
В дебаях дипольный момент равен:
$\mu = \frac{1,47 \cdot 10^{-29} Кл \cdot м}{3,34 \cdot 10^{-30} Кл \cdot м \cdot D^{-1}} = 4,40 D$.
Величина $\mu = 4,40 D$ характеризует дипольный момент молекулы $HF$ при условии, что химическая связь в ней полностью ионная. В действительности же $\mu = 1,83 D$. Сопоставляя эти величины, можно вычислить «долю ионности связи» (частичный ионный характер связи) в молекуле $HF$.
Ионный характер связи = $\frac{1,83\ D \cdot 100}{4,40\ D}\ = 41,6\%$
С увеличением разности электроотрицательности постоянный момент диполя растет.
Дипольный момент является векторной величиной. Направление диполя условно принимают от отрицательного полюса к положительному.
Пример 2
У молекул аммиака $NH_3$ и фторида азота $NF_3$ одинаковая тригонально — пирамидальная форма (Рис. 1). Полярность связей $N-H$ и $N-F$ тоже примерно одинакова. Однако дипольный момент аммиака равен $0,49 \cdot 10^{-29} Кл \cdot м$, а фторида азота — $0,07 \cdot 10^{-29} Кл \cdot м$. Такая разница объясняется тем, что в молекуле аммиака направление дипольного момента связывающей $N-H$ и несвязывающей электронной пары совпадает и при векторном сложении обусловливает больший электрический момент диполя. В молекуле фторида азота дипольные моменты связей $N-F$ и электронной пары направлены в противоположные стороны. Если их сложить, то происходит частичная компенсация.

Рисунок 1. Направления дипольных моментов и электронных пар в молекулах аммиака $NH_3$ и фторида азота $NF_3$
Для многоатомных молекул необходимо различать дипольный момент отдельных связей и молекулы в целом. Если в молекуле присутствует несколько связей, то их электрические моменты (векторы) складываются по правилу параллелограмма. Результирующий дипольный момент будет отличаться от электрических дипольных моментов отдельных связей. Если молекула высокосимметрична, то дипольный момент может быть равен нулю, в то время как отдельные связи обладают высокой полярностью.
Пример 3
Молекула диоксида углерода линейной формы неполярна ($\mu = 0$), в то время как каждая связь $C=O$ имеет значительный дипольный момент ($\mu = 8,9 \cdot 10^{-29} Кл \cdot м$). Это происходит в результате того, что равные по величине постоянные дипольные моменты связей направлены навстречу друг другу.
Чем более полярна молекула и значительнее смещены общие электронные пары к одному из атомов, тем больше значение постоянного дипольного момента.
Методы определения постоянного дипольного момента
Как правило, методы определения электрических дипольных моментов основаны на нахождении ориентационного эффекта полярных молекул в приложенном электрическом поле.
Методы микроволновой спектроскопии. Основаны на эффектах расщепления и сдвига спектральных линий в электрическом поле. Позволяет наиболее точно определить значение величины и направление вектора постоянного дипольного момента. К этим методам относят: метод Штарка, резонансный микроволновой метод, молекулярных пучков и др.
Методы, основанные на измерении диэлектрической проницаемости $\varepsilon$ вещества.
При разных температурах измеряется диэлектрическая проницаемость веществ. Если вещество поместить в электрическое поле, создаваемое конденсатором, то емкость конденсатора возрастет в ? раз, то есть
где $c_0$ и $c$ — емкость конденсатора в вакууме и в среде вещества.
Энергия электрического поля в конденсаторе равна:
где $U$ — энергия электрического поля в конденсаторе;
$c$ — емкость конденсатора в среде вещества;
$V$ — напряжение на обкладках конденсатора.
В среде вещества конденсатор имеет больший запас энергии, чем в вакууме. Это объясняется тем, что под действием электрического поля происходит ориентация диполей и деформация молекул вещества.
Постоянный дипольный момент находят с помощью уравнения Ланженева — Дебая, которое связывает температурную зависимость диэлектрической проницаемости и дипольный момент:
где $M$ — относительная молекулярная масса вещества;
$\rho $ — плотность;
$N_a$- число Авогадро;
$k$ — постоянная Больцмана, равная $\frac{R}{N_a}$;
$R$- универсальная газовая постоянная;
$\alpha $ — деформационная поляризуемость.
Измерив $\varepsilon$ при двух температурах при помощи уравнения Ланжевена — Дебая можно определить деформационную поляризуемость и постоянный дипольный момент.
Зная значение дипольного момента, можно указать характер химической связи (ковалентная полярная или неполярная, ионная) и судить о геометрической структуре молекулы.
Диполь. Дипольный момент молекулы | Задачи 254
Задача 254.
Дипольный момент молекулы HCN равен 2,9D. Вычислить длину диполя.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на
расстояние l между центрами положительного и отрицательного зарядов в диполе:
Отсюда
Учитывая, что 1D = 3,33 . 10-30 Кл . м, находим длину диполя:
Ответ: 6,04 . 10-11 м.
Задача 255.
Длина диполя молекулы фтороводорода равна 4 . 10-11 м. Вычислить ее дипольный момент в дебаях и в кулон-метрах.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе:
Дипольный момент измеряют в дебаях (D), 1D = 3,33 .10-30 Кл . м).
Находим дипольный момент молекулы в кулон-метрах:
Вычисляем дипольный момент молекулы в дебаях:
Ответ: 6,04 .10-30 Кл . м = 1,92D.
Задача 256.
Дипольные моменты молекул Н2О и Н2S равны соответственно 1,84 и 0,94D. Вычислить длины диполей. В какой молекуле связь более полярна? Указать направления дипольных моментов связей в этих молекулах.
Решение:
Дипольный момент молекулы равен произведению абсолютного значения заряда электрона g (1,60 . 10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе:
Дипольный момент измеряют в дебаях (D), 1D = 3,33 . 10-30Кл . м).
Вычислим длину связи молекулы Н2О:
Вычислим длину связи молекулы H2S:
Так как дипольный момент молекулы Н2О больше, чем молекулы H2S, то в молекуле Н2О связь более полярна. Учитывая, что атомы кислорода и серы более электроотрицательнее атома водорода, то дипольные моменты связей будут направлены от атома водорода соответственно к атому кислорода и серы (Н→ О, H →S).
Ответ: 0,038 и 0,020 нм.
Задача 257.
Описать пространственное строение неполярной молекулы ВеСI2. Какие АО бериллия участвуют в образовании связей Ве—С1?
Решение:
В молекуле BeCl2 валентный электронный слой атома бериллия содержит две электронных пары:
Поэтому электронные облака атома бериллия будут максимально удалены друг от друга при sp-гибридизации, когда их оси совпадают и направлены противоположно друг к другу, что приводит к нулевому значению дипольного момента, молекула приобретает линейное строение:
При образовании молекулы BeCl2 в образовании связей Be—Cl участвуют две sp-гибридные АО бериллия.
Задача 258.
Дипольный момент молекулы SO2 равен 1,бID, молекулы СО2 — нулю. Одинаковы ли валентные углы ОSО и ОСО? Ответ мотивировать.
Решение:
Дипольный момент – величина векторная, направленная от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как некоторую сумму дипольных моментов связей; она зависит не только от полярности каждой связи, но и от взаимного расположения этих связей.
В линейных молекулах типа АВ2, в нашем случае в молекуле СО2, дипольные моменты связей С=О направлены друг к другу и поэтому взаимно компенсируются, что и приводит к нулевому значению суммарного диполя молекулы. Поэтому углы ОСО равны 1800. Схема молекулы СО2 имеет вид:
Так как дипольный момент молекулы SO2 имеет значение больше нуля, то дипольные моменты связей S—O направлены друг к другу под углом, молекула имеет угловую структуру:
Взаимное расположение связей в молекуле SO2 угловое, т.е. молекула построена в форме треугольника. Поэтому валентные углы ОSО и ОСО не одинаковы.
Задача 259.
Дипольный момент молекулы СS2 равен нулю. Каким типом гибридизации АО углерода описывается образование этой молекулы?
Решение:
Электронная конфигурация атома углерода 1s22s22р2. Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Электронное строение валентных орбиталей атома углерода в возбужденном состоянии представлено следующей схемой:
Четыре неспаренных электрона возбуждённого атома углерода могут участвовать в образовании четырёх ковалентных связей по обычному механизму с другими атомами химических элементов. Так как дипольный момент молекулы CS2 равен нулю, то молекула имеет линейное строение. В CS2 валентный электронный слой содержит четыре пары электронов, по две пары с двух сторон атома углерода:
Поэтому в молекуле CS2 углерод находится в состоянии sp-гибридизации. Образовавшиеся равноценные sp-гибридные орбитали образуют одинарные — связи C—S, а два неспаренных р-облака, перекрываясь образуют — связь с атомами серы. Поэтому в молекуле CS2 sp-гибридные облака ориентируются в противоположных направлениях, молекула имеет линейное строение. В линейных молекулах типа АВ2, в нашем случае в молекуле CS2, дипольные моменты связей С=S направлены друг к другу и поэтому взаимно компенсируются, что и приводит к нулевому значению суммарного диполя молекулы. Поэтому углы SСS равны 1800. Схема молекулы СS2 имеет вид:
S → C ← S
Задача 260.
Дипольные моменты молекул ВF3 и NF3 равны соответственно О и 0,2D. Какими типами гибридизации AO бора и азота описывается образование этих молекул?
Решение:
а) В молекуле BF3 валентный электронный слой атома бора содержит три пары электронов:
Электронные облака атома бора будут максимально удалены друг от друга при sp2-гибридизации, когда оси связей
B—F направлены друг к другу под углом 1200 (т.е. в направлениях к вершинам правильного треугольника), молекула будет иметь форму:
Такое расположение связей взаимно компенсирует их дипольные моменты, так что суммарное значение дипольного момента молекулы трифторида бора равно нулю.
б) В молекуле NF3 валентный электронный слой атома азота содержит четыре пары электронов:
Поэтому электронные облака атома азота будут максимально удалены друг от друга при sp3-гибридизации, когда оси связей N—F будут направлены к вершинам тетраэдра (углы между этими направлениями составляют 109028’). При образовании молекулы NF3 атом азота расположен в центре тетраэдра, а атомы фтора расположены в трёх вершинах тетраэдра, к четвёртой вершине направлено электронное облако неподелённой пары электронов атома азота. Образовавшаяся фигура – тригональная пирамида. Дипольный момент такой молекулы будет иметь значение больше нуля.

