Параметры, цоколевка и аналоги стабилитрона Д814В
RadioLibs.ru
- Справочник
- Аудио и видео обзоры
- Объявления
- Главная /
- Стабилитроны маломощные /
- Стабилитрон Д814В
Описание стабилитрона Д814В
Стабилитрон Д814В кремниевый, сплавный, средней мощности.Предназначен для стабилизации напряжения 9,0-10,5 В в диапазоне токов стабилизации 3…32 мА.
Выпускается в металлостеклянном корпусе с гибкими выводами.
Тип стабилитрона приводится на корпусе.
Корпус стабилитрона в рабочем режиме служит положительным электродом (анодом).
Масса стабилитрона не более 1 г.
Размеры стабилитрона Д814В
Характеристики стабилитрона Д814В
| Номинальное напряжение стабилизации стабилитрона | 10,0 В |
| Номинальный ток стабилизации стабилитрона | 5,0 мА |
| Максимально-допустимая рассеиваемая мощность на стабилитроне | 340 мВт |
| 9,0 В | |
| Максимальное напряжение стабилизации стабилитрона | 10,5 В |
| Дифференциальное сопротивление стабилитрона | 12 Ом |
| Температурный коэффициент стабилизации стабилитрона | 9,0 10-2 %/°С |
| Минимальный ток стабилизации стабилитрона | 3,0 мА |
| Максимальный ток стабилизации стабилитрона | 32 мА |
| Максимально-допустимая температура корпуса стабилитрона | 125 °С |
Справочник
- Импортные биполярные транзисторы
- Биполярные транзисторы
- Диоды
- Стабилитроны маломощные
- Светодиоды
- Тиристоры
Реклама
Copyright © 2013-2022 RadioLibs. ru
ru
Oтзывы и предложения для RadioLibs
Характеристики стабилитрона, аналоги и datasheet
Как указанно в технических характеристиках, Д814В является кремниевым стабилитроном средней мощности. Они изготавливаются по сплавной технологии. Их можно использовать в различной радиоэлектронной аппаратуре общего применения. Д814В могут храниться до 25 лет на отапливаемом складе со стабильной температурой и влажностью. В помещении без отопления может сберегаться не более 16,5 лет, а на открытом месте под навесом – 12,5 лет.
Цоколевка
Д814В можно встретить в двух типах корпусов металлостеклянном КД-8 и стеклянном KD-3A. В первом случае (КД-8) маркировка наносится сверху на устройство. Во втором случае (KD-3A), для обозначения используется цветная маркировка, возле катода имеется узкое чёрное кольцо.
Технические характеристики
Рассмотрение характеристик стабилитрона Д814В начнём с рассмотрения максимально допустимых.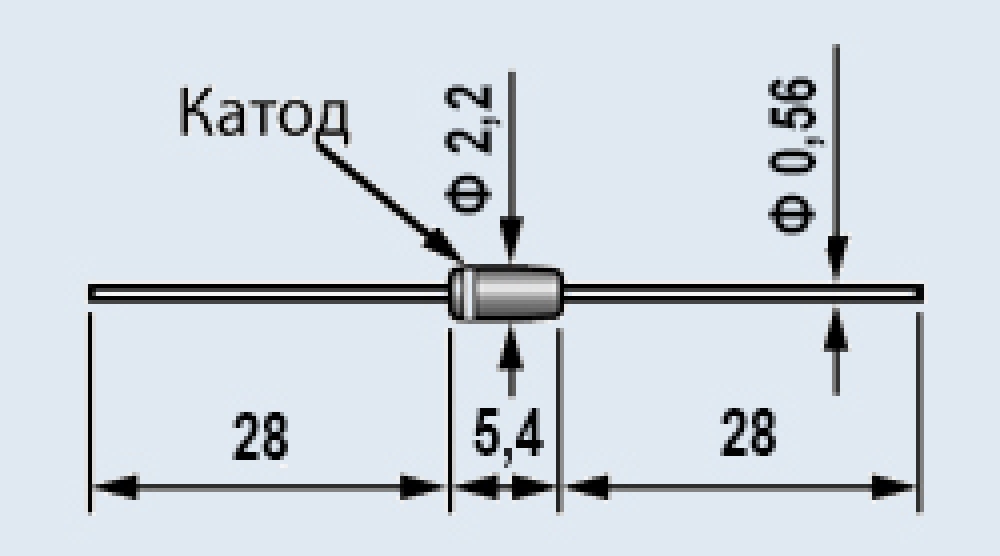 Они важны и их нужно обязательно учитывать при поиске замены или конструировании нового устройства, ведь при их превышении устройство выйдет из строя. Также вредна для долговечности Д814В длительная работа при значениях близких к максимальным. В нашем случае они равны:
Они важны и их нужно обязательно учитывать при поиске замены или конструировании нового устройства, ведь при их превышении устройство выйдет из строя. Также вредна для долговечности Д814В длительная работа при значениях близких к максимальным. В нашем случае они равны:
- минимальный ток, нужный для стабилизации – 3 мА;
- +35°С – 32 мА;
- +100°С – 19 мА;
- +125°С – 9,5 мА;
- предельный возможный ток, текущий на протяжении длительного времени – 100 мА;
- наибольшая мощность при т-ре:
- меньше +35°С – 340 мВт;
- +100°С – 200 мВт;
- +125°С – 100 мВт;
- диапазон т-р от -60°С до +125°С.
Электрические х-ки также важны, так как от них зависит сфера использования рассматриваемого стабилитрона.
- разность потенциалов стабилизации при токе через Д814Г — 5 мА и т-ре:
- +25°С – от 9 до 10,5 В;
- -60°С – от 8 до 10,5 В;
- +125°С – от 9 до 11,5 В;
- температурный коэф-нт разности потенциалов стабилизации, при т-ре от -60 до +125°С и токе 5 мА не может быть выше 0,090%/ОС;
- разброс напряжения (при токе 5 мА) – ±1%;
- разброс разности потенциалов стабилизации:
- в диапазоне времени от 5 с до 15 с после подачи разности потенциалов 210 мВ;
- в диапазоне времени от 15 с до 20 с после подачи разности потенциалов 20 мВ;
- напряжение при т-ре от -60 до +25°С и токе равном 50 мА, не более 1 В;
- ток в обратном направлении не должен превышать 0,1 мкА;
- электрическое сопротивление Д814В, определённое при:
- Т = +25°С и I = 5 мА не может быть больше 12 Ом;
- Т = +25°С и I = 1 мА не может быть больше 25 Ом;
- Т =-60 °С и +125ОС и IСТ = 5 мА не может быть больше
В технических характеристиках также есть условия по эксплуатации Д814В. В них говорится, что пайка выводов разрешена на расстоянии свыше 5 мм от корпуса. При пайке корпус стабилитрона не должен превышать нагрева выше +125°С.
В них говорится, что пайка выводов разрешена на расстоянии свыше 5 мм от корпуса. При пайке корпус стабилитрона не должен превышать нагрева выше +125°С.
Так же в даташите оговариваются механические нагрузки на стабилитрон. К анодному выводу можно приложить растягивающее усилие до 19,6 Н, а к анодному не более 9,8 Н.
Кроме этого допускается как параллельное, так и последовательное соединение неограниченного количества устройств.
Аналоги
Стабилитронов, аналогичных Д814В, нет как среди отечественных, так и среди зарубежных устройств. В некоторых случаях, при проверке всех важных для данной схемы параметров, можно использовать следующие радиодетали:
- 1N1959A;
- 1094Z4;
- 1095Z4.
Производители
Д814В до сих пор изготавливают на ООО «Саранский завод точных приборов», которое входит в МПиТ РФ. Других предприятий, занимающихся выпуском этого устройства, нет. Поэтому, в продаже можно найти продукцию только этой компании.
Потеря функции TET2 взаимодействует с конститутивно активным KIT в мышиных и человеческих моделях мастоцитоза
1. Лонгли Б.Дж., Тиррелл Л., Лу С.З., Ма Ю.С., Лэнгли К. и др. (1996)Соматическая мутация, активирующая c-KIT, при пигментной крапивнице и агрессивном мастоцитозе: установление клональности в новообразованиях тучных клеток человека. Нат Жене
12: 312–314. [PubMed] [Google Scholar]
Лонгли Б.Дж., Тиррелл Л., Лу С.З., Ма Ю.С., Лэнгли К. и др. (1996)Соматическая мутация, активирующая c-KIT, при пигментной крапивнице и агрессивном мастоцитозе: установление клональности в новообразованиях тучных клеток человека. Нат Жене
12: 312–314. [PubMed] [Google Scholar]
2. Horny HP, Valent P (2001)Диагностика мастоцитоза: общие гистопатологические аспекты, морфологические критерии и результаты иммуногистохимии. Лейк Рез 25: 543–551. [PubMed] [Академия Google]
3. Valent P, Horny HP, Escribano L, Longley BJ, Li CY и др. (2001) Диагностические критерии и классификация мастоцитоза: консенсусное предложение. Лейк Рез 25: 603–625. [PubMed] [Google Scholar]
4.
Nagata H, Worobec AS, Oh CK, Chowdhury BA, Tannenbaum S, et al. (1995)Идентификация точечной мутации в каталитическом домене протоонкогена c-kit в мононуклеарных клетках периферической крови пациентов с мастоцитозом и сопутствующим гематологическим заболеванием. Proc Natl Acad Sci U S A
92: 10560–10564.
5. Гарсия-Монтеро А.С., Хара-Асеведо М., Теодосио С., Санчес М.Л., Нуньес Р. и др. (2006)Мутация KIT в тучных клетках и других линиях гемопоэтических клеток костного мозга при системных заболеваниях тучных клеток: проспективное исследование Испанской сети по мастоцитозу (REMA) в серии из 113 пациентов. Кровь 108: 2366–2372. [PubMed] [Google Scholar]
6. Ma Y, Zeng S, Metcalfe DD, Akin C, Dimitrijevic S, et al. (2002) Мутация c-KIT, вызывающая мастоцитоз человека, устойчива к STI571 и другим ингибиторам киназы KIT; киназы с мутациями ферментативного сайта демонстрируют разные профили чувствительности к ингибиторам, чем киназы дикого типа и киназы с мутациями регуляторного типа. Кровь 99: 1741–1744. [PubMed] [Google Scholar]
7.
Акин С., Броков К., Д’Амброзио С., Киршенбаум А.С., Ма Ю. и др. (2003) Влияние ингибитора тирозинкиназы STI571 на тучные клетки человека, несущие c-kit дикого типа или мутантный. Опыт Гематол
31: 686–692. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
8. Шах Н.П., Ли Ф.Ю., Луо Р., Цзян И., Донкер М. и др. (2006) Дазатиниб (BMS-354825) ингибирует KITD816V, резистентную к иматинибу активирующую мутацию, которая запускает неопластический рост у большинства пациентов с системным мастоцитозом. Кровь 108: 286–291. [PubMed] [Google Scholar]
9. Верстовсек С., Теффери А., Кортес Дж., О’Брайен С., Гарсия-Манеро Г. и др. (2008) Исследование фазы II дазатиниба при острых и хронических миелоидных заболеваниях с отсутствием филадельфийских хромосом, включая системный мастоцитоз. Клин Рак Рез 14: 3906–3915. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
Промежуточный анализ глобального испытания CPKC412D2201. Кровь (тезисы годового собрания). Ноябрь 2012 (120:79)9.).
11. Теффери А., Левин Р.Л., Лим К.Х., Абдель-Вахаб О., Лашо Т.Л. и др. (2009)Частые мутации TET2 при системном мастоцитозе: клинические, корреляции KITD816V и FIP1L1-PDGFRA. Лейкемия 23: 900–904. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Traina F, Visconte V, Jankowska AM, Makishima H, O’Keefe CL, et al. (2012) При системном мастоцитозе присутствуют поражения однонуклеотидного полиморфизма, мутации TET2, DNMT3A, ASXL1 и CBL. PLoS один
7: е43090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Traina F, Visconte V, Jankowska AM, Makishima H, O’Keefe CL, et al. (2012) При системном мастоцитозе присутствуют поражения однонуклеотидного полиморфизма, мутации TET2, DNMT3A, ASXL1 и CBL. PLoS один
7: е43090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Wilson TM, Maric I, Simakova O, Bai Y, Chan EC, et al. (2011)Клональный анализ мутаций, активирующих NRAS, при системном мастоцитозе KIT-D816V. гематологический 96: 459–463. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Ito S, Shen L, Dai Q, Wu SC, Collins LB, et al. (2011) Белки Tet могут превращать 5-метилцитозин в 5-формилцитозин и 5-карбоксицитозин. Наука 333: 1300–1303. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. He YF, Li BZ, Li Z, Liu P, Wang Y и др. (2011) Tet-опосредованное образование 5-карбоксицитозина и его удаление с помощью TDG в ДНК млекопитающих. Наука 333: 1303–1307. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Деломмо Ф., Дюпон С., Делла Валле В. , Джеймс С., Транной С. и др. (2009)Мутация TET2 при миелоидном раке. N Engl J Med
360: 2289–2301. [PubMed] [Google Scholar]
, Джеймс С., Транной С. и др. (2009)Мутация TET2 при миелоидном раке. N Engl J Med
360: 2289–2301. [PubMed] [Google Scholar]
17. Теффери А., Парданани А., Лим К.Х., Абдель-Вахаб О., Лашо Т.Л. и др. (2009) Мутации TET2 и их клинические корреляты при истинной полицитемии, эссенциальной тромбоцитемии и миелофиброзе. Лейкемия 23: 905–911. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Лангемейер С.М., Койпер Р.П., Берендс М., Кнопс Р., Асланян М.Г. и др. (2009 г.) Приобретенные мутации TET2 часто встречаются при миелодиспластических синдромах. Нат Жене 41: 838–842. [PubMed] [Google Scholar]
19. Моран-Крузио К., Риви Л., Ши А., Абдель-Вахаб О., Ндиайе-Лобри Д. и др. (2011) Потеря Tet2 приводит к усилению самообновления гемопоэтических стволовых клеток и миелоидной трансформации. Раковая клетка 20: 11–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20.
Quivoron C, Couronne L, Della Valle V, Lopez CK, Plo I и др. (2011) Инактивация TET2 приводит к плейотропным гемопоэтическим аномалиям у мышей и является повторяющимся событием во время лимфомагенеза человека. Раковая клетка
20: 25–38. [PubMed] [Академия Google]
Раковая клетка
20: 25–38. [PubMed] [Академия Google]
21. Li Z, Cai X, Cai CL, Wang J, Zhang W и др. (2011) Делеция Tet2 у мышей приводит к нарушению регуляции гемопоэтических стволовых клеток и последующему развитию миелоидных злокачественных новообразований. Кровь 118: 4509–4518. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Суси Э., Ханссенс К., Мерчер Т., Джорджин-Лавиаль С., Дамадж Г. и др. (2012) При агрессивных формах мастоцитоза потеря TET2 взаимодействует с c-KITD816V для трансформации тучных клеток. Кровь 120: 4846–4849. [PubMed] [Академия Google]
23. Gerbaulet A, Wickenhauser C, Scholten J, Peschke K, Drube S, et al. (2011)Гиперплазия тучных клеток, злокачественное новообразование В-клеток и воспаление кишечника у мышей с условной экспрессией конститутивно активного набора. Кровь 117: 2012–2021. [PubMed] [Google Scholar]
24.
Kuhn R, Schwenk F, Aguet M, Rajewsky K (1995) Нацеливание на индуцируемые гены у мышей. Наука
269: 1427–1429. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
25. Шолтен Дж., Хартманн К., Герболет А., Криг Т., Мюллер В. и др. (2008) Cre/loxP-опосредованная рекомбинация in vivo, специфичная для тучных клеток. Трансгенный Рез 17: 307–315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Butterfield JH, Marcoux JP, Weiler D, Harner SG (1988) Фарингит тучных клеток как причина надгортанного отека. Арка Оториноларингол 245: 88–91. [PubMed] [Google Scholar]
27. Aichberger KJ, Gleixner KV, Mirkina I, Cerny-Reiterer S, Peter B, et al. (2009)Идентификация проапоптотического Bim как супрессора опухоли в опухолевых тучных клетках: роль KIT D816V и эффекты различных таргетных препаратов. Кровь 114: 5342–5351. [PubMed] [Google Scholar]
28. Явуз А.С., Липский П.Е., Явуз С., Меткалф Д.Д., Акин С. (2002)Доказательства участия гемопоэтической клетки-предшественника в системном мастоцитозе на основе одноклеточного анализа мутаций в гене c-kit. Кровь 100: 661–665. [PubMed] [Академия Google]
29. Chen CC, Grimbaldeston MA, Tsai M, Weissman IL, Galli SJ (2005)Идентификация предшественников тучных клеток у взрослых мышей. Proc Natl Acad Sci U S A
102: 11408–11413. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Chen CC, Grimbaldeston MA, Tsai M, Weissman IL, Galli SJ (2005)Идентификация предшественников тучных клеток у взрослых мышей. Proc Natl Acad Sci U S A
102: 11408–11413. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Arinobu Y, Iwasaki H, Gurish MF, Mizuno S, Shigematsu H, et al. (2005) Контрольные точки развития базофильных / тучных клеток в гемопоэзе взрослых мышей. Proc Natl Acad Sci U S A 102: 18105–18110. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Ихле Дж. Н., Келлер Дж., Орослан С., Хендерсон Л.Э., Коупленд Т.Д. и соавт. (1983) Биологические свойства гомогенного интерлейкина 3. I. Демонстрация активности фактора роста WEHI-3, активности фактора роста тучных клеток, активности p-клеточно-стимулирующего фактора, активности колониестимулирующего фактора и гистамин-продуцирующего клеточно-стимулирующего фактора. Дж Иммунол 131: 282–287. [PubMed] [Google Scholar]
32.
Разин Э., Ихле Дж. Н., Селдин Д., Менсия-Уэрта Дж. М., Кац Х. Р. и соавт. (1984) Интерлейкин 3: фактор дифференцировки и роста тучных клеток мыши, содержащий протеогликан хондроитинсульфата Е. Дж Иммунол
132: 1479–1486. [PubMed] [Google Scholar]
Дж Иммунол
132: 1479–1486. [PubMed] [Google Scholar]
33. Schittenhelm MM, Shiraga S, Schroeder A, Corbin AS, Griffith D, et al. (2006) Дазатиниб (BMS-354825), двойной ингибитор киназы SRC/ABL, ингибирует киназную активность изоформ KIT дикого типа, околомембранных и мутантных по петле активации, связанных со злокачественными новообразованиями человека. Рак Рез 66: 473–481. [PubMed] [Google Scholar]
34. Фигероа М.Е., Абдель-Вахаб О., Лу С., Уорд П.С., Патель Дж. и др. (2010)Лейкемические мутации IDh2 и IDh3 приводят к фенотипу гиперметилирования, нарушают функцию TET2 и нарушают гемопоэтическую дифференцировку. Раковая клетка 18: 553–567. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Travis WD, Li CY, Yam LT, Bergstralh EJ, Swee RG (1988)Значение системного заболевания тучных клеток с сопутствующими гематологическими нарушениями. Рак 62: 965–972. [PubMed] [Google Scholar]
36.
Парданани А., Лим К.Х., Лашо Т.Л., Финке С., МакКлюр Р.Ф. и соавт. (2009)Прогнозически значимое расстройство 123 пациентов с системным мастоцитозом, связанным с другими миелоидными злокачественными новообразованиями. Кровь
114: 3769–3772. [PubMed] [Google Scholar]
Кровь
114: 3769–3772. [PubMed] [Google Scholar]
37. Horny HP, Sotlar K, Sperr WR, Valent P (2004)Системный мастоцитоз с ассоциированными клональными гематологическими заболеваниями, не относящимися к тучным клеткам: гистопатологическая проблема. Джей Клин Патол 57: 604–608. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Masserot C, Adjaoud D, Haouy S, Deswarte C, Ballerini P, et al. (2008)Острый лимфобластный лейкоз и кожный мастоцитоз у двух детей. Детский рак крови 51: 444–445. [PubMed] [Google Scholar]
39. Льюис Х.М., Винтер Э., Дарбишир П., Юн А., Марсден Дж. Р. и др. (1995)Пигментная крапивница и острый лимфобластный лейкоз. JR Soc Med 88: 530П–531П. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Китаяма Х., Цудзимура Т., Мацумура И., Оритани К., Икеда Х. и др. (1996) Неопластическая трансформация нормальных гемопоэтических клеток путем конститутивной активации мутаций тирозинкиназы рецептора c-kit. Кровь 88: 995–1004. [PubMed] [Google Scholar]
41. Xiang Z, Kreisel F, Cain J, Colson A, Tomasson MH (2007)Неоплазия, вызванная мутантным c-KIT, опосредуется внутриклеточной, а не плазматической мембраной, передачей сигналов рецептора. Мол Селл Биол
27: 267–282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Xiang Z, Kreisel F, Cain J, Colson A, Tomasson MH (2007)Неоплазия, вызванная мутантным c-KIT, опосредуется внутриклеточной, а не плазматической мембраной, передачей сигналов рецептора. Мол Селл Биол
27: 267–282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Langemeijer SM, Jansen JH, Hooijer J, van Hoogen P, Stevens-Linders E, et al. (2011) Мутации TET2 при детской лейкемии. Лейкемия 25: 189–192. [PubMed] [Google Scholar]
43. Estey EH (2013) Эпигенетика в клинической практике: примеры азацитидина и децитабина при миелодисплазии и остром миелоидном лейкозе. Лейкемия. [PubMed]
44. Ганим В., Херрманн Х., Хеллер Г., Питер Б., Хадзиюсуфович Э. и др. (2012) 5-азацитидин и децитабин оказывают проапоптотическое действие на неопластические тучные клетки: роль FAS-деметилирования и повторной экспрессии FAS, а также синергизм с FAS-лигандом. Кровь 119: 4242–4252. [PubMed] [Академия Google]
45.
Tsai HC, Li H, Van Neste L, Cai Y, Robert C, et al. (2012) Кратковременные низкие дозы ДНК-деметилирующих агентов оказывают стойкое противоопухолевое действие на гематологические и эпителиальные опухолевые клетки.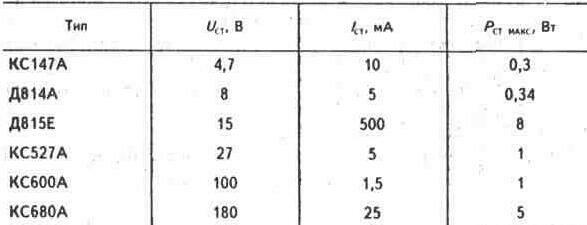 Раковая клетка
21: 430–446. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Раковая клетка
21: 430–446. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Klco JM, Spencer DH, Lamprecht TL, Sarkaria SM, Wylie T, et al. (2013)Геномное влияние кратковременного лечения децитабином в низких дозах на первичные клетки ОМЛ. Кровь 121: 1633–1643. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Потеря функции TET2 взаимодействует с конститутивно активным KIT в мышиных и человеческих моделях мастоцитоза
Фигура 1.
Повышенная пролиферация клеток HMC-1.2 после нокдауна TET2.
A ) Клетки HMC-1.2 обрабатывали двумя шпильками против TET2 (TET2 sh-1 и TET2 sh-3) или контрольной кшРНК (ctr sh). Рост клеток рассчитывали с использованием анализа CellTiter-Glo от Promega. Данные представлены в виде кратности изменения по сравнению с 5-м днем после трансдукции. Значения представляют собой среднее значение ± стандартная ошибка среднего, n = 3 независимых эксперимента. * P <0,05. B ) Процент клеток в S-фазе, определенный по включению BrdU в клетки HMC-1.2, обработанные TET2 sh-1 и sh-3, по сравнению с контрольной шпилькой. Значения являются средними ± SEM. n = 3 независимых эксперимента, *** P <0,001, ns = не значимо. C ) Репрезентативные графики FACS, показывающие включение BrdU по отношению к стадиям клеточного цикла в клетках HMC-1.2, инфицированных контрольной шпилькой (ctr sh), по сравнению с TET2 sh-1 и TET2 sh-3.
* P <0,05. B ) Процент клеток в S-фазе, определенный по включению BrdU в клетки HMC-1.2, обработанные TET2 sh-1 и sh-3, по сравнению с контрольной шпилькой. Значения являются средними ± SEM. n = 3 независимых эксперимента, *** P <0,001, ns = не значимо. C ) Репрезентативные графики FACS, показывающие включение BrdU по отношению к стадиям клеточного цикла в клетках HMC-1.2, инфицированных контрольной шпилькой (ctr sh), по сравнению с TET2 sh-1 и TET2 sh-3.
Подробнее »
РасширятьФигура 2.
Потеря Tet2 подчеркивает управляемый Kit D814V фенотип тучных клеток.
A ) Среднее количество тучных клеток на срез кожи по генотипам. N = 60–80 срезов от 3–4 независимых животных/генотип. * P <0,05. B ) Среднее количество тучных клеток на срез желудка/пищевода по генотипам. N = 60–80 срезов от 3–4 независимых животных/генотип. * P <0,05. На рисунках 2А и 2В цифры 1-4 обозначают следующие генотипы: 1 = WT ctr, 2 = Tet2 +/+ ; Kit D814, 3 = Tet2 -/- ; Kit D814, 4 = Tet2 -/ − ;комплект WT. C ) Процент срезов кожи с определенной гистологической оценкой из Tet2 +/+ ; Набор D814V и Tet2 -/- ; Набор D814V. D ) Процент срезов желудка/пищевода с определенной гистологической оценкой в Tet2 +/+ ;Kit D814V и Tet2 -/- ;Набор животных D814V. Для рис. 2A–2D двадцать случайно выбранных и независимых областей одинаковой толщины на животное подсчитывали слепым методом при 20-кратном увеличении и оценивали в соответствии с классификацией, представленной в таблице 1. Мышей всех собирали между 8 и 20 неделями после последняя инъекция pI:C. n = 4 на генотип. E ) Репрезентативные изображения окрашивания по Гимзе, выполненного на коже (левые панели) или срезах желудка/пищевода (правые панели), приготовленных из Tet2 +/+ ;Комплект D814V и Tet2 -/- ;Комплект D814V животные.
N = 60–80 срезов от 3–4 независимых животных/генотип. * P <0,05. На рисунках 2А и 2В цифры 1-4 обозначают следующие генотипы: 1 = WT ctr, 2 = Tet2 +/+ ; Kit D814, 3 = Tet2 -/- ; Kit D814, 4 = Tet2 -/ − ;комплект WT. C ) Процент срезов кожи с определенной гистологической оценкой из Tet2 +/+ ; Набор D814V и Tet2 -/- ; Набор D814V. D ) Процент срезов желудка/пищевода с определенной гистологической оценкой в Tet2 +/+ ;Kit D814V и Tet2 -/- ;Набор животных D814V. Для рис. 2A–2D двадцать случайно выбранных и независимых областей одинаковой толщины на животное подсчитывали слепым методом при 20-кратном увеличении и оценивали в соответствии с классификацией, представленной в таблице 1. Мышей всех собирали между 8 и 20 неделями после последняя инъекция pI:C. n = 4 на генотип. E ) Репрезентативные изображения окрашивания по Гимзе, выполненного на коже (левые панели) или срезах желудка/пищевода (правые панели), приготовленных из Tet2 +/+ ;Комплект D814V и Tet2 -/- ;Комплект D814V животные. Тучные клетки окрашиваются в темно-синий цвет в этих срезах. Масштабная линейка представляет 100 мкм.
Тучные клетки окрашиваются в темно-синий цвет в этих срезах. Масштабная линейка представляет 100 мкм.
Подробнее »
РасширятьТаблица 1.
Гистологическая оценка, используемая для классификации областей кожи и желудка/пищевода у животных с мастоцитозом.
Подробнее »
РасширятьРисунок 3.
Влияние потери Tet2 на BMMC, полученные от мышей Kit D814V-MxCre.
A ) Уровни мРНК Tet2, измеренные в BMMC после Mx1-Cre-опосредованной делеции Tet2. Данные представлены в виде кратного изменения уровней мРНК Tet2/мРНК Gapdh по сравнению с Tet2 +/+ ; Kit D814V. Данные представляют собой среднее ± SEM, n = 3, * P = <05, *** P <0,001. B ) Фосфорилирование рецептора Kit в отсутствие его лиганда SCF из-за наличия мутации, активирующей Kit, в BMMC из Tet2 +/+ ;Набор D814V, Tet2 +/- ;Набор D814V и Tet2 -/- ;Набор D814V животные. Показанный вестерн-блот представляет два независимых эксперимента с аналогичными результатами. Указаны две различные гликозилированные формы рецептора Kit. CG = сложная форма гликозилирования; HM = форма с высоким содержанием маннозы. Общие уровни c-KIT и β-актина показаны в качестве контроля загрузки. C ) Пролиферация BMMC, несущих мутацию Kit D814V при потере Tet2. Данные показывают средний процент ± SEM BrdU-положительных BMMC по генотипам, n = 3, * P <0,05, нс = не значимо. D ) Дифференциация Kit D814V положительных BMMC в отсутствие Tet2. Данные показывают средний процент ± SEM двойных положительных (Fcε + c-Kit + ) BMMC из Tet2 +/+ ; Kit D814V, Tet2 +/- ; Kit D814V и Tet2 -/- ; Набор D814V (64,1±8,2) после 4 недель культивирования с mIL-3. n = 3, * P = <05, ** P <0,01, ns = не значимо E ) Репрезентативные изображения Tet2 +/+ ;Комплект D814V, Tet2 +/- ;Комплект D814V и Tet2 -/- ;Комплект D814V BMMC.
Показанный вестерн-блот представляет два независимых эксперимента с аналогичными результатами. Указаны две различные гликозилированные формы рецептора Kit. CG = сложная форма гликозилирования; HM = форма с высоким содержанием маннозы. Общие уровни c-KIT и β-актина показаны в качестве контроля загрузки. C ) Пролиферация BMMC, несущих мутацию Kit D814V при потере Tet2. Данные показывают средний процент ± SEM BrdU-положительных BMMC по генотипам, n = 3, * P <0,05, нс = не значимо. D ) Дифференциация Kit D814V положительных BMMC в отсутствие Tet2. Данные показывают средний процент ± SEM двойных положительных (Fcε + c-Kit + ) BMMC из Tet2 +/+ ; Kit D814V, Tet2 +/- ; Kit D814V и Tet2 -/- ; Набор D814V (64,1±8,2) после 4 недель культивирования с mIL-3. n = 3, * P = <05, ** P <0,01, ns = не значимо E ) Репрезентативные изображения Tet2 +/+ ;Комплект D814V, Tet2 +/- ;Комплект D814V и Tet2 -/- ;Комплект D814V BMMC. Масштабная линейка = 20 мкм. Стрелки указывают на клетки, содержащие гранулы, что свидетельствует о более дифференцированном фенотипе.
Масштабная линейка = 20 мкм. Стрелки указывают на клетки, содержащие гранулы, что свидетельствует о более дифференцированном фенотипе.
Подробнее »
РасширятьРисунок 4.
Делеция Tet2 влияет на прогрессирование, но не на инициацию ALL, управляемого Kit D814V.
A ) Количество лейкоцитов у умирающих лейкемических животных в соответствии с генотипом. Каждая точка данных представляет отдельное животное. ** P <.01. B ) Лейкемическая инфильтрация селезенки, выраженная в виде веса (в мг) по генотипам. C ) Латентность заболевания (выраженная в неделях после последней инъекции pI:C, когда мыши были обнаружены умирающими) для разных генотипов. Данные в A B, C представлены как среднее ± SEM (n = 3–12 на группу). D ) График Каплана-Мейера, демонстрирующий выживаемость реципиентов, которым трансплантировали Tet2 +/+ ;Kit D814V (черная линия),Tet2 +/- ;Kit D814V (серая линия) и Tet2 -/- ;Kit D814V (черная пунктирная линия) лимфоидные лейкемические бласты (медиана выживаемости, 13, 13 и 11 дней соответственно, n = 10–15 на группу, P = 0,009). E ) Количество лейкоцитов у животных с вторичной умирающей лейкемией в зависимости от генотипа. Каждая точка данных представляет отдельное животное. F ) Лейкемическая инфильтрация селезенки, выраженная в виде веса (в мг) по генотипам вторичных животных. нс = не имеет значения.
E ) Количество лейкоцитов у животных с вторичной умирающей лейкемией в зависимости от генотипа. Каждая точка данных представляет отдельное животное. F ) Лейкемическая инфильтрация селезенки, выраженная в виде веса (в мг) по генотипам вторичных животных. нс = не имеет значения.
Подробнее »
РасширятьРисунок 5.
Экспрессия Kit D814V и потеря Tet2 в MC частично повторяют фенотип, опосредованный Mx1-Cre.
A ) Кожный мастоцитоз у мышей, экспрессирующих Kit D814V под контролем промотора Cre (Mcpt5-Cre), специфичного для тучных клеток. График представляет среднее количество тучных клеток на участок кожи для перечисленных генотипов. N = 56–96 от 3–4 независимых животных на генотип. нс = не имеет значения. Цифры 1–6 обозначают следующие генотипы: 1 = WT ctr, 2 = Tet2 +/+ ;Kit D814;Mcpt5-Cre, 3 = Tet2 +/- ;Kit D814;Mcpt5-Cre, 4 = Tet2 -/- ;Kit D814V;Mcpt5-Cre, 5 = Tet2 + /- ;Kit WT;Mcpt5-Cre,6 = Tet2 -/- ;Kit WT;Mcpt5-Cre, B ) Гистологическая оценка болезни у пораженных животных Mcpt5-Cre. Каждый участок кожи оценивали в соответствии с критериями, представленными в таблице 1. Гистограмма представляет процент участков на генотип с определенной гистологической оценкой (от 3 до >4). Проанализированные мыши были 9-месячного возраста (n = 3–4 на генотип). C ) Репрезентативные микрофотографии , показывающие инфильтрацию тучных клеток в Tet2 +/+ ; Kit D814V; Mcpt5-Cre (дермальный лимфатический узел), Tet2 +/- ; Kit D814V; Mcpt5-Cre и Tet2 -/- ; Kit D814V; Mcpt5-Cre животные (срезы кожи). Тучные клетки окрашиваются в темно-синий цвет в этих срезах. Масштаб = 100 мкм.
Каждый участок кожи оценивали в соответствии с критериями, представленными в таблице 1. Гистограмма представляет процент участков на генотип с определенной гистологической оценкой (от 3 до >4). Проанализированные мыши были 9-месячного возраста (n = 3–4 на генотип). C ) Репрезентативные микрофотографии , показывающие инфильтрацию тучных клеток в Tet2 +/+ ; Kit D814V; Mcpt5-Cre (дермальный лимфатический узел), Tet2 +/- ; Kit D814V; Mcpt5-Cre и Tet2 -/- ; Kit D814V; Mcpt5-Cre животные (срезы кожи). Тучные клетки окрашиваются в темно-синий цвет в этих срезах. Масштаб = 100 мкм.
Подробнее »
РасширятьРисунок 6.
Нокдаун TET2 усиливает реакцию HMC-1.2 на эпигенетические модификаторы.
A ) HMC-1.2, трансдуцированные двумя шпильками против TET2 (TET2 sh-1 и TET2 sh-3) или контрольной кшРНК (ctr sh), обрабатывали в течение 72 часов низкими дозами DAC (0,5 мкМ) или ДМСО.

