Электролиз | CHEMEGE.RU
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl20
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na0 + Cl20
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O20 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na0 + O20+ 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al0
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al0 + 3О20
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются частицы меди из электрода:
Анод (+): Cu0 – 2ē → Cu2+
Поделиться ссылкой:
Аноды в химии что такое. Что такое анод и катод — простое объяснение
Анод в электрохимии
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде . Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление . При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
См. также
- Мнемонические правила запоминания знака анода
Литература
Ссылки
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). — СПб. , 1890-1907.
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое «Анод» в других словарях:
— (греч. anodos восходящая дорога). В гальваническом элементе, одна из двух пластинок или проволок, по которой вступает или выходит из жидкости электрический ток. Противоположность катоду. Словарь иностранных слов, вошедших в состав русского языка … Словарь иностранных слов русского языка
анод — а, м. anode f., англ. anode <гр. anodos путь вверх, восхождение. физ. Положительно заряженный электрод. В действии таких приборов, как гальваническая батарея, полярности нет и быть не может.. <положительный и отрицательный полюс..… … Исторический словарь галлицизмов русского языка
Отрицательный электрод Словарь русских синонимов. анод сущ., кол во синонимов: 1 электрод (10) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
анод — электровакуумного прибора; анод; отрасл. коллектор Электрод, основным назначением которого обычно является прием основного потока электронов при электрическом разряде … Политехнический терминологический толковый словарь
анод — (устройства) электрод, через который электрический ток входит в среду, имеющую удельную проводимость, отличную от удельной проводимости анода [СТ МЭК50(151) 78] анод EN anode electrode capable of emitting positive charge… … Справочник технического переводчика
— (от греческого anodos движение вверх, восхождение), электрод электронного или электротехнического прибора (например, электронной лампы, гальванического элемента, электролитической ванны), характеризующийся тем, что движение электронов во внешней… … Современная энциклопедия Толковый словарь Ожегова
— (от греч. anodos движение вверх), 1) электрод электронного или ионного прибора, соединяемый с положит. полюсом источника. 2) Положит. электрод источника электрич. тока (гальванич. элемента, аккумулятора). 3) Положит. электрод электрич. дуги.… … Физическая энциклопедия
Определить, какой из электродов является анодом, а какой – катодом, на 1-й взор кажется легко. Принято считать, что анод имеет негативный заряд, катод – правильный. Но на практике могут появиться путаницы в определении.
Инструкция
1. Анод – электрод, на котором протекает реакция окисления. А электрод, на котором происходит поправление, именуется катодом.
2. Возьмите для примера гальванический элемент Якоби-Даниэля. Он состоит из цинкового электрода, опущенного в раствор сульфата цинка, и медного электрода, находящегося в растворе сульфата меди. Растворы соприкасаются между собой, но не смешиваются – для этого между ними предусмотрена пористая перегородка.
Электролиз, подготовка к ЕГЭ по химии
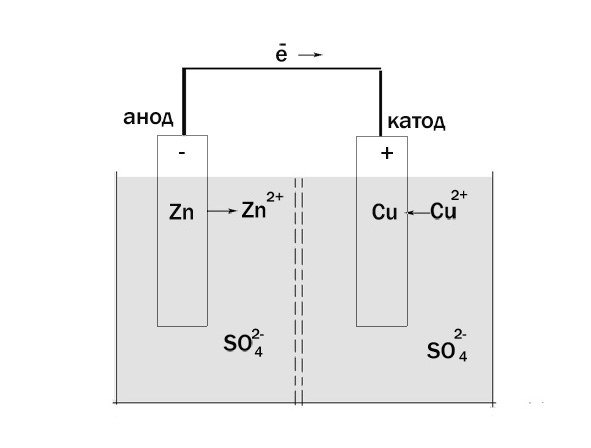
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na
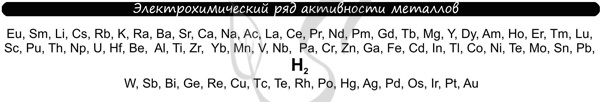
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaCl, BaI2, CH3COOLi.
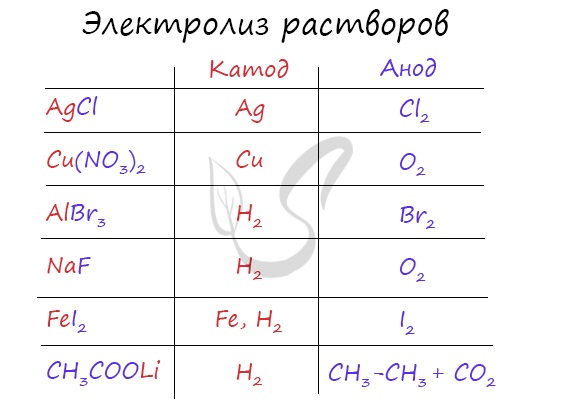
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое электролиз? Анод и катод. Физико-химический процесс
Долгое время людям не удавалось получать многие чистые вещества в свободном виде. Такие, например, как:
- металлы;
- щелочи;
- хлор;
- водород;
- перекись водорода;
- хлорорганика и прочие.
Их получали либо с большим содержанием примесей, от которых невозможно было избавиться, либо не синтезировали вовсе. А ведь соединения очень важные для использования в промышленности и быту. Но с открытием такого процесса, как электролиз, задача огромного масштаба была решена. Сегодня он применяется не только для синтеза, но и для многих других процессов.

Что такое электролиз? Как он происходит, из каких этапов складывается, в чем заключается основное преимущество данного метода, попробуем разобраться в ходе статьи.
Что такое электролиз?
Чтобы ответить на данный вопрос, следует сначала обратиться к терминологии и уяснить некоторые основные физико-химические понятия.
- Постоянный ток — это направленный поток электронов, исходящий от любого источника электричества.
- Электролит — вещество, раствор которого способен проводить электрический ток.
- Электроды — пластинки из определенных материалов, соединенные между собой, которые пропускают электричество через себя (анод и катод).
- Окислительно-восстановительная реакция — это процесс, при котором происходит изменение степеней окисления участников. То есть одни ионы окисляются и повышают значение степени окисления, другие, напротив, восстанавливаются, понижая ее.
Уяснив все эти термины, можно ответить на вопрос о том, что такое электролиз. Это окислительно-восстановительный процесс, заключающийся в пропускании постоянного тока через раствор электролита и завершающийся выделением разных продуктов на электродах.
Простейшая установка, которую можно назвать электролизером, включает в себя всего несколько компонентов:
- два стакана с электролитом;
- источник тока;
- два электрода, соединенных между собой.
В промышленности использует гораздо более сложные автоматизированные конструкции, позволяющие получать большие массы продуктов — электролизные ванны.
Процесс электролиза достаточно сложный, подчиняется нескольким теоретическим законам и протекает по установленным порядкам и правилам. Чтобы правильно предсказать его исход, необходимо четко усвоить все закономерности и возможные варианты прохождения.

Теоретические основы процесса
Самые главные основополагающие каноны, на которых держится электролиз, — законы Майкла Фарадея — знаменитого ученого-физика, известного своими работами в области изучения электрического тока и всех сопровождающих его процессов.
Всего таких правил два, каждое из которых описывает суть происходящих при электролизе процессов.
Первый закон
Первый закон Фарадея, формула которого записывается как m=kI*Δt, звучит следующим образом.
Масса вещества, выделяющегося на электроде, прямо пропорциональна тому электричеству, которое прошло через электролит.
Из формулы видно, что m — это масса вещества, I — сила тока, Δt — время, в течение которого он пропускался. Также имеется значение k, которое называется электрохимическим эквивалентом соединения. Эта величина зависит от природы самого соединения. Численно k равно массе вещества, которое выделяется на электроде при пропускании через электролит одной единицы электрического заряда.

Второе правило электролиза
Второй закон Фарадея, формула которого — m=M*I*Δt/n*F, звучит следующим образом. Электрохимический эквивалент соединения (k) прямо пропорционален его молярной массе и обратно пропорционален валентности вещества.
Приведенная формула является результатом вывода из всех объединенных. Она отражает суть второго закона электролиза. М — молярная масса соединения, I — сила тока, пропущенного за весь процесс, Δt — время всего электролиза, F — постоянная Фарадея, n — электроны, которые участвовали в процессе. Их число равно заряду иона, принимавшего участие в процессе.
Законы Фарадея помогают понять, что такое электролиз, а также рассчитать возможный выход продукта по массе, спрогнозировать необходимый результат и повлиять на ход процесса. Они и составляют теоретическую основу рассматриваемых преобразований.

Понятие об аноде и его типы
Очень важное значение в электролизе имеют электроды. Весь процесс зависит от материала, из которого они изготовлены, от их специфических свойств и характера. Поэтому рассмотрим более подробно каждый из них.
Анод — плюс, или положительный электрод. То есть такой, который присоединяется к «+» полюсу источника питания. Соответственно, к нему из раствора электролита будут двигаться отрицательные ионы или анионы. Они будут окисляться здесь, приобретая более высокую степень окисления.
Поэтому можно изобразить небольшую схему, которая поможет запомнить анодные процессы: анод «плюс» — анионы — окисление. При этом существует два основных типа данного электрода, в зависимости от которых, будет получаться тот или иной продукт.
- Нерастворимый, или инертный анод. К такому типу относят электрод, который служит лишь для передачи электронов и процессов окисления, однако сам он при этом не расходуется и не растворяется. Таковыми анодами являются изготовленные из графита, иридия, платины, угля и так далее. Используя такие электроды, можно получать металлы в чистом виде, газы (кислород, водород, хлор и так далее).
- Растворимый анод. При окислительных процессах он сам растворяется и влияет на исход всего электролиза. Основные материалы, из которых изготавливаются подобного типа электроды: никель, медь, кадмий, свинец, олово, цинк и прочие. Использование таких анодов необходимо для процессов электрорафинирования металлов, гальванопластике, нанесения защитных покрытий от коррозии и так далее.
Суть всех происходящих процессов на положительном электроде сводится к тому, чтобы разрядились наиболее электроотрицательные по значению потенциала ионы. ИВот почему это делают анионы бескислородных кислот и гидроксид-ион, а потом вода, если речь идет о растворе. Кислородсодержащие анионы в водном растворе электролита вообще на аноде не разряжаются, так как вода делает это быстрее, высвобождая кислород.

Катод и его характеристика
Катод — это отрицательно заряженный электрод (за счет скопления на нем электронов при пропускании электрического тока). Именно поэтому к нему движутся положительно заряженные ионы — катионы, которые претерпевают восстановление, то есть понижают степень окисления.
Здесь для запоминания также уместна схема: катод «минус» — катион — восстановление. В качестве материала для катода могут служить:
- нержавейка;
- медь;
- углерод;
- латунь;
- железо;
- алюминий и прочие.
Именно на этом электроде происходит восстановление металлов до чистых веществ, что является одним из основных способов получения их в промышленности. Также возможен переход электронов от анода к катоду, а если первый — растворимый, то его ионы восстанавливаются на отрицательном электроде. Здесь же происходит восстановление катионов водорода до газа Н2. Поэтому катод — это одна из самых важных частей в общей схеме процесса электролиза веществ.

Электролиз расплавов
С точки зрения химии рассматриваемый процесс имеет свое уравнение. При помощи него можно изобразить всю схему на бумаге и предугадать результат. Самое главное, на что следует обращать внимание, — наличие или отсутствие водной среды и тип анода (растворимый или нет).
Если необходимо получение следующих продуктов: щелочных и щелочноземельных металлов, щелочей, алюминия, бериллия, газы из кислородсодержащих анионов, тогда не может идти речь об электролизе раствора электролита. Только расплав, потому что иначе требуемых соединений не получится. Именно поэтому часто в промышленности синтезируют перечисленные вещества, используя их безводные сухие соли и гидроксиды.
В целом уравнение электролиза расплава выглядит достаточно просто и стандартно. Например, если рассмотреть и записать его для йодида калия, то вид будет следующий:
KI = K+ + I—
Катод (К) «-«: К+ + 1е = К0
Анод (А) «+»: 2I— — 2e = I20
Итог процесса: KI = K + I2.
Точно так же будет записываться электролиз любого металла, независимо от значения его электродного потенциала.
Электролиз водного раствора
Если речь идет о растворах электролитов, то исход процесса будет совсем другой. Ведь вода становится активным участником. Она способна также диссоциировать на ионы и разряжаться у электродов. Поэтому в подобных случаях важное значение имеет электродный потенциал ионов. Чем его отрицательное значение ниже, тем больше вероятность более быстрого окисления или восстановления.
Электролиз водного раствора подчиняется нескольким правилам, которые следует запомнить.
- Анодные процессы: разряжаются только анионы бескислородных кислот (кроме фтороводородной). Если ион кислородсодержащий или фторид-ион, то окисляться будет вода с высвобождением кислорода.
- Катодные процессы: металлы в электрохимическом ряду напряжений (до алюминия включительно) на катоде не восстанавливаются вследствие высокой химической активности. Это делает вода с высвобождением водорода. Металлы от алюминия до водорода восстанавливаются одновременно с водой до простых веществ. Те же, что стоят после водорода в ряду напряжений (малоактивные), легко подвергаются восстановлению до простых веществ.
Если следовать этим правилам, то можно изобразить любой электролиз и просчитать выход продукта. В случае с растворимым анодом схема меняется и становится гораздо более сложной.

Электролиз солей
Данные процессы используют для получения чистых металлов и газов, так как это технологически просто и экономически выгодно. К тому же продукты выходят с большой долей чистоты, что немаловажно.
Например, электролиз меди позволяет быстро получать ее в чистом виде из раствора любой соли. Чаще всего используется медный купорос или сульфат меди (II) — CuSO4.
Как из расплава, так и из раствора данной соли можно извлечь чистый металл, который так необходим практически во всех отраслях электротехники и металлостроительстве.
Значение и применение процесса
Электролиз — очень важный процесс. На его основе базируются такие необходимые технические операции, как:
- Рафинирование металлов.
- Электроэкстракция.
- Гальванотехника.
- Электросинтез.
- Нанесение антикоррозионных покрытий и другие.
что это такое, применение, сущность, правила, примеры
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.

Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.


Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:


k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
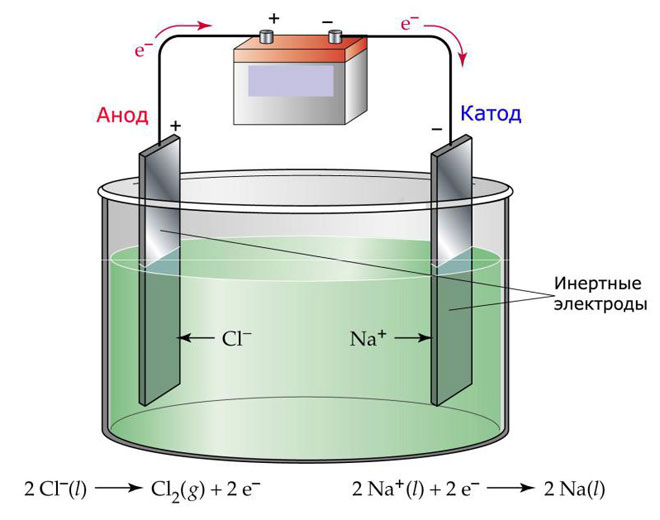
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.

При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.

Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
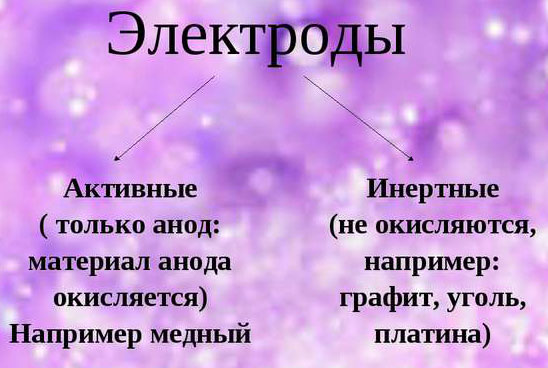

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.


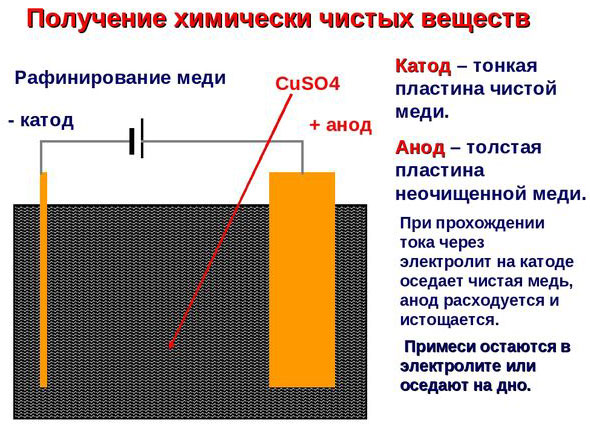
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
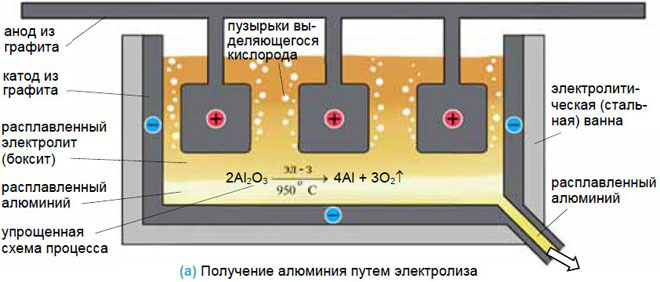

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Анод — Википедия



Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
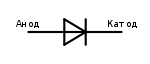
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.

