Опыты по химии. Электролиты и неэлектролиты
Чтобы поделиться, нажимайте
Зависимость электропроводности растворов от концентрации
Электропроводность веществ можно испытать с помощью прибора. Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Чем ярче горит лампочка, тем выше электропроводность вещества. Проверим, проводит ли электрический ток концентрированная уксусная кислота. Лампочка не загорается, электропроводность раствора ‑ низкая. Уксусная кислота ‑ слабый электролит. Разбавляем кислоту водой – спираль лампочки начинает накаляться. Разбавление приводит к образованию большего числа токопроводящих частиц ‑ ионов и увеличению проводимости раствора.
СH3COOН <=> СH3COO— + Н+
Оборудование: Установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), химические стаканы.
Техника безопасности. Необходимо соблюдать правила работы с кислотами и
правила обращения с электроприборами. Опыт проводить с напряжением не более 42 В.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Изменение диссоциации электролитов при различных температурах
Электропроводность веществ можно испытать с помощью прибора. Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Чем ярче горит лампочка, тем выше электропроводность вещества.Уксусная кислота – слабый электролит. Это означает, что она лишь частично диссоциирует в растворе и плохо проводит ток. Зависит ли диссоциация, а значит и проводимость электролита от температуры? Раствор при комнатной температуре слабо проводит электрический ток: спираль лампочки не накалена.Горячая уксусная кислота лучше проводит ток – лампочка загорается. Значит, с увеличением температуры в растворе становится больше ионов, диссоциация увеличивается.
Зависит ли диссоциация, а значит и проводимость электролита от температуры? Раствор при комнатной температуре слабо проводит электрический ток: спираль лампочки не накалена.Горячая уксусная кислота лучше проводит ток – лампочка загорается. Значит, с увеличением температуры в растворе становится больше ионов, диссоциация увеличивается.
СН3СООН <=> СН3СОО— + Н+
Оборудование: Установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), химические стаканы, термометр.
Техника безопасности. Необходимо соблюдать правила работы с кислотами и
правила обращения с электроприборами. Опыт проводить с напряжением не более 42 В.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Испытание веществ на электрическую проводимость
Электропроводность веществ можно испытать с помощью прибора. Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит.
Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит.
Испытание твердых веществ. Насыпаем сахар в чашку Петри и подносим к электродам. Лампочка не горит, значит сахар (органическое вещество) не проводит электрический ток. Щелочь ‑ твердый гидроксид натрия (NaOH), тоже не проводит ток. Возьмем поваренную соль — кристаллический хлорид натрия (NaCl). Лампочка не горит. Все испытанные твердые вещества не проводят электрический ток.
Электропроводны ли растворы этих веществ?
Испытание жидкостей. Раствор гидроксида натрия электропроводен: лампочка загорается. Лампочка горит и при испытании раствора поваренной соли. Электропроводен также раствор соляной кислоты (HCl). Все испытанные растворы оказались электролитами. ( Жидкости, проводящие электрический ток, называются электролитами. Электропроводность электролитов обеспечивают ионы .) Проверим, является ли электролитом дистиллированная вода. Лампочка не горит. Ионов в дистиллированной воде совсем немного, поэтому электропроводность воды низкая. Дистиллированная вода – очень слабый электролит. В растворе сахара нет подвижных заряженных частиц. Ток в цепи не идет. Раствор сахара – не электролит. Спирт, как и раствор сахара, не является электролитом.
( Жидкости, проводящие электрический ток, называются электролитами. Электропроводность электролитов обеспечивают ионы .) Проверим, является ли электролитом дистиллированная вода. Лампочка не горит. Ионов в дистиллированной воде совсем немного, поэтому электропроводность воды низкая. Дистиллированная вода – очень слабый электролит. В растворе сахара нет подвижных заряженных частиц. Ток в цепи не идет. Раствор сахара – не электролит. Спирт, как и раствор сахара, не является электролитом.
Оборудование: установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), чашки Петри, стаканы.
Техника безопасности.
Следует соблюдать правила работы с кислотами и щелочами, правила работы с электроприборами. Опыт проводить с напряжением не более 42 В.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Отличие ионов водорода от молекул водорода
Отличаются ли по химическим свойствам ионы водорода от молекул водорода? Приготовим раствор лакмуса. В одну из колб добавим соляной кислоты (HCl). Соляная кислота содержит ионы водорода. Фиолетовый раствор лакмуса под действием ионов водорода становится красным. А молекулы водорода повлияют ли на окраску лакмуса? Опустим в колбу с лакмусом газоотводную трубку: пусть молекулы водорода попадут в колбу из пробирки, где происходит реакция кислоты с цинком. Окраска лакмуса не меняется. Значит, ионы водорода H+ и молекулы водорода H2 – не одно и то же, их свойства различны.
В одну из колб добавим соляной кислоты (HCl). Соляная кислота содержит ионы водорода. Фиолетовый раствор лакмуса под действием ионов водорода становится красным. А молекулы водорода повлияют ли на окраску лакмуса? Опустим в колбу с лакмусом газоотводную трубку: пусть молекулы водорода попадут в колбу из пробирки, где происходит реакция кислоты с цинком. Окраска лакмуса не меняется. Значит, ионы водорода H+ и молекулы водорода H2 – не одно и то же, их свойства различны.
HC1 → H+ + C1—
Zn + 2HC1 = ZnC12 + H2 ↑
Оборудование: колбы, пипетка, пробирка, газоотводная трубка.
Техника безопасности. Следует соблюдать правила работы с кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Электропроводность расплава
Электропроводность веществ можно испытать с помощью прибора. Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Проводит ли ток расплав гидроксида натрия (NaOH)? Твердую щелочь нагреем до плавления. Поднесем расплав к электродам. Лампочка загорается. Значит, расплав щелочи проводит электрический ток.
Между электродами прибора – напряжение 36 вольт. Когда электроды помещают в вещество, становится ясно, проводит ли это вещество ток. Если вещество проводит электрический ток, цепь замыкается, и лампочка загорается. Если вещество неэлектропроводно, цепь остается разомкнутой, и лампочка не горит. Проводит ли ток расплав гидроксида натрия (NaOH)? Твердую щелочь нагреем до плавления. Поднесем расплав к электродам. Лампочка загорается. Значит, расплав щелочи проводит электрический ток.
Токопроводящий расплав – это электролит. (Жидкости, проводящие электрический ток, называются электролитами. Электропроводность электролитов обеспечивают ионы.) При плавлении щелочи ионы освобождаются и становятся подвижными. Расплав щелочи проводит электрический ток.
NaOH → Na+ + OH—
Оборудование: установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), спиртовка, фарфоровая чашка, держатель.
Техника безопасности.
Требуется особая осторожность при работе с расплавленной щелочью. Работать только в защитных очках или с применением защитного экрана. Соблюдать правила обращения с нагревательными приборами и электроприборами. Опыт проводить с напряжением не более 42 В.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Теория электролитической диссоциации (ТЭД) — что это такое? Основные положения и примеры
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).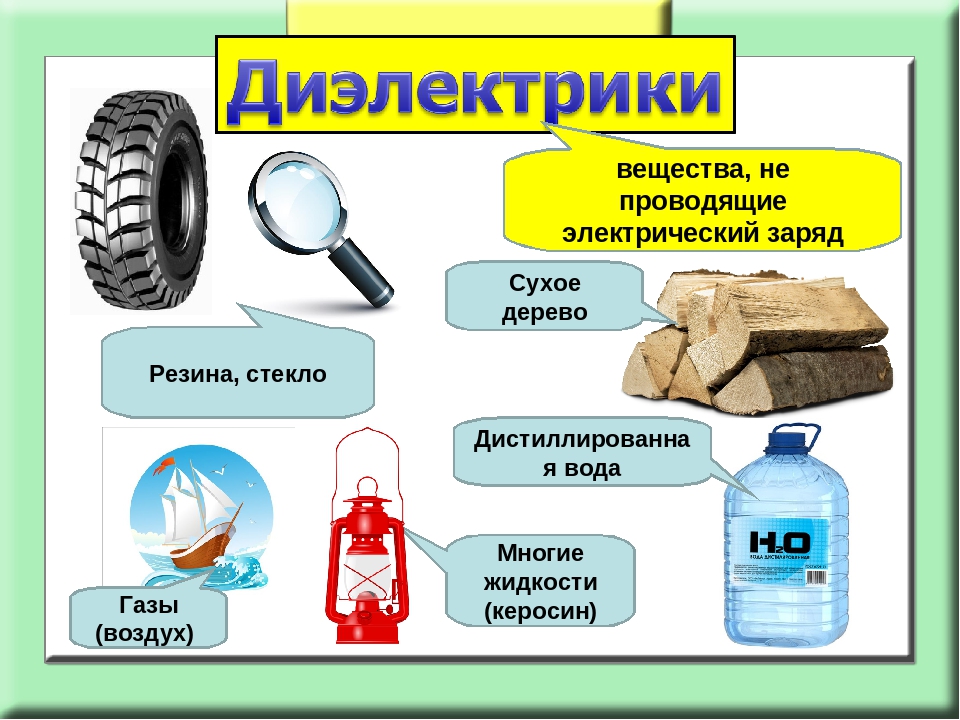
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A— (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na+ + Cl—.
Говорите правильно 🤓
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет. Все, что нужно — это контакт электролита с водой (растворителем).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl—, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na+ и Cl— окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
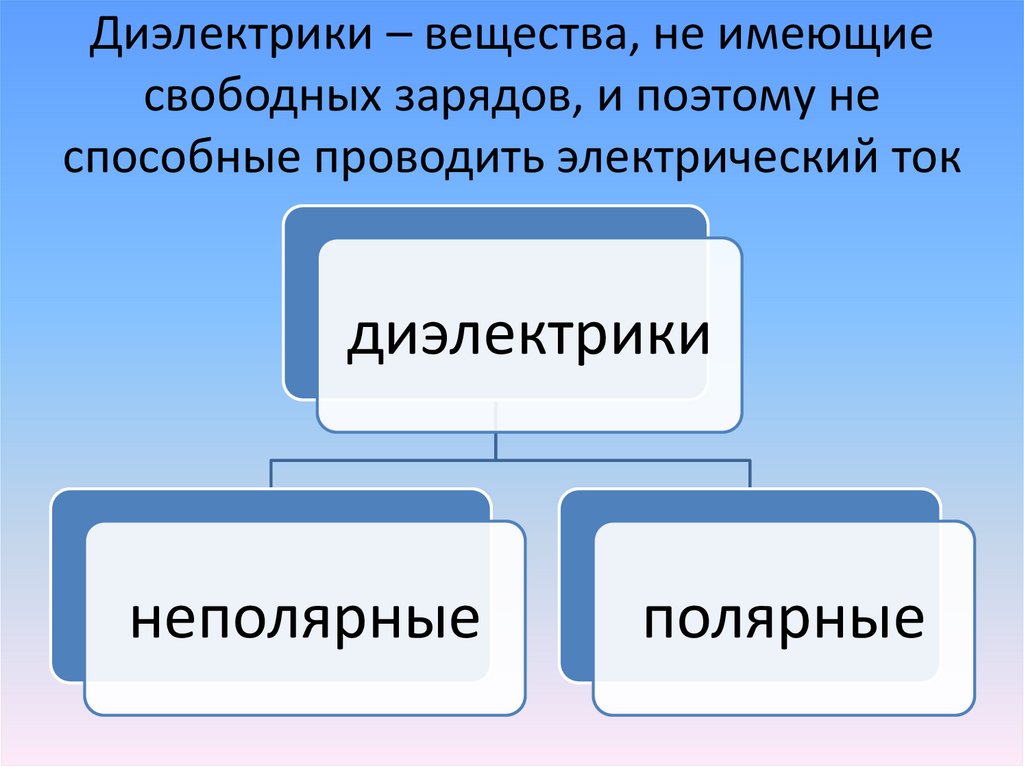
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
или .
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
слабые — ;
средние — ;
сильные — .
Важно!
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
H3PO4 ⇄ H+ + H2PO4—
H2PO4— ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3— и слабый электролит, поэтому реакция обратима.
Ca(HCO3)2 = Ca2+ + 2HCO3—
HCO3— ⇄ H+ + CO32-
H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
HCl = H+ + Cl—
H2SO4 = 2H+ + SO42-
HNO2 ⇄ H+ + NO2-
Многоосновные кислоты
AlOHCl2 = AlOH2+ + 2Cl—
AlOH2+ ⇄ Al3+ + OH—
Диссоциация оснований
Происходит с образованием гидроксильных групп OH— и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
NaOH = Na+ + OH
Слабые основания:
Cu(ON)2 ⇄ CuOH+ + OH—
CuOH+ ⇄ Cu2+ + OH—
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Na3PO4 = 3Na + PO43-
Кислые соли
KHSO4 = K+ + HSO4—
HSO4— ⇄ H+ + SO42-
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH—.
MgOH+ ⇄ Mg2+ + OH—
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
слабые электролиты;
газы.

Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Молекулярное уравнение: Pb(NO3)2 + H2SO4 → 2HNO3 + PbSO4↓
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb2+ + 2NO3— + 2H+ + SO4
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).
Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).
Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.

Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Какие компоненты ионного уравнения не раскладываются на ионы?
11.2: Ионы в растворе (электролиты)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49484
- Эд Витц, Джон В.
 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан - Цифровая библиотека химического образования (ChemEd DL)
В книге «Бинарные ионные соединения и их свойства» мы указываем, что когда ионное соединение растворяется в воде, положительные и отрицательные ионы, изначально присутствующие в кристаллической решетке, остаются в растворе. Их способность практически независимо перемещаться в растворе позволяет им переносить положительные или отрицательные электрические заряды из одного места в другое. Следовательно, раствор проводит электрический ток.
Вещества, растворы которых проводят электричество, называются электролитами. Все растворимые ионные соединения являются сильными электролитами. Они проводят очень хорошо, потому что они обеспечивают обильный запас ионов в растворе. Некоторые полярные ковалентные соединения также являются сильными электролитами. Типичными примерами являются HCl, HBr, HI и H 2 SO 4 , все из которых реагируют с H 2 O с образованием больших концентраций ионов. Раствор HCl, например, проводит даже лучше, чем раствор NaCl той же концентрации.
Раствор HCl, например, проводит даже лучше, чем раствор NaCl той же концентрации.
Влияние концентрации ионов на электрический ток, протекающий через раствор, показано на рисунке \(\PageIndex{1}\). Детали и на рисунке показывают, что происходит, когда батарея подключается через электросчетчик к двум инертным металлическим полоскам (электроды ), погруженным в этанол. В каждом кубическом дециметре такого раствора содержится 0,10 моль NaCl (то есть 0,10 моль Na + и 0,10 моль Cl – ). Электрический ток через раствор проводят как ионы Na + , движущиеся к отрицательному электроду, так и ионы Cl — , которые притягиваются к положительному электроду. Циферблат на измерителе показывает величину тока.
Электрический ток через раствор проводят как ионы Na + , движущиеся к отрицательному электроду, так и ионы Cl — , которые притягиваются к положительному электроду. Циферблат на измерителе показывает величину тока.
На рис. 1 b показано, что при замене 0,10- М раствора NaCl на 0,05- М раствора NaCl показание счетчика падает примерно вдвое от прежнего значения. Уменьшение вдвое концентрации NaCl вдвое уменьшает количество ионов между электродами, а вдвое меньшее количество ионов может нести только вдвое меньший электрический заряд. Поэтому ток вдвое меньше. Поскольку проводимость электрического тока напрямую зависит от концентрации ионов, она является полезным инструментом при изучении растворов.
Измерения электропроводности показывают, что большинство ковалентных соединений, если они вообще растворяются в воде, сохраняют свои первоначальные молекулярные структуры. Нейтральные молекулы не могут нести электрические заряды через раствор, поэтому ток не течет. Вещество, водный раствор которого проводит не лучше, чем сама вода, называется неэлектролитом . Некоторыми примерами являются кислород, O 2 , этанол, C 2 H 5 OH, и сахар, C 12 H 22 O 9.0034 11 .
Вещество, водный раствор которого проводит не лучше, чем сама вода, называется неэлектролитом . Некоторыми примерами являются кислород, O 2 , этанол, C 2 H 5 OH, и сахар, C 12 H 22 O 9.0034 11 .
Некоторые ковалентные вещества ведут себя как слабые электролиты — их растворы пропускают только небольшой ток, но он больше, чем у чистого растворителя. Примером является хлорид ртути (II) (показан на рисунке выше). Для раствора 100- M HgCl 2 показания счетчика показывают только около 0,2 процента тока от тока для 0,10 M NaCl. Кристалл HgCl 2 состоит из дискретных молекул, подобных показанным для HgBr 9.- \номер\]
(Двойные стрелки указывают на то, что ионизация происходит лишь в ограниченной степени и достигается равновесное состояние.) Поскольку только 0,2 процента HgCl 2 образует ионы, всего около 0,2 процента от тока 0,10 M NaCl.
Измерения электропроводности могут сказать нам больше, чем просто о том, является ли вещество сильным, слабым или неэлектролитом. Рассмотрим, например, данные в таблице \(\PageIndex{1}\), в которой показан электрический ток, проводимый через различные водные растворы при одинаковых условиях. При относительно низкой концентрации 0,001 M растворы сильных электролитов проводят в 2500–10 000 раз больше тока, чем чистый H 2 O, и примерно в 10 раз больше, чем слабые электролиты HC 2 H 3 O 2 (уксусная кислота ) и NH 3 (аммиак).
Более внимательное изучение данных для сильных электролитов показывает, что некоторые соединения, содержащие группы H или OH [такие как HCl или Ba(OH) 2 ], проводят необычно хорошо. Если исключить эти соединения, мы обнаружим, что электролиты 1:1 (соединения, состоящие из равного количества ионов +1 и ионов -1) обычно проводят примерно вдвое меньше тока, чем электролиты 2:2 (ионы +2 и -2). Электролиты 1:2 (ионы +1 и -2) или электролиты 2:1 (ионы +2 и -1).
Электролиты 1:2 (ионы +1 и -2) или электролиты 2:1 (ионы +2 и -1).
| Вещество | Ток/мА | Вещество | Ток/мА |
|---|---|---|---|
| Чистая вода | Электролиты 1:2 | ||
| Н 2 О | 3,69 x 10 -4 | Na 2 SO 4 | 2,134 |
| Слабые электролиты | Na 2 CO 3 | 2,24 | |
| HC 2 H 3 O 2 | 0,41 | К 2 СО 3 | 2,660 |
| НХ 3 | 0,28 | Электролиты 2:1 | |
| Электролиты 1:1 | MgCl 2 | 2,128 | |
| NaCl | 1,065 | CaCl 2 | 2,239 |
| НаИ | 1,069 | SrCl 2 | 2,290 |
| KCl | 1,273 | BaCl 2 | 2,312 |
| КИ | 1 282 | Ба(ОН) 2 | 4,14 |
| AgNO 3 | 1.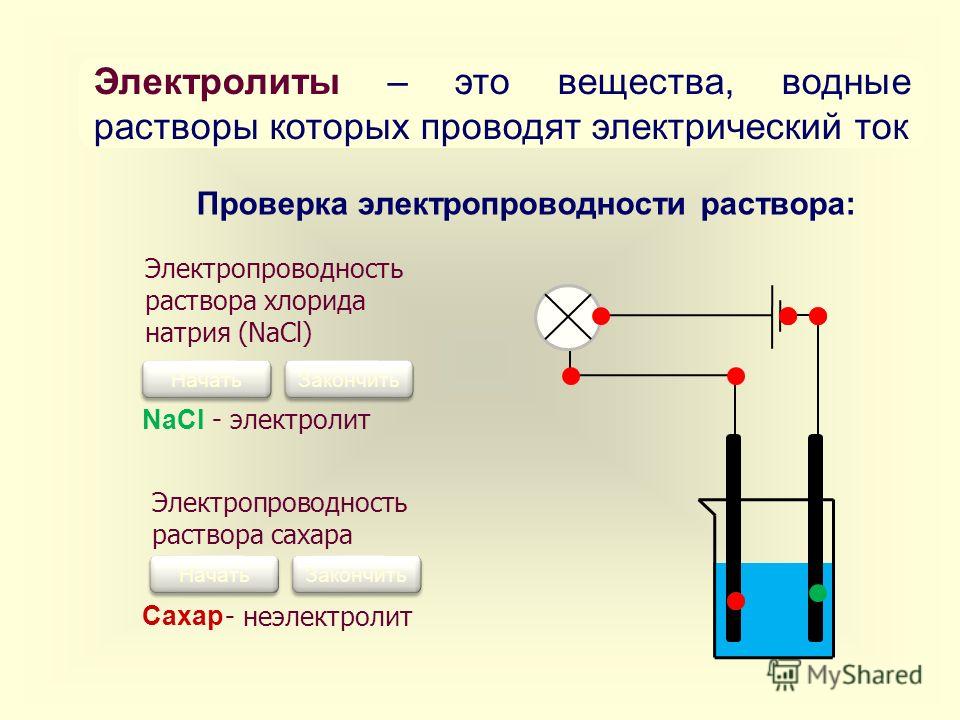 131 131 | 2:2 Электролиты | |
| HCl | 3,77 | MgSO 4 | 2,00 |
| HNO 3 | 3,75 | CaSO 4 | 2,086 |
| NaOH | 2,08 | CuSO 4 | 1,97 |
| КОН | 2,34 | ZnSO 4 | 1,97 |
* Все измерения относятся к cel1, в котором расстояние между электродами составляет 1,0 мм, а площадь каждого электрода составляет 1,0 см². Для получения табличных токов применяется разность потенциалов 1,0 В.
Для получения табличных токов применяется разность потенциалов 1,0 В.
Этому есть простая причина. В сходных условиях большинство ионов перемещаются в воде с сопоставимыми скоростями. Это означает, что ионы, подобные Mg 2+ или SO 4 2–, которые имеют двойной заряд, будут проводить через раствор вдвое больший ток, чем однозарядные ионы, такие как Na + или Cl – . Следовательно, 0,001 М раствор электролита 2:2, такого как MgSO 4 , будет проводить примерно вдвое лучше, чем 0,001 М раствор электролита 1:1, такого как NaCl.
Аналогичный аргумент применим к растворам электролитов 1:2 и 2:1. Раствор типа 0,001 М Na 2 SO 4 проводит примерно в два раза лучше, чем 0,001 M NaCl отчасти потому, что имеется вдвое больше ионов Na – , способных двигаться при подключении батареи, а также потому, что SO 4 2 – Ионы несут вдвое больший заряд, чем ионы Cl – при движении с той же скоростью. Эти различия в проводимости между различными типами сильных электролитов иногда могут быть очень полезными при принятии решения о том, какие ионы действительно присутствуют в данном растворе электролита, как ясно показывает следующий пример.
Эти различия в проводимости между различными типами сильных электролитов иногда могут быть очень полезными при принятии решения о том, какие ионы действительно присутствуют в данном растворе электролита, как ясно показывает следующий пример.
На основании данных таблицы \(\PageIndex{1}\) можно сделать второй, чуть более тонкий вывод. Когда электролит растворяется, каждый тип ионов вносит независимый вклад в ток, проводимый раствором. В этом можно убедиться, сравнив NaCl с KCl, а NaI с KI. В каждом случае соединение, содержащее K + , проводит примерно на 0,2 мА больше, чем соединение, содержащее Na + . Если применить это наблюдение к Na 2 CO 3 и K 2 CO 3 , каждая из которых образует в растворе в два раза больше ионов Na + или К + , мы находим, что разница в токе также вдвое больше — около 0,4 мА.
Таким образом, измерения электропроводности подтверждают наше утверждение о том, что каждый ион проявляет свои характерные свойства в водных растворах, независимо от присутствия других ионов. Одним из таких характерных свойств является количество электрического тока, которое может нести данная концентрация определенного типа иона.
Одним из таких характерных свойств является количество электрического тока, которое может нести данная концентрация определенного типа иона.
Пример \(\PageIndex{1}\): Ионы
При 18°C 0,001- М водный раствор гидрокарбоната калия, KHCO 3 , проводит ток 1,10 мА в ячейке того же конструкция, использованная для получения данных в таблице 11.1. Какие ионы присутствуют в растворе?
Раствор
Ссылаясь на Таблицу 6.2, в которой перечислены возможные многоатомные ионы, мы можем прийти к трем возможным вариантам ионов, из которых состоит KHCO 3 :
- К + и Н + и С 4+ и три О 2–
- K + и H + и CO 3 2–
- K + и HCO 3 –
Поскольку ток, проводимый раствором, находится в диапазоне от 1,0 до 1,3 мА, характерном для электролитов 1:1, вариант c является единственным разумным выбором.
Эта страница под названием 11.2: Ионы в растворе (электролиты) распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- электрод
- электролит
- ионное соединение
- неэлектролит
- сильный электролит
- слабый электролит
Как определить проводимость в соединениях
Обновлено 13 марта 2018 г.
Автор: Marie-Luise Blue
Соединения, проводящие ток, удерживаются вместе электростатическими силами или притяжением. Они содержат положительно заряженный атом или молекулу, называемую катионом, и отрицательно заряженный атом или молекулу, называемую анионом. В твердом состоянии эти соединения не проводят электричество, но при растворении в воде ионы диссоциируют и могут проводить ток. При высоких температурах, когда эти соединения становятся жидкими, катионы и анионы начинают течь и могут проводить электричество даже в отсутствие воды. Неионогенные соединения или соединения, не диссоциирующие на ионы, не проводят ток. Вы можете построить простую схему с лампочкой в качестве индикатора для проверки проводимости водных соединений. Тестовое соединение в этой установке замкнет цепь и включит лампочку, если оно может проводить ток.
При высоких температурах, когда эти соединения становятся жидкими, катионы и анионы начинают течь и могут проводить электричество даже в отсутствие воды. Неионогенные соединения или соединения, не диссоциирующие на ионы, не проводят ток. Вы можете построить простую схему с лампочкой в качестве индикатора для проверки проводимости водных соединений. Тестовое соединение в этой установке замкнет цепь и включит лампочку, если оно может проводить ток.
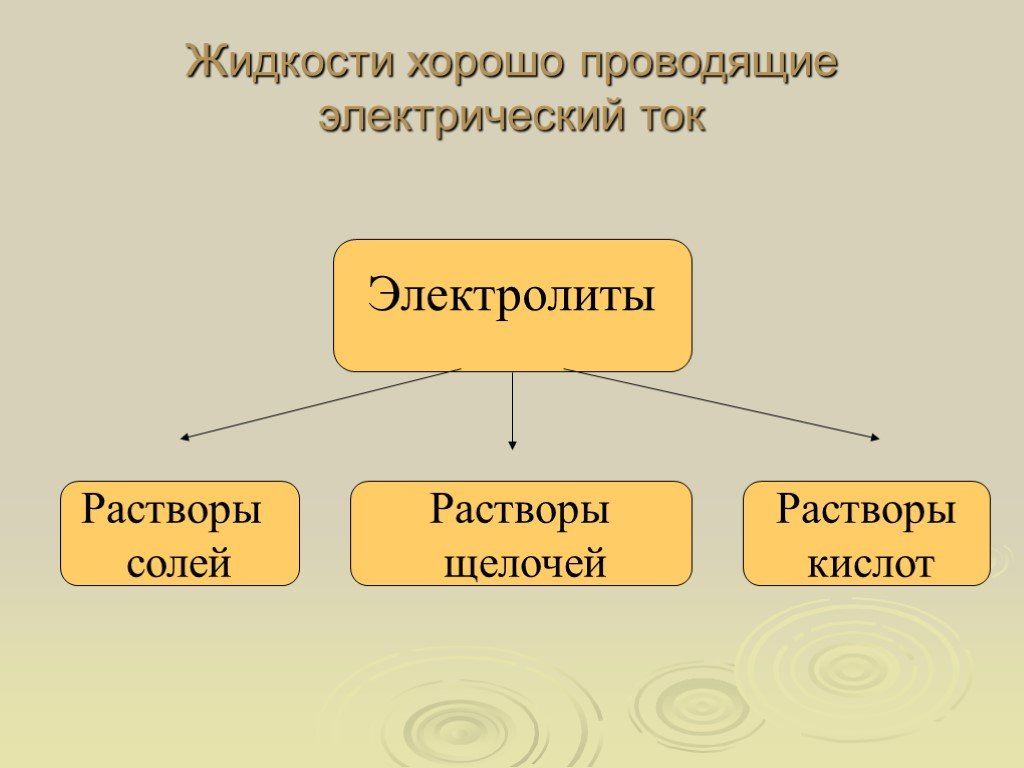
Соединения с высокой проводимостью
Самый простой способ определить, может ли соединение проводить ток, — определить его молекулярную структуру или состав. Соединения с высокой проводимостью полностью диссоциируют на заряженные атомы или молекулы или ионы при растворении в воде. Эти ионы могут эффективно двигаться и переносить ток. Чем выше концентрация ионов, тем больше проводимость. Поваренная соль, или хлорид натрия, является примером соединения с высокой электропроводностью. В воде диссоциирует на положительно заряженные ионы натрия и отрицательно заряженные ионы хлора. Сульфат аммония, хлорид кальция, соляная кислота, гидроксид натрия, фосфат натрия и нитрат цинка являются другими примерами соединений с высокой проводимостью, также известных как сильные электролиты. Сильные электролиты, как правило, представляют собой неорганические соединения, а это означает, что в них отсутствуют атомы углерода. Органические соединения или углеродсодержащие соединения часто являются слабыми электролитами или непроводящими.
В воде диссоциирует на положительно заряженные ионы натрия и отрицательно заряженные ионы хлора. Сульфат аммония, хлорид кальция, соляная кислота, гидроксид натрия, фосфат натрия и нитрат цинка являются другими примерами соединений с высокой проводимостью, также известных как сильные электролиты. Сильные электролиты, как правило, представляют собой неорганические соединения, а это означает, что в них отсутствуют атомы углерода. Органические соединения или углеродсодержащие соединения часто являются слабыми электролитами или непроводящими.
Соединения со слабой проводимостью
Соединения, лишь частично диссоциирующие в воде, являются слабыми электролитами и плохими проводниками электрического тока. Уксусная кислота, соединение, содержащееся в уксусе, является слабым электролитом, потому что она слабо диссоциирует в воде. Гидроксид аммония — еще один пример соединения со слабой проводимостью. Когда используются растворители, отличные от воды, ионная диссоциация и, следовательно, способность проводить ток изменяются. Ионизация слабых электролитов обычно увеличивается с повышением температуры. Чтобы сравнить проводимость различных соединений в воде, ученые используют удельную проводимость. Удельная проводимость — это мера проводимости соединения в воде при определенной температуре, обычно 25 градусов Цельсия. Удельная проводимость измеряется в единицах сименс или микросименс на сантиметр. Степень загрязнения воды можно определить путем измерения удельной проводимости, поскольку загрязненная вода содержит больше ионов и может генерировать большую проводимость.
Ионизация слабых электролитов обычно увеличивается с повышением температуры. Чтобы сравнить проводимость различных соединений в воде, ученые используют удельную проводимость. Удельная проводимость — это мера проводимости соединения в воде при определенной температуре, обычно 25 градусов Цельсия. Удельная проводимость измеряется в единицах сименс или микросименс на сантиметр. Степень загрязнения воды можно определить путем измерения удельной проводимости, поскольку загрязненная вода содержит больше ионов и может генерировать большую проводимость.
Непроводящие соединения
Соединения, не образующие ионов в воде, не могут проводить электрический ток. Сахар, или сахароза, является примером соединения, которое растворяется в воде, но не образует ионов. Молекулы растворенной сахарозы окружены скоплениями молекул воды и называются «гидратированными», но остаются незаряженными. Соединения, нерастворимые в воде, такие как карбонат кальция, также не обладают проводимостью: они не образуют ионов.


 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан