Физики нащупали границу квантового и классического мира при распаде молекул стронция
Американские физики определили, при каких условиях распад молекулы стронция Sr2 можно описать с помощью аппарата классической физики, а в каких уже нельзя обойтись без учета квантовых эффектов. Оказалось, что квантовые эффекты становятся существенными только при температуре, при которой вращательная энергия молекулы сравнима с энергией ее распада — диссоциации. Статья опубликована в Physical Review Letters, кратко о ней сообщает Physics, препринт работы выложен на сайте arXiv.org. Расширенная версия статьи опубликована в Physical Review A (препринт).
Обычно в химических реакциях участвует макроскопически много молекул, которые случайным образом сталкиваются и взаимодействуют друг с другом. Однако в последнее время физики научились так точно управлять атомами и молекулами, что смогли проводить реакции между отдельными частицами реагентов, охлажденных до очень низких температур. Например, в апреле этого года американские физики «собрали» молекулу NaCs из отдельных атомов натрия и цезия — для этого ученые захватывали и сталкивали частицы с помощью оптического пинцета. Это позволило ученым подробно исследовать эффекты, которые определяют ход химической реакции.
Например, в апреле этого года американские физики «собрали» молекулу NaCs из отдельных атомов натрия и цезия — для этого ученые захватывали и сталкивали частицы с помощью оптического пинцета. Это позволило ученым подробно исследовать эффекты, которые определяют ход химической реакции.
Как правило, для описания взаимодействия атомов, вовлеченных в химическую реакцию, ученые используют квазиклассическое приближение, разработанное в середине 1920-х годов Грегором Вентцелем, Хендриком Крамерсом и Леоном Бриллюэном (поэтому его иногда называют приближением ВКБ). Грубо говоря, в этом приближении молекула моделируется шариками-атомами, которые связаны «пружинкой» — химической связью, описываемой потенциалом взаимодействия. Если бы квазиклассическое приближение выполнялось, атомы диссоциировавшей («развалившейся») молекулы всегда бы разлетались в строго противоположные стороны. При больших температурах обычно так и происходит, однако при приближении к абсолютному нулю, когда тепловые колебания молекулы затухают, начинают играть роль более тонкие эффекты.
В частности, в 2016 году группа ученых под руководством Тани Зелевински (Tanya Zelevinsky) показала, что диссоциацию молекулы Sr2, охлажденной до температуры порядка 50 микрокельвинов, нельзя объяснить, ограничиваясь квазиклассическим приближением — построенное учеными угловое распределение атомов стронция-88, разлетающихся после распада молекулы, выглядело сложнее, чем предсказывает эта модель. Это позволило физикам показать, что при низких температурах взаимодействие частиц определяется квантовыми эффектами — в частности, резонансным рассеянием и подбарьерным туннелированием. К сожалению, исследователям не удалось установить границы применимости приближения и увидеть переход между «классическим» и «квантовым» режимом.
Два года спустя группа Зелевински вернулась к опыту с диссоциацией молекул стронция, чтобы изучить его более детально. Для этого ученые захватывали несколько тысяч молекул Sr2 в оптическую ловушку размером 30 × 730 микрометров и светили на них импульсами лазера длиной волны около 690 нанометров и длительностью порядка 20 микросекунд, в результате чего молекулы «разваливались» на атомы. Регулируя мощность лазерных вспышек, физики управляли температурой (то есть энергией колебаний) молекул, изменяя ее в диапазоне от 0,1 до 100 милликельвин. После этого исследователи «фотографировали» угловое распределение атомов стронция с помощью времяпролетной камеры (time-of-flight image), а также рассчитывали сечение распределения с помощью обратного преобразования Абеля.
Регулируя мощность лазерных вспышек, физики управляли температурой (то есть энергией колебаний) молекул, изменяя ее в диапазоне от 0,1 до 100 милликельвин. После этого исследователи «фотографировали» угловое распределение атомов стронция с помощью времяпролетной камеры (time-of-flight image), а также рассчитывали сечение распределения с помощью обратного преобразования Абеля.
Перед распадом молекула могла находиться в одном из двух возбужденных состояний — либо в состоянии, в котором потенциал взаимодействия не имеет барьера (0u+), либо в состоянии с барьером высотой порядка одного милликельвина (1u). Кроме того, состояния могли иметь различные колебательные квантовые числа (vibrational quantum number). В зависимости от формы потенциала и значения квантового числа вид распределения немного изменялся. Наконец, исследователи сравнивали полученные распределения с теоретическими расчетами, выполненными в рамках «чистой» квантовой механики или метода ВКБ.
В результате физики обнаружили, что квазиклассическое приближение достаточно хорошо описывает распад молекулы вплоть до температур порядка пяти кельвинов — при такой высокой температуре можно пренебречь квантовой статистикой, которой подчиняются атомы стронция, а потому оба метода дают примерно одинаковое распределение. Однако при снижении температуры метод ВКБ переставал работать, поскольку он упускал из вида волны рассеяния с нечетными значениями углового момента. По оценкам ученых, переломный момент наступает, когда вращательная энергия тепловых колебаний молекулы оказывается меньше, чем энергия ее диссоциации.
Авторы статьи подчеркивают, что «классическая природа» траекторий, которые они наблюдали при большой температуре, обусловлена большой кинетической энергией атомов, а не усреднением по большому ансамблю. При большой температуре — следовательно, большой энергии вращения молекулы, — характерное время вращения во много раз превышает характерное время диссоциации, а потому для описания процесса можно использовать квазиклассическое приближение. Еще можно сказать, что при большой температуре энергия атомов много больше высоты потенциальных барьеров, а потому они преодолевают их практически беспрепятственно. В обратном случае пренебречь этими эффектами нельзя. Тем не менее, и в квантовом, и в квазиклассическом режиме необходимо рассматривать квантовые состояния отдельных молекул.
Еще можно сказать, что при большой температуре энергия атомов много больше высоты потенциальных барьеров, а потому они преодолевают их практически беспрепятственно. В обратном случае пренебречь этими эффектами нельзя. Тем не менее, и в квантовом, и в квазиклассическом режиме необходимо рассматривать квантовые состояния отдельных молекул.
Вообще говоря, оптический пинцет, который группа Зелевински использовала для удерживания молекул, был придуман в середине 1980-х годов американским физиком Артуром Эшкиным. Изначально эта технология позволяла управлять только объектами микрометрового размера, однако в дальнейшем ученые увеличили ее точность в несколько тысяч раз. В настоящее время оптические пинцеты широко используются в биофизике и других областях науки для точного позиционирования мелких предметов. За эту разработку Шведская академия наук присудила вчера Артуру Эшкину Нобелевскую премию по физике. Подробнее про принцип работы оптического пинцета можно прочитать в материале «Скальпель и пинцет».
Дмитрий Трунин
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Энергия в клетке. Использование и хранение / Хабр
Всем привет! Эту статью я хотел посвятить клеточному ядру и ДНК. Но перед этим нужно затронуть то, как клетка хранит и использует энергию (спасибо spidgorny). Мы будем касаться вопросов связанных с энергией почти везде. Давайте заранее в них разберемся.
Из чего можно получать энергию? Да из всего! Растения используют световую энергию. Некоторые бактерии тоже. То есть органические вещества синтезируются из неорганических за счет световой энергии. + Есть хемотрофы. Они синтезируют органические вещества из неорганических за счет энергии окисления аммиака, сероводорода и др. веществ. А есть мы с вами. Мы — гетеротрофы. Кто это такие? Это те, кто не умеет синтезировать органические вещества из неорганических. То есть хемосинтез и фотосинтез, это не для нас. Мы берем готовую органику (съедаем). Разбираем ее на кусочки и либо используем, как строительный материал, либо разрушаем для получения энергии.
Что конкретно мы можем разбирать на энергию? Белки (сначала разбирая их на аминокислоты), жиры, углеводы и этиловый спирт (но это по желанию). То есть все эти вещества могут быть использованы, как источники энергии. Но для ее хранения мы используем жиры и углеводы. Обожаю углеводы! В нашем теле основным запасающим углеводом является гликоген.
Он состоит из остатков глюкозы. То есть это длинная, разветвленная цепочка, состоящая из одинаковых звеньев (глюкозы). При необходимости в энергии мы отщепляем по одному кусочку с конца цепи и окисляя его получаем энергию. Такой способ получения энергии характерен для всех клеток тела, но особенно много гликогена в клетках печени и мышечной ткани.
Теперь поговорим о жире. Он хранится в специальных клетках соединительной ткани. Имя им — адипоциты. По сути это клетки с огромной жировой каплей внутри.
При необходимости, организм достает жир из этих клеток, частично расщепляет и транспортирует.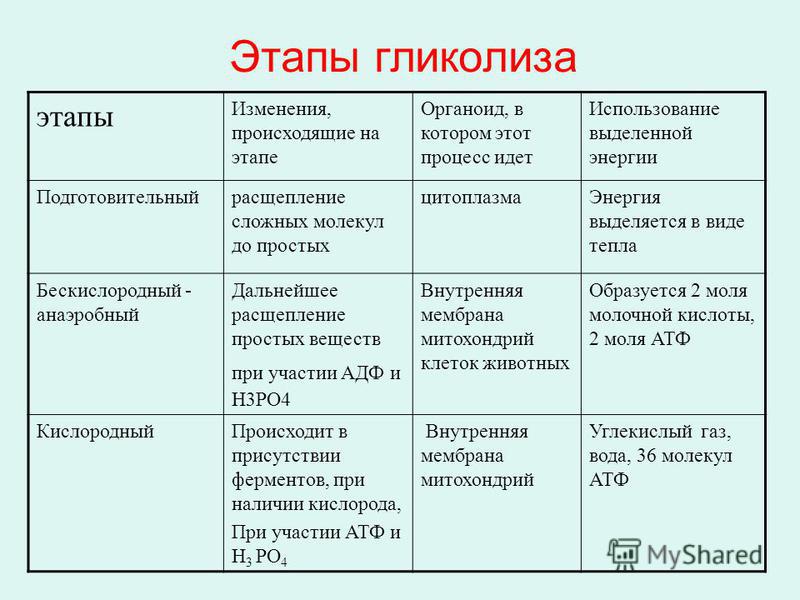 По месту доставки происходит окончательное расщепление с выделением и преобразованием энергии.
По месту доставки происходит окончательное расщепление с выделением и преобразованием энергии.
Довольно популярный вопрос: «Почему нельзя хранить всю энергию в виде жира, или гликогена?»
У этих источников энергии разное назначение. Из гликогена энергию можно получить довольно быстро. Его расщепление начинается почти сразу после начала мышечной работы, достигая пика к 1-2 минуте. Расщепление жиров протекает на несколько порядков медленней. То есть если вы спите, или медленно куда-то идете — у вас постоянный расход энергии, и его можно обеспечить расщепляя жиры. Но как только вы решите ускориться (упали сервера, побежали поднимать), резко потребуются
Есть еще одно важное различие. Гликоген связывает много воды. Примерно 3 г воды на 1 г гликогена. То есть, для 1 кг гликогена это уже 3 кг воды. Не оптимально… С жиром проще. Молекулы липидов (жиры=липиды), в которых запасается энергия не заряжены, в отличие от молекул воды и гликогена.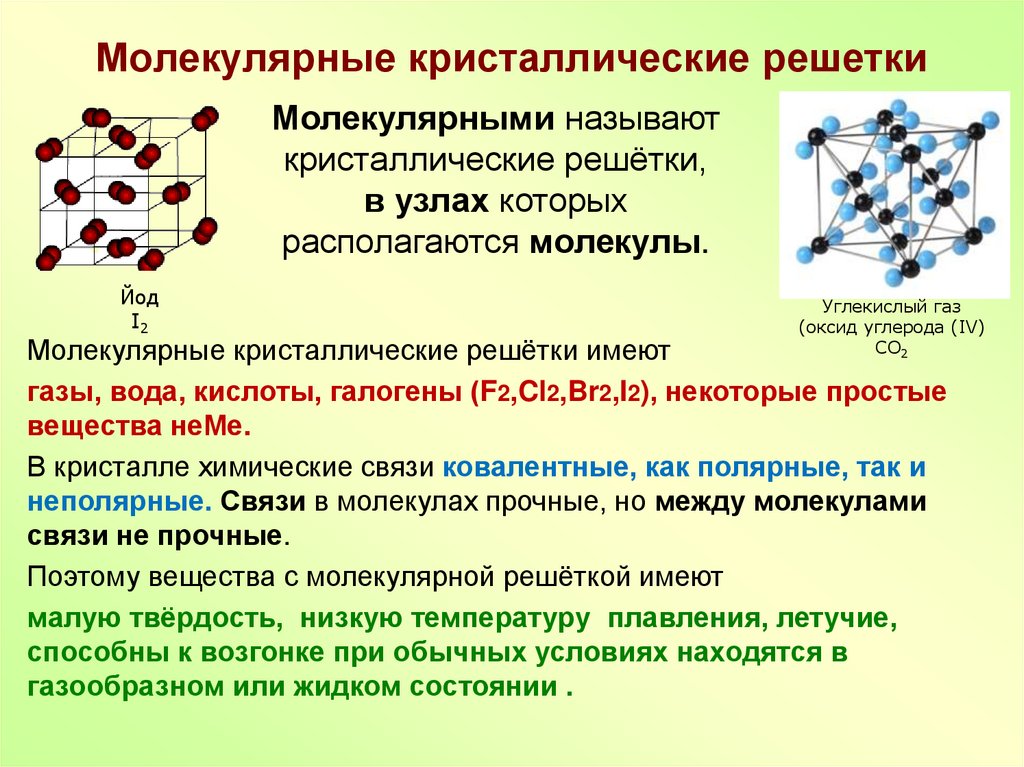
По сути, положительно заряженные атомы водорода взаимодействуют с отрицательно заряженными атомами кислорода. Получается стабильное и энергетически выгодное состояние.
Теперь представим молекулы липидов. Они не заряжены и не могут нормально взаимодействовать с поляризованными молекулами воды. Поэтому смесь липидов с водой энергетически невыгодна. Молекулы липидов не способны адсорбировать воду, как это делает гликоген. Они «кучкуются» в так называемые липидные капли, окружаются мембраной из фосфолипидов (одна их сторона заряжена и обращена к воде снаружи, вторая — не заряжена и смотрит на липиды капли). В итоге, у нас есть стабильная система, эффективно хранящая липиды и ничего лишнего.
Окей, мы разобрались с тем, в каких формах хранится энергия. А что с ней происходит дальше? Вот отщепили мы молекулу глюкозы от гликогена.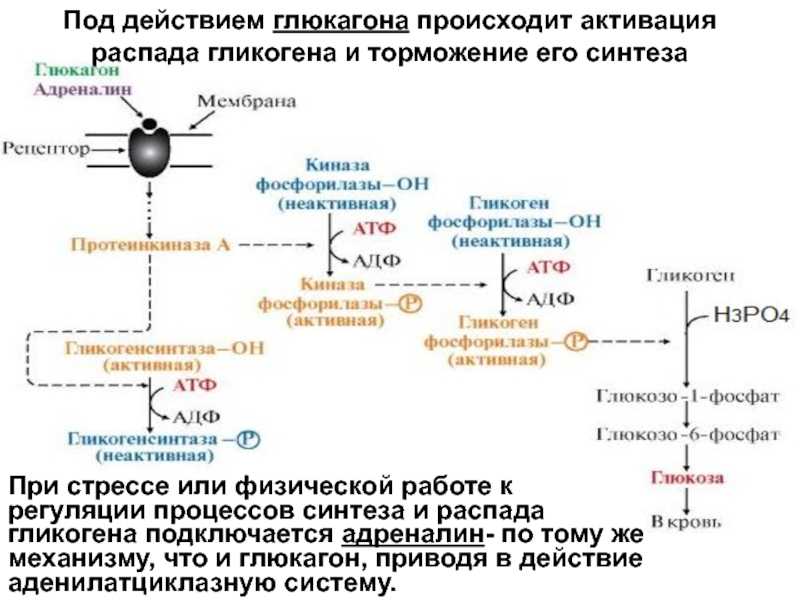 Превратили ее в энергию. Что это значит?
Превратили ее в энергию. Что это значит?
В клетке происходит порядка 1.000.000.000 реакций каждую секунду. При протекании реакции одно вещество трансформируется в другое. Что при этом происходит с его внутренней энергией? Она может уменьшаться, увеличиваться или не меняться. Если она уменьшается -> происходит выделение энергии. Если увеличивается -> нужно взять энергию из вне. Организм обычно совмещает такие реакции. То есть энергия, выделившаяся при протекании одной реакции идет на проведение второй.
Так вот в организме есть специальные соединения, макроэрги, которые способны накапливать и передавать энергию в ходе реакции. В их составе есть одна, или несколько химических связей, в которых и накапливается эта энергия. Теперь можно вернуться к глюкозе. Энергия выделившаяся при ее распаде запасется в связях этих макроэргов.
Разберем на примере.
Самым распространенным макроэргом (энергетической валютой) клетки является АТФ (Аденозинтрифосфат).
Выглядит примерно так.
В его состав входит азотистое основание аденин (одно из 4, используемых для кодирования информации в ДНК), сахар рибоза и три остатка фосфорной кислоты (поэтому и АденозинТРИфосфат). Именно в связях между остатками фосфорной кислоты накапливается энергия. При отщеплении одного остатка фосфорной кислоты образуется АДФ (АденозинДИфосфат). АДФ может выделять энергию, отрывая еще один остаток и превращаясь в АМФ (АденозинМОНОфосфат). Но эффективность отщепленная второго остатка намного ниже. Поэтому, обычно, организм стремится из АДФ снова получить АТФ. Происходит это примерно так. При распаде глюкозы, выделяющаяся энергия тратится на образование связи между двумя остатками фосфорной кислоты и образование ATP. Процесс многостадийный и пока мы его опустим.
Получившийся АТФ является универсальным источником энергии. Он используется везде, начиная от синтеза белка (для соединения аминокислот нужна энергия), заканчивая мышечной работой.
То есть химическая энергия связи переходит в механическую энергию. Вот реальные примеры белков, использующих АТФ для осуществления работы.
Знакомьтесь, это миозин. Моторный белок. Он осуществляет перемещение крупных внутриклеточных образований и участвует в сокращении мышц. Обратите внимание, у него имеется две «ножки». Используя энергию запасенную в 1 молекуле АТФ он осуществляет одно конформационное изменение, по сути один шаг. Самый наглядный пример перехода химической энергии АТФ в механическую.
Второй пример — Na/K насос. На первом этапе он связывает три молекулы Na и одну АТФ. Используя энергию АТФ, он меняет конформацию, выбрасывая Na из клетки. Затем он связывает две молекулы калия и, возвращаясь к исходной конформации, переносит калий в клетку.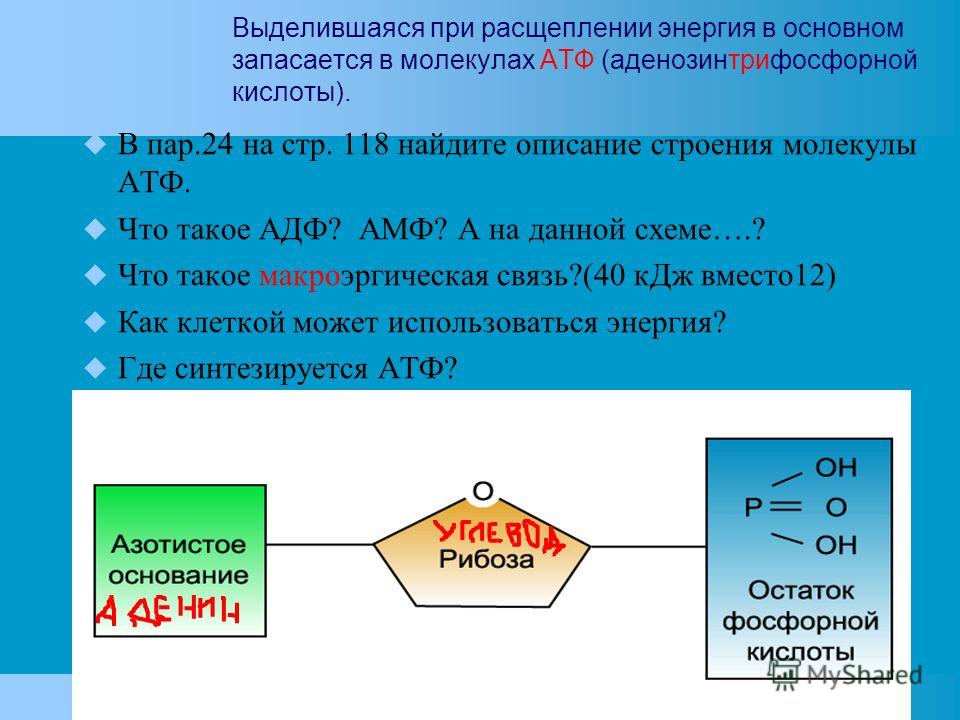 Штука крайне важная, позволяет поддерживать уровень внутриклеточного Na в норме.
Штука крайне важная, позволяет поддерживать уровень внутриклеточного Na в норме.
А если серьезно, то:
Пауза. Зачем нам АТФ? Почему мы не можем использовать запасенную в глюкозе энергию напрямую? Банально, если окислить глюкозу до CO2 за один раз, мгновенно выделится экстремально много энергии. И большая ее часть рассеется в виде тепла. Поэтому реакция разбивается на стадии. На каждой выделяется немного энергии, она запасается, и реакция продолжается пока вещество полностью не окислиться.
Подитожу. Запасается энергия в жирах и углеводах. Из углеводов ее можно извлечь быстрее, но в жирах можно запасти больше. Для проведения реакций клетка использует высокоэнергетические соединения, в которых запасается энергия распада жиров, углеводов и тд… АТФ — основное такое соединение в клетке. По сути, бери и используй. Однако не единственное. Но об этом позже.
P.S. Я попытался максимально упростить материал, поэтому появились некоторые неточности. Прошу ревностных биологов меня простить.
Прошу ревностных биологов меня простить.
Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Britannica Beyond
Мы создали новое место, где вопросы находятся в центре обучения. Вперед, продолжать. Просить. Мы не будем возражать. - Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полёта на Луну до управления космосом — мы изучаем широкий спектр тем, которые подпитывают наше любопытство к космосу!
Страница не найдена
Приносим свои извинения! Этот контент недоступен. Посетите домашнюю страницу Britannica или воспользуйтесь полем поиска ниже.
Поиск в Британике
Я люблю викторины о Я люблю Люси викторина
7 животных, которые зимой белеют
Джон Чилембве: новая статуя прославляет панафриканиста Малави, о котором мир забыл
Когда при разрыве химических связей выделяется энергия?
Категория: Химия Опубликовано: 27 июня 2013 г.
Разрыв химических связей никогда не высвобождает энергию во внешнюю среду. Энергия высвобождается только при образовании химических связей . В общем, химическая реакция включает две стадии: 1) разрываются исходные химические связи между атомами и 2) образуются новые связи. Эти два шага иногда для простоты объединяют в одно событие, но на самом деле это два отдельных события. Например, когда вы сжигаете метан (природный газ) в своей печи, метан вступает в реакцию с кислородом с образованием углекислого газа и воды. Химики часто записывают это как:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O + энергия
Это сбалансированное химическое уравнение обобщает химическую реакцию сжигания метана. Реагенты слева, продукты справа, а стрелка показывает момент, когда происходит реакция. Но за этой стрелой происходит много интересного. Более подробное уравнение будет выглядеть примерно так:
Ч 4 + 2 O 2 + немного энергии → С + 4 Н + 4 О → CO 2 + 2 H 2 O + много энергии
Первая строка уравнения содержит исходные реагенты: молекулы метана и молекулы кислорода. Первая стрелка представляет собой разрыв связей, требующий энергии. На средней линии находятся атомы, теперь отделившиеся от молекул и свободные для реакции. Вторая стрелка представляет собой формирование новых связей. В последней строке находятся конечные продукты. Чтобы запустить реакцию, требуется немного энергии, например искра от воспламенителя в вашей плите. Это связано с тем, что связи должны быть разорваны, прежде чем атомы смогут образовать новые связи, а для разрыва связей всегда требуется энергия. Как только реакция началась, выходная энергия одной сгоревшей молекулы метана становится входной энергией для следующей молекулы. Часть энергии, высвобождаемой каждой связью, которая образуется при образовании углекислого газа и воды, используется для разрыва дополнительных связей в молекулах метана и кислорода. Таким образом, реакция становится самоподдерживающейся (до тех пор, пока продолжают поступать метан и кислород). Зажигалку можно отключить. Если бы разрыв связей не требовал энергии, то топливу не требовалось бы устройство зажигания, чтобы начать гореть.
Первая стрелка представляет собой разрыв связей, требующий энергии. На средней линии находятся атомы, теперь отделившиеся от молекул и свободные для реакции. Вторая стрелка представляет собой формирование новых связей. В последней строке находятся конечные продукты. Чтобы запустить реакцию, требуется немного энергии, например искра от воспламенителя в вашей плите. Это связано с тем, что связи должны быть разорваны, прежде чем атомы смогут образовать новые связи, а для разрыва связей всегда требуется энергия. Как только реакция началась, выходная энергия одной сгоревшей молекулы метана становится входной энергией для следующей молекулы. Часть энергии, высвобождаемой каждой связью, которая образуется при образовании углекислого газа и воды, используется для разрыва дополнительных связей в молекулах метана и кислорода. Таким образом, реакция становится самоподдерживающейся (до тех пор, пока продолжают поступать метан и кислород). Зажигалку можно отключить. Если бы разрыв связей не требовал энергии, то топливу не требовалось бы устройство зажигания, чтобы начать гореть. Они просто начнут гореть сами по себе. Наличие свечей зажигания в вашем автомобиле свидетельствует о том, что для разрыва химических связей требуется энергия. (Обратите внимание, что сжигание метана на самом деле включает в себя множество более мелких стадий, поэтому вышеприведенное уравнение можно было бы расширить до еще более подробных деталей.)
Они просто начнут гореть сами по себе. Наличие свечей зажигания в вашем автомобиле свидетельствует о том, что для разрыва химических связей требуется энергия. (Обратите внимание, что сжигание метана на самом деле включает в себя множество более мелких стадий, поэтому вышеприведенное уравнение можно было бы расширить до еще более подробных деталей.)
В учебнике Advanced Biology Майкла Робертса, Майкла Джонатана Рейсса и Грейс Монгер указано:
Биологи часто говорят об энергии, которая становится доступной при расщеплении сахара, подразумевая, что разрыв химических связей в молекулах сахара высвобождает энергию. И все же из химии мы узнаем, что энергия высвобождается не тогда, когда химические связи разрываются , а когда они образуются . На самом деле дыхание поставляет энергию не за счет разрыва связей в субстрате, а за счет образования прочных связей в продуктах. Однако общим результатом процесса является выделение энергии, и именно в этом смысле биологи говорят о распаде сахара, дающем энергию.
Для сжигания пропана требуется воспламенитель, чтобы запустить реакцию, потому что химические связи должны быть разорваны, прежде чем могут образоваться новые, а для разрыва связей всегда требуется энергия. Изображение общественного достояния, источник: Кристофер С. Бэрд.
Полная энергия, вводимая или вырабатываемая в ходе реакции, равна энергии, выделившейся при образовании новых связей, за вычетом энергии, затраченной на разрыв первоначальных связей. Если для разрыва первоначальных связей требуется на больше энергии, чем высвобождается при образовании новых связей, то чистая энергия реакции отрицательна. Это означает, что для продолжения реакции в систему необходимо накачивать энергию. Такие реакции называются эндотермическими. Если если занимает меньше энергии для разрыва первоначальных связей, чем высвобождается при образовании новых связей, то чистая энергия реакции положительна. Этот факт означает, что энергия будет утекать из системы по мере протекания реакции. Этот факт также означает, что реакция может протекать сама по себе без какой-либо внешней энергии после ее начала. Такие реакции известны как экзотермические. (Эндотермические реакции также могут протекать сами по себе, если для поглощения достаточно внешней энергии в виде окружающего тепла.) Экзотермические реакции имеют тенденцию нагревать окружающую среду, в то время как эндотермические реакции имеют тенденцию охлаждать ее. Сжигание топлива является экзотермическим, потому что есть чистое выделение энергии. Приготовление яйца является эндотермическим процессом, потому что для приготовления яйца требуется чистая энергия. Суть в том, что как эндотермические, так и экзотермические реакции включают разрыв связей, и поэтому обе требуют энергии для начала.
Этот факт также означает, что реакция может протекать сама по себе без какой-либо внешней энергии после ее начала. Такие реакции известны как экзотермические. (Эндотермические реакции также могут протекать сами по себе, если для поглощения достаточно внешней энергии в виде окружающего тепла.) Экзотермические реакции имеют тенденцию нагревать окружающую среду, в то время как эндотермические реакции имеют тенденцию охлаждать ее. Сжигание топлива является экзотермическим, потому что есть чистое выделение энергии. Приготовление яйца является эндотермическим процессом, потому что для приготовления яйца требуется чистая энергия. Суть в том, что как эндотермические, так и экзотермические реакции включают разрыв связей, и поэтому обе требуют энергии для начала.
Понятно, что разрыв связей всегда требует энергии. Химическая связь удерживает два атома вместе. Чтобы разорвать связь, вы должны бороться с ней, как будто растягиваете резиновую ленту, пока она не порвется. Это требует энергии.