Гальванизация и электрофорез (ионофорез) — что это, разница, применение
Электрофорез — это введение различных лекарственных и косметических препаратов с помощью электрического тока. Электрофорез можно проводить с помощью постоянного (гальванического) тока, а также с помощью некоторых видов импульсных токов.
Гальванический ток в современной косметологии применяется при гальванизации, ионофорезе, дезинкрустации и ионной мезотерапии. Ток, который используется для проведения процедур, имеет традиционные, устоявшиеся характеристики: постоянный непрерывный, напряжение 60-80 Вт, сила тока до 50 мА (такой ток называют гальваническим). Воздействие на организм таким током через различные электроды называют гальванизацией.
Около 200 лет назад итальянский физик А.Вольта создал генератор непрерывного тока. Луиджи Гальвани исследовал его действие для начала на лягушках. Очень скоро гальванический ток, как несомненный «хай тек» и новейшее слово в науке 19 века, стал применяться в медицине.
Электрофорез
В косметологии электрофорез лекарственных препаратов чаще называют ионофорезом. Термин не совсем точный, но уже привычный. Технически ионофорез отличается от гальванизации только наличием под электродом лекарственного вещества.
Электрофорез (ионофорез) омыляющих веществ в сочетании с действием отрицательного полюса гальванического тока применяется в косметологии для омыления комедонов. Процедура с использованием аппаратов для гальванизации и ионофореза носит название дезинкрустации, или гальванической чистки.
Способность гальванического тока доставлять лекарственные вещества вглубь кожи используется в процедуре ионной мезотерапии, или ионотерапии. По сути это электрофорез лекарственных веществ при помощи стационарных электродов. Процедура проводится без инъекций. Показания, лечебная тактика и рецептура составления коктейлей соответствуют принятым в мезотерапии схемам с поправкой на форетичность препаратов.
Основные понятия
- Гальванизация = лечебное действие постоянного тока.
- Ионофорез = гальванизация + лекарственное вещество.
- Ионная мезотерапия = ионофорез стационарными электродами.
- Дезинкрустация = ионофорез омыляющих веществ.
Механизм действия метода гальванизации
В основе действия постоянного тока — процесс электролиза. Вещества, находящиеся возле электродов, распадаются на ионы. Ионы перемещаются под действием тока. Молекулы воды распадаются на ионы H+ и OH-. Возле электродов ионы взаимодействуют с водой, образуя продукты электролиза: кислоту и щёлочь.
Продукты электролиза могут вызывать химические ожоги в месте наложения электродов: щелочной ожог под катодом и кислотный под анодом. Это особенно актуально для стационарного расположения электродов. Чтобы избежать этого, электрод отделяют от кожи гидрофильной прокладкой. После процедуры прокладку нужно промыть или сменить.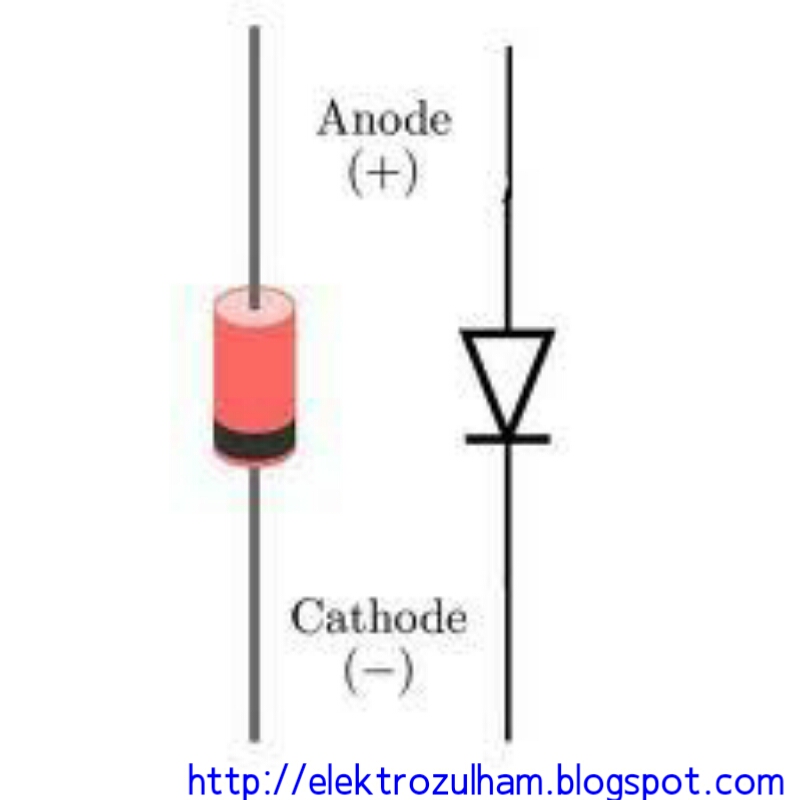
Изменение концентрации ионов ведёт к раздражению рецепторов кожи, при этом возникает лёгкое жжение и покалывание. Прохождение тока через ткани вызывает поляризацию — накопление ионов на биологических мембранах. При определённой концентрации ионов клетки переходят в возбуждённое (электрически активное) состояние. Меняются клеточный и тканевой обмен, возбудимость клетки.
При этом увеличивается пассивный транспорт крупных белковых молекул и других веществ, не несущих заряда (электродиффузия), и гидратированных ионов (электроосмос). Это означает ускорение клеточного и внутриклеточного обновления: быстрое поступление строительного материала, питательных и регулирующих веществ, а также своевременное выведение продуктов обмена из клетки.
Гальванизация
Гальванизация проводится стационарными, подвижными электродами или с помощью ванночек. Для проведения тока используется физраствор или проводящий гель. Выбор активного электрода зависит от показаний. Отрицательный и положительный электрод оказывают разное действие на ткани:
Отрицательный и положительный электрод оказывают разное действие на ткани:
Показания для гальванизации: все виды себореи, сухая увядающая кожа, постугревые рубцы.
Как вещества проникают в кожу при помощи тока?
- Постоянный электрический ток вызывает перемещение ионов.
- При помощи постоянного тока можно вводить через кожу и слизистые как мелкие, так и более крупные частицы лекарственных веществ, несущие электрический заряд.
- Метод введения через кожу и слизистые лекарственных ионов при помощи тока называют электрофорезом (ионофорезом).
- Заряженные частицы отталкиваются от одноимённого электрода и уходят вглубь кожи.
- Таким образом, с отрицательного электрода вводятся отрицательно заряженные ионы.
- Наибольшая подвижность у лекарственных веществ, растворённых в воде.
- Вводимые лекарственные ионы проникают в эпидермис и накапливаются в верхних слоях дермы. При ионофорезе вещества уходят на глубину до 1,5 см.

- В зоне воздействия после процедуры образуется депо, из которого препарат проникает в клетки постепенно. Период действия лекарственного вещества составляет от 3 часов до 15-20 суток.
Видео: вебинар об электрофорезе и гальванизации
Вебинар провела Н. В. Баховец, кандидат медицинских наук, физиотерапевт, косметолог.
Термины и понятия, используемые при электрофорезе и гальванизации
- Для проведения процедуры всегда используют два электрода: положительный и отрицательный.
- Отрицательный электрод называют катодом. Обычно все провода и соединения от отрицательного полюса выполняют в чёрном цвете.
- Положительный электрод называют анодом. Он маркируется красным цветом.
- Электроды, которые используются в процедуре, могут быть разной площади.
 На меньшем электроде плотность тока выше и действие его более выражено. Меньший электрод называют активным.
На меньшем электроде плотность тока выше и действие его более выражено. Меньший электрод называют активным. - Активным электродом воздействуют на проблемную зону.
- Пассивный (индифферентный) — электрод большей площади. Обычно он находится в руке пациента или закрепляется на теле.
- Пассивный электрод тоже может нести лечебную нагрузку. Можно проводить двуполярный ионофорез — с отрицательного электрода будут впитываться отрицательно заряженные ионы, а с положительного, соответственно, положительно заряженные.
- Если электроды по площади равны, более выраженные ощущения возникают под отрицательным электродом.
- Полярность вещества — заряд его активных частиц. От электрода отталкиваются одноимённые ионы и уходят вглубь тканей. Поэтому отрицательные ионы вводятся с отрицательного электрода.
Виды электродов для электрофореза

Лабильные электроды используют для скользящей обработки кожи лица, шеи, декольте. Это металлические электроды разной формы. Форма подбирается для удобства работы. Лабильные электроды обязательно должны скользить по гелю или водному раствору. Высыхание раствора снижает проводимость кожи и появляются неприятные покалывания. Конический электрод обычно используют для проработки зоны вокруг глаз. Сферический или электрод-валик — для щёк, шеи и декольте.
Стационарные электроды — токопроводящие пластины, которые закрепляют на коже. Стационарные электроды бывают металлическими (свинцовые или другие металлические пластины), резиновыми (из токопроводящего латекса) и графитовыми (одноразовые пластины графитизированной бумаги). Стационарный электрод находится на коже 10-30 мин. Поэтому под электродом обязательно должна быть прокладка из ткани или бумаги толщиной 0.5-1 см. Прокладку смачивают водой или физраствором.
При проведении ионофореза прокладку смачивают раствором лекарственного вещества.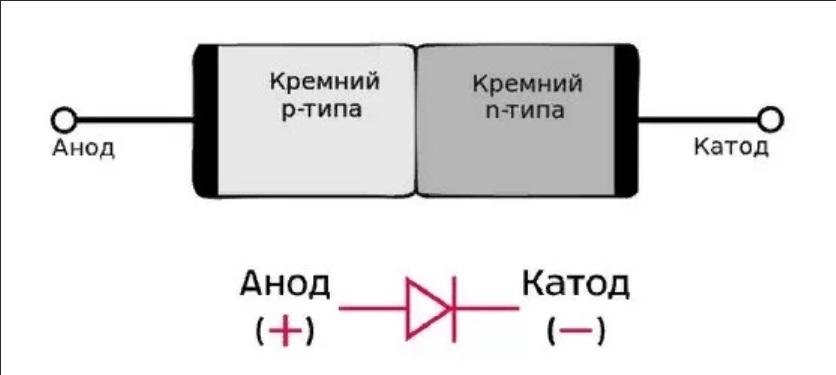 Назначение прокладки — улучшить проведение тока и защитить кожу от раздражающих веществ, которые вырабатываются на электродах. Прокладку нужно после каждой процедуры промыть или продезинфицировать. Удобно использовать разовые салфетки.
Назначение прокладки — улучшить проведение тока и защитить кожу от раздражающих веществ, которые вырабатываются на электродах. Прокладку нужно после каждой процедуры промыть или продезинфицировать. Удобно использовать разовые салфетки.
Электроды для гальванических ванночек представляют собой графитовые пластины, которые укладывают в ёмкость с водой. В этом случае вся вода или раствор ведут себя как электрод. Впитывание лекарственных веществ в кожу происходит из воды.
Противопоказания к гальванизации
Общие противопоказания для электротерапии: онкологические и преонкологические заболевания, лихорадочные состояния, гнойные процессы, обширные нарушения целостности кожи, системные заболевания кожи, хроническая сердечная и почечная недостаточность, беременность, наличие кардиостимулятора, индивидуальная непереносимость тока.
Специфические противопоказания (при работе на лице): сыпи, экзема, чувствительность зубов, зубные кисты, заболевания щитовидной железы, кисты и опухолевые заболевания груди.
Противопоказания к ионофорезу
Противопоказаниями к ионофорезу являются все противопоказания к проведению гальванизации плюс непереносимость вводимого вещества.
Подробнее о технике проведения ионофореза и гальванизации в косметологии, и о веществах, которые для этого применяются – в методическом пособии Гальванизация, ионофорез, дезинкрустация и в книге Н. Баховец Эстетика лица: методы аппаратной косметологии.
Оцените материал:
Средний рейтинг: 4.7 / 5
Наталия Баховец
Автор статьи: кандидат медицинских наук, физиотерапевт, косметолог, аспирант кафедры физиотерапии СПбГМА им. И.М. Мечникова, автор многочисленных книг и методических пособий по аппаратной косметологии, руководитель и методолог учебного центра АЮНА.
Главные ошибки при оцинковке кузова автомобиля своими силами — Лайфхак
- Лайфхак
- Эксплуатация
Фото vesta-site.ru
Оцинковка кузова автомобиля — самая результативная технология борьбы с коррозией, позволяющая практически без последствий эксплуатировать авто в самых неблагоприятных условиях. Правда, весьма дорогостоящая. Не мудрено поэтому, что владельцы подержанных авто, особенно тех, что уже «зацвели», предпочитают проводить эту процедуру самостоятельно. Но, как правило, без особого успеха. Почему, и как правильно цинковать машину в домашних условиях, разобрался портал «АвтоВзгляд».
Правда, весьма дорогостоящая. Не мудрено поэтому, что владельцы подержанных авто, особенно тех, что уже «зацвели», предпочитают проводить эту процедуру самостоятельно. Но, как правило, без особого успеха. Почему, и как правильно цинковать машину в домашних условиях, разобрался портал «АвтоВзгляд».
Дмитрий Цыпкин
При самостоятельном кузовном ремонте заботливый водитель предпочитает покрыть чем-нибудь голый металл перед покраской. И выбор, как правило, падает на «что-нибудь с цинком». Однако мло кто знает, что на рынке сегодня ничтожно мало специальных составов для настоящего цинкования. В магазинах автовладельцу чаще всего впаривают грунты с, якобы, цинком, и невероятными преобразователями ржавчины в цинк. Все это мало относится к настоящему цинкованию.
НАПРАСНЫЕ СЛОВА…
Итак, на вашем автомобиле появился расползающийся «жучок» ржавчины. В случае с подержанными авто — ситуация частая, особенно в районе порогов и колесных арок. Обычно эти места просто зачищают от рыхлой ржавчины, смачивают каким-нибудь преобразователем, наносят грунт и краску.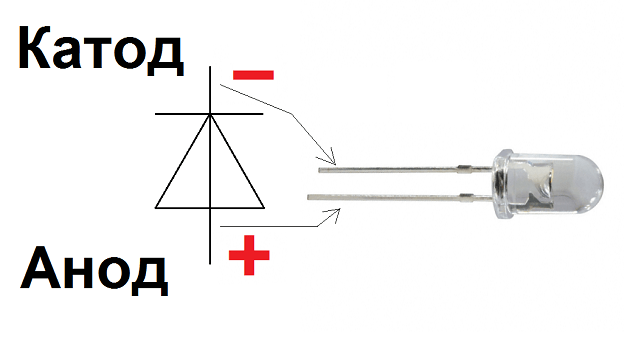 Какое-то время все нормально, а потом ржа вылезает вновь. Как же так? Ведь при подготовке использовали преобразователь ржавчины в цинк! По крайней мере, что-то такое было написано на этикетке.
Какое-то время все нормально, а потом ржа вылезает вновь. Как же так? Ведь при подготовке использовали преобразователь ржавчины в цинк! По крайней мере, что-то такое было написано на этикетке.
На самом деле все подобные препарата сделаны на основе ортофосфорной кислоты и максимум, что может подобный состав — фосфатировать поверхность, причем это будет пористое фосфатирование, которое в дальнейшем заржавеет. Получившаяся пленка не может использоваться как самостоятельная защита — только лишь под покраску. Соответственно, если краска некачественная, либо просто слезла — этот слой не защитит от коррозии.
Фото a.d-cd.net
ЧТО ВЫБРАТЬ?
На полках наших магазинов есть и реальные составы для самостоятельного цинкования, причем двух видов — для холодного цинкования (это процесс еще называют цинкирование) и для гальванического (в комплекте обычно идут и электролит, и анод), но стоят они на порядок дороже преобразователей. Холодное цинкование в расчет не берем, его изначально придумали для покрытия металлоконструкций, оно неустойчиво к органическим растворителям и механическим повреждениям. Нас интересует гальванической способ нанесения цинка, при этом все необходимое для этого процесса можно сделать дома. Итак, понадобится для того, чтобы оцинковать участок кузова?
Нас интересует гальванической способ нанесения цинка, при этом все необходимое для этого процесса можно сделать дома. Итак, понадобится для того, чтобы оцинковать участок кузова?
Прежде чем приступить — следует помнить про соблюдение техники безопасности при работе с реактивами: использовать респираторную маска, резиновые перчатки, защитные очки, а все манипуляции проводить на открытом воздухе или в хорошо проветриваемом помещении.
ПЛЮС КИПЯТОК
Этап первый. Подготовка металла. Поверхность стали должна быть полностью зачищена от ржавчины и краски. Цинк на ржавчину не ложится, на краску — тем более. Используем наждачную бумагу или специальные насадки на дрель. Малогабаритную деталь проще всего прокипятить в 10-процентном (100 грамм кислоты на 900 мл воды) растворе лимонной кислоты до полного уничтожения ржавчины. Затем поверхность обезжирить.
Этап второй. Подготовка электролита и анода. Гальванический процесс цинкования таков. В растворе электролита (электролит служит проводником вещества) цинковый анод (то есть плюс) передает цинк на катод (то есть минус). В Сети бродит множество рецептов электролита. Самый простой — использовать соляную кислоту, в которой растворяют цинк.
В Сети бродит множество рецептов электролита. Самый простой — использовать соляную кислоту, в которой растворяют цинк.
Фото vash-avtomaster.narod.ru
Кислоту можно купить в магазине химических реактивов, либо в хозяйственном. Цинк — в том же магазине химреактивов, либо приобрести обычные солевые батарейки и извлечь из них корпус — он сделан из цинка. Цинк нужно растворять до тех пор, пока он не перестанет реагировать. При этом выделяется газ, так что все манипуляции, повторимся, нужно проводить на улице или в хорошо проветриваемом помещении.
Электролит посложнее делается таким образом — в 62 миллилитрах воды растворяем 12 граммов хлористого цинка, 23 грамма хлористого калия и 3 грамма борной кислоты. Если нужно больше электролита, ингредиенты нужно увеличивать пропорционально. Подобные реактивы проще всего взять в специальном магазине.
МЕДЛЕННО И ПЕЧАЛЬНО
Этап третий. У нас есть полностью подготовленная поверхность — очищенный и обезжиренный металл, анод в виде цинкового корпуса от батарейки, электролит. Обернем анод ватным диском, либо ватой, либо сложенной в несколько слоев марлей. Подключим анод к плюсу автомобильного аккумулятора через провод подходящей длины, а минус к кузову автомобиля. Обмакнем вату на аноде в электролит так, чтобы она пропиталась. Теперь медленными движениями начинаем водить по голому металлу. На нем должно появиться серое покрытие.
Обернем анод ватным диском, либо ватой, либо сложенной в несколько слоев марлей. Подключим анод к плюсу автомобильного аккумулятора через провод подходящей длины, а минус к кузову автомобиля. Обмакнем вату на аноде в электролит так, чтобы она пропиталась. Теперь медленными движениями начинаем водить по голому металлу. На нем должно появиться серое покрытие.
Фото mir-auto24.ru
В ЧЕМ ОШИБКА?
Если покрытие темное (а следовательно — хрупкое и пористое) — значит либо вы медленно водите анодом, либо слишком высокая плотность тока (в этом случае минус от аккумулятора отведите подальше), либо на вате подсох электролит. Равномерный серый налет не должен счищаться ногтем. Регулировать толщину покрытия придется на глаз. Таким образом можно нанести до 15—20 мкм покрытия. Скорость его разрушения примерно по 6 мкм в год при контакте с внешней средой.
В случае с деталью, ей нужно приготовить ванну (пластиковую или стеклянную) с электролитом. Процесс такой же — плюс на цинковый анод, минус на запчасть.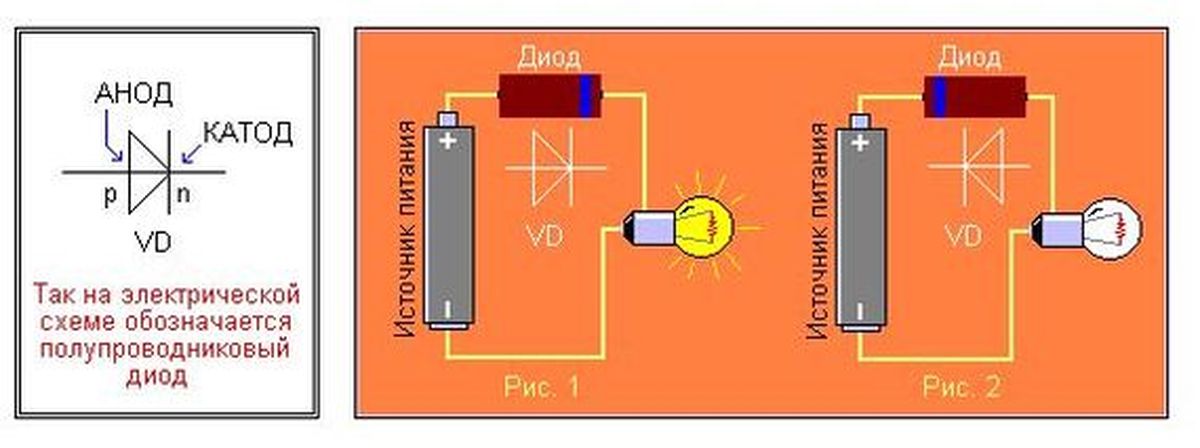 Анод и запчасть следует поместить в электролит так, чтобы они не касались друг друга. Затем просто следите за осаждением цинка.
Анод и запчасть следует поместить в электролит так, чтобы они не касались друг друга. Затем просто следите за осаждением цинка.
После того, как вы нанесли цинк, необходимо хорошо промыть место цинкования водой, чтобы убрать весь электролит. Не лишним будет перед покраской еще раз обезжирить поверхность. Таким образом детали или кузову можно продлить жизнь. Даже при разрушении внешнего слоя краски и грунта цинк не даст быстро заржаветь обработанному металлу.
176308
- ГАИ
- Коррупция
406196
- ГАИ
- Коррупция
406196
Подпишитесь на канал «Автовзгляд»:
- Telegram
- Яндекс.Дзен
подержанные авто, автосервис, ремонт, техническое обслуживание, автохимия
электрохимия — Почему электродный потенциал катода положительный?
спросил
Изменено 10 месяцев назад
Просмотрено 4к раз
$\begingroup$ Потенциал электрода – это разность потенциалов между электродом и окружающим электролитом.
Если потенциал катода положительный, это означает, что потенциал электрода больше, чем потенциал электролита, а это означает, что электроны будут течь из электролита к катоду.
Разве не должно быть наоборот? разве электроны не должны течь от катода к электролиту, что означает, что потенциал электрода должен быть отрицательным?
Точно так же мы можем сказать, что электродный потенциал для анода положителен.
Кто-нибудь может указать на ошибки в этом рассуждении?
- электрохимия
Я думаю, что источником вашей путаницы являются названия катода и анода. Анод и катоды не имеют никакого отношения к электростатическому знаку. Они связаны с процессами.
Катод, независимо от того, является ли он электростатически положительным ИЛИ отрицательным, является электродом, на котором происходит восстановление.
Анод, независимо от того, является ли он электростатически положительным ИЛИ отрицательным, представляет собой электрод, на котором происходит окисление.
Надеюсь, это проясняет ваше замешательство по поводу знаков.
Потенциал электрода — это разность потенциалов между электродом и окружающим электролитом.
Это не электродный потенциал, а скорее межфазная разность потенциалов.
Мэтью хотел уточнить это дальше: «Потенциал электрода НЕ является разностью потенциалов между электродом и окружающим электролитом». Я думаю, что это несбывшаяся мечта электрохимика найти абсолютную разность потенциалов, то есть мы погружаем медный электрод в раствор меди и измеряем разность потенциалов между ними. Я думаю, что можно импровизировать то, что говорит Путник. табличные электродные потенциалы , встречающиеся обычно, не являются разностью потенциалов металлов и их растворов. Причина в том, что измерить такую гипотетическую конструкцию невозможно.
$\endgroup$ 3 $\begingroup$ Потенциал электрода НЕ разность потенциалов между электродом и окружающим электролитом.
Потенциал электрода условно представляет собой относительный потенциал эталонного стандартного водородного электрода (СТЭ) с условно присвоенным потенциалом 0 В.
Тогда «абсолютный» потенциал СТЭ относительно потенциала свободных электронов оценивается как \pm 0,02 В}$.
Катоды более отрицательные, чем аноды в гальванических элементах, и более положительные, чем аноды в гальванических элементах. Но более положительное не означает положительное, а более отрицательное не означает отрицательное. Условие маркировки положительных и отрицательных контактов ячейки достаточно для повседневной жизни, но ничего не говорит о знаке электродных потенциалов (либо относительно свободного электрона в вакууме, либо относительно SHE).
Потенциалы электродов могут быть положительными + отрицательными, или обоими положительными или обоими отрицательными относительно SHE. Они всегда положительны относительно свободного электрона.
$\endgroup$ 11 $\begingroup$Вопрос: Почему электродный потенциал для катода положительный?
Так как вопрос не был направлен к какой ячейке, то ответ не всегда положительный:
Как пояснил М. Фарук, катод – это место, где в клетке происходит восстановление. Таким образом, в гальванической ячейке она положительна, так как происходит реакция восстановления $\ce{Y+ + e- -> Y}$. Необходимые для этого электроны исходили от анода. Однако в электролитической ячейке электроны из внешнего источника (например, батареи) текут к отрицательному концу, где происходит реакция восстановления $\ce{M+ + e- -> M}$. Таким образом, катод здесь отрицательный.
Фарук, катод – это место, где в клетке происходит восстановление. Таким образом, в гальванической ячейке она положительна, так как происходит реакция восстановления $\ce{Y+ + e- -> Y}$. Необходимые для этого электроны исходили от анода. Однако в электролитической ячейке электроны из внешнего источника (например, батареи) текут к отрицательному концу, где происходит реакция восстановления $\ce{M+ + e- -> M}$. Таким образом, катод здесь отрицательный.
Редактировать: Я согласен с комментарием Путника ниже. Соответственно, может быть лучше сказать, что катоды более отрицательные, чем аноды в гальванических элементах, и более положительные, чем аноды в гальванических элементах. Поскольку более положительное не означает положительное, а более отрицательное не означает отрицательное. Условие маркировки положительных и отрицательных контактов клеток достаточно хорошо для повседневной жизни, но оно ничего не говорит о знаке электродных потенциалов ни по отношению к свободному электрону, ни к SHE (например, соответствующий потенциал реакции восстановления полуклетки может нести положительный или отрицательный знак, основанный на соответствующей реакции).
Я думаю, что ACchem прекрасно объясняет значение катода и анода. (Это связано с происходящим процессом, а не с электростатическим потенциалом).
Анод всегда дает электроны (окисление).
Катод всегда принимает электроны (восстановление).
Положительный электрод – это электрод с высоким уровнем er потенциал, чем отрицательный электрод. Поскольку все потенциалы определены относительно теоретического стандартного электрода (см. ответ Путника), это обозначение может соответствовать или не соответствовать фактическому знаку потенциала.
Когда реакция протекает самопроизвольно (гальванический элемент), отрицательный электрод является анодом. Электроны текут от отрицательного электрода к положительному электроду.
Когда реакция должна управляться внешним источником энергии (электролитической ячейкой), отрицательный электрод является катодом. Электроны вынуждены в отрицательный электрод от положительного электрода.
Электроны вынуждены в отрицательный электрод от положительного электрода.
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя электронную почту и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания и подтверждаете, что прочитали и поняли нашу политику конфиденциальности и кодекс поведения.
что это, плюс или минус, определить полярность
Часто возникает проблема определить какой электрод является катодом, а какой анодом. Для начала нам нужно разобраться в терминах.
Содержание
- 1 Концепция катода и анода – простое объяснение
- 2 Применение в электрохимии
- 2.1 Применение в вакуумной электронике
- 2.2 Применение в электронике
- 2.3 Гальванические источники постоянного тока — аккумуляторные батареи
- 2.4 Почему возникает путаница?
- 2,5 Как определить анод и катод
- 2.6 Значение анода и катода
Концепция катода и анода — простое объяснение
В сложных веществах электроны между атомами в составе не являются единообразными. . В результате взаимодействия частицы переходят от атома одного вещества к атому другого. Реакция называется окислительно-восстановительной реакцией. Потеря электронов называется окислением, элемент, отдающий электроны, называется восстановителем.
Присоединение электронов называется восстановлением; элемент, который принимает электроны в этом процессе, является окислителем. Перенос электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать как источник электрической энергии. Устройства, в которых энергия химической реакции преобразуется в электрическую, называются гальваническими элементами.
Простейший классический пример гальванического элемента представляет собой две пластины из разных металлов, погруженные в раствор электролита. В такой системе происходит окисление одного металла и восстановление другого.
ВАЖНО! Электрод, на котором происходит окисление, называется анодом. Электрод, на котором происходит восстановление, называется катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В приборе Якоби-Даниэля медная пластина помещается в раствор сульфата меди (медный электрод), а цинковая пластина погружается в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает в раствор катионы, создавая в нем избыточный положительный заряд, тогда как у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Цинковый электрод отдает в раствор катионы, создавая в нем избыточный положительный заряд, тогда как у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны течь от цинкового электрода к медному электроду. Равновесные отношения на границах фаз прерываются. Происходит окислительно-восстановительная реакция.
Энергия самопроизвольной химической реакции превращается в электрическую энергию.
Если химическая реакция вызывается внешней энергией электрического тока, то происходит процесс, называемый электролизом. Процессы, происходящие при электролизе, обратны тем, которые происходят при работе гальванического элемента.
ПРЕДУПРЕЖДЕНИЕ. Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод заряжен положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваника;
- Гальваника.

При электролизе расплавленных соединений и водных растворов получают металлы, очищают металлы от примесей и извлекают ценные компоненты (электролитическое рафинирование). Пластины отливают из металла, подлежащего рафинированию. Пластины помещаются в качестве анодов в электролизер. Металл растворяется электрическим током. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в исходной сырой металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролит, из которого удаляются. Медь, никель, свинец, золото, серебро и олово подвергаются электролитическому рафинированию.
Электроэкстракция – процесс извлечения металла из раствора при электролизе. Металл обрабатывается специальными реагентами, чтобы перевести его в раствор. В ходе процесса на катоде выделяется металл высокой чистоты. Так получают цинк, медь и кадмий.
Для предотвращения коррозии, придания прочности и украшения изделия поверхность одного металла покрывают слоем другого. Этот процесс называется гальванопокрытием.
Этот процесс называется гальванопокрытием.
Гальваника – это процесс изготовления металлических копий трехмерных объектов путем электроосаждения металла.
Использование в вакуумных электронных устройствах
Принцип действия катода и анода в вакуумном устройстве можно продемонстрировать на примере электронной лампы. Он выглядит как герметически закрытый сосуд с металлическими деталями внутри. Устройство используется для выпрямления, генерации и преобразования электрических сигналов. По количеству электродов различают:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Диод – вакуумный прибор с двумя электродами, катодом и анодом. Катод подключается к отрицательному полюсу источника питания, анод к положительному полюсу. Назначение катода – испускать электроны под действием электрического тока, нагревая его до определенной температуры. За счет испускаемых электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер пространственного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Поток электронов регулируется с помощью дополнительных электродов путем подачи на них электрического потенциала. Диоды используются для преобразования переменного тока в постоянный.
Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер пространственного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Поток электронов регулируется с помощью дополнительных электродов путем подачи на них электрического потенциала. Диоды используются для преобразования переменного тока в постоянный.
Применение в электронике
Сегодня используются полупроводниковые типы диодов.
Свойство диодов пропускать ток в прямом направлении и не пропускать ток в обратном направлении широко используется в электронике.
Работа светодиода основана на свойстве полупроводниковых кристаллов светиться при прохождении тока через p-n переход в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторными батареями: их перезаряжают и используют повторно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдавая свои электроны, восстанавливая двуокись свинца, которая принимает электроны. Металлический свинец в батарее является анодом и заряжен отрицательно. Двуокись свинца является катодом и заряжена положительно.
Металлический свинец окисляется, отдавая свои электроны, восстанавливая двуокись свинца, которая принимает электроны. Металлический свинец в батарее является анодом и заряжен отрицательно. Двуокись свинца является катодом и заряжена положительно.
При разрядке батареи расходуются вещества катода и анода и их электролит – серная кислота. Для зарядки аккумулятора его подключают к источнику тока (плюс к плюсу, минус к минусу). Направление тока теперь противоположно тому, что было при разряде аккумулятора. Электрохимические процессы на электродах «обратные». Теперь свинцовый электрод становится катодом, на нем происходит процесс восстановления, а диоксид свинца становится анодом, при этом происходит процедура окисления. Вещества, необходимые для работы батареи, снова создаются в батарее.
Почему такая путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно прикреплен к аноду или катоду. Часто катод представляет собой положительно заряженный электрод, а анод — отрицательный электрод. Часто, но не всегда. Все зависит от процесса, происходящего на электроде.
Часто, но не всегда. Все зависит от процесса, происходящего на электроде.
ПРЕДУПРЕЖДЕНИЕ. Деталь, которую вы помещаете в электролит, может быть как анодом, так и катодом. Все зависит от цели процесса: нанести на него еще один слой металла или снять его.
Как определить анод и катод
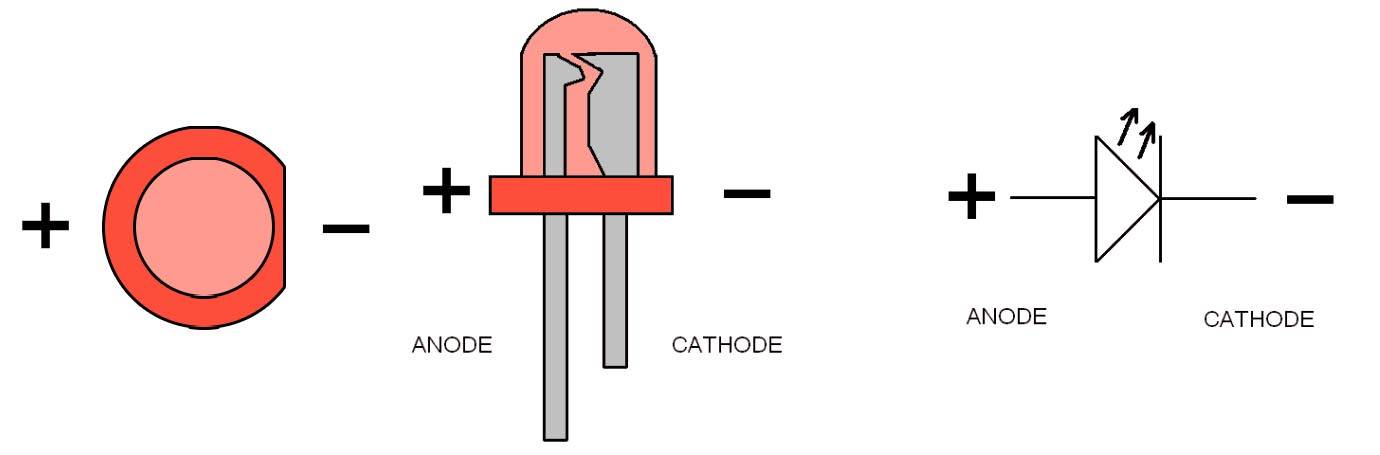
В электрохимии анод — это электрод, на котором происходят процессы окисления, а катод — это электрод, на котором происходят процессы восстановления.
В диоде выводы называются анодом и катодом. Ток будет течь через диод, если вывод «анод» подключен к «плюсу», а вывод «катод» подключен к «минусу».
У нового светодиода с неразрезанными штырьками анод и катод определяются визуально по длине. Катод короче.
Если перебиты контакты, поможет прикрепленная к ним батарейка. Свет появится, когда полярности совпадают.
Знак анода и катода
В электрохимии правильнее говорить не о знаках зарядов электродов, а о процессах, происходящих на них.


 На меньшем электроде плотность тока выше и действие его более выражено. Меньший электрод называют активным.
На меньшем электроде плотность тока выше и действие его более выражено. Меньший электрод называют активным.