Анод | это… Что такое Анод?
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
Содержание
|
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Анод электронной лампы
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны.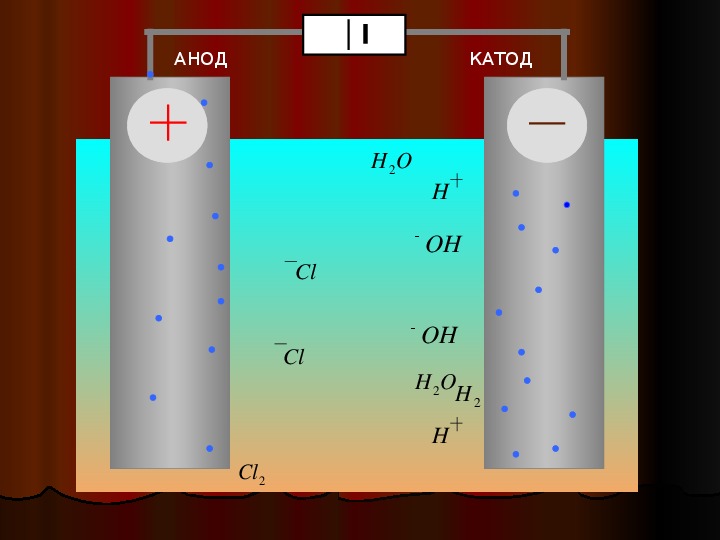 А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Полупроводниковый прибор — диод
Полупроводниковый прибор — тринистор
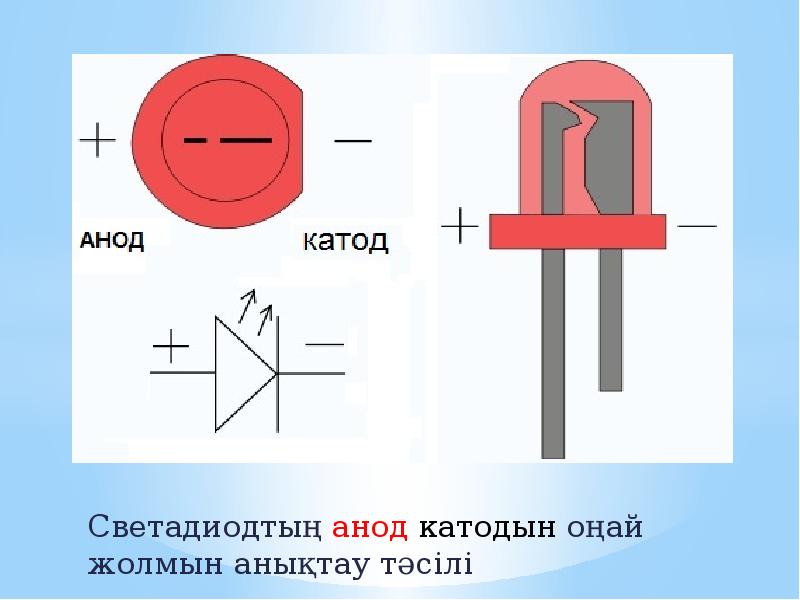
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
Знак анода и катода
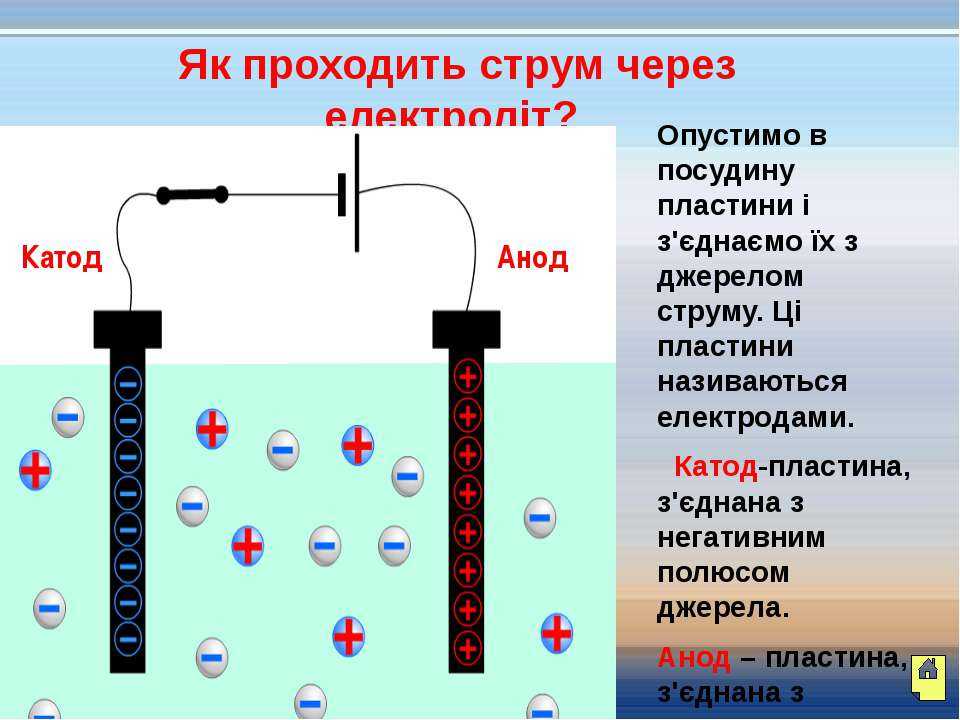
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод.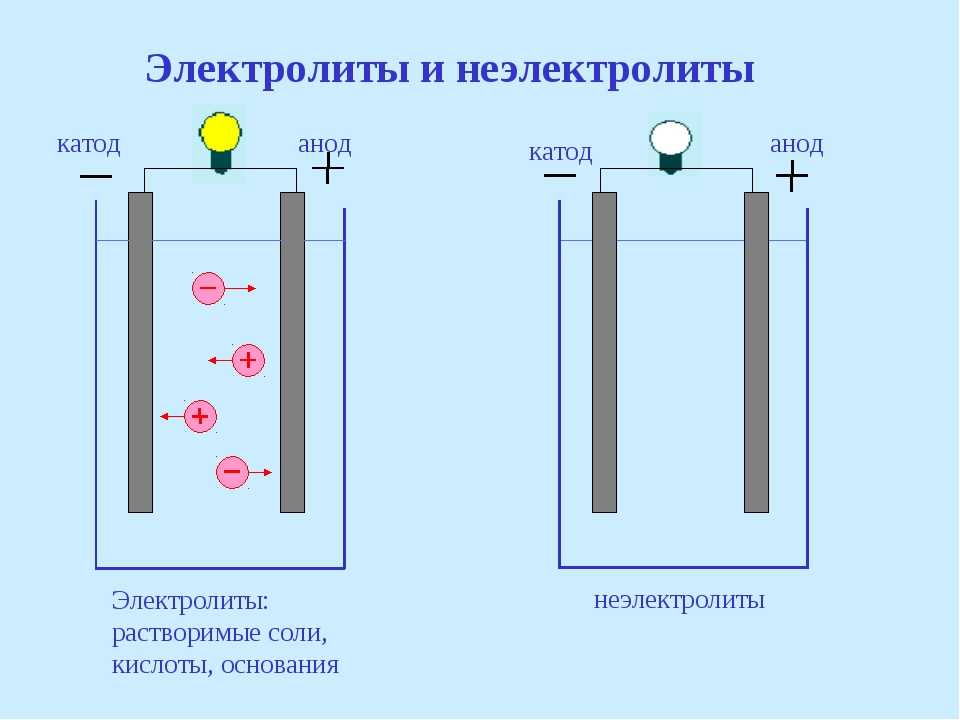 На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
- Катод
- Электролиз
- Мнемонические правила запоминания знака анода
Литература
- ↑ Антропов Л.
 И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13. - ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
- Анод // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Анод в Большой Советской Энциклопедии
- Знаем ли мы, что такое АНОД?
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Анод | это… Что такое Анод?
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
Содержание
|
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины.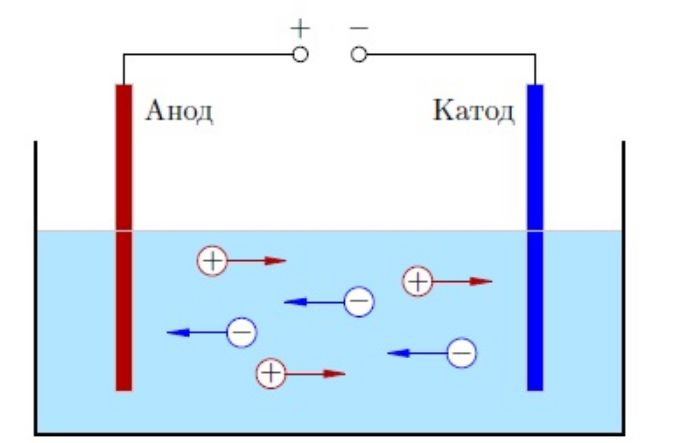 Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Анод электронной лампы
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Полупроводниковый прибор — диод
Полупроводниковый прибор — тринистор
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.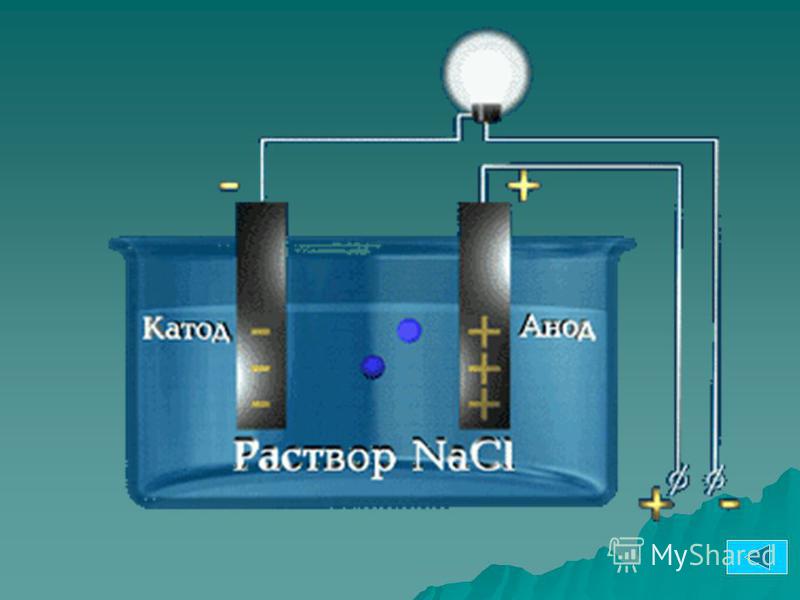
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.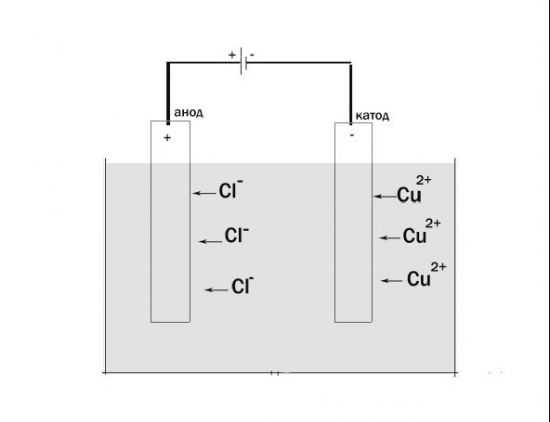
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
- Катод
- Электролиз
- Мнемонические правила запоминания знака анода
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
- Анод // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Анод в Большой Советской Энциклопедии
- Знаем ли мы, что такое АНОД?
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Магниевый и титановый электрический анод (E-anode) для водонагревателя |
Внутренняя емкость водонагревателей изготавливается из высококачественной стали. А эмаль (именуется также стеклоэмалью или стеклофарфором), нанесенная внутри на поверхность бака, характеризуется отличной износоустойчивостью. Эта силикатная масса обладает особыми химическими и физическими свойствами для защиты металла от коррозии, а кроме того, в нее вводятся и специальные добавки, улучшающие характеристики названного покрытия. Как правило, список ингредиентов и их пропорции изготовители стараются сохранять в тайне.
А эмаль (именуется также стеклоэмалью или стеклофарфором), нанесенная внутри на поверхность бака, характеризуется отличной износоустойчивостью. Эта силикатная масса обладает особыми химическими и физическими свойствами для защиты металла от коррозии, а кроме того, в нее вводятся и специальные добавки, улучшающие характеристики названного покрытия. Как правило, список ингредиентов и их пропорции изготовители стараются сохранять в тайне.
Долговечность такой эмали зависит не только от ее составляющих и толщины слоя, но от того, как ее наносят. И основным в этом процессе является подготовка поверхности.
Преимущества эмалевого покрытия
Перечень положительных качеств описываемого покрытия выглядит так:
Оно обладает отличной водоустойчивостью, в частности к морской, а также к включающей соединения азота воде.
Оно исключает ржавление (особенно сочетание эмалевого покрытия и анода), так как такое покрытие сложно отделить от металлической поверхности.
Эмаль обладает высокой износоустойчивостью и не старится.
На это покрытие не оказывают действия резкие перепады температур и высокие показатели последних (наблюдается удвоение химической активности металла, в случае если температура поднимается на 10 С).
Обладает высокими гигиеническими свойствами, не токсична, исключает возможность выделения в воду каких-либо веществ.
Она не поддерживает развитие бактерий, так как биологически нейтральна.
Современные технологии покрытия эмалью позволяют создавать емкости самых разных объемов.
Но все перечисленные достоинства относятся только к водонагревателям, обладающим высоким качеством изготовления и выпущенным на современном оборудовании.
Возможность возникновения коррозии
Иногда на этапе нанесения эмали на поверхность металла образовываются вогнутости, незаметные в начале использования водонагревателя. Но в дальнейшем в этих местах и возникает точечная коррозия. Это обычный химический процесс, происходящий в металлических элементах под воздействием внешней среды (в данном случае – воды), приводящий к их разрушению. Ржавление сильно снижает работоспособность элементов водонагревателя и со временем выводит его из строя.
Ржавление сильно снижает работоспособность элементов водонагревателя и со временем выводит его из строя.
К причинам, провоцирующим появление коррозии, можно отнести следующие:
В воде содержится кислород, способствующий процессу разрушения. При высокой температуре его концентрация обычно составляет 5 мг/л, а при низкой – 12 мг/л.
Наличие солей, которые провоцируют развитие агрессивных свойств у воды.
Развитие коррозии проходит в 3 этапа:
Кислород, которым насыщена вода, вступает в контакт с внутренними металлическими поверхностями емкости.
Железо в составе сплава, из которого сделан бак, обладает свойством взаимодействия с кислородом – его атом при этом теряет 2 электрона, становясь ионом Fe++.
Образовавшиеся ионы железа покидают металлическую поверхность и образуют оксиды – FeO, а этот процесс и провоцирует коррозию, приводящую к появлению сквозных дыр.
Как осуществляется защита от коррозии
Для защиты поверхности бака от разрушения, используются аноды из магния и титана.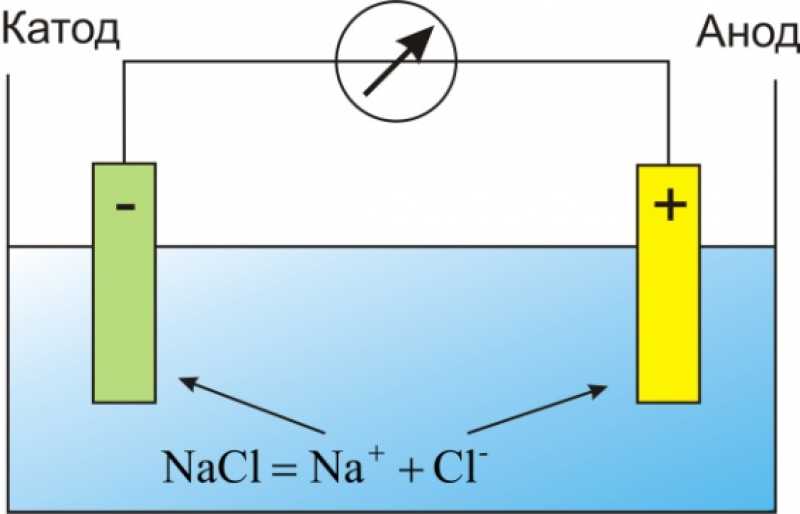 Благодаря ним процессы окисления и появления ржавчины на местах каких-либо повреждений эмалевого покрытия останавливаются, так как движение электродов от анода направляется в обратную сторону, а их избыток (так называемое катодное напряжение) перенаправляет разницу потенциалов от коррозионной области, что и прекращает ржавление.
Благодаря ним процессы окисления и появления ржавчины на местах каких-либо повреждений эмалевого покрытия останавливаются, так как движение электродов от анода направляется в обратную сторону, а их избыток (так называемое катодное напряжение) перенаправляет разницу потенциалов от коррозионной области, что и прекращает ржавление.
Чтобы теплообменник и элементы нагрева воды не подвергались воздействию анодного тока, их устанавливают, применяя изоляторы.
Чтобы уберечь металл от ржавления применяются два вида защиты.
Магниевый анод
Это антикоррозийный стержень, покрытый магниевым сплавом, который отдает электроны и соединяется со стальной внутренней поверхностью бака. От него к поврежденным участкам идет ток, возникающий в итоге разрушения более активного материала. Он и предохраняет поверхность от коррозии.
Этот антикоррозийный стержень вмонтирован в бак, и его первую проверку можно выполнить после года эксплуатации. Остальные проверки также необходимо проводить регулярно, потому что особенности некачественного состава воды могут негативно повлиять на срок службы магниевого анода. Первая проверка обычно помогает решить, как быстро следует делать следующую.
Первая проверка обычно помогает решить, как быстро следует делать следующую.
Магний, также как и сталь, имеет тенденцию ко взаимодействию с водной средой, но магний при этом делает это более активно, чем железо. Атомы магния легче превращаются в ионы, что в результате и становится решением проблемы защиты от коррозии, так как они успевают образовать оксид, раньше атомов железа. В итоге поверхность бака не разрушается.
Титановый электрический анод (E-anode)
У данного анода защитный ток производит наружный источник напряжения и управлять им можно с помощью специального электронного регулятора. Титановый стержень в этом случае выполняет роль измерительного электрода.
Выглядит это так: в устройстве ненадолго прекращается подача тока, а затем полученную при измерении разницу электронные приборы сравнивают с требуемым потенциалом. Сила тока благодаря этому стабилизируется на заданной величине. Решающим в этом процессе оказывается химический состав воды и образование разрушенных участков эмалевого покрытия.
Титановый стержень не нуждается в его замене на протяжении всей эксплуатации водонагревателя, так как он не поддается разрушению.
Что такое анодный стержень? (с изображением)
`;
Терри Брокманн
Анодный стержень — это компонент водонагревателя, помогающий предотвратить внутреннюю коррозию. Стержень, часто называемый жертвенным анодным стержнем, притягивает коррозионно-активные элементы в воде и позволяет им растворять ее. Это замедляет коррозию облицовки бака. Почти все водонагреватели имеют стержни, хотя некоторые резервуары меньшего размера, такие как водонагреватели для транспортных средств для отдыха, могут отсутствовать.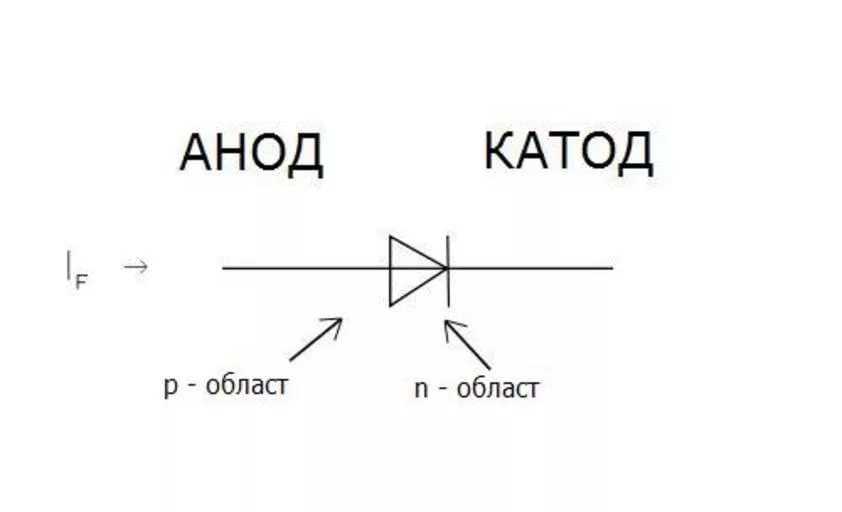
Алюминиевые анодные стержни очень эффективны в районах с жесткой водой. Некоторые люди обеспокоены негативным воздействием алюминия на здоровье; поэтому эксперты советуют людям не использовать воду из бака с горячей водой для питья или приготовления пищи. В руководстве по эксплуатации обычно указывается, какой тип удилища использовал производитель. Иногда домовладельцы ощущают сернистый запах или запах тухлых яиц от горячей воды. Часто установка анодного стержня из алюминия и цинка рассеивает запах.
 Там, где жесткая вода, они не так эффективны, как алюминиевые стержни. Как правило, магниевые стержни не вызывают проблем со здоровьем.
Там, где жесткая вода, они не так эффективны, как алюминиевые стержни. Как правило, магниевые стержни не вызывают проблем со здоровьем.Эксперты рекомендуют домовладельцам проверять анодный стержень ежегодно или каждые два года. Обычно удилище служит пять лет, но это может измениться по многим причинам. Качество воды и количество используемой воды являются двумя основными факторами. Возможно, самым важным фактором является умягченная вода. Соли в воде вызывают более высокую электрохимическую реакцию и растворяют анодный стержень с ускоренной скоростью.
Анодный стержень привинчен к верхней части водонагревателя.
Что такое анод? — Знание
Анод
Анод – это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Обычная мнемоника — ACID для «анодного тока в устройство». Направление (положительного) электрического тока противоположно направлению потока электронов: (отрицательно заряженные) электроны вытекают из анода во внешнюю цепь.
Обычная мнемоника — ACID для «анодного тока в устройство». Направление (положительного) электрического тока противоположно направлению потока электронов: (отрицательно заряженные) электроны вытекают из анода во внешнюю цепь.
Полярность напряжения на аноде относительно связанного с ним катода зависит от типа устройства и режима его работы. В следующих примерах анод отрицательный в устройстве, которое обеспечивает питание, и положительный в устройстве, которое потребляет энергию.
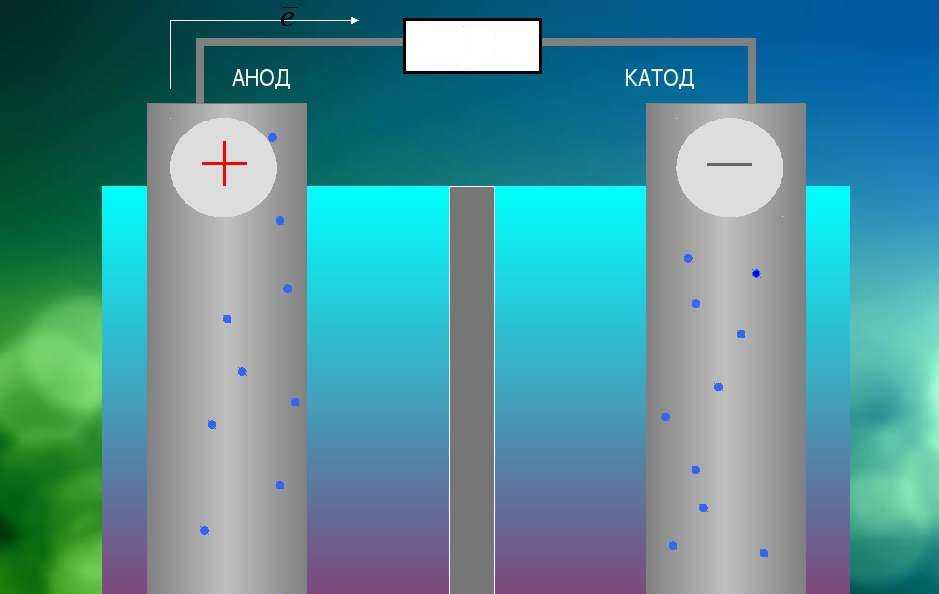
В разряжающейся батарее или гальваническом элементе (схема справа) анод является отрицательной клеммой, потому что через него ток течет в «устройство» (то есть в элемент батареи). Этот внутренний ток переносится наружу электронами, движущимися наружу, отрицательный заряд, текущий в одном направлении, электрически эквивалентен положительному заряду, текущему в противоположном направлении.
В перезаряжаемой батарее или электролитическом элементе анодом является положительная клемма, на которую подается ток от внешнего генератора. Ток через перезаряжаемую батарею противоположен направлению тока при разрядке; другими словами, электрод, который был катодом во время разрядки батареи, становится анодом во время перезарядки батареи.
Ток через перезаряжаемую батарею противоположен направлению тока при разрядке; другими словами, электрод, который был катодом во время разрядки батареи, становится анодом во время перезарядки батареи.
В диоде анодом является положительная клемма в конце символа стрелки (плоская сторона треугольника), через которую в устройство поступает ток. Обратите внимание, что наименование электродов для диодов всегда основано на направлении прямого тока (направление стрелки, в котором ток течет «наиболее легко»), даже для таких типов, как диоды Зенера или солнечные элементы, где интерес представляет собой обратный ток. Текущий.
В электронно-лучевой трубке анод представляет собой положительную клемму, через которую из устройства вытекают электроны, т. е. куда поступает положительный электрический ток.
Поток электронов
Поток электронов всегда идет от анода к катоду вне ячейки или устройства, независимо от типа ячейки или устройства и режима работы, за исключением диодов, где обозначение электродов всегда предполагает ток в прямом направлении (символ стрелки), т.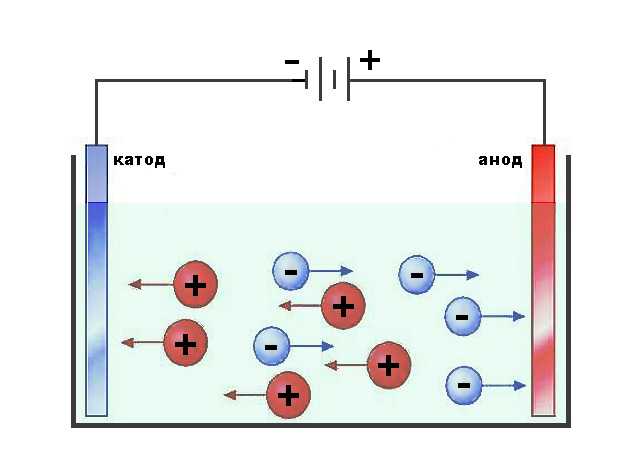 е. электроны текут в противоположном направлении, даже когда диод ведет себя в обратном направлении либо случайно (пробой обычного диода), либо намеренно (пробой стабилитрона, фототок фотодиода). ).
е. электроны текут в противоположном направлении, даже когда диод ведет себя в обратном направлении либо случайно (пробой обычного диода), либо намеренно (пробой стабилитрона, фототок фотодиода). ).
Электролитический анод
В электрохимии анод — это место, где происходит окисление, и контакт положительной полярности в электролитической ячейке. На аноде анионы (отрицательные ионы) под действием электрического потенциала вынуждены вступать в химическую реакцию и испускать электроны (окисление). которые затем текут вверх и в управляющую цепь. Мнемоника: LEO Red Cat (потеря электронов — это окисление, восстановление происходит на катоде), или AnOx Red Cat (анодное окисление, восстановление — катод), или OIL RIG (окисление — это потеря, восстановление — это приобретение электронов), или римско-католическая и Ортодоксальный (Восстановление – Катод, анод – Окисление), или LEO лев говорит GER (Потеря электронов – это Окисление, Получение электронов – это Восстановление).
Этот процесс широко используется в рафинировании металлов.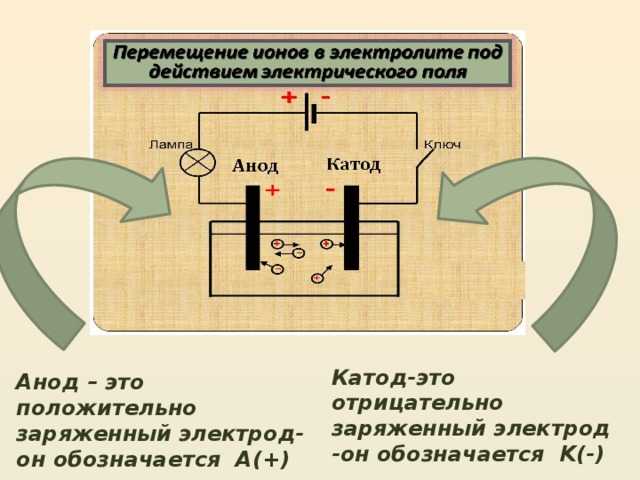 Например, при рафинировании меди медные аноды, промежуточный продукт из печей, подвергают электролизу в соответствующем растворе (например, серной кислоте) для получения катодов высокой чистоты (99,99%). Медные катоды, изготовленные этим методом, также называют электролитической медью.
Например, при рафинировании меди медные аноды, промежуточный продукт из печей, подвергают электролизу в соответствующем растворе (например, серной кислоте) для получения катодов высокой чистоты (99,99%). Медные катоды, изготовленные этим методом, также называют электролитической медью.
Расходуемый анод
Расходуемые аноды, монтируемые «на лету» для защиты от коррозии металлической конструкции
При катодной защите металлический анод, более реагирующий на агрессивную среду защищаемой системы, электрически связан с системы и частично подвергается коррозии или растворению, что защищает металл системы, к которой он подключен. Например, корпус железного или стального корабля может быть защищен расходуемым цинковым анодом, который растворяется в морской воде и предотвращает коррозию корпуса. Жертвенные аноды особенно необходимы для систем, в которых статический заряд создается под действием протекающих жидкостей, таких как трубопроводы и плавсредства. Жертвенные аноды также обычно используются в водонагревателях резервуарного типа.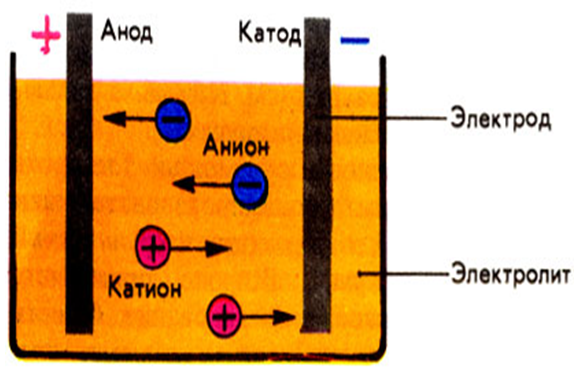
В 1824 году для уменьшения воздействия этого разрушительного электролитического действия на корпуса кораблей, их крепления и подводное оборудование ученый-инженер сэр Хамфри Дэви разработал первую и до сих пор наиболее широко используемую систему защиты от электролиза на море. Дэви установил расходуемые аноды, сделанные из более электрически реактивного (менее благородного) металла, прикрепленные к корпусу судна и электрически соединенные, чтобы сформировать цепь катодной защиты.
Менее очевидным примером этого типа защиты является процесс цинкования железа. Этот процесс покрывает железные конструкции (например, ограждения) покрытием из металлического цинка. Пока цинк остается неповрежденным, железо защищено от воздействия коррозии. Цинковое покрытие неизбежно нарушается в результате растрескивания или физического повреждения. Как только это происходит, коррозионные элементы действуют как электролит, а комбинация цинка и железа — как электроды. Результирующий ток гарантирует, что цинковое покрытие будет принесено в жертву, но основное железо не подвергнется коррозии.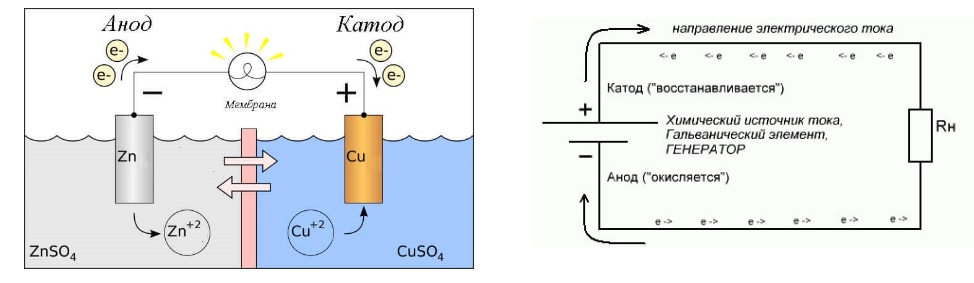 Такое покрытие может защитить железную конструкцию в течение нескольких десятилетий, но как только защитное покрытие израсходовано, железо быстро подвергается коррозии.
Такое покрытие может защитить железную конструкцию в течение нескольких десятилетий, но как только защитное покрытие израсходовано, железо быстро подвергается коррозии.
Часто задаваемые вопросы о расходных анодах – Performance Metals
A. Все металлы, погруженные в электролит (например, в морскую воду), создают электрическое напряжение. Когда два разнородных металла находятся в контакте (электрически соединены), они образуют гальванический элемент (например, аккумулятор), при этом менее благородный металл (например, бронзовый винт) образует анод, а более благородный металл (вал из нержавеющей стали) образует катод. .
Алюминиевый анодный сплав обеспечивает лучшую защиту и служит дольше, чем цинк. Он будет продолжать работать в пресной воде и безопасен для использования в соленой воде. Алюминий — единственный анод, безопасный для всех применений.
Если вы хотите защитить оба металла, вам нужно подключить третий металл, более активный, чем первые два.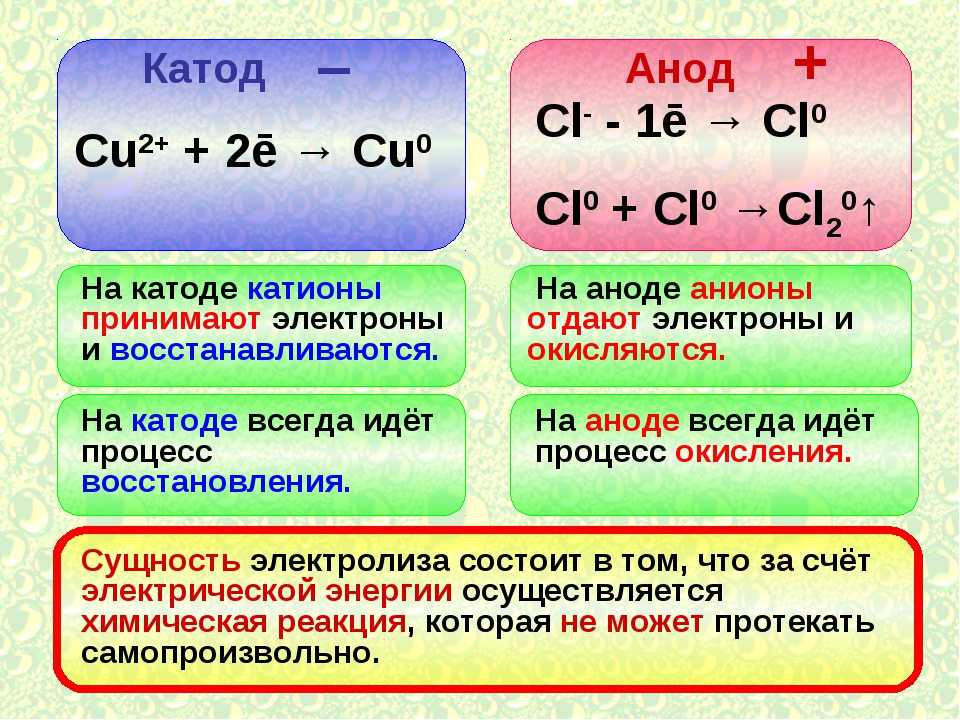 Самый активный металл (например, цинк) становится анодом для других и жертвует собой, подвергаясь коррозии (отдавая металл), чтобы защитить катод — отсюда и термин «жертвенный анод».
Самый активный металл (например, цинк) становится анодом для других и жертвует собой, подвергаясь коррозии (отдавая металл), чтобы защитить катод — отсюда и термин «жертвенный анод».
В. Из каких металлов изготавливаются расходуемые аноды?
A. Три наиболее активных материала, используемых в расходуемых анодах, — это цинк , алюминий и магний . У них разные свойства и применение.
Первым свойством, которое следует рассмотреть, является их электрический потенциал . Все металлы генерируют отрицательное напряжение (по сравнению с электродом сравнения) при погружении в воду. Чем ниже – тем отрицательнее – напряжение, тем более активным считается металл, например:
Магний генерирует -1,6 Вольт, т.е. отрицательные 1,6 Вольта.
Алюминиевый расходуемый анодный сплав генерирует -1,1 В
Цинк, -1,05 В
Для обеспечения защиты требуется максимально возможная разность напряжений между расходуемым анодом и защищаемым металлом.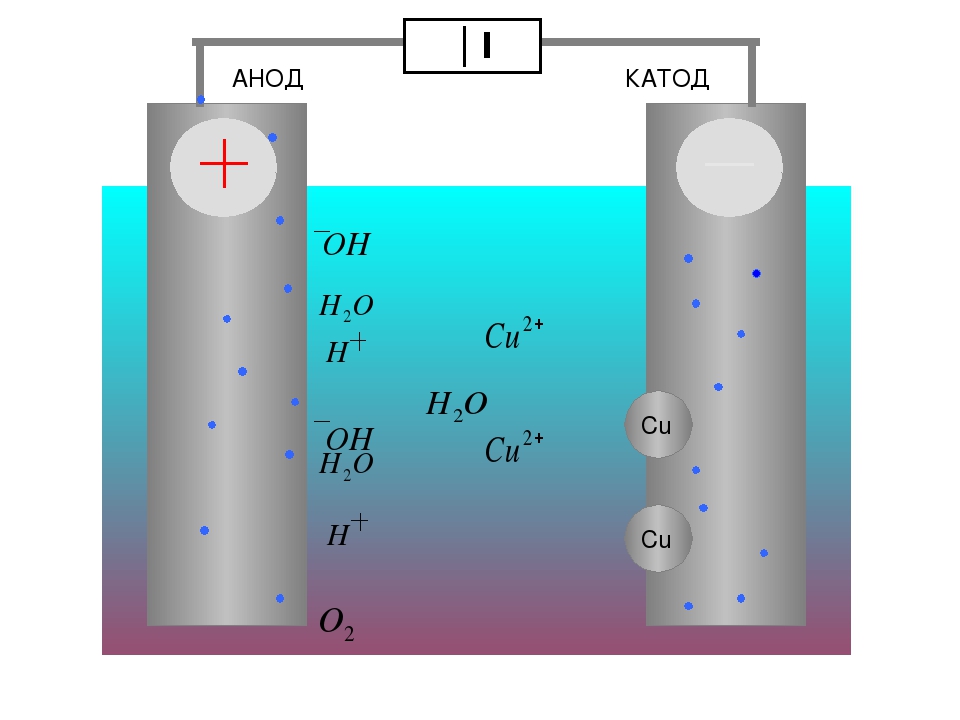
Например, если для защиты бронзового винта используется цинк, будет доступно «управляющее или защитное напряжение» отрицательное –0,75 В, т. е. цинк при -1,05 В минус бронза при -0,3 = -0,75 В.
Если используются алюминиевые аноды, это значение увеличивается до -0,8 Вольт.
Магниевые аноды увеличивают это значение до -1,3 вольта.
Чем больше разница в напряжении, тем больше защита. Но будьте осторожны, некоторые материалы (алюминий) могут быть «перезащищены» — об этом позже.
Вторым важным свойством является токовая емкость материала анода. Анод создает разность потенциалов, которая создает ток между анодом и защищаемым металлом, а также через воду. Это похоже на большую батарею: чем больше у вас емкость, тем дольше она будет защищать. Между прочим, для конкретного анода скорость протекания тока зависит от площади поверхности анода, а срок службы зависит от массы. Для анода того же размера относительные емкости составляют:
Цинк: 100 (Принято за основу, например, это может быть 100 дней)
Магний: 30
Алюминиевый анод: 130–150 (Разные производители указывают разные диапазоны)
Так что, если вы использовали магниевый анод вместо «100 день» цинкового анода, это продлится только 30 дней.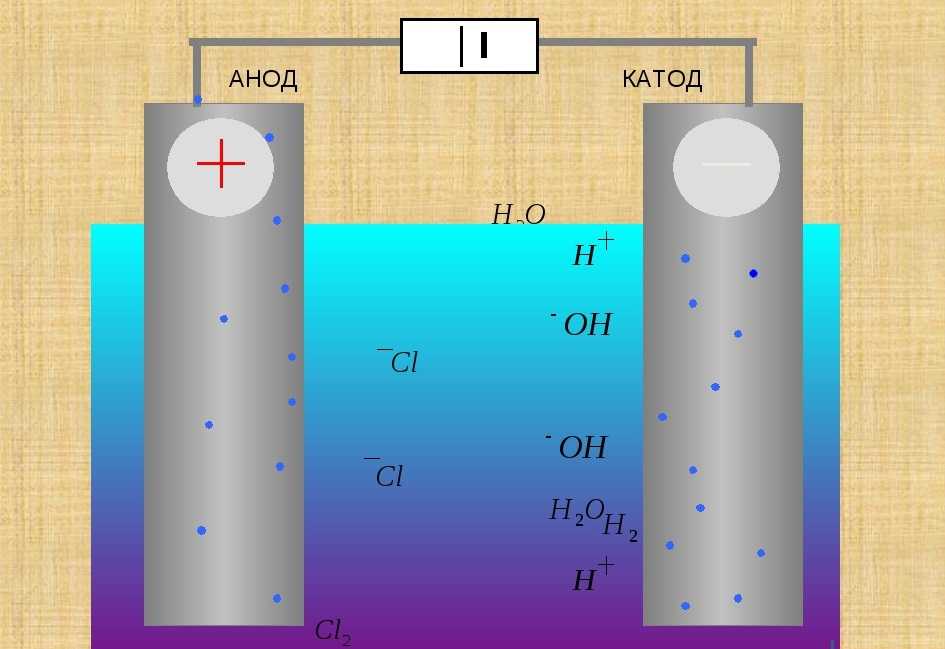
Срок службы алюминиевого анода составляет от 130 до 150 дней.
Для удобства мы предоставляем «Эквивалентный вес цинка» (ZEW) на некоторых страницах со списком наших продуктов. Это количество цинка, которому эквивалентен алюминиевый анод с точки зрения емкости.
Третье свойство Качество анодного сплава
Предупреждение об используемых металлах !!
Подойдет не любой цинк или любой алюминий. Остерегаться ! Есть импортные аноды сомнительного качества. Важно убедиться, что аноды, которые вы покупаете, изготовлены в соответствии с военными или морскими спецификациями. Установка дешевых или нестандартных анодов, несомненно, приведет к усилению и потенциально очень дорогим проблемам с коррозией. Наиболее распространенные спецификации материалов:
Zinc: MIL-DTL-18001L
Алюминий: MIL-DTL-24779 (SH)
Магний: MIL-A-21412
Сравнение свойств
9003
я использую на своей лодке?
A.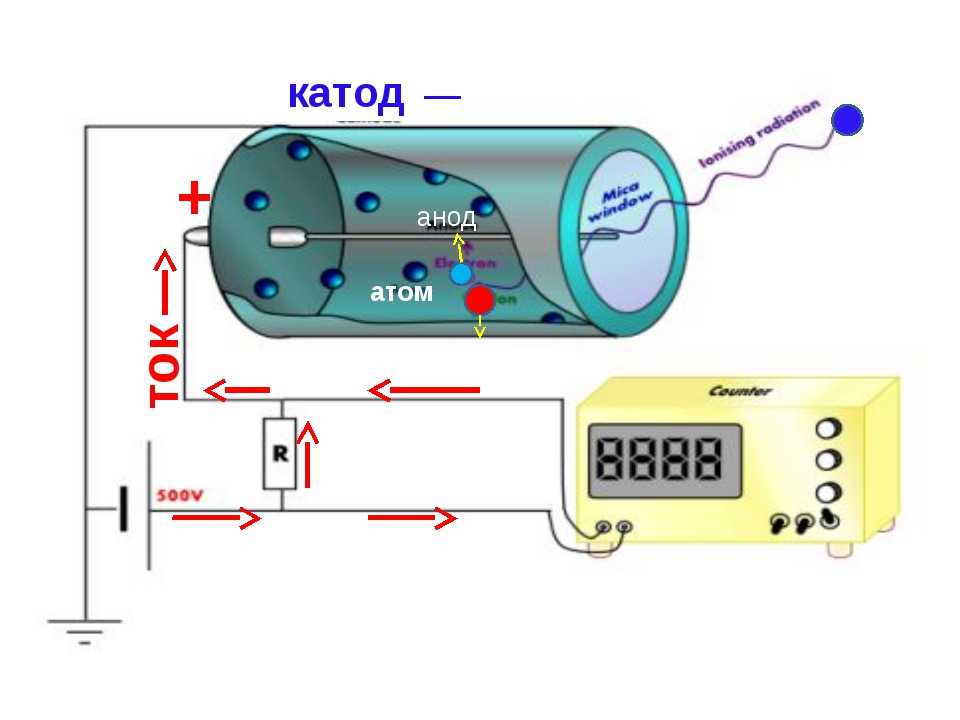 Тип вашей лодки определяет, насколько осторожным вам нужно быть. Корпус из стекловолокна со встроенным двигателем нуждается в гораздо меньшей защите, чем, например, алюминиевый корпус или лодка с алюминиевым кормовым приводом. Несколько простых рекомендаций:
Тип вашей лодки определяет, насколько осторожным вам нужно быть. Корпус из стекловолокна со встроенным двигателем нуждается в гораздо меньшей защите, чем, например, алюминиевый корпус или лодка с алюминиевым кормовым приводом. Несколько простых рекомендаций:
Внутренние лодки с деталями из бронзы и нержавеющей стали могут быть защищены цинковыми или алюминиевыми анодами. Не беспокойтесь о чрезмерной защите их. Вы чрезмерно защищены только тогда, когда вес анодов настолько велик, что ваша лодка тонет! Напряжение, генерируемое цинковыми или алюминиевыми анодами, не вызовет никаких повреждений — независимо от того, сколько материала анода добавлено, максимальное напряжение, которое может быть сгенерировано, равно напряжению самого анода. Вы также можете использовать магний в пресноводных водоемах на лодках с корпусом из стекловолокна. Будьте осторожны при использовании магния на лодках с алюминиевым или деревянным корпусом, так как вы можете чрезмерно защитить их. Стальные корпуса также могут быть чрезмерно защищены до такой степени, что чрезмерное защитное напряжение быстро снимает краску с корпуса.
Стальные корпуса также могут быть чрезмерно защищены до такой степени, что чрезмерное защитное напряжение быстро снимает краску с корпуса.
Кормовые приводы и подвесные моторы требуют немного больше внимания. У жертвенных анодов сложная задача, поскольку они должны защищать то, что уже является очень активной алюминиевой сборкой. Первоначально аноды для этих устройств были изготовлены из цинка, но из-за проблем с коррозией в начале 1990-х годов Mercury и Johnson/Evinrude/OMC начали продавать алюминиевые аноды. Другие производители тоже переходят на алюминий. Небольшое увеличение защитного напряжения помогает обеспечить защиту кормового привода. Если вы используете цинковые аноды, вы можете даже аннулировать свою гарантию! Опять же, будьте осторожны, используя магниевые аноды, так как вы можете чрезмерно защитить кормовой привод или подвесной двигатель.
В. Какие аноды следует использовать в пресной воде?
A.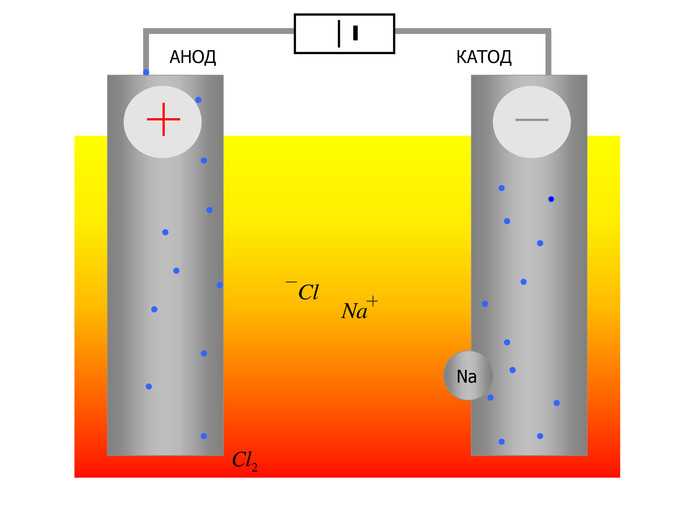 По возможности вместо цинка рекомендуется использовать аноды Navalloy™ (сплав алюминия/цинка/индия). Цинковые аноды могут стать неактивными всего через несколько месяцев из-за образования изолирующей пленки гидроксида цинка. Алюминиевые аноды останутся активными. Не верьте нам на слово, ABYC (Американский совет по лодкам и яхтам), который установил стандарты для отрасли, разъяснил свои рекомендации по анодным материалам в отчетах о стандартах и технической информации для малых судов (июль 2008–2009 гг.).):
По возможности вместо цинка рекомендуется использовать аноды Navalloy™ (сплав алюминия/цинка/индия). Цинковые аноды могут стать неактивными всего через несколько месяцев из-за образования изолирующей пленки гидроксида цинка. Алюминиевые аноды останутся активными. Не верьте нам на слово, ABYC (Американский совет по лодкам и яхтам), который установил стандарты для отрасли, разъяснил свои рекомендации по анодным материалам в отчетах о стандартах и технической информации для малых судов (июль 2008–2009 гг.).):
Как видите, единственным типом анода, который рекомендуется для всех типов воды, является алюминиевый (Navalloy).
В этой таблице представлены варианты выбора анодов в зависимости от типа лодки и типа воды:
В. Какие факторы усиливают коррозию?
A. Разница напряжений между двумя металлами влияет на скорость коррозии. Например, стойка из нержавеющей стали, которая является относительно благородным металлом, вызовет большую коррозию набора цинка, чем стойка из бронзы. Чем соленее вода, тем больше коррозия. Повышение температуры также увеличивает проводимость воды и, как следствие, коррозию. Скорость коррозии удваивается с повышением температуры на каждые 10 градусов Цельсия (18 градусов по Фаренгейту). Загрязнение также может увеличить коррозию. Например, многие пресноводные озера были загрязнены кислотными дождями, что увеличивает проводимость воды и, следовательно, скорость коррозии.
Чем соленее вода, тем больше коррозия. Повышение температуры также увеличивает проводимость воды и, как следствие, коррозию. Скорость коррозии удваивается с повышением температуры на каждые 10 градусов Цельсия (18 градусов по Фаренгейту). Загрязнение также может увеличить коррозию. Например, многие пресноводные озера были загрязнены кислотными дождями, что увеличивает проводимость воды и, следовательно, скорость коррозии.
В. Когда следует заменять расходуемые аноды?
A. Аноды следует заменять не реже одного раза в год (включая аноды в пресной воде) или в случае их коррозии до половины их первоначального размера. Аноды Performance Metals «Premium» включают эксклюзивный запатентованный «индикатор износа». Когда появится красное пятно, пора менять анод!
В. Какие меры предосторожности следует соблюдать при установке новых анодов?
A. Убедитесь, что они имеют хороший электрический контакт с защищаемым металлом.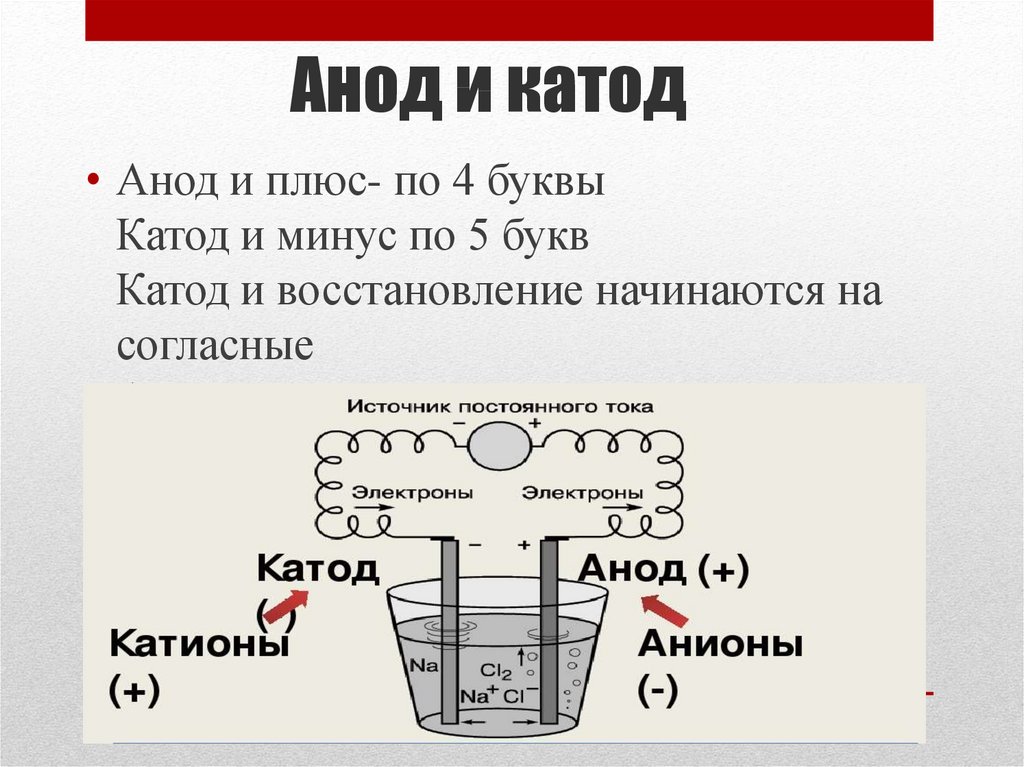 Удалите краску и очистите металлическую поверхность, которая будет соприкасаться с анодом. НЕ красьте аноды! Они не могут работать, если они закрыты.
Удалите краску и очистите металлическую поверхность, которая будет соприкасаться с анодом. НЕ красьте аноды! Они не могут работать, если они закрыты.
В. Что еще нужно сделать, чтобы защитить кормовой привод?
A. Поддерживайте краску (на двигателях, узлах кормового привода и т. д.) в хорошем состоянии. Небольшая царапина быстро разъедает. Оставьте узел кормового привода погруженным в воду. Если вы этого не сделаете, аноды не могут работать. Не наносите на кормовой привод краску против обрастания, содержащую медь или ртуть. Металл в краске увеличивает гальваническую коррозию. Не смешивайте цинковые аноды на корпусе с алюминиевыми анодами на приводе. Алюминиевые аноды будут защищать цинковые аноды в дополнение к устройству.
В. Как аноды Navalloy™ (алюминий) могут защитить алюминиевые передние приводы?
A. Поскольку алюминиевый анод Navalloy™ представляет собой комбинацию алюминия, цинка и индия.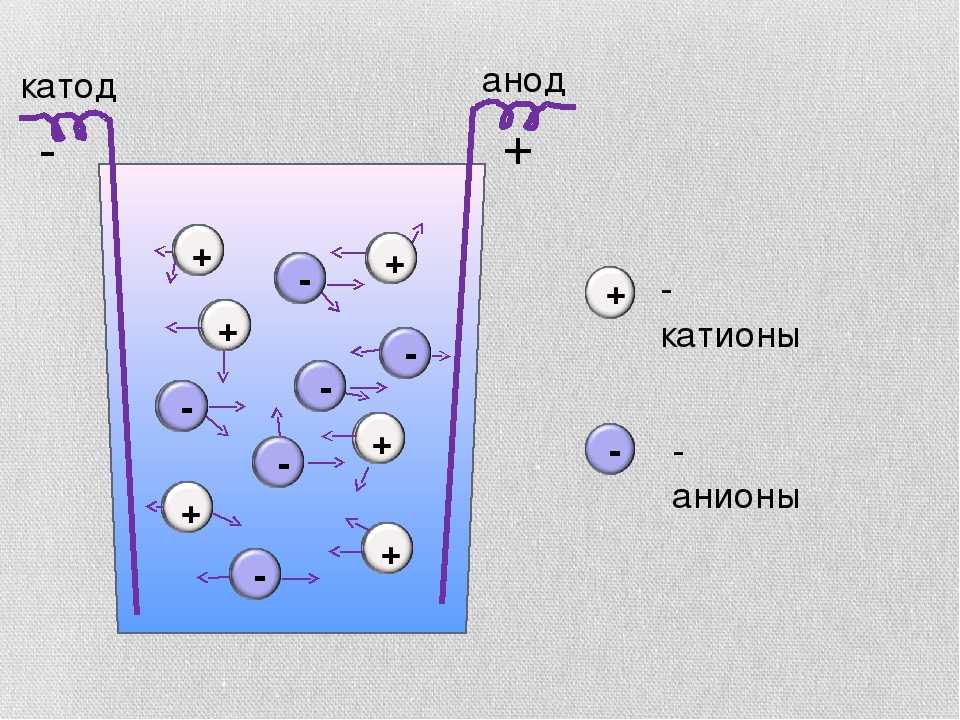


 И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.