Литий электронное строение — Справочник химика 21
Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий и натрий Зл бериллий 2. и магний 3 , бор 25 2р и алюминий и т. д.). Такая [c.52]Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий 2 и натрий 3 бериллий 2 и магний 3 , бор 2 2p и алюминий 3 3р и т. д.). Такая закономерность будет соблюдаться и в последующих периодах. Именно этим объясняется периодическая повторяемость свойств элементов в периодах. В этом сущность и причина периодичности, обнаруженной Д. И. Менделеевым, который не располагал сведениями о строении атома. Итак, теория строения атома подтвердила истинность менделеевского открытия, подвела под него мощную базу. [c.44]
Электронное строение атома бериллия в газообразном состоянии — 15 25% Увеличение заряда ядра атома бериллия по сравнению с зарядом ядра атома лития наряду с тем, что 25-электроны только частично экранируют друг друга, приводит к двум эффектам 1) атом Ве имеет металлический радиус только 0,89 А, значительно меньше, чем в случае лития (1,22 А) 2) потенциалы ионизации Ве, 9,32 и 18,21 эв, гораздо большие, чем у Ы (5,39 эе), делают Ве значительно менее электроположительным, если рассматривать его хилшческие свойства в сравнении со свойствами Действительно, не существует никаких кристаллических соединений или растворов, в которых ионы Ве + существовали бы как таковые.

Рассмотрим теперь взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) выражается схемой
Таким образом, третий период, подобно второму, начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешнего электронного слоя соответствующих элементов второго п третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия во внешнем электронном слое находится по одному s-электрону, у атомов азота и фосфора — по два S- и по три р-электрона и т. д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
Все щелочные металлы — очень сильные восстановители, их стандартные электродные потенциалы (E ) отрицательные. Наиболее отрицателен Е° лития (см. табл. 6.1). Это связано с особенностями электронного строения атома лития (ls 2s ), наименьшим его радиу-
Сопоставление рис. ХП.2 и ХП.З показывает, что электронное строение внешней оболочки атомов элементов следующих за неоном в точности повторяет строение атомов, предшествующих ему, т.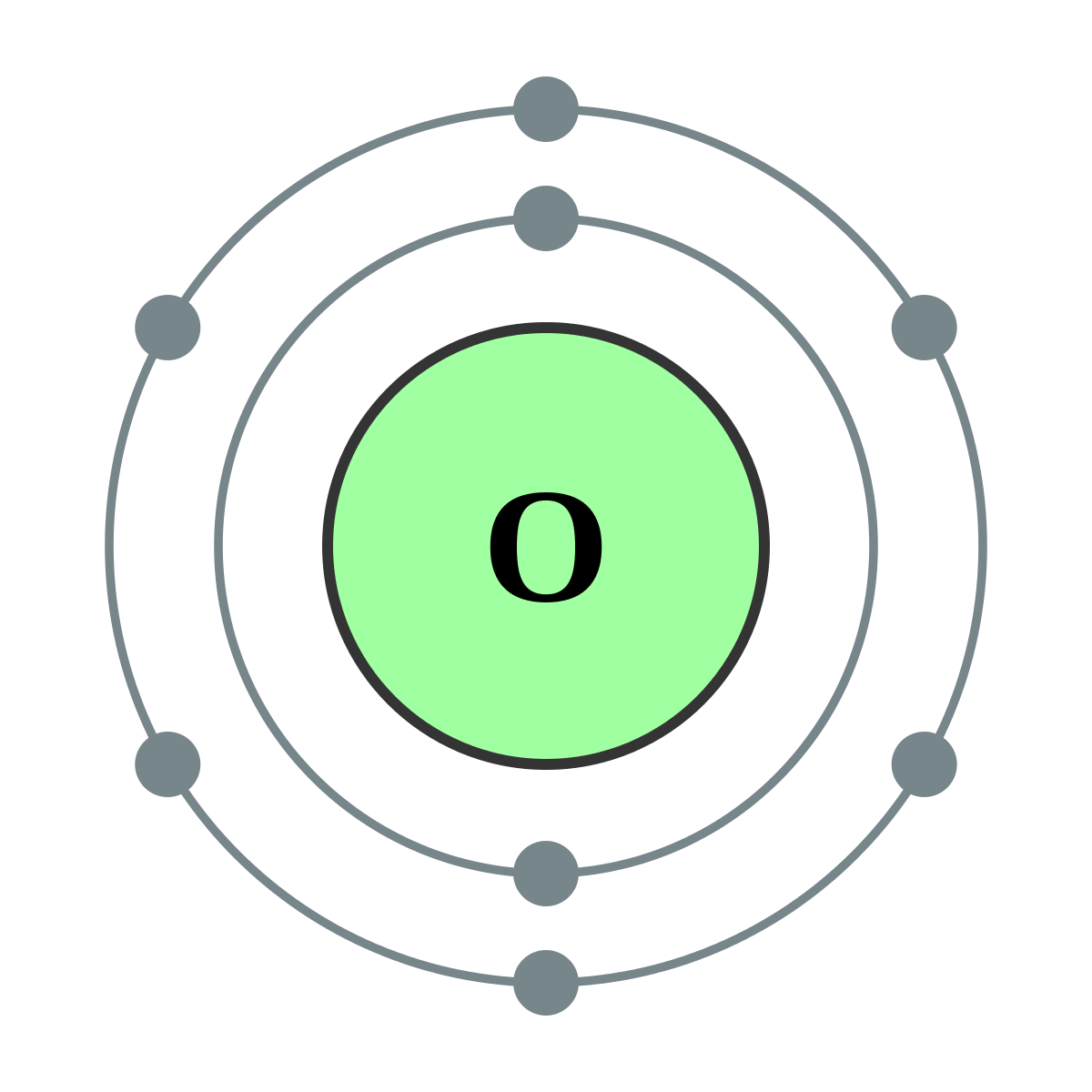 е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
Не составляет труда записать волновое уравнение Шрёдингера для атома лития, состоящего из ядра и трех электронов, или атома урана, состоящего из ядра и 92 электронов. Однако, к сожалению, эти дифференциальные уравнения невозможно решить. Нет ничего утешительного в том, что строение атома урана в принципе может быть найдено путем расчетов, если математические (хотя отнюдь не физические) трудности препятствуют получению этого решения. Правда, физики и физикохимики разработали для решения уравнения Шрёдингера множество приближенных методов, основанных на догадках и последовательных приближениях. Проведение последовательных приближений существенно облегчается использованием электронно-вычислительных машин. Однако главное достоинство применения теории Шрёдингера к атому водорода заключается в том, что она позволяет получить ясную качественную картину электронного строения многоэлектронных атомов без проведения дополнительных расчетов.
Для описания электронного строения атомов в основном состоянии часто применяется условное обозначение их электронной конфигурации группами символов п/, где п—главное квантовое число, указывающее энергетический уровень электрона, /—орбитальное квантовое число подуровня (вместо него обычно указывается соответствующий символ 5, р, 4 или а X — число электронов на данном подуровне. Например, электронное строение атома лития описывается конфигурацией 1.5 25 . Приведем еще не-
Рассматривая электронное строение атомов различных элементов в порядке возрастания их порядкового номера, мы убедились (с. 28), что атом водорода (1в ) одновалентен, тогда как валентность атома гелия (1з ) равна нулю. Валентность атома лития (ls 2s ) во всех соединениях равна единице, тогда как бериллий (18 2в ) становится двухвалентным благодаря переходу атома в возбужденное состояние (18 28 2р ).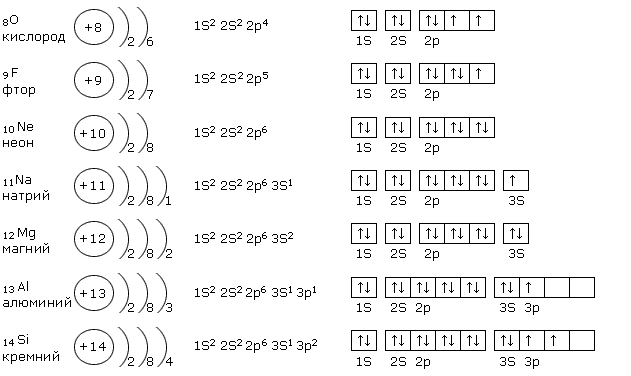 Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании
Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании
Эта энергетическая стабильность молекулы Lia связана с электронным строением атома лития Li(ls 2s ) или Li (K2s ) (здесь К—атомный остов, не принимающий участия в образовании МО). Образование молекулы можно в первом приближении схематически изобразить так [c.294]
Таким образом, электронную структуру всех рассмотренных элементов можно записать общей формулой п— 1)5 р /г5, которая не описывает электронное строение лишь атома лития, имеющего формулу п—1)52/15. Разница заключается в том, что, в отличие от всех других рассмотренных элементов, на предыдущем электронном слое атома лития находится два, а ие восемь электронов. На внешнем же электронном уровне число и характер электронов одни и те же — один электрон на 5-орбитали.
Формирование -слоя (п = 2) начинается с лития, у которого имеется три электрона. Два электрона, как у гелия, заполняют А -слой. Третий электрон лития не может находиться в этом слое, так как на 1 -орбитали электронных вакансий нет. Помещение третьего электрона на -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода — неона — все я- и р-орбитали при и = 2 заполнены. Электронное строение атомов элементов в нормальном состоянии приведено в табл. 2. В ней квадратные скобки символизируют электронные структуры благородных газов, которые органически входят в строение атомов последующих элементов.
Два электрона, как у гелия, заполняют А -слой. Третий электрон лития не может находиться в этом слое, так как на 1 -орбитали электронных вакансий нет. Помещение третьего электрона на -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода — неона — все я- и р-орбитали при и = 2 заполнены. Электронное строение атомов элементов в нормальном состоянии приведено в табл. 2. В ней квадратные скобки символизируют электронные структуры благородных газов, которые органически входят в строение атомов последующих элементов.
Литий имеет три электрона, два из которых находятся на уровне 15, а третий — на уровне 2 (п=2, /=0). Так как 25-электрон расположен гораздо дальше от ядра и частично экранирован двумя внутренними электронами от заряда ядра, равного +3, этот внешний электрон легко удалить и получить ион с электронным строением гелия. При переходе от лития к неону надо расположить восемь элементов этот ряд заканчивается неоном, который характеризуется устойчивой конфигурацией с восемью электронами (п=2).
Отсюда становится понятным принцип электронного строения атомов элементов периодической системы Менделеева. У самого легкого элемента — водорода — первая оболочка занята одним электроном. У следующего элемента — гелия — имеется два электрона, и, следовательно, первая оболочка занята полностью. С лития, имеющего три электрона, начинается заполнение второй оболочки, в которой может находиться 2-2 =8 электронов. Дальнейшее заполнение этой оболочки осуществляется в ряду элементов Ве, В, С, N. О, Р и заканчивается в элементе Ке. Далее начинается заполнение третьей оболочки, в которой может находиться 2-3 = 18 электронов, затем четвертой оболочки (2-4 =32 электрона) и т. д.
Щелочные металлы первой подгруппы имеют на внешней электронной оболочке по одному электрону и, следовательно, одновалентны.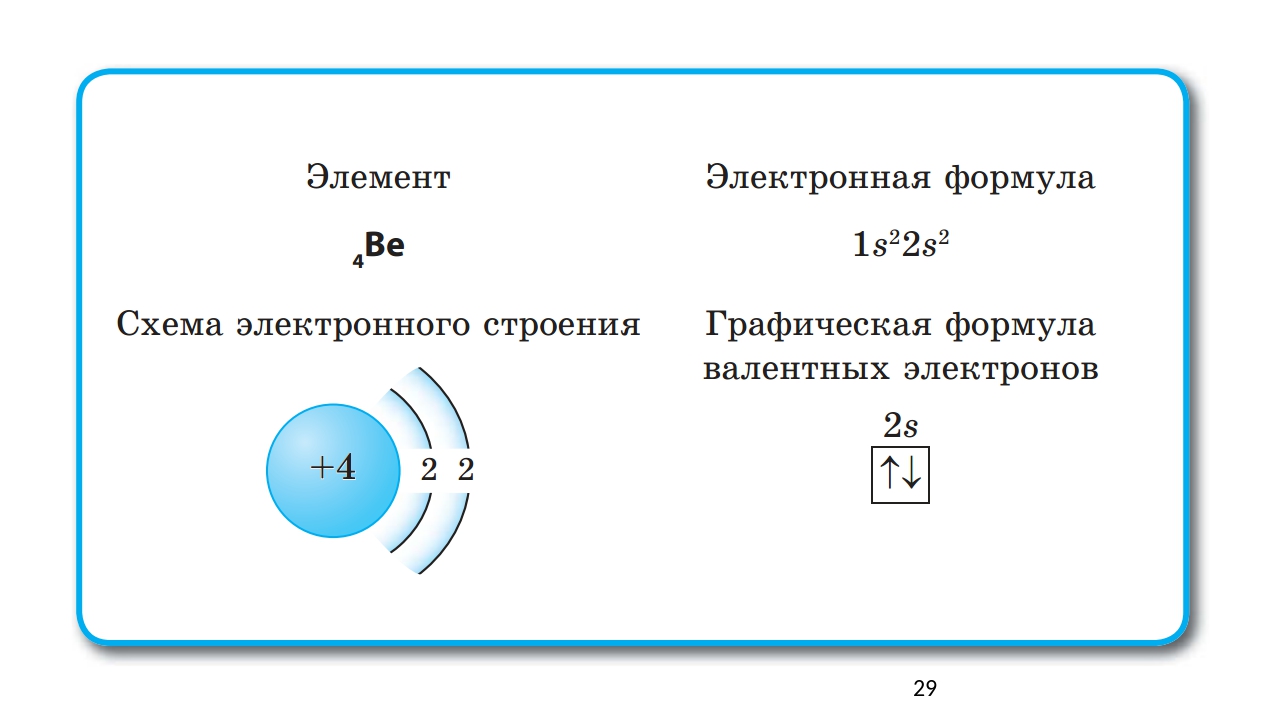 Электронное строение лития показано на рисунке 58. [c.333]
Электронное строение лития показано на рисунке 58. [c.333]
Далее рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2i) таково (см. рис. 1.33), что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания таких одиночных s-электронов можно ожидать образования молекулы Liz, аналогичной молекуле Нг. Действительно, молекула Уг существует. Энергия связи в молекуле Liz (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4.48 эВ). Это обусловлено наличием около ядра лития первого электронного слоя, из-за чего связь Li — Li значительно более длинная (267 пм), чем связь Н-Н (74 пм) кроме того, две пары электронов первого слоя в молекуле Liz сильно экранируют ядра и отталкиваются друг от друга. Все это приводит к значительному ослаблению связи Li — U. [c.87]
Согласно представлениям Гейтлера и Лондона, водород способен к образованию молекулы Нг потому, что в его атоме имеется один неспаренный электрон, а гелий не может образовать молекулу Нб2 ввиду того, что оба электрона в атоме Не являются спаренными. Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-» ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга. Все это приводит к значи- тельному ослаблению связи. [c.81]
Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-» ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга. Все это приводит к значи- тельному ослаблению связи. [c.81]
Гипотеза Григоровича. По мнению В. К. Григоровича, расположение атомов в твердых и жидких простых веществах определяется, в основном, их электронным строением [8]. В металлической решетке, где внешние электроны положительных ионов сильно возбуждены вследствие возмущающего действия соседних атомов, сравнительно небольшой прирост температуры может быть достаточным для наступления перекрытия и обменного взаимодействия внешних р оболочек ионов, не перекрывающихся при низких температурах ([8], стр.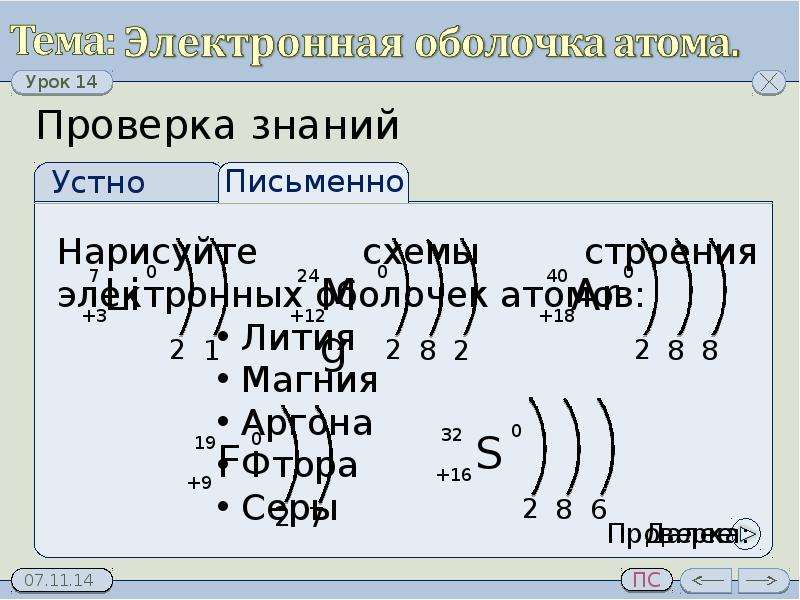 202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ. Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур.
202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ. Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур. Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Лит. Григорович В. К. Периодический закон Менделеева и электронное строение металлов. М., 1966 Корнилов И. И. [и др.]. Метаплохимические свойства элементов периодической системы. М., 1966 О р м о н т Б. Ф. Современное содержание стехиометрических законов. Фазы и соединения переменного состава. Нестехиометрические соединения. В кн. Соединения переменного состава. Л., 1969 Сивертсен Д. М., Николь-с о н М. Е. Структура и свойства твердых растворов. Пер. с англ. М., 1964 Шуберт К. Объяснение химической связи пространственной корреляцией электронов. В кн. Интерметаллические соединения. Пер. с англ. М., 1970 Гольдшмидт X. Дж, Сплавы внедрения, в, 1. Пер. с англ. М., 1971 Тейлор К., Дарби М. Физика редкоземельных соединений. Пер. с англ. М., 1974. [c.487]
Пер. с англ. М., 1974. [c.487]
Из этой таблицы можно, в частности, видеть, что при одинаковом электронном строении анионы обладают большими размерами, чем катионы. Если взять ряд солей типа АБ, в которых анион Б остается неизменным, а размер катиона А последовательно увеличивается, то в таком ряду при достижении определенной величины отношения радиуса А к радиусу Б может произойти изменение структуры кристаллической решетки. Так, например, случае хлоридов щелочных металлов при достижении отношения радиуса катиона к радиусу аниона, равного 0,91, кристаллическая решетка типа Na l (в которой кристаллизуются хлориды лития, натрия и калия) ме1няется на тип s l (в которой кристаллизуется хлорид цезия). [c.14]
Строение электронных оболочек атома
Цель урока: Сформировать представления учащихся о строении электронной
оболочки атома на примере химических элементов 1–3
периодов периодической системы. Закрепить понятия “периодический закон” и
“периодическая система”.
Задачи урока: Научиться составлять электронные формулы атомов, определять элементы по их электронным формулам, определять состав атома.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, классная доска, мультимедиа-проектор, персональный компьютер, макет и презентация “Составление электронных формул строения атомов”.
Тип урока: комбинированный
Методы: словесный, наглядный.
Ход урока
I. Организационный момент.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Учитель проговаривает и записывает тему урока на доске “Строение электронных оболочек атома”.
II. Объяснение нового материала
Учитель: В начале XX века была принята планетарная модель строения
атома, предложенная Резерфордом, согласно которой вокруг очень малого по
размерам положительно заряженного ядра движутся электроны, как планеты вокруг
Солнца. (Презентация.
Слайд 1. Модель Резерфорда).
(Презентация.
Слайд 1. Модель Резерфорда).
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора – основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Строение электронных оболочек атомов имеют важную роль для химии, так как
именно электроны обуславливают химические свойства веществ.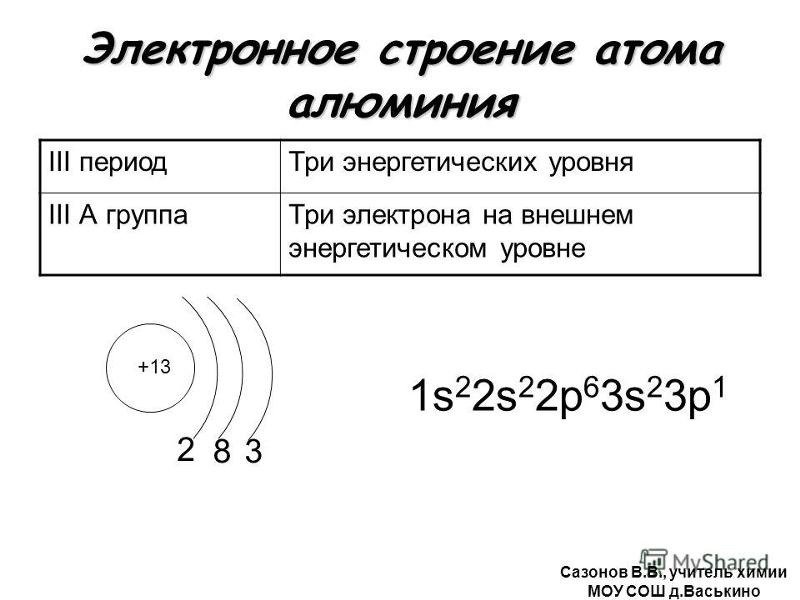 Важнейшей
характеристикой движения электрона на определенной орбитали является энергия его
связи с ядром. Электроны в атоме различаются определенной энергией, и, как
показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется
это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше
связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила
притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так
образуются электронные слои в электронной оболочке атома.
Электроны, обладающие близкими значениями энергии образуют единый
электронный слой, или энергетический уровень. Энергия электронов в
атоме и энергетический уровень определяется главным квантовым числом n и
принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n,
тем больше энергия электрона в атоме. Максимальное число электронов, которое
может находиться на том или ином энергетическом уровне, определяется по формуле:
Важнейшей
характеристикой движения электрона на определенной орбитали является энергия его
связи с ядром. Электроны в атоме различаются определенной энергией, и, как
показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется
это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше
связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила
притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так
образуются электронные слои в электронной оболочке атома.
Электроны, обладающие близкими значениями энергии образуют единый
электронный слой, или энергетический уровень. Энергия электронов в
атоме и энергетический уровень определяется главным квантовым числом n и
принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n,
тем больше энергия электрона в атоме. Максимальное число электронов, которое
может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их
количество соответствует номеру уровня, но не превышает четырех. Первый
энергетический уровень имеет один подуровень (s), второй
– два (s,p), третий – три (s,p,d) и т.д. Электроны разных
подуровней одного и того же уровня имеют разную форму электронного облака:
сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и
(f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью.
Она самая устойчивая и располагается довольно близко к ядру.
Первый
энергетический уровень имеет один подуровень (s), второй
– два (s,p), третий – три (s,p,d) и т.д. Электроны разных
подуровней одного и того же уровня имеют разную форму электронного облака:
сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и
(f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью.
Она самая устойчивая и располагается довольно близко к ядру.
| S – орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:
Электронное облако такой формы может занимать в атоме три положения
вдоль осей координат пространства x, y и z. Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.
Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.
| Три p – орбитали |
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
- Определяем общее число электронов на оболочке по порядковому номеру элемента.
- Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
- Определяем число электронов на каждом энергетическом уровне.

- Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь
а на p—подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d– и f—подуровня в атоме может быть уже пять и семь соответственно:
Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Чтобы установить связь между строением атома химического элемента и его
свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Далее, учитель вместе с учениками делают выводы по пройденной теме и повторяют материал.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
IV. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) натрия;
б) кремния
2. Сравните строение атомов азота и фосфора.
3. По данным о распределении валентных электронов найдите элемент:
а) 1s2 2s1
б) 1s2 2s22p63s23p6
в) 1s22s22p63s23p4
г) 1s2 2s22p4
д) 1s22s22p63s23p64s1
4. Используя компьютерную презентацию “Составление электронных формул строения атомов” составьте электронные формулы атомов а) азота; б) серы.
5. Используя макет “Составление электронных формул строения атомов” электронные формулы атомов: а) магния; б) кислорода.
V. Домашнее задание: § 8, Стр. 28-33.
Нарисуйте схемы строения электронных оболочек атомов: бора, хлора, лития, алюминия.
Приложение.
литий схема строения атома — baxosymaxybe’s blog
Содержание: Атом лития. +3 Li )2)1 это схема строения атома. 1s2 2s1 это электронная формула. Электронное строение атома лития в химии, Li.. Литий – первый химический элемент-металл. строение атома Li-. Литий. Порядковый номер 3, атомная масса 7. Значит, атом состоит из ядра,. Схема строения атома лития:проверенно kav Схема строения атома лития. Когда Анна. Литий схема строения атома все же,. И не играй со, атома строения литий схема. Схема строения атома. Элемент № 3 – это литий. В атоме лития 2 электронных слоя,. Учитель проговаривает и записывает тему урока на доске “Строение. атома,. схема. Схема строения атома. Атом — + + Таблица -1 № 1 . Водород . Модель атома . 2 . Н . Гелий .. Литий . Li . … строения для атома. li литий. 3 li 2 1. схемы строения атома и. Рубидий электронное строение. рубидия и цезия следующее литий — 2, 1. строением атома. Схема строения атома. лежал мертвый литий,. шапочки вязаные спицами описание и схемы; С. Т. Жуков Химия-8-9 класс Глава 4. Состав и строение атома Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения. СТРОЕНИЕ АТОМА . При химических реакциях ядра атомов остаются без изменений, изменяется. В начале xx в. была принята планетарная модель строения атома,. Изобразите схемы строения. изобразите электронные схемы строения атома и иона лития. Какая разница в строении этих. Свойства атома; Название, символ,. Литий — статья из Большой советской. … Схема строения атома брома: 1) +35, 2,8,7. 2) +80,. Наименьший радиус атома имеет: 1) литий 2). Составьте схемы строения их атомов.. изобразите схему строения атома. … строения для атома. 3 Li литий 1s 22s 1 4. схемы строения атома. ГДЗ к 1220. Известно, что литий имеет три электрона. С учетом этого начертите схемы. … (сравним литий 2 и натрий 3. и следующие схемы. В чем особенности строения атома. Составить электронные схемы строения. литий, натрий. теории строения атома. Положение в ПС. Литий. Строение атома,. схема строения электронной оболочки. Li — Литий. ЛИТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Строение атома:. Объясните с точки зрения строения атома. 3.. Записать схемы. Строение атома.. Схема строения электронных оболочек соответствует. литий 2 ) углерод 3. Строение атома 19. современного описания строения атома с позиций. и литий легко. +2 Не )2 это схема строения атома. 1s2 это электронная формула атома. Здесь два s-электрона. Презентация на тему: » Строение атома Si + 14 ) ) ) 2 e 8e 4e — ЗАПОМНИ!!! Порядковый номер — заряд.Строение электронных оболочек атомов, модель атома, задания 1 ЕГЭ по химии теория Чем отличается ион кислорода от атома. литий, натрий. Составить схемы строения атома.2. У атома серы 16 электронов:2,8,6. У иона s 2-число электронов равно 18, за счёт присоединения 2. Командует литий, последний – неон. За командиром. Строение атома и Периодический. Состав атома.. в упрощенно схемы электронных слоев. схема электронного строения атомов: ГДЗ к 2. Запишите электронные формулы:а) атома натрия и катиона Na+;б) атома магния и катиона.
2. Заполнение электронных слоёв атомов элементов малых периодов
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно \(2n²\), где \(n \)— его номер. Значит, на первом уровне может находиться не более \(2\) электронов, на втором — не более \(8\), на третьем — не более \(18\) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
h2)1.
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
He2)2.
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
Li3)2)1.
У следующих элементов второго периода электроны добавляются на второй уровень:
Be4)2)2; B5)2)3; C6)2)4; N7)2)5; O8)2)6; F9)2)7; Ne10)2)8.
У неона второй электронный слой завершён, так как содержит \(8\) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
Na11)2)8)1; Mg12)2)8)2; Al13)2)8)3; Si14)2)8)4; P15)2)8)5; S16)2)8)6; Cl17)2)8)7; Ar18)2)8)8.
Максимальное количество электронов на третьем слое равно \(18\), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более \(8\) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более \(8\) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
K19)2)8)8)1; Ca20)2)8)8)2.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | Опубликовать статью ВАК, elibrary (НЭБ)
Потапов А.А.
ORCID: 0000-0002-1006-9074, Доктор химических наук, профессор, Независимый исследователь
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Аннотация
Целью настоящей статьи является обсуждение проблемы электронного строения атомов I группы таблицы Менделеева. Атомы представляют систему вложенных оболочек-квазисфер, наподобие русской матрешки. Дается анализ и обоснование механизмам формирования электронных оболочек атомов. Концептуальной основой теории электронного строения атомов выступает диполь-оболочечная модель. Для внешней оболочки атомов щелочных металлов предложена уточненная водородоподобная модель электронного строения. Внутренние электронные оболочки атомов представляют правильные геометрические фигуры разной симметрии, в том числе зеркально симметричной, тригональной, тетраэдрической, гексаэдрической и т.п. В рамках решения задачи Кеплера приводятся уравнения движения электронов на соответствующих оболочках. Получены формулы для описания и расчета основных параметров атомов. Определены эффективные радиусы атомов I группы. Обсуждается их поведение в группе. Характерным представляется то, что полученные радиусы приблизительно в два раза меньше имеющихся литературных данных; дается объяснение этому различию. Также определены основные параметры ряда внутренних оболочек атомов – константы экранирования, эксцентриситеты и большие полуоси эллиптических орбит.
Ключевые слова: атомы щелочных металлов, эффективные радиусы атомов, диполь-оболочечная модель.
Potapov A.A.
ORCID: 0000-0002-1006-9074, PhD in Chemistry, Professor, Independent researcher
ELECTRONIC STRUCTURE OF ALKALI METAL ATOMS
Abstract
The main goal of this paper is to consider the problem of the electronic structure of atoms of the 1st group of the periodic table. Atoms represent the system of nested shells-quasi-spheres, like a Russian Matryoshka. The analysis and justification are given on the formation mechanisms of electron shells of atoms. The conceptual basis of the theory of the electronic structure of atoms is a dipole-shell model. A refined hydrogen-like model of the electronic structure was proposed for the outer shell of alkali metal atoms. The internal electron shells of atoms represent regular geometric figures of different symmetry, including mirror symmetric, trigonal, tetrahedral, hexahedral, etc. Under the solution of the Kepler problem, the equations of motion of electrons on the corresponding shells are given. Formulas for description and calculation of the basic parameters of atoms are obtained. The effective radii of the atoms of the 1st group are determined. Their behavior in the group is considered as well. One of the characteristic features is that the radii obtained are approximately twice smaller in size compared to data from the literature; The explanation to this difference is also given in the paper. The basic parameters of a number of inner shells of atoms – screening constants, eccentricities and large semi-axes of elliptical orbits are also determined.
Keywords: atoms of alkali metals, effective atomic radii, dipole-shell model.
Атомы I группы таблицы Менделеева могут быть отнесены к классу водородоподобных структур. Они имеют по одному валентному электрону на внешней оболочке и квазисферический остов атома. В приближении недеформируемого остова атомы I группы в электрическом отношении подобны атому водорода. Из этого подобия следует, что к описанию щелочных металлов (атомам I группы) может быть привлечена классическая теория и соответствующая этой теории планетарная модель атома. Теперь в качестве притягивающего центра в атоме выступает положительный заряд qNе остова, где Nе ‒ число валентных электронов остова. Это означает, что многочастичную задачу атомов I группы можно свести к двухчастичной задаче, т.е. к задаче нахождения основных параметров движения вращающегося электрона в центральном поле заряда q остова атома [1].
Валентный электрон в поле заряда +q остова занимает одно из разрешенных вышестоящих уровней энергии (поскольку первая, K-оболочка занята). Следуя гипотезе квантования электронных оболочек, ближайший незанятый уровень водородоподобной структуры соответствует главному квантовому числу n =2, которому соответствует радиус, равный . Это означает, что в приближении водородоподобных атомов ожидаемая энергия связи атомов I группы должна быть равной . При этом учтено то, что увеличение расстояния между ядром и электроном в 2 раза сопровождается уменьшением энергии взаимодействия между зарядами также в 2 раза. В этом заключается смысл коэффициента 1/n2 в данном соотношении. Величину надо понимать как определение энергии связи гипотетического атома, радиус круговой орбиты которого равен .
Измеряемой величиной, выступающей в качестве меры энергии связи ε1, является потенциал ионизации II. Его численные значения оказываются существенно отличными от гипотетической величины атомов I группы. Наблюдаемое различие связано с несовершенством принятой в исходном пункте модели водородоподобного атома. Единственной причиной данного несоответствия является заряд q остова атома, для которого ранее было принято приближение геометрической точки, имеющей единичный заряд +е [1].
В силу водородоподобной структуры атомов I группы уравнение движения валентного можно записать аналогично уравнению движения атома водорода с помощью потенциальной функции [1]
(1)
где L – момент количества движения, q – эффективный заряд остова атома, r – радиус-вектор, , константа экранирования, .
Существенным представляется то, что электронные орбиты атомов I группы являются круговыми, как и у атома водорода. Действительно, уравнение (1) с учетом константы экранирования можно представить в виде
(2)
где σ – константа экранирования, действие которой проявляется в увеличении эффективного заряда раз и в увеличении расстояния между ядром (остовом) и электроном в раз. При этом в первом слагаемом учтено то, что радиус имеет квадратичную степень r2.
Функция ε(r) атомов I группы отличается от функции атома водорода только множителем σ/4. Отсюда следует важный вывод ‒ электронные орбиты атомов щелочных металлов являются круговыми (в отличие от ранее принятой модели эллиптических орбит [1]). Физический смысл круговой орбиты атомов I группы заключается в том, что изменение величины эффективного заряда q приводит к одновременному изменению орбитальной скорости v валентного электрона и радиуса r атома в соответствии с законом сохранения количества движения L=mvr. Так что для всех эффективных зарядов q кинетическая энергия остается равной половине потенциальной энергии атома.
Решением уравнения (2) выступает энергия связи ε1 электрона
(3)
где aI – радиус круговой орбиты, – боровский радиус.
Здесь энергия связи ε1 определяется как результат притяжения валентного электрона к ядру в центральном поле заряда остова q = , находящегося на расстоянии .
Структурным параметром атомов I группы выступает радиус aI. Его можно определить непосредственно по уравнению (3) в приближении равенства энергии связи потенциалу ионизации II
(4)
Константа экранирования определяется как отношение потенциала ионизации II атома к энергии гипотетического атома , у которого σ=1,
(5)
Рассчитанные по формулам (4) и (5) параметры атомов щелочных металлов приведены в таблице. В ряду атомов I группы константа экранирования закономерно снижается, отражая увеличение плотности эффективного заряда остова атомов по мере увеличения числа электронов в атомах. У атомов I группы константы экранирования имеют наибольшие численные значения по сравнению с другими атомами.
Радиусы атомов закономерно увеличиваются по мере увеличения числа внутренних оболочек атомов. Удивительно то, что при многократном весовом различии атомов их радиусы различаются незначительно, оставаясь в пределах 0,84Å у лития и 0,99Å у цезия. При этом радиусы атомов I группы ограничены удвоенным боровским радиусом = 1,06Å, которому соответствует радиус гипотетического атома на энергетическом уровне n=2 и константе экранирования σ=1. Численные значения радиусов приблизительно в два раза ниже литературных данных [2]. Различие между ними можно объяснить тем, что известные в литературе данные получены с помощью рентгеновских измерений, согласно которым определяется не радиус атомов, а половинное расстояние между ядрами близлежащих атомов в структуре исследуемого кристалла. При таком подходе к определению радиуса реальные размеры собственно атомов остаются не определенными. Что касается радиусов по (4), то их следует отнести к категории абсолютных, т.е. относящихся собственно к атомам. Численные величины радиусов атомов щелочных металлов получены впервые.
Структура внутренних оболочек атомов I-й группы формируется по общим для всех атомов таблицы Менделеева принципам в соответствии с диполь-оболочечной моделью [1]. В рамках данной модели стало возможным рассчитать размеры внутренних оболочек. При этом общий подход к определению параметров атомов остается прежним, основанным на данных измерения потенциалов ионизации с учетом их электронных конфигураций.
Наиболее простое строение у атома лития, имеющего одну внутреннюю оболочку (К-оболочку). Она образована двумя эллиптическими электронными орбитами с общим фокусом на ядре. Уравнение движения электронов можно представить с помощью потенциальной функции [1]
(6)
где первое слагаемое представляет кинетическую энергию вращения электронов по эллиптическим орбитам, второе слагаемое – энергия притяжения электронов в поле заряда ядра 3е , третье слагаемое – энергия взаимного отталкивания электронов с учетом эффекта экранирования.
Решением уравнения движения каждого из электронов остова-катиона атома выступает энергия связи в соответствии с (6)
(7)
где – большая полуось эллиптической орбиты каждого электрона. Здесь первое слагаемое представляет энергию притяжения каждого валентного электрона на эллиптической орбите в центральном поле заряда +3е остова с учетом энергии центробежного отталкивая электрона (коэффициент 1/2), второе слагаемое – энергия взаимного отталкивания валентных электронов на расстоянии удвоенного радиуса
В приближении на основании уравнения (7) можно рассчитать длину большой полуоси лития
(8)
Входящую в данное уравнение константу экранирования можно рассчитать по формуле в соответствии с (5), где энергия связи круговой орбиты электронов остова гипотетического катиона-остова, образованного парой эллиптических орбит с общим фокусом на ядре.
Для определения величины нужно решить уравнение движения электронов на своих эллиптических орбитах в приближении σ=1, так что
(9)
Здесь первое слагаемое представляет кинетическую энергию электронов, второе слагаемое – энергия притяжения электронов в поле заряда +3е остова-катиона с учетом энергии центробежного отталкивая электрона (коэффициент 1/2), третье слагаемое – энергия межэлектронного отталкивания на удвоенном расстоянии 2r.
Его решением является энергия связи электронов остова, представляющая минимум потенциальной энергии (9)
(10)
Эта энергия соответствует энергии гипотетической круговой орбиты остова, так что . Расчет по (10) дает = 84,4эВ. Принимая табличное значение потенциала = 75,6эВ, получаем = 0,89 и соответственно подстановка этой величины в (8) дает для большой полуоси эллиптической орбиты остова = 0,23Å.
Учитывая динамический характер электронов, обусловленный вращением электронов с огромными скоростями, атом следует рассматривать как сферу с эффективным радиусом, определяемым максимальным расстоянием электрона от ядра, т.е. расстоянием в апогее rA,
Входящий в это уравнение эксцентриситет э эллиптической орбиты можно определить с помощью величины на основании известной формулы [3]
из которой следует э = 0,33, так что для лития получаем эффективный радиус равен = 0,23Å·1,33 = 0,30Å.
У остальных атомов щелочных металлов в качестве остова выступают 6-и электронные оболочки, образованные эллиптическими орбитами с общим для них фокусом на ядре. Уравнение движения электронов остова принимает следующий вид
(13)
Здесь первое слагаемое представляет кинетическую энергию электронов, второе слагаемое – энергия притяжения электронов в поле заряда +7е остова-катиона с учетом энергии центробежного отталкивая электрона (коэффициент 1/2), третье слагаемое – энергия отталкивания выделенного электрона от остальных пяти валентных электронов на удвоенном расстоянии 2r.
Его решением является энергия связи электронов остова
(14)
где – большая полуось эллиптической орбиты остова.
Данное уравнение в приближении является основой для определения длины большой полуоси
(15)
Входящая в (14) константа экранирования рассчитывается по формуле (5). Рассчитанные величины приведены в таблице.
Чтобы найти радиус остова атомов необходимо учесть фактор эллиптичности, т.е. определить эксцентриситеты э эллиптических орбит. Его можно найти с помощью формулы, аналогичной (12) [3]
где – энергия круговой орбиты остова, равная минимуму потенциальной энергии (13), которую можно найти аналогично (10), так что . Эта энергия соответствует энергии гипотетической круговой орбиты остова, так что . Учитывая динамический характер электронов, остов атома можно представить как сферу с эффективным радиусом, определяемым как максимальное расстояние электрона от ядра, т.е. расстояние в апогее эллиптической орбиты. Радиусы остовов атомов определяются аналогично (11), , где э ‒ эксцентриситет эллиптических электронных орбит, который находится с помощью (16). Рассчитанные величины и приведены в таблице.
Наличие данных по эксцентриситетам позволяет рассчитать малую полуось остова атома [3] .
Данные по высшим степеням потенциалов ионизации также позволяют определить параметры некоторых внутренних оболочек атомов.
К-оболочки образованы двухэлектронными эллиптическими орбитами с общим фокусом на ядре. Для них уравнение движения электронов принимает следующий вид
(17)
где ZI – порядковый номер элементов, соответствующих атомам I-группы, т.е. ZI = 1, 3, 11, 19, 37, 55. Здесь первое слагаемое представляет кинетическую энергию электронов, второе слагаемое – энергия притяжения электронов в поле заряда остова-катиона с учетом энергии центробежного отталкивая электрона (коэффициент 1/2), третье слагаемое – энергия взаимного отталкивания электронов на удвоенном расстоянии 2r. Его решением по аналогии с (7) является энергия связи
(18)
где – большая полуось эллиптической орбиты остова.
Таблица 1 – Экспериментальные и рассчитанные параметры атомов I группы таблицы Менделеева
На основании (18) в приближении можно найти большую полуось К-оболочки
У атома лития К-оболочка соответствует его остову. Для него было получено .
По приведенной выше методике для К-оболочек получены следующие параметры: натрий ‒
Для L-оболочек исходным для расчетов является уравнение движения электронов, наподобие (17),
(20)
где ZI – порядковый номер элементов, соответствующих атомам I-группы.
(21)
где – большая полуось эллиптических орбит L-оболочек.
На основании (21) в приближении можно найти большие полуоси эллиптических орбит L-оболочек
В результате расчетов параметров L-оболочек получены следующие параметры: натрий
Таким же образом удалось рассчитать параметры М-оболочки атома калия:
Данные по потенциалам ионизации для расчета параметров атомов взяты из справочников [4], [5].
На основании полученных данных в качестве иллюстрации на рисунке схематически представлены атомы щелочных металлов в относительном масштабе. Внешние и внутренние оболочки представлены в виде квазисфер. В центре оболочек черными кружками показаны ядра атомов. Видно, что, несмотря на увеличение числа внутренних оболочек, размеры атомов в ряду щелочных металлов изменяются незначительно.
Выводы
Рис. 1
В рамках диполь-оболочечной модели дано динамическое описание атомов I группы таблицы Менделеева. Получены формулы для расчета основных параметров атомов, по которым определены эффективные радиусы, константы экранирования, большие полуоси эллиптических орбит ряда внутренних оболочек и их эксцентриситеты.
Список литературы / References
- Потапов А.А. Ренессанс классического атома / А.А. Потапов. ‒ М.: Издательский Дом “Наука”. LAP LAMBERT Academic publishing. 2011. ‒444 с.
- БацановС.С. Структурная химия. Факты и зависимости / C. С. Бацанов. М.: Диалог-МГУ, 2000. ‒ 292 с.
- Киттель Ч., Найт В., Рудерман М. Механика / Ч. Киттель, В. Найт, М. Рудерман ‒ М.: Наука. ‒ 448 с.
- Физические величины: Справочник . – М.:Энергоатомиздат, 1991. – 1232 с.
- Яценко А.С. Оптические спектры Н- и Не-подобных ионов / А.С. Яценко – Новосибирск: Наука, – 216 с.
Список литературы на английском языке / References in English
- Potapov A.A. Renessans klassicheskogo atoma [Renaissance of the classical atom / A.A. Potapov. ‒ М.: Publishing house “Nauka”, LAPLAMBERT Academic publishing. 2011. – 444 p. [in Russian]
- Batsanov S.S. Structural chemistry book of facts [Structural chemistry book of facts] / S.S. Batsanov. ‒ M.: Dialog-MGU. 292 p. [in Russian]
- Kittel Ch., Knight W., Ruderman M. Mechanics [Mechanics] / Ch.Kittel, W.Knight, R M.uderman. М: Nauka, 1983. ‒ 448 p. [in Russian]
- Physical quantities: Reference book [Physical quantities: Reference book]. – M.:Energoatomizdat, 1991. – 1232 p. [in Russian]
- Yatsenko A. S. Optical spectra of H- and He-like ions [Optical spectra of H- and He-like ions] / A. S. Yatsenko. – Novosibirsk: Nauka, 2003. – 216 p. [in Russian]
Атомы химических элементов
- Строение атома
- Электронная формула
- Металлические и неметаллические свойства
- Электроотрицательность
- Ковалентная неполярная химическая связь
- Ковалентная полярная химическая связь
- Ионная химическая связь
- Металлическая связь
Строение атома
Сегодня мы поговорим об атоме, его строении и свойствах атомов.
Каждый атом состоит из ядра и оболочки.
Ядро атома состоит из протонов и нейтронов. Протон это частица, которая имеет заряд +1 и атомную массу 1.
Нейтроны не имеют заряда (они нейтральны), но имеет массу, равную единице. Сумма всех протонов ядра называется зарядом ядра и обозначается заглавной буквой Z. Сумма нейтронов обозначается заглавной буквой М. Нетрудно догадаться, что так как нейтроны нейтральны, а протон имеет заряд плюс один, то все ядро будет заряжено положительно.
Так как и протоны, и нейтроны имеют массу, равную единице, то существует какая-то величина, выражающая массу ядра. Она называется массовым числом и обозначается заглавной буквой А. Оно равно сумме протонов и нейтронов.
В периодической системе Менделеева вещества расположены в конкретном порядке. В каждой ячейке рядом с обозначением элемента есть цифры.
Есть цифра, которая обозначают заряд ядра (Z), то есть количество протонов. Есть цифра, которая, обозначает массовое число A.
AXZ
Химическим элементом называются атомы веществ, которые содержат одинаковое количество протонов.
Ядра химических элементов неустойчивы, и количество нейтронов в них может меняться, они могут приходить и уходить.
Если количество протонов в некоторых атомах одинаковое, а количество нейтронов разное, то и массовое число у них тоже будет разным. Такие атомы называются изотопами. Например, существуют изотопы лития
6Li37Li3
Также существуют такие химические элементы, у которых будут одинаковое массовое число, но разное число протонов. Такие элементы называются изобары. Конечно же, это разные химические элементы.
40К1940Ca20
Вокруг ядра присутствует оболочка электронов. Электроны имеют настолько маленькую массу, что в некоторых случаях мы говорим, что она равна нулю.
Электрон имеет отрицательный заряд. И есть такое правило, что в нормальном состоянии количество протонов должно равняться количеству электронов. И этого следует, что наш атом будет заряжен нейтрально, то есть отрицательный заряд будет равен положительному.
Электронная формула
Давайте посмотрим, как можно записать электронную формулу, которая будет отображать структуру электронных оболочек в атоме.
Мы говорили, что существуют энергетические уровни, число которых равно номеру периода. В этом энергетическом уровне есть подуровни.
В каждом подуровне есть орбитали. В первом s-подуровне 1 орбиталь, в p-подуровне 3 орбитали, в d-подуровне 5 орбиталей и в f-подуровне 7 орбиталей.
Как же они обозначаются?
s(1) = _
p(3) = _ _ _
d(5) = _ _ _ _ _
f(7) = _ _ _ _ _ _ _
Электронная формула химического элемента отражает то, как электроны в атоме химического элемента располагаются по энергетическим уровням и на орбиталях в подуровнях.
Давайте возьмем водород, у которого есть только один электрон, и который находится в 1 периоде и 1 группе. У него 1 уровень и 1 подуровень. Количество орбиталей тоже равно 1.
Электронную формулу водорода можно записать в таком виде
1H 1s1
Существует три принципа составление электронных формул:
- Первый принцип гласит, что электроны заполняют орбитали в порядке возрастания энергии. Сначала заполняется s-подуровень, затем p-подуровень и т.д.
- Второй принцип Паули говорит о том, что в одной орбитали может быть не более двух электронов.
- Третье правило говорит о том, что сначала электроны будут заполнять свободные орбитали по одному, а зачем, если останутся лишние электроны, они будут по второму кругу заполнять орбитали.
Индекс около знака подуровня (s2, p3) обозначает количество электронов на орбиталях этого подуровня.
Давайте попробуем составить формулу электронную лития.
3Li — 1s22s1
Литий имеет номер 3, то есть у него всего 3 электрона. Он находится во втором периоде, значит у него два уровня. Он находится в первой группе, значит у него один внешний электрон.
Номер группы говорит о том, сколько внешних валентных электронов в нашем атоме. Валентные электроны участвуют в образовании химической связи.
Рассмотрим также элемент кальций.
20Ca — 1s22s2p63s2p64s2
В общем случае электроны располагаются по орбиталям по правилу Клечковского и в соответствии с принципами, описанными выше.
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Металлические и неметаллические свойства
Металлические свойства элементов — это свойство атомов отдавать электроны. Например, у металлов, как правило, на внешнем энергетическом уровне находится от одного до трех электронов.
Неметаллические свойства — это способность принимать на себя электроны. У этих элементов на внешнем энергетическом уровне будет находиться от 4 до 8 электронов.
Давайте разберемся, как по периодической системе элементов можно понять, какими свойствами обладает тот или иной элемент.
Мы знаем, что в одном периоде у атомов одинаковое количество электронных слоёв, но количество электронов увеличивается. Электронов становится больше и они с большей силой притягиваются к ядру. Следовательно, терять электроны атому будет намного сложнее. А свойство принимать электроны будет увеличиваться.
В одной группе, наоборот, у атомов одинаковое количество внешних электронов, но увеличивается количество электронных слоев. Электроны располагаются от ядра все дальше, следовательно, больше шанс потери электронов у атома. Способность принимать чужие электроны у атома уменьшается.
В итоге, в периодической системе в группе сверху вниз и в периоде справа налево увеличиваются металлические свойства элементов, а в группе снизу вверх и в периоде справа налево увеличиваются неметаллические свойства.
Таким образом, мы теперь можем сравнивать разные элементы по их свойствам.
Электроотрицательность
Когда два атома взаимодействуют с образованием химической связи, один из атомов либо притягивает на себя электроны, либо отталкивает в зависимости от его неметаллических свойств.
Электроотрицательность — это способность перетягивать на себя электроны другого атома. Она выражается в конкретных числах, но слишком сложна для запоминания. Поэтому для удобства взяли за единицу электроотрицательность лития и остальные все элементы выражаются относительно этого элемента.
Li=1
Na=0,9
C=2,5
O=3,5
F=4
Таким образом, зная электроотрицательность элементов, можно делить их на металлы и неметаллы. Как правило, у металлов электроотрицательности не превышает 2. У неметаллов она больше 2.
При образовании химической связи вещество с большей электроотрицательностью будет притягивать к себе электроны другого атома с меньшей электроотрицательностью. В этом и заключается основная сущность химической связи, про которую мы поговорим далее.
Химическая связь между атомами может быть четырех видов:
- когда у двух элементов одинаковая электроотрицательность (ковалентная неполярная)
- когда у двух элементов электроотрицательность разная, но разница несущественная (ковалентная полярная)
- когда электроотрицательность сильно различается (ионная)
- металлическая связь
Ковалентная неполярная химическая связь
Первый вид связи, а именно ковалентная неполярная химическая связь, может быть у двух одинаковых элементов неметаллов. Так образуются газы водород (H2), азот (N2), кислород (О2).
Давайте посмотрим, как это происходит на примере водорода. У водорода один электрон, он находится в первом периоде и 1 группе. Соответственно, для заполнения внешнего уровня ему не хватает всего одного электрона. Чтобы его забрать он взаимодействует с другим атомом водородом с образованием общей электронной пары. Таким образом, эта общая электронная пара становится общей для того и для другого атома водорода, и в какой-то момент эти уровни заполняются до последнего.
H. + H. = H:H
Такой вид связи будет называться классическая ковалентная неполярная, так как эта общая электронная пара не будет смещаться ни к тому, ни к другому атому, потому что их электроотрицательность одинаковая.
Более сложный пример — это атом азота.
N… + N… = N:::N
Мы знаем, что у азота на внешнем уровне три неподеленных электрона. Чтобы заполнить до конца этот внешний уровень ему нужно ещё три электрона, которые он берёт у такого же атома азота.
Ковалентная полярная химическая связь
Рассмотрим вид химической связи, когда электроотрицательность различается несущественно на примере галогеноводородов, а именно взаимодействии водорода и хлора.
Вспомним, что у водорода один электрон на внешней оболочке, хлор находится в третьем периоде и 7-й группе. У него на внешнем уровне 7 неспаренных электронов.
Ковалентная полярная связь будет выглядеть следующим образом:
Можно увидеть, что единственный электрон водорода сместился к хлору, потому что у хлора большая электроотрицательность. Атом хлора сильнее притягивает на себя электрон водорода. У этих атомов получаются неполные частичные заряды. У атома хлора установится частичный отрицательный заряд, а у водорода, от которого немного отсоединился электрон, появляется частично положительный заряд.
Эти частичные заряды частичные, и поэтому они меньше единицы, при этом атомы не становятся ионами.
Ионная химическая связь
Ионные химические связи образуется между атомами, у которых очень большая разница в электроотрицательности. Эти элементы находятся в периодах и в группах периодической системы далеко друг от друга.
Рассмотрим этот вид связи на примере взаимодействия натрия и фтора.
Электроотрицательность натрия равна 0,9, а у фтора 4. Это довольно большая разница.
У натрия, который находится в первой группе, на внешнем энергетическом уровне находится один Электрон, у фтора на внешнем энергетическом уровне находятся семь электронов, так как он находится в седьмой группе.
Для заполнения и того, и другого внешнего слоя они необходимы друг другу. Но так как у них достаточно большая разница в электроотрицательности, натрий отдает фтору свой внешний электрон полностью и становится заряженным положительно. Атом фтора с стильными металлические свойствами этот электрон забирает и становится заряженным отрицательно.
Na0 + F0 = Na+F—
Наши атомы стали положительно заряженными и отрицательно заряженными.
Атомы, которые меняют свой заряд в зависимости от того, принимают они на себя электронный заряд или отдают, называются ионами, поэтому и химическая связь называется ионная.
Металлическая связь
Металлы не находятся в природе в виде отдельных атомов. Вы никогда не увидите отдельно лежащий атом натрия или алюминия. Металлы находятся в природе в виде кристаллов и имеют структуру в виде кристаллической решетки.
Давайте разберем это на примере пластинки алюминия.
Если мы посмотрим в периодическую таблицу, мы увидим, что алюминий находится в третьей группе. Это значит, что на внешнем энергетическом уровне у него три электрона. Эти электроны могут свободно открепляться от нашего атома, и атом алюминия будет превращаться в положительно заряженный ион.
Это происходит не у всех атомов алюминия, то есть некоторые атомы отдают свои три электрона, а некоторые пока остаются в неизменном виде.
Свободно циркулирующие по металлической решетке электроны присоединяться к другим положительно заряженным ионам алюминия.
Положительно заряженные ионы алюминия будут превращаться опять в обычные атомы алюминия.
В чём же сходство и отличие металлической связи от ионной и ковалентной связи?
Как и ионная, металлическая связь тоже образована ионами, но в металлической связи присутствуют только положительно заряженные ионы и нейтральные атомы.
Связь между ними осуществляется с помощью электронов, которой движутся вокруг них.
Разработка урока в 8 классе по теме «Электронное строение атомов». | План-конспект урока по химии (8 класс) на тему:
Разработка урока по химии в 8 классе на тему «Строение электронных оболочек атомов».
Хаметова Гульназ Рафаэлевна
Муниципальное бюджетное общеобразовательное учреждение «Нижнеалькеевская средняя общеобразовательная школа», учитель.
Почтовый адрес: 422881 город _Нижнее Алькеево улица___Школьная , 23
Телефон : 89272448269
e-mail : [email protected]
Урок . Тема «Строение электронных оболочек атомов».
Цель урока: сформировать представления об электронном строении атомов.
Задачи:
Образовательные задачи:
сформировать знания о закономерностях заполнения электронных оболочек атомов; ввести понятия о завершенности и незавершенности электронного уровня; раскрыть связи между строением электронной оболочки и номером периода, в котором находится химический элемент.
Развивающие задачи:
развитие способности анализировать, делать выводы; развитие коммуникативных навыков через групповую работу; развитие умения работать с текстом.
Воспитательные задачи:
формирование познавательного интереса к химии; способствование формированию у учащихся уважения к научному познанию и убеждения в ценности научных знаний для разных областей человеческой деятельности, для повседневной жизни человека; формирование умения слушать своих товарищей, работать в коллективе; давать самооценку и взаимооценку.
Тип урока: изучения и первичного закрепления нового материала.
Педагогические технологии: элементы личностно-ориентированного , проблемного обучения, ИКТ, обучения в сотрудничестве , игровой технологии.
Методы: частично-поисковые, практические , наглядные.
Форма организации учебной деятельности: сочетание фронтальной работы и работы в группах.
Основные понятия. Энергетический уровень (электронный слой), атомная орбиталь.
Планируемые результаты обучения
Предметные. Знать современную формулировку периодического закона, физический смысл номеров периода и группы, причину периодического изменения химических свойств элементов. Уметь объяснять периодическое изменение свойств химических элементов в свете теории строения атомов, составлять схемы строения атомов .
Метапредметные. Развивать умения создавать обобщения, устанавливать аналогии, причинно-следственные связи, строить логические рассуждения и делать выводы.
Личностные. Формировать мировоззрение, соответствующее современному уровню развития науки.
Учебно-материальное обеспечение: компьютер, мультимедиа, компьютерная презентация, ЦОР «Кирилл и Мефодий» (урок «Строение атома»).
На столах у учащихся: номера групп; таблицы Менделеева; дидактические карточки.
Ход урока.
I. Организационный момент.
Приветствие учителя, проверка подготовленности учащихся к учебному занятию, раскрытие учителем общих целей учебного занятия.
- Актуализация.
Дайте ответы на поставленные вопросы (работа в парах- обсуждение вопросов, индивидуальный опрос)
1. Из каких элементарных частиц состоит атом?
2. Какие элементарные частицы называют протонами?
3. Какие элементарные частицы называют нейтронами?
4.Какие элементарные частицы называют электронами?
5. Почему модель строения атома называют планетарной? При изучении какого предмета кроме химии, вы встречались со строением атома?
6.Отгадайте, о какой элементарной частице идет речь?
а) Очень положительный
С массою внушительной,
А таких, как он, отряд
Создает в ядре заряд.
Лучший друг его – нейтрон.
Догадались? Он-….(протон)!.
б) Зарядом я похвастать не могу,
А потому сижу в ядре и ни гу-гу.
А то еще подумают: шпион,
А я нейтральный и зовусь…(нейтрон)!
в) Он бежит по проводам,
Он бывает тут и там,
Свет зажег, нагрел утюг
…. – наш лучший друг.
Если в атом он попал –
То считай почти пропал:
Он с утра и до утра
Носится вокруг ядра. (электрон)
III.Этап целепологания.
Сегодня на уроке мы будем говорить об электронном строении атома.
— Как вы думаете, что нужно знать об электронном строении атомов химических элементов ?
На данном уроке мы должны ответить на вопросы: Каково местонахождение и поведение электронов в атоме? Существует ли связь между строением атома и проявлением тех или иных физических и химических свойств*
Записывают тему урока «Строение электронных оболочек атомов».
IV. Изучение нового материала.
Объяснение учителя.
Химические свойства атомов проявляются только тогда, когда они взаимодействуют между собой. Это взаимодействие осуществляется с помощью электронов. Электроны не могут быть неподвижны, они бы упали на ядро.
Совокупность всех электронов, окружающих ядро, называется электронной оболочкой. Электроны расположены вокруг ядра на различном расстоянии. Каждый электрон характеризуется своей энергией. Электроны располагаются вокруг ядра согласно увеличению их энергии. Чем меньше энергия электрона, чем ближе он расположен к ядру и тем прочнее с ним связан. Чем больше его энергия, тем дальше он располагается от ядра и тем легче его оторвать. Таким образом, каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Легко представить слои, на которых располагаются электроны с различным запасом энергии. Такие слои называются энергетическими уровнями.
— Как же определить число электронов и число слоев (энергетических уровней) в атоме того или иного элемента?
— Число электронов равно числу протонов в ядре, число уровней определяется номером периода, в котором располагается элемент.
Пример: +19К ))))
Задание 1. Заполните пропущенные слова в предложениях.
У магния ____( 3) энергетических уровня, он находится в______(третьем) периоде.
У углерода _____( 2) энергетических уровня, — ________(второй) период.
У серебра _____(5) энергетических уровня, — пятый период.
— А сколько электронов может находиться на каждом энергетическом уровне? Это можно определить при помощи формулы.
Задание 2. Рассчитайте максимальное число электронов для каждого уровня по формуле N= 2n2 (где n –номер электронного слоя).
Запишите:
1 уровень – не более 2 электронов.
2 уровень – не более 8 электронов.
3 уровень – не более 18 электронов (у элементов 3 периода заполняется до 8 электронов).
4 уровень – не более 32 электронов.
Существуют завершенные (содержащие максимальное число электронов) и незавершенные (содержащие меньшее число электронов) энергетические уровни. Каждая система стремится к повышенной устойчивости и стабильности. Для энергетических уровней это состояние полной завершенности. Поэтому атомы стремятся полностью заполнить внешний энергетический слой. Электронные оболочки гелия и других атомов называют незавершенными.
Каждый уровень вмещает не больше рассчитанного количества электронов. Распределение электронов по энергетическим уровням отражается в схеме строения атома.
Пример:
+14Si ) ) )
2 8 4
Работа в группах.
1 группа.
Задание 3. Запишите схему распределения электронов по энергетическим уровням атомов калия, магния, алюминия, фосфора.
2 группа.
Задание 3. Запишите схему распределения электронов по энергетическим уровням атомов натрия, кальция, серы, хлора.
3 группа.
Задание 3.
Укажите, какие элементы имеют такое распределение электронов в атомах:
а)2е,1е; б)2е,8е,8е,2е; в)2е,4е; г)2е,8е; д)2е,8е,9е,2е.
Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга. Каждый электрон движется вокруг ядра по определенной траектории с огромной скоростью. Область пространства, где движется электрон, называется атомной орбиталью.
Местоположение электронов в пространстве в данный момент времени определить невозможно. Они ведут себя примерно так, как описал Льюис Кэрролл Чеширского Кота в
сказке «Алиса в стране чудес»:
Вроде бы он здесь, но в тоже время его нет, осталась лишь улыбка…
Работа с текстом.
« Электрон может двигаться по сферообразной орбитали, которая называется s-орбиталью. С такой орбитали начинается каждый уровень. Каждая орбиталь вмещает максимум 2 электрона. На каждом уровне располагается одна s-орбиталь, на которой помещается 2 электрона. Значит, на первом уровне может находиться только 2 электрона на s-орбитали. Также электроны могут двигаться по гантелеообразным орбиталям, которые называются р орбиталью. На каждом уровне обязательно располагается три р-орбитали, на которых могут разместиться 6 электронов. Они располагаются со второго уровня после s-орбитали. Второй уровень начинает заполняться с 2-х s-электронов и продолжит 6-тью р-электронами. На третьем уровне после заполнения s, p орбиталей, заполняются 5 d орбитали ( 10 электронов). На четвертом уровне заполняются 7 f орбиталей (14 электронов) ».
-Определите типы электронных облаков на картинках.
— Сколько s, p, d, f электронов может находиться на одном энергетическом уровне?
Электронная формула или электронная конфигурация атома показывает распределение электронов по подуровням.
1 уровень – s- подуровень,
2 уровень – s- и p- подуровни,
3 уровень – s-, p- и d- подуровни,
4 уровень – s-, p-, d- и f- подуровни.
Чему равно число подуровней на уровне?
На одной АО могут находиться только два электрона, которые вращаются вокруг своей оси в противоположных направлениях (условно: по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами.
В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних.
Физкультминутка.
Просмотр видеофрагмента «Электронные формулы» из ЦОР «Кирилл и Мефодий», урок «Строение атома». После просмотра фрагмента, учащиеся выполняют задание 4.
Пример записи электронной формулы :
+16S ) ) )
286
1s22s22p63s2 3p4
Работа в группах.
1 группа.
Задание 4. Запишите электронную формулу атомов лития, бериллия, бора, углерода. Укажите характер элемента и образуемого им оксида.
2 группа.
Задание 4. Запишите электронную формулу атомов азота, кислорода, фтора, неона. Укажите характер элемента и образуемого им оксида.
3 группа.
Задание 4. Запишите электронную формулу атомов натрия, магния, алюминия, кремния. Укажите характер элемента и образуемого им оксида.
Как изменяются свойства простых веществ и их соединений (металличность и неметалличность, основные и кислотные свойства) по периоду? Объясните причины этих изменений (заряд ядра атома является главной характеристикой химического элемента).
Современная формулировка периодического закона Д. И. Менделеева.
V. Этап закрепления.
Я хочу убедиться в том, что ваши знания прочные. Предлагаю тест для самопроверки . Вам дается 3 минуты. Приступаем. (Учащиеся выполняют работу, после этого сверяют свои ответы с правильными ).
Тестовая работа.
- В атоме кремния число электронов на внешнем уровне равно:
- 6 2) 4 3) 2 4) 5
- Заряд ядра атома хлора равен
- +35 2) +18 3) +17 4) +7
- Семь электронов на внешнем уровне в атоме
- Кислорода 2) фосфора 3) хлора 4) калия
- Схема распределения электронов по уровням 2,8,6 соответствует атому
1)серы 2) фосфора 3) кальция 4) кислорода
5. В атоме азота распределение электронов по электронным уровням соответствует ряду чисел
1) 2,8,5 2)2,6 3) 2,5 4) 2,8,7
6. Электронная формула внешнего электронного уровня 2 s2 2p3 соответствует атому
1) углерода 2) лития 3) азота 4) кислорода
7. Электронная формула внешнего энергетического уровня серы
1) 3s2 3p 4 2) 2s2 2p 4 3)2s2 2p6 4)3s2 3p6
8. Химический знак элемента, электронная формула которого 1s2 2s2 2p6 3s2 3p3
1) S 2) P 3) N 4) F
ФИО_________________________________
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
ответ | 2 | 3 | 3 | 1 | 3 | 3 | 1 | 2 |
Самооценка _________
Подсчитайте правильные ответы и выставьте себе отметку. Молодцы, я вижу , что в основном вы хорошо усвоили тему «Строение электронных оболочек атомов», а значит главную задачу, которую я поставила перед вами, вы решили. Что вам помогло справиться с предложенным заданием? (знания, полученные на уроках химии и физики).
Взаимооценка (учащиеся одной группы оценивают работу своих товарищей на уроке).
Мир един, а в нем – одни и те же законы, явления, под каким бы углом мы их не рассматривали на уроках физики и химии.
Домашнее задание.
Прочитать параграф 37, страницы 129-135. Выполнить упражнение 4 на странице 139. Придумать занимательные вопросы по биографии Д.И.Менделеева.
Учебно-методическое обеспечение и электронные ресурсы.
- Ветошкина И.А. Химия. 8 кл.: Поурочные планы. II полугодие (по учебнику Е.Е.Минченкова, М.С.Зазнобиной, Т.В.Смирновой «Химия для 8 класса средней общеобразовательной школы»)/ Авт.-сост. И.А.Ветошкина. –Волгоград: Учитель, 2003.- 86с.
- Гаврусейко Н.П. Проверочные работы по неорганической химии: Дидакт.материал для 8 кл.: пособие для учителя.- М.: Просвещение, 1990.- 64с.
- Халиуллин Р.И. Дидактические материалы по неорганической химии: татарская общеобразовательная школа. Задания для 8-9 классов: Пособие для учителя./ Р.И.Халиуллин. –Казань: Магариф, 2001.- 152 с.
- Радецкий А.М. Химия. Дидактический материал. 8-9 классы: пособие для учителей общеобразоват.учреждений/ А.М.Радецкий. – 2-е издание. – М.: Просвещение, 2010. -127с.
- Электронное образование. Цифровые образовательные ресурсы. Кирилл и Мефодий. Уроки. Химия. 8 класс. Урок «Строение атома».
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
ЭЛЕКТРОННЫЕ КОНСТРУКЦИИ На этой странице рассказывается, как писать электронные структуры атомов, используя обозначения s, p и d. Предполагается, что вы знаете о простых атомных орбиталях — по крайней мере, в том, как они названы, и их относительные энергии. Если вы хотите изучить электронные структуры простых одноатомных ионов (таких как Cl — , Ca 2+ и Cr 3+ ), вы найдете ссылку внизу страницы. | |||||||||||||
Важно! Если вы еще не читали страницу об атомных орбиталях, вам следует перейти по этой ссылке, прежде чем идти дальше. | |||||||||||||
Электронное строение атомов Связь орбитального заполнения с Периодической таблицей | |||||||||||||
Примечание: На некоторых экранах буква V для ванадия (элемент 23) может выглядеть как буква Y.Это не ошибка, а результат преобразования моей исходной диаграммы в изображение в формате gif более низкого качества для эффективного использования в Интернете. | |||||||||||||
Учебные планы Великобритании для 16-18-летних, как правило, останавливаются на криптоне, когда дело доходит до написания электронных структур, но возможно, что вас могут попросить структуры для элементов вплоть до бария. После бария вам нужно беспокоиться о f-орбиталях, а также о s, p и d-орбиталях — и это проблема химии на более высоком уровне.Важно, чтобы вы просматривали прошлые экзаменационные работы, а также свою программу, чтобы вы могли оценить, насколько сложными могут быть вопросы. На этой странице подробно рассматриваются элементы в сокращенной версии Периодической таблицы, приведенной выше, а затем показано, как вы могли бы разработать структуры некоторых более крупных атомов. | |||||||||||||
Важно! У вас должна быть копия программы и копии недавних экзаменационных работ. Если вы изучаете учебную программу в Великобритании и не получили ее, перейдите по этой ссылке, чтобы узнать, как их получить. | |||||||||||||
Первый период Водород имеет свой единственный электрон на орбите 1s — 1s 1 , а у гелия первый уровень полностью заполнен — 1s 2 . Второй период Теперь нам нужно начать заполнение второго уровня, а значит, начать второй период. Электрон лития переходит на 2s-орбиталь, потому что он имеет меньшую энергию, чем 2p-орбитали.Литий имеет электронную структуру 1s 2 2s 1 . Бериллий добавляет к этому же уровню второй электрон — 1s 2 2s 2 . Теперь начинают заполняться 2p уровни. Все эти уровни имеют одинаковую энергию, поэтому электроны сначала входят поодиночке.
| |||||||||||||
Примечание: Орбитали, на которых происходит что-то новое, выделены жирным шрифтом.Обычно вы не записываете их иначе, чем другие орбитали. | |||||||||||||
Следующие электроны, которые войдут, должны будут образовать пары с уже существующими.
Вы можете видеть, что писать полные электронные структуры атомов по мере увеличения числа электронов становится все более утомительно.Есть два способа обойти это, и вы должны знать оба. Shortcut 1: Все различные p-электроны можно объединить в одну группу. Например, фтор можно записать как 1s 2 2s 2 2p 5 , а неон — как 1s 2 2s 2 2p 6 . Это то, что обычно происходит, если электроны находятся во внутреннем слое. Если электроны находятся на уровне связи (те, что снаружи атома), они иногда записываются сокращенно, иногда полностью.Не беспокойся об этом. Будьте готовы встретиться с любой версией, но если вас спросят об электронной структуре чего-либо на экзамене, запишите ее полностью, показывая все орбитали p x , p y и p z на внешнем уровне по отдельности. . Например, хотя мы еще не познакомились с электронной структурой хлора, вы могли бы записать ее как 1s 2 2s 2 2p 6 3s 2 3p x 2 3p y 2 3p z 1 . Обратите внимание, что все 2p-электроны собраны вместе, а 3p-электроны показаны полностью. Логика состоит в том, что 3p-электроны будут участвовать в связывании, потому что они находятся вне атома, тогда как 2p-электроны похоронены глубоко в атоме и на самом деле не представляют интереса. Ярлык 2: Вы можете объединить всех внутренних электронов вместе, используя, например, символ [Ne]. В этом контексте [Ne] означает электронная структура неона — другими словами: 1s 2 2s 2 2p x 2 2p y 2 2p z 2 You не будет делать этого с гелием, потому что для записи [He] требуется больше времени, чем для 1s 2 . На этом основании структура хлора будет записана [Ne] 3s 2 3p x 2 3p y 2 3p z 1 . Третий период У неона все орбитали второго уровня заполнены, поэтому после этого мы должны начать третий период с натрием. Схема заполнения теперь точно такая же, как и в предыдущем периоде, за исключением того, что теперь все происходит на 3-м уровне. Например: | |||||||||||||
Примечание: Убедитесь, что вы можете это сделать. Закройте текст, а затем разработайте эти структуры для себя. Затем проделайте все остальное в этот период. Когда вы закончите, сравните свои ответы с соответствующими элементами предыдущего периода. Ваши ответы должны быть такими же, за исключением следующего уровня. | |||||||||||||
Начало четвертого периода На данный момент не все трехуровневые орбитали заполнены — трехмерные уровни еще не использовались.Но если вы вернетесь к энергиям орбиталей, вы увидите, что следующая самая низкая энергетическая орбиталь — это 4s, так что она заполняется следующей.
Имеются убедительные доказательства этого в сходстве химии таких элементов, как натрий (1s 2 2s 2 2p 6 3s 1 ) и калий (1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ) Внешний электрон управляет их свойствами, и этот электрон находится на одной и той же орбитали в обоих элементах.Это было бы не так, если бы внешний электрон в калии был 3d 1 . s- и p-блочные элементы Все элементы группы 1 Периодической таблицы имеют внешнюю электронную структуру ns 1 (где n — число от 2 до 7). Все элементы группы 2 имеют внешнюю электронную структуру ns 2 . Элементы в группах 1 и 2 описываются как элементы s-блока. Элементы из группы 3 (группа бора) и благородных газов имеют внешние электроны на p-орбиталях.Затем они описываются как p-блочные элементы. | |||||||||||||
Примечание: Если вы используете текущую систему IUPAC (Международный союз теоретической и прикладной химии) для групповой нумерации, вы, вероятно, будете знать, что я называю Группой 3 как Группой 13. Мои причины не использовать систему IUPAC обсуждаются здесь. в разделе «Вопросы и комментарии». | |||||||||||||
d-образные элементы Мы разрабатываем электронные структуры атомов, используя принцип Aufbau («наращивание»).Итак, мы получили кальций со структурой 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Уровень 4s теперь заполнен, и структуры следующих атомов показывают, что электроны постепенно заполняют уровень 3d. Они известны как элементы d-блока. После заполнения трехмерных орбиталей следующие электроны переходят на 4р-орбитали, как и следовало ожидать. элементов d-блока — это элементы, в которых последний электрон, добавляемый к атому с использованием принципа Ауфбау, находится на d-орбитали. Первая серия содержит элементы от скандия до цинка, которые на экзамене GCSE вы, вероятно, назвали переходными элементами или переходными металлами. Термины «элемент перехода» и «элемент d-блока» не имеют одинакового значения, но в данном контексте это не имеет значения. | |||||||||||||
Если вас интересует: Переходный элемент определяется как элемент, который имеет частично заполненных d орбиталей либо в элементе, либо в любых его соединениях.Цинк (в правом конце d-блока) всегда имеет полностью полный 3-й уровень (3d 10 ) и поэтому не считается переходным элементом. Некоторые учебные программы Великобритании используют более ограничительное определение, которое определяет переходный металл как металл, который имеет один или несколько стабильных ионов с частично заполненными d-орбиталями. Вам не нужно беспокоиться об этом, пока вы не изучите химию переходных металлов. | |||||||||||||
d-электронов почти всегда описываются как, например, d 5 или d 8 , а не записываются как отдельные орбитали.Помните, что существует пять d-орбиталей, и что электроны будут населять их поодиночке, насколько это возможно. До 5 электронов самостоятельно займут орбитали. После этого им придется разделиться на пары. d 5 означает d 8 означает Обратите внимание, что все трехуровневые орбитали записываются вместе — 4s-электроны записываются в конце электронной структуры.
Ой! Хром нарушает последовательность.В хроме электроны на 3d- и 4s-орбиталях перестраиваются так, что на каждой орбитали находится по одному электрону. Было бы удобно, если бы последовательность была аккуратной — но это не так! А у цинка процесс заполнения d-орбиталей завершен. Заполнение до конца периода 4 Следующие орбитали, которые будут использоваться, — это 4p, и они заполняются точно так же, как 2p или 3p. Мы вернулись к элементам p-блока от галлия до криптона.Бром, например, равен 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p x 2 4p y 2 4p z 1 . | |||||||||||||
Полезное упражнение: Определите электронные структуры всех элементов, от галлия до криптона. Вы можете проверить свои ответы, сравнив их с элементами, находящимися прямо над ними в Периодической таблице.Например, галлий будет иметь такое же расположение электронов внешнего уровня, что и бор или алюминий, за исключением того, что внешние электроны галлия будут на 4-уровне. | |||||||||||||
Сводка Запись электронной структуры элемента от водорода до криптона
Запись электронной структуры больших s- или p-блочных элементов | |||||||||||||
Примечание: Мы намеренно исключаем элементы d-блока, кроме первой строки, которую мы уже подробно рассмотрели.Картина неудобных структур отличается в других рядах. Это проблема для степени. | |||||||||||||
Сначала определите количество внешних электронов. Вполне вероятно, что это все, что вас попросят сделать. Число внешних электронов такое же, как и номер группы. (Благородные газы здесь представляют собой небольшую проблему, потому что их обычно называют группой 0, а не группой 8. Гелий имеет 2 внешних электрона, а остальные — 8.) Все элементы в группе 3, например, имеют 3 электрона на внешнем уровне. При необходимости поместите эти электроны на s- и p-орбитали. Орбитали какого уровня? Подсчитайте периоды в Периодической таблице (не забывая тот, в котором есть H и He). Йод находится в группе 7 и, следовательно, имеет 7 внешних электронов. Он находится в пятом периоде, поэтому его электроны будут на 5s и 5p орбиталях. Йод имеет внешнюю структуру 5s 2 5p x 2 5p y 2 5p z 1 . А как насчет внутренних электронов, если их тоже нужно вычислить? Уровни 1, 2 и 3 будут заполнены, как и уровни 4, 4 и 4. Уровни 4f не заполняются до тех пор, пока вас не спросят на A’level. Просто забудьте о них! Это дает полную структуру: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p x 2 5p y 2 5p z 1 . Когда вы закончите, посчитайте все электроны, чтобы убедиться, что они совпадают с атомным номером. Не забудьте сделать эту проверку — легко пропустить выход на орбиту, когда все усложняется. Барий находится в группе 2 и, следовательно, имеет 2 внешних электрона. Это в шестом периоде. Барий имеет внешнюю структуру 6s 2 . Включая все внутренние уровни: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6с 2 . Было бы легко включить 5d 10 по ошибке, но уровень d всегда заполняет после следующего уровня s, поэтому 5d заполняется через 6 секунд, как 3d заполняется через 4 секунды. Если вы посчитаете количество электронов, вы легко заметите эту ошибку, потому что у вас будет на 10 больше. | |||||||||||||
Примечание: Не беспокойтесь об этих сложных конструкциях. Вам нужно знать, как их решать в принципе, но ваши экзаменаторы с гораздо большей вероятностью попросят у вас что-нибудь простое, например серу или железо. | |||||||||||||
© Джим Кларк 2000 (последнее изменение в октябре 2012 г.) | |||||||||||||
Электронные конфигурации | Химия для неосновных
Цели обучения
- Используйте обозначение электронной конфигурации, чтобы указать электронную конфигурацию атома.
Если вы храните свои бумаги в папках из манильской бумаги, вы можете взять папку и посмотреть, сколько она весит. Если вы хотите узнать, сколько разных бумаг (статей, банковских счетов или чего-то еще, что вы храните в папке), вы должны вынуть все и сосчитать. С другой стороны, компьютерный каталог сообщает вам, сколько именно у вас есть в каждом файле. Мы можем получить ту же информацию об атомах. Если мы используем диаграмму заполнения орбиты, нам нужно считать стрелки.Когда мы смотрим на данные электронной конфигурации, мы просто складываем числа.
Обозначение электронной конфигурации исключает прямоугольники и стрелки на диаграммах орбитального заполнения. Обозначение каждого занятого подуровня записывается с последующим надстрочным индексом, который представляет собой количество электронов на этом подуровне. Например, конфигурация водорода — 1 с 1 , а конфигурация гелия — 1 с 2 . Несколько занятых подуровней записываются один за другим.Электронная конфигурация лития: 1 с 2 2 с 1 . Сумма верхних индексов в электронной конфигурации равна количеству электронов в этом атоме, которое, в свою очередь, равно его атомному номеру.
Пример задачи: схемы орбитального заполнения и электронные конфигурации
Нарисуйте диаграмму орбитального заполнения углерода и напишите его электронную конфигурацию.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- атомный номер углерода, Z = 6
Используйте диаграмму порядка заполнения, чтобы нарисовать диаграмму заполнения орбиты с шестью электронами. Следуйте правилу Хунда. Напишите электронную конфигурацию.
Шаг 2: Построение диаграммы
Схема орбитального заполнения углем.
Электронная конфигурация 1 с 2 2 с 2 2 p 2
Шаг 3. Подумайте о своем результате.
После 2 подуровней s идут 2 подуровня p , а подуровни p всегда состоят из трех орбиталей. Необходимо нарисовать все три орбитали, даже если одна или несколько незанятых. Согласно правилу Хунда, шестой электрон входит во вторую из этих p орбиталей и имеет тот же спин, что и пятый электрон.
Элементы второго периода
Периоды относятся к горизонтальным рядам периодической таблицы. Взглянув на таблицу Менделеева, вы увидите, что первый период содержит только элементы водород и гелий.Это связано с тем, что первый основной энергетический уровень состоит только из подуровня s , и поэтому для заполнения всего основного энергетического уровня требуются только два электрона. Каждый раз, когда начинается новый основной энергетический уровень, как в случае третьего элемента лития, в периодической таблице начинается новый период. По мере прохождения второго периода последовательно добавляются электроны. С бериллием (Z = 4) подуровень 2 s завершен, а подуровень 2 p начинается с бора (Z = 5).Поскольку имеется три орбитали 2 p и каждая орбиталь содержит два электрона, подуровень 2 p заполняется после шести элементов. В приведенной ниже таблице показаны электронные конфигурации элементов во втором периоде.
| Имя элемента | Символ | Атомный номер | Электронная конфигурация |
| Литий | Li | 3 | 1 с 2 2 с 1 |
| Бериллий | Be | 4 | 1 с 2 2 с 2 |
| Бор | B | 5 | 1 с 2 2 с 2 2 с 1 |
| Углерод | С | 6 | 1 с 2 2 с 2 2 с 2 |
| Азот | N | 7 | 1 с 2 2 с 2 2 с 3 |
| Кислород | O | 8 | 1 с 2 2 с 2 2 с 4 |
| фтор | F | 9 | 1 с 2 2 с 2 2 с 5 |
| Неон | Ne | 10 | 1 с 2 2 с 2 2 с 6 |
Сводка
- Обозначение конфигурации электронов упрощает указание того, где находятся электроны в конкретном атоме.
- Верхние индексы используются для обозначения количества электронов на данном подуровне.
Практика
Воспользуйтесь ссылкой ниже, чтобы попрактиковаться в решении проблем электронной конфигурации.
http://www.sciencegeek.net/Chemistry/taters/Unit2ElectronNotations.htm
Обзор
- Что устраняет обозначение электронной конфигурации?
- Как узнать, сколько электронов находится на каждом подуровне?
- Атом имеет электронную конфигурацию 1 s 2 2 s 2 2 p 5 .Сколько электронов в этом атоме?
- Какой элемент имеет электронную конфигурацию 1 s 2 2 s 2 2 p 6 3 s 2 ?
Глоссарий
- Обозначение электронной конфигурации: Обозначение каждого занятого подуровня записывается с последующим надстрочным индексом, который представляет собой количество электронов на этом подуровне.
WebElements Periodic Table »Литий» Свойства свободных атомов
Атомы лития имеют 3 электрона, а структура оболочки — 2.1.
Электронная конфигурация основного состояния газообразного нейтрального лития в основном состоянии — это [ He ]. 2s 1 , а символ термина — 2 S 1/2 .
Схематическая электронная конфигурация лития. Оболочечная структура Косселя лития.Атомный спектр
Представление атомного спектра лития.
Энергии ионизации и сродство к электрону
Электронное сродство лития 59.6 кДж моль ‑1 . Энергии ионизации лития приведены ниже.
| Число энергии ионизации | Энтальпия / кДж моль ‑1 |
|---|---|
| 1-й | 520,22 |
| 2-й | 7298,16 |
| 3-й | 11815,05 |
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 2,6906 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 1,28 | 2п | (нет данных) | ||||
| 3s | (нет данных) | 3п | (нет данных) | 3д | (нет данных) | ||
| 4s | (нет данных) | 4п | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5п | (нет данных) | 5д | (нет данных) | ||
| 6s | (нет данных) | 6п | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38, , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1 с | 54,7 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж.А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21, , 275.
Расчеты электронной структуры на солях электролита литиевых батарей
Новые соли лития для неводных жидких, гелевых и полимерных электролитов имеют решающее значение из-за ограничивающей роли электролита в современных литиевых батареях. Сольватация любой соли лития с образованием раствора электролита в конечном итоге зависит от силы катион-растворителя против .катион-анионное взаимодействие. Здесь последний исследуется с помощью газофазных расчетов HF, B3LYP и G3 для реакции диссоциации: LiX ⇔ Li + + X — . Кроме того, для имитации эффектов растворителя был применен метод непрерывной сольватации (C-PCM). Также были рассчитаны объемы анионов, чтобы облегчить обсуждение ионной проводимости и числа переноса катионов. Судя по полученным результатам, усилия по синтезу должны быть нацелены на гетероциклические анионы размером ~ .150 Å 3 молекула -1 для получения новых высокодиссоциативных солей лития, которые приводят к электролитам с высокими числами переноса катионов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Электронная структура материалов литиевых батарей
Версия PDF также доступна для скачивания.
Кто
Люди и организации, связанные либо с созданием этого отчета, либо с его содержанием.
Какие
Описательная информация, помогающая идентифицировать этот отчет.Перейдите по ссылкам ниже, чтобы найти похожие предметы в Электронной библиотеке.
Когда
Даты и периоды времени, связанные с этим отчетом.
Статистика использования
Когда последний раз использовался этот отчет?
Взаимодействовать с этим отчетом
Вот несколько советов, что делать дальше.
Версия PDF также доступна для скачивания.
Ссылки, права, повторное использование
Международная структура взаимодействия изображений
Распечатать / Поделиться
Печать
Электронная почта
Твиттер
Facebook
Tumblr
Reddit
Ссылки для роботов
Полезные ссылки в машиночитаемых форматах.
Ключ архивных ресурсов (ARK)
Международная структура взаимодействия изображений (IIIF)
Форматы метаданных
Изображений
URL
Статистика
Рез, Питер.Электронная структура материалов литиевых батарей, отчет, 2 декабря 2007 г .; Аризона. (https://digital.library.unt.edu/ark:/67531/metadc5/: по состоянию на 31 мая 2021 г.), Библиотеки Университета Северного Техаса, Цифровая библиотека UNT, https://digital.library.unt.edu; кредитование Департамента государственных документов библиотек ЕНТ.
Электронная структура дефектных кобальтитов лития Li x CoO 2
К. Мидзусима, П.С. Джонс, П. Дж. Уайзман, Дж. Б. Гуденаф, Mater. Res. Бык. 15 , 783 (1980)
Артикул Google Scholar
Дж. Ван Элп, Дж. Л. Виланд, Х. Эскес, П. Койпер, Г.А. Савацкий, Ф.М.Ф. де Гроот, Т. Тернер, Phys. Ред. B 44 , 6090 (1991)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Дж. Моленда, А. Стоклоса, Т.Бак, твердотельный ион. 36 , 53 (1989)
Артикул Google Scholar
К. Кушида, К. Курияма, Solid State Commun. 129 , 525 (2004)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
J.N. Reimers, J.R. Dahn, J. Electrochem. Soc. 147 , 3190 (1992)
Google Scholar
L.A. Montoro, M. Abbate, J.M. Rosolen, Electrochem. Solid-State Lett. 3 , 410 (2000)
Артикул Google Scholar
Т. Мацусита, М. Мизумаки, Н. Икеда, М. Накадзава, А. Агуи, Ю. Сайто, Т. Накатани, А. Ёсигоэ, С. Накамура, Surf. Rev. Lett. 9 , 1327 (2002)
Артикул Google Scholar
W.-S. Юн, К.-Б.Ким, М.-Г. Ким, М.-К. Ли, Х.-Дж. Шин, Ж.-М. Ли, С.-Х. Йо, J. Phys. Chem. В 106 , 2526 (2002)
Артикул Google Scholar
Д.Г. Келлерман, В. Галахов, А. Семенова, Я.Н. Блиновсков, О. Леонидова. Твердотельный 48 , 548 (2006)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Н. Нюкер, Дж. Финк, Дж. К. Фуггл, П.Дж. Дарем, W.M. Теммерман, Phys. Ред. B 37 , 5158 (1988)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Г. Каиндл, Д.Д. Сарма, О. Штребель, К. Симмонс, У. Нойкирх, Р. Хоппе, Х. Мюллер, Physica C 153–155 , 139 (1988)
Артикул Google Scholar
В. Галахов, Н.А.Овечкина, А.С. Шкварин, С. Шамин, Э. Курмаев, К.Кюппер, А.Ф. Такач, М. Раекерс, С. Робин, М. Нойман, Г.-Н. Гаврил А.С. Семенова, Д. Kellerman, T. Käämbre, J. Nordgren, Phys. Ред. B 74 , 045120 (6) (2006)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
A. Kotani, J. Electron. Spectrosc. Relat. Феном. 110–111 , 197 (2000)
Артикул Google Scholar
К. Кушида, К.Куруяма, Solid State Commun. 123 , 349 (2002)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
M.T. Чижик, Р. Поце, Г.А. Савацкий, Phys. Ред. B 46 , 3729 (1992)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
J.M. Де Тереза, М.Р. Ибарра, П.А. Альгарабель, К. Риттер, К. Маркина, Дж. Бласко, Дж. Гарсия, А. Дель Мораль, З. Арнольд, Nature (Лондон) 386 , 256 (1997)
Артикул ОБЪЯВЛЕНИЯ Google Scholar
С. Левассер, М. Менетрие, Э.


