Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
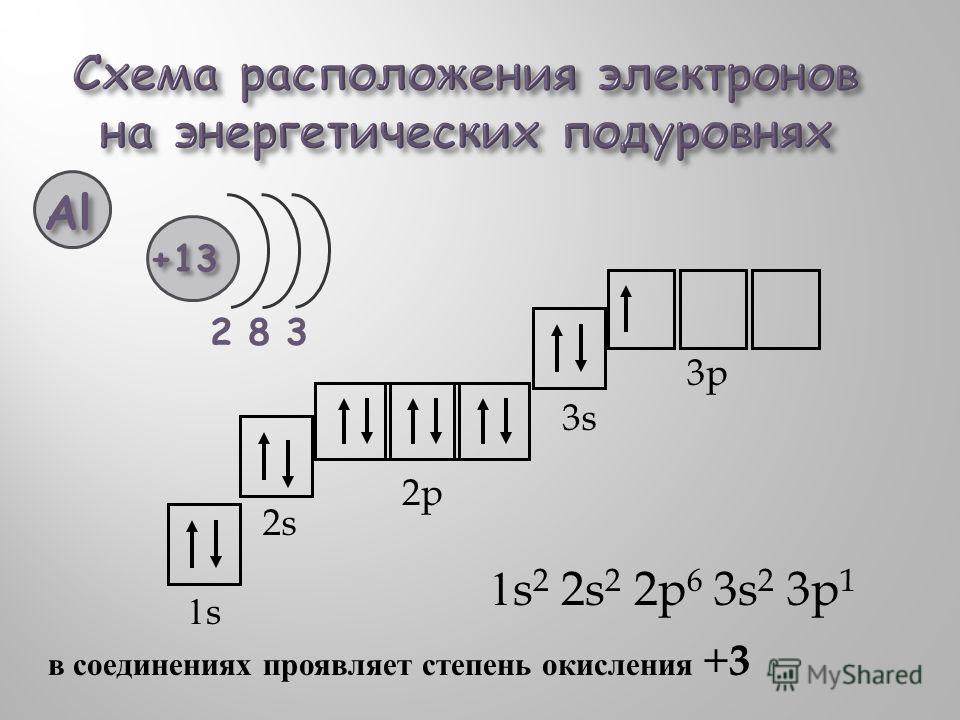
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
| Чем общежития электронов отличаются от студенческих? 1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4. 2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей). 3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента). |
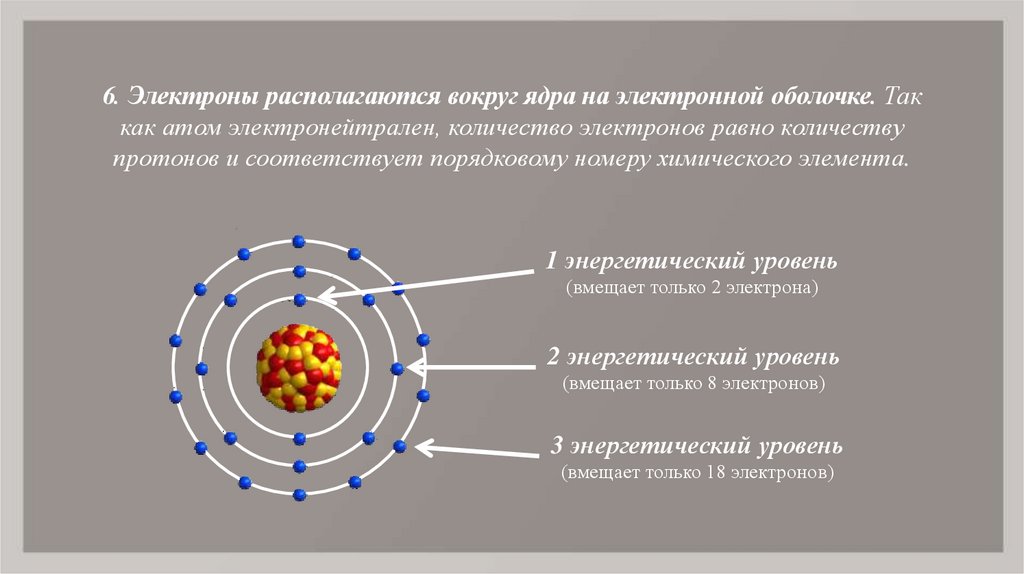
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д.
 И. Менделеева.
И. Менделеева. - Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.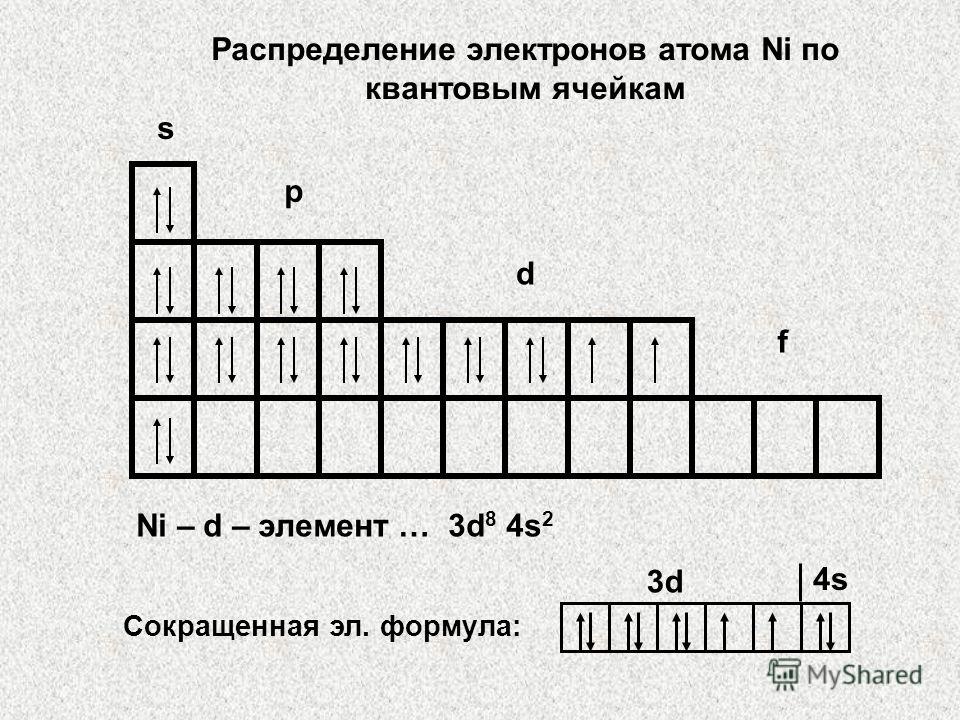
На приведенном рисунке изображена модель атома химического элемента.
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атомаДля изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.
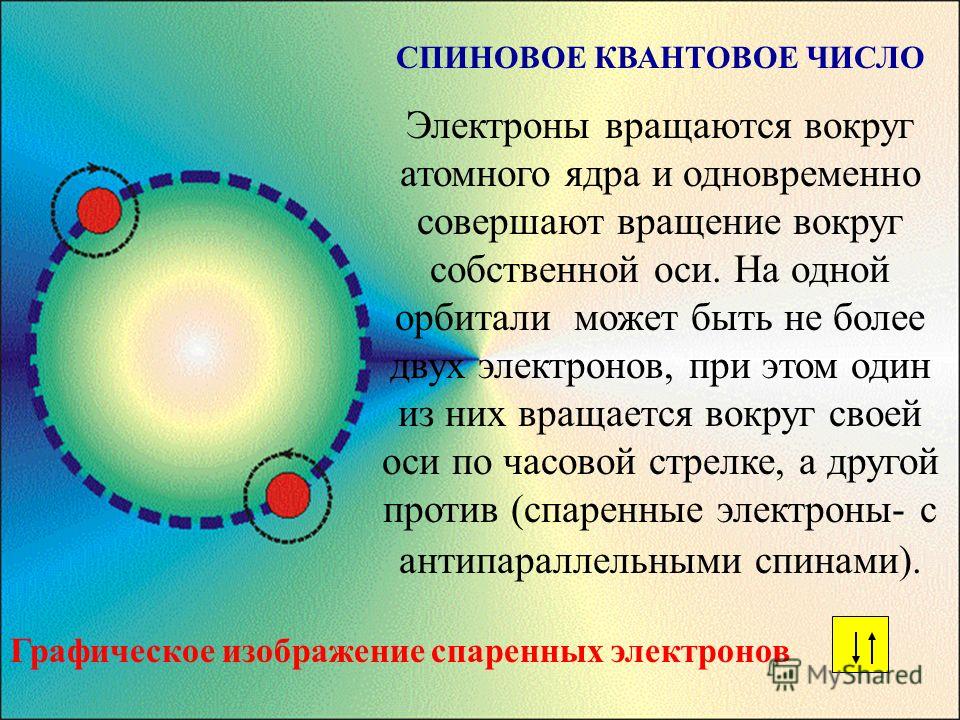
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
| При наличии свободных орбиталей на подуровне электроны занимают именно их, а не «подсаживаются» к другим электронам: Ты приглядись, решив присесть, |
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
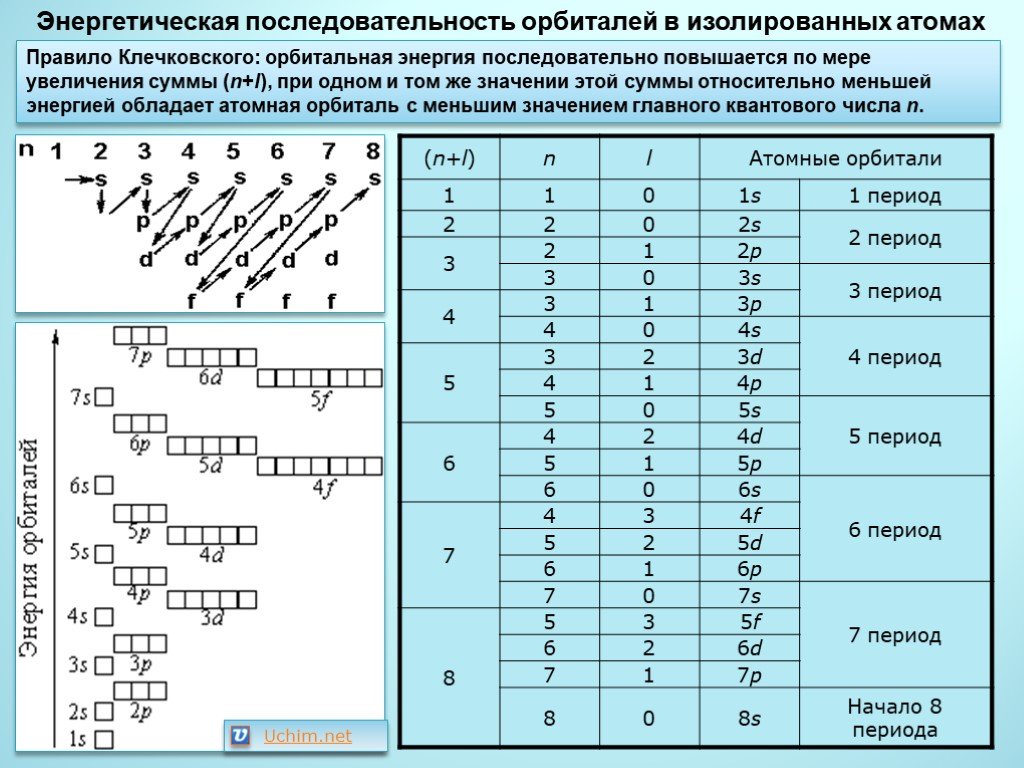
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать. |
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.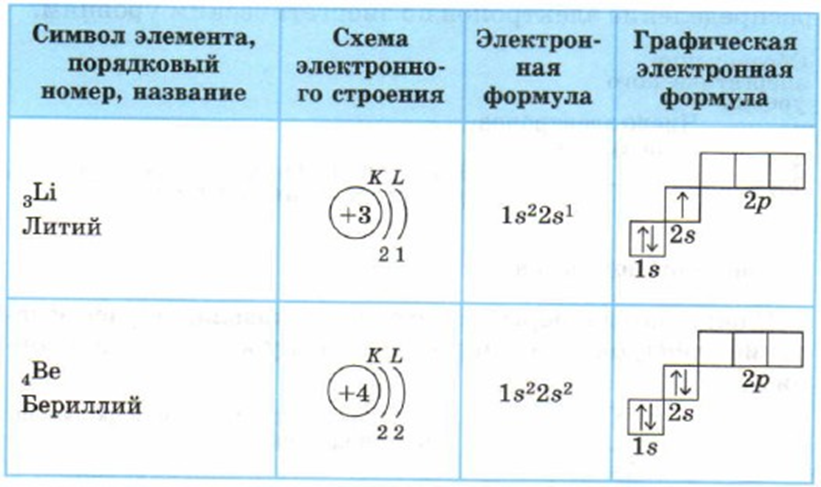
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? — s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; |
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.

- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
— 1.
Как определить число нейтронов, протонов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Содержание
Как определить количество протонов, нейтронов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Количество нейтронов рассчитывается по формуле:
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд атомного ядра (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы – это разновидности атомов данного химического элемента, которые имеют одинаковый ядерный заряд (порядковый номер в таблице), но разные массовые числа.
Проще говоря, изотопы имеют одинаковое количество протонов в ядре атома, но разное количество нейтронов.
Таким образом, изотопы имеют такое же количество протонов и электронов, как и обычные атомы, единственное отличие – количество нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит изотоп титана 50 Ti?
Титан имеет порядковый номер 22. Это означает, что в ядре 22 протона, а в атоме 22 электрона.
Количество нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержится в нейтральном атоме изотопа полония?
В этом случае нам даже не нужно знать массовое число изотопа, потому что мы говорим только об электронах. Порядковый номер полония – 84, поэтому в ядре атома 84 протона и 84 электрона.
Определите число протонов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца – 25. Значит, в ядре атома 25 протонов и 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Найдите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, потому что все дело в протонах – количестве изотопов, имеющих одинаковое число протонов. Калий имеет порядковый номер 19 в таблице, что означает, что каждый изотоп калия будет иметь 19 протонов.
Калий имеет порядковый номер 19 в таблице, что означает, что каждый изотоп калия будет иметь 19 протонов.
Предположим, что на каждую тысячу нормальных атомов приходится один дефектный. И хотя обычный атом золота имеет 117 нейтронов, иногда встречаются “раздутые” уродливые атомы, которые имеют 118 нейтронов. Все помидоры похожи на помидоры, но у одного помидора есть уродливый нарост на боку. Хорошо, мы можем это съесть.
Протон, нейтрон, электрон. Святая троица.
Но прежде чем рассказать о них подробнее, я отвечу на закономерный вопрос, который вы должны задать себе снова: из чего состоят элементарные частицы? Может быть, они также состоят из еще более мелких частей?
Не вдаваясь в ненужные подробности, отвечу: нет! Это не так!
– Позвольте мне! – Какой-нибудь умный ребенок скажет мне, поправляя мизинцем свои круглые очки. – Позвольте мне! Весь мой опыт говорит мне, что если сильно ударить по чему-то, то оно развалится. Чашку – в осколки, частицу – в атомы, атомы – в эти ваши элементарные частицы. А если вы ударите по частицам, во что они распадутся, добрый гражданин?
А если вы ударите по частицам, во что они распадутся, добрый гражданин?
– Какой умный мальчик! – Я отвечаю с некоторой робостью. – Он проник в самую суть вещей! Стук, говорит он, должен быть стуком. Вот чем занимаются физики, изучая частицы! Они разгоняют их в специальных ускорителях и бьют друг о друга. А чем еще их можно ударить, чтобы сломать, если они самые маленькие в мире? Поэтому они соединяют их вместе.
И что, по-вашему, происходит?
Элементарные частицы не распадаются, они превращаются в другие элементарные частицы. Эти превращения, называемые ядерными реакциями, зависят от скорости, с которой ускоряются частицы. То есть, она зависит от энергии, которую получили частицы. Дело в том, что энергия (скорость) может превращаться в материю, в массу. И более того – если посмотреть глубже, оказывается, что это одно и то же – энергия и масса, представьте себе! Мир един. Но об этом мы поговорим позже.
А пока давайте подробнее рассмотрим элементарные частицы. Они ужасно милые! (В целом, существует довольно много элементарных частиц.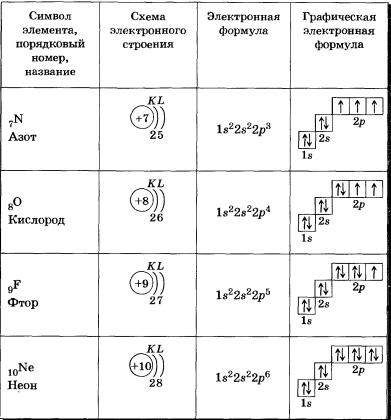 Но основных, из которых состоит вся материя в мире, всего три, как уже говорилось. Мы разберемся с ними, а остальной вселенский хлам оставим взрослым физикам”).
Но основных, из которых состоит вся материя в мире, всего три, как уже говорилось. Мы разберемся с ними, а остальной вселенский хлам оставим взрослым физикам”).
Давайте начнем с электрона. Он самый маленький, и малышам не может причинить вреда.
Так, в свете прожекторов электрон выходит на сцену, чтобы привлечь наше внимание поклоном. Что мы можем сказать о нем? Какого он цвета? Он грубый? Он влажный, твердый, газообразный? Тепло ли это?
Нет! Все эти свойства, к которым мы привыкли в нашем большом мире (называемом макрокосмосом), не имеют ничего общего с миром элементарных частиц (микрокосмосом). В микрокосмосе нет ни цвета, ни запаха, ни шероховатости, ни твердости. Все это свойства макрокосмоса. Все эти свойства состоят из множества частиц, они являются макросвойствами. А по отдельности частицы не обладают этими свойствами.
Так что же у них есть?
А что есть у электрона? В конце концов, он должен обладать какими-то свойствами! Иначе его бы не существовало! Потому что существовать – значит как-то проявляться, то есть иметь свойства!
Да, электрон обладает определенными свойствами.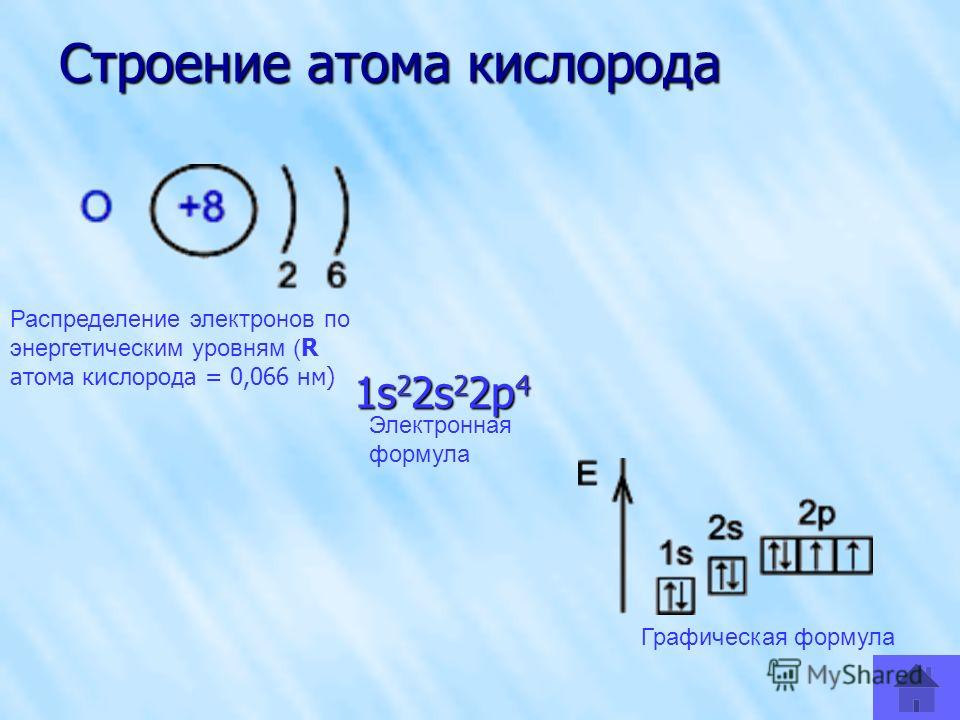 У него есть масса. Мы уже говорили об этом – электрон очень легкий, самый легкий из трех.
У него есть масса. Мы уже говорили об этом – электрон очень легкий, самый легкий из трех.
Электрон в 1820 раз легче протона. Для сравнения, если протон – это танк, то электрон – это канистра с топливом. Если протон – это человек, то электрон – это авторучка в его кармане. Это и есть разница в массе.
Вы, кстати, заметили новый физический термин необычайной сложности – “масса”? Я как бы представил это уже после того, как это произошло. Надеюсь, я вас не расстроил.
Что это такое? Масса – это просто количество материи. Чем тяжелее тело, тем оно массивнее. Отец более значителен, чем ребенок. Танк более массивный, чем автомобиль. Солнце массивнее Земли.
Массу не следует путать с весом. Хотя многие взрослые это делают. Даже генералы и начальники. И, возможно, даже сам президент. Но это совершенно разные вещи! Вес – это сила, с которой Земля притягивает массу. Это сила, с которой массивное тело оказывает давление на опору, на которой оно лежит, или растягивает подвес, на котором оно висит. В космосе, в невесомости, нет веса, поэтому она и называется невесомостью. Но даже в условиях невесомости толстый астронавт гораздо массивнее худого. Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
В космосе, в невесомости, нет веса, поэтому она и называется невесомостью. Но даже в условиях невесомости толстый астронавт гораздо массивнее худого. Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
Физики даже измеряют вес и массу в разных единицах – массу в килограммах, а силу в специальных единицах – ньютонах. Масса определяется с помощью весов, а сила – с помощью специальных приборов – ньютон-метров. Вы понимаете?
Люди науки также называют массу мерой инерции тела. Действительно, массивное тело очень инертно, и для его ускорения требуется много усилий. Но легкое тело также легче разогнать, его инерция мала.
Электрон очень легкий. Его масса настолько мала, что мне приходится быть очень осторожным, чтобы не перепутать нули:
0,0000000000000000000000000000000000000009 грамм – столько весит электрон.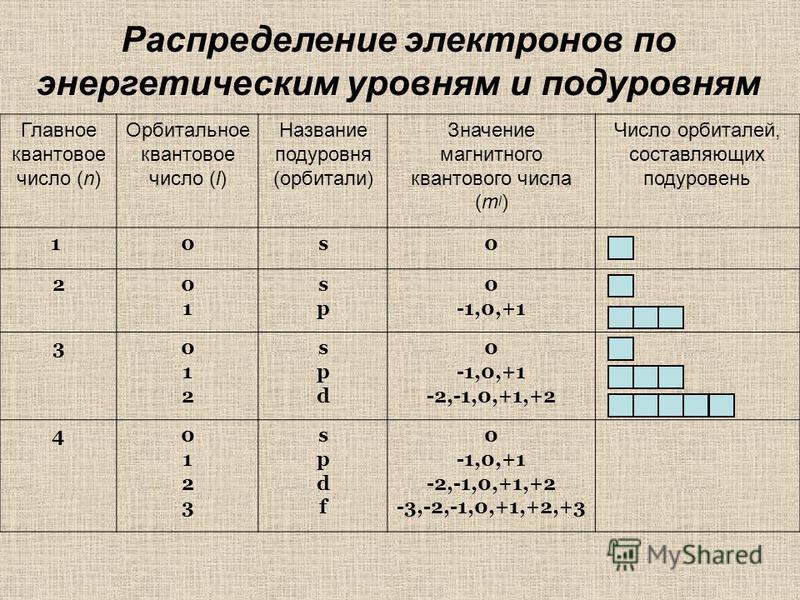
А еще есть размер электрона. Он также является крошечным:
0,000000000000000000000000001 миллиметр – таков размер электрона.
Электрон можно представить как маленький шарик, вращающийся вокруг собственной оси. Своего рода крошечная планета.
И, как вы понимаете, электрон может вращаться в одну или другую сторону, как показано на рисунке ниже. Это также одно из свойств электрона – вращение влево или вправо. С научной точки зрения, вращение электрона называется спином. Это не вращение, потому что шар не крутится, а вращается. Спин – это собственное вращение электрона, от английского слова “spin”.
Если ствол винтовки правша, то пуля, вылетающая из ствола, будет вращаться по часовой стрелке. Если он левосторонний, у него будет левостороннее вращение. Теперь представьте, что мы стреляем по мишени, которая слабо закреплена в центре и может вращаться. В этом случае снаряды с вращением по часовой стрелке, попадая в цель, будут передавать ей свое вращение, постепенно вращаясь в том же направлении – более или менее подобно тому, как отвертка вращает винт.
Если вы не знаете, в какую сторону вращаются пули, вылетающие из ствола, вы можете провести эксперимент, стреляя по вращающейся мишени. В какую сторону она вращается, в ту же сторону вращается и пуля.
Но спин – ничто по сравнению с последним и самым загадочным свойством электрона. Это свойство называется зарядом. Но заряд не в том смысле, что электрон заряжен чем-то, как винтовка патроном, потому что патрон можно извлечь из винтовки. Но этот таинственный заряд не может быть удален с электрона. Это записано в нем, это его часть. Это его основное свойство. Электрон, по сути, является зарядом!
Какова плата?
Никто этого не знает. Но мы знаем, как проявляется этот таинственный заряд. И сейчас вы это узнаете.
Давным-давно люди заметили, что если потереть кусочек янтаря шерстяной тканью, то он притягивает к себе маленькие кусочки бумаги. Янтарь – это окаменевшая сосновая смола. У вашей мамы наверняка есть янтарные безделушки – кулон или серьги. Эти безделушки должны быть использованы с пользой! Возьмите кулон, аккуратно выковыряйте желтоватый янтарь из держателя (маме он больше не понадобится), возьмите шерстяной носок, порвите бумагу на мелкие кусочки. Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Надеюсь, вы не будете получать удовольствие от своих смелых исследований.
Это явление впервые заметили те же древние греки, очень вдумчивые люди. Греческое слово, обозначающее янтарь, – “электрон”. И вы, наверное, уже догадались, что за притягивание бумаг отвечают электроны, поскольку эти частицы были названы физиками в честь янтаря.
Действительно, в этом простом эксперименте человечество впервые столкнулось с действием электрических сил, возникающих из электрического заряда.
Теперь мы привыкли к электричеству. Теперь мы не можем жить без него. Теперь у нас повсюду вилки, которые бьют током умных детей, вставляющих в них свои тонкие пальчики. Сейчас мы просто окружены электричеством, без которого никуда. Стиральные машины, лифты, лампы, холодильники, троллейбусы и электропоезда, радиоприемники и телевизоры, фабрики и заводы – все работает на электричестве. Линии электропередач доставляют потребителям электроэнергию, которая вырабатывается на электростанциях.
Если бы атомы были непроницаемы, ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Все, что вы направите на фольгу, либо застрянет в ней, либо отскочит – точно так же, как любой брошенный предмет отскочит или застрянет в гипсокартоне (рис. 3). Но на самом деле высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – почти все, если быть точным, – могут проходить через материал, не теряя ни энергии, ни импульса при столкновениях с чем-либо внутри атомов. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и т.д. просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Откуда мы знаем, что ядро атома маленькое?
Одно дело убедить себя, что определенное ядро определенного изотопа содержит Z протонов и N нейтронов; другое дело убедить себя, что атомные ядра крошечные, и что протоны и нейтроны, когда они сжимаются вместе, не размазываются в кашу и не рассеиваются в беспорядке, а сохраняют свою структуру, о чем нам говорит картинка из мультфильма. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу, сквозь которую ничего не видно. Поскольку она непрозрачна, можно сделать вывод, что это атомы алюминия:
1. настолько большой, что между ними нет промежутков,
2. настолько плотный и твердый, что свет не может пройти сквозь него.
В первом случае вы будете правы: в твердых телах между двумя атомами почти нет пространства. Вы можете увидеть это на фотографиях атомов, полученных с помощью специальных микроскопов; атомы выглядят как маленькие шарики (края которых являются краями электронных облаков) и довольно плотно упакованы. Но что касается второго пункта, то вы ошибаетесь.
Но что касается второго пункта, то вы ошибаетесь.
Рисунок 4.
Если бы атомы были непроницаемы, то ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские лучи, ни электроны, ни протоны, ни атомные ядра. Любой предмет, направленный на фольгу, либо застрянет в ней, либо отскочит от нее – точно так же, как любой предмет, брошенный в нее, должен отскочить от нее или застрять в гипсокартоне (рис. 3). Но в действительности высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – точнее, почти все из них – могут проходить через материал, не теряя энергии и импульса при столкновениях с чем-либо в атомах. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и других лучей просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Рис. 5
Чем толще фольга – например, при укладке все большего количества листов фольги – тем больше вероятность того, что запущенные в нее частицы столкнутся с чем-то, потеряют энергию, отскочат, изменят направление или даже остановятся. То же самое относится и к укладке одной проволочной сетки за другой (Рисунок 6). И, как вы понимаете, на основании того, насколько далеко средний камешек может проникнуть через слои решетки и насколько велики зазоры в решетке, ученые могут рассчитать, основываясь на расстоянии, пройденном электронами или атомными ядрами, насколько пуст атом.
Рисунок 6.
Благодаря таким экспериментам физики в начале XX века установили, что ничто внутри атома – ни атомное ядро, ни электроны – не может быть больше одной тысячной доли миллионной доли метра, или в 100 000 раз меньше самого атома. То, что ядро достигает таких размеров, в то время как электроны по крайней мере в 1 000 раз меньше, мы установили в других экспериментах – например, при рассеянии высокоэнергетических электронов друг от друга или от позитронов.
Чтобы быть еще более точным, следует упомянуть, что некоторые частицы потеряют часть своей энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это эффект дальнего действия, который на самом деле не является столкновением. В результате потери энергии значительны для летящих электронов, но не для летящего ядра.
Интересно, не похож ли способ прохождения частиц через пленку на способ прохождения пули через бумагу – измельчение кусочков бумаги. Возможно, первые несколько частиц просто раздвигают атомы, оставляя большие отверстия, через которые проходят последующие частицы? Мы знаем, что это не так, потому что можем провести эксперимент, в котором частицы входят и выходят из контейнера из металла или стекла, в котором существует вакуум. Если бы частица, проходящая через стенки контейнера, создавала отверстия размером больше, чем атомы, то молекулы воздуха устремились бы внутрь, и вакуум исчез бы.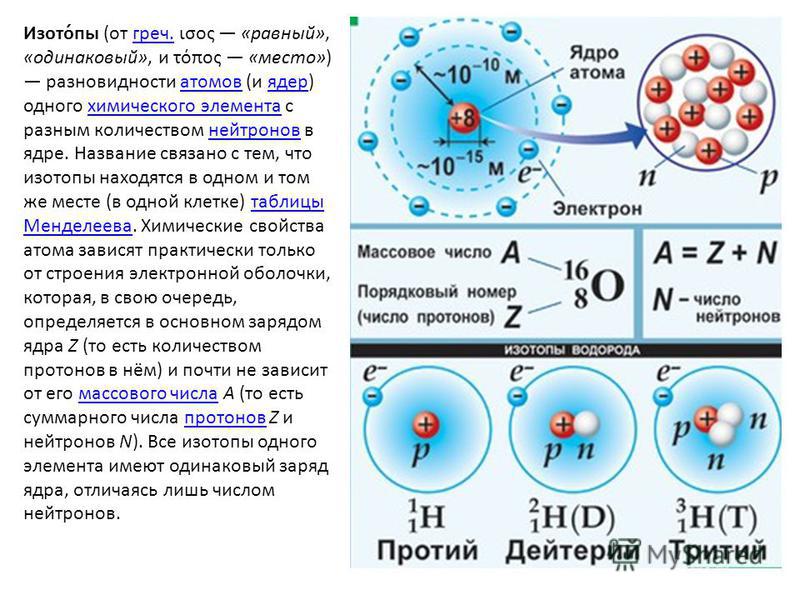 Но в таких экспериментах вакуум остается!
Но в таких экспериментах вакуум остается!
Также довольно легко сделать вывод, что ядро не является особо упорядоченной кучей, внутри которой нуклоны сохраняют свою структуру. Об этом можно догадаться уже из того, что масса ядра очень близка к сумме масс содержащихся в нем протонов и нейтронов. Это верно как для атомов, так и для молекул – их массы почти равны сумме масс их содержимого, за исключением небольшой поправки на энергию связи – и это отражается в том, что молекулы довольно легко разбить на атомы (например, нагревая их, чтобы они больше сталкивались друг с другом) и выбить электроны из атомов (опять же, нагревая их). Аналогичным образом, относительно легко разбить ядра на части, этот процесс мы называем делением, или собрать ядро из меньших ядер и нуклонов, этот процесс мы называем ядерным синтезом. Например, относительно медленно движущиеся протоны или маленькие ядра, сталкиваясь с большим ядром, могут разделить его на части; при этом нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.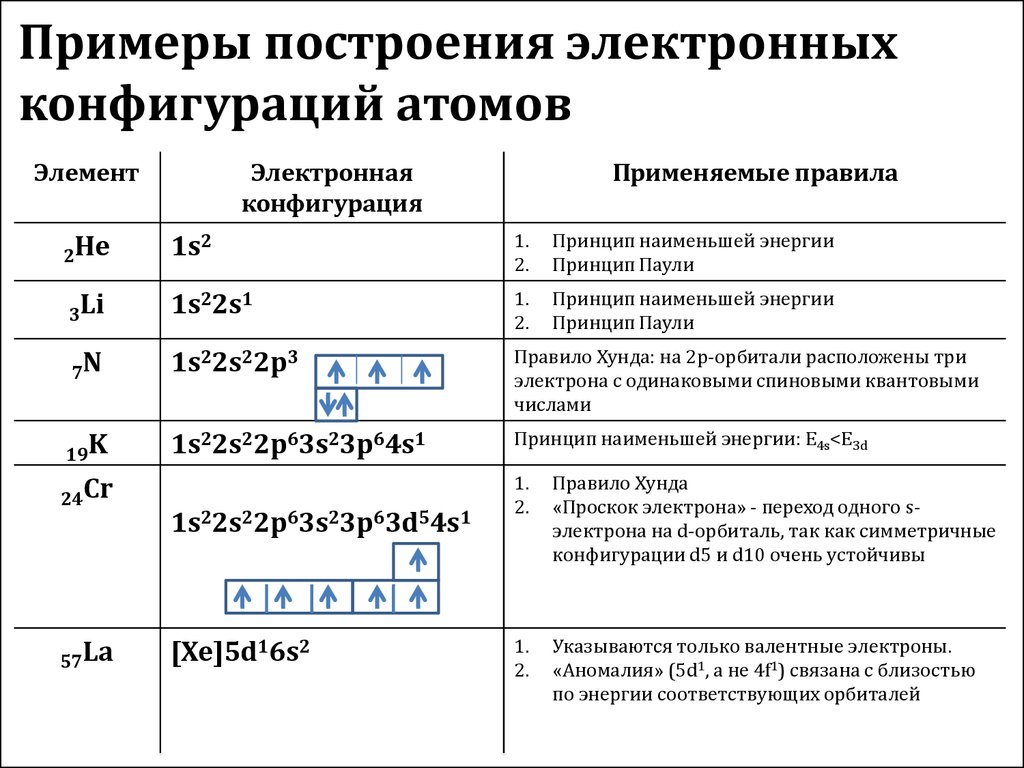
Рис. 7
Однако, чтобы понять, что это не является неизбежным, отметим, что сами протоны и нейтроны не обладают этими свойствами. Масса протона не равна приблизительной сумме масс объектов в нем; протон не может распадаться; и для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (т.е. порядковый номер элемента) [Пример: если мы найдем число протонов в Mg (магнии), то атомная масса магния равна 24, а его порядковый номер – 12, поэтому число нейтронов равно 12].
Объясните мне пожалуйста как найти протоны, нейтроны и электроны в атомах)) Пожалуйста, домашнее задание по химии на завтра) Начало 8 класса)
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (которое является порядковым номером элемента) [Пример: предположим, мы находим число протонов в Mg (магний), атомная масса магния равна 24, а его порядковый номер – 12; следовательно, число нейтронов равно 12].
Атом переводится как неделимый.
Атом электрически инертен, состоит из ядра и вращающихся вокруг него электронов.
Электрон – это частица с отрицательным зарядом, не имеющая массы.
Ядро положительно заряжено и состоит из нейтронов и протонов.
Протон – частица с зарядом +1 и массой 1
Нейтрон-n-частица без заряда и массой 1
Заряд ядра=p=количество электронов
n=Ar-p
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки. Существует только два возможных значения: +1/2 i -1/2.
Структура атома
Атом – в переводе с древнегреческого – неделимый – это мельчайшая частица химического элемента, которая является носителем его свойств. Современные представления о строении атома требуют знания основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (состоящего из протонов и нейтронов) и электронов. Хотя на ядро приходится большая часть массы атома, оно очень маленькое.
| Зарядка с | масса m | |
| Протон p + | +1 | 1 |
| Нейтрон n 0 | 0 | 1 |
| Электрон e – – – | -1 | 0 |
Число протонов равно числу электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности между атомной массой и атомным номером элемента.
Бор – пятый элемент в периодической таблице, его атом имеет 5 протонов и 5 электронов. Атомная масса ≈ 11, число нейтронов 11 – 5 = 6.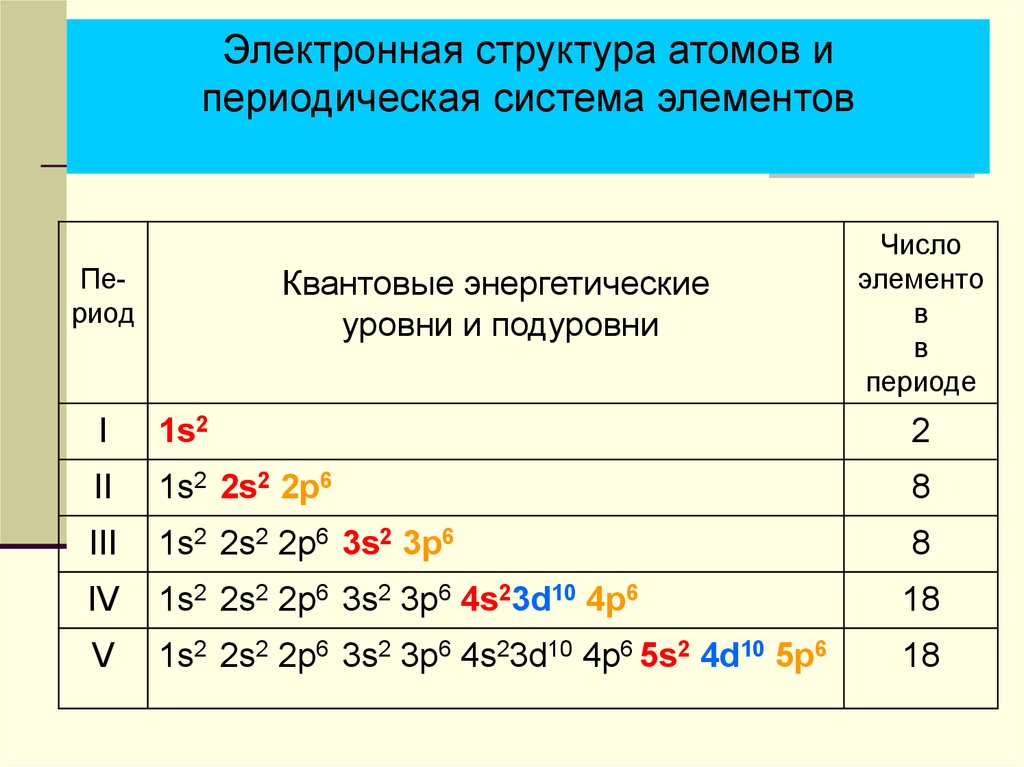
Элементы, которые имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов, называются изотопами.
Например, 35 Cl и 37 Cl – это изотопы, которые отличаются атомной массой и числом нейтронов.
| Количество протонов | Количество нейтронов | Количество электронов | |
| 35 Кл | 17 | 18 | 17 |
| 37 Кл | 17 | 17 |
Электроны движутся вокруг ядра по различным путям – орбиталям. Каждая орбиталь соответствует своему энергетическому уровню; чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны размещаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:Электроны сначала заполняют самые низкие энергетические уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s
| Тип орбиты | Количество орбиталей на одном энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки. Существует только два возможных значения: +1/2 i -1/2.
- Принцип Паули:На каждой орбитали не может быть более двух электронов, и их спины должны быть разными.
- Принцип Хунда:Общее вращение системы должно быть как можно больше.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. Каждый последующий элемент в таблице Менделеева имеет на один протон и один электрон больше, чем предыдущий. Элементы n-го периода заполнили предыдущие n-1 электронных уровней.
– Магний является двенадцатым элементом и имеет по 12 протонов и электронов. Давайте распределим эти электроны в соответствии с (●), помня, что на каждом подуровне не может быть более двух электронов.
Магний – элемент третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6 . Магний находится во второй группе, поэтому у него два электрона на третьем уровне – 3s 2 . Таким образом, получаем1s 2 2s 2p 6 3s 2 .
В основном состоянии атома магния нет неспаренных электронов.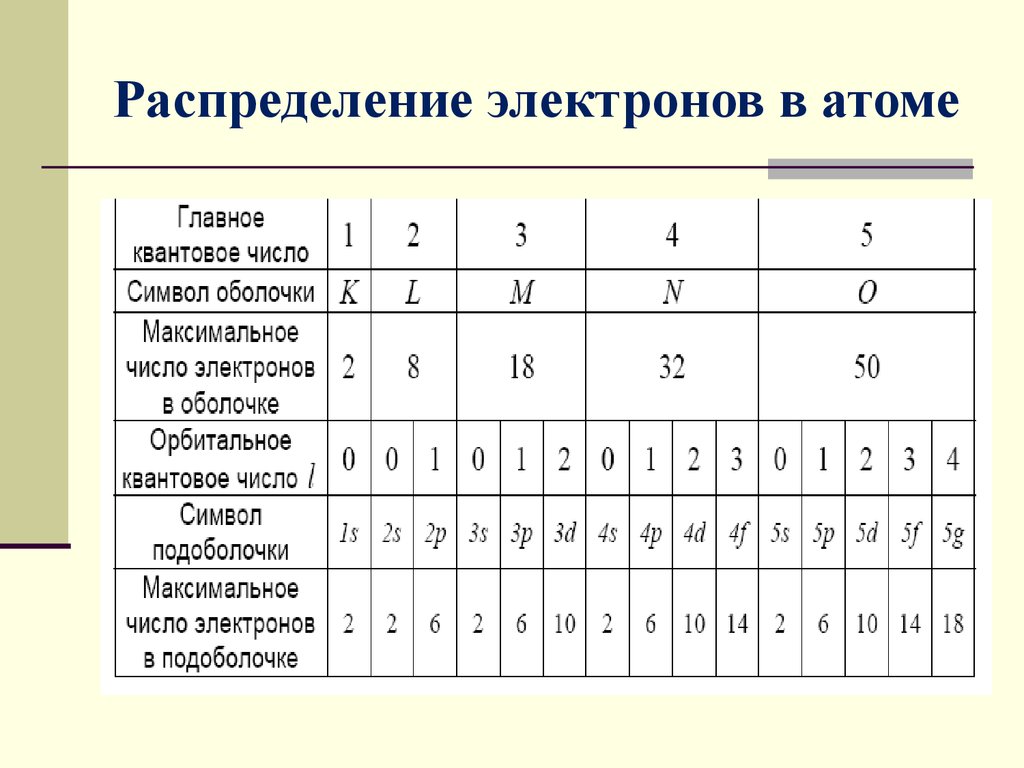
Если атом получает дополнительную энергию (например, нагревается), пара электронов может испариться, и один из электронов перейдет на свободную орбиталь того же энергетического уровня. В своем возбужденном состоянии атом магния имеет два неспаренных электрона и может образовывать две связи (валентность II).
– Фосфор – пятнадцатый элемент, отдающий 15 электронов: Фосфор является элементом третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6. Фосфор находится в пятой группе, поэтому у него пять электронов на третьем уровне – 3s 2 3p 3 . Таким образом, получаем1s 2 2s 2 2p 6 3s 2 3p 3 .
Атом фосфора в основном состоянии имеет три неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовывать пять связей (валентность V).
– Цирконий является сороковым элементом и имеет 40 электронов. Цирконий – элемент пятого периода, поэтому первые четыре энергетических уровня полностью заполнены – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 .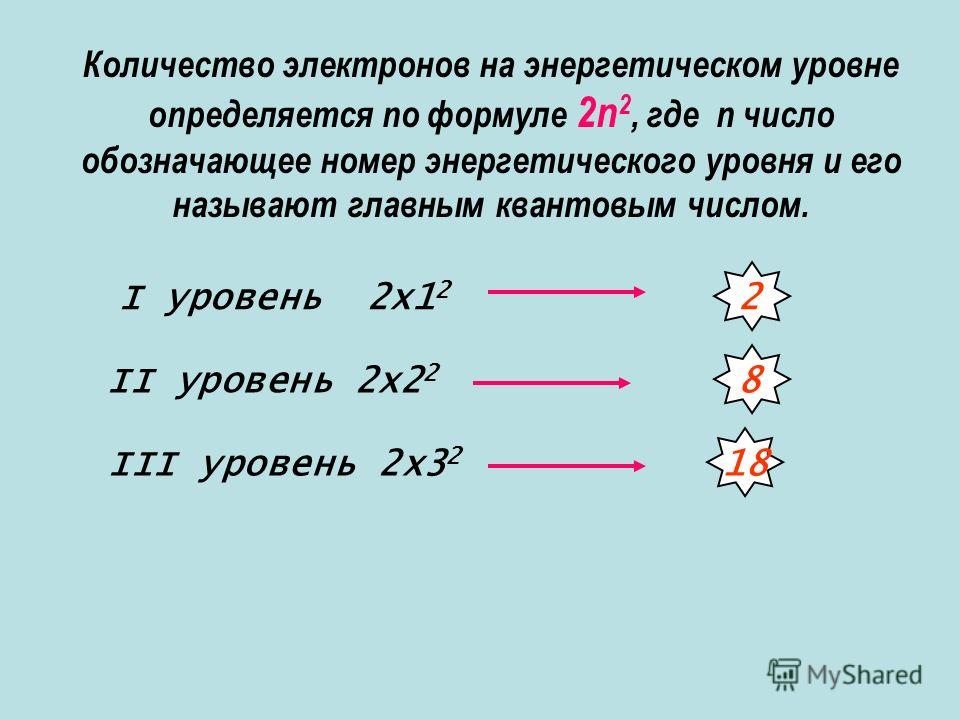 Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Атом циркония имеет 2 неспаренных электрона в основном состоянии.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключение из общего порядка заполнения электронных подуровней составляют хром, марганец, медь, серебро и золото – в этих случаях происходит “падение” электронов с внешнего подуровня s на подуровень d. Например, электронные конфигурации хрома и меди вместо 4s 2 3d 4 и 4s 2 3d 9 имеют вид 4s 1 3d 5 и 4s 1 3d 10.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это
Атомы состоят из еще более мелких частиц.
В центре каждого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы, называемые электронами, которые образуют так называемое электронное облако. Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, которое содержит два протона, два нейтрона и два электрона:
Ядро атома – это центральная часть атома, где сосредоточена его основная масса и весь положительный электрический заряд. Атомное ядро состоит из протонов и нейтронов.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это p + .
Нейтрон – это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона – это n 0 .
Протоны и нейтроны имеют общее название – нуклоны.
Атомные ядра имеют положительный заряд, поскольку состоят из положительно заряженных протонов и нейтронов. Этот заряд равен числу протонов в ядре и совпадает с порядковым номером элемента в периодической таблице.
Электрон – это частица, имеющая отрицательный электрический заряд. Заряд электрона равен -1 в условных единицах. Символом электрона является e .
Протоны, нейтроны и электроны имеют общее название – элементарные частицы или субатомные частицы.
| Имя | Символ | Гонорар |
|---|---|---|
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряды протона и электрона равны по величине, но противоположны по знаку. Каждый атом содержит равное количество протонов и электронов, поэтому ядерный заряд и суммарный заряд всех электронов в атоме равны по величине, но противоположны по знаку. Поэтому атомы являются электрически нейтральными частицами.
Читайте далее:
- Многоликий протон.
- Определение количества нейтронов, протонов и электронов в атоме.

- Атомная структура.
- Заряд атомного ядра, теория и примеры.
- Как работают атомы.
- Свойства атомов и их периодичность – ЗФТШ, МФТИ.
- Атомы и электроны, подготовка к экзамену ЕГЭ по химии.
Как найти число протонов, нейтронов и электронов
Учебные пособия
- Сообщение от Райли Мазиек
22
апреляОсновные понятия
В этом уроке вы узнаете, как найти и рассчитать количество протонов, нейтронов и электронов в атоме или элементе. Кроме того, вы узнаете о различных субатомных частицах. Если вам понравился этот урок, обязательно ознакомьтесь с другими!
Описано в других статьях
- Структура атома
- Что такое элемент?
- Как читать Периодическую таблицу
- Статьи об элементах
- Открытие электрона
- Электронные орбитали и формы орбит
Словарь:
- Протоны: положительно заряженные субатомные частицы, находящиеся в ядре.

- Нейтроны: нейтрально заряженные субатомные частицы, расположенные в ядре атома.
- Электроны: Отрицательно заряженные субатомные частицы, расположенные на орбиталях, окружающих ядро.
- Атомная масса: Средневзвешенное число нейтронов и протонов, присутствующих во всех изотопах.
- Атомный номер: Количество протонов, присутствующих в атоме.
- Элемент: чистое вещество, которое нельзя разложить химическим путем на более простое вещество.
Как найти атомный номер
Атомный номер элемента — это просто число протонов в его ядре. Самый простой способ найти атомный номер — посмотреть в периодической таблице, атомный номер находится в верхнем левом углу или является самым большим числом на квадрате.
Определение количества протонов
Количество протонов в атоме равно атомному номеру элемента. Например, возьмем кислород. Согласно периодической таблице кислород имеет атомный номер восемь. Атомный номер расположен над символом элемента. Поскольку кислород имеет атомный номер восемь, всего должно быть восемь протонов. Более того, количество протонов никогда не меняется для элемента.
Поскольку кислород имеет атомный номер восемь, всего должно быть восемь протонов. Более того, количество протонов никогда не меняется для элемента.
Определение количества нейтронов
Количество нейтронов в атоме можно рассчитать, вычитая атомный номер из атомной массы. Оба этих числа можно найти в периодической таблице. Атомный номер указан над символом элемента, тогда как массовое число помещено ниже. Давайте продолжим использовать кислород в качестве нашего примера. Его атомная масса равна 15,9.99 атомных единиц массы (а.е.м.), а его атомный номер равен 8. Когда мы вычтем 8 из 15,999, мы получим 8. Также следует отметить, что количество нейтронов для элемента может варьироваться. У некоторых элементов есть изотопы, которые имеют разную массу и, следовательно, разное количество нейтронов.
Определение количества электронов
Количество электронов в атоме равно атомному номеру элемента для нейтрально заряженных частиц. Это означает, что количество электронов и количество протонов в элементе равны.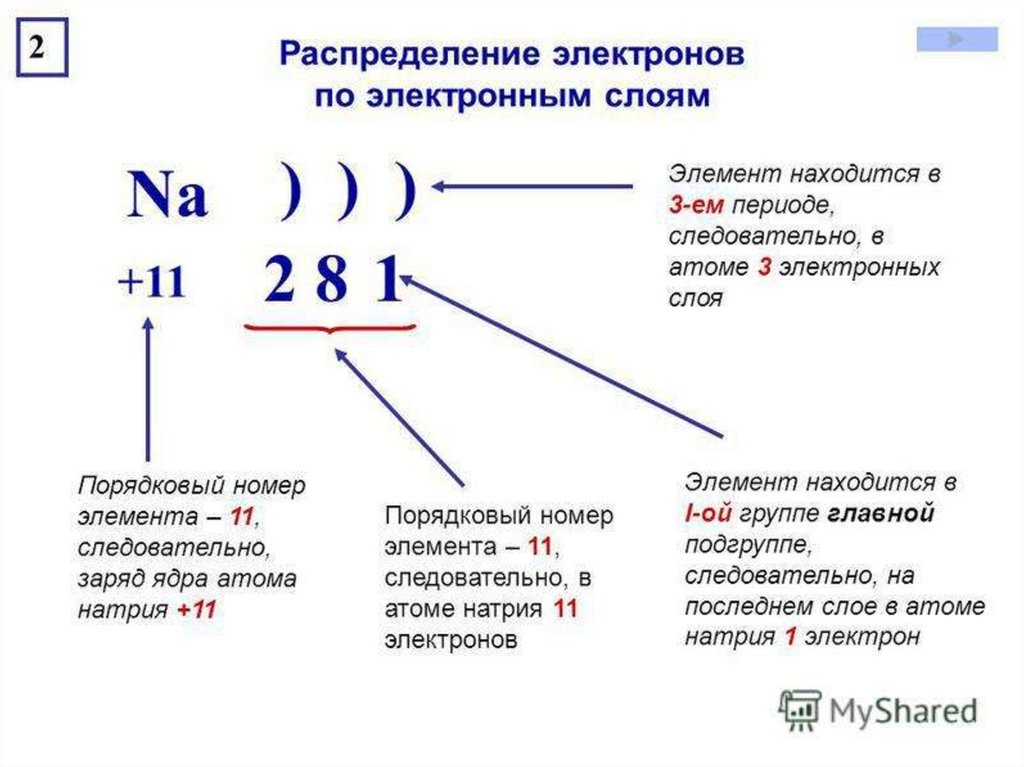 Следовательно, число электронов в кислороде равно 8. Более того, поскольку эти две субатомные частицы, электроны и протоны, имеют противоположные заряды, они компенсируются и сохраняют атом нейтральным.
Следовательно, число электронов в кислороде равно 8. Более того, поскольку эти две субатомные частицы, электроны и протоны, имеют противоположные заряды, они компенсируются и сохраняют атом нейтральным.
Summary Table
| Number of Protons = | Atomic Number |
| Number of Neutrons = | Atomic Mass- Atomic Number |
| Number of Electrons = | Atomic Number |
 Подписывайтесь на наш канал на YouTube, впереди еще много потрясающих видео!
Подписывайтесь на наш канал на YouTube, впереди еще много потрясающих видео!Лучшая периодическая таблица в мире
Компания ChemTalk, по нашему скромному мнению, разработала лучшую в мире интерактивную периодическую таблицу. Познакомьтесь с нашей периодической таблицей здесь.
Дополнительная литература
- Структуры точек Льюиса
- Периодические тренды, сделанные проще
Структура атома
Структура атомаАтом и электромагнитное излучение
| Основные Субатомные частицы | Электромагнитный Радиация |
| Свет и другие формы электромагнитного излучения | |
Фундаментальный субатомный Частицы
| Частица | Символ | Зарядка | Масса | |
| электрон | и — | -1 | 0,0005486 а. е.м. е.м. | |
| протон | р + | +1 | 1.007276 а.е.м. | |
| нейтрон | п о | 0 | 1.008665 аму | |
Количество протонов, нейтронов и электронов в атоме можно определить из набора простых правила.
- Число протонов в ядре атома равно равно атомному номеру ( Z ).
- Количество электронов в нейтральном атоме равно равно числу протонов.
- Массовое число атома ( M ) равно сумма числа протонов и нейтронов в ядро.
- Количество нейтронов равно разности
между массовым числом атома ( M ) и
атомный номер ( Z ).

Примеры: Определим количество протонов, нейтронов, и электроны в следующих изотопах.
| 12 С | 13 С | 14 С | 14 Н |
Различные изотопы элемента идентифицируют, записывая массовое число атома в верхний левый угол символа элемента. 12 С, 13 C и 14 C изотопы углерода ( Z = 6) и, следовательно, содержат шесть протонов. Если атомы нейтральны, они также должны содержать шесть электронов. Единственный разница между этими изотопами в количестве нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6 нейтронов
13 C: 6 электронов, 6 протонов и 7 нейтронов
14 С: 6 электронов, 6 протонов и 8 нейтронов
Электромагнитный Радиация
Многое из того, что известно о строении электронов
в атоме было получено при изучении взаимодействия
между материей и различными формами электромагнитный
излучение . Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Частицы имеют определенную массу и занимают космос. Волны не имеют массы, но несут энергию как они путешествуют по космосу. Помимо их способности несут энергию, волны имеют четыре другие характеристики свойства: скорость, частота, длина волны и амплитуда. частота ( v ) количество волн (или циклов) на единицу время. Частота волны указывается в единицах циклов. в секунду (с -1 ) или герц (Гц).
Идеализированный рисунок волны на рисунке ниже иллюстрирует определения амплитуды и длины волны. Длина волны ( l ) — наименьшее расстояние между повторяющимися точками на волне. Амплитуда волны это расстояние между самой высокой (или самой низкой) точкой волны и центр тяжести волны.
Если мы измерим частоту ( v ) волны в циклах
в секунду и длина волны ( l ) в метрах,
Произведение этих двух чисел выражается в метрах на
второй.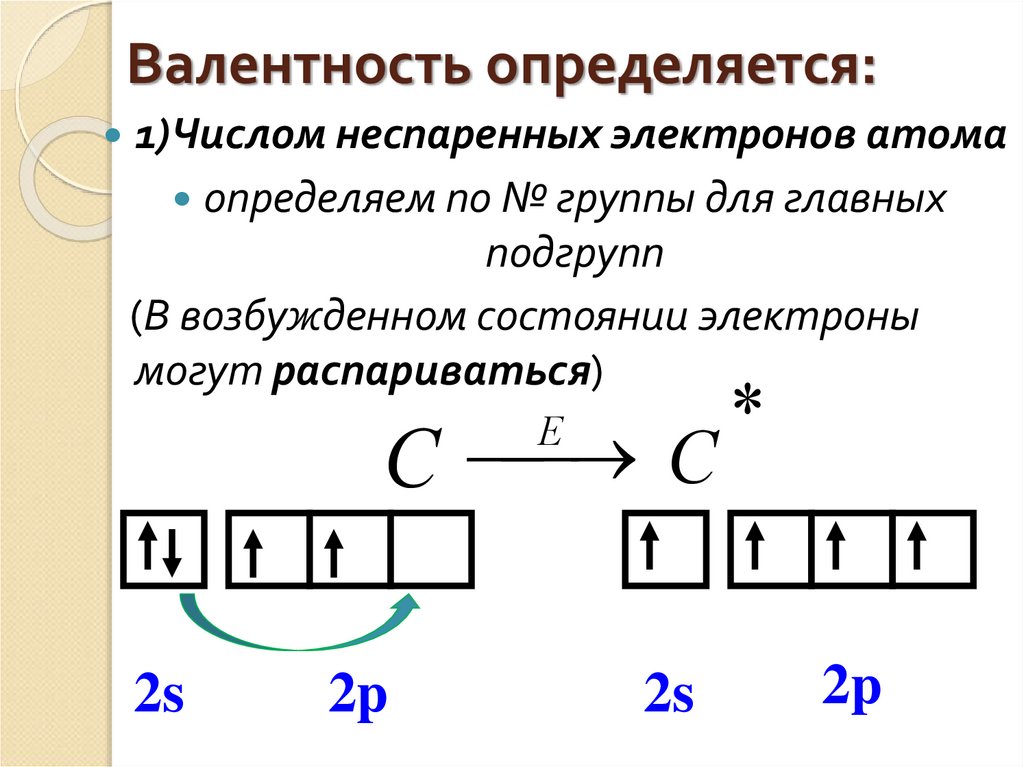 Произведение частоты ( v ) умножить на
длина волны ( l ) волны, поэтому скорость ( с )
при котором волна распространяется в пространстве.
Произведение частоты ( v ) умножить на
длина волны ( l ) волны, поэтому скорость ( с )
при котором волна распространяется в пространстве.
вл = с
Легкие и прочие Формы электромагнитного излучения
Свет — это волна с электрическими и магнитными компоненты. Следовательно, это форма электромагнитного поля . излучение .
Видимый свет содержит узкую полосу частот и
длины волн в части электромагнитного спектра
которые наши глаза могут обнаружить. Он включает в себя излучение с
длины волн от 400 нм (фиолетовый) до 700 нм (красный).
Поскольку это волна, свет преломляется, когда попадает в стекло.
призма. Когда белый свет фокусируется на призме, световые лучи
с разной длиной волны изгибаются на разную величину и
свет превращается в спектр цветов. Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Как видно из следующей диаграммы, энергия переносимый светом, увеличивается по мере того, как мы переходим от красного к синему через видимый спектр.
Поскольку длина волны электромагнитного излучения может быть до 40 м или до 10 -5 нм, видимый спектр составляет лишь малую часть всего диапазона электромагнитного излучения.
Электромагнитный спектр включает радио- и телеволны,
микроволны, инфракрасное излучение, видимый свет, ультрафиолет, рентгеновские лучи,
g-лучи и космические лучи, как показано на рисунке выше. Эти
различные формы излучения движутся со скоростью света
( с ). Однако они различаются по своей частоте и
длины волн. Произведение частоты на
длина волны электромагнитного излучения всегда равна
скорость света.


 И. Менделеева.
И. Менделеева.