Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 — 8 = 8 (в кислороде 8 нейтронов)
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 3 | 4 | 7,0160 |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | 28,9765 |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 15 | 16 | 30,9738 |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 22 | 39,9624 | |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46 |
20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 53,9396 | |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 34 | 62,9296 |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 33 | 42 | 74,9216 | |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 46 | 80,9163 |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 48 | 84,9118 | |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 53 | 94,9058 |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атомаВеликие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.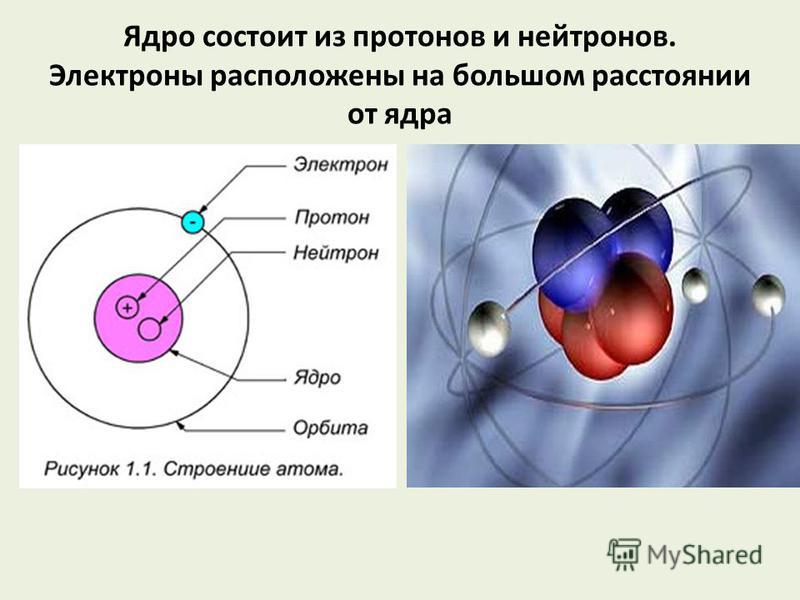
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты).  Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частицИз таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а. е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями).
 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя. - На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.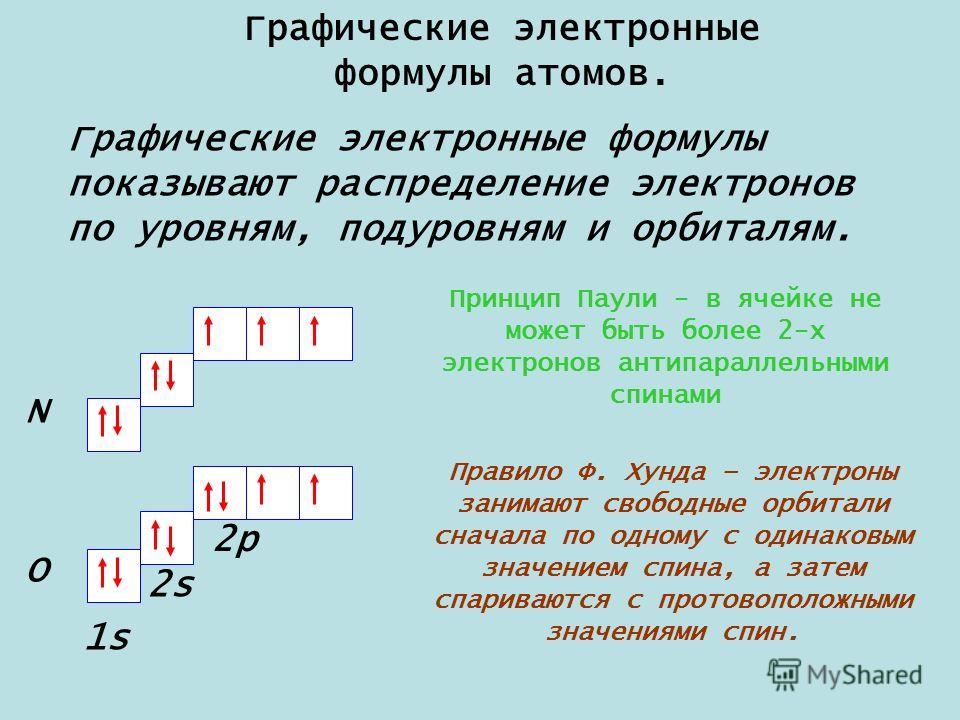
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атомПри заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.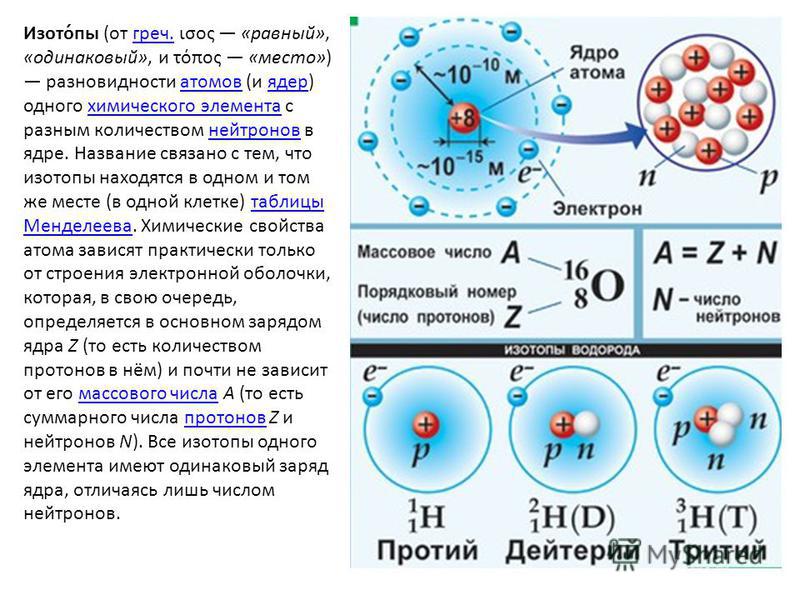
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.

У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Структура материи
Структура материиМатериалы
сайта Нобелевского комитета
http://www. Оглавление
|
1. Структура материи Структура материи |
| Атомы состоят из ядер, содержащих протоны и нейтроны, и электронного облака. Электроны находятся в постоянном движении вокруг ядра, а протоны и нейтроны двигаются внутри ядра. Каждый нейтрон и протон состоят из трех кварков. С современной точки зрения кварки и электроны являются наиболее фундаментальными формами материи. |
2. Революционные идеи | |
| В науке есть периоды, когда дальнейший прогресс может быть достигнут только на основе революционных идей. Николай Коперник сделал именно такой шаг в неизвестность, когда предположил, что Солнце является центром Солнечной системы. Альберт
Эйнштейн (Нобелевская премия по физике, 1921 г.) совершил такой же
шаг, когда поведал миру о том, что скорость света не может быть
превышена, и опубликовал свою теорию относительности. Кварки также требовали революции в мышлении. | |
3. Вопрос, оставшийся без ответа | |||
| К
1930 году представление об атомах достигло критической
стадии. Считалось, что атомы состоят из ядер, содержащих протоны и
нейтроны (Джеймс Чэдвик, Нобелевская премия по физике, 1935 г.), и
внешнего облака электронов (Джозеф Джон Томсон, Нобелевская премия по
физике, 1906 г.). Считалось, что эти три частицы являются
фундаментальными составляющими всей материи. Но оставался вопрос: как внутри ядра удерживаются вместе все протоны, которые отталкиваются друг от друга? Почему ядро стабильно? Эти
вопросы привели к экспериментам на ускорителях заряженных частиц для
изучения взаимодействия нейтронов и протонов. Но, помимо ответов на
поставленные вопросы, в этих экспериментах было обнаружено много
других типов частиц. Это породило в свою очередь большое число новых
вопросов, которые в конечном итоге привели к совершенно новому
пониманию фундаментальной структуры ядра. | |||
4. Научные приборы | |
Такие приборы, как пузырьковые камеры (Дональд Глазер, Нобелевская премия по физике, 1960 г.) играли решающую роль в разработке нового взгляда на строение материи. Принцип работы пузырьковой камеры состоит в том, что, когда вы направляете заряженные частицы в жидкость, которая нагрета выше ее температуры кипения (перегретая жидкость), за пролетающей частицей остается след (трек) в виде пузырьков. В камере легко зарегистрировать треки частиц и затем рассчитать такие важные характеристики, как заряд и массу частиц. С
помощью таких регистрирующих приборов были открыты многие новые
частицы. | |
5. Спин: свойство частиц | |
С помощью пузырьковой камеры и других приборов были открыты сотни новых частиц (Луис Альварес, Нобелевская премия по физике, 1968 г.). Существование трех фундаментальных частиц материи казалось правдоподобным, но сотен? Все это напоминало мозаику, потому что предполагается, что природа устроена просто и элегантно, а не сложно и уродливо. Пытаясь разгадать эту простоту природы, физики начали классифицировать все частицы в соответствии с их характеристиками (свойствами). Одной из таких характеристик был спин. Спин –
значение углового момента (момента импульса), которым обладают все
частицы. Например, если волчок вращается, то он имеет определенный
момент импульса. В квантовых теориях момент импульса измеряется в единицах ħ = h/2π = 1,05×10-34 Дж·с (Макс Планк, Нобелевская премия по физике, 1918 г.). (Дж·с произносится как Джоуль-секунда, а ħ = «аш с чертой» | |
6. Момент импульса. Закон сохранения момента импульса | |
Спин
– момент импульса, который является характеристикой частиц. Но
момент импульса может быть связан и с вращением одного объекта
относительно другого. Например, Земля вращается вокруг Солнца: она
имеет момент импульса, обусловленный ее «собственным»
вращением и имеет орбитальный момент импульса вследствие вращения
вокруг Солнца. Общий момент импульса, связанный со спином и вращательным движением, является полезной величиной, поскольку эта величина всегда остается постоянной. В ускорителе при соударении частиц возникают другие частицы. Но суммарный момент импульса остается постоянным до столкновения, во время столкновения и после столкновения. Значение углового момента всегда должно быть одни и тем же. Это утверждение называется законом сохранения момента импульса. | |
| Одними из возможных продуктов столкновения и аннигиляции электрона (e—) и позитрона (e+) является пара пионов π— и π+. | |
Сохранение момента импульса | |||
Две
частицы (позитрон и электрон) с невероятно большой энергией
сталкиваются друг с другом. | При аннигиляции частиц возникают две новые частицы | На этом
этапе можно предположить, что две частицы со спином 1/2 приведут к
созданию частиц со спином, равным нулю. Но куда делся момент импульса? Момент импульса не сохраняется? | Момент
импульса тем не менее остается постоянным, но изменяет свою форму.
Сначала он был в виде спина, а теперь в форме вращательного
момента импульса. Подобно тому, как Земля и Луна, эти частицы имеют момент импульса из-за движения относительно точки столкновения. |
| Таким образом, момент импульса сохраняется. Спиновый момент импульса преобразуется во вращательный момент импульса, но общая величина момента импульса остается неизменной. | |||
7. Классификация частиц | ||||
В
физических экспериментах столкновение частиц с известным спином
используется для получения других частиц. Т.к. физики знали суммарный
спин частиц, участвующих в столкновениях, то они использовали закон
сохранения момента импульса для определения спина частиц, полученных
при столкновении. Физики установили, что спин частиц может быть целым
числом ħ (0ħ, 1ħ, 2ħ, 3ħ, …)
или полуцелым числом ħ (1/2ħ, 3/2ħ, 5/2ħ,…). Т.к. физики знали суммарный
спин частиц, участвующих в столкновениях, то они использовали закон
сохранения момента импульса для определения спина частиц, полученных
при столкновении. Физики установили, что спин частиц может быть целым
числом ħ (0ħ, 1ħ, 2ħ, 3ħ, …)
или полуцелым числом ħ (1/2ħ, 3/2ħ, 5/2ħ,…).Большинство вновь открытых частиц относится к известному классу частиц, которые называются адронами. Адроны были классифицированы либо как мезоны с полуцелым значением спина, либо как барионы с целым значением спина.
|
8. Другая характеристика…. Странность Странность | |
Мюррей Гелл-Манн, Нобелевская премия по физике, 1969 г. | Позже была открыта другая важная характеристика. При столкновениях частиц с высокими энергиями было обнаружено рождение большого количества частиц, которые получили название К-мезоны. Но обнаружилось нечто странное с этими частицами. Наблюдение показало, что имеют достаточно большое время жизни. Можно предположить существование некоторого закона, который запрещает К-мезонам распадаться на другие частицы. Мюррей Гелл-Манн (Нобелевская премия по физике, 1969 г.) предположил, что К-мезоны и некоторые другие частицы имеют неизвестное ранее свойство (характеристику), которое получило название «странность». Затем он идентифицировал эти свойства и модели как часть некоторой математической классификационной схемы. Однако,
эта схема казалась не вполне работающей. Схема предсказывала
существование еще не обнаруженной частицы – Ω— (омега-минус). |
9. Появляется кварк | |
Когда космические лучи (протоны) взаимодействуют с атмосферой, образуются пионы (пи-мезоны). π+ состоит из down-антикварка и up-кварка. | Несмотря
на созданную Гелл-Манном модель и классификацию таких частиц либо как
барионов, либо как мезонов, физики «застряли» с сотней
«фундаментальных» частиц. Для того чтобы избежать «зоопарка частиц», следующим шагом было выяснение того, могут ли эти модели объясняться, если постулировать, что барионы и мезоны состоят из других частиц. Эти частицы были названы кварками. Мюррей
Гелл-Манн и Георг Цвейг предположили, что барионы – это
частицы, состоящие из трех кварков (qqq),
а мезоны – частицы, состоящие из кварка и антикварка (q). (up-кварк (верхний кварк) обозначается буквой u, down-кварк (нижний кварк) — буквой d. Слова up и down – просто имена кварков и никакого отношения к понятию «верх» или «низ» не имеют). |
Протон состоит из двух up-кварков и одного down-кварка, нейтрон – из двух down-кварков и одного up-кварка. | |
10. Дробный заряд и ненаблюдаемость кварков | ||
| Однако
кварки не казались вполне совершенным ответом. Гелл-Манн и Цвейг
признали, что их идея имеет серьезные проблемы. Одна из них связана с
необходимостью дробного заряда кварков, который должен быть связан с
известными зарядами мезонов и барионов. Однако, частицы с таким
дробным зарядом никогда ранее не наблюдались. Перед
Гелл-Манном и Цвейгом стояли две другие серьезные проблемы, которые
нужно было разрешить до принятия их теории. | ||
11. Цветной заряд | |
| Нужно было
объяснить, например, почему наблюдаются только такие комбинации
кварков и антикварков, которые имеют целый заряд, и почему нет,
например, таких комбинаций, как q,
qq, qq
или неисчислимо много других комбинаций. Гелл-Манн и другие исследователи полагали, что ответ лежит в природе сил,
связывающих кварки. Эта сила называется «ядерной» и является мерой «сильного»
взаимодействия, и новые заряды, которые чувствительны к ядерным силам, были
названы «цветными» зарядами, хотя к обычному цвету это не имеют никакого
отношения. | |
| Подобно тому, как
комбинация красного и синего цвета дает пурпурный цвет, комбинация
определенных цветов (красный, зеленый, синий) дает белый цвет. Могут существовать только те частицы, которые имеют нейтральный цвет, т.е. только qqq и q. | |
12. Кварки удерживаются вместе или «кварки находятся в заключении» | |
Ядерная
сила существенно отличается от гравитационных и электромагнитных сил.
Гравитационные и электромагнитные силы по мере увеличения расстояния
между объектами или зарядами ослабевают. Однако, для ядерных сил
расстояние не имеет значения. Интенсивность сильного взаимодействия
между кварками остается постоянной. Интенсивность сильного взаимодействия
между кварками остается постоянной.Почему возникают только частицы с нейтральным цветом? Что произойдет, если кварк испытает сильное соударение и примет участие в ядерных реакциях, обусловленных ядерным взаимодействием. | |
| Кварки удерживаются вместе Что произойдет, если попытаться разделить два кварка? Если кварк каким-либо образом сдвинуть от его соседа, то энергия поля ядерной силы будет увеличиваться. Подобно тому, как при растяжении резиновой ленты, по мере удаления кварков друг от друга все большее количество энергии будет преобразовываться в энергию поля ядерного взаимодействия. Если энергия поля достигнет определенного значения, произойдет преобразование энергии в новую пару кварк/антикварк – . Энергия поля сохранится из-за преобразования энергии поля в массу новых кварков. Кроме того, поле ядерной силы вернется в исходное состояние. По этой
причине кварки нельзя наблюдать в свободном виде по отдельности. | |
13. Масса, частицы и кварки | |
| Взаимное
удержание – конфайнмент кварков демонстрирует взаимозависимость
массы и энергии, открытую Эйнштейном. Масса частицы, состоящей из
кварков, определяется не только массой отдельных кварков, но и их
кинетической энергией. Для протона, только 1,3% его массы определяется массой трех кварков. Это сильно отличается от ядер, масса которого меньше массы составляющих его нуклонов. Поскольку кварки в протоне или нейтроне имеют очень большую кинетическую энергию, то как они связаны вместе? Почему они не могут вылететь из протона? Так как ядерная сила (в отличие от гравитационной) остается постоянной, то для удаления кварка нужно совершить бесконечно большую работу (работа = сила расстояние). Поэтому кварк никогда нельзя увидеть свободным. Это была революционная
идея. | |
Так как сила тяжести ослабевает с расстоянием, ракета может преодолеть ее, если у нее будет достаточно энергии. В то же время, сильное взаимодействие не меняется с расстоянием. Таким образом, у кварка никогда не будет достаточно кинетической энергии, чтобы вырваться на свободу. | |
14. Носитель ядерной силы | |
Обмен пионами. | С
открытием ядерной силы, наконец, стало возможным объяснить, ядро не
разлетается. Хидеки
Юкава (Нобелевская премия по физике, 1949 г.) предположил, что
ядерное взаимодействие между протонами и нейтронами в ядре возникает
из-за обмена пи-мезонами (пи-мезон состоит из кварка и анти-кварка).
Но, с более современной точки зрения остается проблема. Ядерная сила
действует только между частицами с цветным зарядом, а протоны и
нейтроны имеют нейтральный цветовой заряд. |
Обмен глюонами | Физики предположили, что мезоны и барионы, такие как протоны и нейтроны в ядре могут перекрываться. Поэтому, хотя протоны и нейтроны с нейтральным цветом не взаимодействуют друг с другом, это делают их кварки. Ядерное взаимодействие возникает за счет обмена глюонами между кварками соседних протонов и нейтронов. Этот процесс «склеивает» («glues») ядро. Процесс очень похож на тот, который удерживает вместе нейтральные атомы в молекулах. |
15. Можно ли увидеть кварки? | |||
«Смотрим» внутрь протона. Используя электроны, ускоренные до высоких энергий, физики смогли «увидеть» кварки внутри протона. | Хотя
кварки и нельзя получить в свободном виде, физики нашли способ
«увидеть» кварки внутри ядра. Эксперимент Джерома И.
Фридмана (Jerome I. Friedman), Генри У. Кендалла (Henry W, Kendall) и
Ричарда Е. Тейлора (Richard E. Taylor) (Нобелевская премия по физике,
1990 г.) очень похож на эксперимент Эрнста Резерфорда (Нобелевская
премия по химии, 1908 г.). Однако, в их экспериментах мишенями были
протоны и нейтроны, а пучок состоял из электронов с энергиями в
тысячи раз больше, чем энергия альфа-частиц в пучках, использованных
Резерфордом. И снова, изучая углы рассеяния частиц, удалось выйти на
новый уровень понимания материи. Глубоко внутри протонов и нейтронов,
они нашли экспериментально физическое доказательство существования
кварков. Эксперимент Джерома И.
Фридмана (Jerome I. Friedman), Генри У. Кендалла (Henry W, Kendall) и
Ричарда Е. Тейлора (Richard E. Taylor) (Нобелевская премия по физике,
1990 г.) очень похож на эксперимент Эрнста Резерфорда (Нобелевская
премия по химии, 1908 г.). Однако, в их экспериментах мишенями были
протоны и нейтроны, а пучок состоял из электронов с энергиями в
тысячи раз больше, чем энергия альфа-частиц в пучках, использованных
Резерфордом. И снова, изучая углы рассеяния частиц, удалось выйти на
новый уровень понимания материи. Глубоко внутри протонов и нейтронов,
они нашли экспериментально физическое доказательство существования
кварков. | ||
| |||
16. Что можно сказать о дробных зарядах? | |
| Через несколько лет, другие физики-экспериментаторы изучали рассеяние нейтрино на протонах и нейтронах и изучали интенсивность столкновений. Нейтрино крайне легкие частицы, которые участвуют в слабых взаимодействиях, но не участвуют в электромагнитных взаимодействиях. Сравнение сечения столкновения нейтрино и электронов дало доказательство существования дробного заряда. | |
| Рассеяние электронов | Рассеяние нейтрино |
17. Даже
кварки распадаются Даже
кварки распадаются | |
| Развитие
науки характеризуется тем, что старые представления и идеи достаточно
редко полностью заменяются, при этом их область применения становится
ограниченной. Именно так произошло и с теорией распада нейтрона. Нейтрон распадается на протон, электрон и нейтрино. Но, как предположили физики, так как нейтрон состоит из кварков, одного верхнего и двух нижних кварков, то сам нейтрон распадаться не может. Физики предположили, что распадается один из кварков. Итак кварки «пролили» свет на действительную природу взаимодействия частиц, которую раньше считалось невозможно объяснить. | |
| При бета-распаде нейтрона (udd) образуются протон (uud), электрон и антинейтрино. | Нейтрон
не имеет заряда и состоит из одного верхнего кварка (u-кварк)
и двух нижних кварков (d-кварк). | Если
нейтрон распадается, то один из нижних кварков преобразуется в
верхний кварк. Так как нижний кварк имеет заряд -1/3, а верхний
кварк имеет заряд +2/3, то необходимо выполнение закона сохранения
заряда. Этот закон будет выполнен, если при распаде появится
виртуальная частица – промежуточный векторный бозон W заряд которого равен -1 . | Теперь нейтрон
становится протоном Как только виртуальная W-частица отталкивается от протона, она преобразуется в электрон и антинейтрино. | Наконец, протон,
электрон и антинейтрино удаляются друг от друга. В действительности весь процесс длится миллиардную долю миллиардной доли секунды, т.е. 10-18 с. |
18. Пропавшее очарование | ||
Используя
все открытые частицы Глэшоу, Салам и Вейнберг создали Стандартную
модель, теорию, которая объяснила фундаментальные частицы и силы
взаимодействия. В Стандартной модели имеется три кварка, верхний
кварк, нижний кварк и странный кварк (u-, d-
и s-кварки). Странный
кварк (s-кварк) – частица, имеющая свойство странности. В Стандартной модели имеется три кварка, верхний
кварк, нижний кварк и странный кварк (u-, d-
и s-кварки). Странный
кварк (s-кварк) – частица, имеющая свойство странности.Однако трех кварков оказалось недостаточно. Математическая теория, которая лежит в основе Стандартной модели, предсказывает существование четвертого кварка, получившего название очарованный кварк (charm). Однако, ни одной частицы, содержащий такой кварк, не было обнаружено. Позже, в 1974 г., в экспериментах, проведенных Самуэлем Тингом (Samuel Ting) и Бэртоном Рихтером (Burton Richter) (Нобелевская премия по физике, 1976 г.) одновременно была найдена частица, которая содержала недостающий очарованный кварк. Один из исследователей назвал ее J-частицей, другой – Ψ. Теперь она известная как J/Ψ-частица. | ||
Самуэлем Тинг | Бэртоном Рихтер | |
19. Еще
кварки? Еще
кварки? | |
| С
открытием очарованного кварка, физики задавали себе вопрос, а нет
ли еще кварков, кроме этих четырех. Очень скоро на их вопрос
появился ответ после того, как Леон Ледерман (Нобелевская премия
по физике, 1988 г.) и его группа обнаружили пятый кварк. Он был
назван bottom (основным) кварком – b-кварком и имел
заряд -1/3. Физики ожидали, что скоро будет найден недостающий кварк с зарядом +2/3. К сожалению, прошло почти 20 лет, прежде, чем был открыт подходящий кварк. | |
Леон Ледерман | |
20. Возможности Стандартной модели | ||
| Джерардус Хофт | Мартинус Вельтман | Используя
математический аппарат Стандартной модели и
данные с невероятно большой точностью из многих перспективных
экспериментов, оказалось возможным рассчитать массу недостающего
кварка. Используя методику расчета, разработанную Джерардусом Хофтом (Gerardus’t Hooft) и Мартинусом Дж. Г. Вельтманом (Martinus J. G. Veltman) (Нобелевская премия по физике, 1999 г.), физики смогли рассчитать косвенные эффекты влияния top-кварка (t-кварка) на их экспериментальные измерения. Они обнаружили, что t-кварк должен быть много массивней других кварков, примерно в 20-30 раз массивней самого из массивных известных кварков – b-кварка. Эти методы были важны не только для оценок массы t-кварка, но они дали ключ к пониманию полной структуры и непротиворечивости Стандартной модели. До работы Хофта и Вельтмана в 1971 и 1972 гг. никто не знал, как можно проводить расчеты на основе Стандартной модели, получая не только приблизительные ответы. |
21. Открытие топ-кварка | |
Только
к началу 1990-х годов удалось добиться точности эксперимента,
необходимой для расчета массы топ-кварка. В 1995 г. два эксперимента
в Ферми-лаборатории подтвердили существование топ-кварка и показали,
почему его было так трудно обнаружить. Топ-кварк имел необычно
большую массу 175 ГэВ/с2,
более, чем в 30 раз больше массы b-кварка!
Такое большое время, потребовавшееся для его открытия по той причине,
что для обнаружения такой частицы необходимо было иметь более мощные
ускорители. В 1995 г. два эксперимента
в Ферми-лаборатории подтвердили существование топ-кварка и показали,
почему его было так трудно обнаружить. Топ-кварк имел необычно
большую массу 175 ГэВ/с2,
более, чем в 30 раз больше массы b-кварка!
Такое большое время, потребовавшееся для его открытия по той причине,
что для обнаружения такой частицы необходимо было иметь более мощные
ускорители. | |
| Открытие | Нобелевская премия | Лауреаты | |||
|---|---|---|---|---|---|
| Беватрон начал работать в 1954 г., и в 1955 г. был открыт антипротон. | 1959 | Э. Сегре | О. Чемберлен | ||
| В 1969 г. была открыта внутренняя структура нуклонов (протонов и нейтронов) на ускорителе в Стенфорде – SLAC. | 1990 | Дж.  Фридман Фридман | Г. Кендалл | Р. Тейлор | |
| Открытие J/Ψ-частицы, построенной из очарованных кварков, в Брук-Хэвене и SLAC в 1974 г. | 1976 | ||||
| В 1976 г. в SLAC был открыт тау-лептон. | 1995 | М. Перл | |||
| В 1983 г. были открыты W и Z-частицы на ускорите на встречных пучках (протон-антипротонном коллайдере). | 1984 | К. Руббиа | Ван дер Меер | ||
| В 1995 г. объявлено о первом прямом доказательстве на Теватроне в Ферми-лаборатории существования top-кварка. | |||||
22. Фундаментальны ли кварки? Фундаментальны ли кварки? | |
| На
сегодняшнем поколении ускорителей мы не нашли доказательств того, что
кварки имеют внутреннюю структуру или состоят из других частиц. Для
того, чтобы исследовать кварки нужны ускорители встречных пучков
протонов экстремальной высоких значений энергии. Если бы кварки имели
внутри себя составляющие меньшего размера, то получившиеся в
результате столкновения частицы разлетались бы под значительно
большими углами. Пока изучение этих столкновений устанавливает, что кварк является фундаментальной частицей до крошечного масштаба 10-19 м. Но никто не знает, действительно ли кварки являются фундаментальными частицами. Только будущие исследования на новых ускорителях встречных пучков высокой энергии – коллайдерах помогут открыть этот секрет Природы. | |
Найден способ быстрого анализа количества электронов в молекуле
Авторы работы, слева направо: Валентин Новиков, Юлия Нелюбина и Игорь Никовский.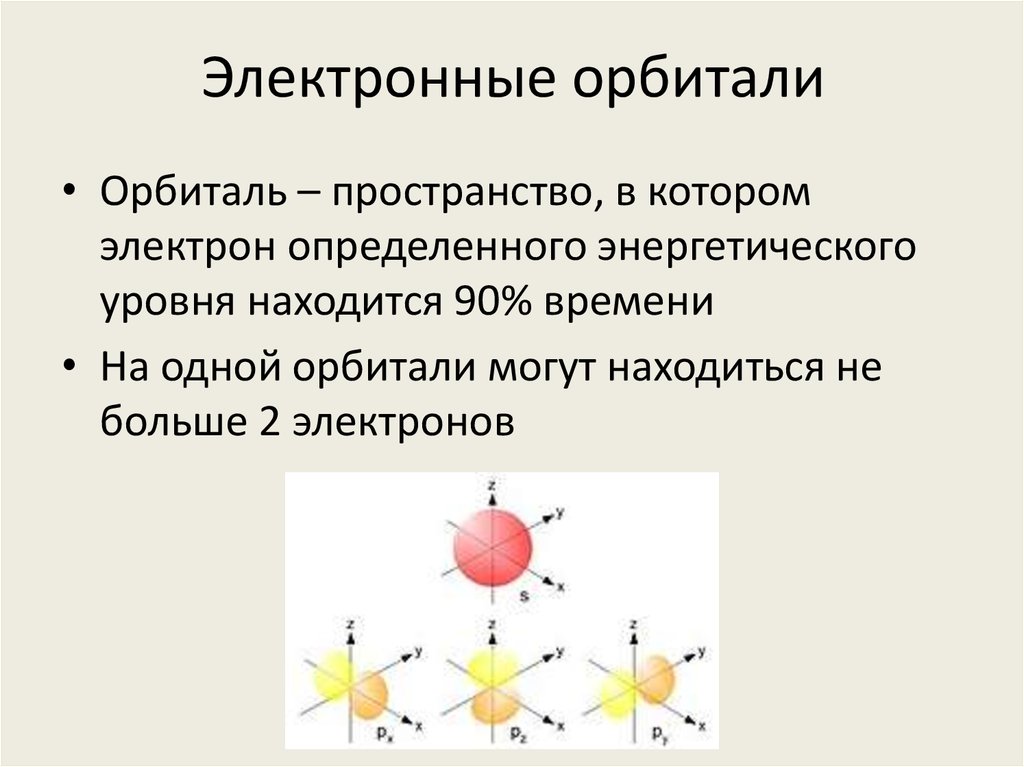 Источник: Валентин Новиков
Источник: Валентин Новиков
Обнаружение соединения кобальта с лигандами в ЯМР-спектрометре. Источник: Валентин Новиков
Принцип работы ЯМР-спектрометра по аналогии с горкой огурцов, из которой берут выделяющийся помидор. Источник: Валентин Новиков
«Использование метода позволяет за короткое время проанализировать целую библиотеку комплексов металлов, образованных различными органическими соединениями и их комбинациями. За счет этого можно существенно ускорить поиск новых соединений со спиновыми переходами, что открывает широчайшие возможности для их направленного дизайна в качестве молекулярных дисплеев, сенсоров или логических элементов», — прокомментировал Валентин Новиков, руководитель проекта по гранту РНФ, доктор химических наук, ведущий научный сотрудник Института элементоорганических соединений имени А. Н. Несмеянова Российской академии наук.

Одной из основных задач современной науки стал поиск молекулярных материалов, свойства которых можно легко изменять. Это важно для самых разных областей: от медицинской диагностики до создания квантового компьютера. Сейчас в качестве таких материалов используются переходные металлы. В них появляются электроны на траекториях движения частиц (орбиталях) d- и f-подуровней, которые слегка удалены от ядра атома и обладают меньшей энергией, чем более приближенные s- и p-. Также они часто обладают переменной валентностью – способностью формировать определенное количество связей с атомами, – что позволяет им легко образовывать комплексные соединения.
Важная особенность существующих комплексов переходных металлов – это то, что их электроны способны менять свое спиновое состояние – физический показатель, который характеризует количество электронов в молекуле, не образующих пары. Среди веществ с такой особенностью наиболее распространены железо и кобальт. Спиновое состояние можно изменять с помощью внешних воздействий, таких как свет, температура и давление. Это позволяет настраивать характеристики вещества. Некоторые из них видны невооруженным глазом, например цвет. На основе соответствующих материалов можно создавать различные устройства, среди которых дисплеи и сенсоры. В последнее время такие соединения начали использовать также в составе средств для сверхплотного хранения и сверхбыстрой обработки информации.
Спиновое состояние можно изменять с помощью внешних воздействий, таких как свет, температура и давление. Это позволяет настраивать характеристики вещества. Некоторые из них видны невооруженным глазом, например цвет. На основе соответствующих материалов можно создавать различные устройства, среди которых дисплеи и сенсоры. В последнее время такие соединения начали использовать также в составе средств для сверхплотного хранения и сверхбыстрой обработки информации.
Российские ученые из Института элементоорганических соединений имени А. Н. Несмеянова Российской академии наук (Москва) нашли способ быстрого определения спинового состояния ионов металла при помощи спектроскопии ядерного магнитного резонанса (ЯМР). Это один из наиболее распространенных методов исследования новых химических веществ, который основан на изучении взаимодействия вещества с электромагнитной энергией. Спектроскопию ЯМР ученые используют для определения спинового состояния уже больше 50 лет. Суть метода Эванса, как называется этот подход, такова: изучаемое вещество добавляют в какой-либо растворитель, в результате магнитные характеристики растворителя меняются, что регистрируют при помощи ЯМР-спектрометра. Эти изменения зависят от концентрации вещества и количества в нем электронов без пары. Таким образом, ученые смотрят не на само изучаемое вещество, а на то, как оно изменяет свойства растворителя. У этого метода есть несколько серьезных недостатков. Во-первых, он требует от исследователей знать точную концентрацию изучаемого соединения. Во-вторых, при таком подходе невозможно изучать смеси. Новый метод, описанный в новой статье, позволяет избавиться от этих проблем.
Эти изменения зависят от концентрации вещества и количества в нем электронов без пары. Таким образом, ученые смотрят не на само изучаемое вещество, а на то, как оно изменяет свойства растворителя. У этого метода есть несколько серьезных недостатков. Во-первых, он требует от исследователей знать точную концентрацию изучаемого соединения. Во-вторых, при таком подходе невозможно изучать смеси. Новый метод, описанный в новой статье, позволяет избавиться от этих проблем.
Их подход отличается тем, что с помощью ЯМР-спектрометра они изучали непосредственно само вещество. Это сложнее, так как у него необходимо проанализировать большее количество сигналов, чем у раствора, у которого он может быть всего один. Но за счет этого можно получить много информации о целевом веществе. Для проверки метода на практике ученые использовали растворы комплексов металла. К ионам кобальта добавили лиганды — вещества, прикрепленные к комплексообразующему металлу. При помощи ЯМР ученые определили спиновое состояние ионов металла и обнаружили, что в некоторых из соединений кобальта с органическими частицами-лигандами оно меняется под действием температуры. Результаты подтвердили, что с помощью спектроскопии ЯМР можно легко и быстро определять спиновое состояние ионов металла сразу в нескольких соединениях. Знать точную концентрацию изучаемого вещества при этом не нужно. Благодаря этому оказывается возможным за несколько часов получить информацию о соединении, в том числе о том, возможно ли переключить спиновое состояние с помощью внешних воздействий и обратим ли этот процесс.
Результаты подтвердили, что с помощью спектроскопии ЯМР можно легко и быстро определять спиновое состояние ионов металла сразу в нескольких соединениях. Знать точную концентрацию изучаемого вещества при этом не нужно. Благодаря этому оказывается возможным за несколько часов получить информацию о соединении, в том числе о том, возможно ли переключить спиновое состояние с помощью внешних воздействий и обратим ли этот процесс.
Теги
Президентская программа, Химия и материалы, Спецпроект, Молодежные группы
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Нахождение числа нейтронов, протонов и электронов в атоме
Репетитор
по физике
916 478 1032
П
Р
О
Г
Р
А
М
М
И
Р
О
В
А
Н
И
Е
Репетитор
916 478 1032
Репетитор
по физике
916 478 1032
Репетитор
по алгебре
916 478 1032
Репетитор
по физике
916 478 1032
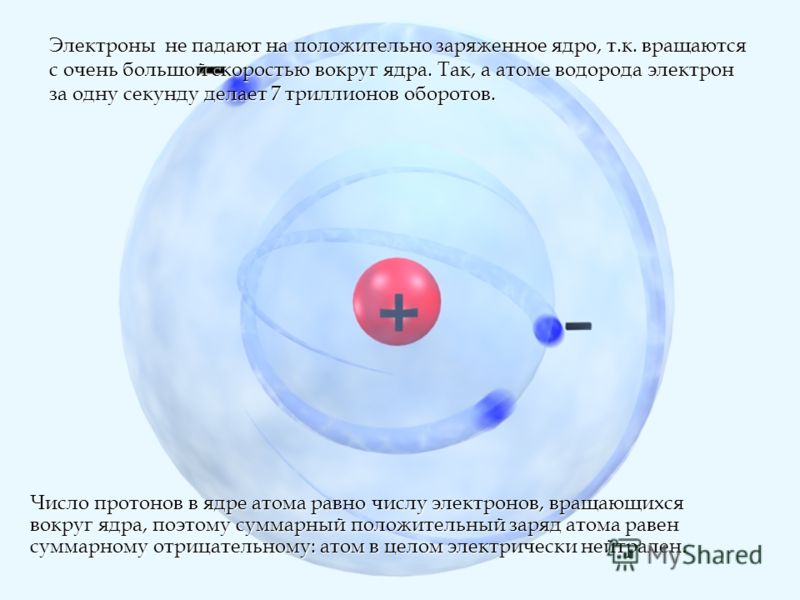
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
Количество нейтронов=1-1=0
В атоме водорода нет нейтронов
Модель атома водорода:
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
Количество нейтронов=4-2=2
В атоме гелия 2 нейтрона
Модель атома гелия:
Задача 1.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Показать ответ Показать решение Видеорешение
Ответ: 3 протона 3 электрона 4 нейтрона
Дано:
M=7
Z=3
Протонов 3
электронов 3
Нейтронов=M-Z=7-3=4
Ответ: 3 протона 3 электрона 4 нейтрона
Задача 2.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме углерода.
Показать ответ Показать решение Видеорешение
Ответ: 6 протонов 6 электронов 6 нейтронов
Дано:
M=12
Z=6
Протонов 6
электронов 6
Нейтронов=M-Z=12-6=6
Ответ: 6 протонов 6 электронов 6 нейтронов
Задача 3.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме азота.
Показать ответ Показать решение Видеорешение
Ответ: 7 протонов 7 электронов 7 нейтронов
Дано:
M=14
Z=7
Протонов 7
электронов 7
Нейтронов=M-Z=14-7=7
Ответ: 7 протонов 7 электронов 7 нейтронов
Задача 4.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме кислорода.
Атомную массу округлить до 16.
Показать ответ Показать решение Видеорешение
Ответ: 8 протонов 8 электронов 8 нейтронов
Дано:
M=16
Z=8
Протонов 8
электронов 8
Нейтронов=M-Z=16-8=8
Ответ: 8 протонов 8 электронов 8 нейтронов
Как мы видим в таблице Менделеева выше стоит порядковый номер, то есть заряд, который равен числу протонов
и электронов , а под ним расположена атомная масса.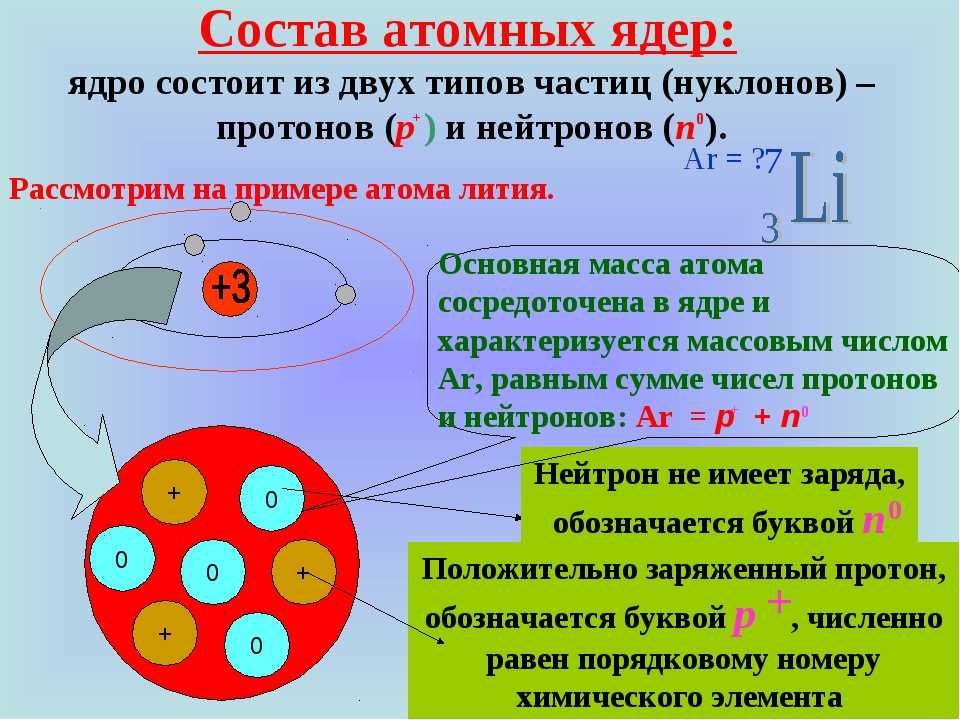 {18}\textrm{O} \)
{18}\textrm{O} \)
Структура атома
Структура атомаАтом и электромагнитное излучение
| Основные Субатомные частицы | Электромагнитный Радиация |
| Свет и другие формы электромагнитного излучения | |
Фундаментальный субатомный Частицы
| Частица | Символ | Оплата | Масса | |
| электрон | и — | -1 | 0,0005486 а.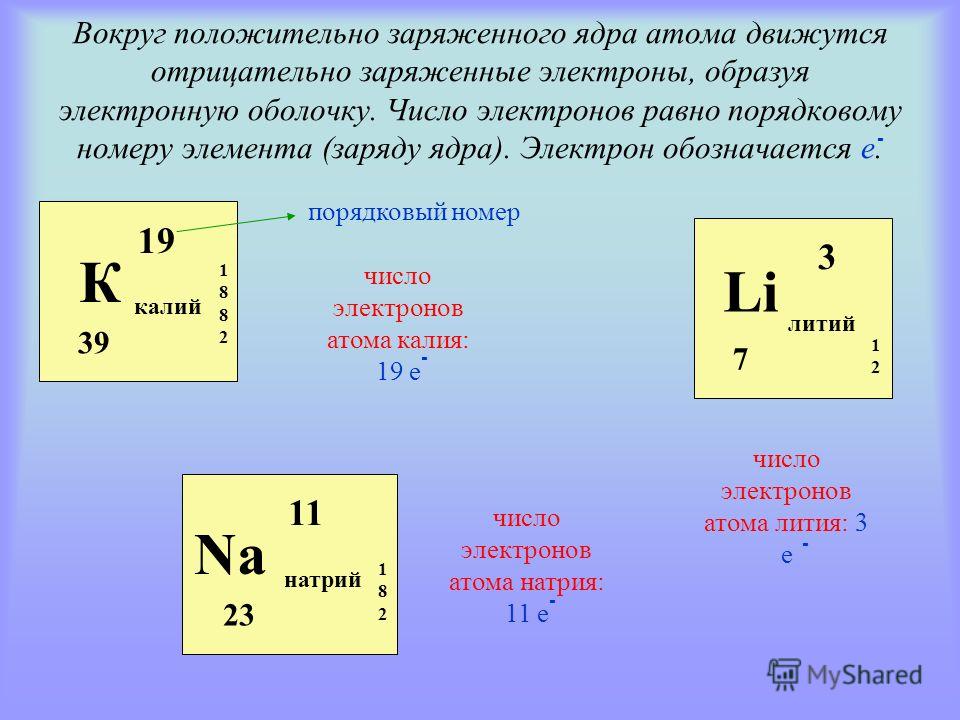 е.м. е.м. | |
| протон | р + | +1 | 1,007276 а.е.м. | |
| нейтрон | нет или | 0 | 1.008665 аму | |
Число протонов, нейтронов и электронов в атоме можно определить из набора простых правила.
- Число протонов в ядре атома равно равно атомному номеру ( Z ).
- Количество электронов в нейтральном атоме равно равно числу протонов.
- Массовое число атома ( M ) равно сумма числа протонов и нейтронов в ядро.
- Число нейтронов равно разности
между массовым числом атома ( M ) и
атомный номер ( Z ).

Примеры: Определим количество протонов, нейтронов, и электроны в следующих изотопах.
| 12 С | 13 С | 14 С | 14 Н |
Различные изотопы элемента идентифицируют, записывая массовое число атома в верхний левый угол символа элемента. 12 С, 13 C и 14 C изотопы углерода ( Z = 6) и, следовательно, содержат шесть протонов. Если атомы нейтральны, они также должны содержать шесть электронов. Единственный разница между этими изотопами в количестве нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6 нейтронов
13 C: 6 электронов, 6 протонов и 7 нейтронов
14 С: 6 электронов, 6 протонов и 8 нейтронов
Электромагнитный Радиация
Многое из того, что известно о строении электронов
в атоме было получено при изучении взаимодействия
между материей и различными формами электромагнитных
радиация . Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Частицы имеют определенную массу и занимают пространство. Волны не имеют массы, но несут энергию как они путешествуют по космосу. Помимо их способности несут энергию, волны имеют четыре другие характеристики свойства: скорость, частота, длина волны и амплитуда. Частота ( v ) количество волн (или циклов) на единицу время. Частота волны указывается в единицах циклов. в секунду (с -1 ) или герц (Гц).
Идеализированный рисунок волны на рисунке ниже иллюстрирует определения амплитуды и длины волны. Длина волны ( l ) — наименьшее расстояние между повторяющимися точками на волне. Амплитуда волны — это расстояние между самой высокой (или самой низкой) точкой волны и центр тяжести волны.
Если мы измерим частоту ( v ) волны в циклах
в секунду и длина волны ( l ) в метрах,
Произведение этих двух чисел выражается в метрах на
второй. Произведение частоты ( v ), умноженной на
длина волны ( l ) волны, следовательно, равна скорости ( с )
при котором волна распространяется в пространстве.
Произведение частоты ( v ), умноженной на
длина волны ( l ) волны, следовательно, равна скорости ( с )
при котором волна распространяется в пространстве.
вл = с
Легкие и прочие Формы электромагнитного излучения
Свет — это волна с электрическими и магнитными . составные части. Следовательно, это форма электромагнитных радиация .
Видимый свет содержит узкую полосу частот и
длины волн в части электромагнитного спектра
которые наши глаза могут обнаружить. Он включает в себя излучение с
длины волн от 400 нм (фиолетовый) до 700 нм (красный).
Поскольку это волна, свет преломляется, когда попадает в стекло.
призма. Когда белый свет фокусируется на призме, световые лучи
с разной длиной волны изгибаются на разную величину и
свет превращается в спектр цветов. Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Как видно из следующей диаграммы, энергия переносимый светом, увеличивается по мере того, как мы переходим от красного к синему через видимый спектр.
Поскольку длина волны электромагнитного излучения может быть до 40 м или до 10 -5 нм, видимый спектр составляет лишь малую часть всего диапазона электромагнитного излучения.
Электромагнитный спектр включает радио- и телеволны,
микроволны, инфракрасное излучение, видимый свет, ультрафиолет, рентгеновские лучи,
g-лучи и космические лучи, как показано на рисунке выше. Эти
различные формы излучения движутся со скоростью света
( с ). Однако они различаются по своей частоте и
длины волн. Произведение частоты на
длина волны электромагнитного излучения всегда равна
скорость света.
вл = с
В результате электромагнитное излучение то, что имеет большую длину волны, имеет низкую частоту, а излучение с высокой частотой имеет короткую длину волны.
Как найти, сколько протонов, нейтронов и электронов содержится в изотопах
Обновлено 10 мая 2018 г.
Автор: Karen G Blaettler
Материя бывает разных размеров, форм и цветов. Рассмотрим хлор, желтоватый газ, или свинец, серо-черное твердое вещество, или ртуть, серебристую жидкость. Три совершенно разных элемента, каждый из которых состоит из атомов только одного типа. Различия в материи сводятся к мельчайшим различиям в строении атомов.
TL;DR (слишком длинно, не читал)
Поймите, что изотопы элемента имеют разные массовые числа, но одинаковое количество протонов. Используя периодическую таблицу, найдите атомный номер элемента. Атомный номер равен количеству протонов. В сбалансированном атоме количество электронов равно количеству протонов. В несбалансированном атоме количество электронов равно количеству протонов плюс заряд, противоположный заряду иона. Рассчитайте количество нейтронов, вычитая атомный номер из массового числа. Если массовое число конкретного изотопа неизвестно, используйте атомную массу из Периодической таблицы, округленную до ближайшего целого числа, минус атомный номер, чтобы найти среднее число нейтронов для элемента.
В сбалансированном атоме количество электронов равно количеству протонов. В несбалансированном атоме количество электронов равно количеству протонов плюс заряд, противоположный заряду иона. Рассчитайте количество нейтронов, вычитая атомный номер из массового числа. Если массовое число конкретного изотопа неизвестно, используйте атомную массу из Периодической таблицы, округленную до ближайшего целого числа, минус атомный номер, чтобы найти среднее число нейтронов для элемента.
Структура атомов
Каждый атом состоит из трех основных частиц. Протоны и нейтроны группируются в ядре в центре атома. Электроны образуют вращающееся облако вокруг ядра. Протоны и нейтроны составляют массу атомов. Электроны, крошечные по сравнению с протонами и нейтронами, вносят очень небольшой вклад в общую массу атомов.
Атомы и изотопы
Атомы одного и того же элемента имеют одинаковое количество протонов. Все атомы меди имеют 29 протонов. Все атомы гелия имеют 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку количество протонов элемента не меняется, разница в массе возникает из-за разного количества нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 имеет 29протонов и массовое число 63. Медь-65 имеет 29 протонов и массовое число 65. Гелий имеет 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который все еще имеет 2 протона, но имеет массовое число 3.
Все атомы гелия имеют 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку количество протонов элемента не меняется, разница в массе возникает из-за разного количества нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 имеет 29протонов и массовое число 63. Медь-65 имеет 29 протонов и массовое число 65. Гелий имеет 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который все еще имеет 2 протона, но имеет массовое число 3.
Один из способов записи формулы изотопа показывает название элемента или символ, за которым следует массовое число, например, гелий-4 или He-4. Другая сокращенная идентификация изотопов показывает массовое число в виде верхнего индекса и атомный номер в виде нижнего индекса, оба показаны перед атомным символом. Например, 4 2 Он указывает на изотоп гелия с массовым числом 4.
Периодическая таблица элементов
Расположение Периодической таблицы элементов дает важную информацию для определения количества протонов, нейтронов и электронов в атомах. В современной периодической таблице элементы располагаются в порядке их протонов. Первый элемент в таблице, водород, имеет один протон. Последний элемент (по крайней мере, на данный момент) в таблице, Оганессон или Унуноктий, имеет 118 протонов.
В современной периодической таблице элементы располагаются в порядке их протонов. Первый элемент в таблице, водород, имеет один протон. Последний элемент (по крайней мере, на данный момент) в таблице, Оганессон или Унуноктий, имеет 118 протонов.
Сколько протонов?
Атомный номер в Периодической таблице определяет количество протонов в любом атоме этого элемента. Медь, атомный номер 29, имеет 29 протонов. Нахождение атомного номера элемента показывает количество протонов.
Сколько нейтронов?
Разница между изотопами элемента зависит от количества нейтронов. Чтобы найти число нейтронов в изотопе, найдите массовое число изотопа и атомный номер. Атомный номер или количество протонов находится в периодической таблице. Атомная масса, также указанная в Периодической таблице, представляет собой средневзвешенное значение всех изотопов элемента. Если изотоп не идентифицирован, атомную массу можно округлить до ближайшего целого числа и использовать для нахождения среднего числа нейтронов.
Например, атомная масса ртути равна 200,592. Ртуть имеет несколько изотопов с массовыми числами в диапазоне от 196 до 204. Используя среднюю атомную массу, рассчитайте среднее количество нейтронов, сначала округлив атомную массу от 200,592 до 201. Теперь вычтите количество протонов, 80, из атомной массы. , 201-80, чтобы найти среднее число нейтронов, 121.
Если известно массовое число изотопа, можно вычислить фактическое число нейтронов. Используйте ту же формулу, массовое число минус атомный номер, чтобы вычислить количество нейтронов. В случае ртути наиболее распространенным изотопом является ртуть-202. Используйте уравнение 202-80=122, чтобы найти, что ртуть-202 имеет 122 нейтрона.
Сколько электронов?
Нейтральный изотоп не имеет заряда, а это означает, что положительный и отрицательный заряды уравновешиваются в нейтральном изотопе. В нейтральном изотопе количество электронов равно количеству протонов. Как и для определения количества протонов, для определения количества электронов в нейтральном изотопе требуется найти атомный номер элемента.
В ионах, изотопах с положительным или отрицательным зарядом, количество протонов не равно количеству электронов. Если протонов больше, чем электронов, то изотоп имеет больше положительных зарядов, чем отрицательных. Другими словами, количество протонов превышает количество электронов на столько же, сколько и положительный заряд. Если количество электронов превышает количество протонов, заряд иона будет отрицательным. Чтобы найти количество электронов, прибавьте к количеству протонов противоположное дисбалансу зарядов.
Например, если изотоп имеет заряд -3, как у фосфора (атомный номер 15), то число электронов на три больше числа протонов. Расчет количества электронов тогда становится 15+(-1)(-3) или 15+3=18, или 18 электронов. Если изотоп имеет заряд +2, как у стронция (атомный номер 38), то число электронов на два меньше числа протонов. В этом случае вычисление становится 38+(-1)(+2)=38-2=36, поэтому ион имеет 36 электронов. Обычное сокращение для ионов показывает дисбаланс заряда в виде надстрочного индекса, следующего за символом атома. В примере с фосфором ион будет записан как P -3 .
В примере с фосфором ион будет записан как P -3 .
Калькулятор атомов
Создано Анной Павлик, докторантом
Рассмотрение Богной Шик и Аденой Бенн
Последнее обновление: 16 июля 2022 г.
Содержание:- Что такое атом?
- Атомный номер, атомная масса
- Уравнения, используемые для расчета количества протонов, нейтронов, электронов, атомной массы и атомного заряда
- Как вычислить атомный номер, массу и заряд расчет атомного номера и массового числа по количеству компонентов атома — протонов, нейтронов и электронов (или наоборот). Кроме того, вы можете определить заряд ионов с известными числами протонов и электронов. Эта статья предоставит вам:
- Определения:
- Атом;
- Компоненты атома;
- Атомный номер; и
- Массовый номер.
- Уравнения, используемые для расчета количества:
- Протоны;
- нейтронов;
- электронов;
- Атомный номер;
- Атомная масса и
- Атомный заряд.

- Наконец, краткое пошаговое руководство по расчету:
- Атомный номер;
- Атомная масса; и
- Плата.
Что такое атом?
🙋 Атом — наименьшая составная единица материи, сохраняющая свойства элемента.
Типичный атом состоит из ядер и электронных облаков . Компоненты атома — это положительно заряженные протона и электрически нейтральные нейтрона в ядре с отрицательно заряженными электронами , вращающимися вокруг этого ядра. Протоны и нейтроны называются нуклонами.
Атомы электрически нейтральны, потому что они содержат одинаковое количество электронов и протонов. Однако, когда атом имеет неравное количество протонов и электронов, он имеет электрический заряд и создает ионов .
🙋 Если ион имеет больше протонов, чем электронов, то он положительно заряжен и называется катионом .
 И наоборот, если ион имеет больше электронов, чем протонов, он заряжен отрицательно и называется .0003 анион .
И наоборот, если ион имеет больше электронов, чем протонов, он заряжен отрицательно и называется .0003 анион .Некоторые атомы могут разделяться на более мелкие части (более легкие ядра). Вы можете использовать наш калькулятор полураспада, чтобы рассчитать количество ядер, оставшихся после определенного времени.
Атомный номер, атомная масса
Атом однозначно идентифицируется атомным символом
Z. Атомный номер – это количество протонов, присутствующих в ядре. В случае незаряженных атомов атомный номер равен числу электронов.Напротив, в ионах, количество электронов — это разница между атомным номером и зарядом ионов.
В катионах электронов меньше, чем протонов, а в анионах электронов больше, чем протонов.
Однако количество нейтронов в данном элементе может варьироваться. Варианты одного и того же химического элемента с разным числом нейтронов называются изотопами.
 Протоны и нейтроны определяют массу атома. Символ массового числа
Протоны и нейтроны определяют массу атома. Символ массового числа A— это сумма количества протонов и нейтронов.Очень важно знать число атомов, составляющих молекулу, так как оно служит основой для многих оценок, таких как степень ненасыщенности. Он предоставляет информацию о структуре молекулы.
Уравнения, используемые для расчета числа протонов, нейтронов, электронов, атомной массы и атомного заряда
Если вы знаете атомный номер (
Z), атомную массу (A) и заряд (z), вы можете рассчитать количество протонов (p), нейтронов (n) и электронов (e), используя данные математические уравнения 1-3:р = Zн = А - Яе = Z - Z
С другой стороны, если вы знаете количество протонов (
p), нейтронов (n) и электронов (e), вы можете рассчитать атомный номер (Z), атомную массу (A) и заряд (z), используя уравнения 4-6:Z = рА = p + nг = р - е
Как рассчитать атомный номер, массу и заряд
Выберите свой элемент.
 Предположим, что это атом натрия (
Предположим, что это атом натрия ( №). Стоимость0.Найдите атомный номер (
Z) и массовое число (A). Они равны11и23соответственно.Рассчитайте количество протонов, нейтронов и электронов, используя математические выражения (1-3):
p = 11(1)n = 23 - 11 = 12(2)е = 11 - 0 = 11(3)Кроме того, вы также можете рассчитать атомный номер, атомную массу и заряд.
Выберите свой элемент. Предположим, что это сульфид-анион.
Найдите количество протонов, нейтронов и электронов. Они равны
16,16и18соответственно.Рассчитайте атомный номер, атомную массу и заряд, используя математические выражения (4-6):
Z = 16(4)А = 16 + 16 = 32(5)г = 16 - 18 = -2(6)
Конечно, вам не обязательно выполнять все эти расчеты вручную! Введите любые три значения в этот атомный калькулятор и посмотрите, как он сделает всю работу за вас.

Полезен ли вам этот калькулятор? У нас также есть калькулятор массовых процентов, который может вас заинтересовать.
Анна Павлик, кандидат технических наук
Атомный номер
Массовый номер
Заряд
Атомная состав
Количество протонов
Количество нейтронов
Количество электронов
Проверьте 38 аналогичные стехиометрии и растворы. Калькуляторы 🧪
Фактический доход. Как рассчитать формальный заряд
Чтобы рассчитать формальный заряд атома, мы начнем с:
- оценивая число валентных электрона (VE) имеет нейтральных атомов (например, 3 для бора, 4 для углерода, 5 для азота и т. д.). (примечание: это также эквивалентно эффективному заряду ядра Z eff , количеству протонов, которые электрон на валентной орбитали «видит» из-за экранирования электронами внутренних оболочек.)
- считая число несвязанные валентные электроны (NBE) на атоме.
 Каждая неподеленная пара считается как 2 , а каждый неспаренный электрон считается как 1.
Каждая неподеленная пара считается как 2 , а каждый неспаренный электрон считается как 1. - подсчитав количество связей (B) в атоме, или, альтернативно, подсчитав количество электронов связи и , разделив это число на 2 .
Формальный сбор FC затем рассчитывается путем вычитания NBE и B из VE .
FC = VE – (NBE + B)
, что эквивалентно
FC = VE – NBE – B
Расчет довольно прост если вам предоставлена вся информация. Однако, для краткости, есть много случаев, когда неподеленных пары и связи C-H являются явно не вытянутыми .
Таким образом, часть трюка для вас будет состоять в том, чтобы рассчитать формальную плату в ситуациях, когда вы должны учитывать неявных одиночных пар и связей C-H.

В статье ниже мы рассмотрим многие из этих ситуаций. Мы также предупредим вас о ситуациях, когда вычисленный формальный заряд атома не обязательно является хорошим ключом к его реактивность , что чрезвычайно важно в будущем.
СОДЕРЖАНИЕ
- Формальный заряд
- Простые примеры для элементов первого ряда
- Формальные расчеты заряда. Стрелки
- Галогены
- Вывод
- Примечания
- Проверь себя!
- (дополнительно) Ссылки и дополнительная литература
1. Формальное начисление
Формальное начисление бухгалтерский учет формализм для присвоения заряда конкретному атому.
Для получения формального заряда атома начнем с подсчета числа валентных электронов [Примечание 1] для нейтрального атома , а затем вычтем из него число электронов, которыми он « владеет » ( т.
 е. электроны в неподеленных парах или одиночно занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно количеству связей )
е. электроны в неподеленных парах или одиночно занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно количеству связей )FC = VE – NBE – B
где
- VE соответствует числу электронов вокруг нейтрального атома (3 для кислорода, 6 для азота, 4 для азота , 7 для фтора)
- NBE соответствует количеству несвязанных электронов вокруг атома (2 для неподеленной пары, 1 для одиночной занятой орбитали, 0 для пустой орбитали) связывает вокруг атома (эквивалентно половине числа связывающих электронов)
Это называется « формальный » заряд, поскольку предполагается, что все связывающие электроны поровну . Он не учитывает различия в электроотрицательности (т.
 е. диполи).
е. диполи).По этой причине формальный заряд не всегда является хорошим показателем того, где на самом деле или электронов в молекуле, и может быть ненадежным показателем реактивности. Мы еще поговорим об этом ниже.
2. Простые примеры для элементов первого ряда
Когда для вас вытянуты все неподеленные пары, вычислить формальную плату довольно просто.
Давайте рассмотрим первый пример викторины ниже.
- В ион гидроксония (H 3 O) центральный атом кислород , который имеет 6 валентных электронов в нейтральном атоме
- Центральный атом имеет 2 неспаренных электронов и 3 связей
- Формальный заряд кислорода 903 [6 – 9003 2 – 3 = +1 ] дает нам H 3 O +
Посмотрите, можете ли вы заполнить остальные для примеров ниже.
Если все прошло хорошо, вы можете попробовать заполнить формальные расходы для всех примеров в этой таблице.

Потребуется некоторое время, чтобы привыкнуть к формальному заряду, но через некоторое время будет предполагается , что вы понимаете, как вычислять формальный заряд, и что вы можете распознавать структуры, в которых атомы будут иметь формальный заряд.
Давайте рассмотрим более сложные случаи.
3. Формальные расчеты расходов, когда вам не известны все детали
Когда мы рисуем фигурку человека и не рисуем его пальцы, это не значит, что мы рисуем кого-то, у кого была плохой день работы с настольной пилой . Мы просто предполагаем , что вы могли бы вставить пальцы, если бы вам это действительно нужно, но вы пропускаете это, чтобы сэкономить время.
Чертежи химических линий похожи на фигурки из палочек. Они опускают много деталей, но все же предполагают, что вы знаете, что там есть определенные вещи.
- С углеродом мы часто опускаем рисование водорода . Вы по-прежнему должны знать, что они там есть, и добавлять столько водородов, сколько необходимо, чтобы получить полный октет (или секстет, если это карбокатион).

- Если на углероде есть неподеленная пара или неспаренный электрон, он всегда рисуется в .
Одно примечание. Если мы нарисуем фигурку, и мы делаем нарисуем пальцы, и потратим время только на то, чтобы нарисовать только 3 , то мы можем с уверенностью предположить, что у человека действительно только 3 пальца . Таким образом, в последних двух примерах этого теста нам пришлось рисовать водороды, чтобы вы знали, что это карбокатион, иначе вам пришлось бы предположить, что у него есть полный октет!
Кислород и азот (и галогены) рассматриваются несколько иначе.
- Связи с водородом всегда втягиваются.
- неподеленные пары , которые часто опускаются.
- Азот и кислород всегда имеют полные октеты. Всегда. [Примечание 2 – ОК, два исключения ]
Таким образом, даже если одинокие пары не нарисованы, предполагает, что их достаточно для создания полного октета .
 А когда связей этих атомов с водородом отсутствует , это означает именно то, что кажется: водорода на самом деле нет!
А когда связей этих атомов с водородом отсутствует , это означает именно то, что кажется: водорода на самом деле нет!Попробуйте эти примеры:
Теперь посмотрите, сможете ли вы собрать эти примеры вместе!
(Обратите внимание, что некоторые из них не являются стабильными молекулами, а вместо этого представляют собой — это резонансных форм, с которыми вы столкнетесь в различные моменты курса!)
точно такая же формула формального заряда, приведенная выше, вместе с правилами для неявных неподеленных пар и водородов, чтобы выяснить формальный заряд атомов в некоторых довольно экзотических молекулах.
Вот несколько классических формальных задач начисления.
Обратите внимание: хотя структура может выглядеть странно, формальная формула оплаты остается прежней.
Формула формального начисления может быть применена даже к некоторым довольно экзотическим реакционноспособным промежуточным продуктам, с которыми мы познакомимся позже в этом семестре.

Не пугайтесь. Просто посчитайте электроны и связи, и это приведет вас к правильному ответу.
5. Формальные заряды и изогнутые стрелки
Мы используем изогнутые стрелки, чтобы показать движение электронных пар в реакциях и в резонансных структурах. ( См. сообщение: Изогнутые стрелки для реакций )
Например, вот изогнутая стрелка, которая показывает реакцию гидроксид-иона HO(-) с протоном (H+).
Стрелка показывает перемещение двух электронов от кислорода с образованием новой связи O–H .
Изогнутые стрелки также полезны для отслеживания изменений в официальном обвинении. Обратите внимание, что формальный заряд на начальном конце изогнутой стрелки (кислород) становится на более положительным (от -1 до 0), а формальный заряд в конце хвоста (H+) становится на более отрицательным (от +1 до 0).
При добавлении кислоты к воде образуется ион гидроксония H 3 O + .

Вот викторина. Посмотрите, сможете ли вы нарисовать изогнутую стрелку, идущую от иона гидроксида к H 3 O+.
Если вам это удалось – поздравляем!
Но я готов поспорить, что по крайней мере небольшой процент из вас нарисовал стрелку, идущую к положительно заряженный кислород .
Что в этом не так?
На кислороде нет пустой орбитали, которая могла бы принять неподеленную пару. Если вы будете следовать логике изогнутых стрелок, это приведет к новой связи O–O и 10 электронам на кислороде, что нарушит правило октета.
Подождите минутку, скажете вы. « Я думал, что кислород заряжен положительно? I f он не реагирует на кислород, где он должен реагировать ?»
На водороды! Н 3 O+ — это кислота Бренстеда, в конце концов. Верно?
Это отличная иллюстрация того, почему это называется « формальный заряд », и почему формальный заряд не то же самое, что электростатический заряд (также известный как «частичные заряды» или «электронная плотность»).

Формальное обвинение — это, в конечном счете, бухгалтерский формализм, немного похожий на присвоение «выигрыша» одному из 5 питчеров в бейсбольном матче. [Примечание 3] Не учитывается тот факт, что электроны в кислородно-водородной связи распределены неравномерно, с существенным диполем.
Таким образом, хотя мы рисуем «формальный» заряд кислорода, все частичные положительные заряды принадлежат водороду. Несмотря на формальный положительный заряд , несет частично отрицательный электростатический заряд.
Вот почему такие основания, как HO(-), реагируют на H, а не на кислород.
Просто повторюсь:
- Положительные заряды на кислорода и азота не представляют собой пустую орбиталь. Предположим, что кислород и азот имеют полные октеты! [Примечание 2]
- Напротив, положительные заряды углерода с по представляют собой пустые орбитали.

6. Галогены
Положительные формальные обвинения в отношении галогенов делятся на две основные категории.
Мы часто изображаем ионов галония Cl+ , Br+ и I+ как вещества с шестью валентными электронами и пустой орбиталью ( , но никогда F+ – это хищный зверь )
Можно думать об этих видах как несущий пустую орбиту , так как они большие и относительно поляризуемые . Они могут распределять положительный заряд по своему относительно большому объему.
Эти виды могут принимать неподеленную пару электронов от основания Льюиса, что приводит к полному октету.
Cl, Br и I также могут нести положительный формальный заряд в результате связи с двумя атомами.
В этих случаях важно понимать, что галоген имеет полный октет , а не пустую орбиталь. Поэтому они не будут напрямую принимать пару электронов от оснований Льюиса; часто бывает так, что атом рядом с галогеном принимает электроны.

7. Заключение
Если вы дошли до конца и выполнили все тесты, вы должны быть хорошо подготовлены ко всем примерам формального обвинения, которые вы увидите в остальной части курса.
- Формальный заряд можно рассчитать по формуле FC = VE – NBE – B
- На чертежах часто не показаны неподеленные пары и связи C-H. Будьте внимательны к этим ситуациям при расчете формальных сборов.
- Положительно заряженный углерод имеет пустую орбиталь, но предположим, что положительно заряженный азот и кислород имеют полные октеты.
- Пример иона гидроксония H 3 O+ показывает опасность использования формального заряда для понимания реакционной способности. Обратите особое внимание на различия в электроотрицательности между атомами и вытяните диполи, чтобы получить истинное представление об их реакционной способности.
ПримечанияСвязанные статьи
- Как использовать электроотрицательность для определения плотности электронов (и почему НЕ доверять формальному заряду)
- Частичные заряды дают подсказки о потоке электронов
- Как применять электроотрицательность и резонанс для понимания реакционной способности Формальные победы»?
Примечание 1.
 Используя «валентные электроны», вы получите правильный ответ. Но если подумать, то это не совсем понятно. Откуда берутся положительные заряды? С положительно заряженных протона в ядре, конечно!
Используя «валентные электроны», вы получите правильный ответ. Но если подумать, то это не совсем понятно. Откуда берутся положительные заряды? С положительно заряженных протона в ядре, конечно!Таким образом, «валентные электроны» в этом уравнении правильнее рассматривать как заменитель валентных протонов — это другой способ сказать « эффективный ядерный заряд» ; заряд, ощущаемый каждым валентным электроном от ядра, не считая заполненных внутренних оболочек.
Примечание 2. Нитрены являются исключением. Другим исключением является случай, когда мы хотим нарисовать плохих резонансных форм.
Примечание 3 . В бейсболе каждая игра заканчивается победой или поражением команды . Еще во времена Старого Хосса Рэдборна, когда полные игры были нормой, логичным продолжением этого было присуждение победы отдельным питчерам из .
 В сегодняшнюю эпоху, когда есть несколько запасных питчеров, существуют правила для определения того, какой питчер получит победу. Вполне возможно, что питчер полностью разлетится на насыпи, и все же, благодаря случайному стечению обстоятельств, ему все равно будет засчитана победа. См. публикацию: Может быть, они должны называть их «формальными победами»?
В сегодняшнюю эпоху, когда есть несколько запасных питчеров, существуют правила для определения того, какой питчер получит победу. Вполне возможно, что питчер полностью разлетится на насыпи, и все же, благодаря случайному стечению обстоятельств, ему все равно будет засчитана победа. См. публикацию: Может быть, они должны называть их «формальными победами»? Таким же образом кислороду присваивается индивидуальный заряд +1 на ионе гидроксония , H 3 O+, хотя фактический положительный электростатический заряд распределяется между атомами водорода.
Примечание 4. Это изображение из предыдущего воплощения этого поста демонстрирует некоторые соотношения для геометрии различных соединений элементов первого ряда.
Проверьте себя! (расширенный) Ссылки и дополнительная литература1. Валентность, число окисления и формальный заряд: три взаимосвязанных, но принципиально разных понятия
Gerard Parkin
Journal of Chemical Education7 90 , 791
DOI : 10. 1021/ed083p791
1021/ed083p7912. Структуры Льюиса, формальный заряд и степени окисления: более удобный подход
Джон Э. Пакер и Шейла Д. Вудгейт
Журнал химического образования 1991 68 (6), 456
DOI : 10.1021/ED068P456: 10.1021/ED068P456
how?
Мельчайшими частицами веществ являются атомарные частицы. После эволюции научных исследований доказано, что мельчайшие частицы называются субатомными частицами. Существует три типа субатомных частиц. Это протоны, электроны и нейтроны. Их количество, реакционная способность и свойства определяют поведение вещества. Если вы хотите найти свойства элемента, вам нужно знать количество частиц, присутствующих в компоненте. Давайте выясним методы расчета количества субатомных частиц, присутствующих в веществе.
Найти количество частиц не так уж и сложно. Иногда нужно заглянуть в периодическую таблицу. И ответ будет там.
 Не знаете, как найти их в таблице Менделеева? Позвольте мне показать вам шаги, чтобы узнать количество субатомных частиц.
Не знаете, как найти их в таблице Менделеева? Позвольте мне показать вам шаги, чтобы узнать количество субатомных частиц.Сначала получите правильно структурированную периодическую таблицу. В таблице элементы изначально организованы по их атомарной структуре. На столе ищите свой компонент. Таблица в основном разделена на три группы: металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами.
Найдя элемент, найдите его атомный номер. Вы можете найти его в верхнем левом углу квадрата, расположенного над символом элемента. Атомный номер говорит вам о количестве протонов, присутствующих в атоме. Например, возьмем случай бора (B). Ядерное число бора равно 5. Таким образом, количество протонов, присутствующих в атоме бора, равно 5.
Теперь давайте перейдем к части электрона. Протоны несут положительный заряд, в то время как частицы двигаются больше отрицательного заряда. Таким образом, для нейтрального атома количество протонов равно количеству частиц.
 Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если ядерно-ядерный заряд имеет высокий заряд (может быть положительным или отрицательным), считается, что он находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если ядерно-ядерный заряд имеет высокий заряд (может быть положительным или отрицательным), считается, что он находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.Чтобы узнать количество нейтронов в атоме, вам нужно сначала узнать его атомную массу. Как видим масса электрона тока-тока в молекуле-молекуле ничтожно мала. Таким образом, масса атома полностью зависит от количества присутствующих протонов и нейтронов. Итак, если вы знаете число протонов частицы и ее атомную массу, то подставьте число протонов из атомной массы. Результат, который вы получили, — это количество нейтронов, присутствующих в молекуле-молекуле.
Если у вас есть ион и вы хотите проверить количество электронов и протонов в нем, сначала определите суммарный заряд атома. Атом переходит в свою ионную форму только путем добавления или вычитания частиц.
 Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставьте номер протона из общего заряда молекулы-молекулы. Результат, который вы получили, будет числом электронов.
Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставьте номер протона из общего заряда молекулы-молекулы. Результат, который вы получили, будет числом электронов.Надеюсь, у вас есть четкое представление о субатомных частицах (таких как протон, электрон и нейтрон) и о том, как их считать.
Мельчайшими частицами веществ являются атомарные частицы. После эволюции научных исследований доказано, что мельчайшие частицы называются субатомными частицами. Существует три типа субатомных частиц. Это протоны, электроны и нейтроны. Их количество, реакционная способность и свойства определяют поведение вещества. Если вы хотите найти свойства элемента, вам нужно знать количество частиц, присутствующих в компоненте. Давайте выясним методы расчета количества субатомных частиц, присутствующих в веществе.

Найти количество частиц не так уж и сложно. Иногда нужно заглянуть в периодическую таблицу. И ответ будет там. Не знаете, как найти их в таблице Менделеева? Позвольте мне показать вам шаги, чтобы узнать количество субатомных частиц.
Сначала получите правильно структурированную периодическую таблицу. В таблице элементы изначально организованы по их атомарной структуре. На столе ищите свой компонент. Таблица в основном разделена на три группы: металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами.
Найдя элемент, найдите его атомный номер. Вы можете найти его в верхнем левом углу квадрата, расположенного над символом элемента. Атомный номер говорит вам о количестве протонов, присутствующих в атоме. Например, возьмем случай бора (B). Ядерно-ядерное число бора равно 5. Таким образом, количество протонов, присутствующих в атоме бора, равно 5.
Теперь давайте перейдем к части электрона.
 Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.Чтобы узнать количество нейтронов в атоме, вам нужно сначала узнать его атомную массу. Как видим, масса электрона тока в молекуле ничтожно мала. Таким образом, масса атома полностью зависит от количества присутствующих протонов и нейтронов. Итак, если вы знаете число протонов частицы и ее атомную массу, то подставьте число протонов из атомной массы. Результат, который вы получили, — это количество нейтронов, присутствующих в атоме.
Если у вас есть ион и вы хотите проверить количество электронов и протонов в нем, сначала определите суммарный заряд атома.
 Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов. Таблица в основном разделена на три группы, то есть металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами.
Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов. Таблица в основном разделена на три группы, то есть металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами.Найдя элемент, найдите его атомный номер. Вы можете найти его в верхнем левом углу квадрата, расположенного над символом элемента. Атомный номер говорит вам о количестве протонов, присутствующих в атоме. Например, возьмем случай бора (B). Ядерно-ядерное число бора равно 5. Таким образом, количество протонов, присутствующих в атоме бора, равно 5.
Теперь давайте перейдем к части электрона.
 Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.Чтобы узнать количество нейтронов в атоме, вам нужно сначала узнать его атомную массу. Как видим, масса электрона тока в молекуле ничтожно мала. Таким образом, масса атома полностью зависит от количества присутствующих протонов и нейтронов. Итак, если вы знаете число протонов частицы и ее атомную массу, то подставьте число протонов из атомной массы. Результат, который вы получили, — это количество нейтронов, присутствующих в атоме.
Если у вас есть ион и вы хотите проверить количество электронов и протонов в нем, сначала определите суммарный заряд атома.
 Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов.
Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов.Конфигурации электронов: обязательный лайфхак
Представьте себе… вы сдаете промежуточный экзамен по общей химии и решили сначала сдать экзамен и выполнить все сложные задания. Вы совершенно недооценили, сколько времени эти задачи отнимут у вас, и теперь у вас осталось три минуты, чтобы записать электронную конфигурацию 10 элементов. Без учета времени это было бы легко сделать. Это систематично и просто, но все же требует приличного количества размышлений, основанных на том, как вас учили это делать. Ваши ладони становятся потными. Это должны быть простые пункты, и есть вероятность, что вы не выполните их.
 Если вы закончите его, есть вероятность, что вы ошибетесь, потому что торопитесь. В этот момент ваше горло сжимается. Вы пытаетесь вспомнить, были ли вы уверены в других вопросах, которые вы уже задали, задаваясь вопросом, можете ли вы позволить себе потерять эти простые пункты перед вами. Ваш учитель объявляет, что до начала сбора экзаменов есть еще две минуты.
Если вы закончите его, есть вероятность, что вы ошибетесь, потому что торопитесь. В этот момент ваше горло сжимается. Вы пытаетесь вспомнить, были ли вы уверены в других вопросах, которые вы уже задали, задаваясь вопросом, можете ли вы позволить себе потерять эти простые пункты перед вами. Ваш учитель объявляет, что до начала сбора экзаменов есть еще две минуты.Что, если я скажу вам, что существует более быстрый и безупречный способ определения электронных конфигураций?
Как вы знаете, протоны и нейтроны находятся в ядре атома. Ядро находится в центре атома; поэтому протоны и нейтроны легко обнаружить.
Поскольку электроны не находятся в ядре, они могут быть буквально где угодно, потому что ядро занимает лишь небольшое пространство, которое кажется огромным пространством для покрытия. Таким образом, найти электрон может быть довольно сложно. Это как искать иголку в стоге сена. Зачем нам искать электроны? Потому что электроны — самый ценный игрок химии. Короче говоря, они являются причиной того, что атомы могут взаимодействовать с другими атомами.

Электроны можно найти на орбиталях, в области пространства вокруг ядра, где существует высокая (90 %) вероятность обнаружения электрона. Орбитали — это не точное место, а скорее область, включающая это точное место.
Электронная оболочка или энергетический уровень представляет собой совокупность орбиталей, находящихся на одинаковом вероятном расстоянии от ядра. В каждой оболочке есть одна или несколько подоболочек. Внутри каждой подоболочки находится одна или несколько орбиталей. Каждая орбиталь содержит два электрона.
Таблица Менделеева состоит из элементов, все из которых являются многоэлектронными атомами (кроме водорода, конечно). Электронная конфигурация говорит нам, как эти электроны распределяются между различными атомными орбиталями. Они в обязательном порядке появляются на экзаменах по общей химии.
Обычный способ определения электронной конфигурацииКак упоминалось ранее, электронная конфигурация представляет собой определенное распределение электронов среди доступных орбиталей.
 В нем последовательно перечислены орбитальные символы с надстрочным индексом, указывающим количество электронов, занимающих эту орбиталь. В нейтральном элементе количество протонов равно количеству электронов. Чем больше у элемента электронов, тем больше орбиталей он должен заполнить.
В нем последовательно перечислены орбитальные символы с надстрочным индексом, указывающим количество электронов, занимающих эту орбиталь. В нейтральном элементе количество протонов равно количеству электронов. Чем больше у элемента электронов, тем больше орбиталей он должен заполнить.При записи электронных конфигураций необходимо соблюдать несколько правил. Здесь они рассматриваться не будут. Я упоминаю их, чтобы подчеркнуть тот факт, что существует определенный порядок заполнения орбиталей:
Это средство запоминания, которое видел каждый, кто когда-либо изучал общую химию. Следуйте по диагоналям последовательно, от хвоста к голове. Помните, что s получает два электрона, p получает шесть электронов, d получает 10 электронов, а f получает 14 электронов. Но я здесь не для того, чтобы научить вас пользоваться этим традиционным методом. Я здесь, чтобы сказать вам, что с этим не так:
- Вы должны запомнить эту память, диагонали и все такое.
- Вы должны вести точный подсчет электронов, которые вы использовали до сих пор, чтобы не превысить количество электронов в элементе, над которым вы работаете.

- Вы должны помнить, сколько электронов помещается в каждую подоболочку (s, p, d, f).
- Это занимает много времени, особенно когда у элемента больше 20 электронов.
На картинке выше показано решение всех ваших проблем с электронной конфигурацией. Это периодическая таблица, размеченная блоками. Обратите внимание, что для блока d коэффициент или число впереди всегда на единицу меньше, чем в строке, в которой он находится. Для блока f коэффициент всегда на два меньше, чем в строке, в которой он находится. Вам нужно запомнить это. . Когда дело доходит до общей химии, всегда будут вещи, которые вам просто нужно запомнить. Даже хаки требуют некоторой работы мозга. Но помимо маркировки чистой периодической таблицы, когда вы получаете ее в день теста, как вы видите выше, это буквально все. Итак, как вы его используете?
Шаг 1: Разметьте таблицу периодов блоками.

Шаг 2: Определите интересующий элемент в периодической таблице и обведите его кружком
Шаг 3: Найдите водород в качестве отправной точки
Шаг 4: Скользите по каждой строке слева направо и сверху вниз, записывая электронную конфигурацию, пока не доберетесь до своего элемента.
Ge: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2
- Не переходите к следующему ряду, пока не закончите ряд над ним.
- Подсчитайте количество элементов, которые вы проходите для каждого блока. Это ваш верхний индекс.
- Когда блок d наконец будет включен, помните, что его коэффициент на единицу меньше, чем у строки, в которой он фактически находится. Если вы заранее пометили, это будет очевидно.
Шаг 5: Проверьте свою работу, добавив все надстрочные индексы и посмотрев, соответствует ли это общее количество электронов в интересующем вас элементе.

- Определения:


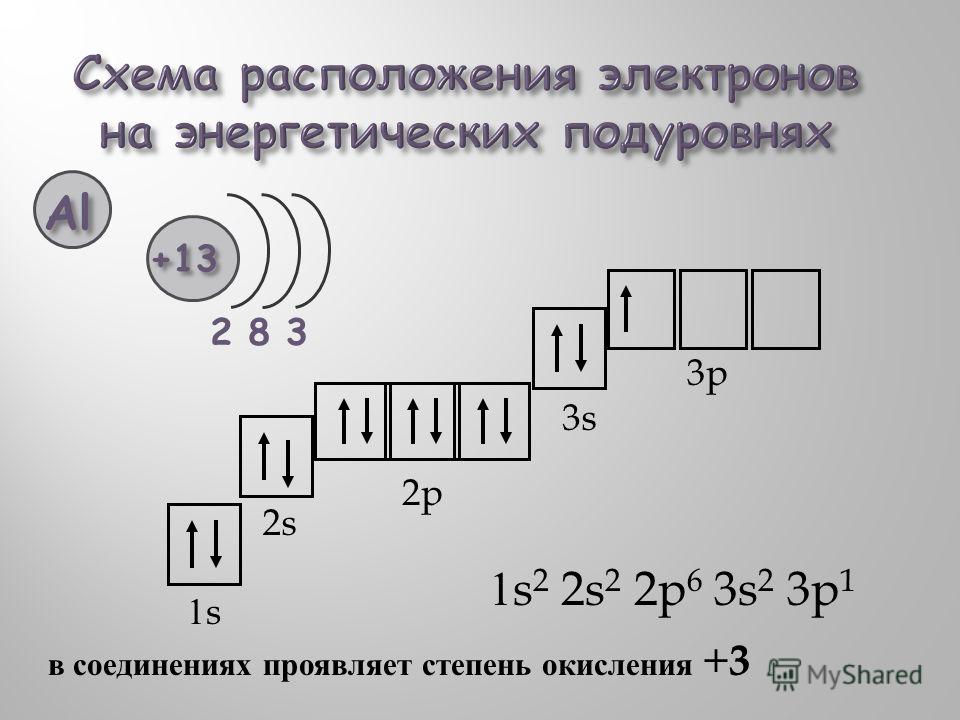 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя.
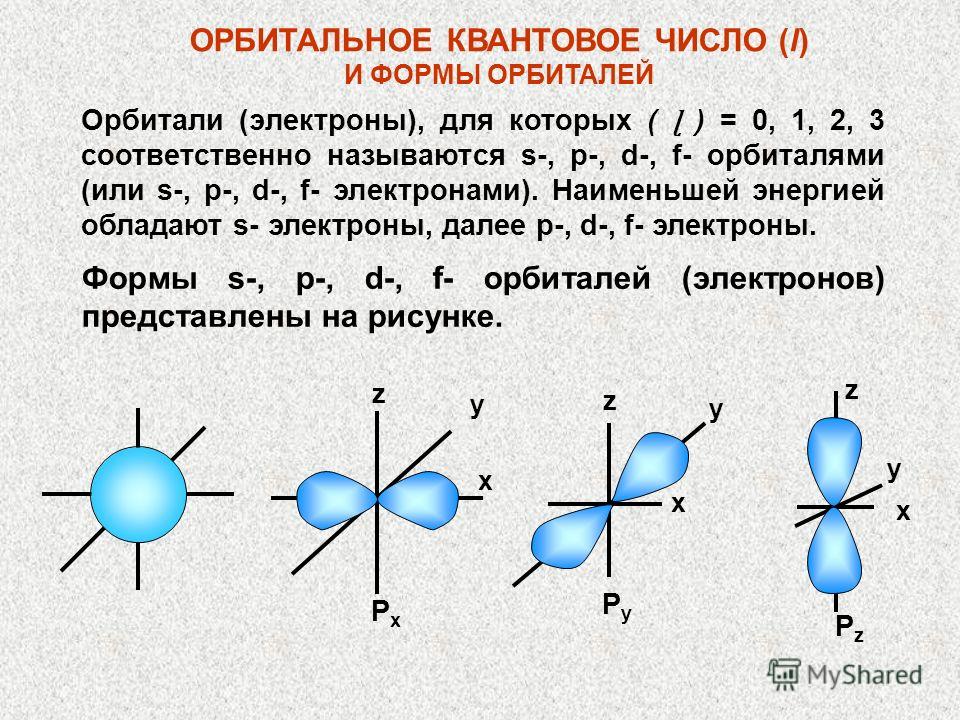

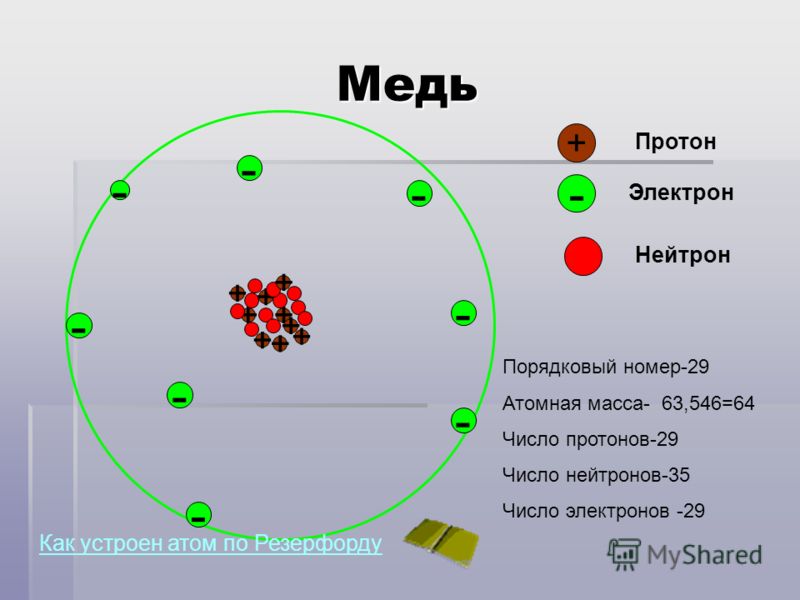 nobel.se/physics/educational/matter/
nobel.se/physics/educational/matter/
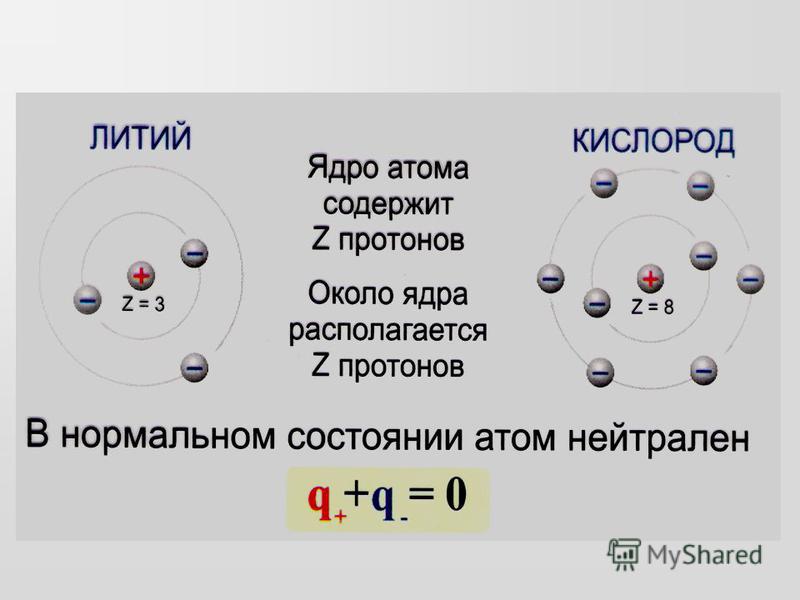
 Перед физиками был поставлен вопрос: «Как эти
частицы связаны с протонами, нейтронами и электронами?».
Перед физиками был поставлен вопрос: «Как эти
частицы связаны с протонами, нейтронами и электронами?». Чем быстрее вращается волчок, тем больше момент
импульса. Физики обнаружили, что эта идея справедлива и для
частиц, но спин частицы – ее внутренняя, неизменяемая
характеристика. Например, электрон имеет и всегда будет иметь
спин, равный 1/2 ħ.
Чем быстрее вращается волчок, тем больше момент
импульса. Физики обнаружили, что эта идея справедлива и для
частиц, но спин частицы – ее внутренняя, неизменяемая
характеристика. Например, электрон имеет и всегда будет иметь
спин, равный 1/2 ħ. Но это не остановило физиков. Вскоре они обнаружили
частицу с массой, которая была предсказана Гелл-Манном. Это и
подтвердило всю модель классификации частиц, которая была им
создана.
Но это не остановило физиков. Вскоре они обнаружили
частицу с массой, которая была предсказана Гелл-Манном. Это и
подтвердило всю модель классификации частиц, которая была им
создана.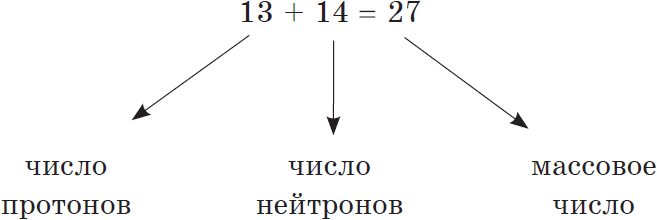
 Во-первых, кварки не
наблюдались, и никто не мог объяснить этот факт. Во-вторых, можно
было предположить различные комбинации кварков, но эти другие
комбинации никогда не были обнаружены экспериментально.
Во-первых, кварки не
наблюдались, и никто не мог объяснить этот факт. Во-вторых, можно
было предположить различные комбинации кварков, но эти другие
комбинации никогда не были обнаружены экспериментально. Ученые предположили, что кварки имеют три цветовых заряда. Этот тип
заряда был назван «цветом», т.к. некоторые комбинации цветов кварков будут
«нейтральными» по аналогии с комбинацией обычных цветов, которые могут дать белый, т.е.
нейтральный цвет.
Ученые предположили, что кварки имеют три цветовых заряда. Этот тип
заряда был назван «цветом», т.к. некоторые комбинации цветов кварков будут
«нейтральными» по аналогии с комбинацией обычных цветов, которые могут дать белый, т.е.
нейтральный цвет.
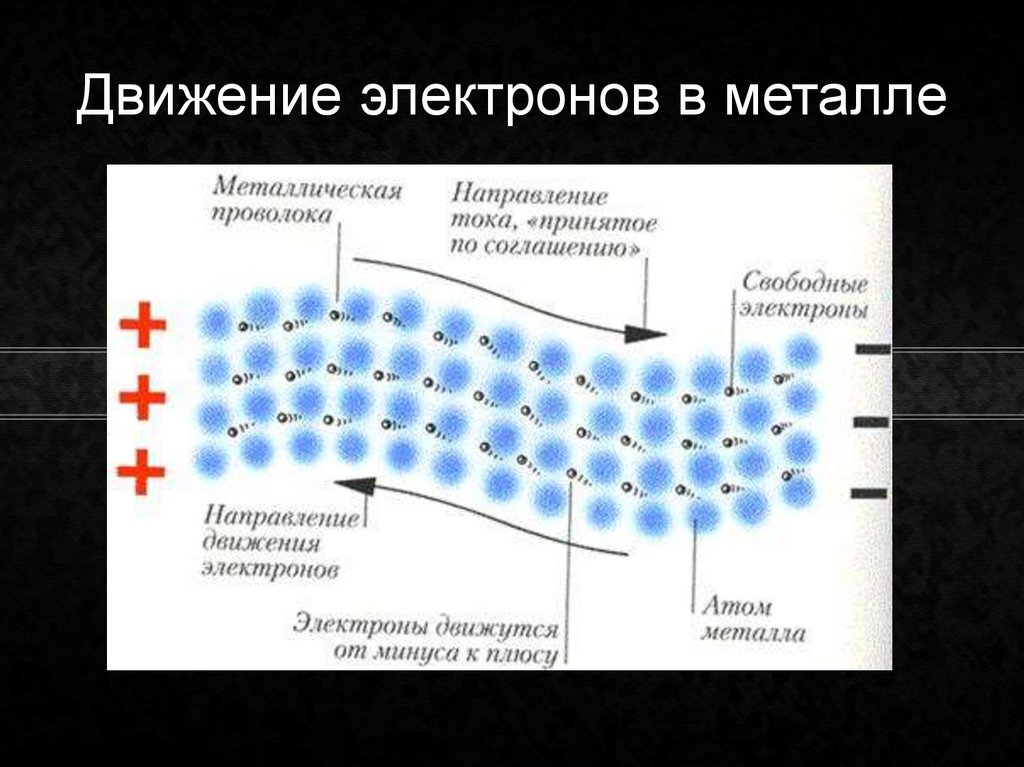
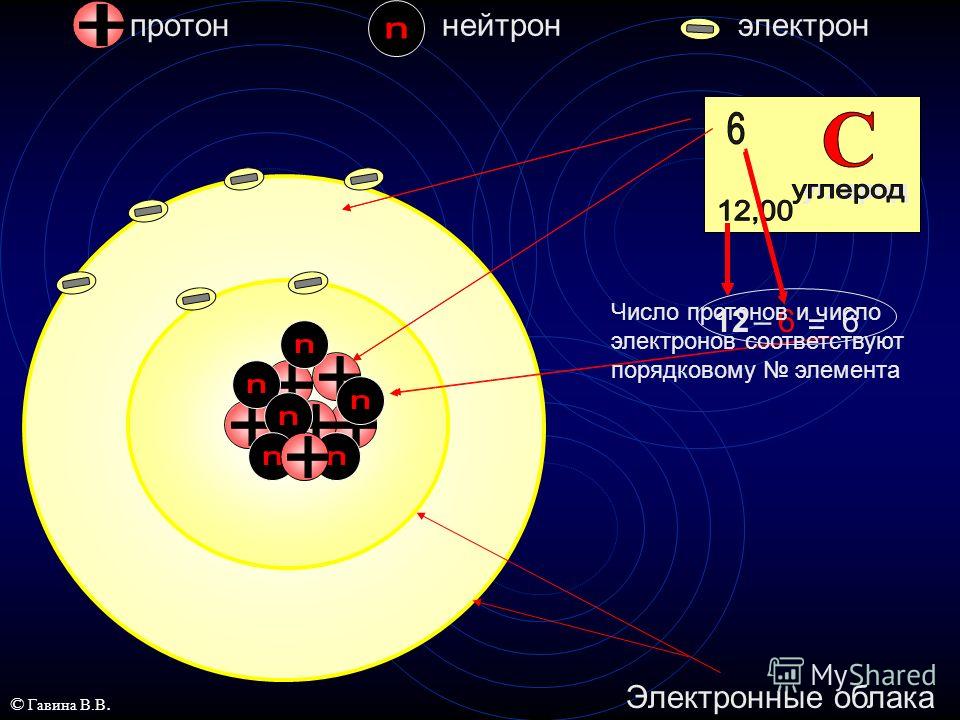
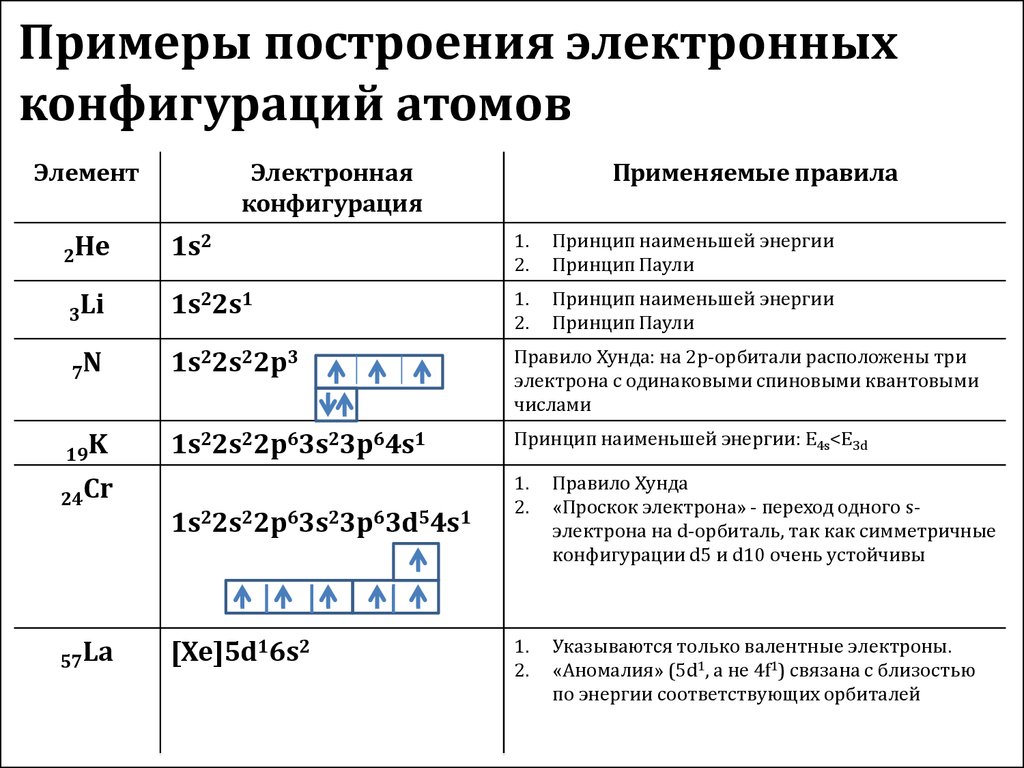 к. протон имеет внутреннюю структуру (он состоит из кварков),
электронный пучок будет рассеиваться на большие углы.
к. протон имеет внутреннюю структуру (он состоит из кварков),
электронный пучок будет рассеиваться на большие углы.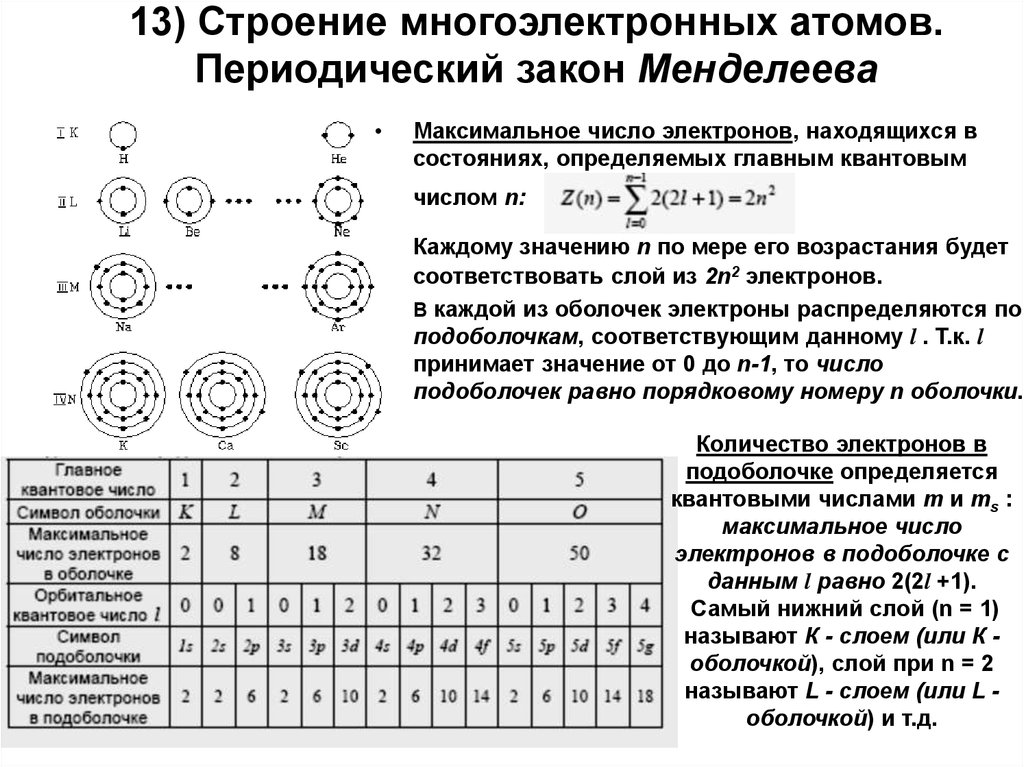

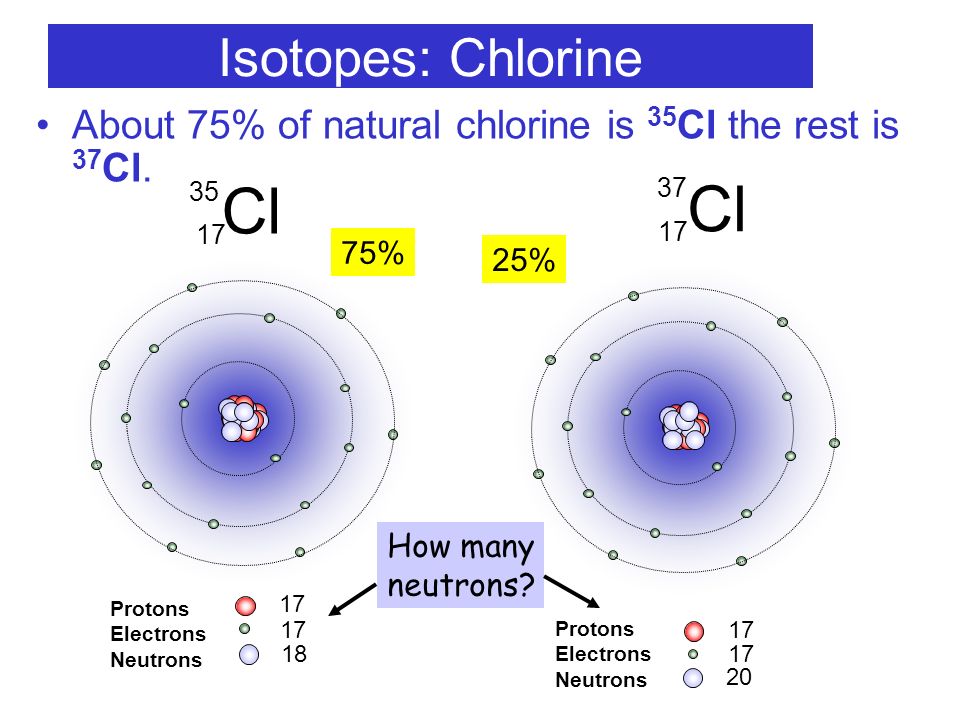
 И наоборот, если ион имеет больше электронов, чем протонов, он заряжен отрицательно и называется .0003 анион .
И наоборот, если ион имеет больше электронов, чем протонов, он заряжен отрицательно и называется .0003 анион . Протоны и нейтроны определяют массу атома. Символ массового числа
Протоны и нейтроны определяют массу атома. Символ массового числа  Предположим, что это атом натрия (
Предположим, что это атом натрия ( 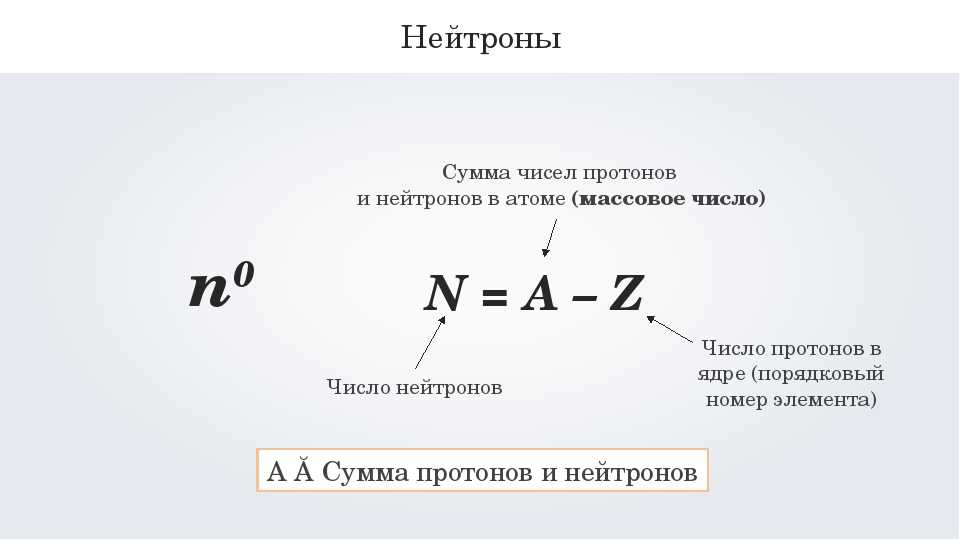
 Каждая неподеленная пара считается как 2 , а каждый неспаренный электрон считается как 1.
Каждая неподеленная пара считается как 2 , а каждый неспаренный электрон считается как 1. 
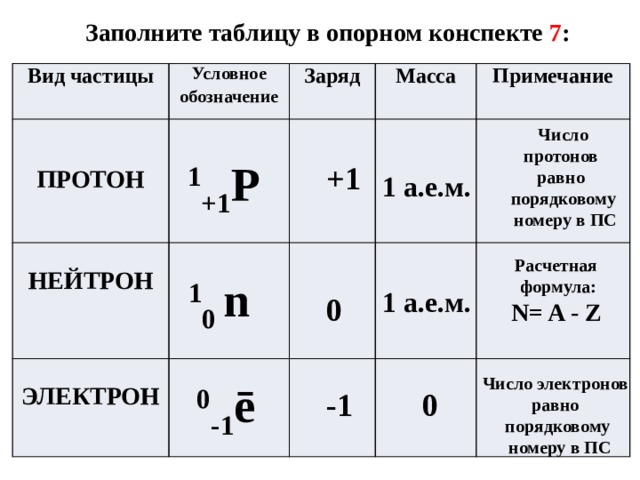 е. электроны в неподеленных парах или одиночно занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно количеству связей )
е. электроны в неподеленных парах или одиночно занятые орбитали ) и половина электронов, которые он разделяет ( половина числа связывающих электронов, что эквивалентно количеству связей )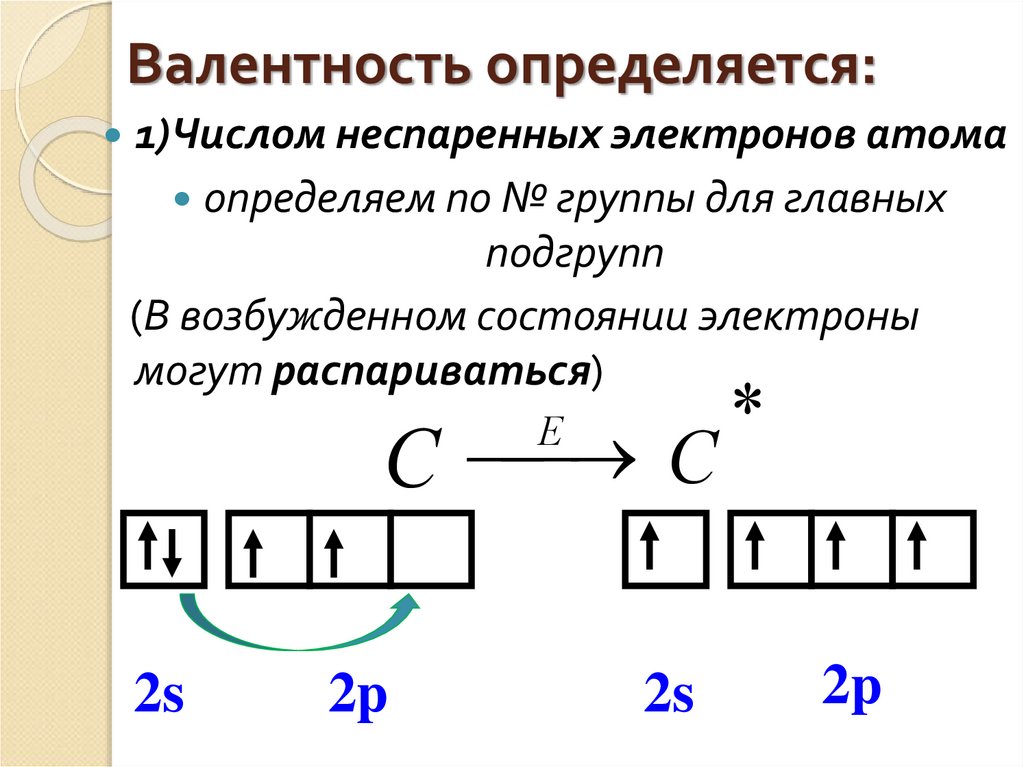 е. диполи).
е. диполи).

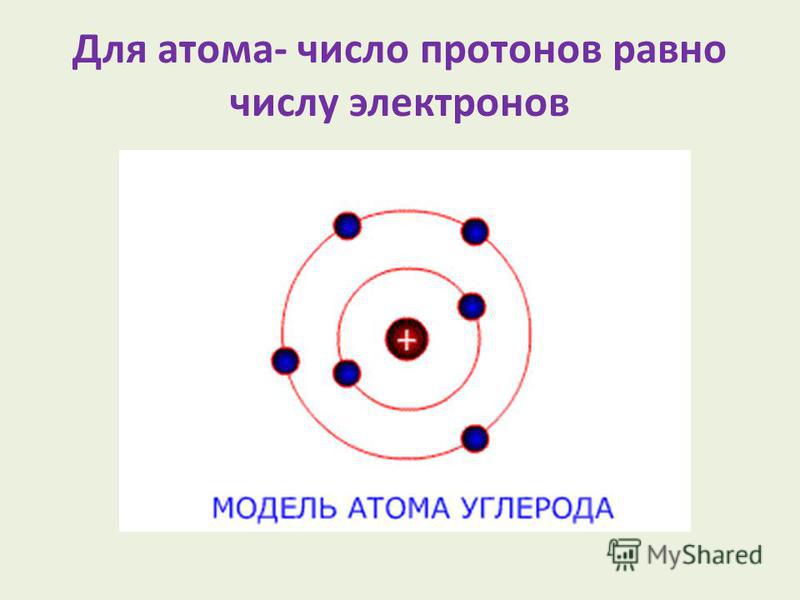 А когда связей этих атомов с водородом отсутствует , это означает именно то, что кажется: водорода на самом деле нет!
А когда связей этих атомов с водородом отсутствует , это означает именно то, что кажется: водорода на самом деле нет!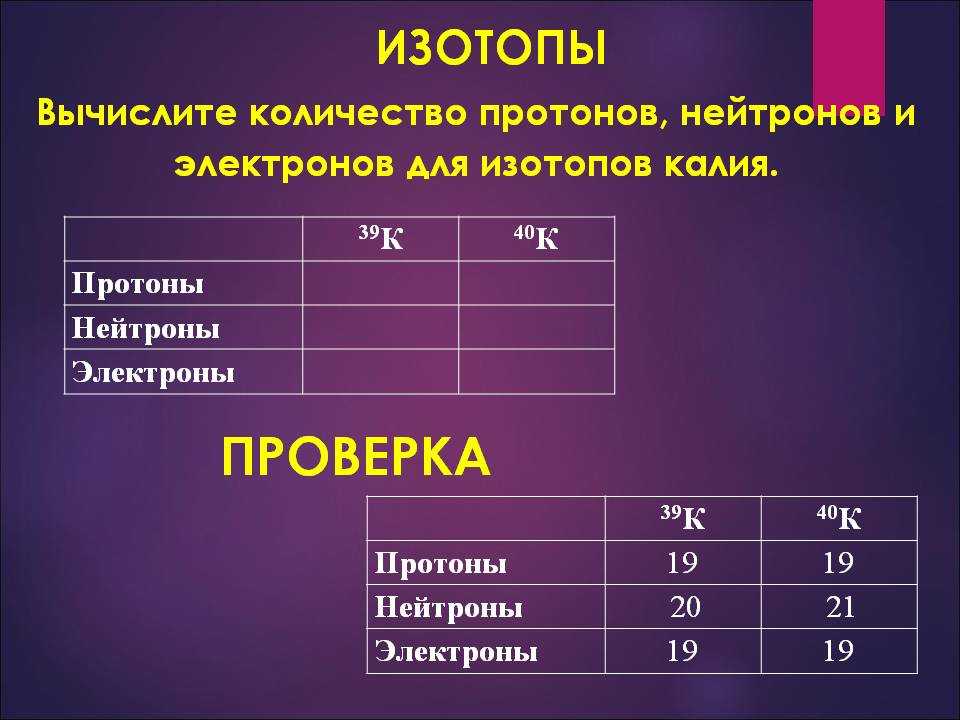
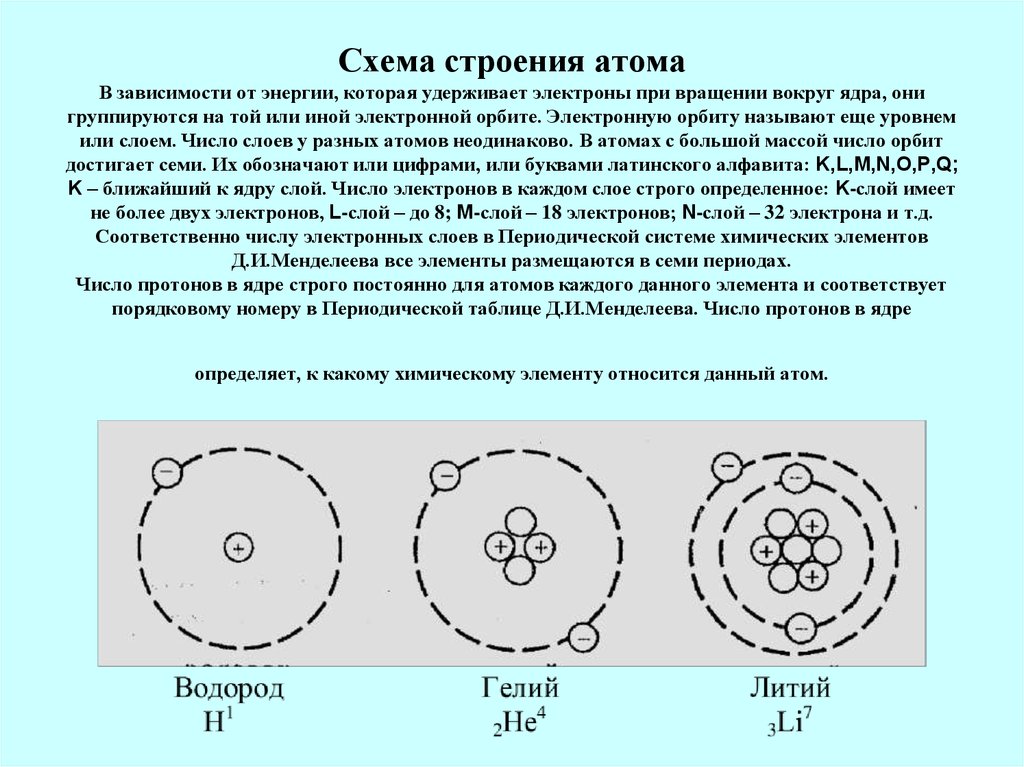

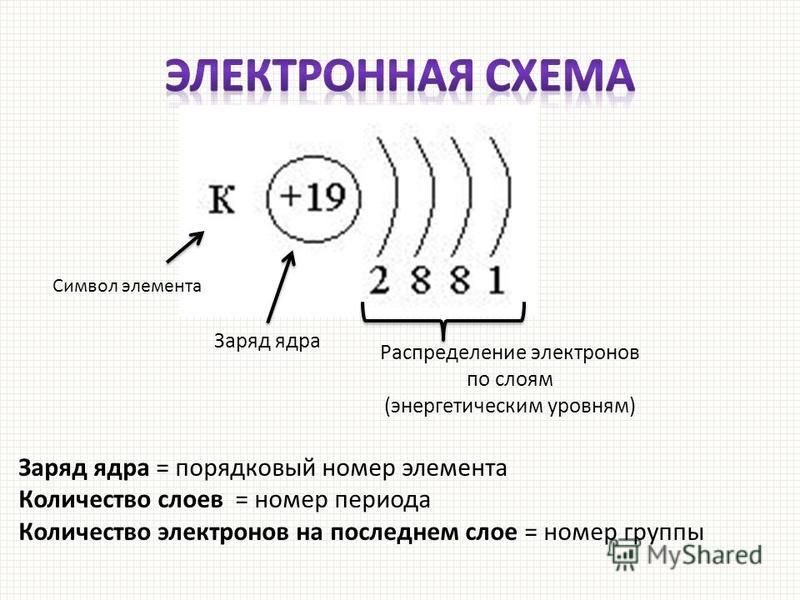

 Используя «валентные электроны», вы получите правильный ответ. Но если подумать, то это не совсем понятно. Откуда берутся положительные заряды? С положительно заряженных протона в ядре, конечно!
Используя «валентные электроны», вы получите правильный ответ. Но если подумать, то это не совсем понятно. Откуда берутся положительные заряды? С положительно заряженных протона в ядре, конечно!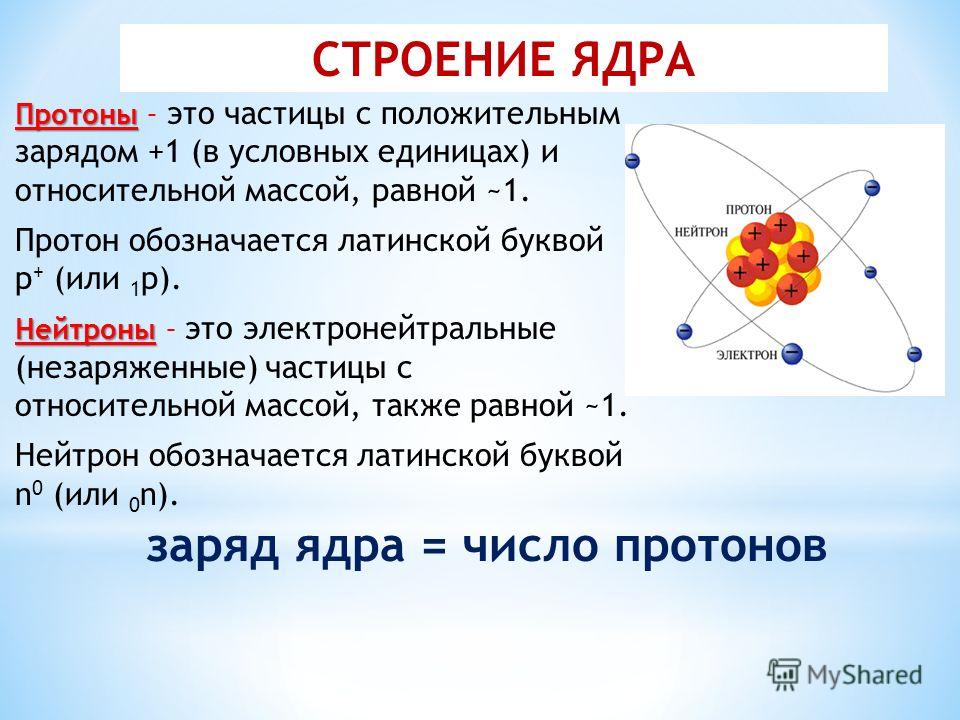 В сегодняшнюю эпоху, когда есть несколько запасных питчеров, существуют правила для определения того, какой питчер получит победу. Вполне возможно, что питчер полностью разлетится на насыпи, и все же, благодаря случайному стечению обстоятельств, ему все равно будет засчитана победа. См. публикацию: Может быть, они должны называть их «формальными победами»?
В сегодняшнюю эпоху, когда есть несколько запасных питчеров, существуют правила для определения того, какой питчер получит победу. Вполне возможно, что питчер полностью разлетится на насыпи, и все же, благодаря случайному стечению обстоятельств, ему все равно будет засчитана победа. См. публикацию: Может быть, они должны называть их «формальными победами»?  1021/ed083p791
1021/ed083p791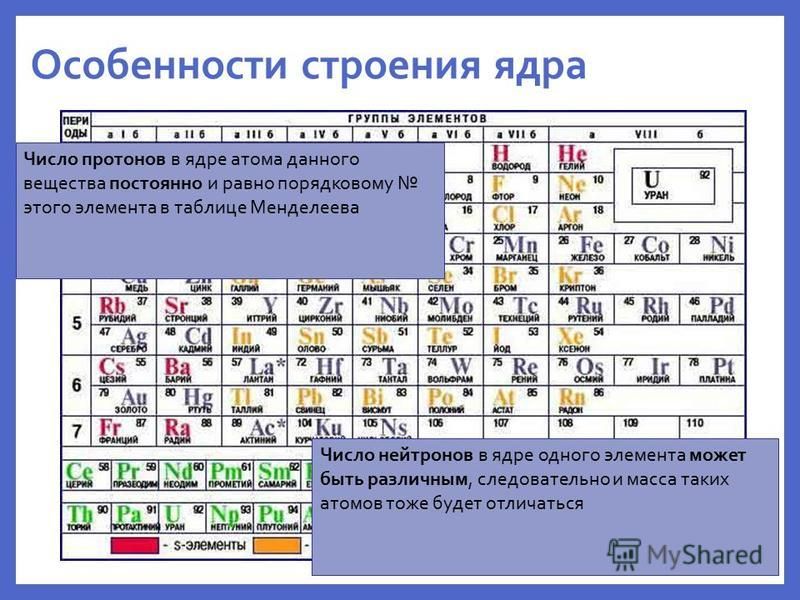 Не знаете, как найти их в таблице Менделеева? Позвольте мне показать вам шаги, чтобы узнать количество субатомных частиц.
Не знаете, как найти их в таблице Менделеева? Позвольте мне показать вам шаги, чтобы узнать количество субатомных частиц. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если ядерно-ядерный заряд имеет высокий заряд (может быть положительным или отрицательным), считается, что он находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если ядерно-ядерный заряд имеет высокий заряд (может быть положительным или отрицательным), считается, что он находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.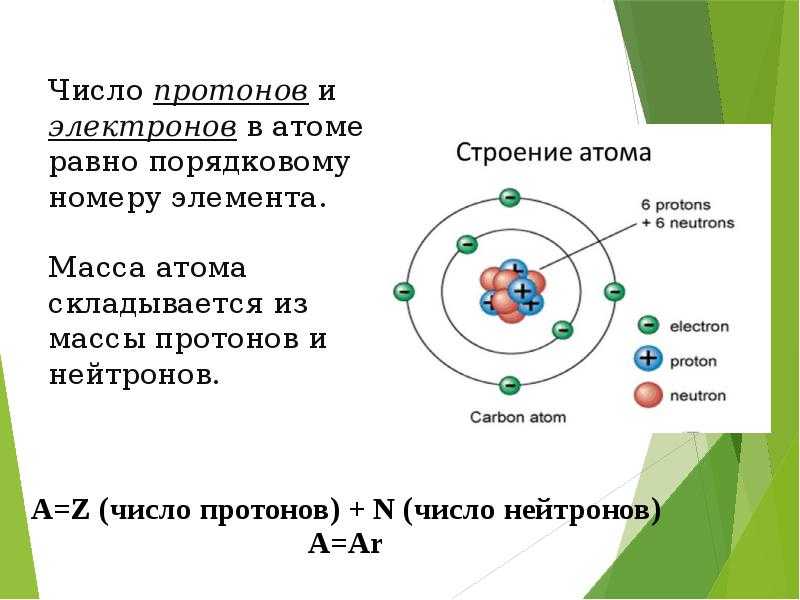 Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставьте номер протона из общего заряда молекулы-молекулы. Результат, который вы получили, будет числом электронов.
Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставьте номер протона из общего заряда молекулы-молекулы. Результат, который вы получили, будет числом электронов.
 Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме. Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов. Таблица в основном разделена на три группы, то есть металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами.
Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов. Таблица в основном разделена на три группы, то есть металлы, неметаллы и металлоиды (полуметаллы). Есть также элементы, которые являются щелочными металлами, галогенами и инертными газами. Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме.
Протоны несут положительный заряд, тогда как частицы несут отрицательный заряд. Таким образом, для нейтрального атома количество протонов равно количеству электронов. Если мы можем узнать количество протонов по атомному номеру, то число частиц будет таким же, как число протонов. В случае, если у ядра высокий уровень любого заряда (может быть положительным или отрицательным), считается, что оно находится в ионном состоянии. В этом случае количество зарядов определяет количество протонов или электронов, присутствующих в атоме. Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов.
Атом переходит в свою ионную форму только путем добавления или вычитания частиц. Помните, что количество протонов, присутствующих в молекуле, всегда постоянно. После того, как вы найдете свой ионный элемент, проверьте его атомный номер в стандартной форме. Число даст вам количество протонов, присутствующих в атоме. Теперь подставим число протонов из общего заряда молекулы. Результат, который вы получили, будет числом электронов.