| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | C_8H_18+O_2→CO_2+H_2O | ||
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | ||
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
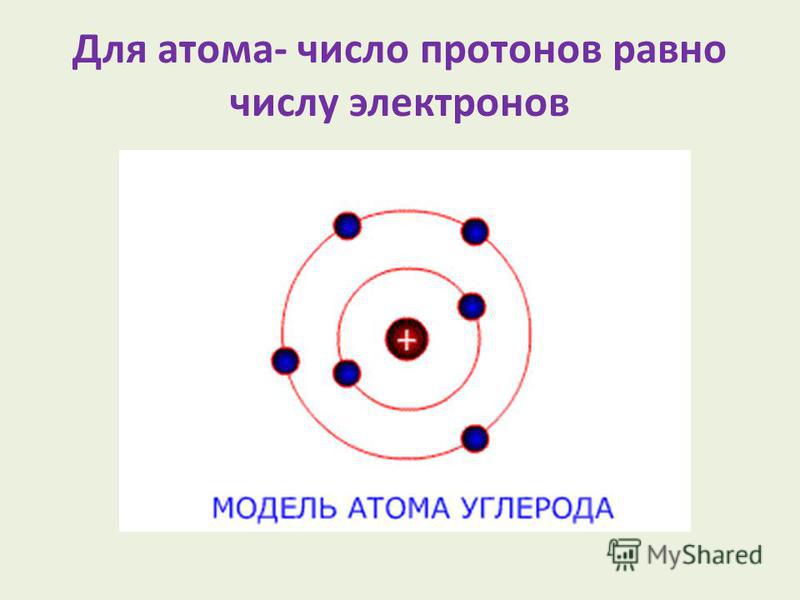
Атом
Атом
Atom
Атом — наименьшая
составная часть вещества, сохраняющая его химические свойства. Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой.
Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой.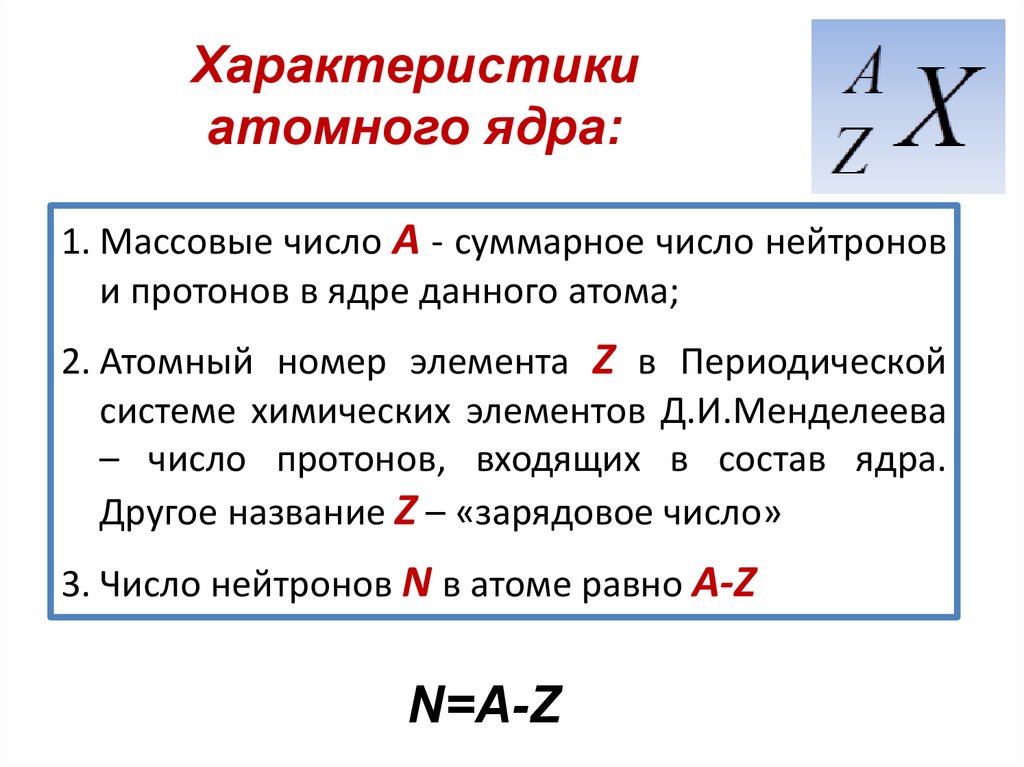 Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Состояние электрона в атоме характеризуется значением его орбитального
момента L, определяемого квантовым числом l, L = ћ[l(l+1)]1/2.
При данном значении l состояния нумеруются в порядке возрастания квантового
числа n, пробегающего значения l+1, l+2,… по мере возрастания энергии.
В нерелятивистском приближении уровни с заданными значениями n и l вырождены
по проекции орбитального момента, характеризуемой квантовым числом ml,
принимающей 2l+1 значение ±l, ±(l-1),…, ±1, ±0 и проекции спинового
момента ms электрона, принимающей 2s+1 = 2 (s = 1/2) значения
ms = ±1/2. Таким образом, кратность вырождения N уровня с определенными
значениями квантовых чисел n и l равна N = (2s+1)(2l+1) = 2(2l+1). Совокупность
2(2l+1) состояний с данными n и l образует электронную оболочку.
Согласно принципу Паули в каждом из этих состояний может находиться один
электрон. Если все состояния электронной оболочки заняты электронами, оболочка
называется замкнутой.
Совокупность
2(2l+1) состояний с данными n и l образует электронную оболочку.
Согласно принципу Паули в каждом из этих состояний может находиться один
электрон. Если все состояния электронной оболочки заняты электронами, оболочка
называется замкнутой.
Замкнутая s оболочка (l=0) содержит 2 электрона
N = (2s+1)(2l+1) = (2·(1/2)+1)(2·0+1) = 2.
Замкнутая р оболочка (l=1) содержит 6 электронов
N = (2s+1)(2l+1) = (2·(1/2+1)(2·1+1) = 6.
Замкнутая d оболочка содержит 10 электронов.
Все электроны с заданным квантовым числом n образуют электронный
слой, содержащий 2n2 электронов. Слои с n = 1, 2, 3,… называют
в соответствии с принятой для рентгеновских спектров терминологией K, L,
M, N-слоями. Максимальное число электронов в K, L, M, N-слоях приведено
в таблице.
Максимальное число электронов K, L, M, N-слоях
| K-слой | L-слой | M-слой | N-слой |
| n = 1 | n = 2 | n = 3 | n = 4 |
| l = 0 | l = 0, 1 | l = 0, 1, 2 | l = 0, 1, 2, 3 |
| 2 электрона | 2 + 6 = 8 электронов | 2 + 6 + 10 = 18 электронов | 2 + 6 + 10 + 14 = 32 электрона |
Наиболее близко к ядру расположен К-слой, затем L-слой и т. д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т.д.
д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т.д.
Последовательное заполнение электронных слоев объясняет Периодический
закон элементов, открытый Д.И. Менделеевым. Периоды в Периодической системе
Д.И. Менделеева соответствуют последовательному заполнению оболочек. Для
элементов 1 периода происходит заполнение оболочки 1s. Для элементов 2 и
3 периодов — заполнение оболочек 2s, 2p, 3s, 3p, 3d. Однако по мере увеличения
числа электронов (заряда ядра Z) такой порядок заполнения нарушается из-за
конкуренции близких по энергии связи электронов. Справедливо следующее правило:
чем меньше l, тем сильнее волновая функция проникает в область, экранируемую
облаком внутренних электронов. В результате этого при заданном значении
n энергия электронов возрастает с увеличением l (рис.).
Например, электроны 4s оказываются сильнее связаны, чем электроны
3d. В основе последовательности заполнения электронных оболочек многоэлектронных
атомов лежит правило Маделунга.
Правило Маделунга. Из двух оболочек ниже по энергии располагается та, для которой величина n = l оказывается наименьшей. Если для двух оболочек значения сумм n = l совпадают, то ниже по энергии лежит оболочка с меньшим значением n. |
| Рис. Относительное расположение электронных оболочек атомов (не в масштабе). Справа указан заряд Z ядра атома, с которого начинается заполнение указанной подоболочки. |
Распределение электронов в атоме по оболочкам определяет
его электронную конфигурацию. Так, например, электронная конфигурация атома 27Al, имеющего 13 электронов, записывается в виде 1s2 2s2 2p6 3s2 3p1. Последовательно
выписываются электронные оболочки, начиная от ближайшей к ядру.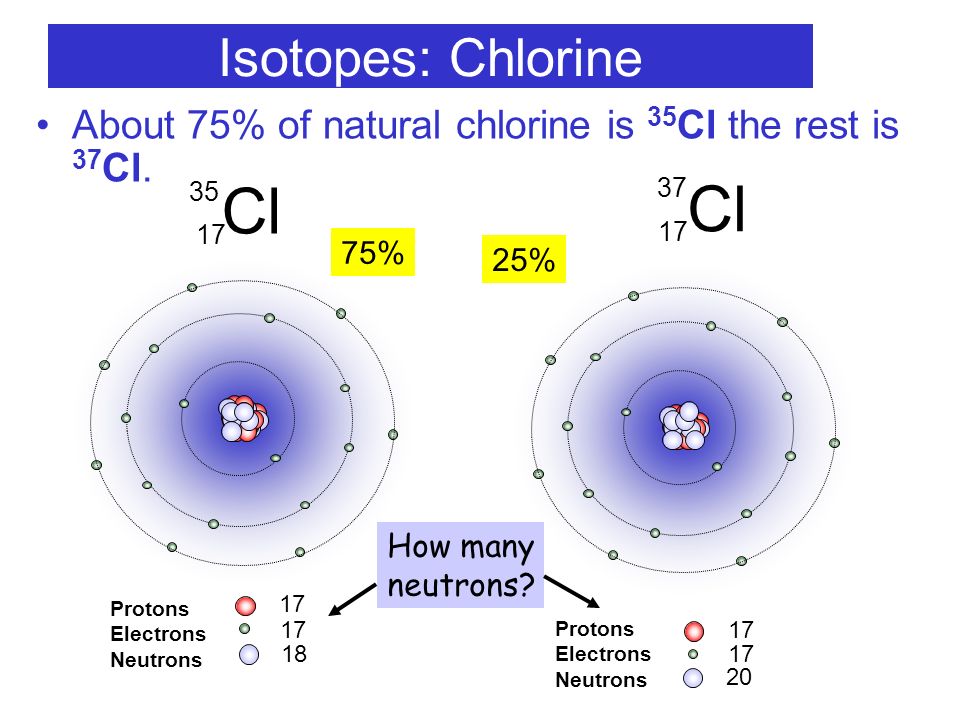 Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
полного спинового момента
и полного момента количества движения
всех электронов данного атома.
Электростатическое и спин-орбитальное взаимодействия электронов атома
приводят к тому, что терм расщепляется на несколько состояний — мультиплет,
число компонентов которого определяется числом возможных ориентаций векторов
и
в пространстве,
т.е. числом возможных значений квантового числа j.
Состояния атома с различными значениями L обозначаются заглавными
буквами латинского алфавита:
L = | 0 | 1 | 2 | 3 | 4 | 5 |
S | P | D | F | G | H |
Сверху слева от этого символа указывается величина 2s+1, а справа внизу
значение полного момента J. Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Конкуренция спин-орбитального и электростатического взаимодействий
определяет порядок сложения орбитальных и спиновых моментов. В том случае,
когда электростатическое взаимодействие много больше спин-орбитального,
орбитальные моменты отдельных электронов складываются в полный орбитальный
момент L. Спиновые моменты отдельных электронов складываются в полный спиновый
момент S.
= + .
Такая схема связи называется L–S связью. В основном она реализуется для
основных состояний лёгких ядер.
В случае, когда спин-орбитальное взаимодействие много больше
электростатического, полные моменты отдельных электронов объединяются в
полный момент атома
.
Такая схема связи называется j–j связью и реализуется в основном в тяжелых
ядрах.
Для определения основного терма данной конфигурации используют
эмпирические правила Хундта.
Ниже по энергии лежит терм, у которого мультиплетность является максимальной.
При равенстве мультиплетностей нескольких термов минимальной энергией обладает терм с максимальным значением суммарного орбитального момента конфигурации.
Если атомная подоболочка заполнена менее, чем наполовину, наименьшую энергию имеет состояние с минимальным значением J, если атомная оболочка заполнена более, чем наполовину, то наименьшую энергию имеет состояние с максимальным J.
Наряду с электронной конфигурацией, соответствующей наибольшей энергии связи всех электронов атома, при возбуждении одного или нескольких электронов образуются возбуждённые электронные конфигурации. Переходы между различными термами атома образуют спектр возбуждённых состояний атома.
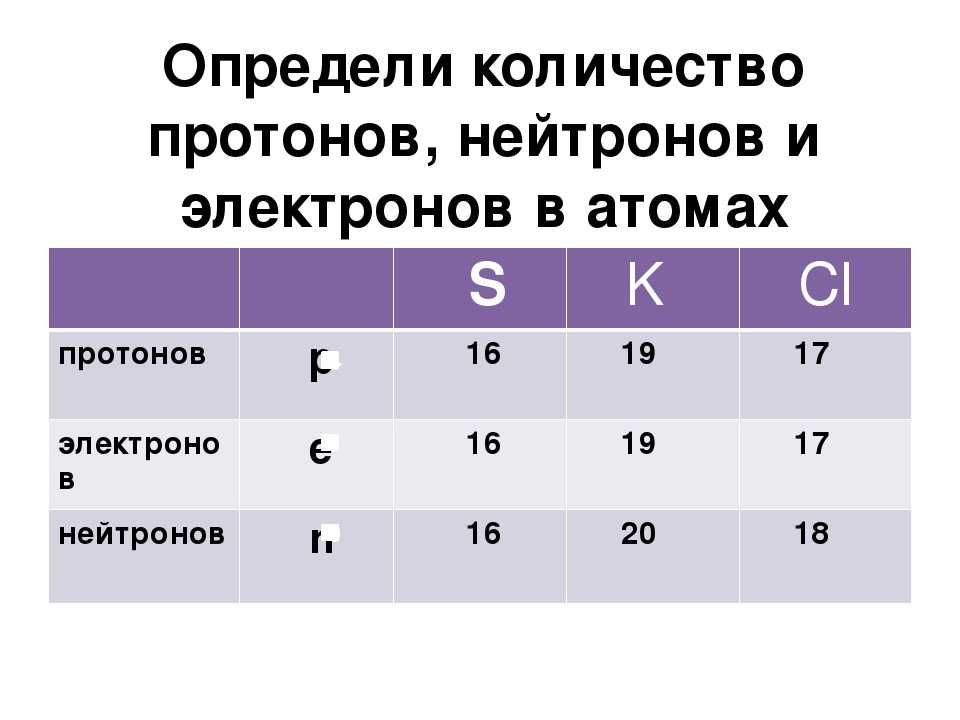
Как найти количество протонов, нейтронов и электронов
Учебные пособия
- Сообщение от Райли Мазиек
22 Апр
Основные понятия
В этом уроке вы узнаете, как найти и рассчитать количество протонов, нейтронов и электронов в атоме или элементе. Кроме того, вы узнаете о различных субатомных частицах. Если вам понравился этот урок, обязательно ознакомьтесь с другими!
Описано в других статьях
- Структура атома
- Что такое элемент?
- Как читать Периодическую таблицу
- Статьи об элементах
- Открытие электрона
- Электронные орбитали и формы орбит
Словарь:
- Протоны: положительно заряженные субатомные частицы, находящиеся в ядре.
- Нейтроны: нейтрально заряженные субатомные частицы, расположенные в ядре атома.
- Электроны: Отрицательно заряженные субатомные частицы, расположенные на орбиталях, окружающих ядро.
- Атомная масса: Средневзвешенное число нейтронов и протонов, присутствующих во всех изотопах.

- Атомный номер: Количество протонов, присутствующих в атоме.
- Элемент: Чистое вещество, которое нельзя разложить химическим путем на более простое вещество.
Как найти атомный номер
Атомный номер элемента — это просто число протонов в его ядре. Самый простой способ найти атомный номер — посмотреть в периодической таблице, атомный номер находится в верхнем левом углу или является самым большим числом на квадрате.
Определение количества протонов
Количество протонов в атоме равно атомному номеру элемента. Например, возьмем кислород. Согласно периодической таблице кислород имеет атомный номер восемь. Атомный номер расположен над символом элемента. Поскольку кислород имеет атомный номер восемь, всего должно быть восемь протонов. Более того, количество протонов никогда не меняется для элемента.
Определение количества нейтронов
Количество нейтронов в атоме можно рассчитать, вычитая атомный номер из атомной массы.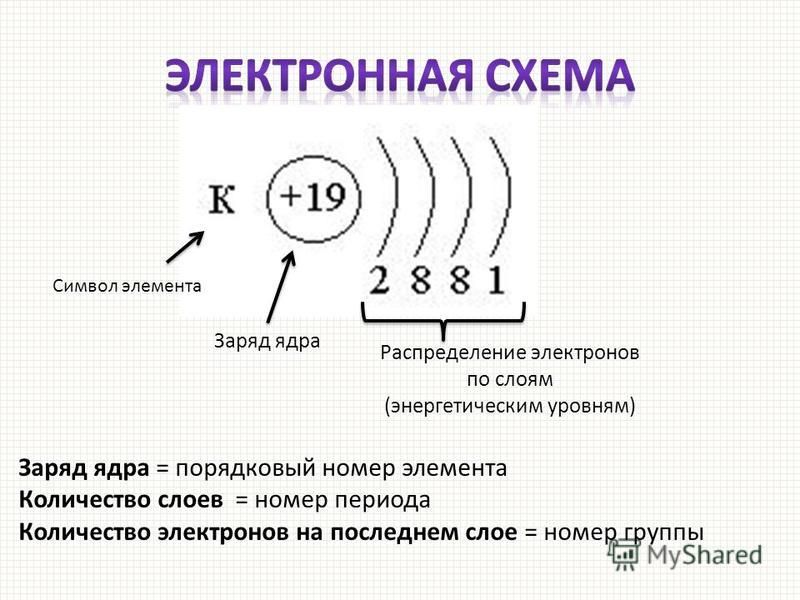 Оба этих числа можно найти в периодической таблице. Атомный номер указан над символом элемента, тогда как массовое число помещено ниже. Давайте продолжим использовать кислород в качестве нашего примера. Его атомная масса равна 15,9.99 атомных единиц массы (а.е.м.), а его атомный номер равен 8. Когда мы вычтем 8 из 15,999, мы получим 8. Также следует отметить, что количество нейтронов для элемента может варьироваться. У некоторых элементов есть изотопы, которые имеют разную массу и, следовательно, разное количество нейтронов.
Оба этих числа можно найти в периодической таблице. Атомный номер указан над символом элемента, тогда как массовое число помещено ниже. Давайте продолжим использовать кислород в качестве нашего примера. Его атомная масса равна 15,9.99 атомных единиц массы (а.е.м.), а его атомный номер равен 8. Когда мы вычтем 8 из 15,999, мы получим 8. Также следует отметить, что количество нейтронов для элемента может варьироваться. У некоторых элементов есть изотопы, которые имеют разную массу и, следовательно, разное количество нейтронов.
Определение количества электронов
Количество электронов в атоме равно порядковому номеру элемента для нейтрально заряженных частиц. Это означает, что количество электронов и количество протонов в элементе равны. Следовательно, количество электронов в кислороде равно 8. Более того, поскольку эти две субатомные частицы, электроны и протоны, имеют противоположные заряды, они компенсируются и сохраняют атом нейтральным.
Summary Table
| Number of Protons = | Atomic Number |
| Number of Neutrons = | Atomic Mass- Atomic Number |
| Number of Electrons = | Atomic Number |
Лучшая периодическая таблица в мире
Компания ChemTalk, по нашему скромному мнению, разработала лучшую в мире интерактивную периодическую таблицу. Познакомьтесь с нашей периодической таблицей здесь.
Дополнительная литература
- Точечные структуры Льюиса
- Периодические тренды, сделанные проще
Электронные конфигурации
Электронные конфигурации Следующее содержание является сутью лекции по общей химии 26. В этой лекции мы продолжаем обсуждение квантовых чисел и их использования в электронных конфигурациях, а также отношения электронной конфигурации к периодическим свойствам элементов.
Электронная конфигурация
Конфигурации электронов — это сводка того, где электроны находятся вокруг ядра. Как мы узнали ранее, каждый нейтральный атом имеет количество электронов, равное количеству его протонов. Теперь мы поместим эти электроны в такое расположение вокруг ядра, которое укажет на их энергию и форму орбитали, на которой они расположены. Вот краткое описание типов орбиталей и количества электронов, которые каждая из них может содержать:
.Итак, основываясь на том, что мы знаем о квантовых числах, и используя приведенную выше таблицу, вам нужно 2 электрона, чтобы заполнить s-орбиталь, 6 электронов, чтобы заполнить p-орбиталь, 10 электронов, чтобы заполнить d-орбиталь, и 14 электронов, чтобы заполнить f-орбиталь. НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
Порядок заполнения
Порядок, в котором электроны размещаются на орбиталях, основан на порядке их энергии. Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен следующей диаграммой:
Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен следующей диаграммой:
или вы можете просто использовать таблицу Менделеева:
Как написать электронную конфигурацию
Символы, используемые для записи электронной конфигурации, начинаются с номера оболочки (n), за которым следует тип орбитали, и, наконец, верхний индекс указывает, сколько электронов находится на орбитали.
Например:
Глядя на периодическую таблицу, вы видите, что кислород имеет 8 электронов. Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .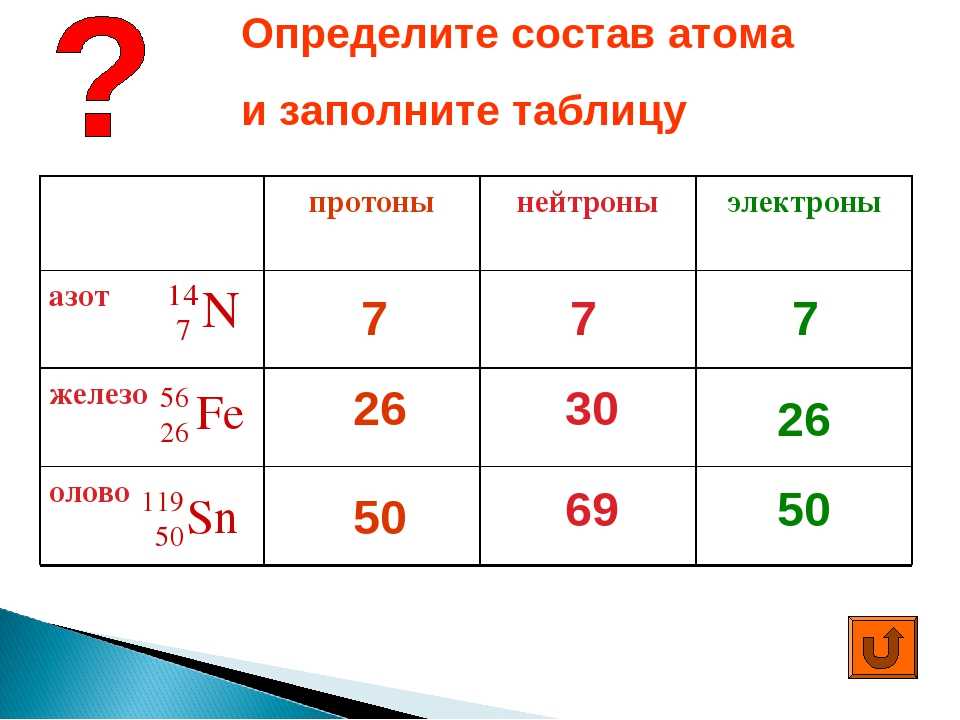
Особые случаи
Конфигурации ионов представляют собой частный случай электронной конфигурации, а также в первую очередь демонстрируют причину образования этих ионов.
Если вам нужно записать полную электронную конфигурацию для аниона , то вы просто добавляете дополнительные электроны, и конфигурация просто продолжается.
Например, мы знаем, что кислород всегда образует 2-ионы, когда он образует ион. Это добавит 2 электрона к его нормальной конфигурации, создав новую конфигурацию: O 2- 1с 2 2с 2 2п 6 . Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона. Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Электронные конфигурации катионов также основаны на количестве электронов, но есть небольшая разница в способе их конфигурации. Сначала вы должны написать их нормальную электронную конфигурацию, а затем, когда вы удаляете электроны, вы должны брать их с самой внешней оболочки. Обратите внимание, что это не всегда тот же способ, которым они были добавлены.
Вот пример того, что я имею в виду:
Железо имеет 26 электронов, поэтому его нормальная конфигурация электронов будет: FE 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3P 6 4S 2 3D 4S 2 3D 4S 2 3P 6 4S 2 3P . Когда мы создаем ион 3+ для железа, нам нужно сначала взять электроны из самой внешней оболочки, чтобы это была оболочка 4s, а не оболочка 3d: Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 Еще одно замечание по записи электронных конфигураций: короткий путь. Исключения Как и в случае с любой другой темой, которую мы рассмотрели на сегодняшний день, существуют исключения из порядка заполнения. Но, исходя из генерируемых электронных конфигураций, эти исключения легко понять. В блоке d, особенно в группах, содержащих хром и медь, есть исключение в том, как они заполняются. Вот актуальные конфигурации: В этих столбцах 4s и 3d Здесь есть множество викторин по электронным конфигурациям, с которыми вы можете попрактиковаться Еще один способ представить порядок заполнения атома — использовать орбитальную диаграмму, которую часто называют «маленькими квадратиками»: Прямоугольники используются для представления орбиталей и для отображения размещенных на них электронов. Одна из действительно интересных особенностей электронных конфигураций — их связь с периодической таблицей. В основном периодическая таблица была построена таким образом, чтобы элементы с одинаковыми электронными конфигурациями были выровнены в одни и те же группы (столбцы). Периодическая таблица, показывающая последнюю заполненную орбиту для каждого элемента Таблица Менделеева, показанная выше, демонстрирует, как конфигурация каждого элемента была выровнена так, чтобы последняя заполненная орбиталь была такой же, за исключением оболочки. Давайте рассмотрим некоторые периодические свойства, на которые напрямую влияет электронная конфигурация: Размер атомов увеличивается вниз по таблице Менделеева. Это должно быть интуитивно понятно, поскольку с каждой строкой таблицы вы добавляете оболочку (n). Что не так интуитивно понятно, так это то, почему размер уменьшается слева направо. Но опять же построение электронной конфигурации дает нам ответ. Что вы делаете, просматривая периодическую таблицу? Ответить, добавляя протоны к ядру и добавляя электроны к валентной оболочке элемента. Что не меняется, когда вы пересекаете период? Ответ: электроны внутренней оболочки. Подумайте об этом так: электроны внутренней оболочки являются защитой от притяжения ядра. Так, например, сила притяжения Sulphur будет равна Z Eff = 16 — 10 = +6 Электроотрицательность может быть самым важным из периодических свойств, которые вы можете изучить и понять, так как многие другие свойства зависят от его значения. Электроотрицательность обычно выражается по шкале Полинга, и значения были определены экспериментально. В таблице ниже показаны значения шкалы для элементов. Значения электроотрицательности увеличиваются слева направо и снизу вверх в периодической таблице, за исключением благородных газов. Наиболее электроотрицательным элементом является фтор. Из этих значений электроотрицательности мы можем вывести модели двух других периодических свойств: энергии ионизации и сродства к электрону. Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Все энергии ионизации являются положительными значениями, потому что все эти удаления (даже для элементов, образующих положительные ионы) требуют ввода энергии. Чем более электроотрицательный элемент, тем выше энергия ионизации.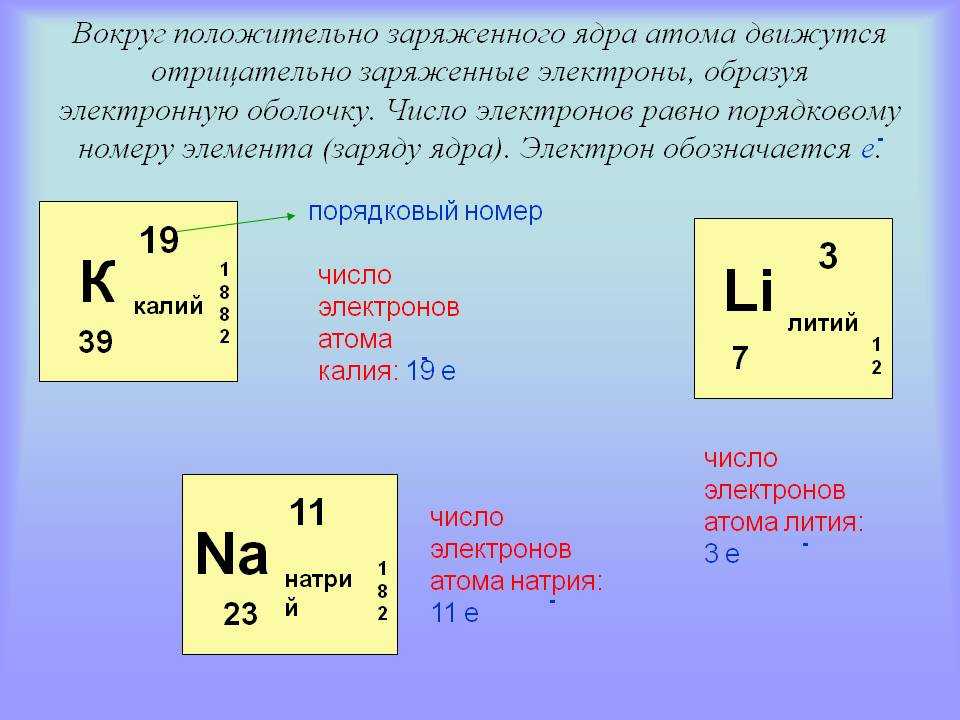 При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ: Практика, Практика, Практика
Орбитальные диаграммы
 Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям. Периодические свойства
 Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства. Атомный размер
 Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны.
Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны. Электроотрицательность
 Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность — это способность атомов притягивать к себе электроны.
Энергия ионизации