Изоэлектронная молекула — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Это значение основывается на предположении, что ион CHj в своем основном состоянии имеет линейное строение. Принимая ьо внимание результаты Герцберга и Джонса [533], согласно которым изоэлектронная молекула ВН2 в своем основном состоянии не линейна, вероятно, можно то же самое применить и к иону CHf, и поэтому значение ( СН2), данное в тексте, является только верхним пределом, а, следовательно, верхний предел D ( СП2 — Н) еще лише. [31]
Несмотря на то что это соединение имеет интенсивную полосу в ИК-спектре, его довольно часто применяют для матричной изоляции. Реакционная способность СО ( не намного более высокая, чем у изоэлектронной молекулы азота) удачно использовалась для получения большого числа новых молекул карбонилов металлов при замораживании атомов металлов в матрице окиси углерода ( см. гл. По своим физическим свойствам окись углерода сходна с аргоном и азотом.
Хотя корреляционные диаграммы для молекул с одинаковыми и различными ядрами, представленные на рис. 4.10 и 4.12, выглядят различными, в действительности между ними существует связь, которая получила название принципа изо-злектронности. Этот принцип важен с исторической точки зрения, поскольку первоначально именно с помощью сравнения изоэлектронных молекул удалось получить сведения о последовательности расположения МО по энергии, о чем говорилось выше. [33]
Указанием на наличие я-дативных связей в цианокомплексах металлов может служить способность цианогрупп стабилизиро — ватъ низшие степени окисления металлов, хотя в этом отношений ион CN менее эффективен, чем типичные я-акцепторные лиганды N0 и СО. Последнее обстоятельство связано, по-видимому, с тем, что, в отличие от
Молекула N2 гомонуклеарна, молекула СО составлена из атомов, окаймляющих азот элементов в строке второго периода; партнеры молекулы BF еще дальше отстоят друг от друга в этой строке, и, несомненно, F обладает значительно большим сродством к электрону, чем бор: фтор более электроотрицателен или электрофилен. Постепенное увеличение разности электроотрицательности может отразиться на строении электронного молекулярного облака в этих трех
Постепенное увеличение разности электроотрицательности может отразиться на строении электронного молекулярного облака в этих трех
| Уровни энергии атома бора. [36] |
Сведения о соединениях системы бор — кислород — фтор в литературе отсутствуют. В Справочник включено простейшее соединение этой системы FBO, существование которого представляется вероятным по аналогии с изоэлектронной молекулой FCN, а также исходя из общих представлений о строении молекул. [37]
Примеры использования концепции изоэлектронности будут даны ниже, в частности при сопоставлении свойств бензола и пиридина. Здесь же будет изложена суть этой идеи для случая двухатомных молекул, образованных атомами элементов первого периода.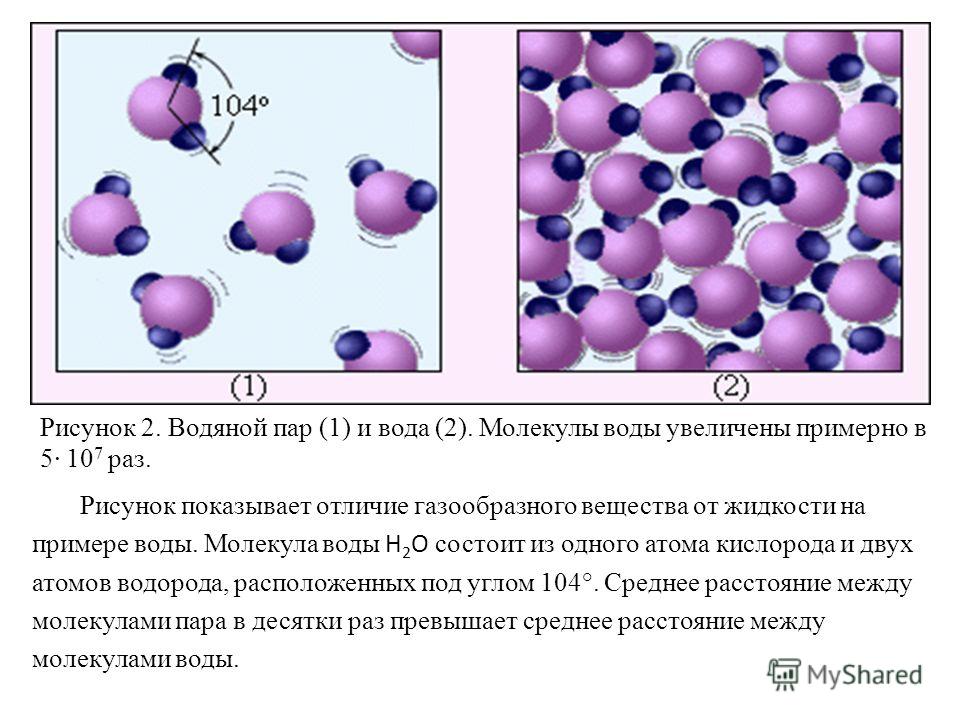 Двумя изоэлектронными молекулами являются N2 и СО.
[38]
Двумя изоэлектронными молекулами являются N2 и СО.
[38]
Таким образом, имеются основания предполагать, что 78 ккал / моль Do ( SF) 59 ккал / моль. Ближайшим аналогом молекулы SF является молекула СЮ, для которой Do ( ClO) 63 34 ккал / моль. Весьма вероятно, что энергии диссоциации изоэлектронных молекул SF
Нетрудно распространить эту качественную теорию с гомоядер-ных двухатомных молекул на гетероядерные, такие, как СО или NO. Для этого нужно только учесть, что взаимодействуют два набора атомных орбиталей, которые имеют разные энергии. Это-показано на рис. 3.13, где приведены изоэлектронные молекулы N2 и СО. [40]
| Свойства изоэлектронных веществ.| Свойства этанола и диметилэфира. [41] |
Наличие водородных связей сильно сказывается на физических и физико-химических свойствах веществ.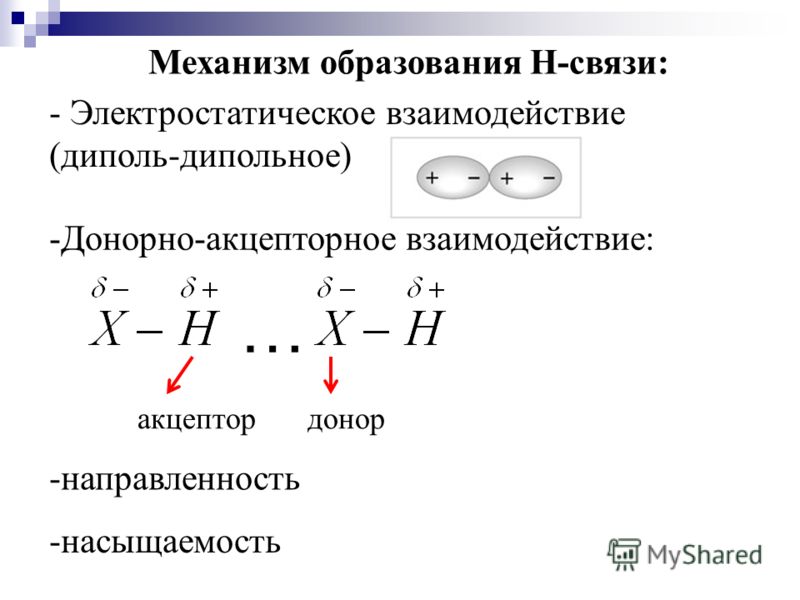
НСО радикалу, хотя точного доказательства не получено. Наблюдение полос в флуоресценции ( см. раздел IIВ) при возбуждении формальдегида коротковолновой ультрафиолетовой радиацией дает веское доказательство в пользу НСО. Кроме того, колебательная структура этих полос весьма сходна со структурой ( 3-полос изоэлектронной молекулы NO. Вращательная структура, наблюдаемая при высокой дисперсии, очень сложна; никакого ее анализа не проведено. Требуется дальнейшая работа, чтобы с достоверностью установить природу носителя. [43]
В настоящем Справочнике, помимо НВОа, рассматриваются еще два газообразных соединения этой системы: НзВОз и НВО. Стабильность ортоборной кислоты при высоких температурах существенно ниже, чем метаборной кислоты, однако при умеренных температурах и высоких давлениях паров воды НзВОз ( газ) может стать основным компонентом рассматриваемой системы. Экспериментальные данные о существовании молекул НВО в литературе отсутствуют, однако ее образование при высоких температурах можно ожидать по аналогии с изоэлектронной молекулой HCN
Экспериментальные данные о существовании молекул НВО в литературе отсутствуют, однако ее образование при высоких температурах можно ожидать по аналогии с изоэлектронной молекулой HCN
Во II томе развивается на принципиально новых примерах термодинамическое направление в химии, основы которого были заложены в I томе, и значительно углубляется учение о реакционной способности веществ и кинетике реакций. В основном, однако, внимание обращено на природу химической связи в различных ее проявлениях как в газообразных молекулах, так и в кристаллах. В этом свете затрагивается учение об ионных, металлических и атомных структурах, проблема соединений переменного состава, понятие о связевых и антисвязевых молекулярных орбиталах, представления о соединениях с недостатком и избытком электронов, а также об [45]
[45]
Страницы: 1 2 3 4
Химики создали полностью металлический аналог карбоната
Химики из Мюнхенского технического университета синтезировали изоэлектронный аналог карбонат-иона, состоящий полностью из атомов металлов — [SnBi3]5-. Это первый пример полностью металлического аналога карбоната, к тому же устойчивого в растворах. Процесс синтеза занял около семи месяцев. Исследование опубликовано в журнале Angewandte Chemie International Edition, кратко о нем сообщает Chemistry World.
Изоэлектронные аналоги — соединения, в молекулах которых содержатся одинаковое количество атомов и совпадающие наборы валентных электронов. Например, изоэлектронными аналогами являются угарный газ (CO) и азот (N2). В атоме углерода ровно на один валентный электрон меньше, чем в азоте, а в кислороде — на один больше, суммарное число валентных электронов в азоте и в угарном газе совпадает. Другие примеры — анионы серной и хлорной кислот (SO42- и ClO4—), графен и нитрид бора. Изоэлектронные частицы оказываются очень близки по своим физическим свойствам: одинаковая структура, похожие температуры плавления и кипения, сходные энергии химической связи.
Другие примеры — анионы серной и хлорной кислот (SO42- и ClO4—), графен и нитрид бора. Изоэлектронные частицы оказываются очень близки по своим физическим свойствам: одинаковая структура, похожие температуры плавления и кипения, сходные энергии химической связи.
Авторы новой работы обнаружили рекордно тяжелый изоэлектронный аналог карбонат-аниона в рамках исследования висмутидов — соединений, в которых висмут несет на себе отрицательный заряд. Химики растворили в жидком аммиаке висмутид калия (K3Bi2) и станнид калия (K4Sn9) и оставили получившуюся красную жидкость более чем на полгода. В результате, через семь месяцев ученые обнаружили в сосуде черные пластинчатые кристаллы K5[SnBi3]·9(NH3) — калиевой соли необычного аниона.
Структурный анализ показал, что [SnBi3]5- — не часть полимерной цепочки из атомов металлов, а анион в форме правильного треугольника, геометрически совпадающий с карбонат-анионом (CO32-). Как и карбонат, новый анион содержит 24 валентных электрона, все атомы висмута в нем абсолютно идентичны (заряд делокализован между резонансными структурами). В отличие от карбонатов, стабильных в водных растворах, [SnBi3]5- быстро разлагается в присутствии воды — соединение устойчиво лишь в растворах жидкого аммиака.
Как и карбонат, новый анион содержит 24 валентных электрона, все атомы висмута в нем абсолютно идентичны (заряд делокализован между резонансными структурами). В отличие от карбонатов, стабильных в водных растворах, [SnBi3]5- быстро разлагается в присутствии воды — соединение устойчиво лишь в растворах жидкого аммиака.
У карбоната есть и более простые изоэлектронные аналоги — например, анион азотной кислоты (NO3—). Ранее химики синтезировали другие аналоги карбонатов — комплексные пниктиды кремния и германия (Cs5SiP3 и другие), пниктиды алюминия и индия (Cs6InAs3). Поиск соединений с необычными электронными свойствами и нестандартных изоэлектронных аналогов позволяет проверить границы применимости современных теорий в химии.
Ранее мы сообщали о синтезе новых классов «неорганических бензолов» — веществ, электронное строение которых напоминает ароматические органические вещества, но которые при этом не содержат в себе атомов углерода.
Владимир Королёв
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
2.4B: Изоэлектронные молекулы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2540
Isoelectronic Species Periodic Trends
Наблюдение, что изоэлектронные частицы обычно изоструктурны, впервые было сделано Пенни и Сазерлендом в 1936 году, известное как изоэлектронный принцип (Джефф). В таблице 1 приведен пример периодических трендов изоструктурных изоэлектронных видов. Все эти молекулы октаэдрические и изоэлектронные в пределах своих периодов.
Все эти молекулы октаэдрические и изоэлектронные в пределах своих периодов.
Изоструктурные изоэлектронные виды в различных группах и периодах
| Таблица 1 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 |
| Период 3 | AlF 6 3 — | SiF 6 2 — | ПФ 6 — | СФ 6 | CLF 6 |
| Период 4 | GaF 6 3 — | ГЭФ 6 2 — | АсФ 6 — | СЭФ 6 | БрФ 6 + |
| Период 5 | ИнФ 6 3 — | СНФ 6 2 — | СбФ 6 — | ТЭФ 6 | ЕСЛИ 6 + |
В периодической таблице появляются и другие интересные тенденции, в том числе:
- Изоэлектронные матрицы — все изоэлектронные виды в матрице, определяемой полным числом электронов и валентными электронами, изменяются в зависимости от номера группы.
 Например, двухатомная матрица с 14 электронами/10 валентных электронов будет иметь такие молекулы, как CN —, CO и N 2 .
Например, двухатомная матрица с 14 электронами/10 валентных электронов будет иметь такие молекулы, как CN —, CO и N 2 . - Изоэлектронные массивы — атом заменяется другим, который изменяет заряд и продолжает изоэлектронные отношения. Например: BeF 4 2- , BF 4 — и CF 4 .
Ссылки
- Смит, Майкл и Джерри Марч. March’s Advanced Organic Chemistry: реакции, механизмы и структура. Хобокен, Нью-Джерси: Wiley-Interscience, 2007.
- Райнер-Кэнэм, Джефф. «Изоэлектронный ряд: фундаментальное периодическое свойство». Основы химии 11.2 (2009): 123-29.
Проблемы
1) Почему важно понимать термин «изоэлектронный» и его тенденции во всей таблице Менделеева?
2) Какой изоэлектронный вид имеет наибольший радиус?
а. Mg2+ б.N3- в. О2- д. F-
3) Назовите 3 изоструктурные молекулы
Ответы:
1) Изоэлектроника может помочь предсказать химические реакции и взаимодействия между молекулами.
2) N3-
3) AlF 6 3 — , SiF 6 2 — , ПФ 6 —
2.4B: Isoelectronic Molecules распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Изоэлектронные виды, молекулы и структура Важные понятия для JEE
«Изо» означает равный, тогда как изоэлектронный, как следует из названия, означает равный заряд или равный электрический ток. Известно, что два или более атома, молекулы или иона, имеющие одинаковое количество электронов и электронную структуру, являются изоэлектронными. Изоэлектронные частицы обычно обладают такими же химическими свойствами. Таким образом, атомы или ионы с одинаковыми электронными конфигурациями называются изоэлектронными по отношению друг к другу. Другими словами, можно также утверждать, что ионы или атомы с одинаковым числом электронов являются изоэлектронными частицами. Элементы могут быть разными, когда количество электронов одинаково, поэтому их называют изоэлектронными видами.
Говорят, что изоэлектронные виды обладают свойством изоэлектронности. Изоэлектронность — это явление между двумя или более молекулами с одинаковой структурой и электронной конфигурацией. Изоэлектроника имеет несколько применений. Это явление можно использовать для поиска редких или неизвестных соединений путем сравнения их конфигурации с известными соединениями.
Изоэлектронные частицы
Любые два или более атома, иона или молекулы, имеющие одинаковое количество электронов, называются изоэлектронными частицами. Изоэлектронные виды не обязательно должны быть одними и теми же элементами. Элементы могут отличаться.
Примеры изоэлектронных видов
Ниже приведены некоторые примеры изоэлектронных видов:
Электронная конфигурация изоэлектронной пары 1s² 2s² 2p6 .
N3-, Al3+, Mg2+, для N3- количество электронов будет равно 10, то есть 7 + 3.
 Для Al3+ будет 10, а для Mg2+ 10.
Для Al3+ будет 10, а для Mg2+ 10.OH-, h3O 18 электронов.
Как найти изоэлектронные частицы
Чтобы определить, является ли пара частиц изоэлектронной, посмотрите на расчеты ниже:
C=6e-, O=8e- и 2e- от отрицательного заряда.
Итак, CO32-⇒ 6 + (3×8) + 2 = 8 + 24 = 32 электрона
Таким же образом, для NO3- , N = 7e-, O = 8e-
NO3- (всего электронов) =7 + (3×8) + 1 = 32 электрона
И CO32-, и NO3- имеют по 32 электрона; следовательно, они изоэлектронны.
Другой пример:
PO43-⇒P=15e-
PO43-⇒15+ (8×9) +3=15+3+32=50 электронов
и SO42-⇒S имеет 16 электронов
SO42-⇒16+ (4×8) +2=16+2+32=50 электронов
Таким образом, PO43-и SO42- изоэлектронны.
CO и N2
Здесь атомный номер для C=6, O=8 и N=7.
6+8 и 7+7 = 14.
Поскольку у обоих по 14 электронов, они изоэлектронны.
Изоэлектронные ионы
Два или более ионов с одинаковым числом электронов называются изоэлектронными ионами. Некоторыми примерами изоэлектронных ионов являются ион K+, изоэлектронный иону Ca2+. Кроме того, монооксид углерода CO изоэлектронен азоту N2 и NO+.
Изоэлектронные молекулы
Две или более молекулы или группа из двух или более атомов, которые имеют одинаковую электронную конфигурацию и одинаковую структуру, но отличаются некоторыми специфическими элементами в структуре, известны как изоэлектронные молекулы.
Некоторые примеры изоэлектронных молекул включают CO, NO+ и азот (N2).
Изоэлектронный ряд
Атомы, ионы или молекулы образуют изоэлектронный ряд, когда все они имеют одинаковое количество электронов. Примеры изоэлектронного ряда включают:
O2-, F-, Na+, Mg2+, Al3+ имеют по 10 электронов.

Другой пример изоэлектронного ряда:
N3-, Al3+, Mg2+: все они имеют одинаковое количество электронов, т. видов, так как все они имеют 2 электрона (т.е. имеют одинаковую электронную конфигурацию).
Здесь также следует отметить, что все изоэлектронные частицы обладают одинаковыми химическими свойствами.
Список изоэлектронных пар
Ниже перечислены некоторые изоэлектронные пары.
CO32- и NO3-
PO43- и SO42-
CO и N2
Подробнее. изоэлектронные элементы, давайте посмотрим на некоторые другие изоэлектронные пары, их электронную конфигурацию и количество электронов.
Sr. | Isoelectronic Elements | Electronic Configuration | Number of Electrons |
1 | Na+ and F- | 1с2 2с2 2п6. | 10 |
2 | N3-, Al3+ | 1s² 2s²0026 | 10 |
3 | Ne, F- | 1s² 2s²2p⁶ | 10 |
4 | Na+, Mg2+ | 1s² 2s²2p⁶ | 10 |
5 | S2-, P3- | 1s² 2s²2p⁶3s2 3p6 | 18 |
6 | Ar, S2- | 1s² 2s²2p⁶3s2 3p6 | 18 |
7 | He, Be2+ | 1s2 | 2 |
Заключение
В статье представлено глубокое понимание таких понятий, как изоэлектронность.


 Например, двухатомная матрица с 14 электронами/10 валентных электронов будет иметь такие молекулы, как CN —, CO и N 2 .
Например, двухатомная матрица с 14 электронами/10 валентных электронов будет иметь такие молекулы, как CN —, CO и N 2 . 
 Для Al3+ будет 10, а для Mg2+ 10.
Для Al3+ будет 10, а для Mg2+ 10.
 No
No