список примеров / Справочник :: Бингоскул
Число протонов, нейтронов и определение заряда ядра: список примеровдобавить в закладки удалить из закладок
Содержание:
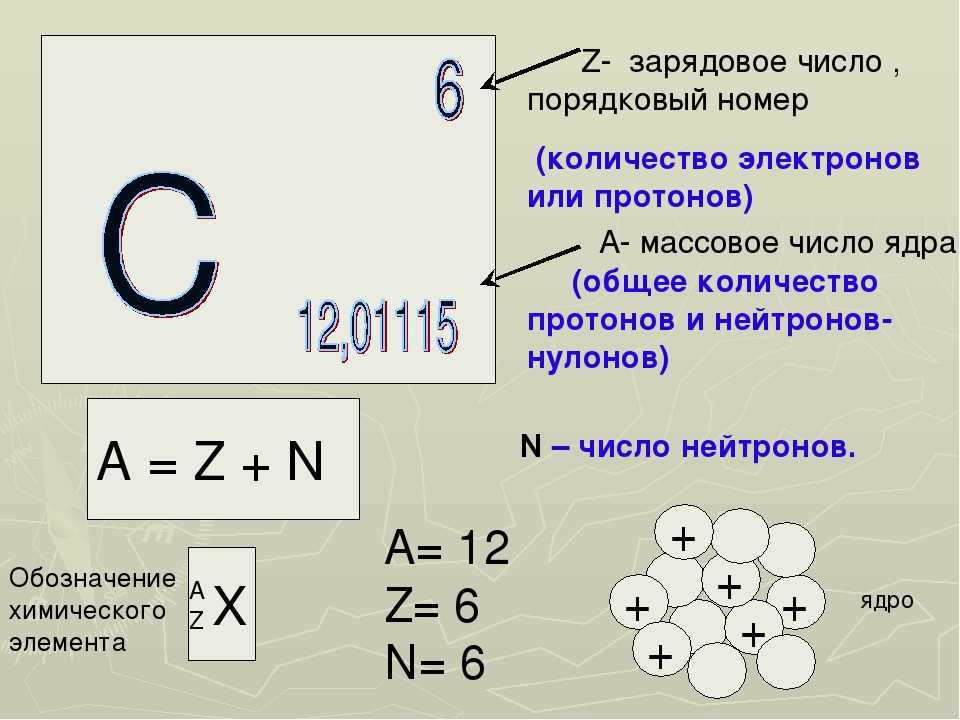
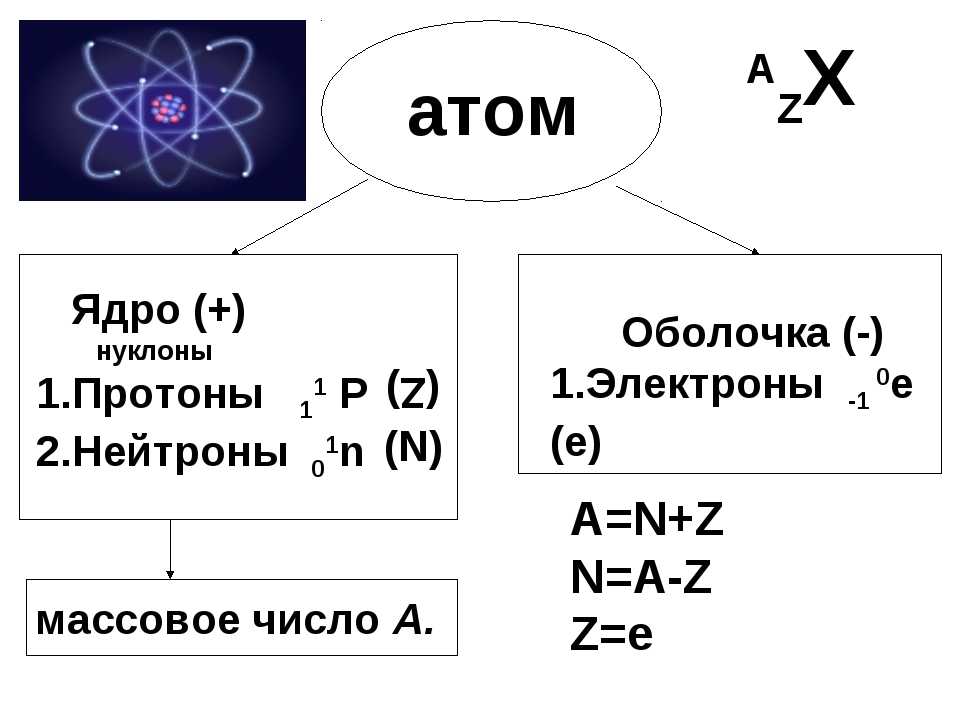
Атом – частица, которая включает протоны, нейтроны и электроны. Совокупность протонов и нейтронов атома формирует ядро, вокруг которого движутся электроны. Все элементы, содержащиеся в атоме, имеют свои особенности.
Строение атомного ядра
В 1911 году английский ученый Эрнест Резерфорд доказал, что ядро имеет положительный заряд и располагается в центре атома. Ядерный заряд численно совпадает с порядковым номером атома в периодической таблице Менделеева. Около 99 % массы сконцентрировано именно в ядре, при этом диаметр ядра примерно в 100 тысяч раз меньше диаметра самого атома.
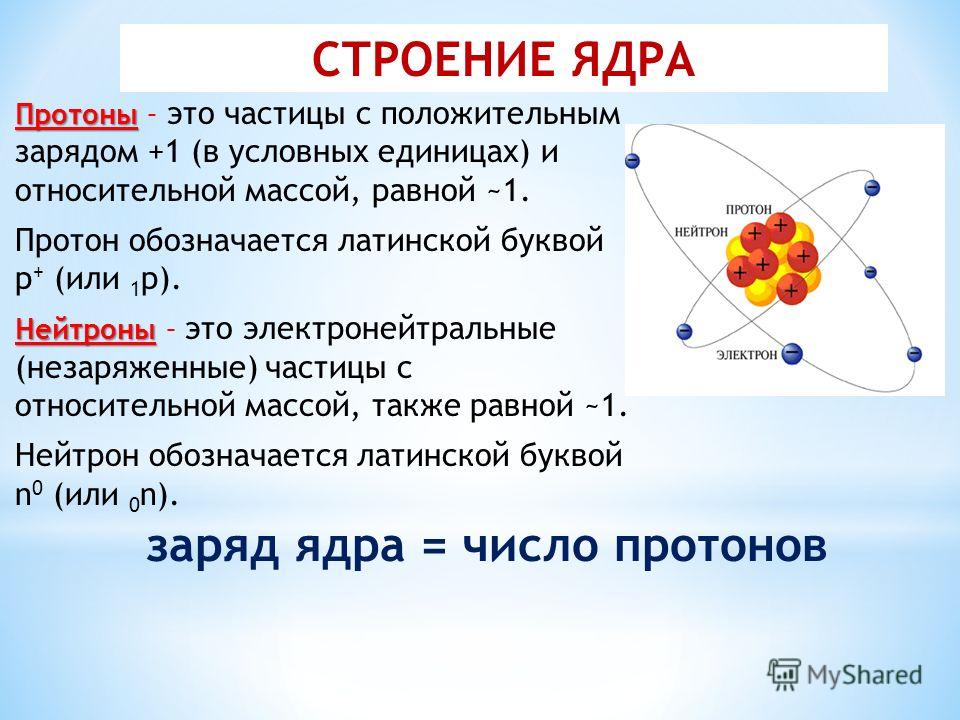
У протонов и нейтронов масса примерно одинакова и равна 1. Они схожи по строению, но различны по заряду. Протоны обладают положительным зарядом, а нейтроны – нулевым. Сумма протонов и нейтронов в одном атоме называется массовым числом.
Сумма протонов и нейтронов в одном атоме называется массовым числом.
Порядковый номер атома кремния равен 14. Таким образом, заряд ядра атома кремния равен 14. Ядро составляют 14 протонов и 14 нейтронов. Массовое число кремния равно 28.
Электроны
Электроны – отрицательно заряженные частицы. У электронов запас энергии неодинаков. Эту энергию электроны излучают или поглощают определенными порциями – квантами. Значение энергии электрона задается главным квантовым числом, которое выражается в виде целых чисел. Электроны в атоме находятся на различных энергетических уровнях.
Электроны, главное число которых равно одному (n=1), размещаются на первом энергетическом уровне. Изменение главного квантового числа связано со скачкообразным изменением энергии. При этом электроны могут переходить на следующий уровень. Максимальное число электронов на энергетическом уровне определяется по формуле:
N=2n2, где n – главное квантовое число.
Например, на первом энергетическом уровне согласно формуле может располагаться только два электрона, а на втором – восемь электронов.
Электроны, находящиеся на внешнем уровне, слабо связаны с атомным ядром, поэтому при химических взаимодействиях эти электроны легко отсоединяются. В электронейтральных атомах число электронов соответствует его порядковому номеру.
Сколько электронов в электронейтральном атоме кремния, можно узнать по порядковому номеру элемента. Таким образом, у кремния 14 электронов.
Изотопы
В экспериментальных условиях было установлено, что некоторые атомы имеют разные массовые числа. Например, для кремния характерны атомы с массовыми числами 28, 29, 40, при этом заряд атома кремния всегда равен 14. Таким образом, меняется только число нейтронов, а количество протонов постоянно. Разновидности атомов одного и того же элемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре, называются изотопами.
Поделитесь в социальных сетях:
5 ноября 2021, 15:15
Could not load xLike class!
Электричество и магнетизм
В начале двадцатого столетия был экспериментально доказан тот факт, что носителями тока в металлах являются свободные электроны. Исходя из этих представлений, немецкий физик Друде создал (1900 г.) классическую электронную теорию проводимости металлов, усовершенствованную затем другими физиками. Внутренняя структура металлов характеризуется кристаллической решеткой, например такой, какая изображена на (рис. 4.33).
Рис. 4.33. Схема кристаллической решетки металлов
В узлах решетки расположены положительные ионы, представляющие собой атомы металла, лишенные одного или нескольких валентных электронов и поэтому заряженные положительно. Эти положительные ионы способны совершать лишь небольшие тепловые колебания около своих положений равновесия в узлах кристаллической решетки. В пространстве между ионами практически свободно движутся оторвавшиеся от атомов и «обобществленные» кристаллом валентные электроны, образуя так называемый  Согласно теории Друде, электроны в кристаллической решетке ведут себя во многом подобно идеальному газу, поэтому можно использовать для описания их поведения известные формулы кинетической теории газов (рис. 4.34).
Согласно теории Друде, электроны в кристаллической решетке ведут себя во многом подобно идеальному газу, поэтому можно использовать для описания их поведения известные формулы кинетической теории газов (рис. 4.34).
Рис. 4.34. Газ свободных электронов в кристаллической решетке металла.
Показана траектория одного из электронов
В отсутствие внешнего поля любые направления скорости электронов, находящихся в хаотическом тепловом движении, равновероятны, следовательно, средняя плотность тока равна нулю, и можно сказать, что электронный газ в целом покоится по отношению к положительным ионам решетки. Согласно классической термодинамике, средняя энергия поступательного теплового движения молекул любого газа зависит лишь от температуры
|
(4. |
Отсюда находим среднеквадратичную скорость хаотического движения частиц
|
|
(4.63) |
Замечание: Отметим, что соотношения (4.62), (4.63) и вытекающие из них справедливы лишь тогда, когда распределение частиц (в данном случае электронов) по скоростям максвелловское, что, в свою очередь, имеет место тогда, когда поступательное движение полностью классично. Электронный газ в металле представляет собой квантовую систему и распределением Максвелла не описывается. Поэтому предпринятое ниже изложение классической теории Друде представляет ограниченный интерес, как способ получения качественно (по размерности) правильных соотношений, которые никак не могут претендовать на количественное согласие с экспериментом.
Мы видели (см. п. 4.1), что для комнатных температур vТ = 106 м/с. При наличии внешнего электрического поля электроны в металле будут также обладать некоторой средней (дрейфовой) скоростью v направленного движения против внешнего поля Е. Согласно данным выше оценкам, скорость v на много порядков меньше скорости vТ (рис. 4.35).
При наличии внешнего электрического поля электроны в металле будут также обладать некоторой средней (дрейфовой) скоростью v направленного движения против внешнего поля Е. Согласно данным выше оценкам, скорость v на много порядков меньше скорости vТ (рис. 4.35).
Рис. 4.35. Движение свободного электрона в кристаллической решетке:
b — хаотическое движение с дрейфом, обусловленным электрическим полем.
Масштабы дрейфа сильно преувеличены
Если рассматривать электронный газ в металле как идеальный газ, то тепловое движение электронов в кристаллической решетке можно охарактеризовать средней длиной свободного пробега , то есть средним расстоянием, проходимым свободно движущимися электронами в металле между двумя последовательными столкновениями с ионами решетки.
Так как v << vТ, то можно считать, что ни ни не меняются при наложении электрического поля Е.
Закон Ома
При наличии внешнего электрического поля Е на электрон действует сила F = еЕ, вследствие чего он приобретает ускорение
(m — масса электрона). Будем считать, что при столкновении с ионом электрон полностью теряет свою скорость направленного движения: vmin = 0. Далее он начинает ускоряться электрическим полем и к следующему столкновению приобретает скорость
Следовательно, средняя скорость направленного движения v за период между двумя столкновениями, то есть за время составляет
|
(4. |
Значит, плотность тока будет равна
|
(4.65) |
Сопоставляя полученное для плотности тока j выражение с законом Ома (4.9), получаем формулу для проводимости
|
|
(4.66) |
Приведем численные оценки. как будет показано в дальнейшем, связь длины свободного пробега с эффективным
сечением рассеивающего центра (иона) и концентрацией этих центров имеет вид
Для металлов, как мы уже обсуждали, концентрация ионов примерно совпадает с концентрацией свободных электронов
Подставляя выражение для в формулу (4. 66), получаем
66), получаем
|
(4.67) |
Оценку для сечения можно получить, зная порядок диаметров атомов
откуда
Скорость хаотического движения была оценена как vТ = 105 м/с. Получаем теперь из (4.67) значение удельного сопротивления
|
(4.68) |
Полученная оценка действительно воспроизводит порядок величины удельных сопротивлений металлов, представленных в таблице (см. п. 4.3).
Закон Джоуля — Ленца
При столкновении с ионом, как мы предположили, электрон передает ему набранную за время энергию дрейфа
Умножая We на концентрацию электронов n и деля на время получаем тепловую энергию, передаваемую единице объема проводника в единицу времени (то есть плотность мощности)
|
|
(4. |
Последнее равенство в этой цепочке получено с использованием выражения (14.66) для . В результате мы вывели закон Джоуля — Ленца (4.60) из микроскопической теории.
Закон Видемана — Франца
Металлы, наряду с высокой электропроводностью, характеризуются также и большой теплопроводностью. В 1853 г. немецкие физики Г. Видеман и Р. Франц установили эмпирический закон, согласно которому отношение коэффициента теплопроводности
|
(4. |
где произведение nm концентрации электронов на их массу подставлено вместо плотности электронного газа.
Удельная теплоемкость одноатомного газа равна
|
(4.71) |
Подставляя это значение в выражение для коэффициента теплопроводности k, получим
|
(4.72) |
Разделив k на , получим
Поскольку
приходим к соотношению
|
|
(4.73) |
Это соотношение выражает закон Видемана — Франца. Подставив значения kВ = 1,38·10–23 Дж/К и е = 1,6·10–19 Кл, получим
Подставив значения kВ = 1,38·10–23 Дж/К и е = 1,6·10–19 Кл, получим
|
(4.74) |
Однако полученное соотношение недостаточно точно согласуется с экспериментом, то есть классическая теория объяснила закон Видемана — Франца лишь качественно. Следующая из классической теории зависимость удельного сопротивления от температуры
также не согласуется с экспериментом. Объяснение всех несоответствий смогла дать только квантовая теория.
Модуль 1 — Разработка — Структура атома
Чтобы полностью понять структуру и поведение атомов, необходимо иметь рабочее представление о том, как выглядят атомы, из которых состоят молекулы. На вводных курсах химии вы узнали, что атомы состоят из трех типов частиц: протонов, , нейтронов, и выборов. Протоны и нейтроны имеют почти одинаковую массу; но протоны заряжены положительно, а нейтроны нейтральны. Электроны, с другой стороны, имеют очень маленькую массу по сравнению с протонами и нейтронами и отрицательный заряд, равный заряду протона. Атомы каждого элемента определяются количеством содержащихся в нем протонов, что обозначено цифрой 9.0003 атомный номер для элемента. Например, атомный номер элемента углерода (C) равен 6, что означает, что каждый атом углерода содержит 6 протонов. Нейтральный атом имеет равное количество протонов и электронов, следовательно, нейтральный атом углерода также содержит 6 электронов. (Для дальнейшего чтения см. Раймонд, разделы 2.1–2.3)
Протоны и нейтроны имеют почти одинаковую массу; но протоны заряжены положительно, а нейтроны нейтральны. Электроны, с другой стороны, имеют очень маленькую массу по сравнению с протонами и нейтронами и отрицательный заряд, равный заряду протона. Атомы каждого элемента определяются количеством содержащихся в нем протонов, что обозначено цифрой 9.0003 атомный номер для элемента. Например, атомный номер элемента углерода (C) равен 6, что означает, что каждый атом углерода содержит 6 протонов. Нейтральный атом имеет равное количество протонов и электронов, следовательно, нейтральный атом углерода также содержит 6 электронов. (Для дальнейшего чтения см. Раймонд, разделы 2.1–2.3)
Масса атома определяется прежде всего количеством содержащихся в нем протонов и нейтронов. Сумма числа протонов и нейтронов в атоме называется номер атомной массы . Это число примерно равно массе атома в атомных единицах массы. Число нейтронов, которое имеет атом данного элемента, является переменным, что приводит к различным изотопам для элемента.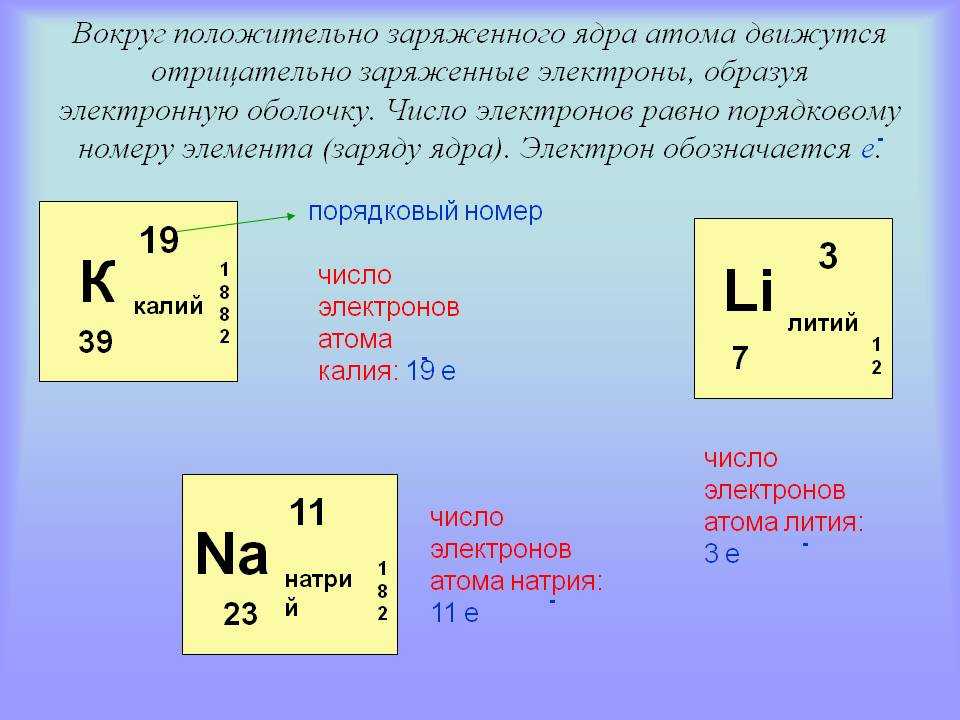 Например, самый распространенный изотоп углерода имеет 6 нейтронов в дополнение к 6 протонам, что дает ему атомное массовое число 12. Этот изотоп углерода называется углерод-12. Другие изотопы углерода, встречающиеся в природе, включают углерод-13 с 7 нейтронами и углерод-14 с 8 нейтронами. Атомные массы, которые даны для элементов в периодической таблице, представляют собой средневзвешенное значение масс различных изотопов элемента, основанное на относительном содержании различных изотопов элемента, встречающихся в природе.
Например, самый распространенный изотоп углерода имеет 6 нейтронов в дополнение к 6 протонам, что дает ему атомное массовое число 12. Этот изотоп углерода называется углерод-12. Другие изотопы углерода, встречающиеся в природе, включают углерод-13 с 7 нейтронами и углерод-14 с 8 нейтронами. Атомные массы, которые даны для элементов в периодической таблице, представляют собой средневзвешенное значение масс различных изотопов элемента, основанное на относительном содержании различных изотопов элемента, встречающихся в природе.
Ниже приведен рисунок, иллюстрирующий это с тремя встречающимися в природе изотопами водорода, водородом-1, водородом-2 и водородом-3:
Метки под каждой моделью на этом изображении показывают другой способ представления изотопов элемента; верхний индекс слева от химического символа элемента указывает атомную массу, а нижний индекс слева от химического символа указывает атомный номер. Нижний индекс часто опускается, так как он избыточен по отношению к химическому символу; водород (H) по определению имеет атомный номер 1.
Изображения водорода-1, водорода-2 и водорода-3, показанные выше, основаны на модели атома, разработанной в начале 19 века.00-х. В этой модели протоны и нейтроны плотно упакованы в центре атома в области, называемой ядром . Электроны окружают ядро диффузным облаком.
Как было сказано выше, количество протонов, содержащихся в атоме, определяет, к какому элементу он относится. Количество нейтронов в атоме определяет изотоп элемента. Количество электронов в атоме также может варьироваться. Нейтральный атом имеет равное количество протонов и электронов.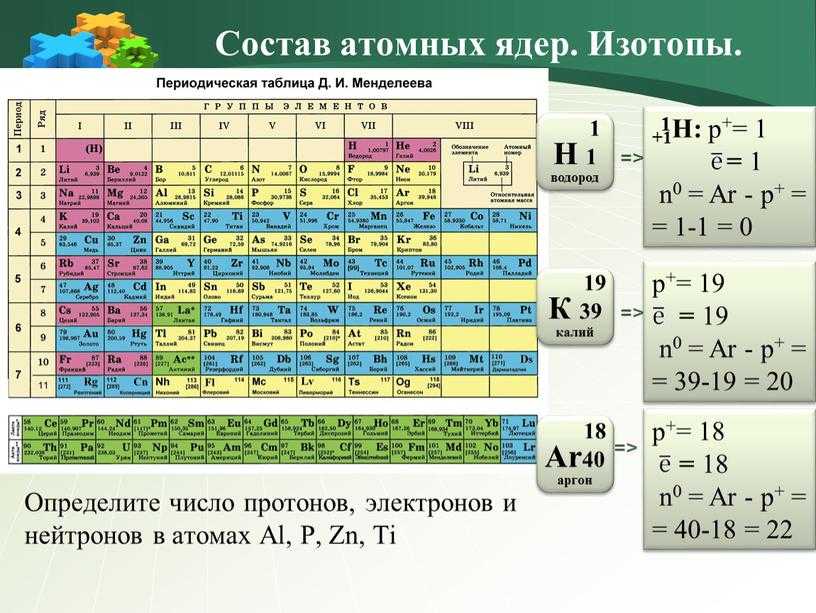 Это приводит к тому, что положительные заряды протонов точно уравновешиваются отрицательными зарядами электронов. При выполнении химии атомам не разрешается приобретать или терять протоны, однако они могут приобретать или терять электроны. Это приведет к чистому заряду атома. Атомы, имеющие большее число электронов, чем протоны, имеют суммарный отрицательный заряд, такие атомы называются отрицательные ионы или анионы . Атомы, у которых меньше электронов, чем у протонов, имеют суммарный положительный заряд, такие атомы называются положительными ионами или катионами . Например, кальций (Ca) имеет атомный номер 20. Это означает, что все атомы кальция содержат 20 протонов. Нейтральный атом кальция также будет иметь 20 электронов. Наиболее распространенной ионной формой кальция является Ca 2+ , который имеет положительный заряд 2. Таким образом, ион Ca 2+ содержит 18 электронов.
Это приводит к тому, что положительные заряды протонов точно уравновешиваются отрицательными зарядами электронов. При выполнении химии атомам не разрешается приобретать или терять протоны, однако они могут приобретать или терять электроны. Это приведет к чистому заряду атома. Атомы, имеющие большее число электронов, чем протоны, имеют суммарный отрицательный заряд, такие атомы называются отрицательные ионы или анионы . Атомы, у которых меньше электронов, чем у протонов, имеют суммарный положительный заряд, такие атомы называются положительными ионами или катионами . Например, кальций (Ca) имеет атомный номер 20. Это означает, что все атомы кальция содержат 20 протонов. Нейтральный атом кальция также будет иметь 20 электронов. Наиболее распространенной ионной формой кальция является Ca 2+ , который имеет положительный заряд 2. Таким образом, ион Ca 2+ содержит 18 электронов.
Видео с вопросами: определение элемента атома по его электронным оболочкам
Стенограмма видео
На схеме показаны электроны в различных электронных оболочках атома. Атом электрически нейтрален. Атом какого элемента это?
Атом электрически нейтрален. Атом какого элемента это?
У нас есть эта диаграмма, которая, как нам сказали, показывает атом с электронами в разных электронных оболочках. Этот красный круг, который мы видим в центре диаграммы, представляет собой ядро атома, и именно здесь находятся все атомы, протоны и нейтроны. Затем вокруг этого ядра мы видим эти два черных кольца, и они представляют собой первые две электронные оболочки атома.
Эти электронные оболочки, также известные как энергетические уровни атома, находятся там, где находятся электроны атома. Эти электроны представлены маленькими синими кружками, нарисованными на каждом из колец. Ближайшая к ядру оболочка — именно она представлена черным кольцом здесь на нашей диаграмме — известна как первая электронная оболочка или первый энергетический уровень. Затем следующая оболочка — та, что представлена этим кольцом на нашей диаграмме, — это вторая электронная оболочка или энергетический уровень.
Если бы у атома также были электроны на более высоких электронных оболочках, то следующим из них была бы третья оболочка, затем у нас была бы четвертая оболочка и так далее. Однако когда мы рисуем схему атома, мы обычно рисуем только те электронные оболочки, в которых есть хотя бы один электрон. Итак, в данном случае это только первые две оболочки.
Однако когда мы рисуем схему атома, мы обычно рисуем только те электронные оболочки, в которых есть хотя бы один электрон. Итак, в данном случае это только первые две оболочки.
Вопрос заключается в том, чтобы определить, атомом какого элемента является этот элемент. Нам говорят, что атом электрически нейтрален, а это означает, что он не имеет общего электрического заряда. Можно вспомнить, что заряд электрона и заряд протона равны по величине, но противоположны по знаку. Протоны заряжены положительно, а электроны – отрицательно. Чтобы атом был электрически нейтральным, количество отрицательно заряженных электронов должно быть равно количеству положительно заряженных протонов, потому что тогда отрицательные и положительные заряды точно компенсируют друг друга, оставляя атом без общего электрического заряда.
Теперь нам может быть интересно, почему эта информация о количестве электронов и количестве протонов в нейтральном атоме полезна для нас в этом вопросе. Итак, нас просят определить, атомом какого элемента является этот атом на диаграмме. И можно вспомнить, что этот элемент определяется атомным номером атома, равным числу протонов в ядре атома.
И можно вспомнить, что этот элемент определяется атомным номером атома, равным числу протонов в ядре атома.
На диаграмме, которую мы даем в этом вопросе, мы не можем напрямую увидеть, сколько протонов содержится в ядре, потому что это ядро просто нарисовано в виде одного красного круга. Однако что мы можем сделать, так это подсчитать все электроны, притянутые к оболочкам вокруг этого ядра. И тогда, поскольку мы знаем, что для электрически нейтрального атома число электронов равно числу протонов в ядре, то число электронов, которое мы посчитаем, даст нам атомный номер атома, что позволит нам работать из какого элемента это атом.
Чтобы подсчитать количество электронов в этом атоме, давайте пронумеруем синие кружки, нарисованные на каждом из черных колец на диаграмме. Мы видим, что на внутреннем кольце или первой электронной оболочке есть два электрона. А затем на внешнем кольце, которое представляет вторую электронную оболочку, есть четыре электрона. Таким образом, общее количество электронов в атоме равно двум электронам с первой оболочки плюс четырем электронам со второй оболочки, что в сумме дает шесть.


 62)
62) 64)
64) 69)
69) 70)
70)