Строение электронных оболочек атома
Цель урока: Сформировать представления учащихся о строении электронной оболочки атома на примере химических элементов 1–3 периодов периодической системы. Закрепить понятия “периодический закон” и “периодическая система”.
Задачи урока: Научиться составлять электронные формулы атомов, определять элементы по их электронным формулам, определять состав атома.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, классная доска, мультимедиа-проектор, персональный компьютер, макет и презентация “Составление электронных формул строения атомов”.
Тип урока: комбинированный
Методы: словесный, наглядный.
Ход урока
I. Организационный момент.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Учитель проговаривает и записывает тему урока на доске “Строение

II. Объяснение нового материала
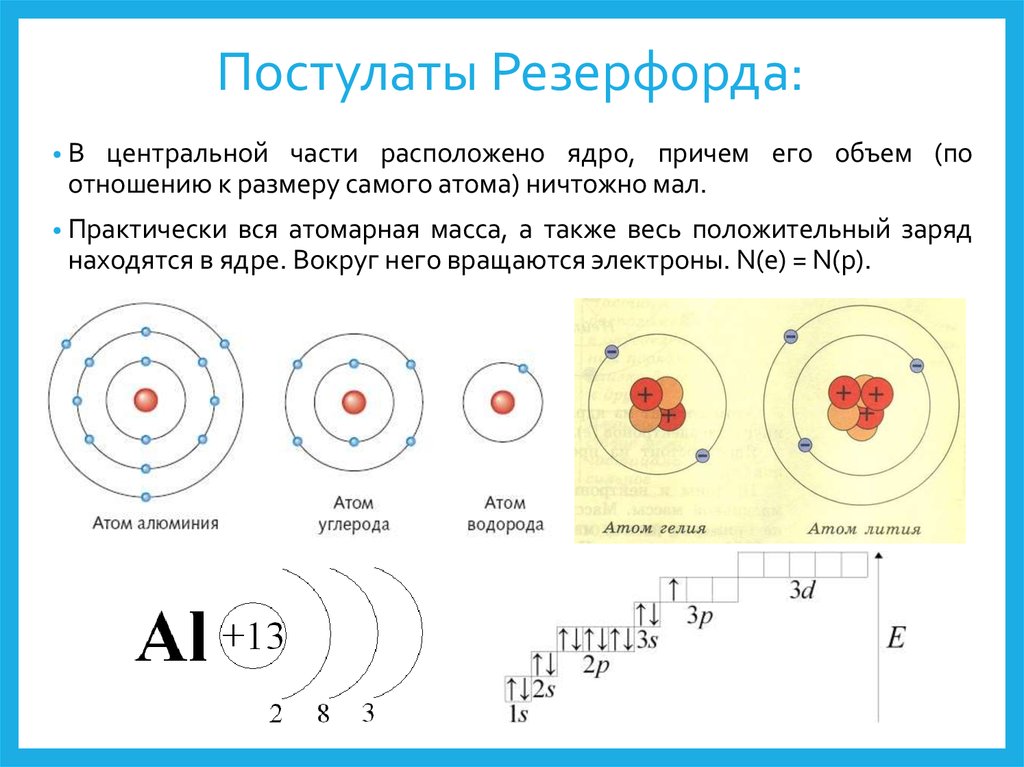
Учитель: В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца. (Презентация. Слайд 1. Модель Резерфорда).
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в
определенном порядке? Исследования Нильса Бора
– основоположника современной атомной физики, а также ряда других ученых
позволили сделать вывод: электроны в атомах располагаются определенными слоями –
оболочками и в определенном порядке.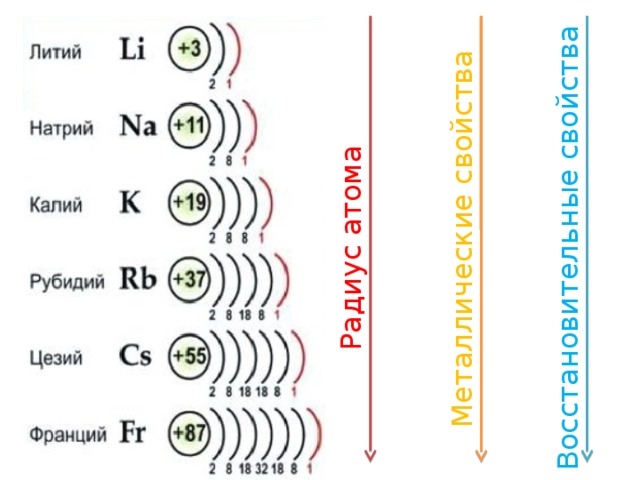
Строение электронных оболочек атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются
 Чем больше значение n,
тем больше энергия электрона в атоме. Максимальное число электронов, которое
может находиться на том или ином энергетическом уровне, определяется по формуле:
Чем больше значение n,
тем больше энергия электрона в атоме. Максимальное число электронов, которое
может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне
электронной оболочки атома равно номеру группы для химических
элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p)
| S – орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:
Электронное облако такой формы может занимать в атоме три положения
 Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.
Это легко
объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака
взаимно отталкиваются и стремятся разместиться как можно дальше друг от
друга.| Три p – орбитали |
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
- Определяем общее число электронов на оболочке по порядковому номеру элемента.
- Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
- Определяем число электронов на каждом энергетическом уровне.

- Используя для обозначения уровня арабские цифры и обозначая орбитали
буквами s и p, а число электронов данной орбитали арабской цифрой вверху
справа над буквой, изображаем строение атомов более полными электронными
формулами. Ученые условились обозначать каждую атомную орбиталь
На s-подуровне может находиться одна атомная орбиталь
а на p—подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d– и f—подуровня в атоме может быть уже пять и семь соответственно:
Пример:
Чтобы установить связь между строением атома химического элемента и его
свойствами, рассмотрим еще несколько химических элементов.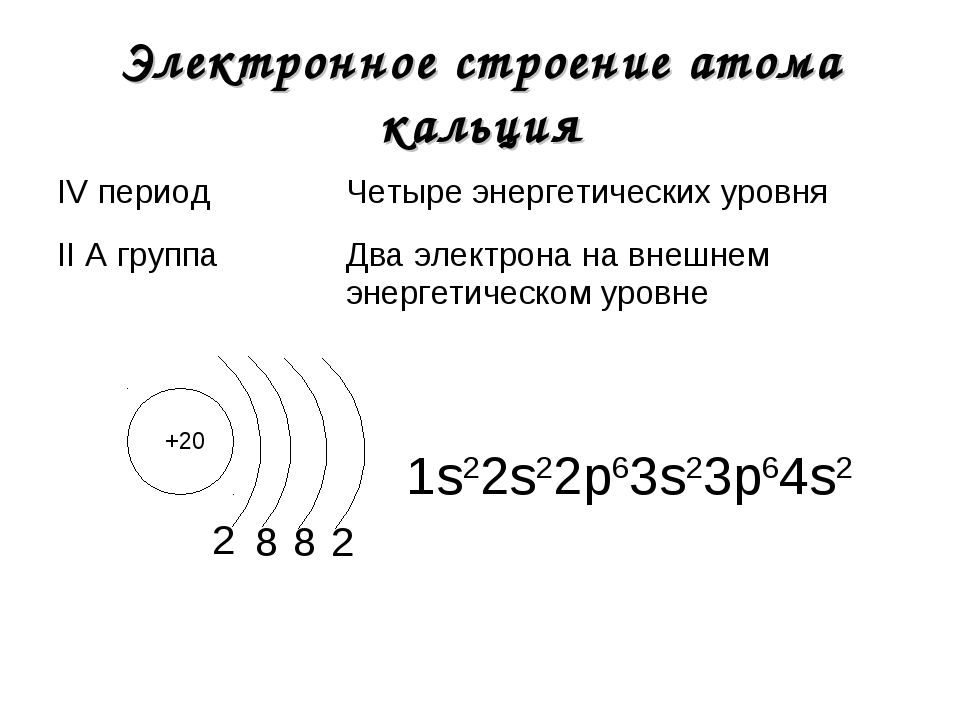
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема.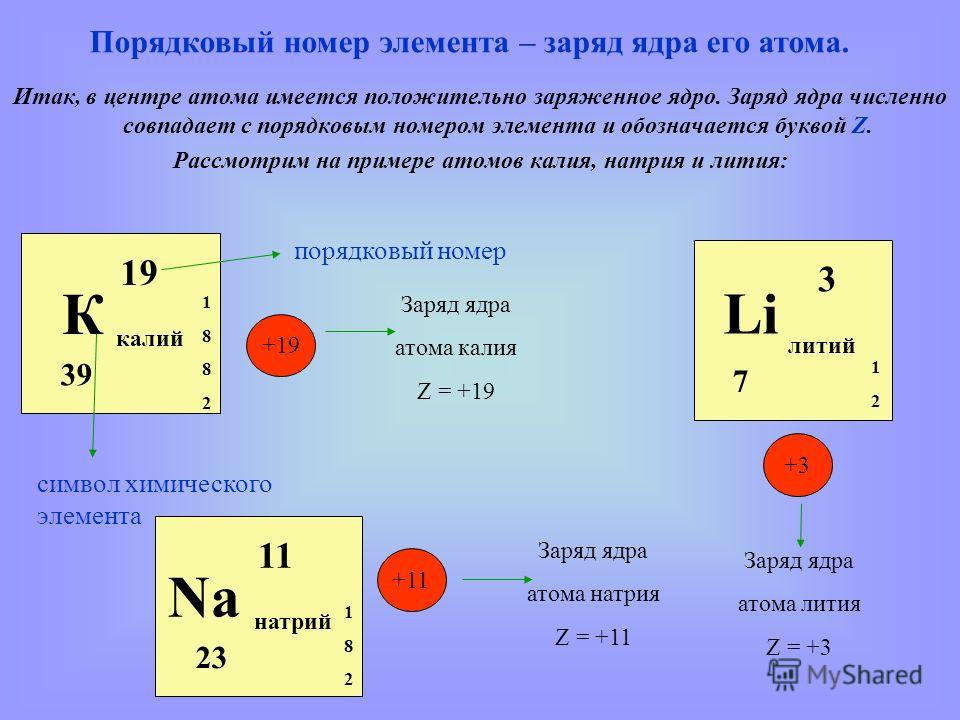 Пользуясь
этим правилом, нетрудно составить схему электронного строения для атома азота:
Пользуясь
этим правилом, нетрудно составить схему электронного строения для атома азота:
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у
которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем
следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня
внешнего электронного слоя. Структура внешнего электронного слоя соответствующих
элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с
увеличением заряда ядра электронная структура внешних слоев атомов периодически
повторяется. Если элементы имеют одинаково устроенные внешние энергетические
уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на
внешнем уровне по восемь электронов, и потому они инертны, то есть почти не
вступают в химические реакции. В свободном виде аргон и неон – газы, которые
имеют одноатомные молекулы.
Структура внешнего электронного слоя соответствующих
элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с
увеличением заряда ядра электронная структура внешних слоев атомов периодически
повторяется. Если элементы имеют одинаково устроенные внешние энергетические
уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на
внешнем уровне по восемь электронов, и потому они инертны, то есть почти не
вступают в химические реакции. В свободном виде аргон и неон – газы, которые
имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Далее, учитель вместе с учениками делают выводы по пройденной теме и повторяют материал.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда
ядра, периодически повторяются, так как периодически повторяется строение
внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
IV. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) натрия;
б) кремния
2. Сравните строение атомов азота и фосфора.
3. По данным о распределении валентных электронов найдите элемент:
а) 1s2 2s1
б) 1s2 2s22p63s23p6
в) 1s22s22p63s23p4
г) 1s2 2s22p4
д) 1s22s22p63s23p64s1
4. Используя компьютерную презентацию “Составление электронных формул
строения атомов” составьте электронные формулы атомов а) азота; б) серы.
Используя компьютерную презентацию “Составление электронных формул
строения атомов” составьте электронные формулы атомов а) азота; б) серы.
5. Используя макет “Составление электронных формул строения атомов” электронные формулы атомов: а) магния; б) кислорода.
V. Домашнее задание: § 8, Стр. 28-33.
Нарисуйте схемы строения электронных оболочек атомов: бора, хлора, лития, алюминия.
Приложение.
Строение атома кальция и схема электронной оболочки
4.4
Средняя оценка: 4.4
Всего получено оценок: 181.
4.4
Средняя оценка: 4.4
Всего получено оценок: 181.
Кальций (Ca) – щелочноземельный металл, входящий в состав минералов. Из-за строения атома кальций проявляет активные восстановительные свойства. Играет важную роль в метаболизме и постройке организма.
Строение
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
Рис. 2. Строение атома.Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция – CaCO3, который является главным соединением известняка, мела, мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Кальций – металл серебристого цвета с температурой плавления 854°С.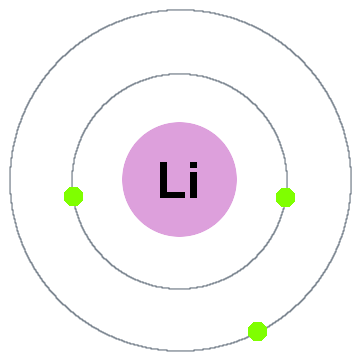 При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
Схема строения атома определяет химические свойства элемента. Кальций активно реагирует с простыми и сложными веществами. Из-за способности быстро присоединять кислород, образуя на поверхности оксидную плёнку, кальций хранят под слоем парафина или керосина в плотно закрытой таре. Основные реакции кальция с элементами и соединения приведены в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом при нагревании (реакция горения) | Оксид кальция (негашёная известь) | 2Ca + O2 → 2CaO |
С большинством неметаллов при нагревании | Соли | – Ca + S → CaS; – Ca + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Ca + 2C → CaC2; – 2Ca + Si → Ca2Si; – Ca + Cl2 → CaCl2 |
С фтором даже на холоде | Фторид кальция | Ca + F2 → CaF2 |
С водой | Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, выделяется водород | Ca + 2H2O → Ca(OH)2↓ + H2↑ |
С кислотами | Соли | Ca + 2HCl → CaCl2 + H2↑ |
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Кальций – активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами. Оксид кальция называется негашёной известью, гидроксид – гашёной известью. Большинство солей кальция плохо растворяются в воде. Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Алексей Беляев
4/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 181.
А какая ваша оценка?
Литий, атомарная структура — Stock Image — C018/3684
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3684
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Литий (Li). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома лития-7 (атомный номер: 3), наиболее распространенного изотопа элемента лития. Ядро состоит из 3 протонов (красный) и 4 нейтронов (оранжевый). Три электрона (белые) включают относительно нестабильный электрон во внешней оболочке (кольце). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Литий является щелочным металлом в группе 1, периоде 2 и s-блоке периодической таблицы. Это мягкий химически активный металл, менее плотный, чем вода, плавящийся при 180 градусах Цельсия.
Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома лития-7 (атомный номер: 3), наиболее распространенного изотопа элемента лития. Ядро состоит из 3 протонов (красный) и 4 нейтронов (оранжевый). Три электрона (белые) включают относительно нестабильный электрон во внешней оболочке (кольце). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Литий является щелочным металлом в группе 1, периоде 2 и s-блоке периодической таблицы. Это мягкий химически активный металл, менее плотный, чем вода, плавящийся при 180 градусах Цельсия.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 2 с
- 2с1
- щелочной металл
- щелочные металлы
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 1
- гелий-7
- иллюстрация
- изотоп
- уровень
- уровней
- ли
- литий
- металл
- металлик
- металлы
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 2
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- с блок
- S-блок
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- валентная орбиталь
- волновая функция
Литий Модель Бора — схема, этапы рисования
Литий — химический элемент 1-й группы.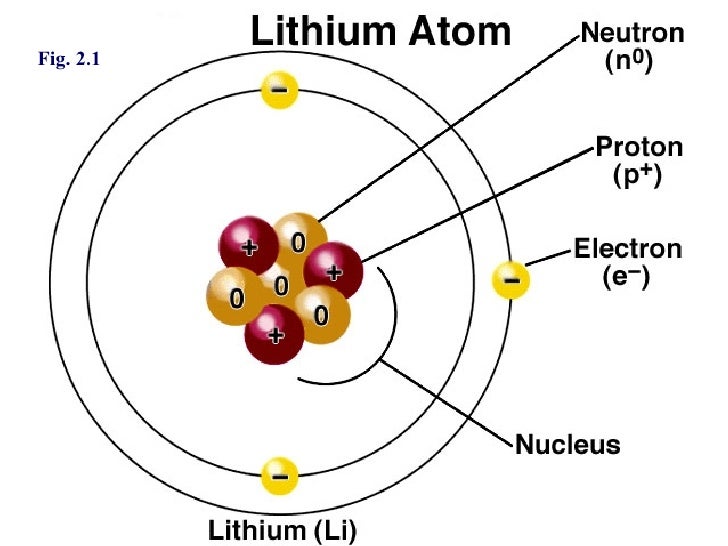 Он имеет атомный номер 3 и обозначается символом Li. Это очень реакционноспособное и легковоспламеняющееся вещество, из-за чего его обычно хранят в инертных условиях, чаще всего погруженным в инертную жидкость, например керосин.
Он имеет атомный номер 3 и обозначается символом Li. Это очень реакционноспособное и легковоспламеняющееся вещество, из-за чего его обычно хранят в инертных условиях, чаще всего погруженным в инертную жидкость, например керосин.
Это щелочной металл с металлическим блеском, подверженный коррозии при воздействии влаги. Обычно он встречается в виде ионного соединения, такого как пегматитовые минералы. Литий также можно выделить электролитически из смеси хлорида калия и хлорида лития. Он используется при изготовлении литий-ионных аккумуляторов, производстве стекла, пиротехники и т. д.
Привет, ребята!! Итак, вы, ребята, готовы к еще одной интересной статье?
Сегодня мы поговорим о литии и его атомной структуре.
Продолжайте читать….
Модель лития Бора
Модель атомов Бора или, точнее, модель Бора-Резерфорда была предложена Эрнстом Резерфордом и Нилом Бором в 1913 году. Резерфордом в 1911 году.
Более ранняя модель не могла объяснить причину стабильности электронов, вращающихся вокруг ядра, и, следовательно, не могла соответствовать законам классической механики и электромагнитной теории.
Новая модель, то есть модель Бора-Резерфорда, объясняла, что электроны — это движущиеся частицы, которые вращаются вокруг ядра по определенной круговой орбите с фиксированной энергией и размером.
Модель Бора описывает структуру атома, определяя место и заряд всех видов атомов. Графическое представление также иллюстрирует массовое число и атомный номер атома.
Прежде чем мы перейдем к модели лития Бора, я хотел бы описать несколько терминов, которые помогут вам лучше понять структуру. Их:
• Ядро: Это сердце или ядро атома. Он обладает положительным зарядом благодаря составляющим его частицам, то есть протонам. Другими атомными частицами, присутствующими в ядре, являются нейтроны.
• Протоны: Они расположены внутри ядра и придают ему положительный заряд.
• Нейтроны: Они также находятся внутри ядра, но имеют нейтральный заряд.
• Электроны: Единственный тип атомных частиц, присутствующих вне ядра в атомном пространстве.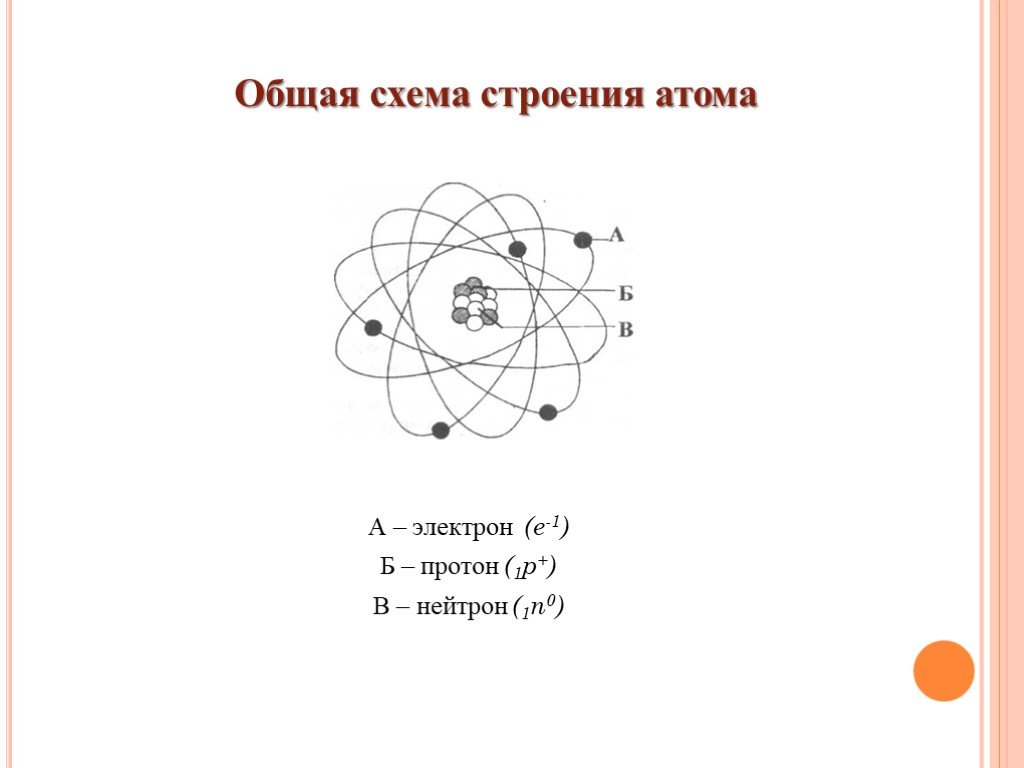 Они не застаиваются, как другие атомные частицы, а циркулируют вокруг ядра.
Они не застаиваются, как другие атомные частицы, а циркулируют вокруг ядра.
• Оболочки: Электроны движутся вокруг атомов по их орбитам, известным как оболочки. Это предопределенные пути и связанные с ними фиксированные энергии, из-за которых они также известны как энергетические уровни.
Обычно самая маленькая оболочка, расположенная ближе всего к атому, имеет наименьшую энергию, а самая большая и самая дальняя оболочка имеет максимальную энергию.
Раковинам также даются имена в нумерологическом и алфавитном порядке. Самой внутренней оболочке присваивается наименьшее значение, которое увеличивается наружу, т.е. K, L, M, N и т. д., или 1, 2, 3, 4 и т. д. Электронная пропускная способность оболочки также увеличивается наружу
Говорят, что электроны, расположенные в оболочке, ближайшей к ядру, т. Е. К-оболочке, находятся в основном состоянии, как и назначенная им оболочка, они также несут максимальную энергию из всех электронов.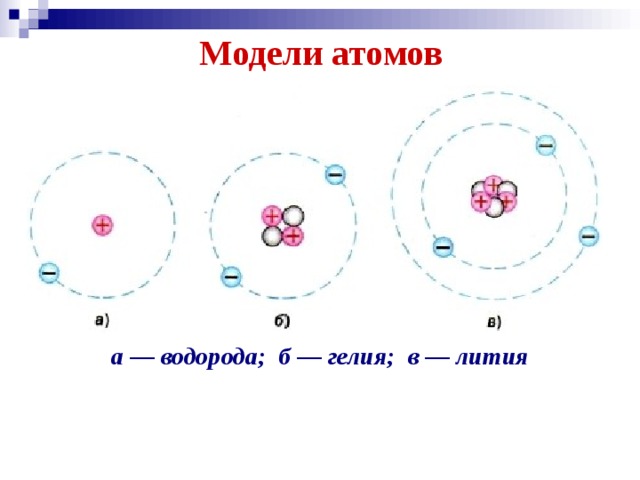
Аналогичным образом, электроны, расположенные в самой удаленной от ядра оболочке (здесь название оболочки может отличаться в зависимости от типа атома), имеют наибольшую энергию и называются валентными электронами, а оболочка известна как валентная оболочка
Электроны также способны прыгать вверх и вниз со своих орбит на более высокую или более низкую орбиту соответственно. Электрон, который поглощает энергию, прыгает вверх, а электрон, теряющий энергию, прыгает вниз
Атом лития состоит из 3 протонов и 4 нейтронов в ядре, и 3 электрона вращаются вокруг атома лития в 2 оболочках, т.е. K и L оболочках.
| Атом лития | Значение |
| № протона | 3 |
| № нейтрона | 4 |
| Количество электронов | 3 |
| Количество снарядов | 2 |
| Количество электронов в первой (K) оболочке | 2 |
| Количество электронов во второй (L) оболочке | 1 |
| Количество валентных электронов | 1 |
Чертеж Бора Модель лития
Литий относится к группе 1 и периоду 2 периодической таблицы. Его местонахождение описано ниже:
Его местонахождение описано ниже:
Информация, которую мы можем получить из вышеупомянутой литиевой коробки, следующая:
• Литий имеет атомный номер 3.
• Литий имеет электронную конфигурацию [He] 2s 1 .
• Литий имеет химический символ Li.
• Литий имеет атомную массу 6,938.
Теперь с помощью этой информации мы можем нарисовать Боровскую модель атома лития.
Начнем с рисования ядра атома лития, для чего нам нужно будет рассчитать количество протонов и нейтронов в атоме лития.
Сначала мы посчитаем количество протонов
Количество протонов для любого атома всегда равно атомному номеру этого атома.
В случае атома лития атомный номер равен 3.
Следовательно, для атома лития число протонов = атомный номер = 3
Далее рассчитаем количество нейтронов, присутствующих в атоме лития.
Следующую формулу можно использовать для расчета количества нейтронов в атоме
Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Глядя на литиевую коробку что мы нарисовали выше, можно сказать, что атомная масса атома лития равна 6,938.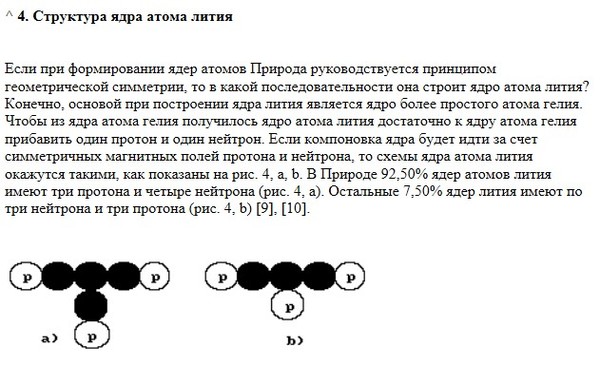
После округления до ближайшего целого числа получаем 7.
Кроме того, как подсчитано выше, количество протонов в атоме лития равно 3.
Теперь найдем количество нейтронов по формуле:
Количество нейтронов в атоме лития = 7 – 3 = 4
Следовательно, количество нейтронов в атоме лития = 4
Используя эти значения, мы нарисуем ядро атома лития.
На приведенной выше диаграмме p + = протоны и n° = нейтроны.
Теперь рассчитаем количество электронов у атома лития.
На самом деле количество электронов, как и протонов в атоме, одинаково, так как они оба равны порядковому номеру атома.
Следовательно, для атома лития также
Число электронов = 3 = атомный номер лития
Здесь важно отметить, что электроны являются единственным типом атомных частиц, которые ядро.
Каждый электрон имеет определенную оболочку, в которой он находится в зависимости от его энергии.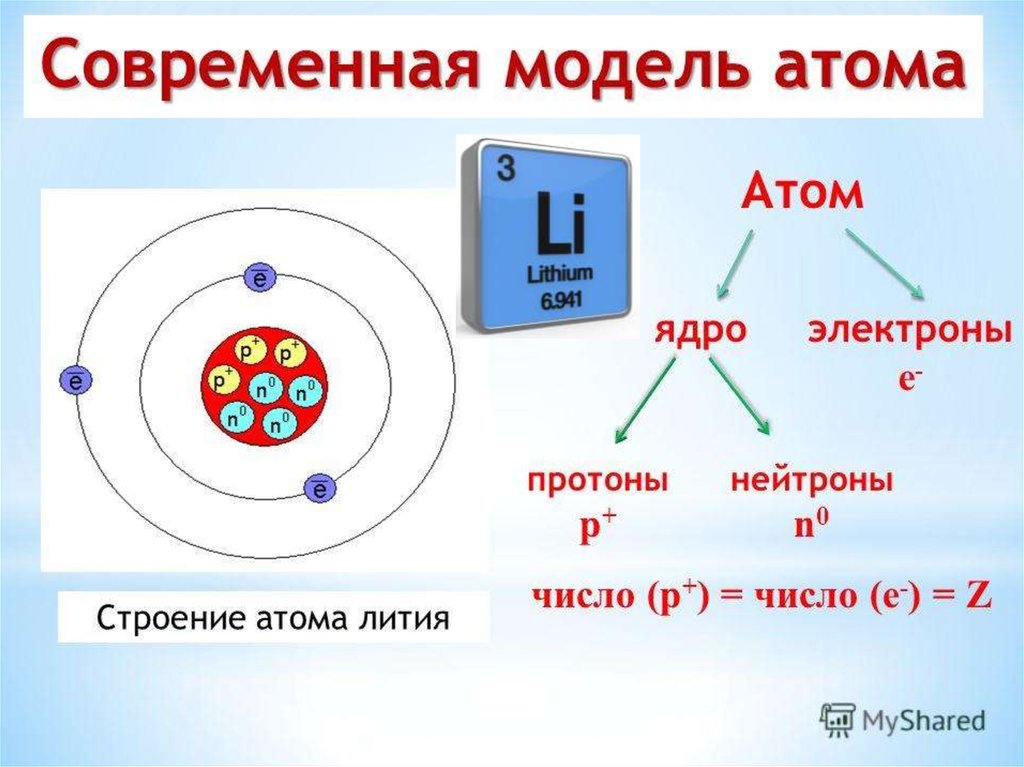 Вот почему каждая оболочка имеет определенное количество электронов, которые она может разместить.
Вот почему каждая оболочка имеет определенное количество электронов, которые она может разместить.
Но как рассчитать количество электронов для данной оболочки?
Не волнуйтесь! для этого используется определенная формула. Задается как 2n 2 .
Здесь n означает количество оболочек.
Теперь мы будем использовать ту же формулу для атома лития.
Максимальное число электронов для К (первой) оболочки = 2n 2 = 2 (1) 2 = 2
Следовательно, на К-оболочке атома лития может разместиться максимум два электрона. После этого атом лития выглядит следующим образом:
Теперь у нас остался еще один электрон, который будет размещен во второй оболочке атома лития.
Сначала рассчитаем максимальное количество электронов для второй оболочки или L-оболочки
Используя приведенную выше формулу, 2n 2 = 2 (2) 2 = 8
Следовательно, максимум 8 электронов может находиться в L-оболочке атома.
Однако, поскольку у нас остался только один электрон, мы поместим его в L-оболочку. После этого окончательная боровская модель лития выглядит следующим образом:
Следовательно, окончательная Боровская модель атома лития состоит из 3 протонов и 4 нейтронов внутри ядра и 3 электронов, вращающихся вокруг ядра. На K-оболочке находятся 2 электрона, а на L-оболочке 1 электрон.
Получение диаграммы Льюиса из модели Бора
Диаграмма Льюиса атома представляет его атомную структуру в графической форме.
На нем изображено ядро атома вместе с его валентными электронами. Атомный символ элемента представляет собой ядро, а точки представляют электроны. Следовательно, они также известны под названием электронной точечной структуры.
Из обсуждения в предыдущем разделе мы знаем, что атом лития состоит из 3 валентных электронов. Таким образом, диаграмма Льюиса для лития выглядит следующим образом:
Свойства лития
Несколько важных свойств лития перечислены ниже:
• Литий является легковоспламеняющимся и реакционноспособным щелочным металлом.
• Серебристо-белый на вид, мягкий на ощупь.
• Температура плавления и кипения лития составляет 180,5 °C и 1342 °C соответственно.
• Плотность лития составляет 0,53 г/см 3 при 20 °C.
• В природе существует в виде двух изотопов, а именно. Изотопы Li 6 и Li 7 .
• Атомы лития расположены в объемно-центрированной кубической решетке.
Связанные темы
Модель Бора натрия
Модель Бора неона
Модель Бора фосфора
Модель Неона Бора
Модель Бора 900 Бора
Аргон Модель Бора
Хлор Модель Бора
Кремний Модель Бора
Заключение
Боровская модель атома лития имеет 3 протона и 4 нейтрона в ядре. 3 электрона вращаются вокруг ядра.
В атоме количество протонов = количеству электронов = атомному номеру этого атома.


