Рентген помог российским физикам уточнить структуру воды
https://ria.ru/20190415/1552694303.html
Рентген помог российским физикам уточнить структуру воды
Рентген помог российским физикам уточнить структуру воды — РИА Новости, 15.04.2019
Рентген помог российским физикам уточнить структуру воды
Международный коллектив ученых точно измерил силу водородных связей между молекулами воды и опроверг популярную сегодня теорию о том, как устроена эта необычная РИА Новости, 15.04.2019
2019-04-15T11:46
2019-04-15T11:46
2019-04-15T11:46
наука
красноярск
швейцария
финляндия
германия
швеция
сибирский федеральный университет
российский научный фонд
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/148056/18/1480561854_0:4:5500:3098_1920x0_80_0_0_86cb514eeba104806e925383012bae88.jpg
МОСКВА, 15 апр – РИА Новости. Международный коллектив ученых точно измерил силу водородных связей между молекулами воды и опроверг популярную сегодня теорию о том, как устроена эта необычная жидкость. Новое теоретическое описание структуры воды было представлено в журнале Nature Communications.Почти все молекулы, существующие во Вселенной, состоят из атомов, связанных тремя путями – посредством прочных ковалентных или ионных связей, основанных на «обобществлении» или «экспроприации» электронов между двумя атомами, и слабых водородных связей.Они образуются за счет перераспределения заряда между атомами водорода и кислорода, из-за которого возникает «зарядовая асимметрия» молекулы. В результате этого один ее «конец» оказывается заряжен положительно, а другой отрицательно. К этим «заряженным» концам могут присоединяться другие атомы и молекулы, а также атомы в самой молекуле, содержащей водород.Водородные связи, возникающие между молекулами воды, объясняют высокую температуру кипения и высокую вязкость воды, а также необычные свойства белков, молекул ДНК и других «кирпичиков жизни».
Международный коллектив ученых точно измерил силу водородных связей между молекулами воды и опроверг популярную сегодня теорию о том, как устроена эта необычная жидкость. Новое теоретическое описание структуры воды было представлено в журнале Nature Communications.Почти все молекулы, существующие во Вселенной, состоят из атомов, связанных тремя путями – посредством прочных ковалентных или ионных связей, основанных на «обобществлении» или «экспроприации» электронов между двумя атомами, и слабых водородных связей.Они образуются за счет перераспределения заряда между атомами водорода и кислорода, из-за которого возникает «зарядовая асимметрия» молекулы. В результате этого один ее «конец» оказывается заряжен положительно, а другой отрицательно. К этим «заряженным» концам могут присоединяться другие атомы и молекулы, а также атомы в самой молекуле, содержащей водород.Водородные связи, возникающие между молекулами воды, объясняют высокую температуру кипения и высокую вязкость воды, а также необычные свойства белков, молекул ДНК и других «кирпичиков жизни».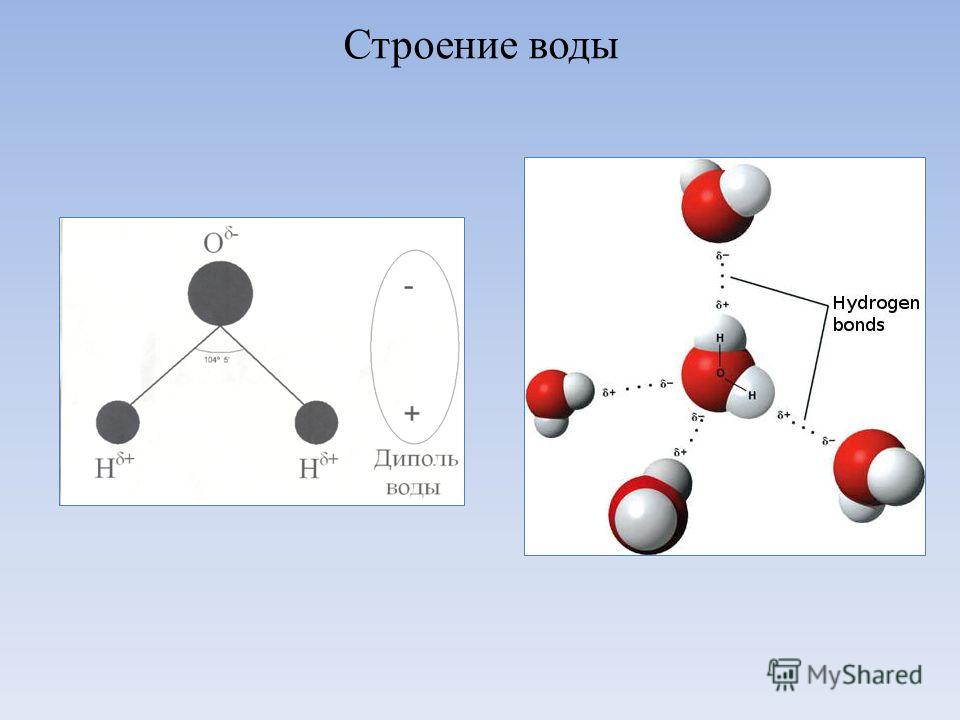 Ученые достаточно давно знают примерную силу этих связей, однако их точное значение так и не было измерено из-за того, что электронные микроскопы крайне плохо «видят» атомы водорода в молекулах.Эта неопределенность, как отмечают Гельмуханов и его коллеги, уже много десятилетий заставляет физиков спорить о том, как устроена вода. Наиболее общепринятая теория ее строения, появившаяся в начале 2000 годов, подразумевает, что она состоит не из одиночных молекул, а особых структур, так называемых кластеров, объединяющих от трех до нескольких десятков элементов.Подобное устройство воды хорошо объясняет некоторые ее аномальные черты, к примеру, ее расширение, а не сжатие при замерзании, или необычно высокие температуры кипения и замерзания. С другой стороны, эта теория не совместима с другими необычными свойствами воды, что заставляет ученых искать альтернативы для нее.Как передает пресс-служба Российского научного фонда, физики из Красноярска и ряда европейских исследовательских центров сделали большой шаг к ответу на эти вопросы, научившись «щупать» ковалентные и водородные связи внутри жидкой воды при помощи рентгеновского излучения.
Ученые достаточно давно знают примерную силу этих связей, однако их точное значение так и не было измерено из-за того, что электронные микроскопы крайне плохо «видят» атомы водорода в молекулах.Эта неопределенность, как отмечают Гельмуханов и его коллеги, уже много десятилетий заставляет физиков спорить о том, как устроена вода. Наиболее общепринятая теория ее строения, появившаяся в начале 2000 годов, подразумевает, что она состоит не из одиночных молекул, а особых структур, так называемых кластеров, объединяющих от трех до нескольких десятков элементов.Подобное устройство воды хорошо объясняет некоторые ее аномальные черты, к примеру, ее расширение, а не сжатие при замерзании, или необычно высокие температуры кипения и замерзания. С другой стороны, эта теория не совместима с другими необычными свойствами воды, что заставляет ученых искать альтернативы для нее.Как передает пресс-служба Российского научного фонда, физики из Красноярска и ряда европейских исследовательских центров сделали большой шаг к ответу на эти вопросы, научившись «щупать» ковалентные и водородные связи внутри жидкой воды при помощи рентгеновского излучения. Подобные замеры, как отмечают ученые, их коллеги пытались проводить и раньше, однако было не понятно, как распады старых и формирование новых водородных связей между молекулами воды в толще жидкости будут влиять на рентген. Российские и зарубежные ученые решили эту проблему остроумным способом, сравнив то, как выглядит жидкая вода и очень разреженный пар.Их идея базировалась на очень простом предположении – водородные связи не возникают между молекулами h3O в парообразном состоянии. Это позволяет отделить то, как они влияют на структуру воды и сказываются на взаимодействии рентгеновского излучения с ее толщей.Классическая теория устройства воды, как отмечают Гельмуханов и его коллеги, предсказывает, что в спектре рентгеновского излучения должен появиться особый набор провалов и пиков, связанных с существованием кластеров разных размеров. Соответственно, он будет характерен для жидкой воды, но будет отсутствовать у пара.В реальности все оказалось иначе – рентгеновское излучение менялось схожим образом и в том, и в другом случае.
Подобные замеры, как отмечают ученые, их коллеги пытались проводить и раньше, однако было не понятно, как распады старых и формирование новых водородных связей между молекулами воды в толще жидкости будут влиять на рентген. Российские и зарубежные ученые решили эту проблему остроумным способом, сравнив то, как выглядит жидкая вода и очень разреженный пар.Их идея базировалась на очень простом предположении – водородные связи не возникают между молекулами h3O в парообразном состоянии. Это позволяет отделить то, как они влияют на структуру воды и сказываются на взаимодействии рентгеновского излучения с ее толщей.Классическая теория устройства воды, как отмечают Гельмуханов и его коллеги, предсказывает, что в спектре рентгеновского излучения должен появиться особый набор провалов и пиков, связанных с существованием кластеров разных размеров. Соответственно, он будет характерен для жидкой воды, но будет отсутствовать у пара.В реальности все оказалось иначе – рентгеновское излучение менялось схожим образом и в том, и в другом случае.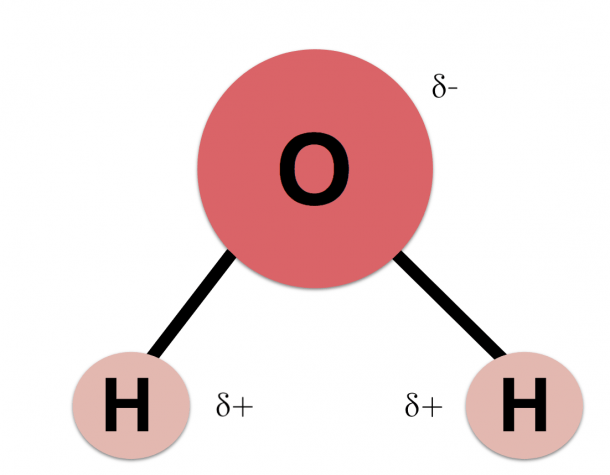 Когда ученые проанализировали эти данные, они пришли к выводу, что подобный рисунок появлялся в спектре излучения не из-за наличия разных типов кластеров в толще воды, а из-за быстрого распада ее молекул на ионы H+ и OH-. Все это, как считают российские и зарубежные физики, говорит о том, что никакой сложной структуры воды, которая описывается в рамках кластерной теории, на самом деле не существует. По их мнению, ее устройство определяется исключительно взаимодействиями отдельных молекул, а не более крупных структур. Характер этих связей ученые планируют изучить в самое ближайшее время. Исследования поддержаны грантом Российского научного фонда (РНФ).
Когда ученые проанализировали эти данные, они пришли к выводу, что подобный рисунок появлялся в спектре излучения не из-за наличия разных типов кластеров в толще воды, а из-за быстрого распада ее молекул на ионы H+ и OH-. Все это, как считают российские и зарубежные физики, говорит о том, что никакой сложной структуры воды, которая описывается в рамках кластерной теории, на самом деле не существует. По их мнению, ее устройство определяется исключительно взаимодействиями отдельных молекул, а не более крупных структур. Характер этих связей ученые планируют изучить в самое ближайшее время. Исследования поддержаны грантом Российского научного фонда (РНФ).
https://ria.ru/20170513/1494214972.html
https://ria.ru/20161202/1482714523.html
красноярск
швейцария
финляндия
германия
швеция
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.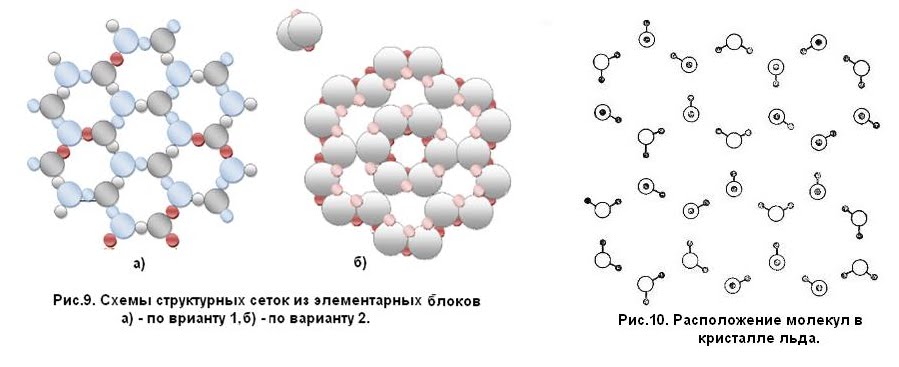 xn--p1ai/awards/
xn--p1ai/awards/
2019
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/148056/18/1480561854_684:0:4817:3100_1920x0_80_0_0_72a66787619ca8e9d56f2f5352c154b3.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4. 7
7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
красноярск, швейцария, финляндия, германия, швеция, сибирский федеральный университет, российский научный фонд, физика
Наука, Красноярск, Швейцария, Финляндия, Германия, Швеция, Сибирский федеральный университет, Российский научный фонд, Физика
МОСКВА, 15 апр – РИА Новости. Международный коллектив ученых точно измерил силу водородных связей между молекулами воды и опроверг популярную сегодня теорию о том, как устроена эта необычная жидкость. Новое теоретическое описание структуры воды было представлено в журнале Nature Communications.
«На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с ее окружением, а значит, и такие свойства, как скорость звука в воде и ее теплоемкость», – заявил Фарис Гельмуханов из Сибирского федерального университета в Красноярске.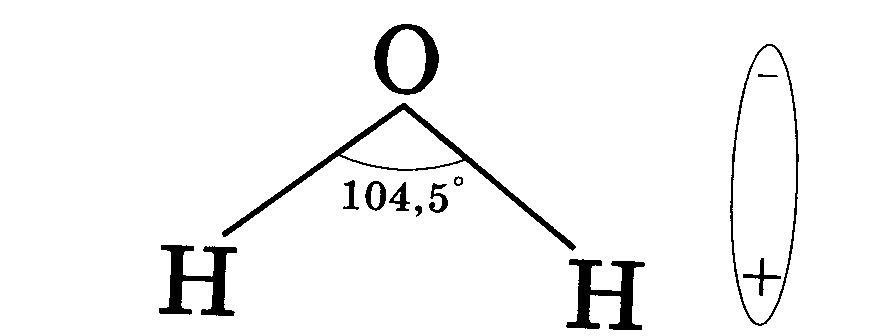
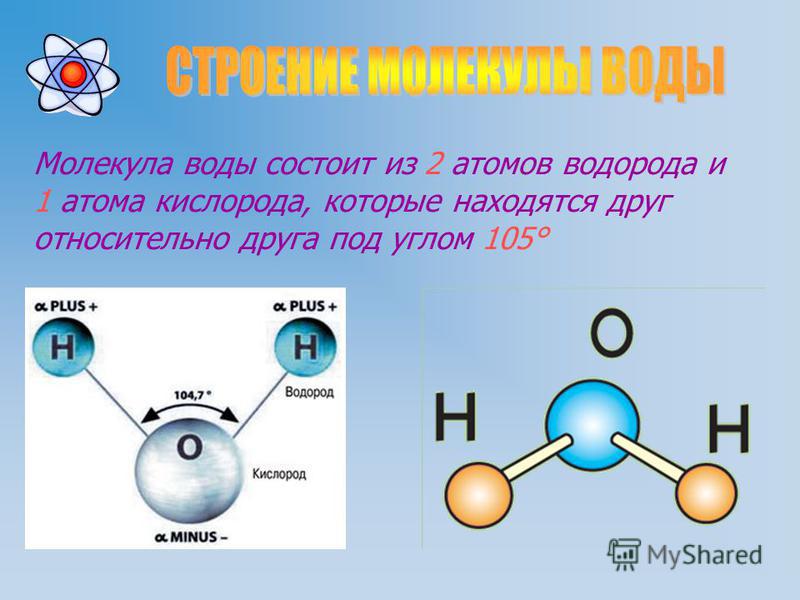
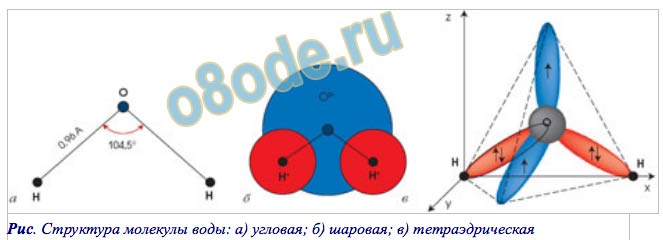
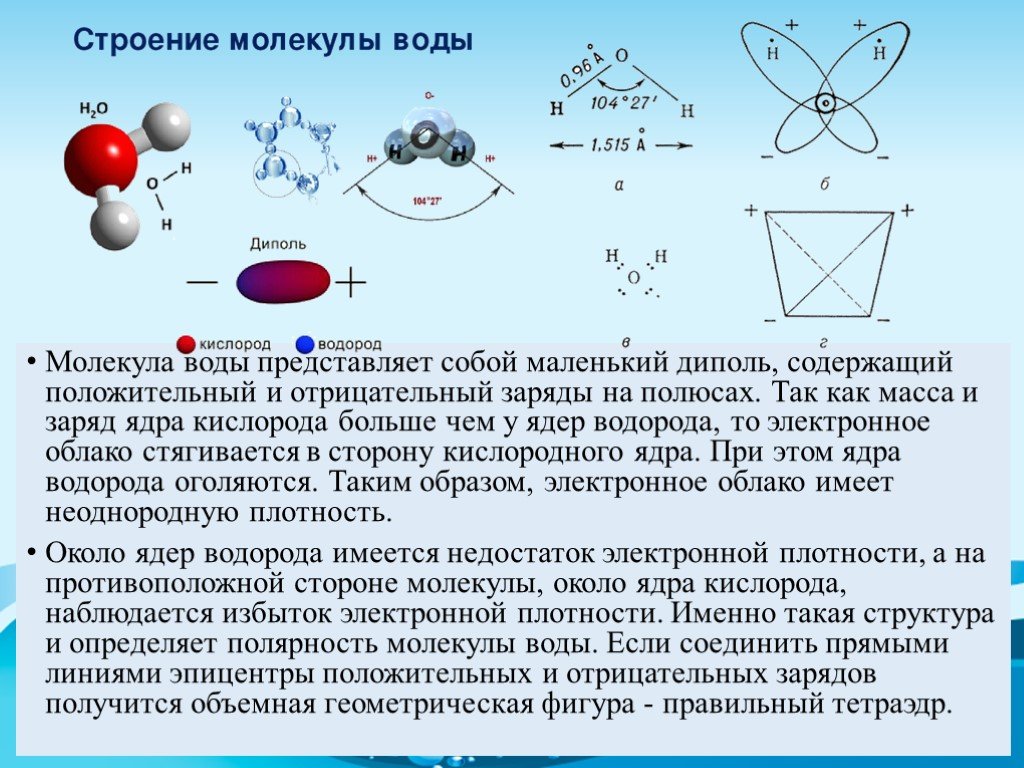
Почти все молекулы, существующие во Вселенной, состоят из атомов, связанных тремя путями – посредством прочных ковалентных или ионных связей, основанных на «обобществлении» или «экспроприации» электронов между двумя атомами, и слабых водородных связей.
Они образуются за счет перераспределения заряда между атомами водорода и кислорода, из-за которого возникает «зарядовая асимметрия» молекулы. В результате этого один ее «конец» оказывается заряжен положительно, а другой отрицательно. К этим «заряженным» концам могут присоединяться другие атомы и молекулы, а также атомы в самой молекуле, содержащей водород.
13 мая 2017, 09:30Наука
Ученые впервые увидели и «пощупали» водородную связь между молекулами
Водородные связи, возникающие между молекулами воды, объясняют высокую температуру кипения и высокую вязкость воды, а также необычные свойства белков, молекул ДНК и других «кирпичиков жизни». Ученые достаточно давно знают примерную силу этих связей, однако их точное значение так и не было измерено из-за того, что электронные микроскопы крайне плохо «видят» атомы водорода в молекулах.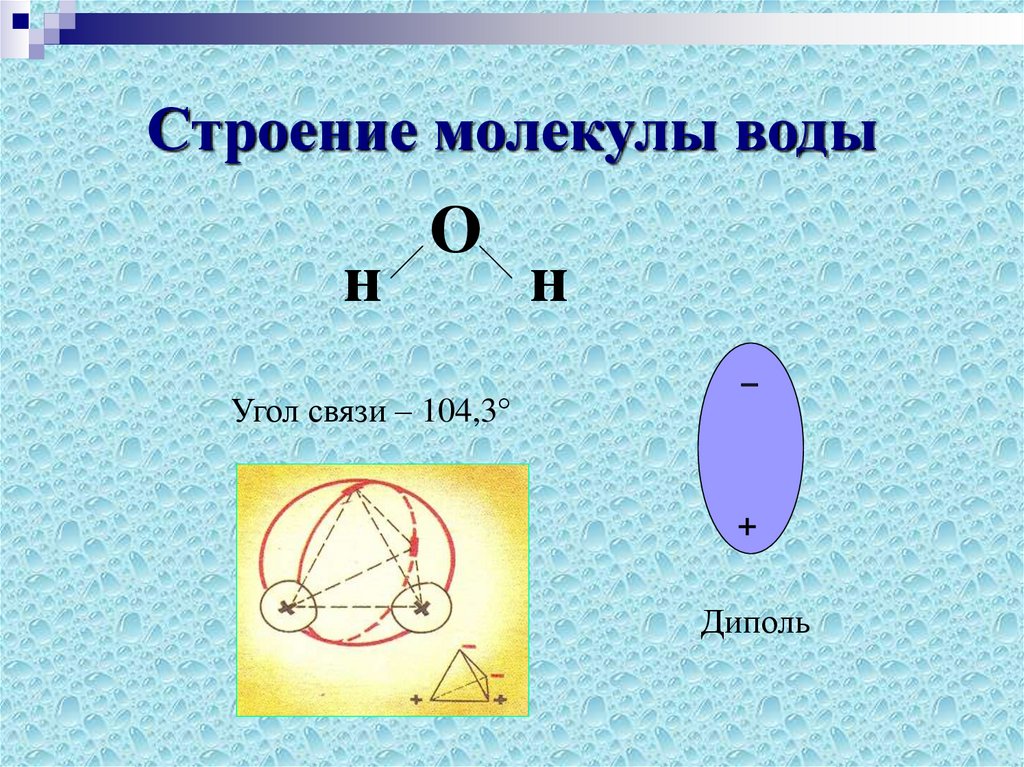
Эта неопределенность, как отмечают Гельмуханов и его коллеги, уже много десятилетий заставляет физиков спорить о том, как устроена вода. Наиболее общепринятая теория ее строения, появившаяся в начале 2000 годов, подразумевает, что она состоит не из одиночных молекул, а особых структур, так называемых кластеров, объединяющих от трех до нескольких десятков элементов.
Подобное устройство воды хорошо объясняет некоторые ее аномальные черты, к примеру, ее расширение, а не сжатие при замерзании, или необычно высокие температуры кипения и замерзания. С другой стороны, эта теория не совместима с другими необычными свойствами воды, что заставляет ученых искать альтернативы для нее.
Как передает пресс-служба Российского научного фонда, физики из Красноярска и ряда европейских исследовательских центров сделали большой шаг к ответу на эти вопросы, научившись «щупать» ковалентные и водородные связи внутри жидкой воды при помощи рентгеновского излучения.
Подобные замеры, как отмечают ученые, их коллеги пытались проводить и раньше, однако было не понятно, как распады старых и формирование новых водородных связей между молекулами воды в толще жидкости будут влиять на рентген. Российские и зарубежные ученые решили эту проблему остроумным способом, сравнив то, как выглядит жидкая вода и очень разреженный пар.
Российские и зарубежные ученые решили эту проблему остроумным способом, сравнив то, как выглядит жидкая вода и очень разреженный пар.
Их идея базировалась на очень простом предположении – водородные связи не возникают между молекулами h3O в парообразном состоянии. Это позволяет отделить то, как они влияют на структуру воды и сказываются на взаимодействии рентгеновского излучения с ее толщей.
Классическая теория устройства воды, как отмечают Гельмуханов и его коллеги, предсказывает, что в спектре рентгеновского излучения должен появиться особый набор провалов и пиков, связанных с существованием кластеров разных размеров. Соответственно, он будет характерен для жидкой воды, но будет отсутствовать у пара.
2 декабря 2016, 15:39Наука
Физики раскрыли секрет того, почему вода проводит токУченые впервые проследили за тем, как одна молекула воды передает протоны своей «соседке», и раскрыли секрет того, почему вода пропускает ток, а другие похожие на нее вещества – не обладают таким свойством.
В реальности все оказалось иначе – рентгеновское излучение менялось схожим образом и в том, и в другом случае. Когда ученые проанализировали эти данные, они пришли к выводу, что подобный рисунок появлялся в спектре излучения не из-за наличия разных типов кластеров в толще воды, а из-за быстрого распада ее молекул на ионы H+ и OH-.
Все это, как считают российские и зарубежные физики, говорит о том, что никакой сложной структуры воды, которая описывается в рамках кластерной теории, на самом деле не существует. По их мнению, ее устройство определяется исключительно взаимодействиями отдельных молекул, а не более крупных структур. Характер этих связей ученые планируют изучить в самое ближайшее время.
Исследования поддержаны грантом Российского научного фонда (РНФ).
Курс общей химии
Курс общей химии
ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ § 1. ПРЕДМЕТ ХИМИИ § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ 1.  СТРОЕНИЕ ВЕЩЕСТВА СТРОЕНИЕ ВЕЩЕСТВАГлава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ 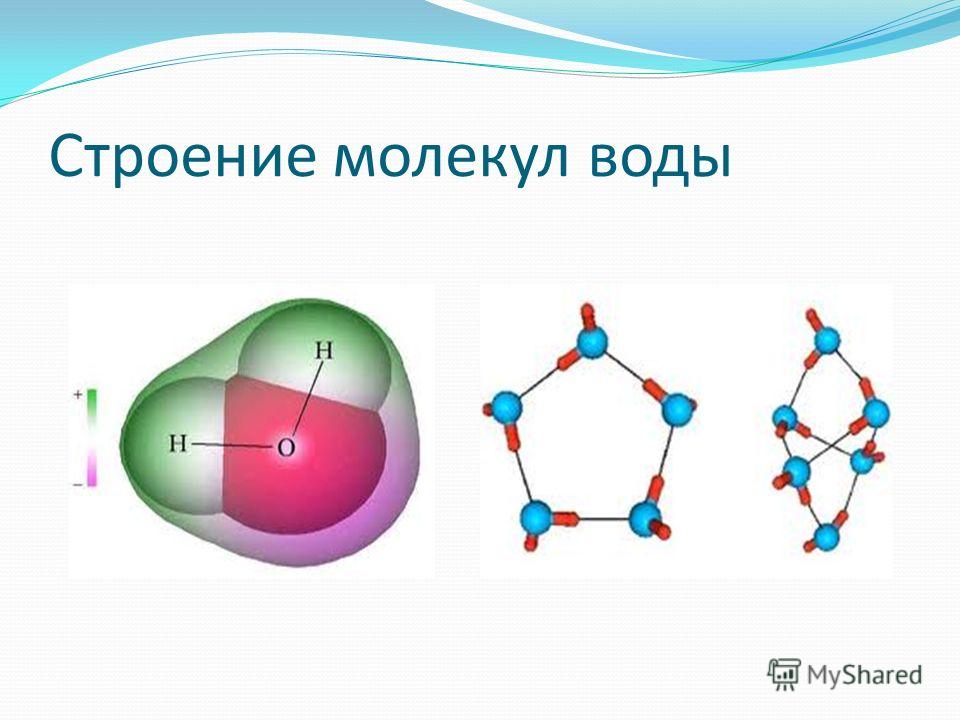 ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО§ IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ § V.8. КАТАЛИЗ 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ § VI.  5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ§ VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ § VII.6. ЭЛЕКТРОЛИЗ Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ  2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА 2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА§ IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ § XI.2. УГЛЕВОДОРОДЫ § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП § XII. 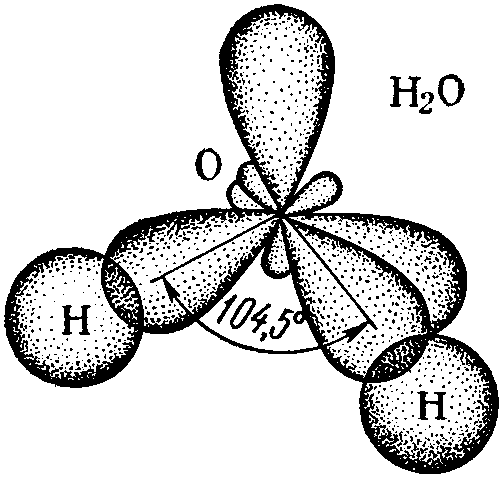 4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ 4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ§ XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ § XIII.3. СВОЙСТВА ПОЛИМЕРОВ § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ § XIV.2. ПРИРОДНЫЕ ВОДЫ § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ § XV.2. ЯДЕРНЫЕ РЕАКЦИИ § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ § XVI. 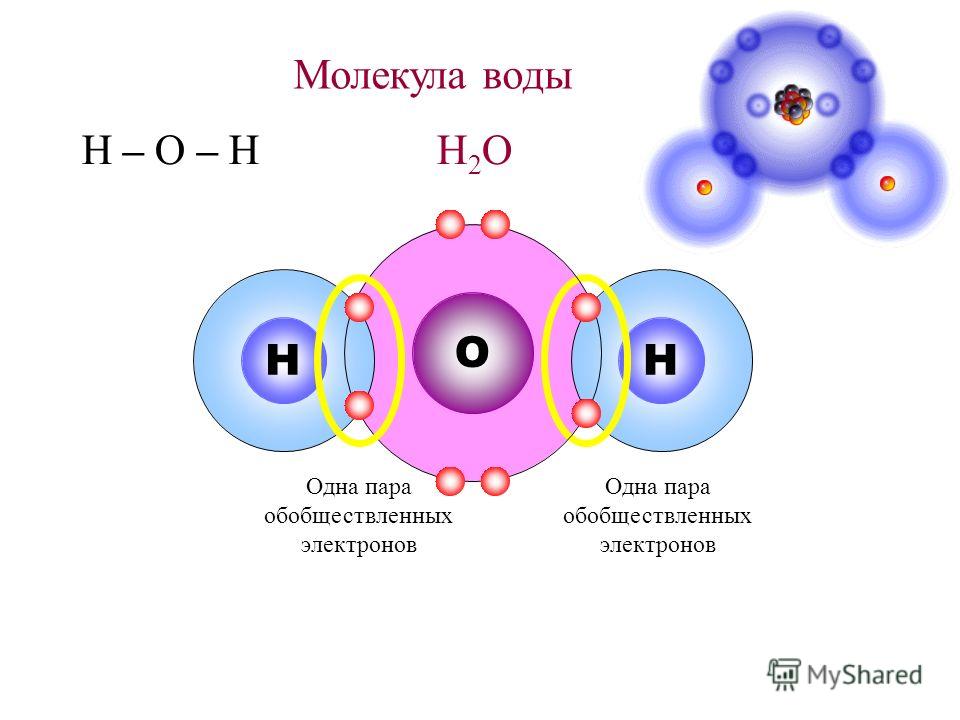 2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ) 2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)§ ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ ЗАКЛЮЧЕНИЕ |
Рабочий лист урока:Вода | Нагва
Начать практику
В этом рабочем листе мы попрактикуемся в описании структуры молекул воды, объясним, почему вода является полярной молекулой, и обрисуем в общих чертах свойства воды, которые делают ее важным компонентом жизни.
Q1:
Что из следующего лучше всего описывает состав молекулы воды?
- A Содержит один атом водорода и два атома кислорода, которые удерживаются вместе ковалентными связями.
- BI содержит один атом кислорода и два атома водорода, которые удерживаются вместе полярными ковалентными связями.
- C Он содержит один атом водорода и один атом кислорода, которые удерживаются вместе за счет электростатического притяжения.

- D Он содержит один ион водорода и два иона кислорода, которые удерживаются вместе полярными ионными связями.
Q2:
Когда вода замерзает в своей твердой форме, она становится льдом. На какой схеме (А или Б) показана наиболее вероятная и распространенная структура связи во льду?
Q3:
Укажите, верны или нет следующие утверждения.
Молекула воды содержит полярные ковалентные связи между слабоотрицательным атомом водорода и слабоположительным атомом кислорода.
- AFНеверно
- BИстинно
Вода необходима клеткам, так как она легко растворяет другие вещества из-за своей полярной природы.
- AFЛожь
- BИстинно
Q4:
Как образуются водородные связи между молекулами воды?
- Водородные связи образуются при взаимодействии слабоотрицательного атома кислорода одной молекулы воды и слабоположительного атома водорода другой молекулы.

- BВодородные связи представляют собой сильные когезионные взаимодействия между слегка положительными атомами водорода различных молекул воды.
- CВодородные связи образуются, когда кислород одной молекулы воды отдает свои электроны кислороду другой молекулы.
- DВодородные связи образуются между отрицательным ионом водорода одной молекулы воды и положительным ионом кислорода другой.
Q5:
Молекула воды образует связи с другими молекулами воды, как показано на схеме. Какой тип связи показан пунктирной линией?
- полярная ковалентная
- Bметаллик
- CВодород
- Дионик
- Эковалентный
Q6:
Вода представляет собой полярную молекулу. Что из следующего лучше всего описывает, что это значит?
Что из следующего лучше всего описывает, что это значит?
- AВода легко замерзает, образуя лед в холодных (полярных) условиях.
- ВА Молекула воды имеет неравномерное распределение заряда, вызванное неравномерным распределением электронов.
- CВода с трудом образует связи с другими молекулами, так как поляризует их.
- DВ воде водород и кислород постоянно отдают друг другу электроны, поэтому они переключаются между положительным и отрицательным состоянием. отрицательно заряженный.
Q7:
Что из следующего не свойство воды?
- AВода в твердом состоянии менее плотная, чем в жидкой.
- BМолекулы воды образуют слабые силы притяжения между собой.

- CВода имеет очень низкий pH, что предотвращает ее реакцию со многими другими веществами.
- DВода может действовать как растворитель, в котором могут быть растворены другие вещества.
- EВода имеет необычно высокую температуру кипения.
Q8:
Сколько примерно процентов человеческого тела составляет вода?
- А60%
- В33,3%
- С20%
- Д95%
- Е25%
Q9:
На изображении паук-плот, способный ходить по поверхности воды.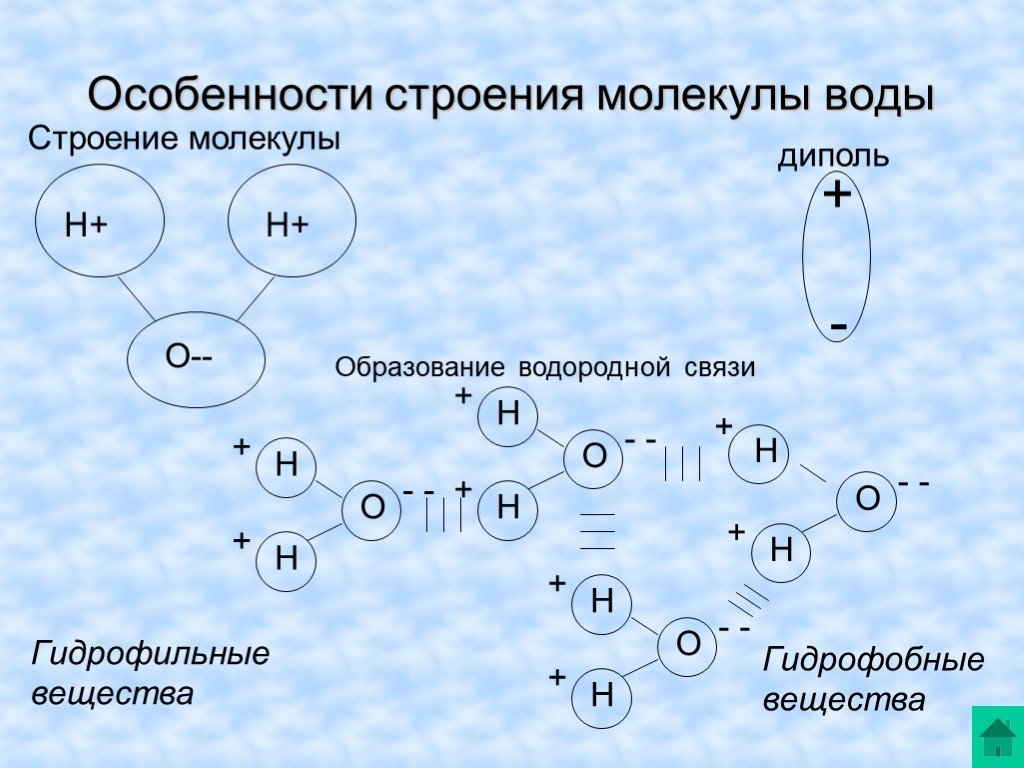 Какое свойство воды позволяет ей поддерживать движение паука?
Какое свойство воды позволяет ей поддерживать движение паука?
- A Имеющие высокую температуру кипения
- BСпособность образовывать водородные связи между молекулами воды
- CМенее плотный в твердом состоянии
- D Быть полярной молекулой
Q10:
Вода обладает многими свойствами, которые делают ее важным компонентом жизни на Земле. Какое свойство воды позволяет ей выступать хладагентом во многих биологических реакциях?
- A. Менее плотный в твердом состоянии
- B Обладающие высокой удельной теплоемкостью
- CОбразование ионных связей между молекулами
- DОбразование ковалентных связей между молекулами
Nagwa использует файлы cookie, чтобы обеспечить вам максимальное удобство на нашем веб-сайте.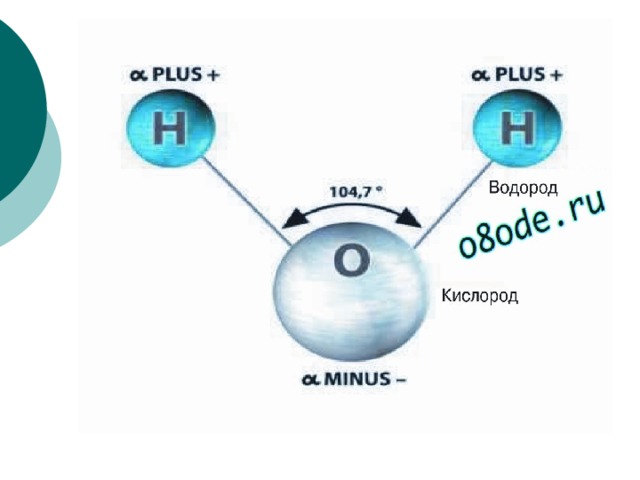 Узнайте больше о нашей Политике конфиденциальности.
Узнайте больше о нашей Политике конфиденциальности.
Исследование молекулы воды
Исследование молекулы воды Водяной цикл — вода (3) |
ЗАДАЧИ: | Учащиеся узнают об углах в окружности. |
ФОН: |


 И. Масленникова Г.Н. Коровин Н.В. Филиппов Э.Л. Курс общей химии. 2-е изд., перераб. и доп. — М.: Высш. шк., 1990.—446 с: ил. МЭИ, 1990 под редакцией Коровина.
И. Масленникова Г.Н. Коровин Н.В. Филиппов Э.Л. Курс общей химии. 2-е изд., перераб. и доп. — М.: Высш. шк., 1990.—446 с: ил. МЭИ, 1990 под редакцией Коровина.

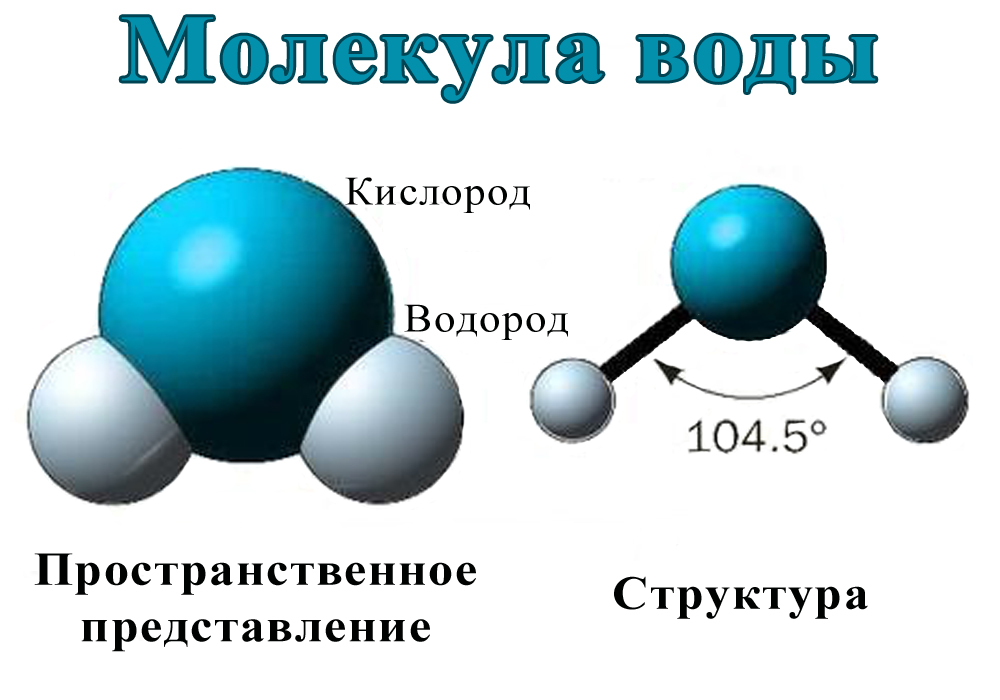
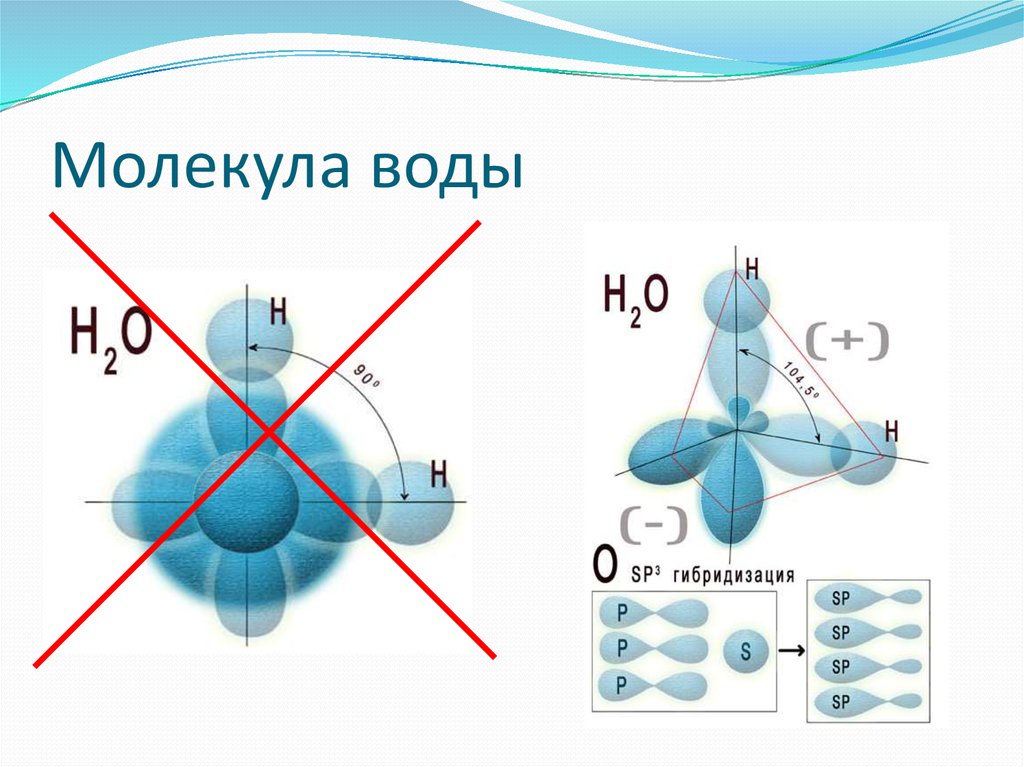
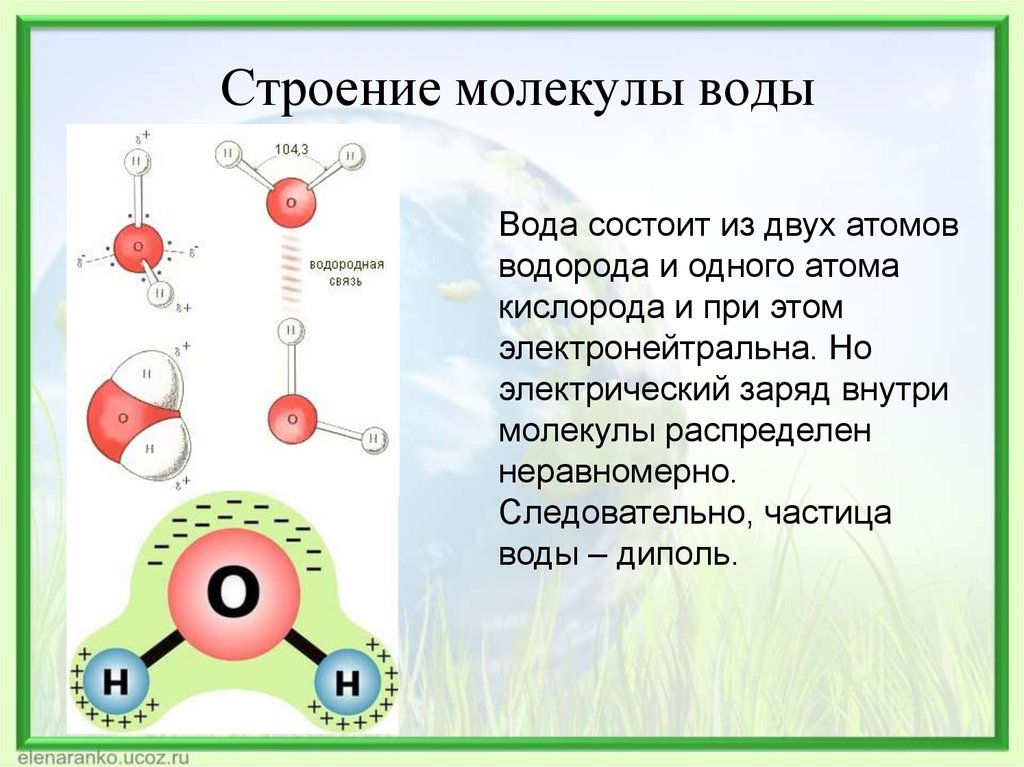 голова медведя
(рисунок выше). Водород и кислород имеют очень тесную ковалентную связь .
связь , где водород и кислород делят электроны, когда они танцуют и
вращаться в молекуле. Отдельные молекулы воды представляют собой
также крепко скреплены тем, что называется
водородная связь. Водородная связь намного прочнее, чем другие связи
которые есть у молекул. Ионная связь является одной из тех более слабых связей, и
такие вещества, как соль, легко разлагаются. Вода — это пакет
силы, которую трудно сломить, и именно эта сила позволяет другим
вещества, растворяющиеся или распадающиеся в воде, отсюда и название, универсальный
растворитель .
голова медведя
(рисунок выше). Водород и кислород имеют очень тесную ковалентную связь .
связь , где водород и кислород делят электроны, когда они танцуют и
вращаться в молекуле. Отдельные молекулы воды представляют собой
также крепко скреплены тем, что называется
водородная связь. Водородная связь намного прочнее, чем другие связи
которые есть у молекул. Ионная связь является одной из тех более слабых связей, и
такие вещества, как соль, легко разлагаются. Вода — это пакет
силы, которую трудно сломить, и именно эта сила позволяет другим
вещества, растворяющиеся или распадающиеся в воде, отсюда и название, универсальный
растворитель .