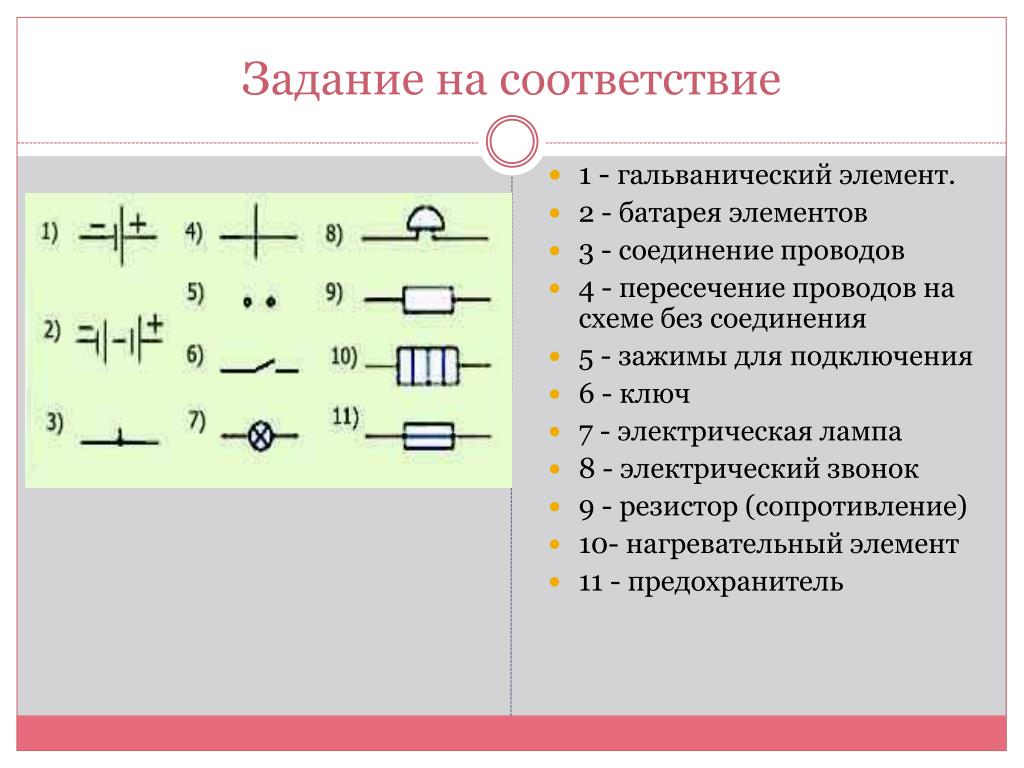
Гальванический элемент: схема, принцип работы, состав
Содержание
- Схема гальванического элемента
- Устройство гальванического элемента
- Принцип работы гальванического элемента
- Ответы на часто задаваемые вопросы
- Типы гальванических элементов
- Таблица гальванических элементов
- Назначение гальванического элемента
- Гальванический элемент в домашних условиях
- Процесс изготовления
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
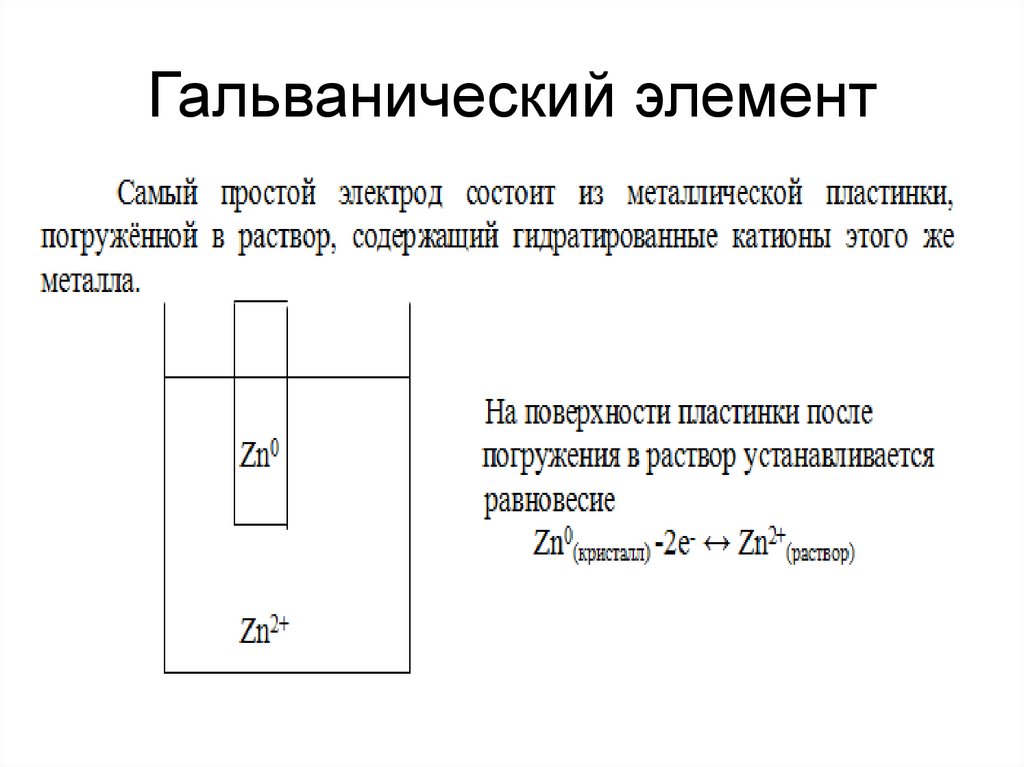
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
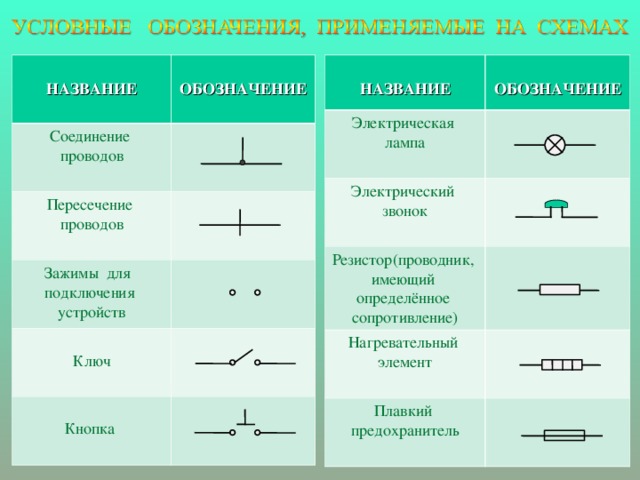
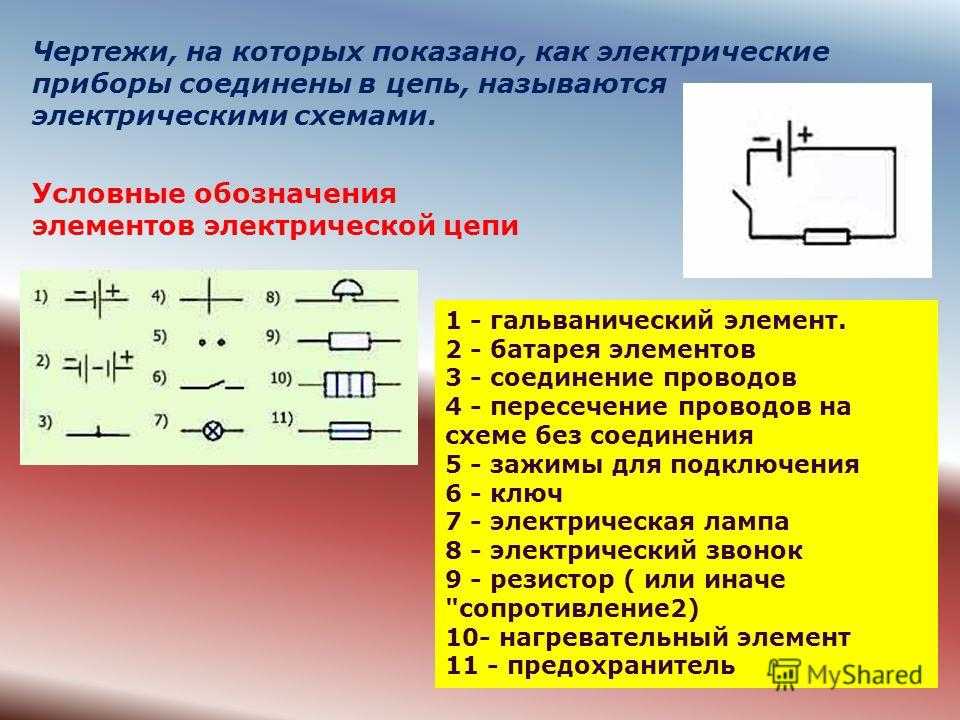
Схема гальванического элементаПод схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений.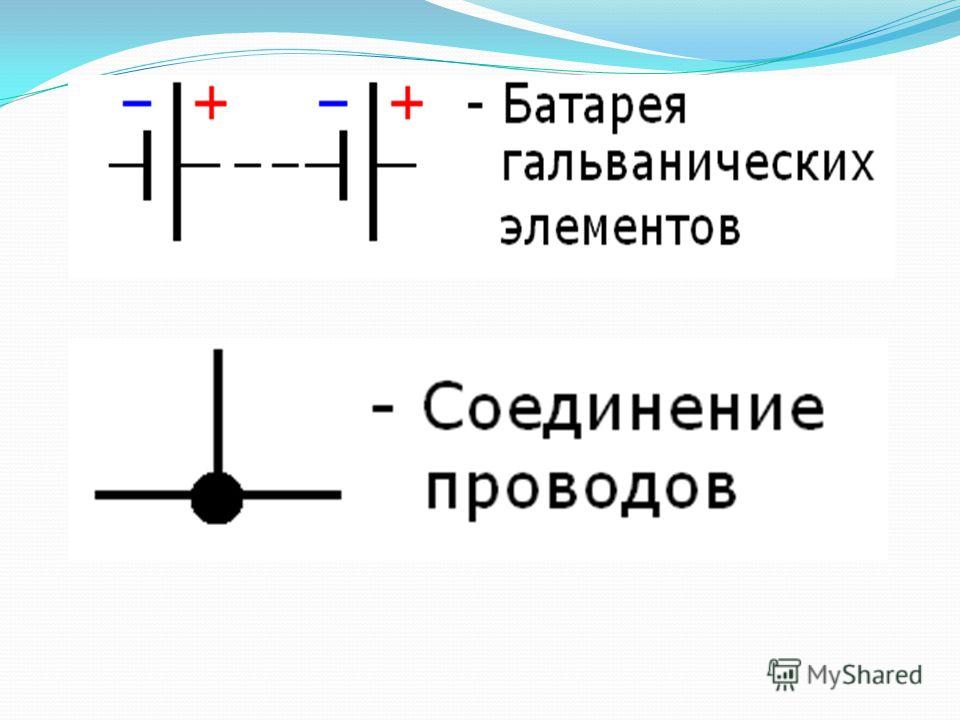 Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.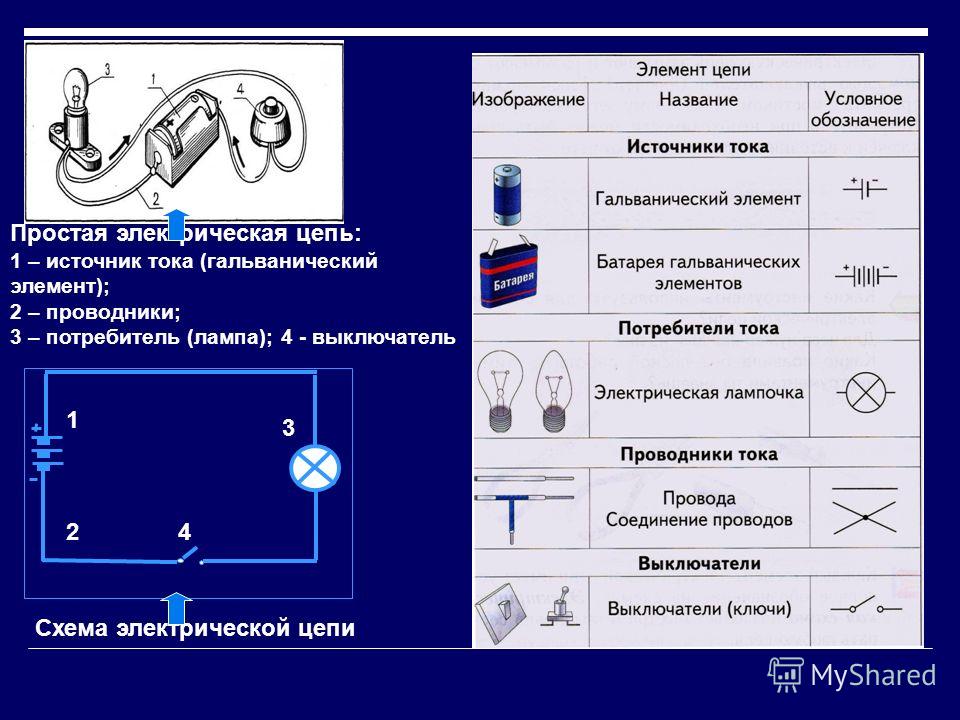
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | Самые дешевые. | |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элементаОн предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.

- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условияхПростой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
Похожие статьи:
ГОСТ 2.768-90 Единая система конструкторской документации. Обозначения условные графические в схемах. Источники электрохимические, электротермические и тепловые
Текст ГОСТ 2.768-90 Единая система конструкторской документации. Обозначения условные графические в схемах. Источники электрохимические, электротермические и тепловые
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Единая система конструкторской документации
ОБОЗНАЧЕНИЯ УСЛОВНЫЕ ГРАФИЧЕСКИЕ В СХЕМАХ Источники электрохимические, электротермические и тепловые
ГОСТ
2.768-90
Unified system of design documentation.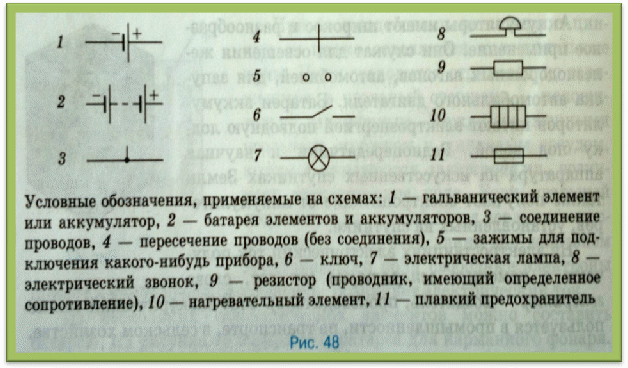 Graphical symbols for diagrams. Electrochemical, electrothermal and heat sources
Graphical symbols for diagrams. Electrochemical, electrothermal and heat sources
MKC 01.080.40 31.180 ОКСТУ 0002
Дата введения 01.01.92
Настоящий стандарт распространяется на схемы изделий всех отраслей промышленности, выполняемые вручную или автоматизированным способом, и устанавливает условные графические обозначения электрохимических, электротермических и тепловых источников и генераторов мощности.
1. Условные графические обозначения электрохимических источников должны соответствовать приведенным в табл. 1.
Таблица 1
Наименование
Обозначение
1. Гальванический элемент (первичный или вторичный)
П римечание. Допускается знаки полярности не указывать
(06-15-01)
2. Батарея, состоящая из гальванических элементов
П римечание. Батарею из гальванических элементов допускается обозначать так же, как в п. 1. При этом над обозначением проставляют значение напряжения батареи, например напряжение 48 В
—1|||||- или —1|——\\—
(06-15-02) (06-15-03)
48 В
3. Батарея с отводами от элементов, например батарея номинального напряжения 12 В, номинальной емкости 84 Ач с отводами 10 В и 8 В
Батарея с отводами от элементов, например батарея номинального напряжения 12 В, номинальной емкости 84 Ач с отводами 10 В и 8 В
8V10B
4. Батарея, состоящая из гальванических элементов с переключаемым отводом
—«I—н ib
5. Батарея, состоящая из гальванических элементов с двумя переключаемыми отводами, например батарея номинального напряжения 120 В с номинальной емкостью 840 А ч
Издание официальное ★
Перепечатка воспрещена
2. Условные графические обозначения электротермических источников должны соответствовать приведенным в табл. 2.
Допускается не зачернять или опускать окружности в условных графических обозначениях электротермических источников.
Таблица 2
Наименование
Обозначение
1. Термоэлемент (термопара)
(08-06-01) (08-06 -OZ)
2. Батарея из термоэлементов, например, с номинальным напряжением 80 В
3. Термоэлектрический преобразователь с контактным нагревом
4. Термоэлектрический преобразователь с бесконтактным нагревом
[)
80 В 80 В
\)
+ш» ^П П
(08-06-05)
3. Условные графические обозначения источников тепла должны соответствовать приведенным в табл. 3.
Условные графические обозначения источников тепла должны соответствовать приведенным в табл. 3.
Таблица 3
Наименование
1. Источник тепла, основной символ (06—17—01)
Обозначение
2. Радиоизотопный источник тепла (06-17-02)
3. Источник тепла, использующий горение (06-17-03)
А
4. Источник тепла, использующий неионизирующее излучение
*
4. Условные графические обозначения генераторов мощности должны соответствовать приведенным в табл. 4.
Таблица 4
Наименование
1. Генератор мощности, основной символ (06-16-01)
2. Термоэлектрический генератор с источником тепла, использующим горение
(06-18-01)
3. Термоэлектрический генератор с источником тепла, использующим неионизирующее излучение (06-18-02)
4. Термоэлектрический генератор с радиоизотопным источником тепла (06-18-03)
5. Термоионический полупроводниковый генератор с источником тепла, использующим неионизирующее излучение (06-18-04)
6. Термоионический полупроводниковый генератор с радиоизотопным источником тепла (06-18-05)
Термоионический полупроводниковый генератор с радиоизотопным источником тепла (06-18-05)
7. Генератор с фотоэлектрическим преобразователем (06-18-06)
Обозначение
Примечания:
1. Числовые обозначения, указанные в скобках после наименования или под условным графическим обозначением, по Международному идентификатору.
2. Соотношения размеров (на модульной сетке) основных условных графических обозначений приведены в приложении.
ПРИЛОЖЕНИЕ
Справочное
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. ВНЕСЕН Государственным комитетом СССР по управлению качеством продукции и стандартам
2. Постановлением Государственного комитета СССР по управлению качеством продукции и стандартам от 26.10.90 № 2706 стандарт Совета Экономической Взаимопомощи СТ СЭВ 653—89 «Единая система конструкторской документации СЭВ. Обозначения условные графические в электрических схемах. Источники электрохимические, электротермические и тепловые» введен в действие непосредственно в качестве государственного стандарта СССР с 01. 01.92
01.92
3. СТАНДАРТ СООТВЕТСТВУЕТ стацдарту МЭК 617-6—83 в части табл. 1, 3, 4, за исключением пи. 3—5 табл. 1 и и. 4 табл. 3, и стандарту МЭК 617-8—83 в части табл. 2, за исключением и. 2 табл. 2
4. ПЕРЕИЗДАНИЕ. Ноябрь 2004 г.
Гальванические элементы (батарейки). Виды и устройство. Работа
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Гальванические элементы широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:- Солевые.
- Щелочные.
- Литиевые.
Солевые батарейки
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены.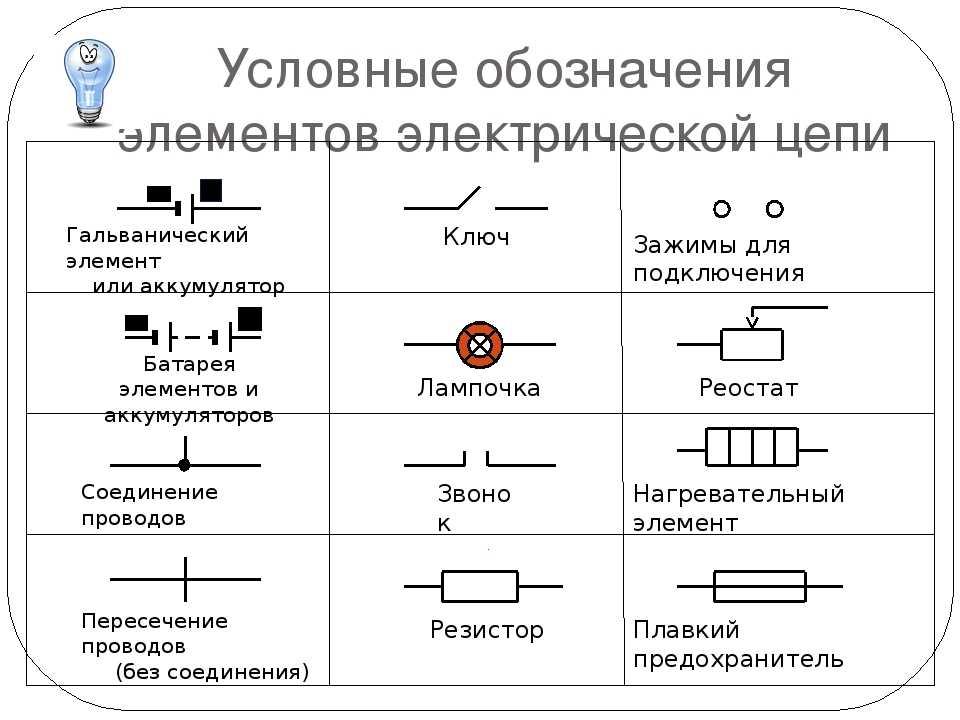 Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питанияЛитиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству:
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды.
 Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации. - Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использованияЛитиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.

- Стабильные параметры в различных условиях.
- Большая емкость.
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Похожие темы:
- Топливные элементы. Электрохимические генераторы. Применение
- Химические источники тока. Виды и особенности. Устройство и работа
- Гибкие аккумуляторные батареи. Технологии будущего и применение
- Аккумуляторные батареи. Виды и устройство. Применение
- Солнечные аккумуляторы (Аккумуляторы для солнечных батарей). Виды
- Литий-полимерные аккумуляторы.
 Виды и устройство. Плюсы и минусы
Виды и устройство. Плюсы и минусы - Литий-ионные аккумуляторы. Устройство и виды. Работа и применение
- Окна батареи. Прозрачные солнечные батареи. Работа и применение
17.9: Обозначение ячеек и условные обозначения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49560
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан 9{2–}(aq)}\) в ячейке \(\ce{Zn–Cu}\) обычно не указывают.
По соглашению электрод, записываемый в слева от солевого моста в этой нотации ячейки, всегда считается анодом , а связанное с ним полууравнение всегда записывается как окисление .
 Таким образом, правый электрод всегда является катодом , а полууравнение всегда записывается как восстановление
Таким образом, правый электрод всегда является катодом , а полууравнение всегда записывается как восстановление Пример \(\PageIndex{1}\): полуреакции
Напишите полууравнения и реакции ячеек для каждой из следующих ячеек: 9{3+}} \mid \ce{Pt} \nonumber \]
(Поскольку и Fe 2+ , и Fe 3+ находятся в растворе, используется Pt-электрод.)
Условные обозначения, которые мы разработали можно использовать, чтобы решить, действительно ли клеточная реакция является спонтанной.
 Если это так, то окисление высвободит электроны во внешнюю цепь на левом электроде. Если в цепь поместить вольтметр, эти электроны сделают его левый вывод отрицательным. Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]
Если это так, то окисление высвободит электроны во внешнюю цепь на левом электроде. Если в цепь поместить вольтметр, эти электроны сделают его левый вывод отрицательным. Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]Но это спонтанная клеточная реакция, которую мы описали ранее (уравнение (2) из Galvanic Cells). Поскольку реакция клетки несамопроизвольна, электроны не будут вытеснены во внешнюю цепь на левом электроде и не будут отведены на правый. На самом деле произойдет обратное. Таким образом, если к этой ячейке подключить вольтметр, его правый вывод станет более отрицательным, а левый — более положительным. Это показано на рисунке 2 от Galvanic Cells.

В общем, если гальванический элемент подключен к вольтметру, электрод, подключенный к отрицательной клемме счетчика, должен быть анодом. Если наша сокращенная запись ячейки показывает этот электрод слева, то соответствующая реакция клетки должна быть спонтанной. Электроны будут освобождены полууравнением окисления слева и приняты восстановлением справа. Если, с другой стороны, вольтметр показывает, что правый электрод испускает электроны, то мы должны записать нашу сокращенную запись назад . Это значит, что в действительности должна иметь место обратная клеточная реакция, полученная по нашим правилам, и именно эта обратная реакция является самопроизвольной. Таким образом, просто наблюдая, какой электрод в клетке испускает электроны, а какой их принимает, т. е. находя, какой электрод отрицательный, а какой положительный, мы можем определить, является ли реакция клетки самопроизвольной.
Эта страница под названием 17.9: Обозначение ячеек и условные обозначения распространяется под лицензией CC BY-NC-SA 4.
 0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Обозначение ячейки
- клеточная реакция
Диаграммы клеток — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47679
- Вспомнить стандартные условия, которые предполагаются в гальваническом элементе, если никакие условия не заданы
- Произвести соответствующее обозначение электрохимической ячейки для данной электрохимической реакции
- Сначала описывается анодная полуячейка; следует катодный полуэлемент. В пределах данной полуячейки первыми указываются реагенты, а последними — продукты. Описание реакции окисления идет первым, а реакция восстановления последним; когда вы читаете его, ваши глаза движутся в направлении потока электронов. Ионы зрителя не учитываются.
- Одна вертикальная линия ( | ) проведена между двумя химическими веществами, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например, твердый электрод | жидкость с электролитом). Двойная вертикальная линия ( || ) представляет солевой мостик или пористую мембрану, разделяющую отдельные полуклетки.

- Фаза каждого химического вещества (s, l, g, aq) указана в скобках. Если электролиты в ячейках не соответствуют стандартным условиям, концентрациям и/или давлению, они указаны в скобках с обозначением фаз. Если концентрация или давление не указаны, предполагается, что электролиты в ячейках находятся в стандартных условиях (1,00 М или 1,00 атм и 298 К).
- Анод и катод ячейки (полуэлементы) разделены двумя полосами или косыми чертами, которые представляют солевой мостик.
- Анод расположен слева, а катод справа.

- Отдельные твердые, жидкие или водные фазы в каждой полуячейке разделены одной чертой.
- Концентрации растворенных частиц могут быть указаны в скобках после обозначения фазы (s, l, g или aq).
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- Описать функцию гальванического элемента и его компонентов
- Использование обозначения ячеек для обозначения состава и конструкции гальванических элементов
- Соответствующие компоненты каждой полуячейки представлены их химическими формулами или символами элементов
- Все интерфейсы между фазами компонентов представлены вертикальными параллельными линиями; если в одной фазе присутствуют два и более компонента, их формулы разделяются запятыми
- По соглашению схема начинается с анода и продолжается слева направо, обозначая фазы и интерфейсы, встречающиеся внутри ячейки, и заканчивается катодом
- [латекс]\текст{Mn}\left(s\right)+\text{Sn}\left(\text{NO}_{3}\right)_{2}\left(aq\right)\longrightarrow \text{Mn}\left(\text{NO}_{3}\right)_{2}\left(aq\right)+\text{Au}\left(s\right)[/latex]
- [латекс]3\текст{CuNO}_{3}\left(aq\right)+\text{Au}\left(\text{NO}_{3}\right)_{3}\left(aq \right)\longrightarrow3\text{Cu}\left(\text{NO}_{3}\right)_{2}\left(aq\right)+\text{Au}\left(s\right)[ /латекс]
- Учитывая следующие обозначения ячеек, определите окисляемые и восстанавливаемые соединения, а также окислитель и восстановитель, не записывая уравновешенные реакции.
 9{-}\left(aq\right)\text{(базовое решение)}[/latex]
9{-}\left(aq\right)\text{(базовое решение)}[/latex] - Определите окисляющиеся и восстанавливаемые соединения, а также окислитель и восстановитель для всех реакций в предыдущей задаче.
- На основе предоставленной информации используйте нотацию ячеек для описания следующих систем:
- В одной полуячейке раствор Pt(NO 3 ) 2 образует металлическую Pt, а в другой полуячейке металлическая Cu переходит в раствор Cu(NO 3 ) 2 с все концентрации растворенных веществ 1 М .
- Катод состоит из золотого электрода в растворе 0,55 M Au(NO 3 ) 3 , а анод представляет собой магниевый электрод в 0,75 M растворе Mg(NO 3 ) 2 .
- Одна полуячейка состоит из серебряного электрода в растворе 1 М AgNO 3 , а в другой полуячейке окисляется медный электрод в 1 М Cu(NO 3 ) 2 .

- Почему солевой мостик необходим в гальванических элементах, подобных показанному на рис. 2?
- Было обнаружено, что активный (металлический) электрод набирает массу по мере протекания окислительно-восстановительной реакции. Был ли электрод частью анода или катода? Объяснять.
- Было обнаружено, что активный (металлический) электрод теряет массу по мере протекания окислительно-восстановительной реакции. Был ли электрод частью анода или катода? Объяснять.
- Масса трех различных металлических электродов, каждый из которых был от разного гальванического элемента, была определена до и после того, как ток, генерируемый окислительно-восстановительной реакцией в каждом элементе, протекал в течение нескольких минут. Было обнаружено, что первый металлический электрод, получивший маркировку А, увеличился в массе; второй металлический электрод, получивший маркировку Б, по массе не изменился; и было обнаружено, что третий металлический электрод, получивший маркировку C, потерял массу.

Цели обучения
Cell Notation (Cell Diagrams)
Напомним, что стандартные клеточные потенциалы могут быть рассчитаны из потенциалов E 0 ячейки как для реакций окисления, так и для восстановления. Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Обозначения элементов представляют собой сокращенное описание гальванических или гальванических (самопроизвольных) элементов. Условия реакции (давление, температура, концентрация и т. д.), анод, катод и компоненты электрода описаны в этой уникальной стенограмме.
Напомним, что окисление происходит на аноде, а восстановление — на катоде. Когда анод и катод соединены проводом, электроны текут от анода к катоду.
Типичное расположение полуэлементов, соединенных в гальванический элемент.
Используя расположение компонентов, давайте соберем ячейку.
Один стакан содержит 0,15 М Cd (NO 3 ) 2 и металлический электрод Cd. Другой стакан содержит 0,20 М AgNO 3 и металлический электрод Ag.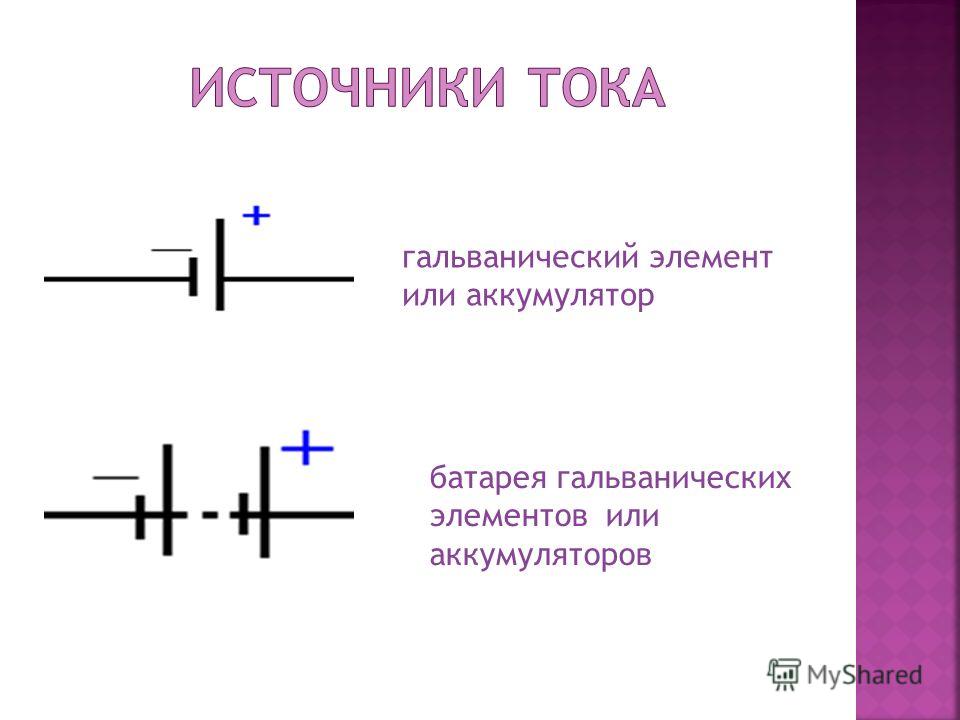 Итоговое ионное уравнение реакции имеет вид:
Итоговое ионное уравнение реакции имеет вид:
В ходе реакции ион серебра восстанавливается, приобретая электрон, а твердый Ag является катодом. Кадмий окисляется, теряя электроны, и твердый Cd является анодом.
Анодная реакция:
Катодная реакция:
Правила обозначения ячеек
Используя эти правила, обозначение для ячейки, которую мы составили, будет:
Cd (s) | Cd 2+ (водн., 0,15 М) || Ag + (водн., 0,20 М) | Ag(s)
Дайте нам отзыв об этом содержании:
Назначьте чтение концепции
Назначьте только эту концепцию или целые главы вашему классу бесплатно.
Редактировать это содержимое
ПРЕДЫДУЩАЯ КОНЦЕПЦИЯ
Электролизеры
Стандартные восстановительные потенциалы
СЛЕДУЮЩАЯ КОНЦЕПЦИЯ
Упоминается в 3 вопроса викторины
Учитывая следующую информацию, представьте соответствующие обозначения электрохимической ячейки для следующей реакции: ZnSO4(водн. ) + Mn(т) Zn(тв) + MnSO4(водн.) 1,0 М, 1,0 атм и 298 К
) + Mn(т) Zn(тв) + MnSO4(водн.) 1,0 М, 1,0 атм и 298 К
Zn (s) | Zn 2+ || Мн 2+ | Mn (с), Mn (с) | Мн 2+ || Zn 2+ | Zn (т), Zn 2+ | Zn (с) || Мн (с) | Mn 2+ или Mn 2+ | Мн (с) || цинк (с) | Цин 2+
Какие из следующих условий считаются стандартными при написании обозначений электрохимических элементов?a. 1 литр объема раствораb. 1 атмосфера давленияc. 1,00 молярный раствор концентрированный. 298 кельвинов температура
а, б и г, а, в и г, а. b и c или b, c и d
Какое обозначение ячейки для гальванического элемента со следующим уравнением? Pb2+(водн.) + Cd(s) → Pb(s) + Cd2+(водн.)
Pb | Pb2⁺|| Cd2⁺| Cd, Pb2⁺ | свинца || компакт-диск | Cd2⁺, Cd | Cd2⁺|| Pb2⁺ | Pb или Cd | Pb2⁺|| свинца | Cd2
Резюме
Источник: Безбрежный. «Обозначение электрохимической ячейки». Безграничная химия. Boundless, 21 июля 2015 г. Получено 11 апреля 2016 г. с сайта www.boundless.com/chemistry/…tion-513-3688/ 9.0032
Cell Diagrams распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
Гальванические элементы | Химия по специальностям
Результаты обучения
В качестве демонстрации спонтанного химического изменения на рис. 1 показан результат погружения свернутой в спираль проволоки из меди в водный раствор нитрата серебра. Спонтанно происходит постепенное, но визуально впечатляющее изменение, когда изначально бесцветный раствор становится все более синим, а изначально гладкая медная проволока покрывается пористым серым твердым веществом.
Рис. 1. Медная проволока и водный раствор нитрата серебра (слева) соприкасаются (в центре) и происходит спонтанный перенос электронов, в результате чего образуется синий Cu 2+<\sup>(водн. ) и серый Ag(s) (справа).
) и серый Ag(s) (справа).
Эти наблюдения согласуются с (i) окислением элементарной меди с образованием ионов меди (II), Cu 2+ (водн.) , которые придают раствору синий цвет, и (ii) восстановлением ионов серебра(I) с образованием элементарного серебра, которое осаждается в виде пушистого твердого вещества на поверхности медной проволоки. Таким образом, прямая передача электронов от медной проволоки к водным ионам серебра происходит самопроизвольно в используемых условиях. Краткое изложение этой окислительно-восстановительной системы представлено следующими уравнениями: 9{-}\longrightarrow \text{2Ag}\left(s\right)\end{array}[/latex]
Рассмотрим конструкцию устройства, содержащего все реагенты и продукты окислительно-восстановительной системы, как здесь, но предотвращает физический контакт между реагентами. Таким образом, прямой перенос электронов предотвращается; вместо этого перенос происходит косвенно через внешнюю цепь, которая контактирует с разделенными реагентами. Устройства такого рода обычно называют электрохимическими ячейками , а те, в которых происходит спонтанная окислительно-восстановительная реакция, называются гальванические элементы (или гальванические элементы ).
Устройства такого рода обычно называют электрохимическими ячейками , а те, в которых происходит спонтанная окислительно-восстановительная реакция, называются гальванические элементы (или гальванические элементы ).
Гальванический элемент, основанный на спонтанной реакции между медью и серебром(I), показан на рисунке 2. Ячейка состоит из двух полуэлементов, каждый из которых содержит окислительно-восстановительную сопряженную пару («пару») одного реагента. Показанная слева полуячейка содержит пару Cu(0)/Cu(II) в виде твердой медной фольги и водного раствора нитрата меди. Правая половина ячейки содержит пару Ag(I)/Ag(0) в виде сплошной серебряной фольги и водного раствора нитрата серебра. Внешняя цепь подключена к каждой полуэлементу на ее твердой фольге, что означает, что каждая медная и серебряная фольга функционирует как электрод . По определению, анодом электрохимической ячейки является электрод, на котором происходит окисление (в данном случае медная фольга), а катодом является электрод, на котором происходит восстановление (серебряная фольга). Окислительно-восстановительные реакции в гальваническом элементе происходят только на границе между реакционной смесью каждой полуэлемента и его электродом. Чтобы разделить реагенты при сохранении баланса заряда, два раствора полуэлемента соединены трубкой, заполненной раствором инертного электролита, называемой солевым мостиком. Спонтанная реакция в этой клетке дает Cu 2+ катионы в анодной полуэлементе и поглощают ионы Ag + в катодной полуэлементе, что приводит к компенсирующему потоку инертных ионов из солевого мостика, который поддерживает баланс заряда. Возрастающие концентрации Cu 2+ в анодной полуячейке уравновешиваются притоком NO 3 − из солевого мостика, а приток Na + в катодную полуячейку компенсирует уменьшение Ag + концентрация.
Окислительно-восстановительные реакции в гальваническом элементе происходят только на границе между реакционной смесью каждой полуэлемента и его электродом. Чтобы разделить реагенты при сохранении баланса заряда, два раствора полуэлемента соединены трубкой, заполненной раствором инертного электролита, называемой солевым мостиком. Спонтанная реакция в этой клетке дает Cu 2+ катионы в анодной полуэлементе и поглощают ионы Ag + в катодной полуэлементе, что приводит к компенсирующему потоку инертных ионов из солевого мостика, который поддерживает баланс заряда. Возрастающие концентрации Cu 2+ в анодной полуячейке уравновешиваются притоком NO 3 − из солевого мостика, а приток Na + в катодную полуячейку компенсирует уменьшение Ag + концентрация.
Рис. 2. Гальванический элемент на основе спонтанной реакции между ионами меди и серебра(I).
Обозначение элемента
Сокращенный символизм обычно используется для представления гальванического элемента, предоставляя важную информацию о его составе и структуре. Эти символические представления называются обозначениями ячеек или схемами ячеек, и они написаны в соответствии с несколькими рекомендациями:
Эти символические представления называются обозначениями ячеек или схемами ячеек, и они написаны в соответствии с несколькими рекомендациями:
Вербальное описание ячейки с точки зрения от анода до катода часто является полезным первым шагом при написании ее схемы. Например, гальванический элемент, показанный на рисунке 2, состоит из твердого медного анода, погруженного в водный раствор нитрата меди(II), который соединен солевым мостиком с водным раствором нитрата серебра(I), в который погружен твердый серебряный катод. Преобразование этого утверждения в символику в соответствии с приведенными выше рекомендациями приводит к схеме ячейки: 9{2+}\left(g\right)\end{array}[/latex]
Преобразование этого утверждения в символику в соответствии с приведенными выше рекомендациями приводит к схеме ячейки: 9{2+}\left(g\right)\end{array}[/latex]
В этой ячейке твердый магниевый анод погружен в водный раствор хлорида магния, который соединен солевым мостиком с водным раствором содержащую смесь хлорида железа(III) и хлорида железа(II), в которую погружен платиновый катод. Затем схема ячейки записывается как
[латекс]\текст{Mg}\left(s\right)\mid {0,1 M} {\text{MgCl}_{2}}\left(aq\right)\parallel {0,2 M}{\text{ FeCl}}_{3}\left(водн.\право), {0,3 M}{\text{ FeCl}_{2}}\left(водн.\право)\mid \text{ Pt}\влево(с\вправо)[/латекс]
Обратите внимание, что катодный полуэлемент отличается от других рассмотренных до сих пор тем, что его электрод состоит из вещества (Pt), которое не является ни реагентом, ни продуктом реакции элемента. Это требуется, когда ни один из членов окислительно-восстановительной пары полуэлемента не может разумно функционировать в качестве электрода, который должен быть электропроводным и находиться в фазе, отдельной от раствора полуэлемента. В этом случае оба члена окислительно-восстановительной пары являются растворенными веществами, поэтому Pt используется в качестве инертный электрод , который может просто отдавать или принимать электроны к окислительно-восстановительным соединениям в растворе. Электроды, изготовленные из элемента окислительно-восстановительной пары, такого как магниевый анод в этой ячейке, называются активными электродами .
В этом случае оба члена окислительно-восстановительной пары являются растворенными веществами, поэтому Pt используется в качестве инертный электрод , который может просто отдавать или принимать электроны к окислительно-восстановительным соединениям в растворе. Электроды, изготовленные из элемента окислительно-восстановительной пары, такого как магниевый анод в этой ячейке, называются активными электродами .
Рис. 3. Гальванический элемент на основе самопроизвольной реакции между ионами магния и железа(III).
Вы можете просмотреть стенограмму «Гальванические элементы (гальванические элементы)» здесь (откроется в новом окне).
Пример 1. Написание схемы гальванического элемента
Гальванический элемент изготавливается путем соединения двух полуэлементов солевым мостиком, в одном из которых хромовая проволока погружена в раствор 1 М CrCl 3 , а в другом медная проволока погружена в 1 М раствор CuCl 2 .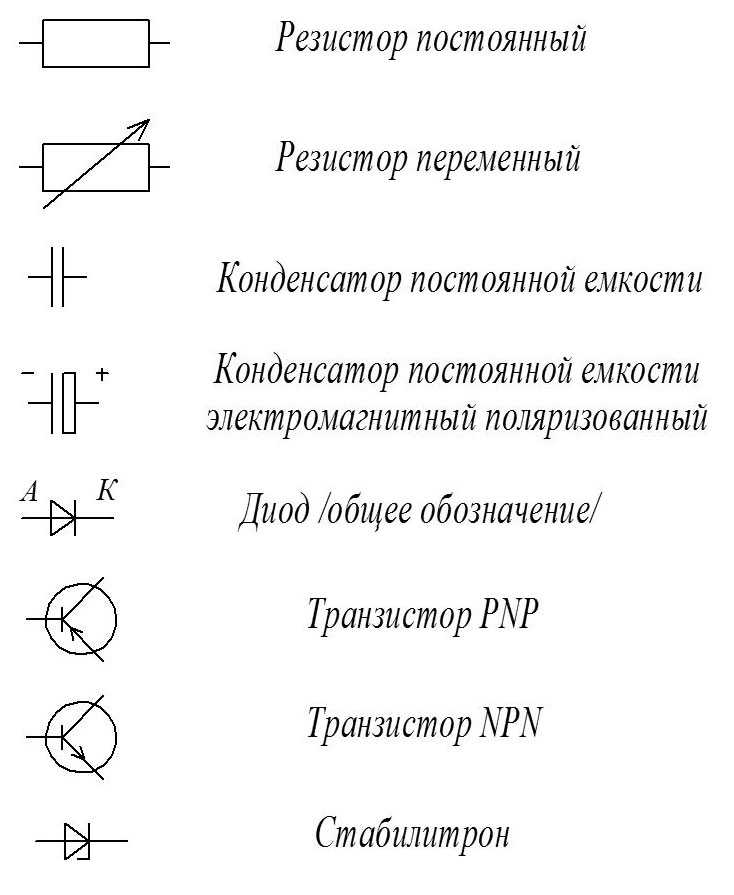 Предполагая, что хромовая проволока действует как анод, напишите схему этой ячейки вместе с уравнениями для анодной полуреакции, катодной полуреакции и общей реакции ячейки.
Предполагая, что хромовая проволока действует как анод, напишите схему этой ячейки вместе с уравнениями для анодной полуреакции, катодной полуреакции и общей реакции ячейки.
Показать решение
Проверьте свои знания
9{2+}\left(aq\right)[/latex]Показать решение
Вы можете просмотреть стенограмму «Гальванический элемент с цинком и медью» здесь (откроется в новом окне).
Ключевые понятия и резюме
Электрохимические элементы обычно состоят из двух полуэлементов. Полуэлементы отделяют полуреакцию окисления от полуреакции восстановления и позволяют току течь по внешнему проводу. Одна полуячейка, обычно изображаемая слева на рисунке, содержит анод. Окисление происходит на аноде. Анод соединен с катодом в другой полуэлементе, часто показанном на рисунке справа. Восстановление происходит на катоде. Добавление соляного моста замыкает цепь, позволяя течь току. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике текут к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией |. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций. 9{2+}\left(aq\right)+\text{2Ag}\left(s\right)[/latex]
Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией |. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций. 9{2+}\left(aq\right)+\text{2Ag}\left(s\right)[/latex]


 Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
 Виды и устройство. Плюсы и минусы
Виды и устройство. Плюсы и минусы Таким образом, правый электрод всегда является катодом , а полууравнение всегда записывается как восстановление
Таким образом, правый электрод всегда является катодом , а полууравнение всегда записывается как восстановление  Если это так, то окисление высвободит электроны во внешнюю цепь на левом электроде. Если в цепь поместить вольтметр, эти электроны сделают его левый вывод отрицательным. Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]
Если это так, то окисление высвободит электроны во внешнюю цепь на левом электроде. Если в цепь поместить вольтметр, эти электроны сделают его левый вывод отрицательным. Поскольку правый электрод соответствует восстановлению, электроны будут оттягиваться от правого вывода вольтметра. Это показано для элемента Zn-Cu на рисунке 1 из раздела «Гальванические элементы». Вы можете легко подтвердить, что спонтанная клеточная реакция (уравнение (1) из Galvanic Cells) соответствует сокращенному обозначению ячейки уравнения \(\ref{1}\). 9{2+}(водн.)} \номер\]
 0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
 9{-}\left(aq\right)\text{(базовое решение)}[/latex]
9{-}\left(aq\right)\text{(базовое решение)}[/latex]