Химические связи, подготовка к ЕГЭ по химии
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
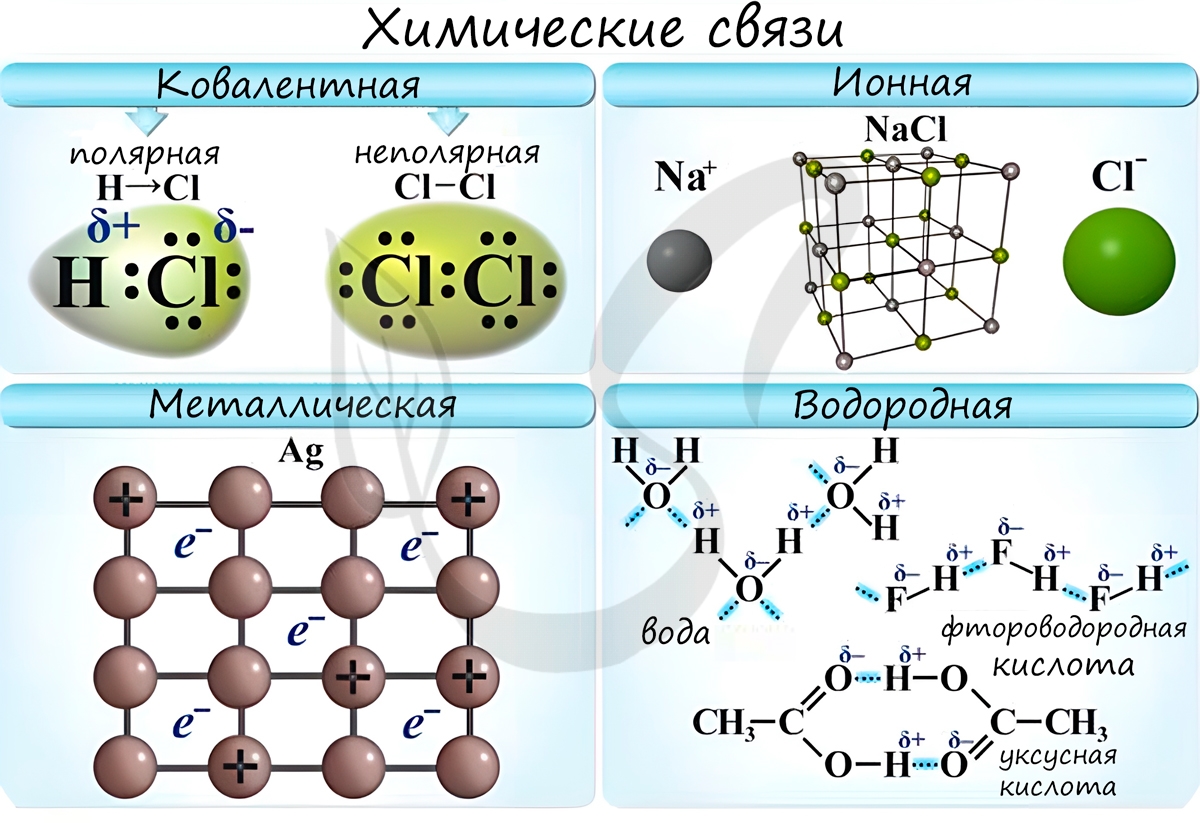
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2),
а также, в общем случае, между атомами неметалла и другого неметалла (NH
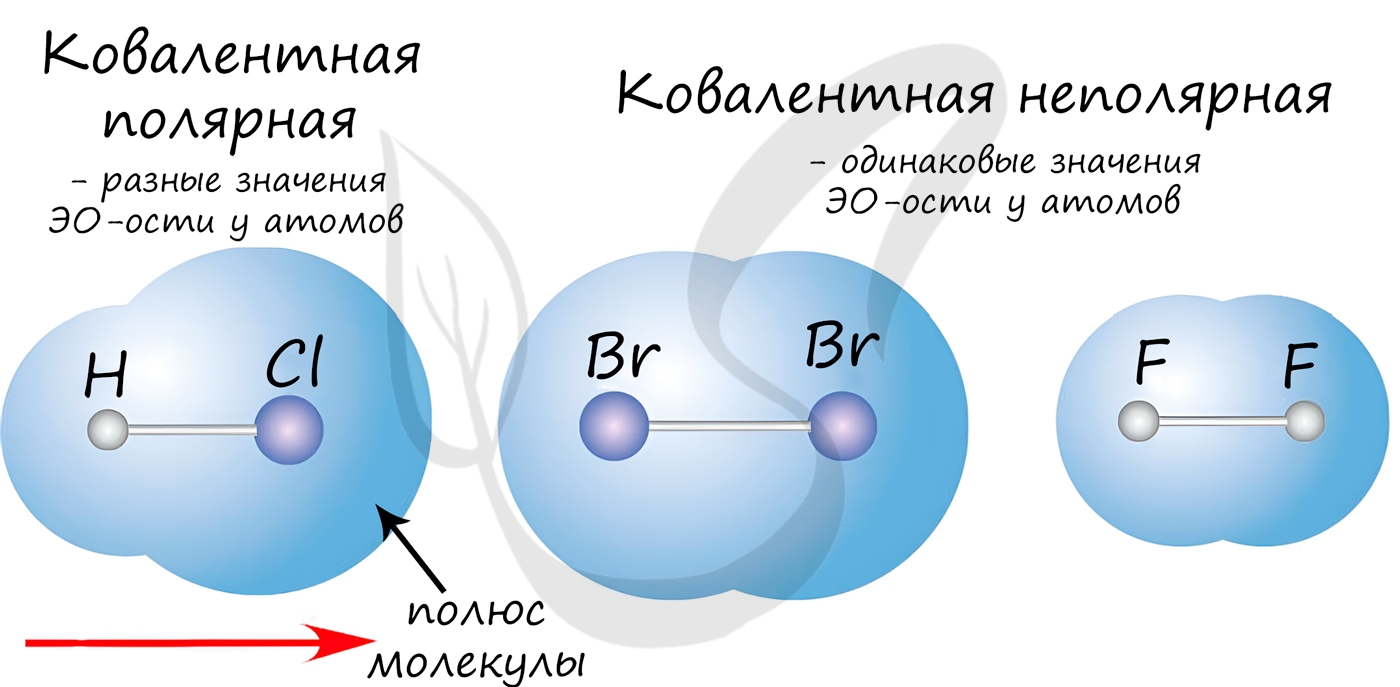
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной.
В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH
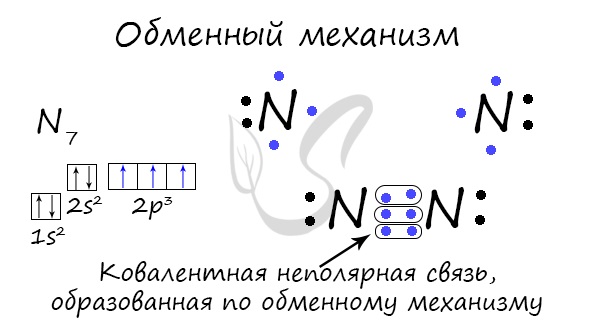
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
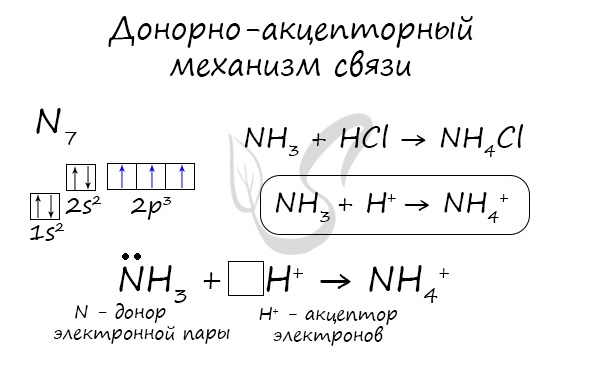
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4.
Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в
соединениях: NH
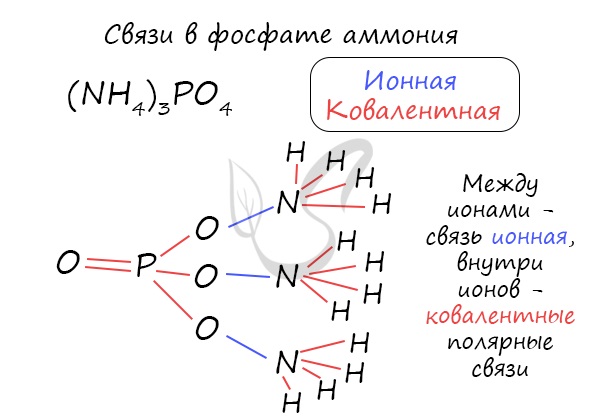
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
Ионная, водородная и металлическая связи
Донорно-акцепторная связь
Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором):
Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от атома-донора к атому-акцептору: А→В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора:
Донорно-акцепторная связь имеет такие же свойства, как и обычная ковалентная связь, а отличается от нее только происхождением общей электронной пары. Образование донорно-акцепторной связи рассмотрим на примере иона аммония NH4+. Этот сложный ион образуется в результате присоединения иона водорода Н+ к молекуле аммиака NH
NH3 + H+ = NH4+
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NH3. Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную 1s-орбиталь, поэтому он может быть акцептором электронов:

Все четыре связи N—H в ионе аммония являются равноценными. Это обусловлено тем, что в момент образования связи в атоме азота происходит гибридизация 2s-орбитали и трех 2р-орбиталей, т. е. sp3 -гибридизация. В результате возникают четыре одинаковые гибридные орбитали, которые направлены к вершинам тетраэдра. Таким образом, ион аммония, как и молекулы типа АВ4, имеет тетраэдрическую форму.
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Следовательно, если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей. Такую валентность азот имеет и в таких соединениях, как N2О5, HNО3, NaNО3 и т. п. Например, в молекуле азотной кислоты три ковалентные связи N—O образуются неспаренными электронами атома азота, а одна связь N—О образуется неподеленной парой электронов атома азота:

Ионная связь
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ДЭО > 1,7), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, имеющих электрические заряды. Эти Частицы называются ионами:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи.
Как вы уже знаете, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны: Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами, например:
Na0 — 1ē→Na+ — катион натрия;
Ca0 — 2ē→Ca2+ — катион кальция.
При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами, например:
Cl0 + 1ē→ Cl— — хлорид-анион;
O0 + 2ē→O2- — оксид анион.
Например, образование ионной связи при взаимодействии атомов натрия и хлора схематично можно показать так:
Как видно из этого примера, ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи, как и при образовании ковалентной связи, атомы переходят в более устойчивое состояние.
По своим свойствам ионная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во все стороны. Поэтому данный ион может притягивать ионы противоположного знака в любом направлении. Этим обусловлены ненаправленность и ненасыщаемость ионной связи. В кристаллической решетке ионных соединений вокруг каждого иона располагается определенное число ионов с противоположным зарядом. Например, в кристаллической решетке хлорида натрия NaCl каждый ион натрия Na+ окружен шестью хлорид-ионами Сl—, а каждый хлорид-ион окружен шестью ионами натрия. Таким образом, для ионных соединений понятие «молекула» при обычных условиях теряет смысл.
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SО4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в NaОН и между атомами кислорода и серы в Na2SО4) — ковалентные полярные.
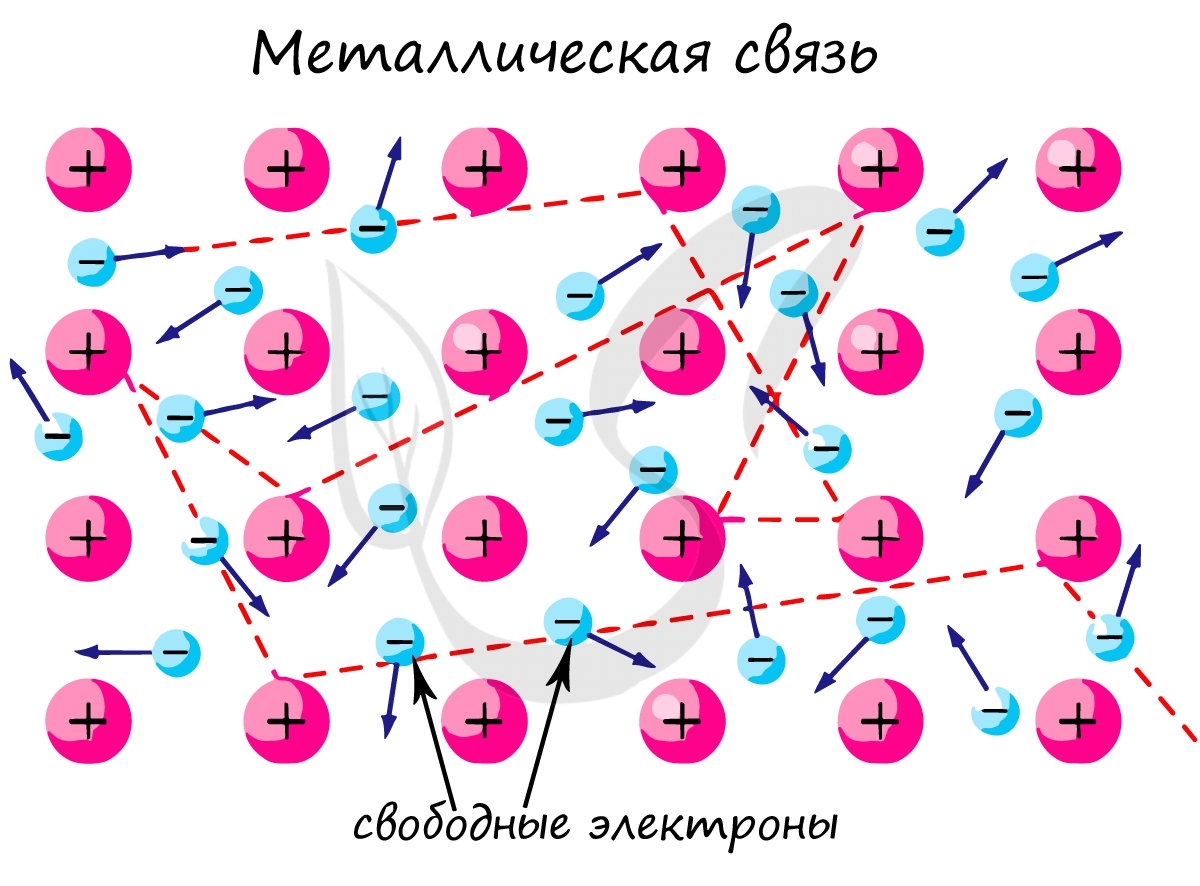
Металлическая связь
Как известно, атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ-металлов.
Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути Hg). В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.
Поэтому электроны, которые находятся в кристаллической решетке металлов, называются свободными электронами, или «электронным газом».
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью.
Металлическая связь обусловливает важнейшие физические свойства металлов.
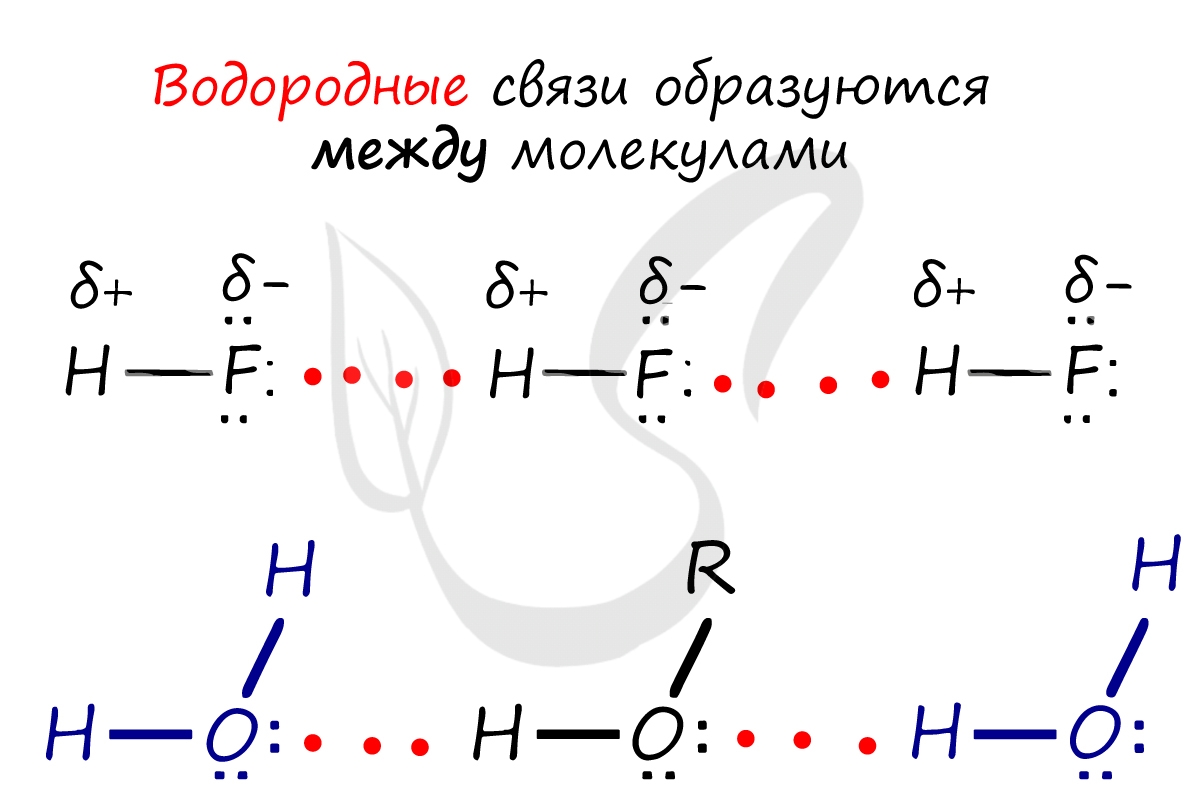
Водородная связь
Водородная связь является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (например, с фтором, кислородом, азотом). Ковалентные связи H—F, Н—О, H—N являются сильно полярными (большая разность ЭО!). Поэтому атом водорода имеет избыточный положительный заряд +5, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды:

В результате электростатического взаимодействия происходит притяжение положительно заряженного атома водорода одной молекулы к электроотрицательному атому другой молекулы. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «полусвободной» 1s-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома:
Это примеры образования межмолекулярных водородных связей. (Водородные связи обозначаются точками). Образование межмолекулярных водородных связей является причиной существования ассоциатов молекул типа (HF)n, (H2O)n и др.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=О:
Внутри- и межмолекулярные водородные связи существуют в молекулах белков, ДНК и др.
Таким образом, при образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью.
Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи и варьируется в пределах 15 — 40 кДж/моль. Тем не менее, водородные связи играют важную роль во многих физико-химических и биологических процессах.
Межмолекулярные взаимодействия
Межмолекулярная водородная связь является одним из видов межмолекулярных взаимодействий.
Существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти силы называются ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольными молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным:
Типы кристаллических решеток твердых веществ

Скачать:
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (46 Загрузок)
Скачать бесплатно реферат на тему: «Химическая связь» Химическая-связь.doc (43 Загрузки)
Рефераты по другим темам можно скачать здесь
Похожее
Ковалентная связь устанавливается между атомами не только одного элемента, но и разных.

Рассмотрим установление химической связи между атомами разных элементов-неметаллов на примере образования фторида водорода.
Запишем схему электронных структур атомов водорода и фтора.
У каждого из атомов имеется по одному неспаренному электрону.
При взаимодействии этих электронов может образоваться общая электронная пара, связывающая атомы разных элементов:

В данном случае перекрываются сферическая s- орбиталь атома водорода и гантелеобразная p-орбиталь атома фтора.
Эта химическая связь также ковалентная.
Она осуществляется общей электронной парой, для образования которой каждый из этих атомов поставляет по одному электрону.
Связывающая их электронная пара принадлежит обоим атомам, однако уже не в равной степени.
Это связано с тем, что атомы разных элементов имеют разную электроотрицательность.
Электроотрицательность – количественная характеристика способности атома смещать в свою сторону общие электронные пары.
Общая электронная пара в молекуле сложного вещества смещена к одному из атомов, что образует вокруг этого атома избыток отрицательного заряда, а у другого – избыток положительного заряда.
Такая молекула имеет как бы два полюса: положительный и отрицательный.
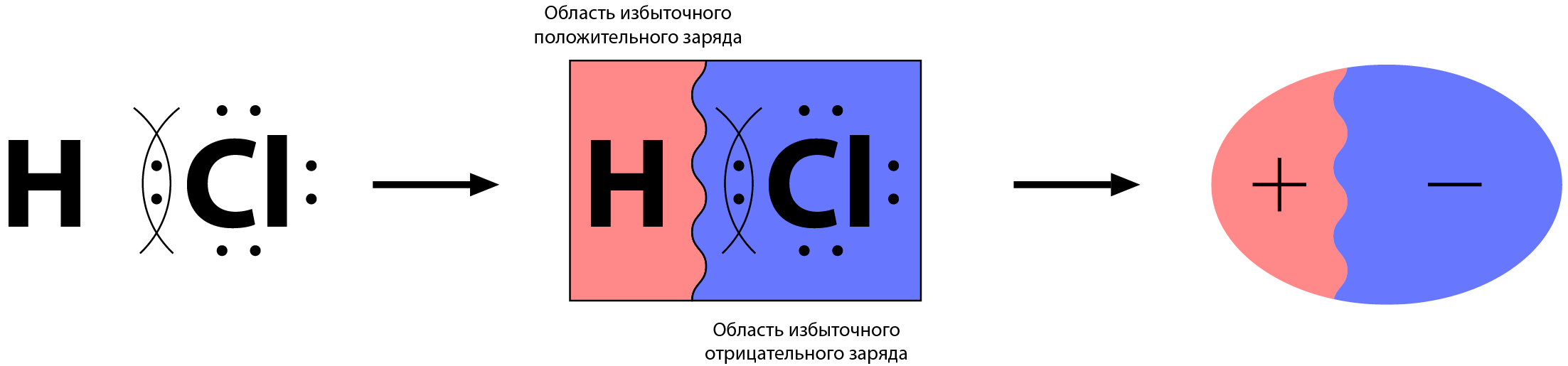
Поэтому такую связь называют ковалентной полярной.
Молекулы хлороводорода, воды, аммиака являются полярными.
Их еще называют диполями (имеющими два полюса).
В противоположность этому, связь между одинаковыми атомами, где электронная пара принадлежит обоим атомам в равной степени, называют ковалентной неполярной.
Важнейшим свойством ковалентной связи является ее прочность.
Она определяется энергией связи. Вы уже знаете, что при образовании химической связи выделяется энергия – это экзотермический процесс.
При образовании H2выделяется 431 кДж/моль, при образовании HF– 565 кДж/моль (количество энергии, выделяющееся при образовании 1 моль вещества).
Чем выше степень перекрывания электронных облаков связывающихся атомов, тем больше энергия их связи и тем прочнее образованная молекула.
Длина связи – другое ее свойство. Длину связи измеряют в нанометрах (1 нанометр = 10-9метра).
Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними.
Чем меньше длина связи, тем она прочнее.
Направленностьковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи.
Рассмотрим направленность ковалентных связей в молекуле воды.
У атома кислорода два неспаренных р-электрона.
Их р-электронные облака расположены в пространстве взаимно перпендикулярно по отношению друг к другу.
При взаимодействии с атомами водорода образуются две химические связи.
В молекуле воды они также образуют угол.
Экспериментально установлено, что угол связи Н–О–Н в молекуле воды равен не 90°, а 104,45° вследствие их взаимного отталкивания: у молекулы воды угловая форма.
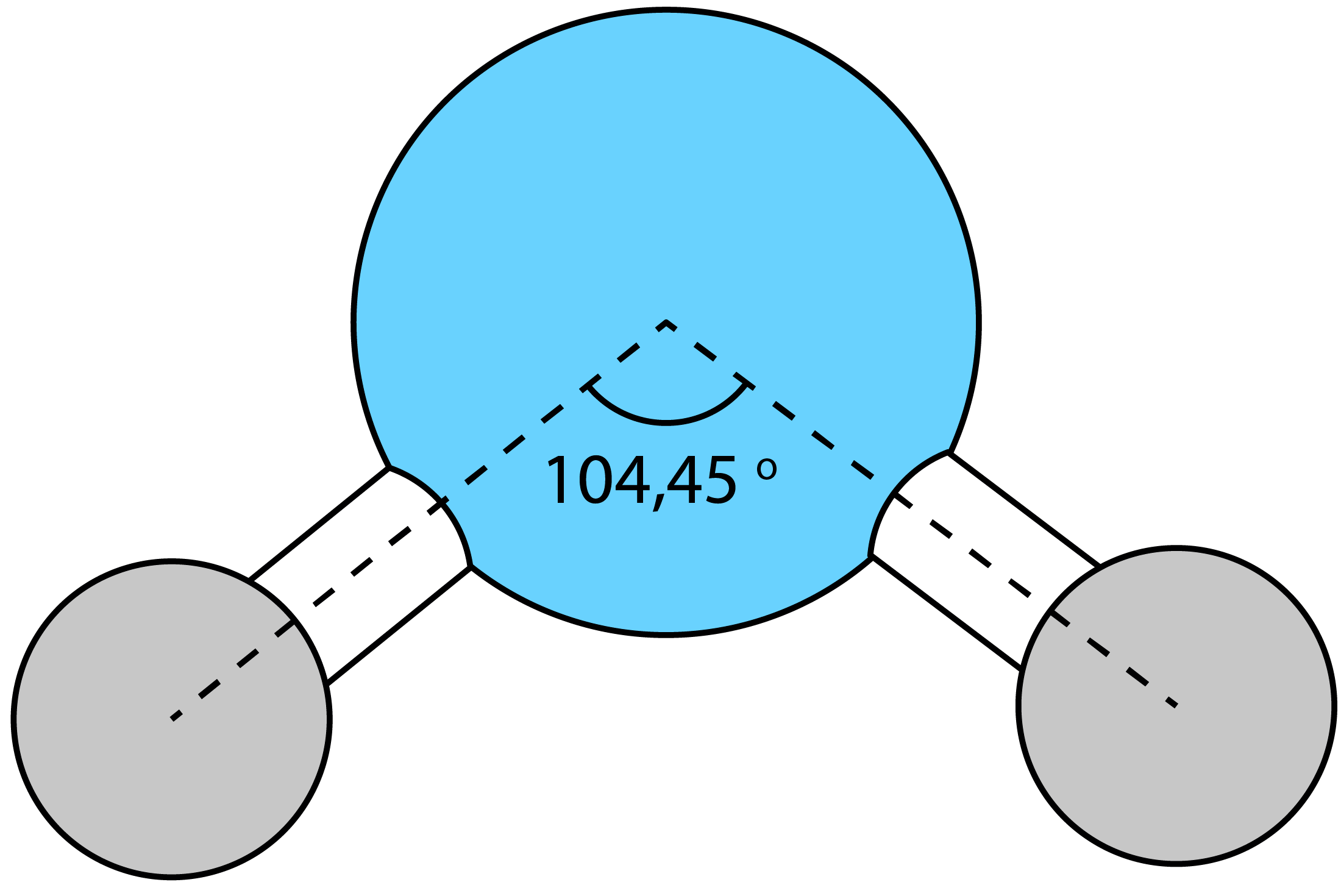
Здесь настало время рассказать про ещё один вид связи.
Эту связь нельзя назвать полностью химической, а скорее электрохимической.
Кислород имеет очень большую электроотрицательность по отношению к водороду, вследствие чего в молекуле воды он очень сильно смещает на себя электронные пары, поэтому образующиеся вокруг атомов заряды ощутимы до такой степени, что между соседними молекулами воды образуются силы притяжения.
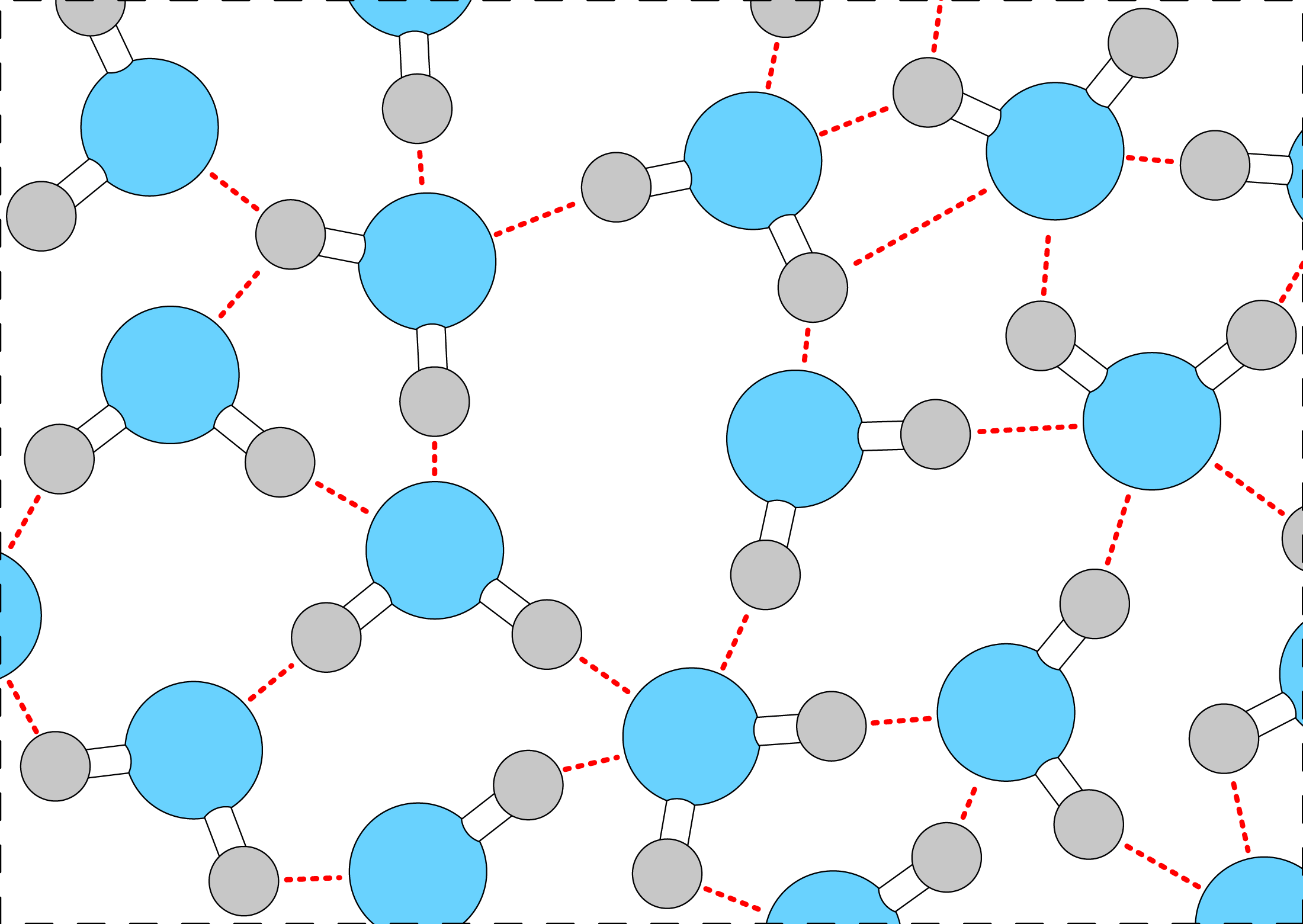
Поскольку такой вид связи образуется преимущественно с участием атомов водорода, её называют водородной.
Прочность такой связи примерно в 10 раз меньше прочности ковалентной, однако она значительно влияет на свойства веществ: повышает температуру плавления и кипения, вязкость, теплопроводность, теплоёмкость веществ.
Для примера рассмотрим температуры кипения и плавления водородных соединений элементов VI группы периодической системы (кислород, сера, селен, теллур) и рассмотрим их в виде таблицы и графика.
Вещество | Температура кипения | Температура плавления |
H2Te (теллуроводород) | –2,2 °С | –49 °С |
H2Se (селеноводород) | –41,25 °С | –65,37 °С |
H2S (сероводород) | –60,28 °С | –82,30 °С |
H2O (вода) | +100,00 °С | 0,00 °С |
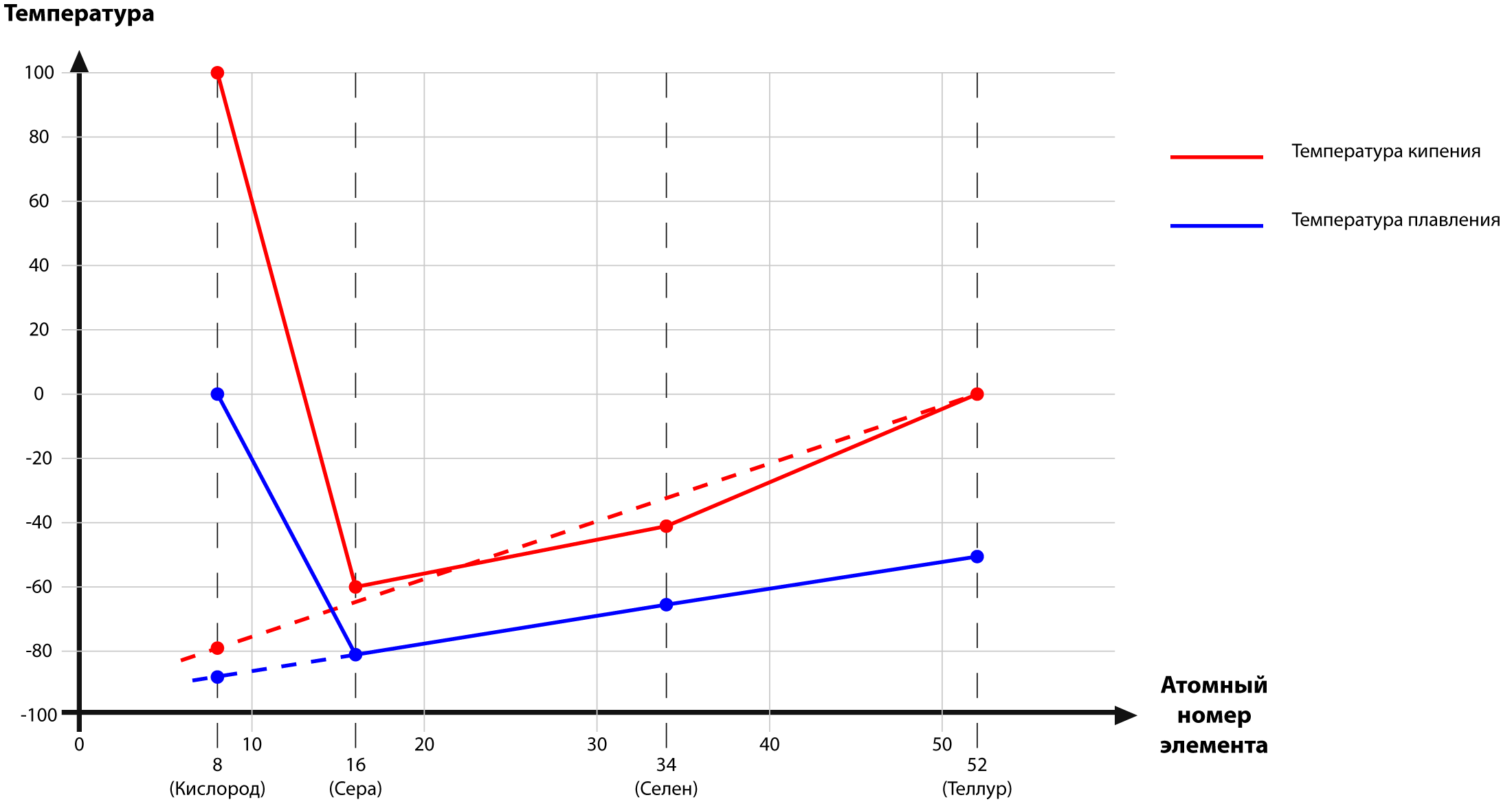
Если бы между молекулами воды не существовало водородных связей, температура кипения воды была бы около минус 80 °С, а температура плавления около минус 90°С.
Водородная связь играет большую роль не только в том, что вода при нормальных условиях представляет собой жидкость.
Она также участвует в стабилизации очень многих органических молекул в живых организмах, таких как белки или нуклеиновые кислоты.
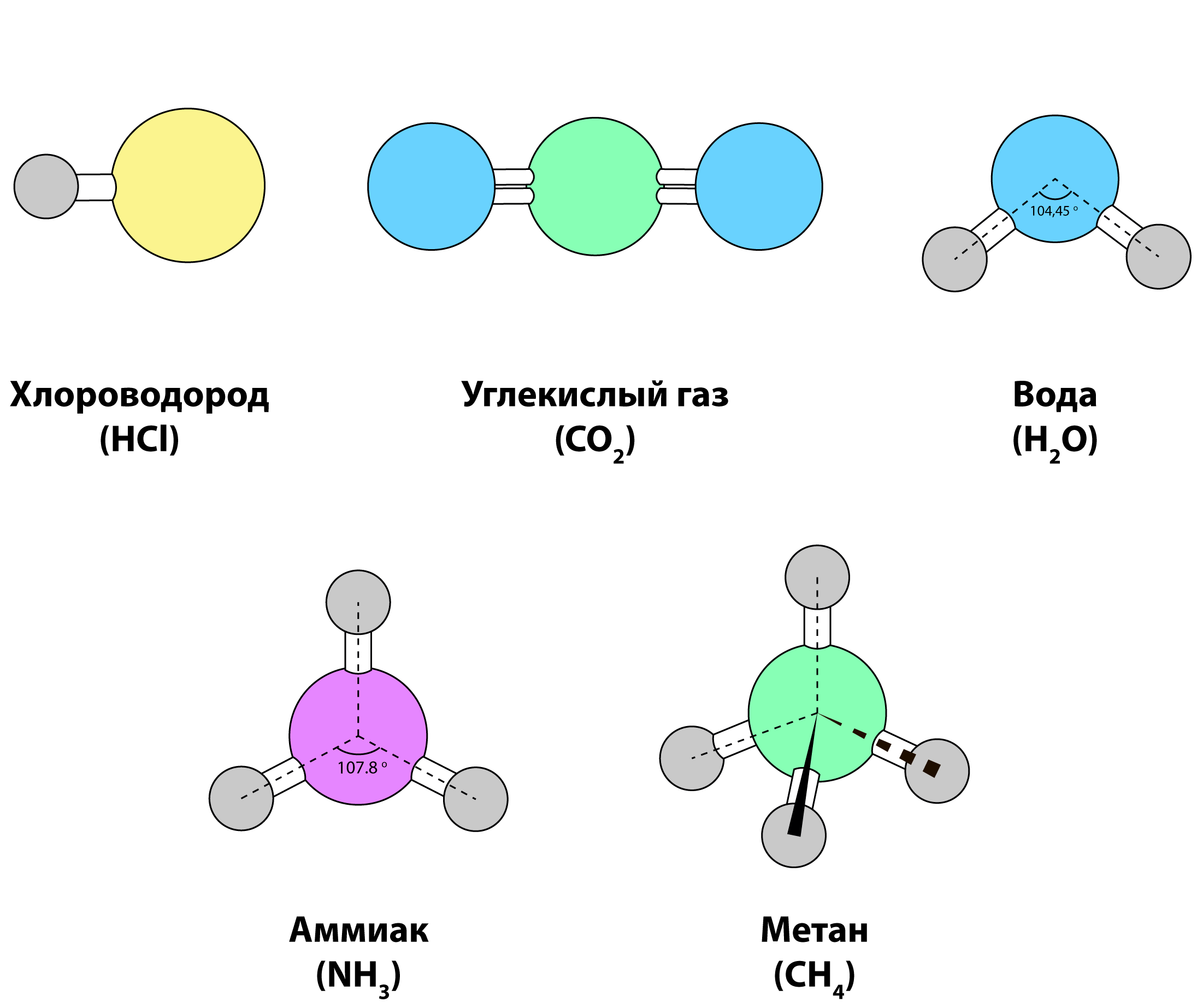
Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
Двухатомные молекулы, естественно, линейной формы.
Трехатомные молекулы могут иметь линейную или угловую форму. Четырехатомная молекула аммиака имеет форму пирамиды.

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
1) O2, H2, N2
2) Al, O3, H2SO4
3) Na, H2, NaBr
4) H2O, O3, Li2SO4
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
1) O2, H2SO4, N2
2) H2SO4, H2O, HNO3
3) NaBr, H3PO4, HCl
4) H2O, O3, Li2SO4
3. Только ионной связью образовано каждое из веществ, формулы которых
1) CaO, H2SO4, N2
2) BaSO4, BaCl2, BaNO3
3) NaBr, K3PO4, HCl
4) RbCl, Na2S, LiF
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
1) HCl и Na2S
2) Cr и Al(OH)3
3) NaBr и P2O5
4) P2O5 и CO2
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
1) HI – PH3 – HCl
2) PH3 – HCl – H2S
3) HI – HCl – H2S
4) HCl – H2S – PH3
11. Длина химической связи Э–Н уменьшается в ряду веществ
1) NH3 – H2O – HF
2) PH3 – HCl – H2S
3) HF – H2O – HCl
4) HCl – H2S – HBr
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
1) 4
2) 2
3) 6
4) 8
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
1) 4
2) 20
3) 6
4) 12
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
1) Mg
2) H2
3) NaCl
4) CaCl2
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
1) NaF, CaF2
2) NaNO3, N2
3) O2, SO3
4) Ca(NO3)2, AlCl3
Ответы

Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
Введение в химическое связывание — химия LibreTexts
Химическое связывание является одной из самых основных основ химии, которая объясняет другие понятия, такие как молекулы и реакции. Без этого ученые не смогли бы объяснить, почему атомы притягиваются друг к другу или как образуются продукты после химической реакции. Чтобы понять концепцию связи, нужно сначала знать основы атомной структуры.
Диаграммы Льюиса
Диаграммы Льюиса являются графическим представлением элементов и их валентных электронов.Валентные электроны — это электроны, которые образуют внешнюю оболочку атома. На диаграмме Льюиса элемента символ элемента записан в центре, а валентные электроны нарисованы вокруг него в виде точек. Положение нарисованных валентных электронов неважно. Тем не менее, общее соглашение состоит в том, чтобы начинать с позиции 12 часов и двигаться по часовой стрелке до 3 часов, 6 часов, 9 часов и обратно до 12 часов соответственно. Обычно римская цифра группы соответствует количеству валентных электронов элемента.
Ниже приведена таблица периодических чисел числа валентных электронов. Щелочные металлы группы IA имеют один валентный электрон, щелочноземельные металлы группы IIA имеют 2 валентных электрона, группа IIIA имеет 3 валентных электрона и так далее. Неопознанные переходные металлы, лантаноиды и актиноиды являются более сложными с точки зрения различения числа валентных электронов, которые они имеют; однако, этот раздел только вводит связь, следовательно, они не будут охвачены в этом модуле.
диаграммы Льюиса для молекулярных соединений / ионов
Чтобы нарисовать диаграммы Льюиса для молекулярных соединений или ионов, выполните следующие действия (мы будем использовать H 2 O в качестве примера для подражания):
1) Подсчитайте количество валентных электронов молекулярного соединения или иона. Помните, если есть два или более одинаковых элемента, то вы должны удвоить или умножить на сколько бы атомов ни было число электронов валанса.Следуйте за номером группы римских цифр, чтобы увидеть соответствующее количество валентных электронов для этого элемента.
Valance электронов:
Кислород (O) — группа VIA: следовательно, есть 6 валентных электронов
Водород (H) — группа IA: следовательно, есть 1 электрон-баланс
ПРИМЕЧАНИЕ. ДВА атома водорода умножают на 1 валентный электрон X 2 атома
Итого: 6 + 2 = 8 валентных электронов
2) Если молекула, о которой идет речь, является ионом, не забудьте добавить или вычесть соответствующее количество электронов к общему количеству, начиная с шага 1.
Для ионов, если ион имеет отрицательный заряд (анион), добавьте соответствующее количество электронов к общему количеству электронов (т. Е. Если у НЕТ 3 — отрицательный заряд 1-, то вы добавляете 1 дополнительный электрон к общему количеству; 5 + 3 (6) = 23 +1 = 24 полных электрона). Знаки — означают, что молекула имеет общий отрицательный заряд, поэтому она должна иметь этот дополнительный электрон. Это потому, что анионы имеют более высокое сродство к электрону (тенденция к получению электронов).Большинство анионов состоят из неметаллов, которые имеют высокую электроотрицательность.
Если ион имеет положительный заряд (катион), вычтите из соответствующего числа электронов из общего числа электронов (т. Е. H 3 O + имеет положительный заряд 1+, поэтому вы вычтите 1 дополнительный электрон к общему количеству; 6 + 1 (3) = 9 — 1 = 8 полных электронов). Знак + означает, что молекула имеет общий положительный заряд, поэтому ей не хватает одного электрона.Катионы являются положительными и имеют более слабое сродство к электрону. Они в основном состоят из металлов; их атомные радиусы больше, чем у неметаллов. Следовательно, это означает, что экранирование увеличивается, и электроны имеют меньшую тенденцию притягиваться к «экранированному» ядру.
В нашем примере вода является нейтральной молекулой, поэтому нет необходимости добавлять или вычитать электроны из общего количества.
3) Запишите символы элементов, убедившись, что все атомы учтены (i.е. H 2 O, запишите O и 2 H по обе стороны от кислорода). Начните с добавления одинарных связей (1 пара электронов) ко всем возможным атомам, следя за тем, чтобы они следовали правилу октетов (за исключением правила дуэта и других элементов, упомянутых выше).
4) Если есть какие-либо оставшиеся электроны, то добавьте их к центральному атому молекулы (т.е. XeF 4 имеет 4 дополнительных электрона после распределения, поэтому 4 дополнительных электрона передаются Xe: примерно так.Наконец, переставьте электронные пары в двойные или тройные связи, если это возможно.
Октет Правило
Большинство элементов следуют правилу октетов в химической связи, что означает, что элемент должен иметь контакт с восемью валентными электронами в связи или точно заполнить свою валентную оболочку. Наличие всего восьми электронов обеспечивает стабильность атома. Это причина того, почему благородные газы, валентная электронная оболочка из 8 электронов, являются химически инертными; они уже стабильны и, как правило, не нуждаются в переносе электронов при связывании с другим атомом, чтобы быть стабильными.С другой стороны, щелочные металлы имеют валентную электронную оболочку из одного электрона. Поскольку они хотят выполнить правило октета, они часто просто теряют один электрон. Это делает их весьма реактивными, потому что они могут легко пожертвовать этот электрон другим элементам. Это объясняет высокую реакционную способность элементов группы IA.
Некоторые элементы, которые являются исключениями из правила октета, включают алюминий (Al), фосфор (P), серу (S) и ксенон (Xe).
Водород (H) и Гелий (He) следуют правилу дуэта, поскольку их валентная оболочка допускает только два электрона.Нет никаких исключений из правила дуэта; водород и гелий всегда будут содержать максимум два электрона.
Ионное соединение
Ионная связь — это процесс неделения электронов между двумя атомами. Это происходит между неметаллом и металлом. Ионная связь также известна как процесс, в котором электроны «переносятся» друг на друга, потому что два атома имеют разные уровни сродства к электрону. На рисунке ниже ион натрия (Na) и ион хлора (Cl) объединяются посредством ионной связи.Na + имеет меньшую электроотрицательность из-за большого атомного радиуса и по существу не хочет, чтобы у него был электрон. Это легко позволит более электроотрицательному атому хлора получить электрон, чтобы завершить свой 3-й энергетический уровень. На протяжении всего этого процесса передача электрона высвобождает энергию в атмосферу.
Другим примером ионной связи является структура кристаллической решетки, показанная выше. Ионы расположены таким образом, что демонстрирует однородность и стабильность; физическая характеристика в кристаллах и твердых телах.Более того, в концепции, называемой «морем электронов», видно, что молекулярная структура металлов состоит из стабилизированных положительных ионов (катионов) и «свободно текущих» электронов, которые ткут между катионами. Это приписывает металлу свойство проводимости; текущие электроны позволяют электрическому току проходить через них. Кроме того, это объясняет, почему сильные электролиты являются хорошими проводниками. Ионные связи легко разрушаются водой, потому что полярность молекул воды защищает анионы от привлечения катионов.Следовательно, ионные соединения легко диссоциируют в воде, а металлические свойства соединения позволяют проводить проводимость раствора.
Ковалентное соединение
Ковалентная связь — это процесс разделения электронов между двумя атомами. Связи обычно находятся между неметаллом и неметаллом. Поскольку их электроотрицательности находятся в высоком диапазоне, электроны притягиваются и притягиваются ядерными ядрами обоих атомов. В случае двух идентичных атомов, которые связаны друг с другом (также известный как неполярная связь, объясненная ниже ниже), они оба испускают одинаковую силу притяжения на электронах, таким образом, существует равное притяжение между двумя атомами (т.е.е. газообразный кислород, или O 2 , имеет одинаковое распределение сродства к электрону. Это затрудняет разрыв ковалентных связей.
Существует три типа ковалентных связей: одинарные, двойные и тройные связи. Простая связь состоит из 2 связанных электронов. Естественно, двойная связь имеет 4 электрона, а тройная связь имеет 6 связанных электронов. Поскольку тройная связь будет иметь большее сродство к электрону, чем простая связь, притяжение к положительно заряженному ядру увеличивается, а это означает, что расстояние от ядра до электронов меньше.Проще говоря, чем больше связей или чем больше прочность связи, тем короче будет длина связи. В прочем w
.химическая связь | Определение и примеры
Химическая связь , любое из взаимодействий, которые объясняют ассоциацию атомов в молекулы, ионы, кристаллы и другие стабильные частицы, которые составляют знакомые вещества повседневного мира. Когда атомы приближаются друг к другу, их ядра и электроны взаимодействуют и имеют тенденцию распределяться в пространстве таким образом, что полная энергия ниже, чем это было бы при любом альтернативном расположении. Если полная энергия группы атомов ниже, чем сумма энергий атомов компонента, они тогда соединяются вместе, и снижение энергии является энергией связи.
склеивание кристаллов Различные виды склеивания в кристаллах. Encyclopædia Britannica, Inc.Британика Викторина
входов и выходов из химии
Что из этого не является редкоземельным элементом?
Идеи, которые помогли установить природу химической связи, осуществились в начале 20-го века, после того, как электрон был обнаружен, и квантовая механика предоставила язык для описания поведения электронов в атомах.Однако, хотя химикам нужна квантовая механика для достижения детального количественного понимания образования связей, большая часть их прагматического понимания связей выражается в простых интуитивных моделях. Эти модели рассматривают связи как прежде всего двух видов, а именно, ионные и ковалентные. Тип связи, которая наиболее вероятно возникает между двумя атомами, можно предсказать на основе расположения элементов в периодической таблице, и в некоторой степени свойства образовавшихся веществ могут быть связаны с типом связи.
Ключевой концепцией в обсуждении химической связи является концепция молекулы. Молекулы являются наименьшими единицами соединений, которые могут существовать. Одной из особенностей молекул, которые могут быть предсказаны с достаточным успехом, является их форма. Молекулярные формы имеют большое значение для понимания реакций, которые могут происходить с соединениями, поэтому в этой статье кратко обсуждается связь между химической связью и химической реакционной способностью.
Хотя простые модели связывания полезны в качестве практических правил для рационализации существования соединений, а также физических и химических свойств и структур молекул, их необходимо обосновать, обратившись к более сложным описаниям связывания.Более того, есть некоторые аспекты молекулярной структуры, которые выходят за рамки простых теорий. Чтобы достичь этого понимания, необходимо прибегнуть к полностью квантово-механическому описанию. На практике эти описания влекут за собой большую зависимость от компьютеров. Такие численные подходы к химической связи дают важную информацию о связи.
молекулярная структура Шарообразная модель молекулярной структуры, показывающая атомы, связанные вместе. © asiseeit / iStock.ком Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняЭта статья начинается с описания исторической эволюции современного понимания химической связи, а затем обсуждается, как возникли современные теории образования химических связей и развились в мощное описание структуры материи. После исторического введения обсуждаются качественные модели связи, при этом особое внимание уделяется образованию ионных и ковалентных связей и корреляции последних с молекулярными формами.Затем описываются более сложные квантово-механические подходы к образованию связей, после чего следует обзор ряда особых случаев, которые поднимают интересные проблемы или приводят к важным выводам.
Для подробного обсуждения структуры и свойств атомов, см. атомов. Химические соединения рассматриваются в статье химического состава, а элементы описаны в статье химического элемента.
Исторический обзор
Появление количественной химии
Ранние греки, особенно Демокрит, утверждали, что материя состоит из фундаментальных частиц, называемых атомами.Во взглядах атомщиков, однако, не хватало авторитета, вытекающего из эксперимента, и доказательств существования атомов не было в течение двух тысячелетий до появления количественной эмпирической науки в 18 веке.
,Введение в химическое связывание
Концепция химической связи лежит в основе химии; это то, что позволяет около ста элементам образовывать более пятидесяти миллионов известных химических веществ, составляющих наш физический мир. Прежде чем мы углубимся в теорию химической связи, нам нужно определить, о чем мы говорим:
Что именно является химической связью?
И какие наблюдаемые свойства мы можем использовать, чтобы отделить один вид связи от другого? Это первый из десяти уроков, которые помогут познакомить вас с основными понятиями этого очень широкого предмета.
1 Что такое , это химическая связь?
Вы, наверное, недавно узнали, что химические связи — это то, что удерживает атомы вместе, образуя более сложные агрегаты, которые мы знаем как молекулы и расширенные твердые частицы. Химики все время говорят о связях и рисуют их в виде линий, соединяющих символы атома. Учителя часто идентифицируют их как маленькие палочки, которые соединяют сферы, которые представляют атомы в пластической молекулярной модели.Поэтому неудивительно, что мы иногда склонны думать о химических связях как о «вещах». Но никто никогда не видел химической связи, и нет никаких оснований полагать, что они действительно существуют как физические объекты.
«В некоторых случаях мне кажется, что связь между двумя атомами стала настолько реальной, такой ощутимой, такой дружеской, что я почти могу ее увидеть. Затем я просыпаюсь с небольшим шоком, потому что химическая связь не является реальной. не существует. Никто никогда не видел.Никто никогда не может. Это плод нашего собственного воображения «.
К.А. Коулсон (1910-1974) был английским химиком-теоретиком, который сыграл центральную роль в развитии квантовых теорий химической связи.
Вероятно, более полезно рассматривать химическую связь как эффект , который заставляет определенные атомы объединяться, образуя прочные структуры, которые имеют уникальные физические и химические свойства.
Таким образом, хотя «химическая связь» (как физический объект) может быть не более чем удобным вымыслом, химическая связь , которая приводит к почти бесконечности веществ (31 миллион в середине 2007 года), лежит на самой ядро химии.
Силы, которые удерживают связанные атомы вместе, в основном представляют собой одни и те же виды электростатического притяжения, которые связывают электроны атома с его положительно заряженным ядром;
химическая связь происходит, когда один или несколько электронов
одновременно притягиваются двух ядер.
Это самый важный факт о химическом связывании, который вы должны знать, но он сам по себе не является работоспособной теорией связывания , потому что он не описывает условия, при которых происходит связывание, и не делает полезных предсказаний о свойствах связывания. связанные атомы.
Наши взгляды на то, что составляет химическое связывание, все еще развиваются, согласно статье 2007 года в Chemical and Engineering News ( 85 37-40). Этот «бакибол и перчатка», синтезированный в 2007 году Анджеем Сигулой, является тому примером. Бакибол C 60 находится в С 60 H 28 «Бакибоул». Там нет традиционных «химических связей» между мячом и мит!
изображение из C & EN 85 (13) 2008
2 Что такое молекула ?
Даже в конце 19-го века, когда соединения и их формулы давно использовались, некоторые выдающиеся химики сомневались, что молекулы (или атомы) были не просто удобными моделями.Молекулы неожиданно стали реальностью в 1905 году, когда Альберт Эйнштейн показал, что броуновское движение, нерегулярные микроскопические движения крошечных пыльцевых зерен, плавающих в воде, может быть напрямую связано с столкновениями с частицами размером с молекулу.
Большинство людей думают о молекулах как о частицах, которые образуются, когда атомы каким-то образом объединяются. Это передает общую картину, но несколько лучшее определение, которое мы будем использовать на этих уроках, —
Молекула представляет собой совокупность атомов, которая обладает характерными наблюдаемыми свойствами
В более ограничительном определении проводится различие между «истинной» молекулой, которая существует как независимая частица, и расширенным твердым телом , которое может быть представлено только в самой простой формуле.Метан, CH 4 , является примером первого, в то время как хлорид натрия, который не содержит каких-либо отдельных единиц NaCl, является наиболее широко известным расширенным твердым веществом. Но поскольку мы хотим взглянуть на химическое связывание в самом общем виде, мы не будем делать это различие здесь, за исключением нескольких особых случаев. Чтобы подчеркнуть это определение «совокупности атомов», мы будем часто использовать такие термины, как «химические частицы» и «структуры» вместо «молекул» в этом уроке.
Вышеприведенное определение является операционным ; то есть это зависит от нашей способности наблюдать и измерять свойства молекулы.Понятно, что это означает, что молекула должна сохранять свою идентичность в течение периода времени, достаточного для проведения этих наблюдений. Для большинства молекул, представляющих химический интерес, это не представляет трудностей. Но случается так, что некоторые структуры, для которых мы можем написать формулы, такие как He , 294747, имеют такой короткий срок службы, что никаких существенных свойств не наблюдалось. Поэтому в некоторой степени то, что мы считаем молекулой, зависит от технологии, которую мы используем для их наблюдения, и это обязательно изменится со временем.
Структура, структура, структура!
А что это за свойства, которые характеризуют определенный тип молекулы и отличают ее от других? Подобно тому, как недвижимость оценивается как «местоположение, местоположение, местоположение», идентичность химического вида определяется его структурой . В самом фундаментальном смысле структура молекулы определяется идентичностью составляющих ее атомов и последовательностью, в которой они объединены, то есть связывающим соединением .Это, в свою очередь, определяет геометрию связи — пространственную связь между связанными атомами.
Важность связывающего соединения хорошо иллюстрируется структурами двух соединений: , этанола, и , диметилового эфира , оба из которых имеют простейшую формулу , C 2 H 6 О. Структурные формулы , , раскрывают очень разные связи между этими двумя молекулами, физические и химические свойства которых весьма различны:
Структуры без молекул: стабильность и реакционная способность
Точное определение энергии связи описано в другом уроке и здесь не важно.На данный момент вам нужно только знать, что в любой стабильной структуре потенциальная энергия ее атомов ниже, чем у отдельных изолированных атомов. Таким образом, образование метана из его газообразных атомов (реакция, которую нельзя наблюдать в обычных условиях, но энергетика которой известна из косвенных данных)
4 H ( г ) + C ( г ) → CH 4
сопровождается выделением тепла и, таким образом, является экзотермическим процессом .Количество выделяемого тепла связано со стабильностью молекулы. Чем меньше выделяемое количество энергии, тем легче молекула может поглощать тепловую энергию из окружающей среды, что приводит к обратной реакции и приводит к разложению молекулы. Высокостабильная молекула, такая как метан, должна подвергаться температурам более 1000 ° С, чтобы произошло значительное разложение. Но молекула благородного газа KrF 2 настолько слабо связана, что разлагается даже при 0 ° C, а структура He 2 никогда не наблюдалась.Если конкретное расположение атомов слишком нестабильно, чтобы раскрывать его свойства при любой достижимой температуре, тогда его нельзя назвать молекулой.
Существует много молекул, которые достаточно энергетически стабильны, чтобы соответствовать вышеуказанному критерию, но настолько активны, что их времена жизни слишком коротки, чтобы их наблюдение стало возможным. Молекула CH 3 , метил , является хорошим примером: она может быть сформирована электрическим разрядом в газообразном CH 4 , но она настолько реактивна, что объединяется практически с любой молекулой, на которую она попадает (даже с другим CH 3 ) в течение нескольких столкновений.Только после разработки спектроскопических методов (в которых молекула характеризуется длиной волны света, которую она поглощает или испускает), метил был признан стабильной, хотя и бесстыдной беспорядочной молекулой, которая является важным промежуточным звеном во многих химических процессах, начиная от пламени. к химии атмосферы.
3 Как мы изображаем молекулярные структуры
Химические вещества традиционно представлены структурными формулами , такими как формулы для фосфорной кислоты, H 3 PO 4 , которые мы здесь показываем.Линии, конечно, представляют «химические связи» молекулы.
Что еще более важно, структурная формула молекулы определяет ее связность , как было показано в сравнении этанола и диметилового эфира, показанном в предыдущем разделе.
Одним из ограничений таких формул является то, что они нарисованы на двумерной поверхности, тогда как большинство молекул имеют трехмерную форму.
Клинообразные линии в структурной формуле справа являются одним из способов указания того, какие связи проходят над или под плоскостью обзора, обеспечивая вид псевдо-3D вида.Вы, вероятно, будете избавлены от необходимости изучать это соглашение, пока не начнете изучать органическую химию.
Трехмерные модели (реальные пластиковые или изображения, которые включают перспективу и затенение) раскрывают гораздо больше о структуре молекулы. Широко используются представления типа «шарик-и-палка» и заполнение пространства, но у каждого есть свои ограничения, как видно из следующих примеров, в которых сравниваются различные способы изображения структур одних и тех же двух молекул:
Простые структурные формулы в двух измерениях показывают связность молекулы, но не более того.
↑ Эта простая структурная формула метана, CH 4 , проецирует свою трехмерную структуру на двумерную поверхность.
↑ Структурная формула аскорбиновой кислоты (витамин С) обычно усиливается клиновидными связями, чтобы показать, что они простираются над плоскостью бумаги или экрана.
Модели с шариковой ручкой показывают трехмерные виды «химических связей» и их геометрию.хотя с отдельными атомами нереально разделены.
Это изображение правильно выражает тетраэдрическую координацию четырех связей С — Н.
[U. Рочестер]
Аскорбиновая кислота
Модели заполнения пространства не пытаются изобразить связи, но показывают относительные размеры атомов и общую форму молекулы за счет сокрытия некоторых атомов.
Обратите внимание, как это показывает, что CH 4 является примерно сферическим.

