Атомы и молекулы
Атомы — это маленькие частицы, из которых состоит вещество. Невозможно даже представить себе, насколько они малы. Если сложить в цепочку сто миллионов атомов, у нас получится ниточка длиной всего лишь в 1 см. В тонком листе бумаги, наверное, не меньше миллиона слоев атомов. Науке известно более ста видов атомов; соединяясь друг с другом, они образуют все окружающие нас вещества.

 Представление об атомах
Представление об атомах
Мысль о том, что всё в природе состоит из атомов, возникла давно. Еще 2500 лет назад древнегреческие философы полагали, что вещество состоит из таких частиц, которые нельзя разделить. Само слово «атом» восходит к греческому слову «атомос», что значит «неделимый». В Древней Греции (см. статью «Загадочные жители Греции«) философы обсуждали гипотезу о том, что всё вещество в мире состоит из неделимых частиц. Правда, Аристотель в этом сомневался.
 Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.
Термин «атом» был впервые использован английским химиком Джоном Дальтоном (1766- 1844). В 1807 г. Дальтон выдвинул свою атомную теорию. Атомами он назвал составляющие всякое вещество малые частицы, которые не изменяются входе химических реакций. Согласно Дальтону, химическая реакция — это процесс, при котором атомы соединяются вместе или отделяются друг от друга. Атомная теория Дальтона лежит в основе представлений современных ученых.  Структура атома
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Атомный номер и атомная масса
Атомный номер — это число протонов в атомном ядре. Как правило, в состав атома входит одинаковое число протонов и электронов, поэтому по атомному номеру можно судить и о том, сколько в атоме электронов. В разных атомах содержится разное количество протонов. В ядре атома фосфора 15 протонов и 16 нейтронов, значит, его атомный номер 15. В ядре атома золота 79 протонов и 118 нейтронов: следовательно, атомный номер золота 79.
Чем больше протонов и нейтронов имеет атом, тем больше его масса (величина, показывающая количество вещества в составе атома). Сумму числа протонов и числа нейтронов мы называем атомной массой. Атомная масса фосфора — 31. При исчислении атомной массы электроны в расчет не принимаются, так как их масса ничтожно мала по сравнению с массой атома. Существует особый прибор — масс-спектрометр. Он позволяет определить для каждого данного атома его массу.

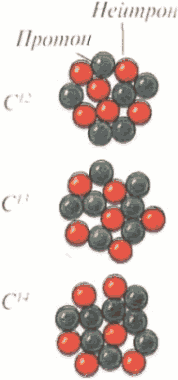
Изотопы
У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12 есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов.
Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количествах.
Молекулы
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры. Молекула — это мельчайшая частица вещества, которая может существовать самостоятельно. Она состоит из атомов, удерживающихся вместе при помощи связей. Например, у молекулы воды два атома водорода связанны с атомом кислорода. Атомы удерживаются вместе благодаря электрическим зарядам частиц, из которых они состоят. Описывая строение молекул, ученые прибегают к помощи
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев. Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол. Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
Что такое молекула?
В первый раз слово «молекула» большинство из нас услышали в школе на уроках природоведения. Это одно из основополагающих понятий современной химии, которое сделало возможным дальнейшее познание окружающей среды.
Что же такое молекула, из чего она состоит и зачем вообще нужно изучать молекулы?
Откуда взялось слово «молекула»?
Из чего состоит молекула?
Чему равна масса молекулы?
Откуда взялось слово «молекула»?
Как и большинство химических терминов, слово «молекула» имеет в основе латынь. Оно образовано из двух слов: «мoles», имеющего значение массы, тяжести и «-cule» — уменьшительного суффикса. Дословное значение – маленькая масса.
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества.
Если молекулу разделить на составные части, вещество, которое она составляла, уничтожится, распавшись на более простые элементы – атомы. На этой основе сформирован весь свод понятий, образующих современную химическую науку и практику.
Из чего состоит молекула?
Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» — атомов химических элементов.
Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: h3O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.
Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода.
Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Чему равна масса молекулы?
Конечно, таких чувствительных весов, которые позволяли бы взвесить одну молекулу вещества, не существует в арсенале современной науки. Масса молекул и атомов вычисляется другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех атомов, из которых состоит это вещество.
Но как узнать, сколько весит атом? Это можно узнать из Периодической таблицы элементов Менделеева, где указана масса каждого элемента. Правда, указана не в привычных нам килограммах, а в специальных единицах атомной массы.
Одна атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, что в численном выражении равно 1,660*10-27 кг.
Т.е. чтобы подсчитать, сколько весит молекула вещества, нужно взять его формулу, сложить атомные массы всех входящих в нее элементов и умножить на вес атомной единицы массы.
Конспект «Атомы, молекулы и ионы»
«Атомы, молекулы и ионы»
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.

Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.

Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу — ион. Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики (читать Конспект «Электронно-ионная теория»)

Конспект урока «Атомы, молекулы и ионы».
Следующая тема: «Простые и сложные вещества».
МОЛЕКУЛА — это… Что такое МОЛЕКУЛА?
молекула — ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС 1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная… … Исторический словарь галлицизмов русского языка
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
МОЛЕКУЛА — (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
молекула — эксимер, генонема, эписома, хромосома, микрочастица, макромолекула Словарь русских синонимов. молекула сущ., кол во синонимов: 10 • биомолекула (1) • … Словарь синонимов
МОЛЕКУЛА — МОЛЕКУЛА, наименьшая частица вещества, обладающая его основными химическими свойствами. Состоит из атомов, расположенных в пространстве в определенном порядке и соединенных химическими связями. Состав и расположение атомов отражены в химической… … Современная энциклопедия
МОЛЕКУЛА — (новолат. molecula уменьшит. от лат. moles масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью… … Большой Энциклопедический словарь
МОЛЕКУЛА — МОЛЕКУЛА, молекулы, жен. (от лат. moles масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛЕКУЛА — МОЛЕКУЛА, ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Молекула — или частица система или группа атомов … Энциклопедия Брокгауза и Ефрона
МОЛЕКУЛА — [франц. molecule от лат. moles масса ] наименьшая частица данного вещества, обладающая его основными хим. свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединенных в одно целое хим. связями … Геологическая энциклопедия
Что такое парфюм Молекула? Чем знамениты духи Molecules?
Парфюм молекула — что это такое?
Отсутствие предела совершенству снова подтверждается, когда заходит речь о парфюмерном бренде Escentric Molecules, созданном знаменитым парфюмером Геза Шоен в 2006 году. Был предпринят совершенно новый подход к созданию духов.
Уникальность модного бренда
Необычайный эффект от аромата этого удивительного парфюма происходит отнюдь не от феромонов, как об этом ошибочно думают. Его уникальность заключается в наличии молекулы Iso E Super. Многие задаются вопросом: парфюм молекула — что это такое? На самом деле этот элемент создан синтетически, он обладает потрясающей способностью воздействовать на трансформацию запаха. Происходит синергетический эффект, когда составляющие парфюма сливаются воедино и рождают новый образ. Оттенки аромата могут изменяться в зависимости от настроения.

Магия Escentric Molecules
Познакомившись с английскими духами Молекула, начинаешь верить в магию. Исходящий аромат действует на окружающих гипнотически. Самая удивительная особенность этих духов в их неповторимости и многогранности. Можно сказать, что они сами себя не повторяют. Ведь оттенок запаха меняется в соответствие с эмоциональным состоянием человека. Парфюм воздействует на сенсоры восприятия, затрагивает участки мозга, отвечающие за мироощущение, интеллект и сексуальность.

То, что происходит, как только духи касаются кожи, поражает и восхищает. Если начать знакомство с ними с помощью блоттера, можно практически не почувствовать запаха. Но стоит нанести их на участок тела, мгновенно появляется изысканный аромат, и вместе с ним происходит всплеск эмоций. Кажется, на клеточном уровне идет процесс приятного раскрепощения, при этом ощущаешь особое блаженство, эстетическое наслаждение и томительную негу.
Кстати, подобное происходит и с теми, кто находится рядом и вдыхает этот аромат. Благодаря поразительному свойству магической формулы, по которой созданы духи, представители противоположного пола испытывают притягательную силу, у них просыпаются эротические чувства.


Парфюм Molecules создан на основе использования инновационных технологий, это результат изысканий настоящих профессионалов-парфюмеров, которые воспроизвели многосоставной компонент Исо Е Супер.
Начиная с 2006 года, владелец парфюмерного бренда Geza Schoen работает над совершенствованием линии Molecule. В 2010 году появляется супер современный парфюм Молекула 03. Для этого поистине эпатажного шедевра мастер использовал индонезийский ветивер (разновидность синтезированной молекулы vetivery leacetate). Аромат полон соблазна и очарования. Духи оставляют приятный шлейф утонченных, изысканных оттенков. Этот парфюм по праву называют афродизиаком.
Очередным хитом коллекции духов «Молекула» стала четвертая по счету линия, включающая в себя как одномолекулярную «Molecule 04», так и традиционно насыщенный «Escentric 04». В качестве соло, здесь выступает молекула сандалового дерева — Яванол (Javanol). Эти парфюмы доступны в нашем магазине. Они так же представлены в виде пробников и отливантов.
Вы можете попробовать ароматы, представленные в этой статье! Для этого приобретайте набор пробников, представленных в разделе “Пробники”. Там представлены сеты:
Набор Molecules Escentric Classic
Набор Все Молекулы
Набор Все Эсцентрики
Объёма как раз достаточно, чтобы оценить всю полноту и качество ароматов.
Обсуждение:Молекула — Википедия
Материал из Википедии — свободной энциклопедии
а может стоит добавить как дошли ло понимания молекул и кто их придумал? а также написать кто их впервые разглядел
- кто ж тебе мешает — напиши. MaxiMaxiMax 15:18, 22 Июн 2004 (UTC)
Словарное определение[править код]
В статье написано, что молекула это частица, состоящая из двух и более атомов, хотя это неверно, ведь существуют одноатомные молекулы у благородных газов. Наиболее верным и распространенным являтся определение, приведенное ниже в тексте статьи:
Молекула — наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
По моему мнению, им и стоит заменить текущее определение.
Не хотелось бы менять определение в статье, без согласия человека это определение сюда написавшего. Fizhimik 23:00, 22 декабря 2008 (UTC)
Определение противоречиво[править код]
Определение противоречиво. По первой его части один атом серебра (к примеру) можно называть молекулой. По второй его части — нельзя. 85.141.46.98 10:27, 29 мая 2009 (UTC)alex
- По-моему, фраза «Молекула состоит из двух или более атомов» откровенно неправильная. Благородные газы образуют одноатомные молекулы. Поэтому определение нужно менять. Ну а металлы сами молекул, как раз, и не образуют — только металлическую кристаллическую решетку. Fizhimik 18:33, 29 мая 2009 (UTC)
Противоречия в определении нет.[править код]
- Фраза «молекула состоит из двух и более атомов» правильная. Если бы молекула состояла только из одного атома, то она называлась бы атомом, а не молекулой.
Благородные (инертные) газы являются одноатомными и не образуют молекул в нормальных условиях. В возбужденном состоянии атомы инертных газов образуют короткоживущие двухатомные молекулы, называемые эксимерами. На этом принципе работают эксимерные лазеры и эксилампы. Ну, а металлы всё-таки образуют молекулы. Так, например, молекула лития (Li2) имеет длину 2,67Å и характеризуется энергией диссоциации 26 ккал/моль.—Golart 17:47, 29 октября 2012 (UTC)
- Просто в химии и в физике понятие разное. Например, когда физик изучает свойства инертного газа, ему неважно, что он состоит из «атомов», для него эти частицы — такие же «молекулы», как у кислорода и т.п. —аимаина хикари 18:43, 29 октября 2012 (UTC)
- Не обязательно инертный газ; например, пары ртути состоят из одноатомных молекул. Сейчас у химиков принято определение ИЮПАК, согласно которому молекула нейтральна и состоит из двух и более атомов. Более раннее «химическое» определение: наименьшая частица, сохраняющая химические свойства вещества. Одноатомные молекулы сюда подпадают. У физиков количество атомов в молекуле неважно, в рамках этого определения ксенон, ртуть и т.п. состоят из молекул. —V1adis1av 10:08, 30 октября 2012 (UTC)
- Некоторые вещества состоят из одной макро-молекулы, поэтому «наименьшая частица, сохраняющая химические свойства вещества» звучит неправильно. Думаю химические свойства вообще нужно убрать из определения, и оставить количественные «2 и более». Alexander Mayorov 11:17, 30 октября 2012 (UTC)
- Alexander Mayorov предлагает оставить в определении только количественные свойства «2 и более». Радикальное предложение.
Но что делать в этом случае с «одноатомными молекулами»? Этот термин широко используется в Гугле и Яндексе. —Golart 16:06, 31 октября 2012 (UTC)
Спор ни о чем — Молекула не состоит из атомов[править код]
- Из квантовой механики известно: Молекула не состоит из атомов! Все химические вещества состоят из атомных ядер и электронов. «С современной точки зрения ясно, что при образовании молекулы сохраняются не атомы, а только ядра атомов и электроны». Смотри Татевский В.М. Квантовая механика и теория строения молекул. МГУ, 1965. стр.17.
- Понятия атома в молекуле из квантовой механики не вытекает, но попыток дать такое определение было много. Наиболее последовательное — Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. При этих подходах пытаются выделить области электронной плотности около атомных ядер и назвать их атомами, что не имеет никакого отношения к стандартному понятию атома.
Baz.77.243.99.32
- Опишите в статье квантовомех. толкование и определение Бейдера. Конечно, всё прочее это упрощения, но они тоже используются и даже не только в школе значительно чаще, чем квантовомеханическое. —аимаина хикари 13:17, 1 ноября 2012 (UTC)
- «Современную точку зрения» Татевский В.М. формулировал по мотивам своего выступления на печально известном Совещании 1951 года, участники которого громили теорию Лайнуса Полинга, будущего дважды лауреата Нобелевской премии (Совещание по теории химического строения в органической химии. Успехи физических наук, 1951, т. XLV, вып. 2, стр. 291).
В настоящее время считается, что деформационная поляризация затрагивает только внешнюю электронную оболочку атома. Определена электронная поляризуемость практически всех элементов таблицы Менделеева (Потапов А.А. Деформационная поляризация: Поиск оптимальных моделей. — Новосибирск: Наука, 2004. — 511 с.). Атомное ядро и внутренние электронные оболочки составляют устойчивый атомный остов в молекуле, размер которого соответствует ионному радиусу по Полингу. Это положение входит составной частью в теорию отталкивания электронных пар Гиллеспи-Найхолма [1]. —Golart 17:33, 4 ноября 2012 (UTC)
- Уважаемый Golart: Все указанные модели хороши в качестве несложных запоминающихся образов для варки веществ. Из квантовой механики — все электроны в молекуле являются общими, и можно лишь использовать для описания редуцированные (одночастичные, двухчастичные, s-частичные) матрицы плотности (статистические операторы), одночастичные электронные плотности (см Местечкин М.М. Метод матрицы плотности в теории молекул. Киев: Наукова думка, 1977). Разделение на внешние и внутренние электроны — от лукавого. Последовательное описание может быть построено лишь с использованием РМП и обобщений методов самосогласованного поля (см Местечкин Параграфы 11 и 12). Все другие модели носят феноменологический характер и не имеют обоснования на фундаменте квантовой механики. Возможно, они важны для практических целей (варки веществ), но это не имеет отношения к квантовой механике молекул. Кроме того, «атомный остов в молекуле» — еще более некорректное понятие, чем атом в молекуле (с точки зрения квантовой теории). Атомного остова не существует. Baz.77.243.99.32
- Квантовая механика позволяет решить аналитически точно уравнение Шрёдингера для систем, содержащих только один электрон — атом водорода, ион гелия, молекулярный ион водорода. Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих более одного электрона, невозможно, возникли различные приближённые теории, взаимно исключающие друг друга.
Апологеты какой-либо приближённой теории чтут свою и хулят другие теории. Консенсус невозможен. Но мы удалились от темы — «Одноатомная молекула». —Golart 16:56, 6 ноября 2012 (UTC)
- Атом и молекула, действительно являются составными частицами, состоящими из элементарных частиц и входят в избранный список Проекта:Физика. [2] Атомно-молекулярное учение утверждает, что при взаимодействии атомов образуется молекула. Может ли образоваться «одноатомная молекула» из одного атома?
PS. Уважаемый Baz.77.243.99.32. Поведение атомов в молекуле интересно, творческое наследие Rihard F.W.Bader по поведению атомов в молекуле важно, но статьи Бейдер,Ричард и Бадер,Ричард целесообразно объединить. —Golart 19:05, 1 ноября 2012 (UTC)
- Словосочетание «одноатомная молекула» представляет собой софизм (словесное ухищрение, вводимое в заблуждение).
Частица, содержащая один атом — это атом, а не молекула. Нельзя пользоваться формально кажущимся правильным, но ложным по существу умозаключением, основанным на преднамеренно неправильном подборе исходных положений. Необходимо делать различие между атомом и молекулой. Википедия — это энциклопедия, а не сборник софизмов. —Golart 16:05, 5 ноября 2012 (UTC)
- Невзирая на обсуждение, участник Burzuchius ввёл в преамбулу фразу — «В физике к молекулам причисляют также одноатомные молекулы, то есть свободные (химически не связанные) атомы (например, инертных газов)». Но где аргументы, позволяющие физикам причислять свободные атомы к молекулам? Зачем физикам нужно смешивать понятия «атом» и «молекула»? —Golart 17:24, 8 ноября 2012 (UTC)
- Физики не смешивают, у них просто другое понятие молекулы. А Википедия не вправе решать кто здесь более прав, а только должна описывать оба понятия. —аимаина хикари 18:51, 8 ноября 2012 (UTC)
- Первоначально преамбула содержала определение молекулы в рамках ИЮПАК. Участник Burzuchius дополнил преамбулу, отметив, что в физике к молекулам причисляют и свободные атомы, без ссылки на АИ. Расширение понятия молекулы и причисление к молекулам и атомов является оригинальным исследованием и подлежит удалению. —Golart 17:18, 9 ноября 2012 (UTC)
- Вот куча ссылок на употребление в АИ понятия «одноатомная молекула» / «monoatomic molecule» / «single-atom molecule». —V1adis1av 22:30, 13 ноября 2012 (UTC)
- Так всё-таки какое конкретное понятие молекулы имеется у физиков? Нужно выполнить предложение Аимаина хикари и дать физическое толкование термина молекула, а также обосновать, почему молекула может быть атомом. —Golart 17:27, 16 ноября 2012 (UTC)
- На физиков грешат напрасно. Физики солидарны с химиками и считают, что «молекула состоит из двух и более атомов». См. Список частиц. Убираю утверждение участника Burzuchius как орисс. —Golart 16:43, 21 ноября 2012 (UTC)
- Википедия не является АИ, так что ссылка на статью Список частиц не подтверждает Ваше мнение. Я дал выше ссылку на употребление в АИ понятия «одноатомная молекула» / «monoatomic molecule» / «single-atom molecule». Отменяю Вашу правку, поскольку Википедия должна отражать все имеющиеся и широко распространённые толкования терминов. —V1adis1av 18:52, 29 ноября 2012 (UTC)
- Уважаемый V1adis1av, Вы в своей ссылке приводите лишь перечень по употреблению понятия «одноатомная молекула», но, к сожалению, не даёте нужного Википедии толкования этого термина. —Golart 16:06, 3 декабря 2012 (UTC)
- Кроме того, Ваша куча ссылок не является АИ, нужен конкретный источник (См.Википедия:Форум/Вопросы) —Golart 18:40, 4 декабря 2012 (UTC)
Ни одной фотографии в статье, серьёзно? В английской Вики их несколько, и даже в литературе 15-летней давности были приведены фотографии молекул, которых увидели через сканирующий микроскоп. Надо бы добавить. 91.224.77.194 09:42, 27 сентября 2019 (UTC)
Молекулярная физика — Википедия
Материал из Википедии — свободной энциклопедии
Молекулярная физика — раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения. Задачи молекулярной физики решаются методами статистической механики, термодинамики и физической кинетики, они связаны с изучением движения и взаимодействия частиц (атомов, молекул, ионов), составляющих физические тела.
Первым сформировавшимся разделом молекулярной физики была кинетическая теория газов. В процессе её развития работами Джеймса Клерка Максвелла, Людвига Больцмана , Дж. У. Гиббса была создана классическая статистическая физика.
Количественные представления о взаимодействии молекул (молекулярных силах) начали развиваться в теории капиллярных явлений. Классические работы в этой области Алекси Клод Клеро (1743), Пьера-Симона Лапласа (1806), Томаса Юнга (1805), С. Д. Пуассона , Карла Фридриха Гаусса (1830—1831) и других положили начало теории поверхностных явлений. Межмолекулярные взаимодействия были учтены Й. Д. Ван-дер-Ваальсом (1873) при объяснении физических свойств реальных газов и жидкостей.
В начале XX века молекулярная физика вступила в новый этап развития. В работах Жана Батиста Перрена и Теодора Сведберга (1906), Мариан Смолуховского и Альберта Эйнштейна (1904—06), посвященных броуновскому движению микрочастиц, были получены доказательства реальности существования молекул.
Методами рентгеновского структурного анализа (а впоследствии методами электронографии и нейтронографии) были изучены структура твёрдых тел и жидкостей и её изменения при фазовых переходах и изменении температуры, давления и других характеристик. Учение о межатомных взаимодействиях на основе представлений квантовой механики получило развитие в работах Макса Борна, Фрица Лондона и Вальера Гайтлера, а также Петера Дебая. Теория переходов из одного агрегатного состояния в другое, намеченная Ван-дер-Ваальсом и Уильямом Томсоном и развитая в работах Гиббса (конец XIX века), Льва Давидовича Ландау и Макса Фольмера (1930-е) и их последователей, превратилась в современную теорию образования фазы — важный самостоятельный раздел физики. Объединение статистических методов с современными представлениями о структуре вещества в работах Якова Ильича Френкеля, Генри Эйринга (1935—1936), Джона Десмонда Бернала и других привело к молекулярной физике жидких и твёрдых тел.
Круг вопросов, охватываемых молекулярной физикой, очень широк. В ней рассматриваются: строение вещества и его изменение под влиянием внешних факторов (давления, температуры, электромагнитного поля), явления переноса (диффузия, теплопроводность, вязкость), фазовое равновесие и процессы фазовых переходов (кристаллизация, плавление, испарение, конденсация), критическое состояние вещества, поверхностные явления на границах раздела фаз.
Развитие молекулярной физики привело к выделению из неё самостоятельных разделов: статистической физики, физической кинетики, физики твёрдого тела, физической химии, молекулярной биологии. На основе общих теоретических представлений молекулярной физики получили развитие физика металлов, физика полимеров, физика плазмы, кристаллофизика, физико-химия дисперсных систем и поверхностных явлений, теория массопереноса и теплопереноса, физико-химическая механика. При всём различии объектов и методов исследования здесь сохраняется, однако, главная идея: молекулярная физика — описание макроскопических свойств вещества на основе микроскопической (молекулярной) картины его строения.
- Ахматов А. С. Молекулярная физика граничного трения. М.: ФМЛ, 1963. — 472с.
- Гиршфельдер Дж., Кертисс Ч., Берд Р. Молекулярная теория газов и жидкостей. М.: ИЛ, 1961. — 931с.
- Дерягин Б. В., Чураев Н. В., Муллер В. М. Поверхностные силы. (недоступная ссылка) М.: Наука, 1985.
- Квасников И. А. Молекулярная физика. М.: Едиториал УРСС, 2011. — 230с. ISBN 978-5-8360-0560-3
- Кикоин А. К., Кикоин И. К. Молекулярная физика. 2-е изд. М.: Наука, 1976.
- Матвеев А. Н. Молекулярная физика. М.: Высшая школа, 1981. — 400 с.
- Оно С. Кондо С. Молекулярная теория поверхностного натяжения в жидкостях. Пер. с англ. М.: ИИЛ, 1963. — 292с.
- Радченко И. В. Молекулярная физика. — М.: Наука, 1965 −480c.
- Резибуа П., Де Ленер М. Классическая кинетическая теория жидкостей и газов. Пер. с англ. М.: Мир, 1980.
- Телеснин Р. В. Молекулярная физика. 2-е изд. М.: Высшая школа, 1973.
- Фишер И. З. Статистическая теория жидкостей. Наука, 1961. — 280с.
- Френкель Я. И. Кинетическая теория жидкостей. М.: Наука, 1975. — 592с.



 Структура атома
Структура атома