§ 20. Вода —
§ 20. Вода — 1. Какое строение имеет молекула воды? За счёт какой химической связи она образуется? Какие другие типы химических связей вы знаете?
2. Какая связь называется водородной? Как она определяет физические свойства воды?

3. Какие аномалии физических свойств воды вы знаете? Какую роль они играют в природе?

4. Растворение называют физико-химическим процессом. Как растворимость характеризует свойства воды? Как по этому признаку делятся вещества? Для ответа на вопрос обратитесь к таблице растворимости.

5. Какие вещества называются гидрофильными, а какие — гидрофобными? Приведите примеры.

6. Перечислите химические свойства воды, иллюстрируя их уравнениями соответствующих реакций. Какую роль играют эти свойства в природе?

7. В 80 мл воды растворили 80 г медного купороса CuSO4 * 5Н2O. Какой стала массовая доля сульфата меди (II) в полученном растворе?

8. Для наложения гипсовой повязки хирург использовал 290 г алебастра. Какое количество вещества воды было израсходовано в результате превращения алебастра в гипс? Какова масса гипса?

Молекулярное и немолекулярное строение | Дистанционные уроки
16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.

Темы, которые нужно знать:
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток

- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.
Характерна для B, Si, Ge, силициды
- Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J2, S2, твердый CO2 («сухой лед»), твердые органические вещества (кроме солей) и т.д.

- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть основное отличие — вещества с металлической решеткой проводят электрический ток и пластичны.
Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
Еще на эту тему:
Обсуждение: «Молекулярное и немолекулярное строение»
(Правила комментирования)Строение молекулы воды | Химия. Шпаргалка, шпора, формула, закон, презентация, ГДЗ, конспект, опыты, тесты, сообщение, реферат, кратко
Молекула воды имеет угловое строение: входящие в её состав ядра образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а в вершине — атом кислорода. Межъядерное расстояние O—H близко к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями H—O—H равен 104,5°. Из октетной оболочки атома кислорода в молекуле воды четыре электрона задействованы в образовании ковалентных связей O—H, остальные составляют неподелённые электронные пары:
H:Ö̤:H
Связи O—H являются полярными за счёт более высокой электроотрицательности кислорода, на котором локализован частичный отрицательный заряд. На атомах водорода, напротив, создаётся дефицит электронной плотности:
В целом молекула H2O является полярной молекулой, т. е. диполем. Относительная молекулярная масса воды равна 18 и отвечает её простейшей формуле. Однако молекулярная масса жидкой воды, определяемая в обычных условиях, оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт
В физике и химии существуют различные точки зрения на водородную связь.
В физике ионную, ковалентную и металлическую химические связи рассматривают как отдельные типы связей, тогда как о водородной связи как об отдельном типе связи и речи не идёт. Она рассматривается как частный случай межмолекулярного взаимодействия. Её энергия сравнительно невелика и составляет 4—40 кДж/моль, т. е. эта связь вписывается в энергетическую характеристику межмолекулярных сил.
В химии водородная связь — это не просто отдельный тип связи, а важнейший фактор в организации живой материи на планете. С химиками солидарны и биологи. Материал с сайта http://doklad-referat.ru
Межмолекулярная водородная связь — это взаимодействие между атомами водорода одной молекулы и атомами фтора, кислорода и азота другой молекулы. Обязательным партнёром в образовании этой связи служит водород, что легко объяснить особенностями строения атомов данного химического элемента (наличие на внешнем, и единственном, уровне единственного электрона, который легко отрывается, превращая атом в протон). Партнёры водорода по этому типу связи — фтор, кислород и азот — также имеют особенности строения атомов (большое значение электроотрицательности и наличие неподелённых электронных пар), которые её и обеспечивают.
Особенности строения воды химия
Какое строение молекулы воды кратко
Назовите особенности строения молекул воды из химий
Какое строение имеет молекула воды
Опишите строение молекулы воды и назовите химическую связь за счет которой
Какое строение у молекулы воды?
Назовите химическую связь, за счёт которой образуется молекулы воды.
Какая связь считается водородной?
Молекулярное строение вещества :: SYL.ru
Довольно длительное время ученые создавали теории и модели, которые бы помогали объяснить основные свойства веществ и материй, из которых состоит окружающий мир.
В ходе истории было проведено множество опытов, экспериментов; были открыты новые законы и физико-химические свойства материалов. Во многом это происходило благодаря открытию понятий «молекула» и «атомно-молекулярное строение вещества». Поговорим о них подробнее в данной статье.
Появление понятия «атомно-молекулярное строение вещества»
Еще во времена Древней Греции появилась мысль о том, что всё на свете состоит из мельчайших частей. Эти частицы греки называли молекулами и атомами. Автором данной гипотезы был Демокрит, который впоследствии стал родоначальником атомистической теории. Но эти знания в те времена особо не развивались вплоть до 17 столетия. Все исследования материалов снова приводили к тому, что многие вещества состоят из молекул, структурной единицей которых являются атомы.
Позднее ученые стали приходить к выводам, что один тип минерала состоит, например, из железа на 38 % и из кислорода на 62 %, и каждый из образцов покажет такой химический состав. А вот если взять другое тело, с отличными свойствами, то анализ атомно-молекулярного строения вещества покажет, что оно состоит на 60 % из железа и на 40 % из кислорода.
Таким образом, несмотря на то что определенной концепции всё же не было, в ходе исследований начала появляться теория о том, что каждое вещество является разным набором молекул и атомов, которые определяют его основные свойства.
Развитие понятия «молекулярное строение вещества»
 Впервые термин «молекула» был введен в 1811 году итальянским физико-химиком Амадео Авогадро. Именно он стал зачинателем теории атомно-молекулярного строения.
Впервые термин «молекула» был введен в 1811 году итальянским физико-химиком Амадео Авогадро. Именно он стал зачинателем теории атомно-молекулярного строения.Подтверждения этой теории появились только в 1860-е годы, когда русский химик Бутлеров А. М. сформировал и сумел объяснить молекулярную теорию строения вещества. В соответствии с его работами свойства любого вещества определяются тем, как связаны между собой атомы в молекулах, их взаимодействием. Ученый выдвинул гипотезу относительно того, что молекула – это микрочастица материала, состоящая из атомов, которая способна существовать самостоятельно.
Закрепилось понятие молекулы благодаря трудам еще одного русского ученого. Речь идет о М. В. Ломоносове.
В развитии атомистического учения участвовало множество ученых со всего мира: Дж. Максвелл, Л. Больцман, Дж. Гиббс, Р. Клаузиус, Дж. Дальтон, Д. И. Менделеев, В. Рентген, А. Беккерель, Дж. Томсон, М. Планк и многие другие. Вклад этих людей в молекулярную физику и химию бесценен.
Суть молекулярной теории строения вещества
 На основании комплекса учений за долгие годы была выведена молекулярная теория строения вещества. Существует несколько основных положений этой теории, а именно три базовых утверждения, которые были доказаны неоднократно путем проведения лабораторных исследований:
На основании комплекса учений за долгие годы была выведена молекулярная теория строения вещества. Существует несколько основных положений этой теории, а именно три базовых утверждения, которые были доказаны неоднократно путем проведения лабораторных исследований:- Любое тело состоит из самых мелких частиц – молекул и атомов, которые также состоят из более мелких элементов. Структура всех веществ прерывиста.
- Атомы и молекулы находятся в непрестанном движении хаотической природы.
- Все вещества взаимодействуют между собой на основании электромагнитных сил притяжения и отталкивания.
Обоснование тез молекулярно-кинетической теории
Первым подтверждением положений теории является броуновское движение, что было открыто в 1827 году известным ботаником Р. Броуном. Причина такого явления – хаотический ход молекул в разных направлениях, который происходит вследствие ударов их между собой.
Вторым подтверждением этой теории будут бессчётные опыты с процессом диффузии, то есть способности одного вещества проникать во второе. Ярким примером такого опыта из повседневной жизни являются духи или любое ароматное вещество. Если в помещении поместить такое вещество, через некоторый период аромат рассеется по всей его площади.
Атом и молекула
Сегодня эти термины уже обоснованы и выведены точно и аргументированно. Простым языком, атом – это химически неделимая частица любого вещества или материала, составляющая молекулы. А молекула – это также мельчайшая частичка чего-либо, но важно то, что именно она задает основные свойства тела. Молекулярное строение вещества является каркасом определенного материала, в соединениях которого находятся молекулы.
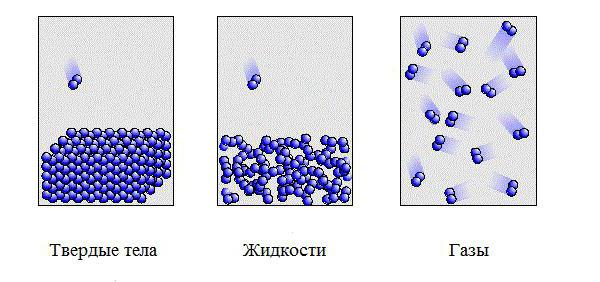
Если для материала характерна молекулярная кристаллическая решетка, то он, как правило, обладает невысокой твердостью, его легко расплавить; такое вещество будет летучим или растворимым в воде, электричество не проводит.
Наука, изучающая силу взаимодействия этих частиц и молекулярное строение тел, называется молекулярной физикой. Тут исследуются многообразные свойства тел в разных агрегатных состояниях.
Какие вещества имеют молекулярное строение?
Молекулярная связь, как правило, слабая и преобладает в органических веществах. Молекулярное строение имеют многие известные нам вещества. Например, вода (Н2О), водород (Н2), хлор (Cl2), углекислый газ (СО2), кислород (О2), этанол, или спирт этиловый (С2Н5ОН), органические полимеры и многие другие.
Другими словами, вещества, имеющие молекулярное строение, — это в основном газы. В них молекулы находятся далеко друг от друга и взаимодействуют слабо. Тесная связь между частницами того или иного вещества образует твердые тела. Единственная жидкость, которая имеет молекулярное строение, – это Br2. Это вещество обладает высокой летучестью.
К неметаллам с молекулярным строением относятся такие твердые вещества, как I2, P4, S8. Эти материалы легкоплавки и могут сублимироваться.
Молекулярное строение имеет… Какое вещество имеет молекулярное строение
Как известно, химия изучает строение и свойства веществ, а также их взаимные превращения. Важное место в характеристике химических соединений занимает вопрос о том, из каких именно частиц они состоят. Это могут быть атомы, ионы или молекулы. В твердых телах они входят в узлы кристаллических решеток. Молекулярное строение имеет сравнительно небольшое количество соединений, находящихся в твердом, жидком и газообразном состоянии.
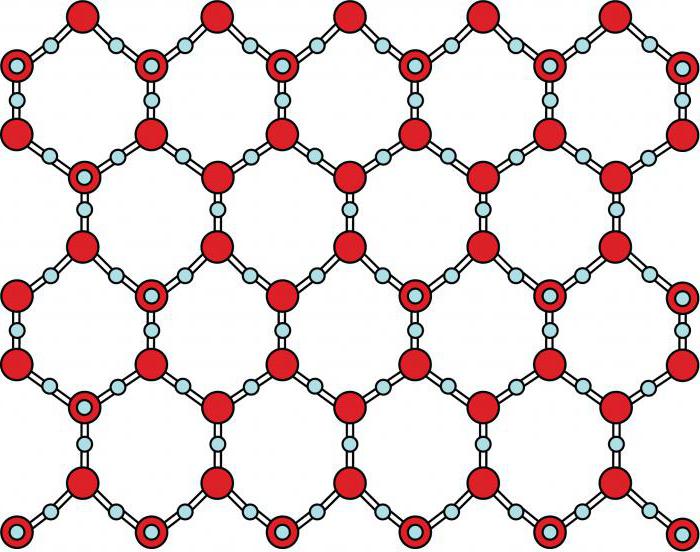
В нашей статье мы приведем примеры веществ, для которых характерны молекулярные кристаллические решетки, а также рассмотрим несколько видов межмолекулярного взаимодействия, характерных для твердых тел, жидкостей и газов.
Почему нужно знать строение химических соединений
В каждой отрасли человеческого знания можно выделить группу фундаментальных законов, на которых основывается дальнейшее развитие науки. В химии – это теория М.В. Ломоносова и Дж. Дальтона, объясняющая атомно-молекулярное строение вещества. Как установили ученые, зная внутреннюю структуру, можно спрогнозировать как физические, так и химические свойства соединения. Всё огромное количество искусственно синтезированных человеком органических веществ (пластмассы, лекарственные препараты, пестициды и т.д.) имеют заранее предусмотренные характеристики и свойства, наиболее ценные для его промышленных и хозяйственно-бытовых нужд.

Знания об особенностях строения и свойств соединений востребованы при проведении контрольных срезов, тестов и экзаменов в курсе химии. Например, в предлагаемом перечне веществ найти правильные варианты ответов: какое вещество имеет молекулярное строение?
Правильным ответом будет: цинк имеет молекулярное строение, а также нафталин.
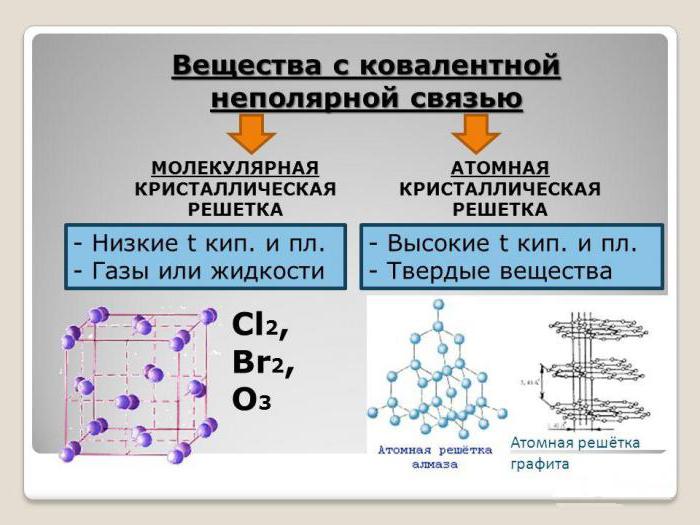
Силы межмолекулярного взаимодействия
Экспериментально установлено, что молекулярное строение характерно для веществ с низкими температурами плавления и малой твердостью. Чем же можно объяснить непрочность кристаллических решеток этих соединений? Как оказалось, все зависит от силы совместного влияния частиц, находящихся в их узлах. Она имеет электрическую природу и называется межмолекулярным взаимодействием или ван-дер-ваальсовыми силами, в основе которых лежит влияние друг на друга противоположно заряженных молекул – диполей. Оказалось, что существует несколько механизмов их образования, зависящих от природы самого вещества.
Кислоты как соединения молекулярного состава
Растворы большинства кислот, как органических, так и неорганических, содержат полярные частицы, которые ориентируются друг относительно друга противоположно заряженными полюсами. Например, в растворе хлоридной кислоты HCI присутствуют диполи, между которыми возникает ориентационные взаимодействия. С повышением температуры у молекул соляной, бромоводородной (HBr) и других галогенсодержащих кислот наблюдается уменьшение ориентационного эффекта, так как тепловое движение частиц мешает их взаимному притяжению. Кроме выше перечисленных веществ, молекулярное строение имеет сахароза, нафталин, этанол и другие органические соединения.
Как возникают индуцированные заряженные частицы
Ранее мы рассмотрели один из механизмов действия сил Ван-дер-Ваальса, называемый ориентационным взаимодействием. Кроме органических веществ и галогенсодержащих кислот, молекулярное строение имеет оксид водорода – вода. У веществ, состоящих из неполярных, но склонных к образованию диполей, молекул, таких как углекислый газ CO2, можно наблюдать возникновение наведенных заряженных частиц – диполей. Их важнейшее свойство – это способность притягиваться друг к другу, благодаря появлению сил электростатического притяжения.
Молекулярное строение газа
В предыдущем подзаголовке мы упомянули такое соединение, как диоксид углерода. Каждый его атом создает вокруг себя электрическое поле, которое наводит поляризацию на атом рядом расположенной молекулы углекислого газа. Она видоизменяется в диполь, который, в свою очередь, становится способной к поляризации других частиц CO2. В итоге молекулы притягиваются друг к другу. Индукционное взаимодействие можно наблюдать и у веществ, состоящих из полярных частиц, правда, в этом случае оно значительно слабее, чем ориентационные ван-дер-ваальсовые силы.

Дисперсионное взаимодействие
Как сами атомы, так и частицы, входящие в их состав (ядра, электроны), способны к непрерывному вращательному и колебательному движению. Оно приводит к появлению диполей. Согласно исследованиям квантовой механики, возникновение мгновенных двузарядных частиц происходит и в твердых телах, и в жидкостях синхронно, таким образом, что концы молекул, расположенных рядом, оказываются с противоположными полюсами. Это приводит к их электростатическому притяжению, получившему название дисперсионного взаимодействия. Оно свойственно всем веществам, кроме тех, которые находятся в газообразном состоянии, и чьи молекулы одноатомны. Однако, ван-дер-ваальсовые силы могут возникать, например, при переходе инертных газов (гелия, неона) в жидкую фазу при низких температурах. Таким образом, молекулярное строение тел или жидкостей обуславливает их способность к формированию различных видов межмолекулярного взаимодействия: ориентационного, индуцированного или дисперсионного.
Что такое сублимация
Молекулярное строение твердого тела, например, кристаллов йода, обуславливает такое интересное физическое явление, как возгонка – улетучивание молекул I2 в виде фиолетовых паров. Оно происходит с поверхности вещества, находящегося в твердой фазе, минуя жидкое состояние.
Этот визуально эффектный опыт часто проводят в школьных кабинетах химии, чтобы проиллюстрировать особенности строения молекулярных кристаллических решеток и связанных с ними свойств соединений. Обычно это невысокая твердость, низкие температуры плавления и кипения, плохая тепло- и электропроводность, летучесть.
Практическое использование знаний о строении веществ
Как мы убедились, между типом кристаллической решетки, строением и свойствами соединения можно установить определенную корреляцию. Поэтому, если известны характеристики вещества, то достаточно легко спрогнозировать особенности его строения и состава частиц: атомов, молекул или ионов. Полученная информация также может пригодиться, если в заданиях по химии нужно из определенной группы соединений правильно выбрать вещества, имеющие молекулярное строение, исключив те, у которых присутствуют атомные или ионные типы решеток.
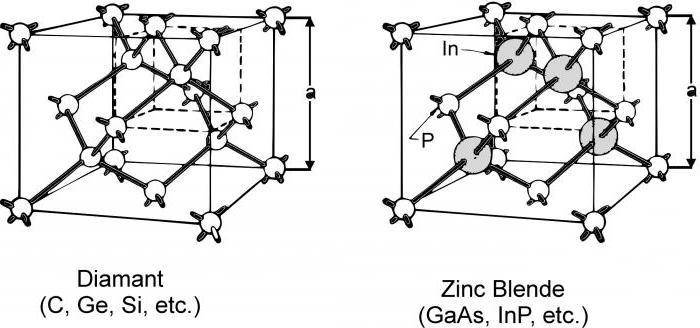
Подводя итог, можно сделать следующий вывод: молекулярное строение имеет твердое тело, и его пространственное строение кристаллических решеток, а особенности расположения поляризованных частиц в жидкостях и газах полностью отвечают за его физические и химические свойства. В теоретическом плане свойства соединений, содержащих диполи, зависят от величины сил межмолекулярного взаимодействия. Чем выше полярность молекул и меньше радиус атомов, входящих в их состав, тем сильнее ориентационные силы, возникающие между ними. Наоборот, чем больше атомы, составляющие молекулу, тем выше ее дипольный момент, а, значит, более значительны дисперсионные силы. Таким образом, молекулярное строение твердого тела влияет еще и на силы взаимодействия между его частицами – диполями.
Вещества молекулярного и немолекулярного строения
1. Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам?
Вещества с молекулярным строением: кислород, азот, йод, вода, спирт, уксусная кислота, сахар, сера…
Молекулярное строение обеспечивает низкие температуры плавления и кипения. Часто такие вещества находятся в газообразном или жидком агрегатном состоянии. Это связано с тем, что молекулы удерживаются рядом друг с другом водородными связями и/или слабыми Ван-дер-Ваальсовыми силами.
Вещества с немолекулярным (атомным, ионным) строением: алмаз, графит, поваренная соль, кварц…
В таких веществах взаимодействие между частицами (атомами, ионами) гораздо сильнее. Поэтому, как правило, они имеют высокие температуры плавления и кипения, нелетучи, находятся в твердом агрегатном состоянии.
2. Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное.
Признаки молекулярного строения: низкие температуры плавления и кипения, газообразное или жидкое состояние. Иногда имеют запах.
Признаки немолекулярного строения: высокие температуры плавления и кипения, твердое агрегатное состояние.
3. Какие типы кристаллических решеток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решетки. Составьте схему «Типы кристаллических решеток».
| Кристаллические решетки | ||
| Атомные | Ионные | Молекулярные |
| Алмаз, графит, сажа. | Большинство неорганических солей. Например, поваренная соль. | Йод, сахар, лед (вода). |
4. Углекислый газ при нормальном давлении переходит в твердое состояние при температуре около -70° C, а речной песок (кремнезём) плавится при температуре около 1 700° C. Какие выводы о строении этих веществ в твердом состоянии можно сделать.
Можно спокойно сделать вывод о том, что в твердом агрегатном состоянии углекислый газ имеет молекулярную кристаллическую решетку, а кремнезём — атомную или ионную. См. ответ на вопрос №2.
Тестовые задания
1. Для углекислого газа характерна кристаллическая решетка:
1) молекулярная
2) атомная
3) ионная
Ответ: 1) молекулярная. См. вопрос №4.
2. Установите соответствие между типом кристаллической решетки вещества и его свойствами.
1) молекулярная
2) ионная
3) атомная
А. твёрдое, тугоплавкое, не растворяется в воде
Б. хрупкое, легкоплавкое, не проводит электрический ток
В. твёрдое, тугоплавкое, хорошо растворяется в воде
Ответы: 1) — Б, 2) — В, 3) — А.
Молекулярные и немолекулярные вещества — урок. Химия, 8–9 класс.
Существуют вещества с молекулярным и немолекулярным строением.
Между молекулами возникают силы взаимного притяжения и отталкивания. Наиболее выражены эти силы в твёрдых веществах, а наименее — в газах.
Силы взаимодействия между молекулами слабые, поэтому молекулярные вещества летучи, имеют низкие температуры плавления и кипения. Все газообразные и жидкие при обычных условиях вещества состоят из молекул. Молекулярные вещества могут быть и твёрдыми, но узнать их можно по легкоплавкости.
Обрати внимание!
Газы, жидкости и легкоплавкие твёрдые вещества имеют молекулярное строение.
Все вещества, имеющие запах, имеют молекулярное строение.
Атомы могут соединяться друг с другом и другим способом. Так, в кристаллах алмаза, графита, песка все атомы соединены в единое целое, и молекулу выделить в них невозможно.

Строение алмаза
Подобное строение имеют железо, медь, цинк, алюминий и другие металлы.
В некоторых сложных веществах атомы превращаются в заряженные частицы — ионы — и тоже молекул не образуют. Противоположно заряженные ионы притягиваются друг к другу и образуют твёрдое тугоплавкое вещество. Такое строение имеют поваренная соль, мел, питьевая сода, медный купорос, щёлочь.
Строение поваренной соли
Такие вещества называют немолекулярными. В их кристаллах связи между частицами прочные, поэтому все немолекулярные вещества твёрдые, нелетучие, тугоплавкие.




