Лекция 3. Вода, её химические и физические свойства.
14
Введение.
Прошлая лекция закончилась рассказом о минералах, созданных со специальными свойствами для различных нужд людей, животных и растений. Особенно ярко целенаправленными представляются минералы глин. Они служат для удержания воды для растений в почве, как строительный материал человеку для получения кирпича и керамики, обеспечивают устойчивость сводов в норах животных, применяются для грязелечения. Однако глины в своей полезности далеко уступают другому минералу, который называется вода. Экологическое служение его много разнообразнее.
Вода и связанные с ней единством химического
состава минералы лёд и пар обладают совершенно уникальными
свойствами. Заметим, что лёд и пар суть
другие минералы. Минералом в геологии
называется однородное физическое тело
постоянного химического состава с
постоянными ему присущими физическими
свойствами. Люди выделили и назвали
минералы задолго до появления химии.
Они для практических и ритуальных целей
выделили минералы по сочетанию признаков
и свойств: цвету, блеску, степени
прозрачности, твердости, ковкости и
другим. Только тысячелетия спустя было
установлено, что каждый минерал кроме
постоянства признаков и свойств обладает
постоянством химического состава. По
свойствам и признакам три минерала
пар, вода и лёд различны. Потому это три
минерала. Будем говорить преимущественно
о воде. Свойства воды и ее назначение
столь многообразны, что не только в
одной лекции, но и в нескольких лекциях
их нельзя полностью осветить. Тем более,
что они еще не достаточно раскрыты
наукой.
Люди выделили и назвали
минералы задолго до появления химии.
Они для практических и ритуальных целей
выделили минералы по сочетанию признаков
и свойств: цвету, блеску, степени
прозрачности, твердости, ковкости и
другим. Только тысячелетия спустя было
установлено, что каждый минерал кроме
постоянства признаков и свойств обладает
постоянством химического состава. По
свойствам и признакам три минерала
пар, вода и лёд различны. Потому это три
минерала. Будем говорить преимущественно
о воде. Свойства воды и ее назначение
столь многообразны, что не только в
одной лекции, но и в нескольких лекциях
их нельзя полностью осветить. Тем более,
что они еще не достаточно раскрыты
наукой.
Вода обязательно применяется в некоторых таинствах Православной Церкви, в воде Иордана крестил Иоанн Предтеча. Она была освящена погружением Иисуса Христа в Иордан. И ранее в ветхозаветной церкви вода применялась для ритуальных омовений.
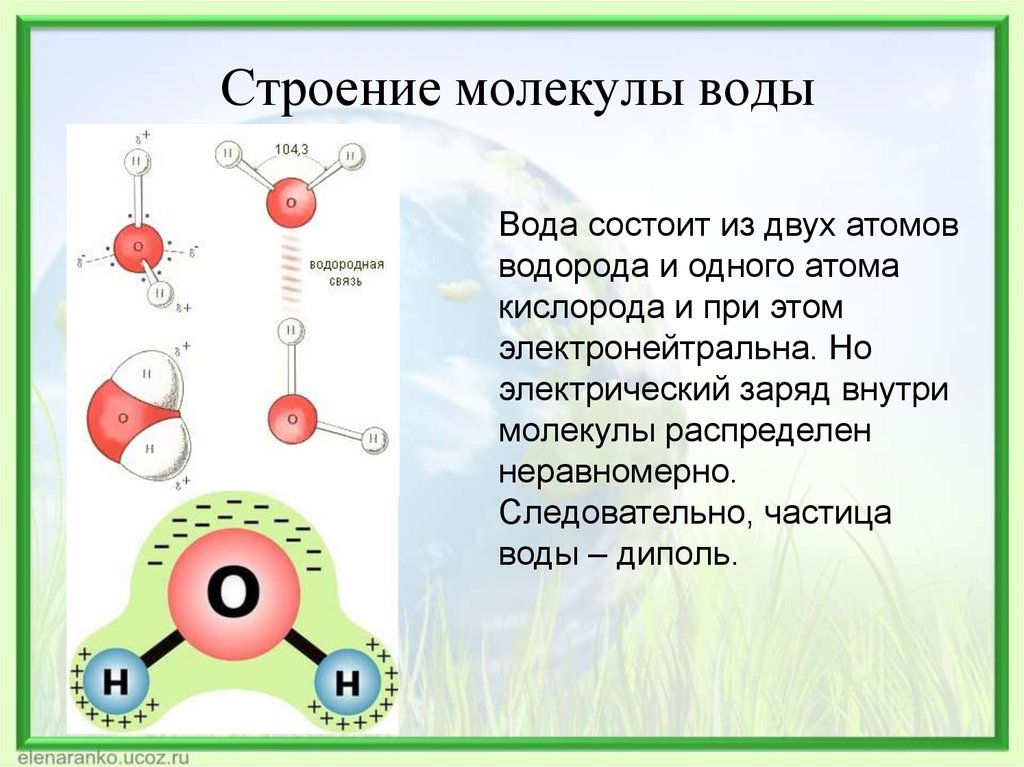
В молекуле воды
химически связаны два атома водорода
с одним атомом кислорода.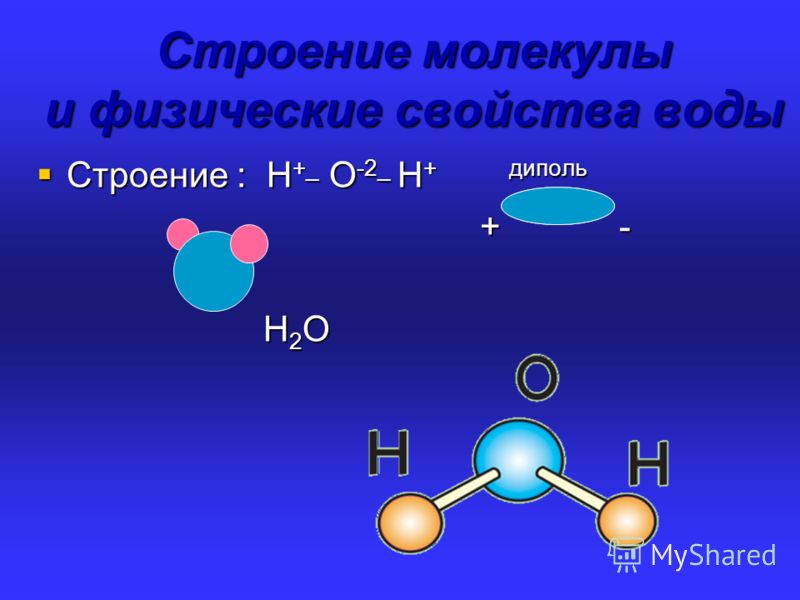 Её химическая
формула Н2О.
Расположение ядер атомов таково, что
ни образуют равнобедренный треугольник
с углом 104о 27’ при вершине (рис. 3-1).
Её химическая
формула Н2О.
Расположение ядер атомов таково, что
ни образуют равнобедренный треугольник
с углом 104о 27’ при вершине (рис. 3-1).
Рис. 3-1. Строение молекулы воды. 1 – ядра атомов кислорода и водорода; 2 – орбиты пар электронов, вращающихся вокруг ядер.
Вокруг них вращаются
5 пар электронов. Одна из этих пар
вращается вокруг ядра кислорода. Она
показана на рисунке небольшим кружком,
охватывающим нижнюю жирную точку. Две
пары охватывают и связывают ядро
кислорода О с двумя ядрами водорода H.
Их орбиты показаны двумя большими
эллипсами. Ещё две пары электронов
вращаются по двум эллиптическим орбитам
у ядра кислорода. Последние две пары
создают слабые отрицательные заряды в
нижней части фигуры молекулы. В верхней
части её, напротив, имеются слабые
положительные заряды, созданные не
полностью компенсированными положительными
зарядами ядер водорода. Таким образом,
у молекулы воды имеются 4 вершины, из
которых две имеют положительный заряд
и две имеют отрицательный.
Рис 3-2.Модель молекулы воды в вида тетраэдра. Четырёх полюса зарядов на молекулы расположены в вершинах тетраэдра.
8 класс. Химия. Вода и ее свойства — Вода и ее свойства
Комментарии преподавателяВода в природе
Вода – самое распространенное вещество на Земле. Поверхность земного шара на 3/4 покрыта водой, в довольно больших количествах вода находится в атмосфере, а также в земной коре. Основное количество воды содержится в океанах (около 97,6%), запасы же пресной воды достаточно ограничены. Около 85% всех запасов пресной воды сосредоточено в ледниках.
Поверхность земного шара на 3/4 покрыта водой, в довольно больших количествах вода находится в атмосфере, а также в земной коре. Основное количество воды содержится в океанах (около 97,6%), запасы же пресной воды достаточно ограничены. Около 85% всех запасов пресной воды сосредоточено в ледниках.
Вода – единственное вещество, которое встречается на Земле в трех агрегатных состояниях: твердом (лед), жидком и газообразном (водяной пар).
Состав молекулы воды вам хорошо знаком: на два атома водорода в молекуле воды приходится один атом кислорода, е химическая формула – Н2О. Такой состав был установлен еще А.Л. Лавуазье и подтверждается результатами эксперимента по разложению воды, когда на 1 объем выделяющегося кислорода приходится два объема выделяющегося водорода.
Вы уже знакомы с некоторыми химическими свойствами воды. При пропускании через воду электрического тока (или при нагревании до 2000˚С) вода разлагается на водород и кислород. Вода может вступать в реакцию соединения со многими оксидами.
Пример такой реакции вам хорошо знаком. Так называемое «гашение извести» — взаимодействие оксида кальция с водой. В результате этой реакции образуется гашеная известь – гидроксид кальция. Эта реакция является экзотермической, т.е. протекает с выделением тепла.
СаО + Н2О = Са(ОН)2 + Q
Вода способна вступать в реакции замещения с активными металлами. Например, кальций взаимодействует с водой с образованием гидроксида кальция и водорода.
Са + 2Н2О = Са(ОН)2 + Н2↑ + Q
В результате этой реакции выделяется большое количество теплоты.
Вода из природных источников не всегда пригодна для питья и даже промышленных процессов. Поэтому ее подвергают очистке. Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов. Сначала воду из рек, озер и прудов отстаивают в специальных бассейнах и фильтруют через слой песка. Затем обрабатывают хлором, а иногда озоном или ультрафиолетом, для уничтожения микроорганизмов.
Рис. 3. Станция очистки воды
Роль воды в промышленности, быту и сельском хозяйстве сложно переоценить.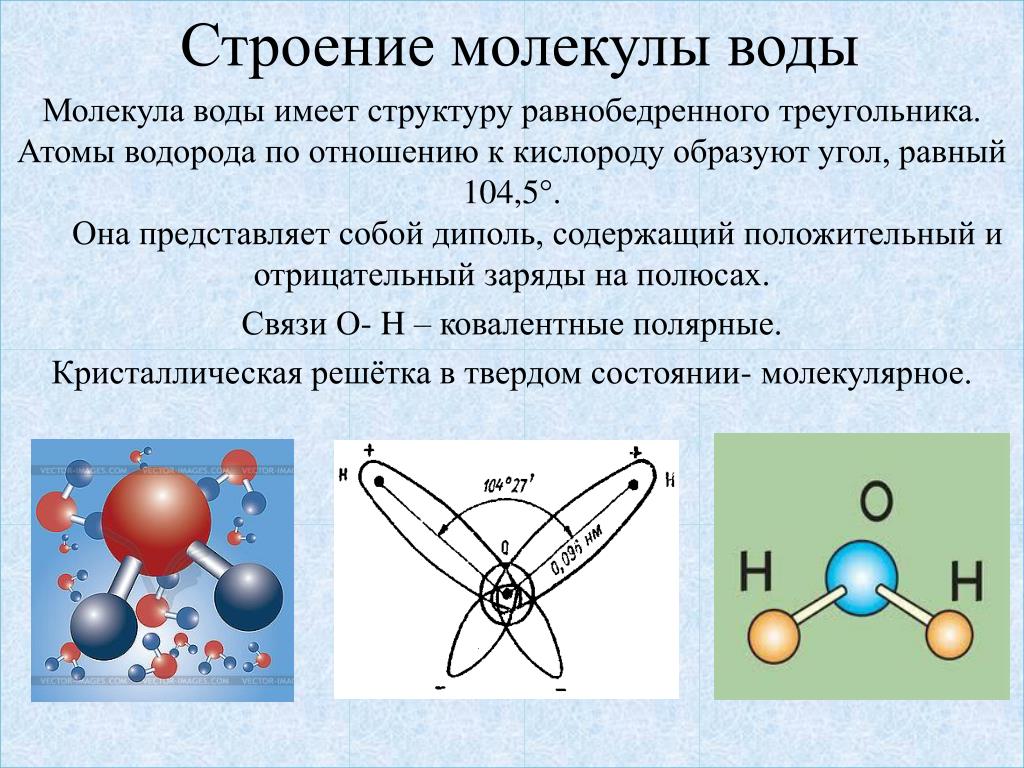 Развитие всех отраслей хозяйства страны, рост городов нередко приводят к загрязнению водоемов. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию водных природных ресурсов.
Развитие всех отраслей хозяйства страны, рост городов нередко приводят к загрязнению водоемов. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию водных природных ресурсов.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/voda
источник видео — http://www.youtube.com/watch?v=hl7NrtMZtss
источник видео — http://www.youtube.com/watch?v=ih6QhoRO_9U
источник презентации — http://ppt4web.ru/khimija/voda-fizicheskie-i-khimicheskie-svojjstva-vody.html
источник презентации — http://ppt4web.ru/ehkologija/sposoby-ochistki-pitevojj-vody.html
http://900igr.net/zip/khimija/Voda-i-ejo-svojstva.html
Свойства воды
ПРЕДСТОЯЩИЕ СОБЫТИЯ
Ваш браузер должен поддерживать JavaScript для просмотра этого контента.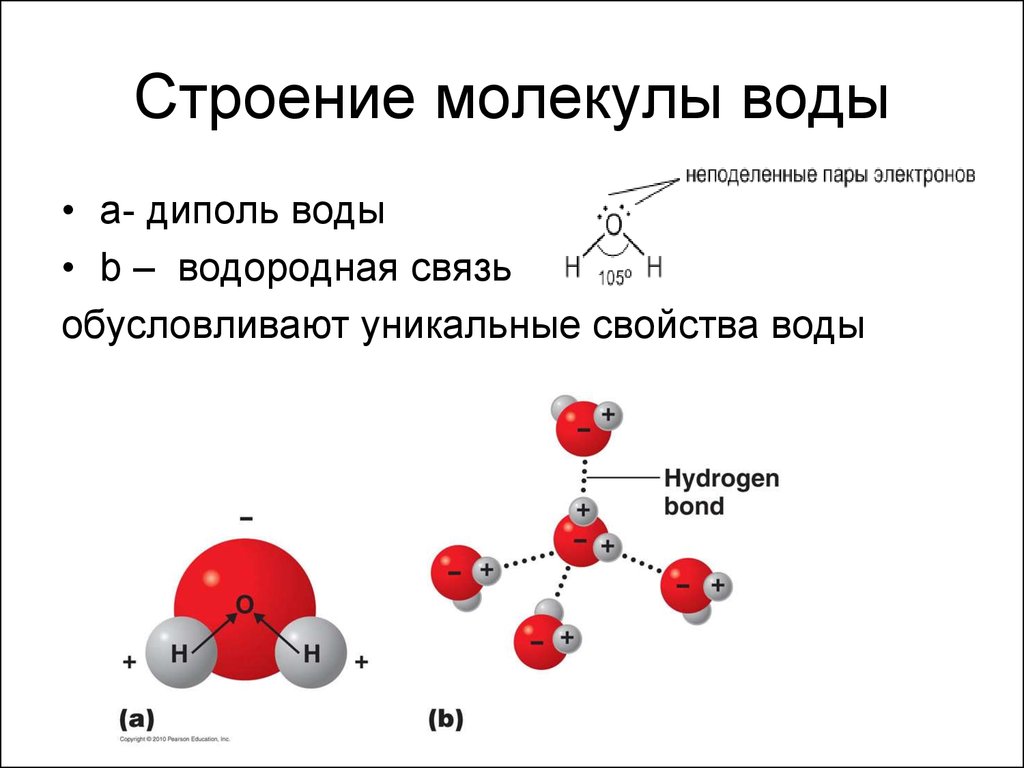 Включите JavaScript в настройках браузера и повторите попытку.
Календарь событий от TrumbaView полный календарь
Включите JavaScript в настройках браузера и повторите попытку.
Календарь событий от TrumbaView полный календарьУЗНАЙТЕ О СВОЙСТВАХ ВОДЫ
Структура молекулы воды создает слабое притяжение между концами кислорода одной молекулы и водородными концами других молекул воды. Хотя эти «полярные» связи относительно слабы и постоянно рвутся и восстанавливаются, их существование приводит к многим особым свойствам воды по сравнению с другими веществами на земле. Эти свойства воды в значительной степени ответственны за жизнь на Земле.
Ниже приведены естественные свойства воды, на которые человек может существенно повлиять. виды деятельности: химические, физические и биологические.
ХИМИЧЕСКИЕ СВОЙСТВА
Природные воды всегда содержат растворенные соли, микроэлементы, некоторые металлы и газы.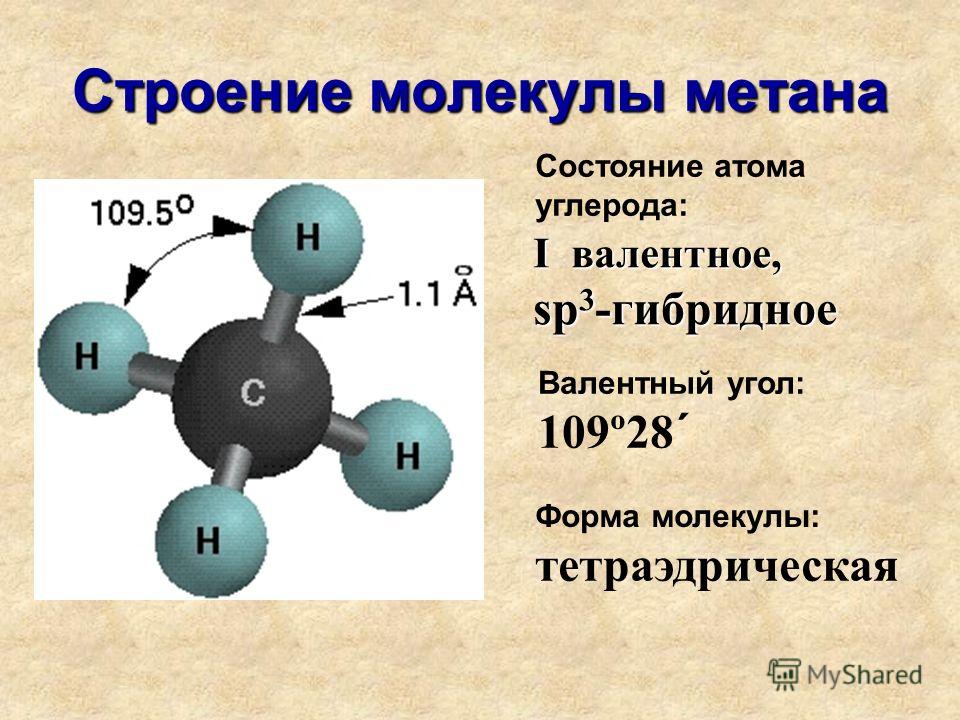
Растворенного кислорода
Питательные вещества
щелочность и твердость
Металлы
PHEN и другие органы.
ФИЗИЧЕСКИЕ СВОЙСТВА
Температура
Мутность
Движение воды
Свет
БИОЛОГИЧЕСКИЕ СВОЙСТВА
Растения
Водные растения представляют собой фотосинтезирующие организмы, приспособленные к жизни в воде. Наземные растения
в основном «сосудистые» растения, имеющие корни, которые поглощают и транспортируют воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простое строение.
Этим «макрофитам» не нужно транспортировать воду, так как они живут в воде, и
как правило, они могут получать питательные вещества непосредственно из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручьи) или неподвижные (озера, пруды или водно-болотные угодья).
Наземные растения
в основном «сосудистые» растения, имеющие корни, которые поглощают и транспортируют воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простое строение.
Этим «макрофитам» не нужно транспортировать воду, так как они живут в воде, и
как правило, они могут получать питательные вещества непосредственно из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручьи) или неподвижные (озера, пруды или водно-болотные угодья).
Suspended and attached algae
Emergent, floating and submersed plants
Animals
Zooplankton
Macroinvertebrates
Fish
Other vertebrates
Бактерии
С точки зрения качества воды нас больше всего беспокоит роль бактерий в развитии болезней. Бактерии и родственные им одноклеточные организмы
все более признается за их важность в разложении органических материалов, обработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
Бактерии и родственные им одноклеточные организмы
все более признается за их важность в разложении органических материалов, обработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
ДРУГИЕ ВОЗДЕЙСТВИЯ
Инвазивные виды
1.3 Физические и химические свойства – CHEM 1114 – Введение в химию
Глава 1. Химия: экспериментальная наука
Цели обучения
К концу этого раздела вы сможете:
- Определять физические или химические свойства и изменения материи
- Определите свойства материи как экстенсивные или интенсивные
Напомним, что химия изучает материю, ее свойства, изменения, которые претерпевает материя, и энергию, связанную с этими изменениями. В этой главе мы более подробно рассмотрим материю и энергию и то, как они связаны.
Когда вещество претерпевает изменение, процесс часто сопровождается изменением энергии — тепла, света, звука, кинетической энергии движущегося вещества и т. д. Если при изменении выделяется (выделяется) теплота, то изменение экзотермическое . Если требуется подвод тепла, изменение эндотермический .
Важным отличием является то, что тепло — это энергия, которая течет из-за разницы температур, а температура — это мера средней кинетической энергии молекул в веществе. Чем быстрее они двигаются, тем «горячее».
Характеристики, которые позволяют нам отличить одно вещество от другого, называются свойствами. Физическое свойство — характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А
Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. А
Мы наблюдаем физические изменения при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 2). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Превращение одного типа материи в другой тип (или невозможность изменения) является химическим веществом . свойство . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 3). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рисунок 3. (a) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает.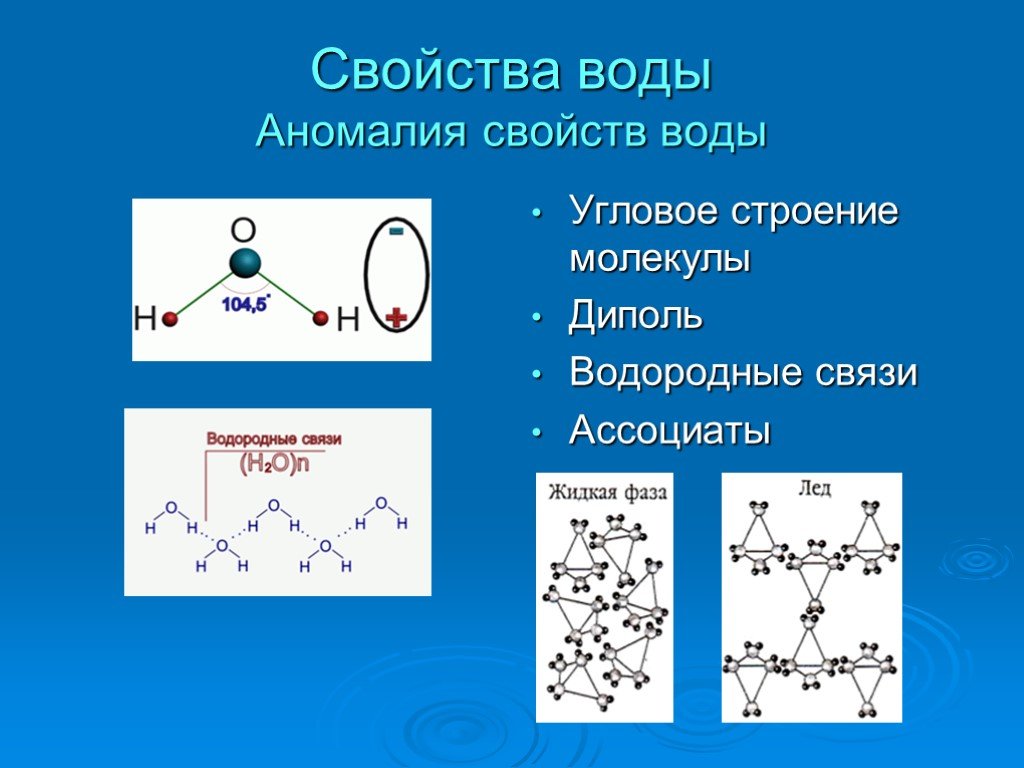 (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
(кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 4).
Рисунок 4. (a) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
(b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)Пример 1
Классифицируйте каждое из следующих свойств либо как физическое, либо как химическое свойство:
a) Температура кипения воды составляет 100 o C
b) Кислород представляет собой газ
c) Сахар сбраживается с образованием спирта
Решение
а) Хотя это свойство описывает изменение, это изменение не влечет за собой изменение существа. H 2 O остается H 2 O независимо от того, в каком состоянии он находится. Таким образом, это физическое свойство.
H 2 O остается H 2 O независимо от того, в каком состоянии он находится. Таким образом, это физическое свойство.
b) Это неотъемлемое свойство и, следовательно, физическое свойство.
c) Это свойство связано с изменением вещества с сахара на спирт. Это химическое свойство.
Проверьте себя
Классифицируйте каждое из следующих. Ответы
а) физическое свойство б) химическое свойство в) химическое свойство
Свойства материи попадают в одну из двух категорий. Если свойство зависит от количества присутствующей материи, то это экстенсивное свойство . Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца материи не зависит от количества присутствующей материи, то это интенсивное свойство . Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Пример 2
Классифицируйте каждое из следующих явлений как физическое или химическое изменение:
a) Конденсация пара на зеркале в душе
b) Железообразующая ржавчина
c) Таблетка антацида шипит при контакте с желудком кислота
d) Соль растворяется в воде
Раствор
а) Пар представляет собой водяной пар, и когда он конденсируется, он образует жидкую воду на зеркале.
Это физическое изменение.
б) Железо реагирует с кислородом воздуха, образуя оксид железа, который представляет собой ржавчину.
Это химическое изменение.
c) Шипение в воде – это выделение углекислого газа при контакте с кислотой. Это химическое изменение.
d) Растворение считается физическим изменением. Хотя связи соли при растворении разрываются, они не образуют новых связей или нового вещества. Если выпарить воду, останется соль.
Проверь себя
Классифицируй каждое из следующих явлений как физическое или химическое:
a) Резинка растягивается, когда за нее тянут
b) Ацетон удаляет лак для ногтей
c) Медь плавится при высокие температуры
d) Серебро со временем тускнеет
Ответы
а) физические изменения 0006
Пример 3
Опишите каждый процесс как физическое или химическое изменение.
а) Вода в воздухе превращается в снег.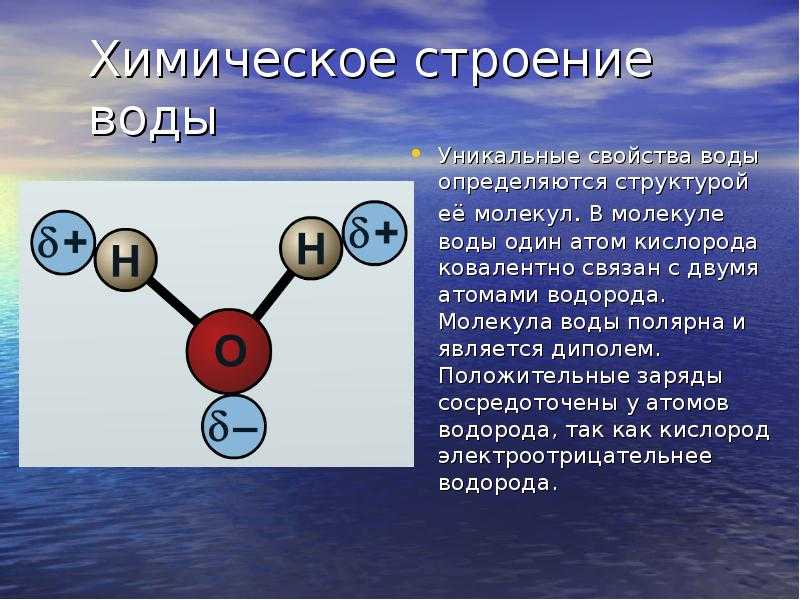
б) Человеку стригут волосы.
c) Тесто для хлеба превращается в свежий хлеб в духовке.
Решение
а) Поскольку вода переходит из газовой фазы в твердую, это физическое изменение.
б) Ваши длинные волосы укорачиваются. Это физическое изменение.
c) Из-за температуры в духовке в хлебном тесте происходят химические изменения, необходимые для приготовления свежего хлеба. Это химические изменения. (На самом деле во многих процессах приготовления пищи происходят химические изменения.)
Проверьте себя
Определите каждый процесс как физическое или химическое изменение.
а) В камине бушует огонь.
b) Вода нагревается для приготовления чашки кофе.
Ответы
а) химическое изменение б) физическое изменение
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 5, на контейнерах с химикатами или на рабочем месте в лаборатории. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
5, на контейнерах с химикатами или на рабочем месте в лаборатории. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению.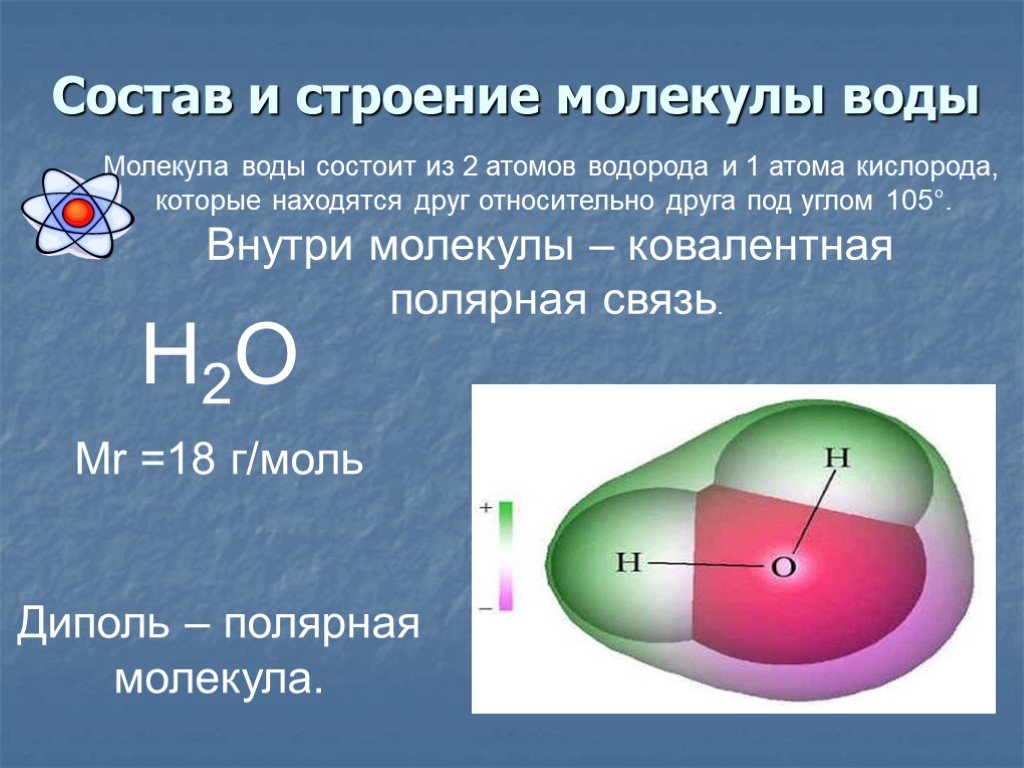 Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислым, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Разложение воды / Производство водорода
Вода состоит из элементов водорода и кислорода, соединенных в соотношении 2:1. Вода может подвергаться химическому изменению, в ходе которого молекулы воды расщепляются на водород и кислородные газы за счет добавления энергии. Один из способов сделать это — использовать батарею или блок питания, как показано на (Рисунок 6).
Рисунок 6. Разложение воды показано на макроскопическом, микроскопическом и условном уровнях. Батарея обеспечивает электрический ток (микроскопический), который разлагает воду. На макроскопическом уровне жидкость разделяется на газы водород (слева) и кислород (справа). Символически это изменение представлено тем, что показано, как жидкий H 2 O разделяется на газы H 2 и O 2 .
Символически это изменение представлено тем, что показано, как жидкий H 2 O разделяется на газы H 2 и O 2 .Расщепление воды включает перегруппировку атомов в молекулах воды в разные молекулы, каждая из которых состоит из двух атомов водорода и двух атомов кислорода соответственно. Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление того, что происходит, [латекс]2\текст{H}_2\текст{O}(l) \rightarrow 2\text{H}_2(g) + \text{O}_2(g)[/latex] , будут более подробно рассмотрены в последующих главах.
Два образовавшихся газа имеют совершенно разные свойства. Кислород не воспламеняется, но необходим для сгорания топлива, а водород легко воспламеняется и является мощным источником энергии. Как эти знания можно применить в нашем мире? Одно приложение включает исследования в области более экономичного транспорта. Автомобили на топливных элементах (FCV) работают на водороде вместо бензина (рис. 7). Они более эффективны, чем автомобили с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, что делает нас менее зависимыми от ископаемого топлива. Однако FCV еще не являются экономически жизнеспособными, и текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производства водорода другим экологически безопасным способом, FCV могут стать способом будущего.
Однако FCV еще не являются экономически жизнеспособными, и текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производства водорода другим экологически безопасным способом, FCV могут стать способом будущего.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы со сходными свойствами расположены близко друг к другу (рис. 6). Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Рисунок 6. Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.Основные понятия и резюме
Все вещества обладают различными физическими и химическими свойствами и могут подвергаться физическим или химическим изменениям. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, связаны с образованием вещества, отличного от того, что было ранее.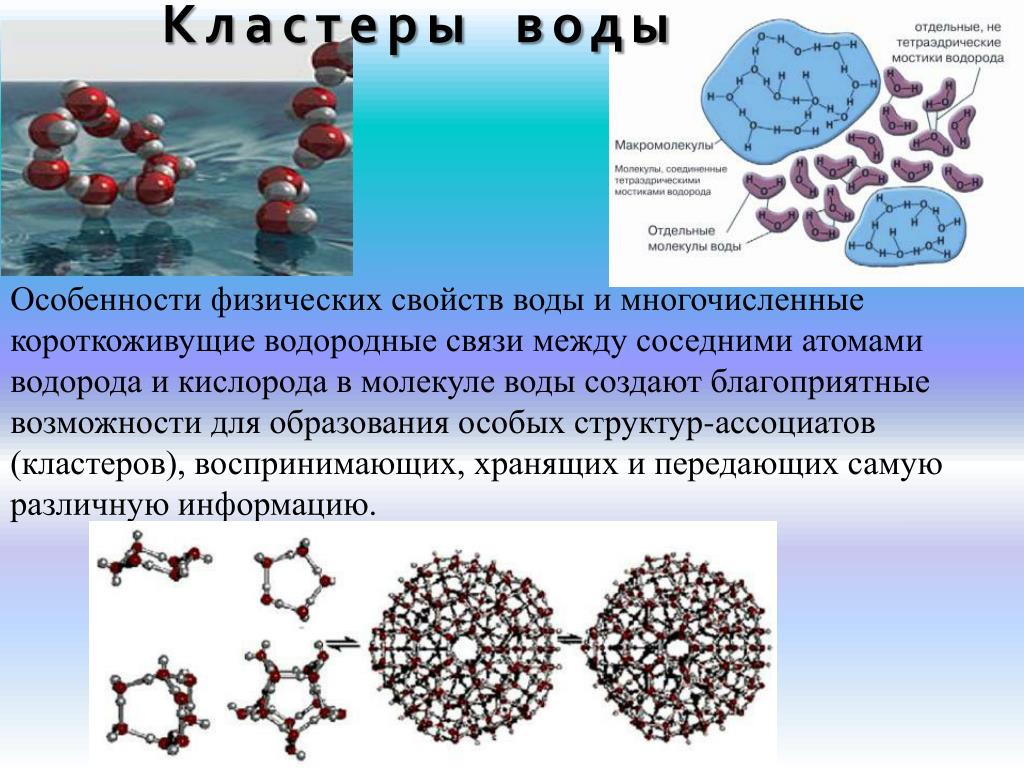
Измеряемые свойства относятся к одной из двух категорий. Экстенсивные свойства зависят от количества присутствующего вещества, например, массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотность золота. Теплота — пример экстенсивного свойства, а температура — пример интенсивного свойства.
Упражнения
1. Классифицируйте каждое из следующих изменений как физическое или химическое:
а) конденсация пара
б) сжигание бензина
в) скисание молока
г) растворение сахара в воде
д) ) плавление золота
2. Объем образца газообразного кислорода изменялся с 10 мл до 11 мл при изменении температуры. Это химическое или физическое изменение?
3. Объясните разницу между экстенсивными и интенсивными свойствами.
4. Плотность (d) вещества – интенсивное свойство, определяемое как отношение его массы (m) к его объему (V).
[латекс]\text{плотность}= \frac{\text{масса}}{\text{объем}}[/latex] [латекс]\text{d} = \frac{\text{m}}{ \text{V}}[/latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
5. Представляет ли каждое утверждение физическое или химическое свойство?
а) Сера желтая.
b) Стальная вата горит при воспламенении от пламени.
c) Галлон молока весит более восьми фунтов.
6. Представляет ли каждое утверждение физическое или химическое свойство?
а) Куча листьев медленно гниет на заднем дворе.
b) В присутствии кислорода водород может взаимодействовать с образованием воды.
c) Золото можно растянуть в очень тонкую проволоку.
7. Представляет ли каждое утверждение физическое или химическое изменение?
а) Вода закипает и превращается в пар.
b) Пища преобразуется в пригодную для употребления форму пищеварительной системой.
c) Спирт во многих термометрах замерзает при температуре около -40 градусов по Фаренгейту.
8. Представляет ли каждое утверждение физическое или химическое изменение?
а) Графит, форма элементарного углерода, может быть превращен в алмаз, другую форму углерода, при очень высоких температурах и давлениях.