Урок по теме: «Сущность химических реакций и признаки их протекания. Тепловой эффект реакции» | План-конспект урока по химии (8 класс) по теме:
Тема урока: «Сущность химических реакций и признаки их протекания. Тепловой эффект реакции»
Основные понятия в теме: химические реакции, признаки реакции, эндо- и экзотермические реакции, тепловой эффект реакции, термохимические реакции
Требования к уровню подготовки обучающихся (результат): Знать определение понятия химическая реакция, признаки и условия течения химических реакций, типы реакций по выделению или поглощению тепла.
Информационное сопровождение:
Опыты: 1) нагревание медной проволоки, 2) сода + кислота, 3) хлорид меди + гидроксид натрия
Тип урока. Изучение нового материала.
Урок подготовлен по технологии критического мышления.
Вид урока. Беседа с использованием учебного химического эксперимента.
Цель. Учащиеся научаться отличать физические явления от химических
Задачи :
— с помощью химического эксперимента изучить условия, сущность и признаки химических реакций;
— познакомиться с экзо- и эндотермическими реакциями;
— развивать умение анализировать, сравнивать, делать выводы.
Методы и методические приемы. Беседа, верные и неверные утверждения, демонстрация опытов, лабораторные опыты, работа с таблицей, заполнение кластера.
Оборудование и реактивы. Видеозапись опыта: разложение воды электрическим током; горение угля; отрывок из книги А.Казанцева «Пылающий остров», презентация.
Для лабораторных опытов:
лоток № 1: медная проволока, спиртовка, спички;
лоток № 2: сода, раствор соляной кислоты, пробирка;
лоток № 3: растворы CuCl2 и NаОН, пробирка.
ХОД УРОКА
1. Введение в урок
УЧИТЕЛЬ. Здравствуйте, ребята! Я очень рада видеть вас на уроке. Сегодня мы начинаем изучать новую тему «Химические реакции, их сущность, признаки протекания, классификация». Этот раздел также включает в себя составление уравнений химических реакций и выполнение расчетов по химическим уравнениям.
Откройте тетради и запишите тему урока.
2. Актуализация знаний. Стадия вызова.
УЧИТЕЛЬ. (фронтальная беседа). В этом году мы с вами начали изучать очень интересный предмет, относящийся к естественно-научным предметам (вместе с физикой, биологией, географией), – химию. Что изучает химия?
Что изучает химия?
УЧЕНИК. Химия – это наука о веществах, их свойствах, о превращениях веществ и способах управления этими превращениями.
УЧИТЕЛЬ. В природе, на производстве, в быту с веществами происходят различные изменения. Как по другому они называются?
УЧЕНИК- Они называются явлениями.
УЧИТЕЛЬ. Какие явления, происходящие с веществами, вам известны?
УЧЕНИК. Нам известны физические и химические явления.
УЧИТЕЛЬ. Какие явления называются физическими, а какие химическими?
УЧЕНИК. Физическими явлениями называются изменения, при которых новые вещества не образуются.
Химическими называются явления, при которых исходные вещества (реагенты) превращаются в другие вещества (продукты реакции)
УЧИТЕЛЬ. Перед вами примеры некоторых явлений. Прочитайте внимательно и определите верные и неверные высказывания.
На работу отводится 5 минут.
- Горение угля – это физическое явление.
- Скисание молока – это химическое явление.

- Диффузия паров духов – это физическое явление.
- Нагревание медной проволоки в пламени спиртовки – это физическое явление.
- Взаимодействие соды с соляной кислотой – это химическое явление.
- Действие йода на крахмал – это физическое явление.
- Разложение воды электрическим током – это физическое явление.
- Взаимодействие хлорида меди(II) и гидроксида натрия – это химическое явление.
Ответы: 1-Н, 2-В, 3-В, 4-Н, 5-В, 6-Н, 7-Н, 8-В.
УЧИТЕЛЬь. Обменяйтесь своим мнением с соседом, а теперь обменяйтесь с ребятами сидящими рядом с вами.
Заслушаем ваши варианты ответов. Какие трудности вы испытали при выполнении этого задания?
Постановка цели учащимися. Научиться отличать химические явления от физических, узнать в чем сущность химических реакций.
3. Стадия осмысления.
Проведем химический эксперимент. Данные эксперимента занесите в тетрадь в виде таблицы.
Исходные вещества | Условия | Признаки реакции |
Первый ряд выполняет опыт «Нагревание медной проволоки в пламени спиртовки». Какие правила необходимо соблюдать при работе со спиртовкой?
Какие правила необходимо соблюдать при работе со спиртовкой?
УЧЕНИК. Зажигать спиртовку следует горящей спичкой или лучинкой; ни в коем случае нельзя зажигать ее от другой спиртовки. Переносить горящую спиртовку с одного стола на другой запрещается; тушить пламя можно, только накрывая его колпачком.
УЧИТЕЛЬ. Второй ряд – «Взаимодействие соды с соляной кислотой». Вспомним, какие правила нужно соблюдать при работе с кислотами и щелочами.
Третий ряд выполняет задание «Взаимодействие хлорида меди(II) с раствором гидроксида натрия».
УЧЕНИК. Работать с едкими веществами нужно осторожно, избегая их попадания в глаза, на кожу и одежду.
На выполнение работы отводится 5 минут. После окончания опытов трое учащихся представляют результаты своей работы и наблюдения, остальные заполняют таблицу до конца.
Исходные вещества | Условия | Признаки реакции |
Медь, кислород | соприкосновение, t° | Изменение цвета |
сода,хлороводородная кислота | соприкосновение | Выделение газа |
Хлорид меди(II), гидроксид натрия | соприкосновение | Выпадение осадка |
Какой вывод можно сделать на основании ваших наблюдений.
Ученик. Мы наблюдали химические реакции, так как в результате образовывалось новое вещество и это доказывало появление какого ни будь признака.
УЧИТЕЛЬ. Что требовалось для того чтоб произошла реакция? Как по другому это можно назвать?
УЧЕНИК. Требовались определенные условия.
УЧИТЕЛЬ. Запишите их в таблицу. Посмотрите видео разложения воды. (Демонстрация опыта. Видео )
Запишите в таблицу данные эксперимента.
Вода | Электрический ток | Выделение газов |
Как вы думаете все ли признаки химических явлений мы рассмотрели?
Посмотрим видео горения угля. Какие условия необходимы? Какие признаки реакции?
Учащиеся просматривают видеосюжеты и заполняют таблицу.
Уголь, кислород | соприкосновение, t° | Выделяется энергия |
Физминутка. Гимнастика для глаз.
Гимнастика для глаз.
УЧИТЕЛЬ. Еще Д.И.Менделеев указывал, что наиболее существенным признаком всех химических реакций является изменение энергии.
У вас на столах отрывок из произведения писателя-фантаста А.Казанцева «Пылающий остров».
«Люди мира! Воздух, которым вы дышите, состоит из смеси двух газов – азота и кислорода. Кислород – очень деятельный газ. При повышенной температуре он стремится соединиться со многими телами нашей Земли. Эта реакция хорошо известна нам как горение. Когда горит уголь, вещество его соединяется с кислородом, при этом выделяется тепло.
Соединение многих тел с кислородом сопровождается выделением тепла; выражаясь научно, является реакцией экзотермической. Но не все тела таковы. Есть соединения с кислородом, образование которых требует тепла извне, есть явления холодного горения – горения, не выделяющего, а поглощающего тепло. Таким холодным горением было до сих пор соединение двух газов нашего воздуха – азота и кислорода. Эта реакция эндотермическая, она требовала затраты значительной энергии и потому была редка на Земле. Она происходила в природе во время грозовых электрических разрядов – во время ударов молнии».
Она происходила в природе во время грозовых электрических разрядов – во время ударов молнии».
Прочтите этот текст и ответьте на вопросы. О какой реакции говорится в тексте? О каком признаке реакции автор говорит в этом отрывке?
УЧЕНИК. В отрывке говорится о реакции горения. Автор выделяет признак реакции – выделение тепла или поглощение. В тексте автор приводит примеры экзо- и эндотермических реакций.
Как вы думаете на что затрачивается энергия во время химической реакции?
Энергия затрачивается на разрушение одних веществ и выделяется при образовании других веществ. Энергетические изменения проявляются либо в выделении, либо в поглощении теплоты.
Откройте учебник на стр. 70, найдите в тексте как называется количество теплоты, которое выделяется или поглощается в результате реакции.
УЧЕНИК. Называется тепловым эффектом реакции.
УЧИТЕЛЬ. Какие различают реакции по тепловому эффекту?
УЧЕНИК. Реакции бывают экзо- или эндотермическими.
УЧИТЕЛЬ. Найдите в тексте учебника определения, какие реакции называются экзотермическими и какие эндотермическими. Дома эти определения выучите.
Найдите в тексте учебника определения, какие реакции называются экзотермическими и какие эндотермическими. Дома эти определения выучите.
Рассмотрим в общем виде схему, поясняющую сущность экзо- и эндотермических реакций
УЧИТЕЛЬ. На данной схеме буквой Q обозначено количество теплоты, которое поглощается или выделяется в реакции, т.е. тепловой эффект реакции. Тепловой эффект реакции записывается в правой части уравнения со знаком «+», если теплота выделяется, и со знаком «–», если она поглощается. Тепловой эффект выражается в килоджоулях (кДж) и часто относится к одному моль вещества.
Область химической науки, занимающаяся изучением тепловых эффектов химических реакций, называется термохимией. Соответственно химические уравнения с указанием теплового эффекта называют термохимическими.
Что же происходит с веществами в процессе химической реакции?.
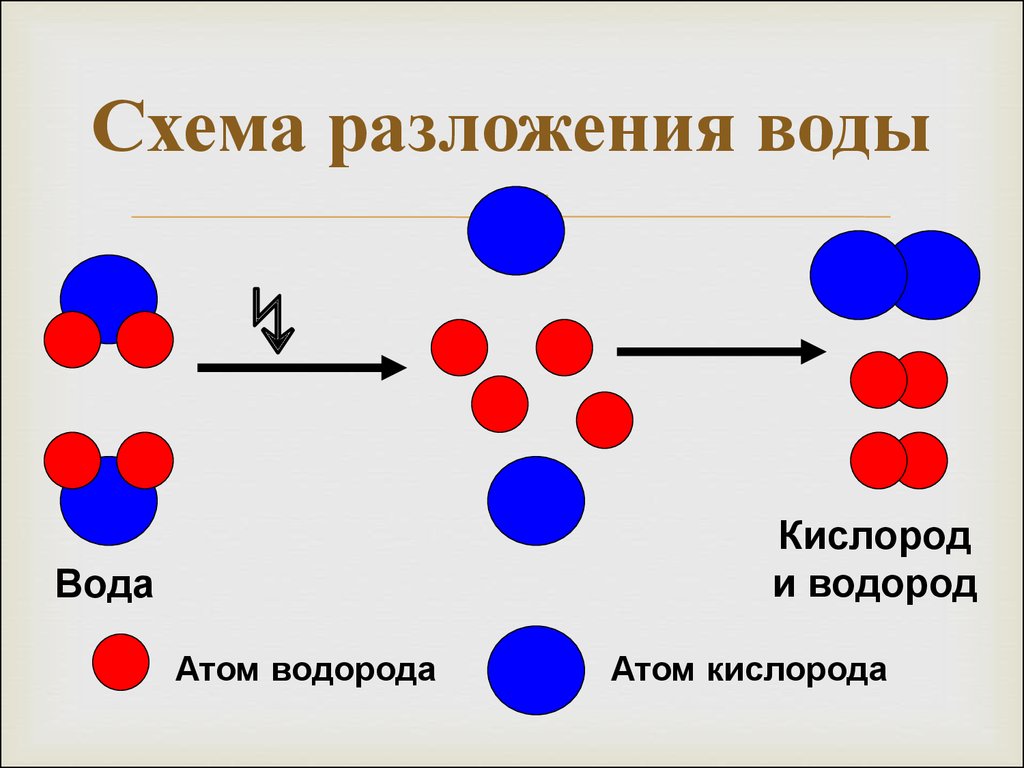
Обратимся к реакции разложения воды электрическим током.
Понять сущность этой реакции нам поможет статическая модель.
УЧИТЕЛЬ. Ответьте на вопрос: что же происходит с молекулами воды под действием постоянного электрического тока?
УЧЕНИК. Под действием постоянного электрического тока молекулы воды разрушаются.
УЧИТЕЛЬ. Точнее, разрушаются химические связи между атомами водорода и кислорода в молекулах воды. Какие вещества образуются при разложении воды?
УЧЕНИК. При разложении воды образуются газы водород и кислород.
УЧИТЕЛЬ. Атомы водорода, объединяясь попарно, образуют двухатомные молекулы водорода, атомы кислорода, объединяясь попарно, образуют двухатомные молекулы кислорода – т.е. в продуктах реакции образуются новые химические связи. Данная реакция идет с поглощением теплоты, т.е. является эндотермической.
Итак, в рассмотренном опыте исходное вещество вода – жидкость, без цвета, вкуса и запаха, под действием электрического тока разлагается на бесцветные газы: водород и кислород. Продукты реакции отличаются от исходного вещества составом, строением, свойствами.
Сделаем вывод: согласно атомно-молекулярному учению при химических реакциях молекулы разрушаются, а атомы сохраняются; Следовательно, сущность химической реакции состоит в перегруппировке атомов.
(Учащиеся делают запись в тетрадях.)
4. Стадия рефлексии
УЧИТЕЛЬ. Ребята, наш урок подходит к завершению. В начале урока перед вами была поставлена цель научиться различать химические явления от физических.
Давайте вернемся к первому заданию, верные и неверные утверждения.
(Учащиеся называют химические явления и доказывают, опираясь на знания полученные на уроке)
- Горение угля – это физическое явление.
- Скисание молока – это химическое явление.
- Диффузия паров духов – это физическое явление.
- Нагревание медной проволоки в пламени спиртовки – это физическое явление.
- Взаимодействие соды с соляной кислотой – это химическое явление.
- Действие йода на крахмал – это физическое явление.
- Разложение воды электрическим током – это физическое явление.
- Взаимодействие хлорида меди(II) и гидроксида натрия – это химическое явление.
Настало время подвести итоги, что вы сегодня узнали о химической реакции?
Заполнение кластера.
УЧЕНИК. На уроке мы разобрались в сущности химических реакций, узнали, что в ходе реакции образуются новые вещества, это сопровождается внешними признаками. С помощью лабораторных опытов мы узнали, что для осуществления химической реакции необходимы определенные условия, познакомились с экзо- и эндотермическими реакциями.
УЧИТЕЛЬ. Ребята! Я надеюсь, что знания, полученные на уроке, пригодятся вам при дальнейшем изучении химии.
Осталось записать домашнее задание.
1 уровень- §17 (выучить определение), упр.3
2 уровень – тоже, что для 1-го и упр.4,6.
Электрический ток в электролитах — материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях. Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.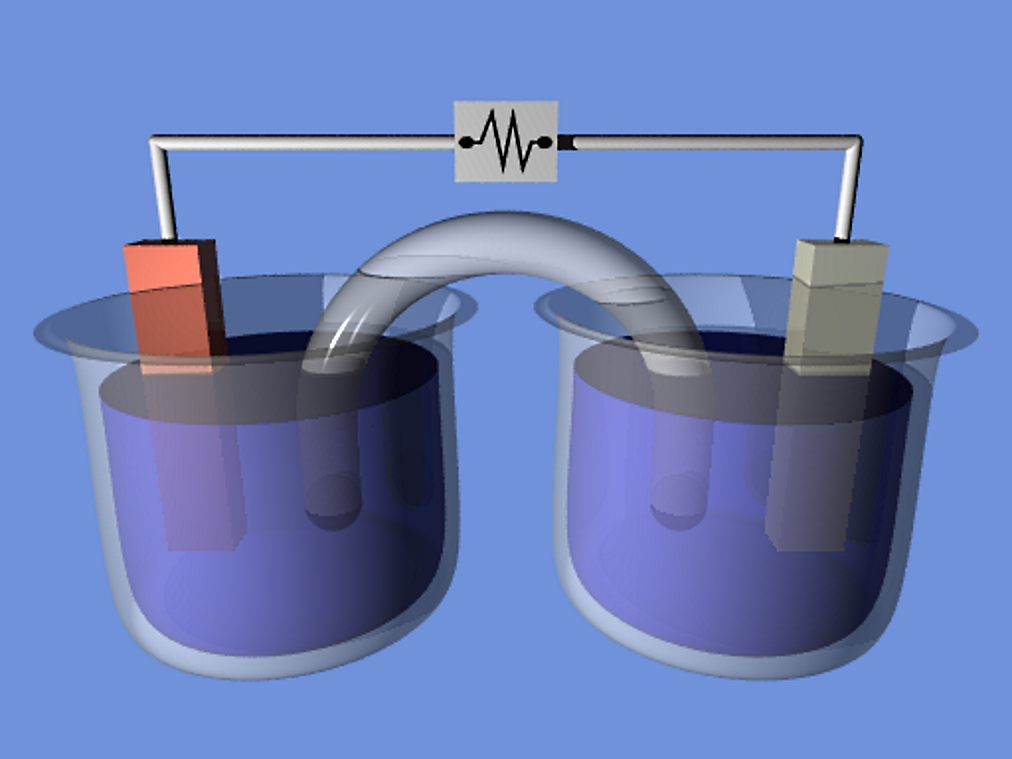
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что
Рис. 1. Молекулы воды
Угол, образованный линиями центров атома кислорода и двух атомов водорода, составляет примерно . Кроме того, электронные оболочки смещены в сторону кислорода. В результате центры положительных и отрицательных зарядов оказываются пространственно разделёнными: «минусы» преобладают в кислородной части молекулы воды, а «плюсы» — в водородной части.
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи.
Почему же соли, кислоты и основания распадаются в воде на ионы? Всё дело в том, что молекулы этих веществ также являются полярными. Давайте вернёмся к нашему примеру с растворением поваренной соли .
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Поэтому при образовании молекулы внешний электрон атома натрия уходит к атому хлора, и в результате молекула становится полярной — она состоит из положительного иона и отрицательного иона . Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).
Рис. 2.
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.
Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В конце концов эта связь становится настолько слабой, что удары соседних частиц, совершающих тепловое движение, разрушают молекулу . Она распадается на положительный ион и отрицательный ион .
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4). Это и является необходимым условием прохождения тока через раствор.
Рис. 4. Раствор в воде
Описанный выше процесс растворения совершенно аналогично протекает и в случае других примесей.Так, щёлочь распадается в водном растворе на положительные ионы калия и отрицательные ионы гидроксильной группы . Молекула серной кислоты при распаде даёт два положительных иона и отрицательно заряженный ион кислотного остатка В растворе медного купороса появляются положительные ионы меди и отрицательно заряженные ионы
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Степенью диссоциации
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов . Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Естественным образом возникает вопрос о нахождении массы вещества, выделяющегося на электроде за определённое время . Эта масса, очевидно, совпадает с массой данного вещества, перенесённого током за время через электролит.
Пусть — масса одного иона этого вещества, — заряд иона ( — валентность вещества). Предположим, что за время через электролит прошёл заряд . Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
(1)
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
При протекании через электролит постоянного тока за время проходит заряд . Подставляя это в формулу (1), получим первую формулу Фарадея:
(2)
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Подставляя это выражение в (2), получим вторую формулу Фарадея:
(3)
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.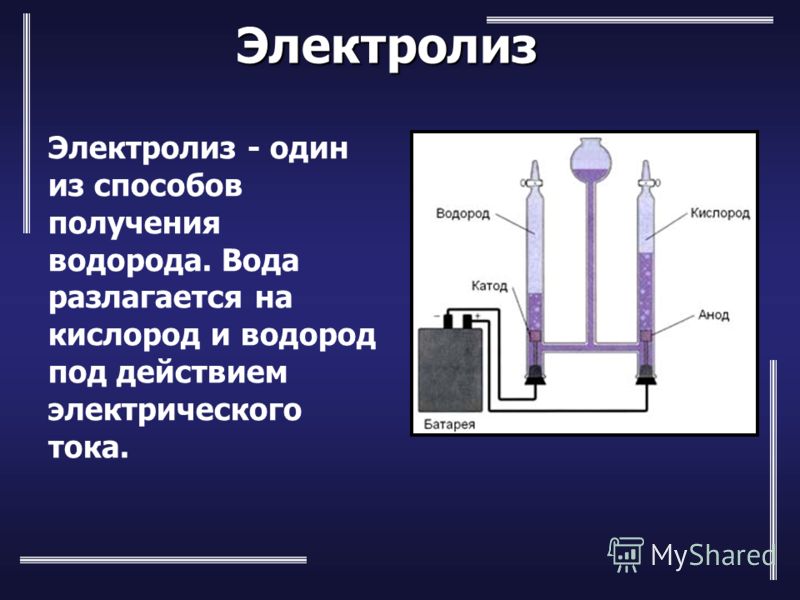
В формуле (3) мы видим произведение двух констант и . Оно также является константой и называется постоянной Фарадея:
Кл/моль.
Формула (3) с постоянной Фарадея запишется так:
Спасибо за то, что пользуйтесь нашими статьями. Информация на странице «Электрический ток в электролитах» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ. Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий. Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена: 06.02.2023
Химические реакции — Разложение | Шмуп
Предыдущий СледующийРазложение
Простите меня, пока я разлагаюсь
У всех нас есть довольно хорошее представление о том, что такое разложение. Серьезно, сколько сериалов типа CSI или Закон и порядок сейчас существует? Они все время говорят о разложении. Реакции разложения протекают именно так, как и следовало ожидать: расщепление или разделение химического соединения на элементы или более простые соединения.
Серьезно, сколько сериалов типа CSI или Закон и порядок сейчас существует? Они все время говорят о разложении. Реакции разложения протекают именно так, как и следовало ожидать: расщепление или разделение химического соединения на элементы или более простые соединения.
Добро пожаловать в противоположный день
Реакции разложения противоположны реакциям синтеза. Самое простое представление реакции разложения:
AB → A + B
Во время процесса вещество AB разлагается или распадается с образованием веществ A и B.
В простейшем типе реакции разложения соединение распадается на составляющие его элементы. Простым примером из повседневной жизни может быть разложение воды на водород и кислород следующим образом:
2 H 2 O → 2 H 2 + O 2
Когда вы в последний раз наливали себе хороший стакан воды, и она самопроизвольно превращалась в водород и кислород? Мы надеемся, ответ никогда. Правда в том, что реакции разложения обычно не происходят самопроизвольно. Обычно им нужна какая-то движущая сила, чтобы заставить их произойти. В случае превращения воды в водород и кислород движущей силой является энергия в виде электричества. Процесс называется «расщепление воды». Если вы хотите попробовать разделить воду дома, ознакомьтесь с инструкциями здесь или посмотрите видео здесь.
Правда в том, что реакции разложения обычно не происходят самопроизвольно. Обычно им нужна какая-то движущая сила, чтобы заставить их произойти. В случае превращения воды в водород и кислород движущей силой является энергия в виде электричества. Процесс называется «расщепление воды». Если вы хотите попробовать разделить воду дома, ознакомьтесь с инструкциями здесь или посмотрите видео здесь.
Электролиз воды: форма разложения
Поскольку реакция разложения включает разрыв химических связей, она требует добавления энергии. Мы уже упоминали, что одним из способов добавления энергии является электролиз , который буквально представляет собой добавление электрического тока. Еще один способ добавить энергии — добавить тепла, и мы не говорим о том виде тепла, который можно получить, поедая перец-призрак.
Отличный пример Реакция термического разложения (это тип разложения, который происходит с добавлением тепла) представляет собой разложение карбоната меди, CuCO 3 . Если пробирку с CuCO 3 нагреть в горелке Бунзена, твердый порошок «прыгает» по мере высвобождения молекул углекислого газа. Твердое вещество остается в трубке, но теперь это оксид меди CuO. Проверьте это в этом замечательном видео.
Если пробирку с CuCO 3 нагреть в горелке Бунзена, твердый порошок «прыгает» по мере высвобождения молекул углекислого газа. Твердое вещество остается в трубке, но теперь это оксид меди CuO. Проверьте это в этом замечательном видео.
CuCO 3 + тепло → CuO + CO 2
Для определенного количества химических соединений энергия, необходимая для разложения, довольно мала. В этих случаях достаточно легкого толчка или удара, чтобы добиться цели. К счастью для нас, мы разработали способ использования одной из таких реакций разложения, который спасает тысячи жизней в год. Азид натрия, Na(N 3 ) 2 , взрывоопасно разлагается на газообразный азот, N 2 , и натрий после довольно небольшого удара. Мы используем этот процесс для надувания автомобильных подушек безопасности во время столкновения.
Датчик подушки безопасности
Помните: реакция разложения противоположна реакции синтеза, поэтому, когда вы видите, что один реагент дает более одного продукта, у вас в руках разложение.
Закуска для мозгов
Посмотрите это видео, демонстрирующее разложение бургеров и картофеля фри McDonald’s. Это может заставить вас переосмыслить следующий Биг Мак.
Предыдущий СледующийПодробнее о химических реакциях Навигация
Это продукт премиум-класса
Разблокировать эти функции
Устали от рекламы?
Присоединяйтесь сегодня и никогда больше их не увидите.
Начало работы
Реакции разложения — определение, типы, примеры, использование и часто задаваемые вопросы
Реакции разложения происходят, когда сложные химические соединения распадаются на более мелкие компоненты. Реакции разложения часто требуют затрат энергии. Химическое разложение перекиси водорода на воду и кислород, а также разложение воды на водород и кислород — вот некоторые распространенные примеры реакций разложения. Следовательно, реакцию разложения можно просто определить как химическую реакцию, в которой один реагент разлагается на два или более продуктов. Давайте разберемся с такими понятиями, как «Что такое реакция разложения», «Примеры», «Типы», «Двойные реакции разложения», «Использование» и «Часто задаваемые вопросы» в этой статье!
Следовательно, реакцию разложения можно просто определить как химическую реакцию, в которой один реагент разлагается на два или более продуктов. Давайте разберемся с такими понятиями, как «Что такое реакция разложения», «Примеры», «Типы», «Двойные реакции разложения», «Использование» и «Часто задаваемые вопросы» в этой статье!
Что такое реакция разложения?
Реакция разложения – это химический процесс, при котором молекула или реагент распадаются на более простые продукты. Таким образом, когда один реагент распадается на два или более продуктов, которые могут быть представлены следующим уравнением:
AB → A + B
В приведенной выше реакции AB представляет собой реагент, который является химическим соединением A и B, который запускает реакцию, а A и B представляют собой продукты, полученные в результате реакции. а стрелка представляет направление, в котором происходит реакция.
Реакция разложения прямо противоположна реакции соединения. В реакции соединения вещество образуется в результате химического соединения, однако в реакции разложения вещество распадается на новые вещества.
В реакции соединения вещество образуется в результате химического соединения, однако в реакции разложения вещество распадается на новые вещества.
Процесс разложения требует тепла, поэтому его также называют реакцией термического разложения. Энергия, необходимая для разрушения продукта, может быть в виде тепла, света или электричества. Процесс электролиза является прекрасным примером реакции разложения. Реакция происходит путем разрушения молекул пропусканием электричества.
H 2 O ⇢ 2H 2 + O 2
Примеры реакции декомпозиции
Вот некоторые важные примеры реакции декомпозиции:
Реакция девятизации. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. Реакция разжигания. на воду и кислород в присутствии света, как показано ниже:Реакция разложения карбонатов металлов
При нагревании карбонаты металлов разлагаются на оксиды металлов и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ, а карбонат натрия разлагается на оксид натрия и углекислый газ, как показано ниже:
Например, карбонат кальция разлагается на оксид кальция и углекислый газ, а карбонат натрия разлагается на оксид натрия и углекислый газ, как показано ниже:
Реакция разложения гидроксидов металлов
При нагревании гидроксиды металлов распадаются на оксиды металлов и воду. Таким образом, вода и оксид натрия образуются при разложении гидроксида натрия, как показано ниже:
Реакция разложения оксикислот
Разложение оксикислот приводит к образованию диоксида углерода и воды, как показано ниже:
Двойная реакция разложения
Реакция двойного разложения — это реакция между двумя соединениями, в которой компоненты каждого вещества заменяются с образованием двух новых соединений.
Реакция двойного замещения — это реакция между двумя соединениями, в которой положительный ион одной молекулы заменяется положительным ионом другого компонента. Один или несколько реагентов в реакции двойного разложения нерастворимы в растворителе, что является типом реакции двойного замещения.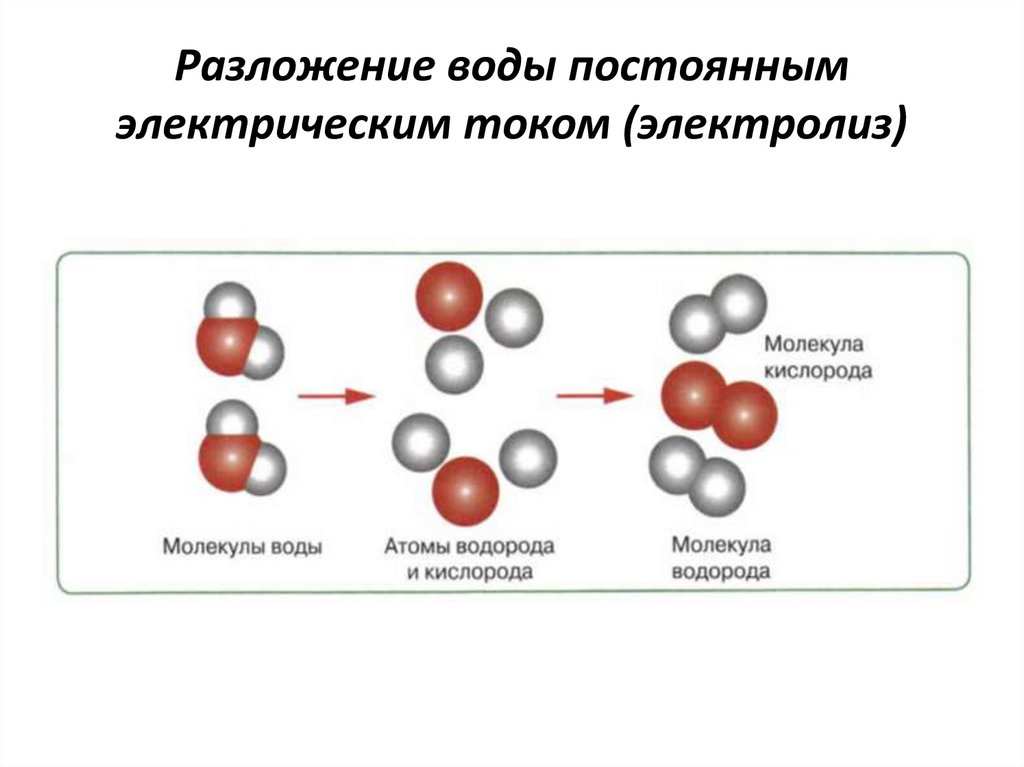
Например, хлорид цинка и газообразный сероводород образуются при реакции сульфида цинка и соляной кислоты. Там сульфид цинка находится в твердом состоянии и не растворяется в водной среде.
Типы реакции разложения
Реакции разложения в основном классифицируются по три типа:
- Реакция термического разложения
- Реакция Электролитического декомпозиции
- Реакция Фото -депозиции
668
668
68
68
9668
Например, хлорид цинка и газообразный сероводород образуются при реакции сульфида цинка и соляной кислоты. Там сульфид цинка находится в твердом состоянии и не растворяется в водной среде, как показано ниже:
Там сульфид цинка находится в твердом состоянии и не растворяется в водной среде, как показано ниже:
Реакция электролитического разложения (электролиз)
При пропускании электрического тока через водный раствор вещества может происходить электролитическое разложение. Электролиз воды служит хорошим примером реакции электролитического разложения (показанной ниже).
Реакция фоторазложения
Фоторазложение — это химическая реакция, при которой химическое соединение распадается на простые вещества под действием света (фотонов).
Например, когда небольшое количество хлорида серебра (AgCl) помещается в часовое стекло и выставляется на некоторое время на солнце. Кристаллы постепенно начинают сереть. Анализ показывает, что хлорид серебра под воздействием солнечного света распадается на серебро и хлор, как показано ниже:
Реакция разложения в нашем организме
Химическая реакция — это процесс превращения одного вещества в другое.
Живые тела также зависят от этих реакций для правильного функционирования, получения питательных веществ, пищеварения, роста и т. д. Когда мы видим функционирование нашего тела, все зависит от химических реакций. Пищеварение — это процесс расщепления молекул или пищи на более простые формы. Слюнные железы выделяют особое химическое вещество, называемое ферментом, которое способствует расщеплению. Крахмал пищи распадается на глюкозу в организме.
Реагент или органический пищевой продукт, состоящий из углеводов, жиров и белков, расщепляется на более простые продукты, при этом также выделяется энергия. Эти продукты разносятся по всему телу через кровоток для функционирования организма.
глюкоза + кислород ⇢ углекислого газа + вода + тепло
или
C 6 H 12 O 6 (AQ ) + 6O 2 (G) + 6O 2 (G) ⇢ 2 + 6O 2 (G) (G) + 6O 2 (G) (G) + 6O 2 (G) + 6O 2 (G) + 6O 2 (G) + 6O 2 (G.
) + 6O 2 (AQ ). (г) + 6Н 2 O (l) + Heat
Точно так же белки разлагаются на более простые формы, называемые аминокислотами, которые способствуют росту. Белки расщепляются на аминокислоты путем гидролиза. Аминокислоты вырабатываются для растворения в крови и разносятся по тканям организма.
Использование реакций разложения
- Реакции разложения широко используются для извлечения металла.
- Реакции разложения помогают производить цемент или оксид кальция.
- Реакция разложения вызывает шипение в бутылке содовой.
- Эта реакция очень полезна для разрушения опасных отходов.
- Также для пищеварительной системы человека важно переваривать пищу.
Часто задаваемые вопросы о реакции разложения
Вопрос 1: Почему реакции разложения называются противоположными реакциям соединения?
Ответ:
Реакция разложения прямо противоположна реакции соединения.
В реакции соединения вещество образуется в результате химического соединения, однако в реакции разложения вещество распадается на новые вещества.
Вопрос 2: Все ли реакции разложения эндотермические?
Ответ:
Да, почти все реакции разложения требуют тепла для разложения, поэтому они эндотермические по своей природе.
Вопрос 3: Укажите важные области применения реакции разложения.
Ответ:
Ниже приведены некоторые важные области применения реакции разложения:
- Реакции разложения широко используются для извлечения металла.
- Реакция разложения вызывает шипение в бутылке содовой.
- Эта реакция очень полезна для разрушения опасных отходов.
- Также важно в пищеварительной системе человека переваривать пищу.
Вопрос 4: Что такое реакция электролитического разложения?
Ответ:
При пропускании электрического тока через водный раствор вещества может происходить электролитическое разложение.
Электролиз воды является хорошим примером реакции электролитического разложения.
Вопрос 5: Что такое реакция двойного разложения?
Ответ:
Реакция двойного замещения – это реакция между двумя соединениями, в которой положительный ион одной молекулы заменяется положительным ионом другого компонента. Один или несколько реагентов в реакции двойного разложения нерастворимы в растворителе, что является типом реакции двойного замещения.
Например, хлорид цинка и газообразный сероводород образуются при реакции сульфида цинка и соляной кислоты. Там сульфид цинка находится в твердом состоянии и не растворяется в водной среде.
Вопрос 5: Что такое реакция термического разложения?
Ответ:
Когда одно вещество расщепляется на два или более простых вещества при нагревании в химическом процессе, известном как термическое разложение.



 Живые тела также зависят от этих реакций для правильного функционирования, получения питательных веществ, пищеварения, роста и т. д. Когда мы видим функционирование нашего тела, все зависит от химических реакций. Пищеварение — это процесс расщепления молекул или пищи на более простые формы. Слюнные железы выделяют особое химическое вещество, называемое ферментом, которое способствует расщеплению. Крахмал пищи распадается на глюкозу в организме.
Живые тела также зависят от этих реакций для правильного функционирования, получения питательных веществ, пищеварения, роста и т. д. Когда мы видим функционирование нашего тела, все зависит от химических реакций. Пищеварение — это процесс расщепления молекул или пищи на более простые формы. Слюнные железы выделяют особое химическое вещество, называемое ферментом, которое способствует расщеплению. Крахмал пищи распадается на глюкозу в организме. ) + 6O 2 (AQ ). (г) + 6Н 2 O (l) + Heat
) + 6O 2 (AQ ). (г) + 6Н 2 O (l) + Heat  В реакции соединения вещество образуется в результате химического соединения, однако в реакции разложения вещество распадается на новые вещества.
В реакции соединения вещество образуется в результате химического соединения, однако в реакции разложения вещество распадается на новые вещества.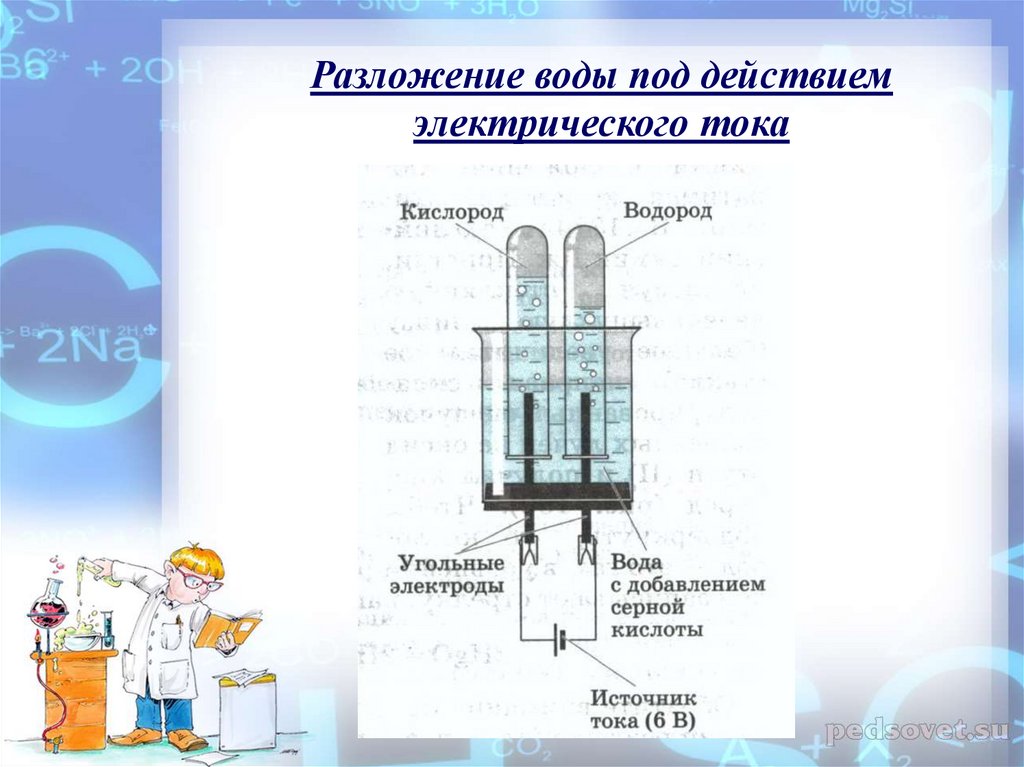 Электролиз воды является хорошим примером реакции электролитического разложения.
Электролиз воды является хорошим примером реакции электролитического разложения.