Элементы жизни. Вода — Рамблер/новости
27 мая 2018
Индикатор
Из чего состоят живые тела и при чем тут углерод? Что такое генетический код, кто такие вирусы, как устроено эволюционное древо и почему произошел кембрийский взрыв? Книга Сергея Ястребова «От атомов к древу: Введение в современную науку о жизни», вышедшая в издательстве «Альпина нон-фикшн» дает актуальные ответы на эти и многие другие вопросы. Публикуем главу из книги.
Фото: ИндикаторИндикатор
Что такое вода?
Видео дня
Вода — одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности,и ее очень много в живых организмах — гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе — например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
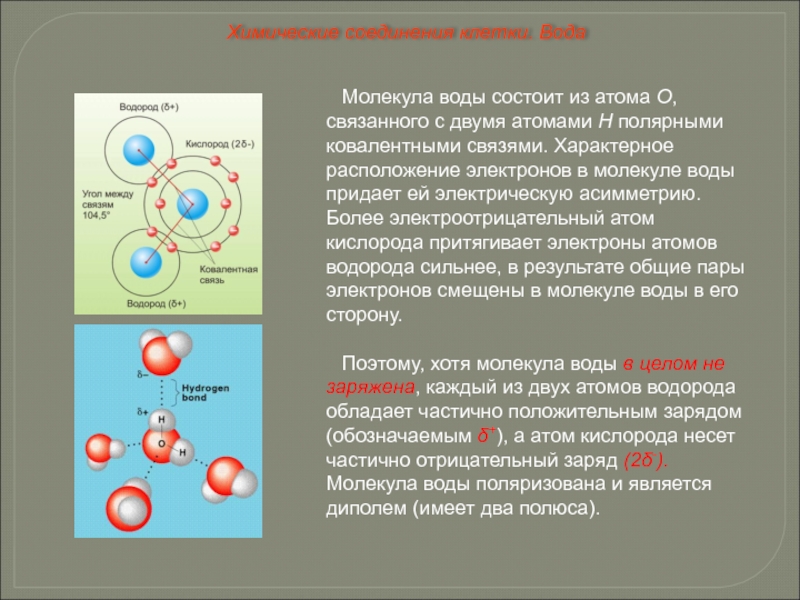
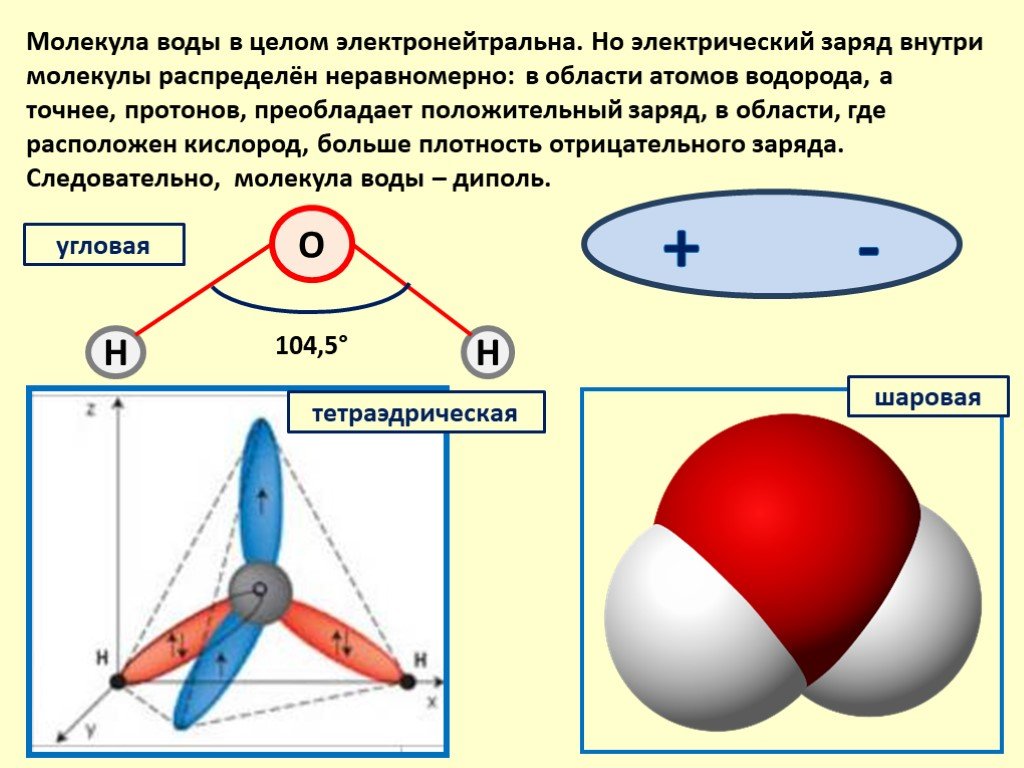
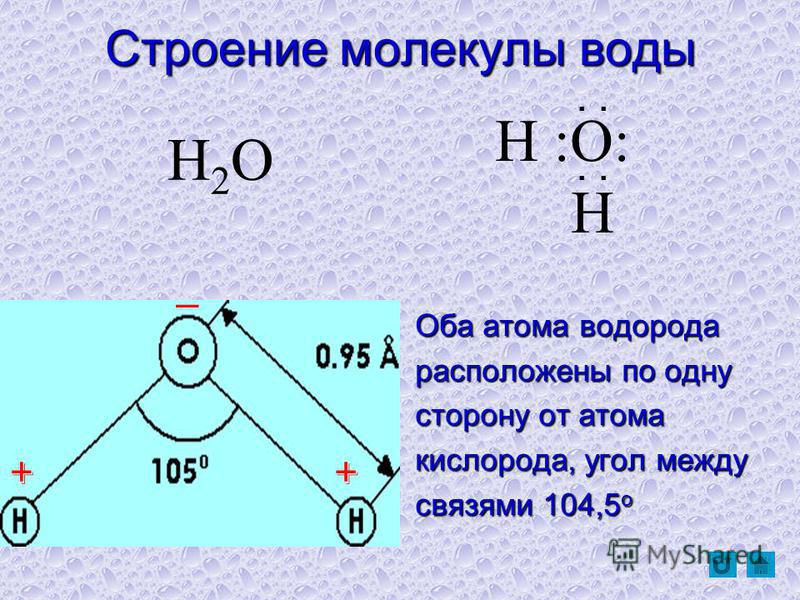
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O). Соответственно, химическая формула воды — h3O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H–O–H. Это эквивалентно формуле 2 которую обычно приводят в книгах.
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо «слипаются» друг с другом. Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху.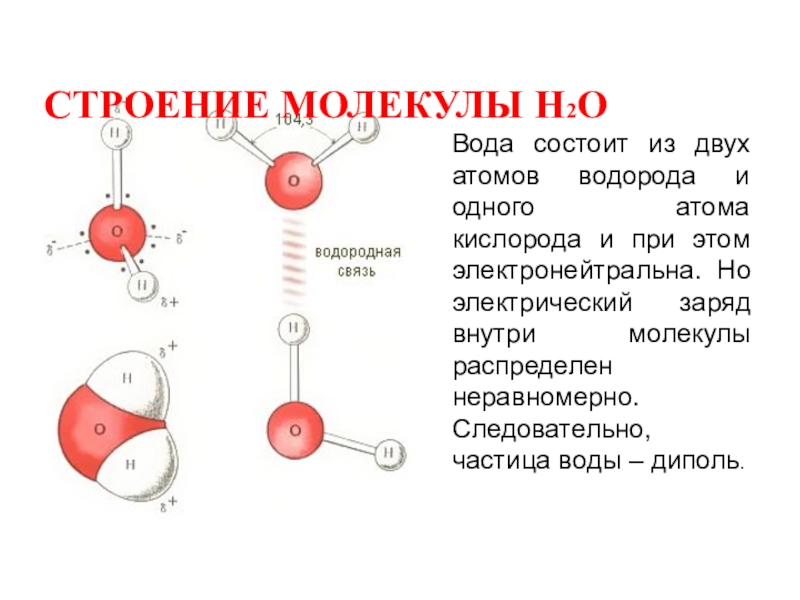 Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается.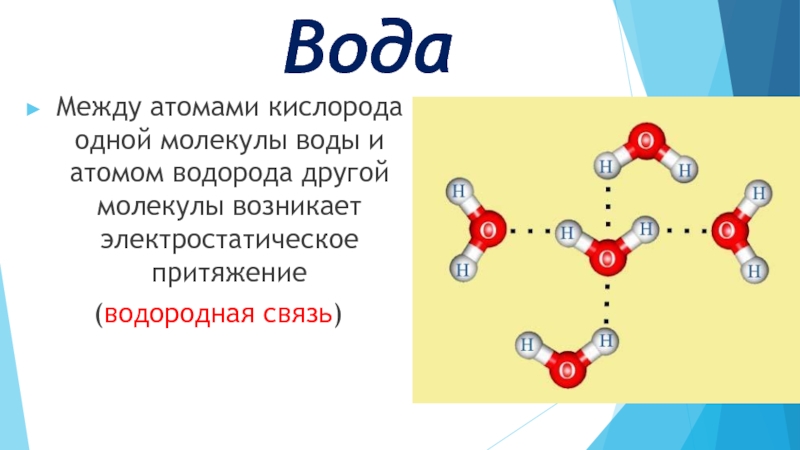 Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие лектроны смещены к нему.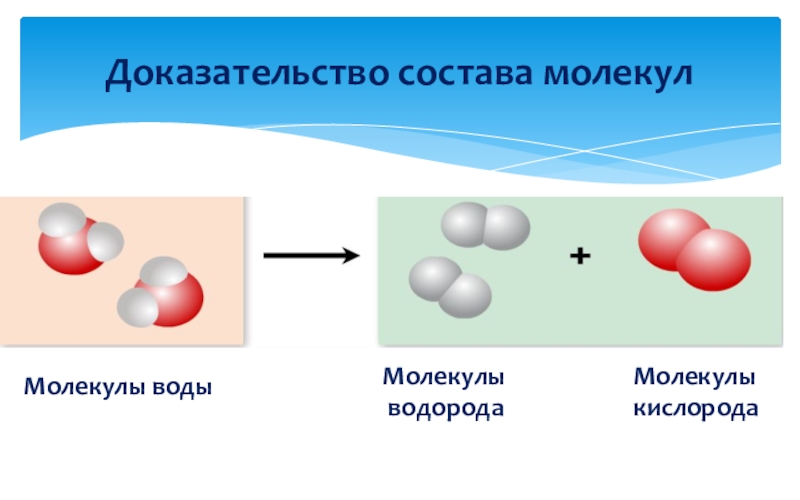 В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах одорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах одорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
А вот связь между углеродом и водородом (C–H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу.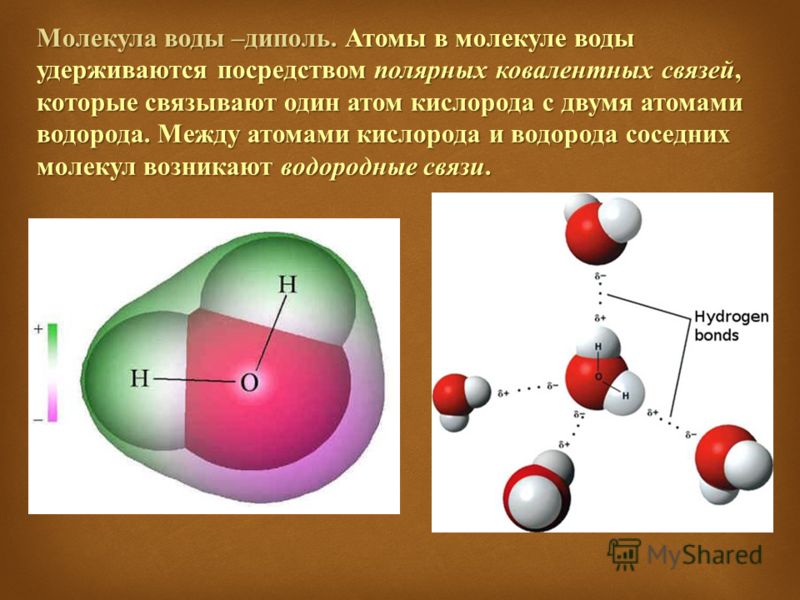 Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.
А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут» своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора — атомами водорода (несущими маленький положительный заряд δ+).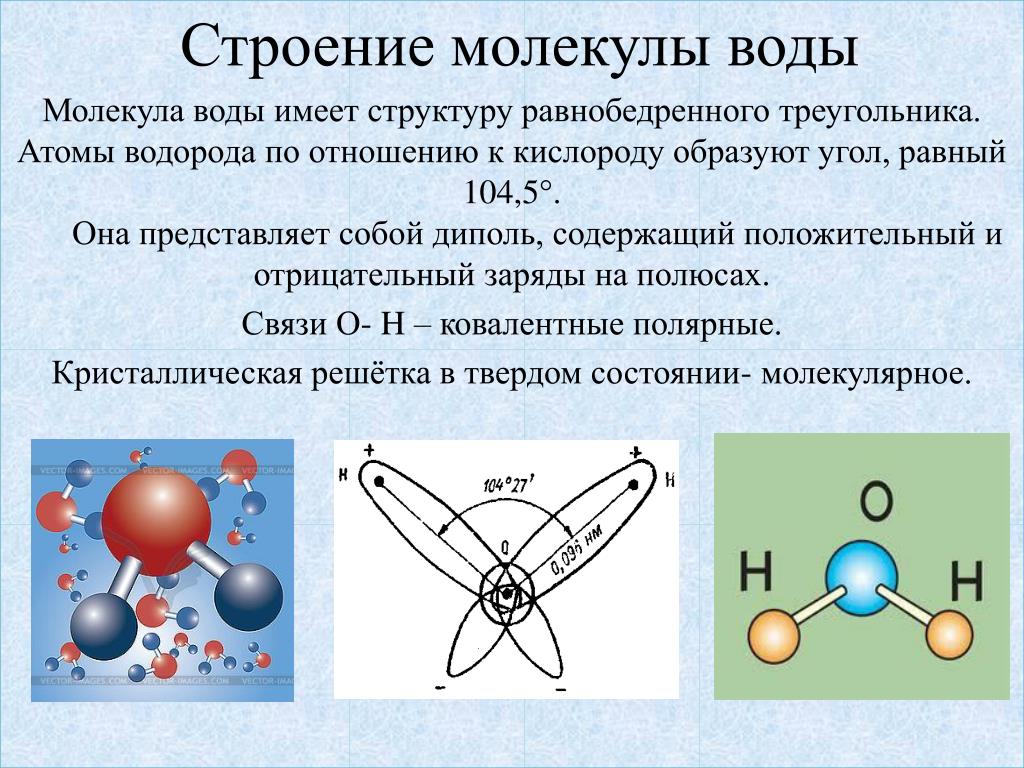 В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда,рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кисло- рода обычно образуются водородные связи. Например, молекула глюкозы (C6h22O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых «суперземлях» — планетах с массой, в несколько раз превосходящей массу Земли.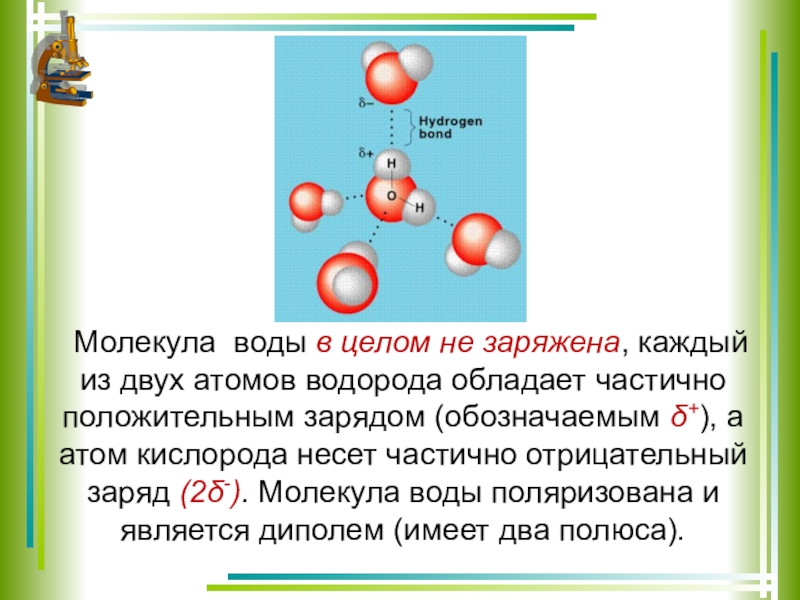 Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (Nh4). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода — ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт,или метанол (Ch4OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Зем- ля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя — сероводород, соединение водорода и серы с формулой h3S (она же H–S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени”.
Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь — на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна — Титане — есть угле- водородные озера и даже моря, состоящие из метана (Ch5),этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, «аш-фтор»). Водный раствор фтороводорода — очень агрессивное вещество, которое называется плавиковой кислотой (в сериале «Во все тяжкие», главный герой которого — химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Великий популяризатор науки Айзек Азимов — кстати говоря, биохимик по научной специальности — не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином «талассогены», что буквально значит «производящие море». По определению Азимова, талассоген — это вещество, способное сформировать планетарный океан. В замечательной книге «Асимметрия жизни» Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены — это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. «Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
«Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она — не единственная теоретически возможная. Изучая природу, всегда полезно помнить люби- мую мысль Станислава Лема: «Среди звезд нас ждет Неизвестное».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс. Новостей и читайте нас чаще.
Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Другое,Карл Саган,Иван Ефремов,Дмитрий Менделеев,Сергей Ястребов,Айзек Азимов,
Вода
Вода — это неорганическое соединение с химической формулой H20. Представляет собой прозрачную жидкость, без цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном— водяным паром.
Вода. Строение молекулы.
Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Самая простая модель молекулы воды предсталяет собой тетраэдр. На самом деле одиночные молекулы воды при нормальных температуре и давлении не существуют, все они соединены друг с другом водородными связями. Можно сказать, все молекулы связаны в одну пространственную сетку – макромолекулу. Каждая молекула воды может участвовать максимум в четырёх водородных связях (каждый атом водорода в одной и атом кислорода — в двух).
Вода имеет несколько химических названий: оксид водорода, монооксид дигидрогена, гидроксид водорода (соединение гидроксильной группы OH- и катиона H+), гидроксильная кислота (воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «кислотного остатка» OH- оксидан дигидромонооксид.)
Вода. Важные свойства.
Важные свойства.
Вода – самое необычное вещество природы. Это связано с тем, что свойства воды во многом не соответствуют физическим законам, которым подчиняются другие вещества. Рассмотрим какими удивительными физическими свойствами обладает вода. Большинство веществ находясь в твердом состоянии обладают более высокой плотностью чем в жидком. А вода наоборот в твердом состоянии (лед) обладает более низкой плотностью чем в жидком. Наибольшая плотность воды достигается при температуре +4оС, что обеспечивает жизнь в воде зимой. В замерзающих водоёмах, когда температура падает ниже +4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура. Еще одно аномальное свойство воды – расширение объема на 10% при замерзании обеспечивает плавание льда, и как следствие сохранение жизни подо льдом.
Важное свойство воды – это большое поверхностное натяжение (72мН/м при 25 ОС).
Так как у воды силы межмолекулярного взаимодействия очень велики, то каждая расположенная на поверхности воды молекула как бы втягивается внутрь слоя воды.
Вода это хороший растворитель полярных веществ. В связи со своими малыми размерами молекулы воды в большом количестве могут окружить каждую молекулу растворяемого вещества. Положительно заряженные части молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода.
Чистая вода (без примесей) — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация ионов гидроксония h4O+ и гидроксид-ионов HO- составляет 0,1 мкмоль/л. А так как вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту. Чем ниже будет уровень электропроводности, тем чище вода.
Вода сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул воды, она также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Вода медленно нагревается благодаря высокой теплоемкости, но процесс остывания происходит намного медленнее. Это дает возможность в летнее время года накапливать тепло на нашей планете посредством океанов и морей, а затем постепенно высвобождать тепло в зимний период. Таким образом, океаны и моря – это оригинальный и природный аккумулятор тепла на территории нашей планеты. Теплоемкость воды более чем в два раза превышает теплоемкость любого другого химического соединения, поэтому именно воду используют в качестве рабочего тела в энергетик.
Объяснитель урока: Свойства воды
В этом объяснителе мы научимся объяснять свойства полярной молекулы воды.
Вода имеет решающее значение для выживания всех организмов на нашей планете. Без надлежащего и устойчивого водоснабжения сельское хозяйство и промышленность не могли бы функционировать. Мы каждый день используем воду для приготовления пищи, уборки и питья.
Одна молекула воды состоит из одного атома кислорода и двух атомов водорода.
Между каждым атомом водорода и центральным атомом кислорода существует ковалентная связь. Итак, молекула имеет две химические связи, и угол между этими химическими связями равен 104,5∘. Молекулярная формула воды HO2.
Каждый элемент периодической таблицы имеет свойство, известное как электроотрицательность.
Определение: Электроотрицательность
Рассмотрим молекулу воды. Кислород более электроотрицателен, чем водород. Так, электроны ковалентных связей находятся ближе к атому кислорода и дальше от атомов водорода.
Мы можем видеть этот эффект на рис. 2. Оранжевые стрелки показывают, как электроны, образующие каждую ковалентную связь, притягиваются ближе к атому кислорода из-за его более высокая электроотрицательность.
Электроотрицательность кислорода больше, чем у водорода, вызывает отрицательное заряженные электроны располагаются ближе к атому кислорода. Чем ближе электроны, тем на атоме кислорода образуется частичный отрицательный заряд. Частичная оплата (𝛿+,𝛿−) в химии подобны полным зарядам ионов. Однако частичный заряд намного слабее полного заряда.
Ученые называют молекулы полярными, если они имеют постоянные частичные заряды. Есть некоторые исключения из этого, но нам не нужно исследовать это в этом объяснителе; мы можем сказать, что вода является полярной молекулой.
Определение: Полярная молекула
Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика. В полярной молекуле один конец молекулы слегка положительный, а другой конец слегка отрицательный.
В полярной молекуле один конец молекулы слегка положительный, а другой конец слегка отрицательный.
Пример 1. Использование электроотрицательности для объяснения того, почему вода является полярной молекулой
Одна молекула воды состоит из двух атомов водорода и одного атома кислорода. Какое из следующих утверждений объясняет, почему вода полярная молекула?
- Атомы водорода намного меньше атомов кислорода.
- Существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
- Между молекулами воды существуют межмолекулярные силы, известные как водородные связи.
- Электроотрицательность атомов водорода и атомов кислорода очень похожи.
- В каждой молекуле воды больше атомов водорода, чем атомов кислорода.
Ответ
Полярная молекула – это ковалентная молекула со значительной разницей в электроотрицательности между ее элементами. Эта разница в электроотрицательности означает, что молекула имеет постоянные частичные заряды.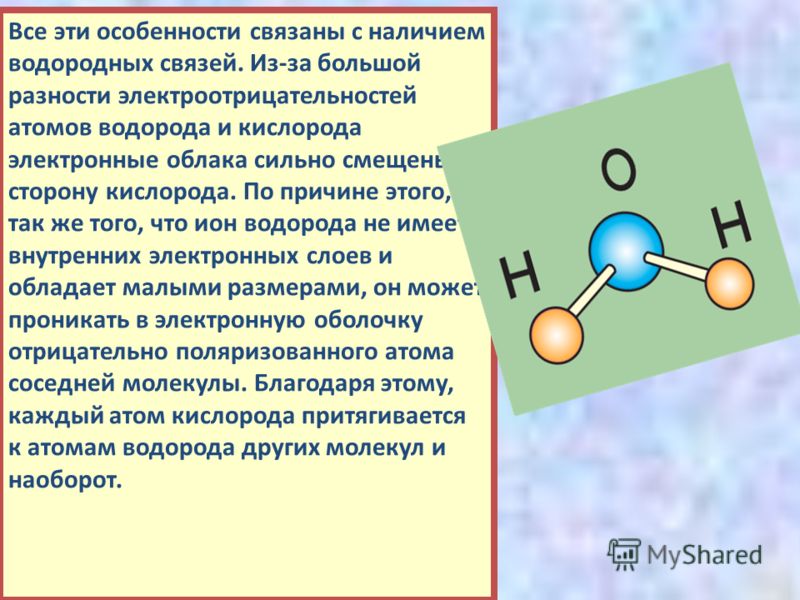
Кислород имеет гораздо более высокую электроотрицательность, чем водород. Пары связывающих электронов от двух ковалентных связей притягиваются ближе к атому кислорода.
Если мы посмотрим на ответы, мы увидим, что B — правильный ответ; существует большая разница в электроотрицательности между атомами водорода и атомами кислорода.
Пример 2. Определение частичных зарядов молекулы воды
Кислород более электроотрицателен, чем водород, и притягивает связь электроны в молекуле воды ближе к себе. 𝛿+ и 𝛿- используются для обозначения частичных зарядов в химии. На какой схеме правильно показаны парциальные заряды молекулы воды?
Ответ
Сила, с которой атом притягивает пару электронов, используемых для образования химической связи, измеряется электроотрицательностью. Поскольку кислород имеет более высокое значение электроотрицательности, чем водород, электроны, образующие ковалентные связи, притягиваются ближе к атому кислорода и удаляются от двух атомов водорода.
Следовательно, атом кислорода имеет частичный отрицательный заряд (𝛿-), и в результате два атома водорода имеют частичный положительный заряд (𝛿+).
Мы можем использовать эту информацию, чтобы определить, что правильный ответ — A.
Другой распространенной полярной молекулой является аммиак (Nh4). Аммиак представляет собой простую молекулу, состоящую из одного атома азота и трех атомы водорода. Как и кислород в молекуле воды, азот гораздо более электроотрицательный. чем водород, что приводит к частичным зарядам внутри молекулы.
Возвращаясь к нашему рассмотрению воды, постоянные частичные заряды в каждой молекуле воды вызывают слабое электростатическое притяжение между частичными зарядами соседних молекул воды. Эти притяжения также можно назвать межмолекулярными силами.
Мы называем это слабым электростатическим притяжением между молекулами воды водородными связями. Хотя мы используем слово

Водородные связи слабее ковалентных, но чрезвычайно важны при объяснении и описании физических свойств воды.
Если бы вы попытались представить себе миллиарды и миллиарды молекул воды, которые существуют в стакане воды, вы могли бы начать видеть, как водородные связи образуются и разрываются непрерывно, когда молекулы вращаются и перемещаются, сталкиваясь друг с другом и с контейнером. Этот Идея показана на рис. 5, где водородные связи показаны синими пунктирными линиями.
Химическая связь и силы межмолекулярного притяжения, о которых мы только что говорили, придают воде некоторые очень уникальные свойства. Например, на рис. 6 показаны примеры воды во всех трех состояниях: в виде жидкости в океане, в виде твердого льда в айсберге и, хотя мы этого не видим, в виде водяного пара в воздухе и облаках.
Рисунок 6 : Различные состояния воды. Вода — полярная молекула; как таковые, другие полярные соединения могут растворяться в воде, образуя растворы. По этой причине мы можем описать воду как полярный растворитель.
По этой причине мы можем описать воду как полярный растворитель.
Такие вещества, как сахар, являются полярными веществами и растворяются в воде. Кроме того, ионные вещества, такие как соль, содержащие заряженные ионы, растворяются в полярных веществах. Нам нужно только подумать о соли в океанах или в чашке чая, чтобы понять, что мы имели непосредственный опыт этих примеров.
Неполярное вещество – это вещество, не содержащее частичных зарядов, поскольку разница в электроотрицательности между элементами атомов в молекулах очень мала.
Определение: неполярная молекула
Неполярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле очень мала.
Однако неполярные растворители, такие как растительное масло, не растворяются в воде, и при добавлении в воду они разделяются на два слоя.
Рисунок 7 : Смесь масла и воды. Вода является превосходным полярным растворителем для большинства ионных веществ, таких как соль, и некоторых ковалентных соединений, таких как сахар, которые образуют водородные связи с молекулами воды.
Пример 3: Наименование растворителей, растворяющих ионные вещества
Как называется растворитель, такой как вода, способный растворять ионные вещества, такие как соль?
- Полярный растворитель.
- Неполярный растворитель.
- Электростатический растворитель. Ионы имеют положительный и отрицательный заряд. Когда заряд распределяется таким образом в химии, это называется полярностью.
Некоторые другие вещества без ионного заряда все еще имеют частичный заряд и также называются полярными. Например, вода представляет собой полярную молекулу.
Мы можем использовать стакан с водой, чтобы растворить столовую ложку хлорида натрия. Вещество, которое может растворять полярные вещества, такие как ионные соли, известно как полярный растворитель, поэтому правильный ответ — А, полярный растворитель.
Водородные связи между молекулами воды также существенно влияют на температуры кипения и плавления воды. вода. Давайте на минутку сравним воду с другим соединением: сероводородом (HS2).
 Водород
сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.
Водород
сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.Сера находится в 16-й группе периодической таблицы, как и кислород, поэтому можно предположить, что точки плавления и кипения очень похожи. Однако, как показано в таблице 1, температуры плавления и кипения воды и сероводорода сильно различаются!
Таблица 1 : Температура плавления и кипения воды и сероводорода.
Соединение Температура плавления (∘C) Температура кипения (∘C) HO2 0 100 HS2 −82 −60 Из приведенной выше таблицы видно, что для разделения молекул воды при плавлении и кипении требуется больше энергии. Эта дополнительная энергия необходима для преодоления водородных связей, существующих между отдельными молекулами воды. Молекулы сероводорода не могут образовывать водородные связи, так как разница в электроотрицательности между серой и водородом недостаточно велика.

Еще одной замечательной характеристикой воды является ее плотность в твердом состоянии, известном как лед. Большинство веществ плотнее, когда они находятся в твердом состоянии; однако вода менее плотная. Когда жидкая вода остывает до температуры ниже 4∘C, молекулы воды образуют большие шестиугольные кристаллы из-за более длинных водородных связей между отдельными молекулами. Когда жидкость замерзает при 0∘C, эти крупные гексагональные кристаллы полностью сформированы, а более длинные водородные связи создают относительно большое пространство между молекулами.
Мы знаем, что плотность — это способ выразить количество массы в данном объеме, а когда вода принимает форму твердого льда, лед имеет меньшую массу, чем тот же объем жидкой воды; следовательно, вода становится менее плотной по мере замерзания и превращается в лед. Мы можем видеть более длинные водородные связи и шестиугольное расположение молекул воды во льду на рисунке ниже.
Пример 4: Сопоставление состояния вещества воды с ее структурным устройством
На рисунке показаны молекулы воды в однородном фиксированном гексагональном расположении, созданном водородными связями.

В каком состоянии вещества вы ожидаете найти воду, если она находится в таком структурном расположении?
- Лед (твердый)
- Вода (жидкий)
- Пар (газ)
Ответ
Молекулы воды образуют большие шестиугольные кристаллы, когда жидкая вода замерзает при 0∘C. Эти шестиугольные кристаллы образуются из-за существования водородных связей между отдельными молекулами.
В жидком состоянии отдельные молекулы воды могут свободно двигаться и вращаться с помощью водородных связей, постоянно образуя и разрывая связи между различными молекулами.
В газообразном состоянии молекулы водяного пара можно рассматривать как независимые единицы с небольшим взаимодействием.
Если мы сравним эти три описания с диаграммой выше, мы увидим, что правильный ответ — A, лед (твердый).
Это уменьшение плотности при замерзании воды объясняет расширение льда при замерзании воды. При замерзании воды масса воды конечно не меняется, но объем увеличивается, и, следовательно, плотность должна уменьшиться.
Рисунок 10 : Вода заполняет трещины в скале и замерзает, а расширение льда разрушает скалу. Рисунок 11 : Напитки замерзают и расширяются в морозильной камере, разрывая контейнеры. Расширение льда при замерзании воды является причиной
для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также
будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере!
Расширение льда при замерзании воды является причиной
для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также
будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере!Пример 5: Объяснение того, почему лед плавает на воде
Какая из следующих последовательностей утверждений правильно описывает, почему лед плавает на воде?
- 1
- 5
- 2
- 4
- 3
Ответ
Итак, мы можем начать отвечать на этот вопрос, заявив, что когда вода замерзает, она становится льдом, поэтому мы знаем, что ответ C неверен.
Благодаря водородным связям, существующим между молекулами воды, вода обладает некоторыми уникальными физическими свойствами.
 Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.
Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.Теперь мы видим, что ответ E также неверен.
При замерзании воды количество воды и, следовательно, ее масса не изменяются, но поскольку вода при замерзании расширяется и становится льдом, ее объем увеличивается. Имея эту информацию, мы теперь можем исключить ответ D.
Если какое-либо вещество трансформируется, чтобы иметь больший объем, но ту же массу, то плотность уменьшится. В случае воды это делает лед менее плотным, поэтому правильный ответ — A.
Морская вода содержит соль, и эта соль влияет на ее плотность. В районах океана, где концентрация соли ниже, например, на Северном и Южном полюсах, плавать труднее, поскольку труднее создать силу против менее плотной жидкости.
Рисунок 12 : Мужчина плавает в (сильно) соленой морской воде Мертвого моря. Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без каких-либо усилий!
Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без каких-либо усилий!Мы начнем завершать это объяснение с рассмотрения некоторых химических свойств воды. Вода является нейтральным соединение и не проявляет никаких кислотных или основных свойств. Мы можем проверить это с помощью лакмусовой бумажки. Красный или синий лакмус не меняет цвет, если он находится в воде.
Мы можем разложить воду на водород и кислород, используя процесс, известный как электролиз. Во время электролиза мы используем электричество для разрыва связей в химических соединениях. Когда мы явно проводим электролиз воды, мы используем уникальное научное оборудование, известное как вольтаметр Хофмана.
Вольтаметр Хофмана наполнен водой, которую мы подкислили, добавив небольшое количество разбавленной серной кислоты.
 Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролиз
Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролизНа рисунке 14 ниже мы видим вольтаметр Гофмана. Обратите внимание, что газообразного водорода было произведено в два раза больше, чем газообразного кислорода.
Давайте внимательно посмотрим на атомы в этой химической реакции. Нам легко понять, почему мы получаем в два раза больше газообразного водорода, чем кислорода. произведенный газ. На рис. 15 показано, как атомы в двух молекулах воды перестраиваются, образуя две молекулы газообразного водорода и одну молекулу газообразного кислорода. при электролизе воды.
Вода — удивительная молекула со многими необычными характеристиками. Многие из его свойств обусловлены тем, что он является полярной молекулой и существованием водородных связей между молекулами.

Подведем итог тому, что мы узнали о свойствах воды.
Ключевые моменты
- Вода является жизненно важным ресурсом.
- Один атом кислорода и два атома водорода составляют одну молекулу воды.
- Кислород более электроотрицателен, чем водород.
- Полярная молекула представляет собой ковалентную молекулу, в которой разница в электроотрицательности между элементами в молекуле относительно велика.
- На молекуле воды существуют постоянные частичные заряды, что делает молекулу полярной.
- Между молекулами воды существует электростатическое притяжение, известное как водородные связи.
- Вода может существовать в виде жидкости, куска твердого льда и газообразного пара.
- Вода является полярным растворителем, и другие полярные соединения могут растворяться в воде и образовывать растворы.
- Вода имеет высокие температуры плавления и кипения из-за водородных связей между молекулами воды.
- Вода образует шестиугольные кристаллы, когда замерзает и становится льдом.

- Лед менее плотный, чем вода.
- Вода нейтрально действует на синюю и красную лакмусовые бумажки.
- Электролиз может быть использован для разложения воды на кислород и водород.
- Вольтаметр Хофмана используется для электролиза подкисленной воды.
- При электролизе подкисленной воды образуется в два раза больше газообразного водорода, чем газообразного кислорода.
Simply Complex > News > USC Dornsife
Формула проста, но h3O — одно из самых замечательных веществ во Вселенной.
Это что-то вроде загадки: соединение, состоящее всего из двух химических элементов, один из которых является самым простым в известной вселенной. Пара атомов водорода, крепко держащаяся за один атом кислорода, создает обманчиво минималистское устройство, которое противоречит его огромной универсальности и важности.
Ценность воды как ресурса общеизвестна. Без постоянного снабжения цивилизация, какой мы ее знаем, не существовала бы.

Но как вещество — как молекула — вода ускользает от чувства удивления большинства людей. Что очень плохо, на самом деле, потому что это весьма примечательно.
Формованная и связанная
Основная молекулярная формула воды, H₂O, предполагает простую структуру из трех атомов на прямой линии. Но физические свойства трех атомов требуют другого расположения — V-образной формы с кислородом в конце. Эта нелинейная форма превращает воду в замечательную субстанцию с поразительными способностями.
Форма «V» возникает из-за расположения электронов в молекуле, которое вызывает дисбаланс электрического заряда, при этом кислородная точка «V» немного более отрицательна, чем противоположный конец возле атомов водорода. Это небольшое разделение означает, что молекулы воды поляризованы — один полюс положительный, а другой отрицательный.
Полярность электрического заряда лежит в основе удивительных свойств воды. Слегка отрицательный конец одной молекулы воды притягивает слегка положительный конец другой и наоборот, что ученые называют водородной связью.

Водородные связи между молекулами воды исключительно прочны, что дает им склонность цепляться друг за друга, поведение, которое чаще всего проявляется как поверхностное натяжение. Например, вода в наполненном до краев сосуде выглядит выпуклой, если смотреть сбоку из-за поверхностного натяжения. А некоторые существа, такие как водомерки, могут использовать поверхностное натяжение, чтобы скользить по поверхности прудов.
Водородные связи также позволяют воде прилипать к посторонним веществам. Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Полярная природа воды и ее форма делают ее легче в твердом состоянии, чем в жидком. Это потому, что молекулярные V образуют воздушные кристаллические структуры при замерзании, делая лед менее плотным, чем его жидкая форма. Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.

Водородные связи воды также приводят к другой важной характеристике — более высокой, чем ожидалось, температуре кипения, объясняет Джессика Парр, профессор (преподавание) химии. Парр получила докторскую степень по химии в USC Dornsife в 2007 году и с тех пор преподает общую химию студентам. Ее диссертационное исследование было сосредоточено на понимании того, как водородные связи реагируют на воздействие интенсивного света.
«Если бы вода не была способна образовывать такие прочные водородные связи, она бы кипела при температуре минус 200 градусов по Цельсию, — объясняет Парр.0069 замерзание 0 градусов по Цельсию. Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Универсальный растворитель
Полярная природа воды также делает ее исключительным растворителем, способным растворять самые разные вещества.

«Мы называем его «универсальным растворителем», потому что он может растворять не все, а очень многое», — говорит Парр. «Многие другие молекулы разборчивы в том, с чем они взаимодействуют и как они работают вместе, но вода будет взаимодействовать практически со всем».
Например, его положительные и отрицательные центры притягивают и легко разводят заряженные атомы, называемые ионами, из которых состоят такие соли, как хлорид натрия, обычно используемый в кулинарии. Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.
Но вода также может растворять вещества, не состоящие из ионов, например сахара. Однако вместо того, чтобы разделять отдельные атомы молекулы сахара, молекулы воды прокладывают себе путь между каждой молекулой сахара, находя слабо заряженные части для водородной связи. Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.

«Пока присутствует один атом, который заставляет другую молекулу взаимодействовать с водой, вода будет это делать», — говорит Парр.
Становится странно
Вода не всегда ведет себя так, как ожидалось. Хотя он чаще всего переходит из твердого состояния (льда) в жидкое, а затем в газообразное (пар или пар) и наоборот, когда его температура поднимается и падает, он может совершить прыжок прямо из льда в пар при правильных условиях.
«Если вы когда-нибудь замечали, что ваши кубики льда со временем становятся меньше, то это потому, что они сублимируются в морозильной камере — лед сразу превращается в газ», — объясняет Парр. Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
В обратном процессе, называемом отложением, газообразная вода внезапно замерзает, так и не превратившись в жидкость. Так образуется снег. А при подходящих условиях снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, где таяние снежного покрова является источником воды.

Но вода может быть еще более странной.
«Лед имеет множество различных кристаллических форм, но он также может существовать в форме, напоминающей стекло — аморфное твердое вещество, которое находится где-то между жидкостью и твердым телом и все еще может течь», — говорит Парр. По словам Парра, когда молекулы воды сливаются при очень низких температурах и давлениях — представьте себе космическое пространство — образующийся лед также может вести себя как стекло. Ученые подозревают, что это может быть одна из самых распространенных форм воды во Вселенной.
Тайны и чудеса продолжаются
Несмотря на широкое распространение во Вселенной и на Земле, а также на давнее знакомство людей с водой, вода продолжает удивлять.
Ученые недавно обнаружили форму под названием «суперионный лед». Существуя при чрезвычайно высоком давлении, например, в ядре планет, он, по-видимому, играет роль в поддержании магнитных полей Земли.
И хотя вода в чистом виде не является электрическим проводником, она ведет себя неожиданно при воздействии электрического поля.




 Водород
сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.
Водород
сульфид очень похож на воду; он имеет атом серы вместо атома кислорода.

 Расширение льда при замерзании воды является причиной
для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также
будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере!
Расширение льда при замерзании воды является причиной
для явлений физического выветривания, таких как замораживание-оттаивание, показанное на рисунке 9.. Это может также
будьте свидетелями дома, когда бутылки с напитками взрываются в морозильной камере! Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.
Когда вода замерзает и превращается в лед, образуются более длинные водородные связи, поскольку молекулы воды образуют шестиугольные кристаллы. Эти шестиугольные кристаллы имеют относительно большое пространство между собой из-за более длинных водородных связей и заставляют воду расширяться.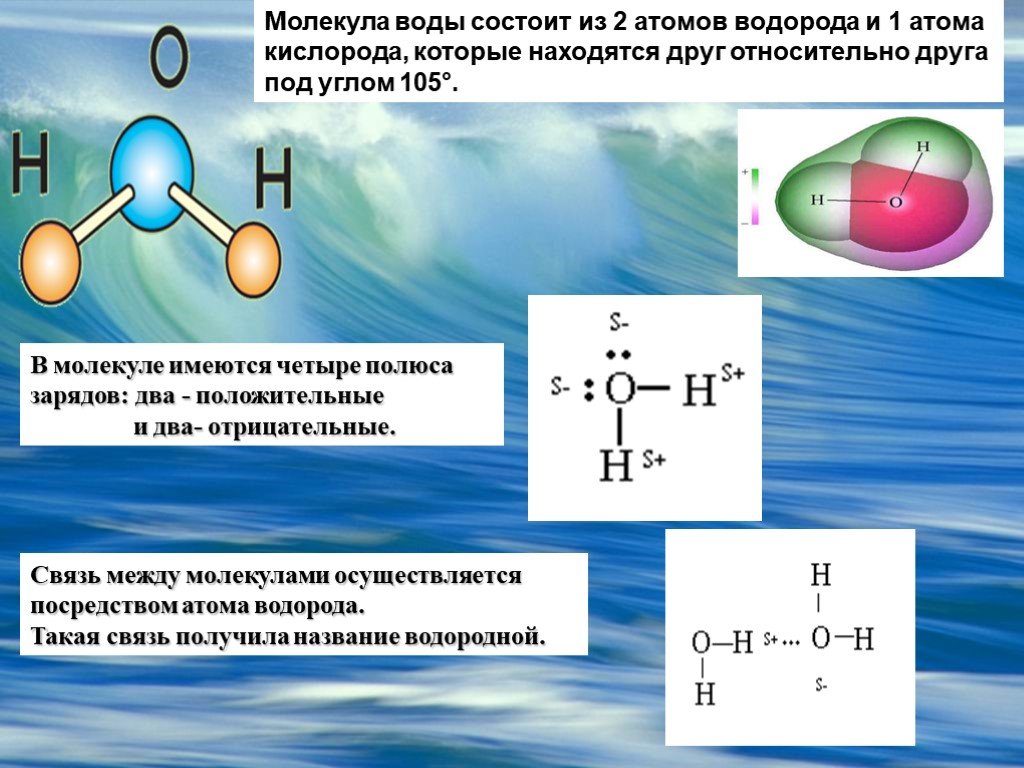 Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без каких-либо усилий!
Напротив, есть некоторые места, такие как Мертвое море в Западной Азии, где концентрация соли настолько высока, что люди могут плавать практически без каких-либо усилий! Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролиз
Добавление кислоты улучшает его проводимость. К вольтаметру присоединяют блок питания, и через подкисленную воду пропускают постоянный ток. Затем вода разделяется в соответствии с
следующее химическое уравнение:
2HO()2H()+O()222lggводаводородкислородэлектролиз