ИАиЭ — Загадка молекулярной структуры воды
03.07.2019 Международная группа учёных разбиралась, как происходит вращение молекулы воды и каковы её критические свойства и локальная структура. Как двигается молекула в поле рентгеновского излучения и какова структура жидкостей — всё это нужно для понимания механизмов взаимодействия излучения с веществом и структурой сложных молекулярных систем. Так, наблюдая за молекулярным движением, ученые используют динамический вращательный эффект Доплера. Наличие изолированных колебательных состояний в Оже-переходах даёт уникальный способ изучения индуцированного молекулярного вращения. Теоретические предсказания подтверждаются на практике. При помощи современных синхротронов и экспериментальной методики есть возможность изучать сверхбыстрое молекулярное вращение во льду, в газообразном и жидком состоянии воды. Применяя Оже-спектроскопию и рентгеновскую фотоионизацию, специалисты рассматривают поведение молекул воды при высоких энергиях фотонов. Фарис Хафизович Гельмуханов – доктор физ-мат. наук, ведущий научный сотрудник, профессор Института нанотехнологий, спектроскопии и квантовой химии Сибирского федерального университета (г. Красноярск), приглашенный исследователь, профессор отделения теоретической химии и биологии Королевского технологического института в Стокгольме (Швеция). Выпускник Новосибирского государственного университета, бывший сотрудник Института автоматики и электрометрии (г. Новосибирск) – рассказал об актуальных исследованиях по изучению атомных связей в молекуле воды, которые проходили в сотрудничестве с зарубежными специалистами, использующими новейшее оборудование. Ряд исследований международной команды ученых представлен несколькими значимыми публикациями. Например, в статье, опубликованной в Proceedings of the National Academy of Sciences of the United States ofAmerica, vol. Фарис Гельмуханов пояснил, как меняется молекулярная ориентация, в частности, как возникает индуцированная отдача молекулярного вращения и каковы отличительные особенности Оже-спектров молекулы:
«Эффект Допплера имеет место для любых волн – звуковых волн, волн на воде, фотонов, электронов и так далее. Эффект Допплера мы наблюдаем и в повседневной жизни: если машина скорой помощи с включённой сиреной приближается к вам, вы слышите высокую частоту. Как только автомобиль проедет мимо – вы слышите низкий звук (см. Рис. 1). Поскольку молекулы двигаются, эффект Допплера можно наблюдать и по характерному сдвигу частоты или энергии испущенного фотона или электрона. Важно отметить, что эффект Допплера можно наблюдать как при поступательном движении молекул, так и при их вращении (вращательный эффект Допплера). Профессор выделяет два ключевых момента исследованного явления: «Первый момент заключается в переводе молекулы в состояние сверхбыстрого вращения. Для этого исследователи ионизовали молекулу CO фотонами большой энергии (около 10 кэВ). Подобно снаряду, вылетевший из атома углерода быстрый фотоэлектрон, сообщил этому атому момент импульса. В результате этой отдачи, молекуле была сообщена большая скорость вращения с характерной вращательной температурой, близкой к температуре на поверхности солнца (10 000 K)».
«Следует отметить, что фотоэлектрон с той же самой вероятностью влетает в противоположную сторону. Тем самым у нас будут молекулы сверхбыстрого вращения в противоположную сторону. Mы детектировали это вращение, измеряя энергию испущенного Оже-электрона Вращение молекулы сдвигает энергию Оже-электрона в сторону увеличения или уменьшения. Это зависит от направления вращения. Taк как у нас половина молекулы крутится в одну сторону, а другая половина в противоположную сторону, то Оже-резонанс расщепляется на два пика (см. Рис. 3a), – поясняет профессор Гельмуханов и продолжает далее – Нo молекула, благодаря этому сверхбыстрому вращению, могла успеть повернуться на заметный угол за короткое время (порядка 8 фемтосекунд) рентгеновского процесса Второй ключевой момент работы, по словам Фариса Гельмуханова, заключается «в детектировании этого угла поворота.
В этой работе по изучению Динамического эффекта Допплера воды участвовали теоретики и экспериментаторы. Группу теоретиков возглавил профессор Фарис Гельмуханов. Эксперимент был выполнен на синхротроне SOLEIL (Париж, Франция). Следующий этап исследований был посвящен изучению локальной структуры жидкой воды. Pезультаты этой работы опубликованы в престижном журнале Proceedings of the National Academy of Sciences of the United States of America, vol. 116 (10) 4058-4063 (2019). По словам Фариса Гельмуханова, «общепринято, что вода состоит из молекул Н2О, объединенных в группы так называемыми водородными связями (ВС). Hе связанные в кластеры молекулы воды присутствуют в ней лишь в небольшом количестве. Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединения. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F». Суть исследований помог понять профессор Гельмуханов: «Существует две модели жидкой воды. Большинство экспериментальных данных указывает на то, что вода является однородной, c плотностью 1г\см3. Несмотря на это, многие ученые думают, что вода есть флуктуирующая смесь кластеров двух типов, в одном их которых молекулы связаны друг с другом водородной связью как во льду, а в другом связи нарушены. Благодаря чему эти кластеры более плотные. Наши недавние теоретические и экспериментальные исследования показали, что жидкая вода все-таки является однородной». Как сообщил Фарис Гельмуханов, «было проведено два типа экспериментов: во-первых, измерение рентгеновских спектров поглощения (RSP) газообразной воды, жидкой воды и льда в широком диапазоне энергии. Измерение RSP вдали от порога ионизации 1S электрона атома кислорода в воде было необходимо, чтобы откалибровать по интенсивности RSP паров воды, жидкой воды и льда (в этой области RSP всех трёх фаз воды строго совпадают). Во втором случае измерялся спектр резонансного неупругого рассеяния рентгеновского излучения (PHPPИ) газообразной и жидкой водой. Для этого использовался спектрометр SAXES на пучке рентгеновских фотонов “ADRESS” синхротрона “Swiss Light Source” в Швейцарии. Что представляет собой PHPPИ метод? Как объяснил профессор, «резонансноe неупругоe рассеяниe рентгеновского излучения может приблизительно рассматриваться как 2-этапный процесс. Далее, экспериментальный материал был детально проанализирован теоретиками при помощи соответствующих расчетов и опубликован в престижном международном журнале Nature Communications 10: 1013 (2019). Здесь акцент ставится на прочности водородной связи в жидкой воде, а в основе лежат показания, снятые при помощи метода PHPPИ. Фарис Гельмуханов подробно прокомментировал основные положения этого исследования: «Mногие ученые считают, что вода есть флуктуирующая смесь кластеров двух типов (лёгкая и тяжёлая фракции), в одном из которых молекулы связаны друг с другом, как во льду, а в другом связи нарушены, благодаря чему эти кластеры более плотные. Как заверил профессор Гельмуханов, «эксперименты привели к неожиданному результату и показали, что точно такое же расщепление присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе, где очевидно водородная связь отсутствует и вопрос о легкой и тяжелой фракциях не возникает.
Вторым не менее важным результатом данной работы, по словам российского ученого, является «извлечение из эксперимента более детальной структурной информации, а именно, как влияет водороднaя связь (ВС) на силу OH связи. Колебательная инфракрасная (ИК) спектроскопия является общепринятым инструментом для исследования ВС в жидкостях. Однако в жидкостях ИК-спектроскопия исследует лишь наиболее интенсивный переход в первое колебательное состояние, которое “слабо чувствует” межмолекулярное взаимодействие (см. Итак, «PHPPИ даёт уникальную возможность исследовать ВС, а именно, извлечь из экспериментального спектра количественную информацию o влиянии соседних молекул через ВС на потенциал взаимодействия OH связи. В этой многоаспектной работе по изучению структуры жидкой воды участвовало две группы: теоретики и экспериментаторы. Группу теоретиков возглавлял профессор Фарис Гельмуханов. Сюда вошли специалисты из разных научных учреждений, в частности, из Королевского технологического института (Стокгольм), Стокгольмского университета и российские ученые Сибирского федерального университета (доктор Сергей Полютов и аспирантка Нина Игнатова). Руководителем экспериментальной группы был профессор Александр Фёxлиш (Alexander Föhlisch) из Института методов и приборов для исследования синхротронного излучения (Берлинский центр материалов и энергии имени Гельмгольца, Берлин, Германия). Важно, что вторая практическая работа, выводы которой обнародованы в Proceedings of the National Academy ofSciences of the United States of America, vol. 116 (10) 4058-4063 (2019), выполнена на двух синхротронах: это Европейская установка синхротронного излучения “European Synchrotron Radiation Facility” в Гренобле (Франция) и “Swiss Light Source” в Швейцарии. По замечанию профессора Гельмуханова, “Swiss Light Source «уникальный спектрометр, который обладает в настоящее время лучшим в мире пo спектральному разрешению. Поэтому мы измеряем на нем, чтобы увидеть в PHPPИ-спектре колебательную структуру воды в жидкой фазе, связанную с колебаниями OH-связи в молекуле воды». Итогом длительной работы ученых стало обнаружение нового физического эффекта – Динамического вращательного эффекта Допплера, а также детальное исследование роли структуры и ядерной динамики на рентеновские спектры паров воды, жидкой воды и льда. Олеся Фарберович
Источники: Загадка молекулярной структуры воды – Научная Россия (scientificrussia.ru), Москва, 29 июня 2019.
Материал в формате pdf |
Вода в жизни организмов. Урок 5
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
Содержание
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
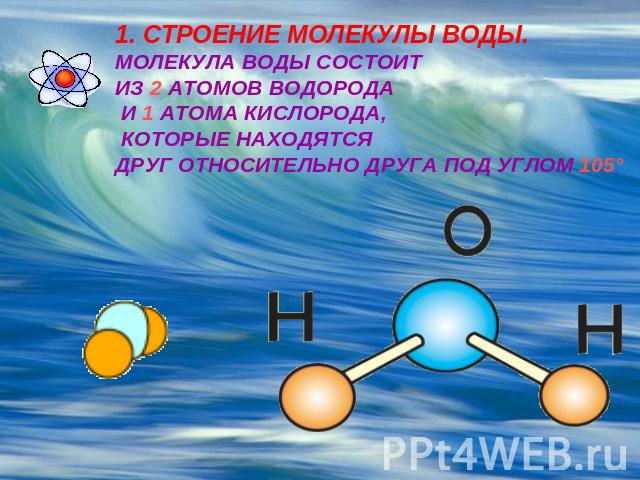
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью.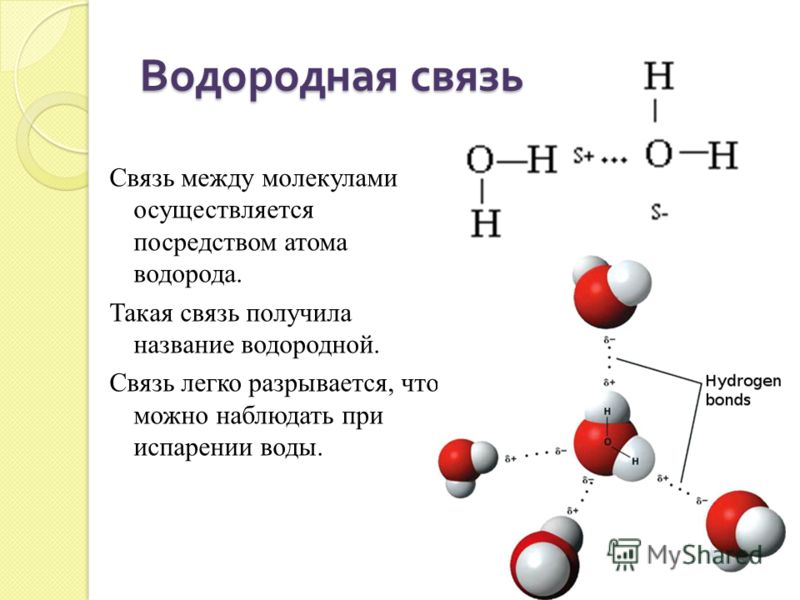 Химическая формула: H₂O
Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.
Молекула воды, картинка № 1
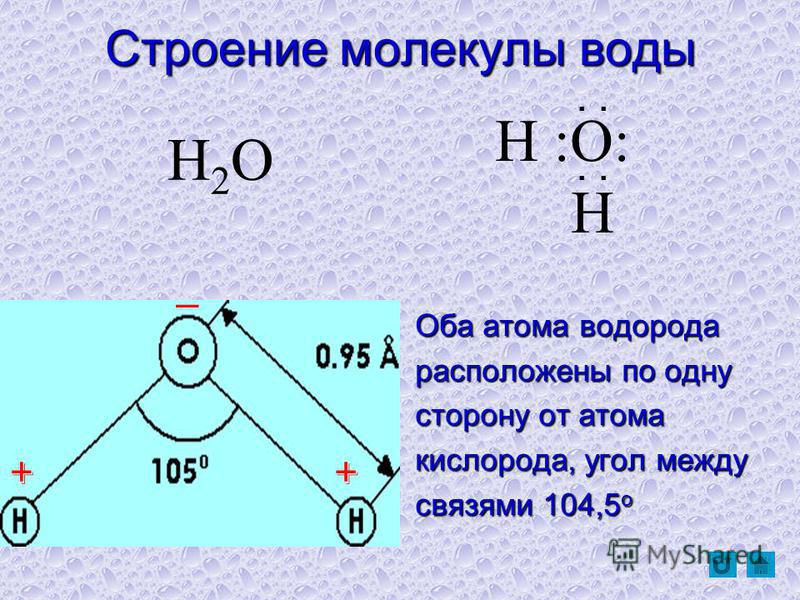
По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода.Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
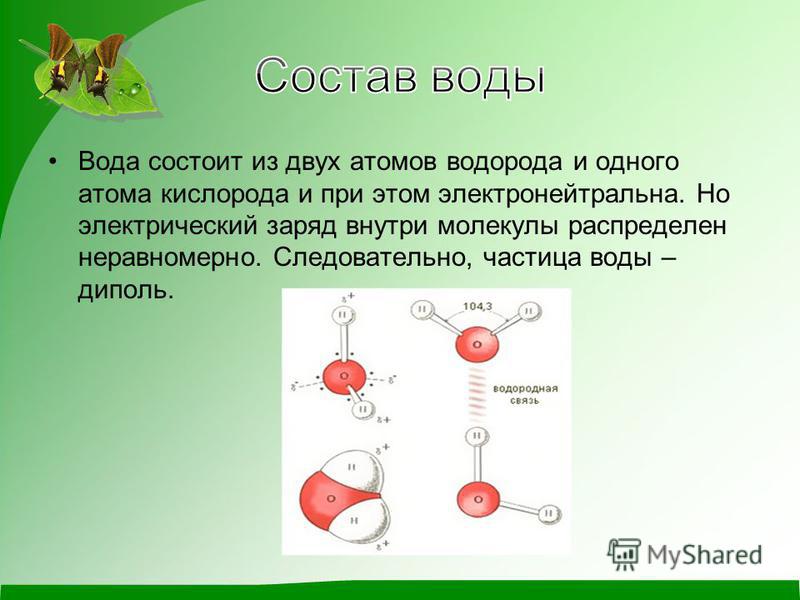
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫМолекула представляет собой совокупность атомных ядер и электронов , что является достаточно устойчивым , чтобы обладать наблюдаемыми свойствами — и есть несколько молекул , которые являются более стабильными и трудно разлагаются , чем H 2 O.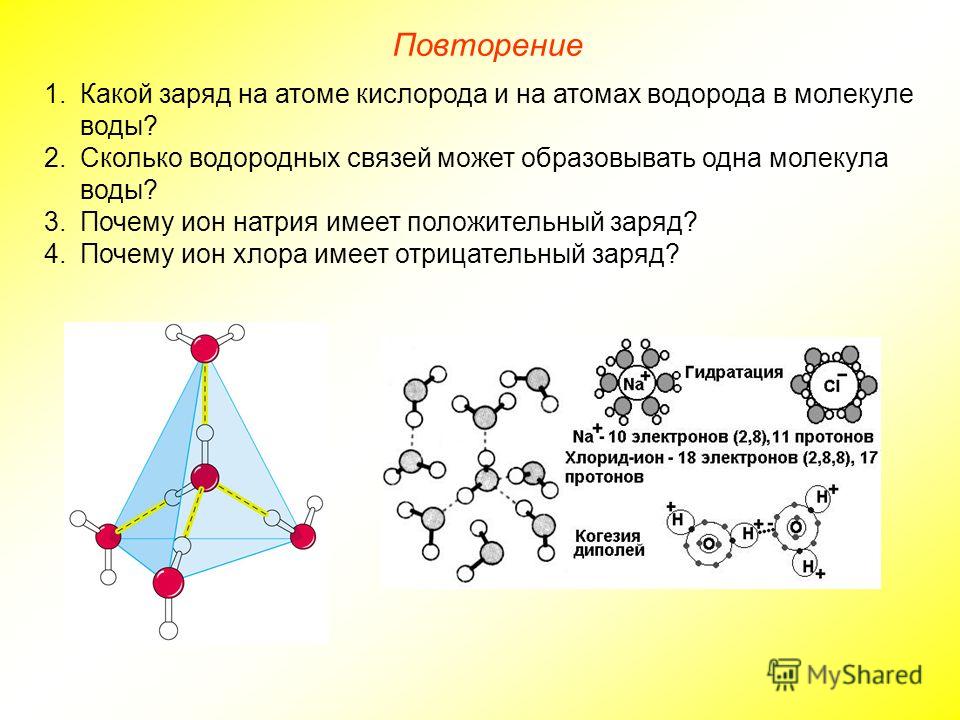
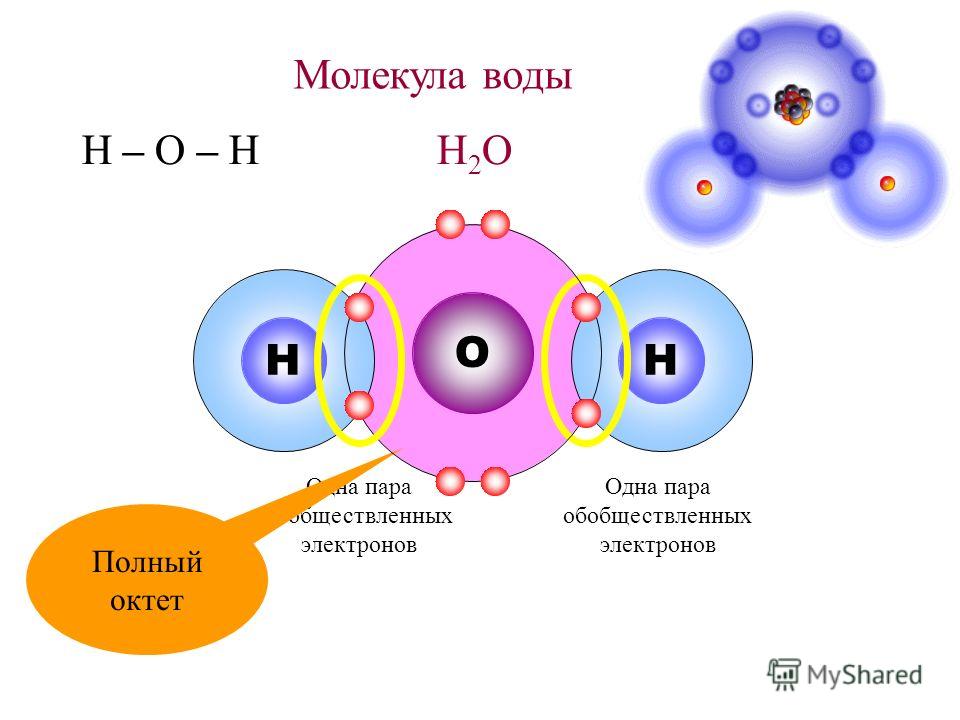
В воде, каждое ядро водорода связаны с центральным атомом кислорода парой электронов, которые делятся между ними. Химики называют эту общую электронную пару ковалентной химической связью. В H 2О, только два из шести электронов кислорода внешней оболочки используются для этой цели, оставляя четыре электрона, которые организованы в две несвязывающие пары.
Четыре электронные пары, окружающие кислород, имеют тенденцию располагаться как можно дальше друг от друга, чтобы минимизировать отталкивания между этими облаками отрицательного заряда. Это обычно приводит к тетраэдрической геометрии, в которой угол между электронными парами (и, следовательно, угол связи HOH ) составляет 109,5 °.
Однако, поскольку две несвязывающие пары остаются ближе к атому кислорода, они оказывают более сильное отталкивание на две пары ковалентных связей, эффективно сближая два атома водорода. Результатом является искаженное тетраэдрическое расположение, в котором угол Н-О-Н составляет 104,5 °.
Хотя молекула воды не несет чистого электрического заряда, ее восемь электронов распределены неравномерно. Немного более отрицательный заряд (фиолетовый) на кислородном конце молекулы и компенсирующий положительный заряд (зеленый) на водородном конце. Получающаяся полярность в значительной степени ответственна за уникальные свойства воды.
Немного более отрицательный заряд (фиолетовый) на кислородном конце молекулы и компенсирующий положительный заряд (зеленый) на водородном конце. Получающаяся полярность в значительной степени ответственна за уникальные свойства воды.
Поскольку молекулы меньше световых волн, их нельзя наблюдать непосредственно, и их необходимо «визуализировать» альтернативными способами. Внешняя оболочка показывает эффективную «поверхность» молекулы, определяемую протяженностью облака отрицательного электрического заряда, созданного восемью электронами.
КАКИЕ СВЯЗИ ИМЕЕТ h3O2
Молекула H 2 O электрически нейтральна, но положительные и отрицательные заряды распределены неравномерно. Это иллюстрируется градацией цвета на схематической диаграмме здесь. Электронный (отрицательный) заряд концентрируется на кислородном конце молекулы, отчасти благодаря несвязывающимся электронам (сплошные синие кружки) и высокому заряду ядра кислорода, который оказывает сильное притяжение на электроны.
Это смещение заряда представляет собой электрический диполь , представленный стрелкой внизу; Вы можете думать об этом диполе как о электрическом «образе» молекулы воды.
Как все мы узнали в школе, противоположные заряды притягиваются, поэтому частично положительный атом водорода на одной молекуле воды электростатически притягивается к частично отрицательному кислороду на соседней молекуле. Этот процесс называется (несколько обманчиво) водородной связью.
Обратите внимание, что водородная связь длиннее, чем ковалентная связь О-Н. Это означает, что он значительно слабее. На самом деле он настолько слаб, что данная водородная связь не может существовать дольше, чем крошечная доля секунды.
ФИЗИЧЕСКИЕ СВОЙСТВА h3O2
Давно известно, что вода обладает многими физическими свойствами, которые отличают ее от других небольших молекул сопоставимой массы. Химики называют их «аномальными» свойствами воды, но они ни в коем случае не являются загадочными. Все они являются полностью предсказуемыми последствиями того, как размер и заряд ядра атома кислорода способствуют искажению облаков электронного заряда атомов других элементов, когда они химически связаны с кислородом. Вода является одним из немногих известных веществ, чья твердая форма менее плотная, чем жидкость.
Вода является одним из немногих известных веществ, чья твердая форма менее плотная, чем жидкость.
Расширение между –4 ° и 0 ° обусловлено образованием более крупных агрегатов с водородными связями. Выше 4 ° начинается тепловое расширение, поскольку колебания связей О — Н становятся более энергичными, что приводит к выталкиванию молекул дальше друг от друга.
Другое широко цитируемое аномальное свойство воды — ее высокая температура кипения. Как показывает этот график, молекула, столь же легкая, как H 2 O, «должна» кипеть при температуре около –90 ° C. То есть, он существовал бы в мире в виде газа, а не жидкости, если бы не было водородных связей. Обратите внимание, что Н-связь также наблюдается с фтором и азотом.
ХИМИЧЕСКИЕ СВОЙСТВА h3O2
Соленость воды может быть определена как концентрация всех катионов, в значительной степени Na + , K + , Mg ++ и Ca ++, а также анионов CO 3 = и SO 4 = и галогенидов, причем все HCO 3 — превращаются в CO = 3. Приведенный выше средний состав пресной воды соответствует среднему речному водоснабжению. В мягких водах Ca ++ и CO = 3 могут быть значительно снижены. В кислых водах сульфат может быть доминирующим.
В мягких водах Ca ++ и CO = 3 могут быть значительно снижены. В кислых водах сульфат может быть доминирующим.
КРУГОВОРОТ ВОДЫ В ПРИРОДЕ
Что происходит в естественном круговороте воды?
В естественном круговороте воды используются физические процессы для перемещения воды с поверхности земли в атмосферу и обратно.
Испарение — это когда солнце светит на воду и нагревает ее, превращая в газ, называемый водяным паром, который поднимается в воздух.
Транспирация — это когда солнце согревает людей, растения и животных, и они выпускают водяной пар в воздух.
Конденсация — это когда водяной пар в воздухе охлаждается и превращается в жидкость, образуя крошечные капельки воды в небе.
Осадки — это когда капли воды падают с неба в виде дождя, снега или града.
Сток — это когда вода течет по земле и впадает в ручьи, реки и океаны.
Инфильтрация — это когда вода падает на землю и впитывается в почву.
Перколяция — это когда вода все глубже проникает в крошечные места в почве и камне.
ПОЧЕМУ НЕ КОНЧАЕТСЯ ВОДА НА ЗЕМЛЕ
Земля содержит огромное количество воды:
- в океанах;
- озерах;
- реках;
- атмосфере;
- в скалах внутренней Земли.
В течение миллионов лет большая часть этой воды рециркулируется между внутренней Землей, океанами и реками и атмосферой. Этот циклический процесс означает, что пресная вода постоянно поступает на поверхность Земли, где мы все живем.
Вулканы выпускают огромное количество воды из внутренней Земли в атмосферу.
Наша планета также очень эффективно удерживает эту воду. Вода, будучи паром в нашей атмосфере, потенциально может сбежать в космос с Земли. Но вода не вытекает, потому что некоторые области атмосферы очень холодные. (Например, на высоте 15 километров температура атмосферы составляет всего -60 ° С!). При этой холодной температуре вода образует твердые кристаллы, которые падают обратно на поверхность Земли.
Хотя на нашей планете в целом никогда не кончится вода, важно помнить, что чистая пресная вода не всегда доступна там, где и когда она нужна людям. Фактически, половина пресной воды в мире может быть найдена только в шести странах. Более миллиарда человек живут без достаточного количества чистой воды.
Фактически, половина пресной воды в мире может быть найдена только в шести странах. Более миллиарда человек живут без достаточного количества чистой воды.
Кроме того, каждая капля воды, которую мы используем, продолжается в круговороте воды. Вещи, которые мы кладем в канализацию, попадают в чью-то воду. Мы можем помочь защитить качество пресной воды на нашей планете, используя ее более разумно.
ВИДЫ ВОДЫ
«Чистая вода»
Для химика термин «чистый» имеет значение только в контексте конкретного применения или процесса. Дистиллированная или деионизированная вода, которую мы используем в лаборатории, содержит растворенные атмосферные газы и иногда немного кремнезема, но их небольшое количество и относительная инертность делают эти примеси незначительными для большинства целей.
Когда для определенных типов точных измерений требуется вода с наивысшей достижимой чистотой, ее обычно фильтруют, деионизируют и подвергают тройной вакуумной дистилляции. Но даже эта «химически чистая» вода представляет собой смесь изотопных частиц: есть два стабильных изотопа водорода (H 1 и H 2 , последний часто обозначается как D) и кислорода (O 16 и O 18 ), которые вызывают комбинации, такие как H 2O 18 , HDO 16 и т. Д. Они легко идентифицируются в инфракрасных спектрах водяного пара.
Д. Они легко идентифицируются в инфракрасных спектрах водяного пара.
И вдобавок ко всему, два атома водорода в воде содержат протоны, магнитные моменты которых могут быть параллельными или антипараллельными, что приводит к орто- и пара- воде соответственно. Две формы обычно присутствуют в соотношении о / п 3: 1.
Количество редких изотопов кислорода и водорода в воде достаточно разнится от места к месту, поэтому теперь можно с некоторой точностью определить возраст и источник конкретного образца воды. Эти различия отражены в изотопных профилях H и O организмов. Таким образом, изотопный анализ волос человека может быть полезным инструментом для расследования преступлений и антропологических исследований.
Питьевая вода
Наша обычная питьевая вода, напротив, никогда не бывает химически чистой, особенно если она контактировала с отложениями. Подземные воды (из родников или колодцев) всегда содержат ионы кальция и магния, а также часто железо и марганец; положительные заряды этих ионов уравновешиваются отрицательными ионами карбонат / бикарбонат, а иногда и некоторым количеством хлорида и сульфата.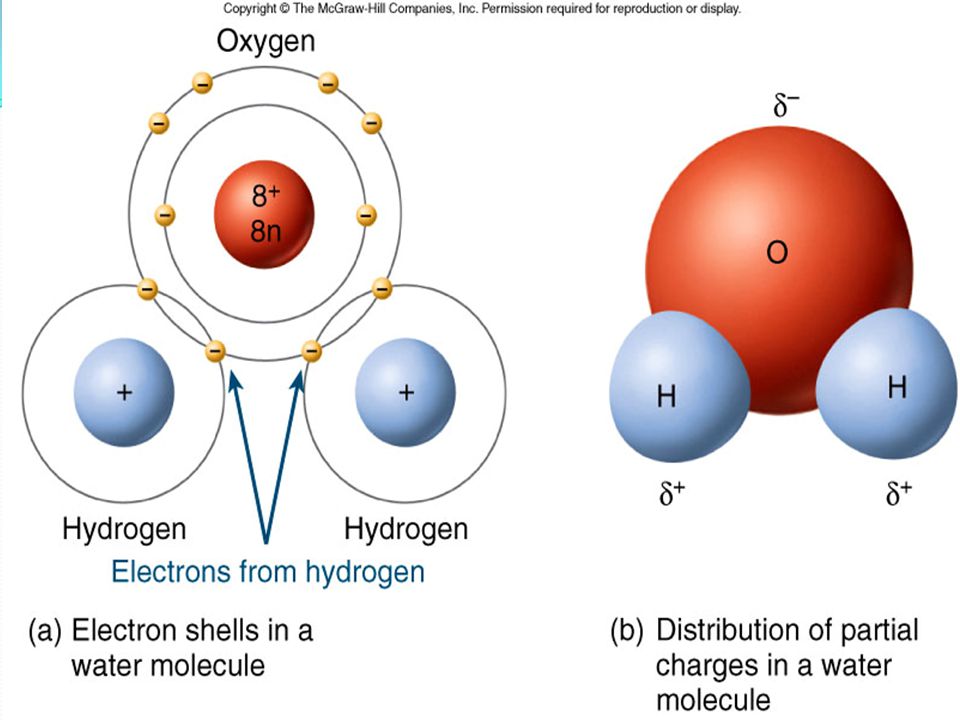 В некоторых регионах подземные воды содержат недопустимо высокие концентрации естественных токсичных элементов, таких как селен и мышьяк.
В некоторых регионах подземные воды содержат недопустимо высокие концентрации естественных токсичных элементов, таких как селен и мышьяк.
Можно подумать, что дождь или снег будут освобождены от загрязнения, но когда водяной пар конденсируется из атмосферы, это всегда происходит на частице пыли, которая выделяет вещества в воду, и даже самый чистый воздух содержит углекислый газ, который растворяется с образованием углекислота За исключением сильно загрязненных атмосфер, примеси, улавливаемые снегом и дождем, слишком малы, чтобы вызывать беспокойство.
Различные правительства установили верхние пределы количества загрязняющих веществ, допустимых в питьевой воде; самые известные из них — Стандарты питьевой воды EPA США.
Безионная вода
Иногда можно услышать, что не содержащая минералов вода и особенно дистиллированная вода вредны для здоровья, потому что они «вымывают» необходимые минералы из организма. Дело в том, что минеральные ионы не проходят через клеточные стенки при обычной осмотической диффузии, а скорее переносятся метаболическими процессами.
Обширное исследование 2008 года не подтвердило более ранние сообщения о том, что низкий уровень кальция / магния в питьевой воде коррелирует с сердечно-сосудистыми заболеваниями. Любая сбалансированная диета должна содержать все необходимые нам минеральные вещества.
Хорошо известно, что люди, которые занимаются тяжелой физической активностью или находятся в очень жаркой среде, должны избегать употребления большого количества даже обычной воды. Чтобы предотвратить серьезные проблемы с электролитным дисбалансом, необходимо компенсировать потери солей при потливости. Это может быть достигнуто путем приема соленых продуктов или напитков (включая «спортивные напитки») или соленых таблеток.
Статью проверил и отредактировал Papa Vlada.
Первоисточник статьи опубликован на сайте про воду.
Вода в жизни организмов: водородная связь – результат особой структуры атома водорода
Вода в жизни организмов играет роль растворителя. Она имеет простую молекулярную структуру, состоящую из атома кислорода, связанного с двумя атомами водорода.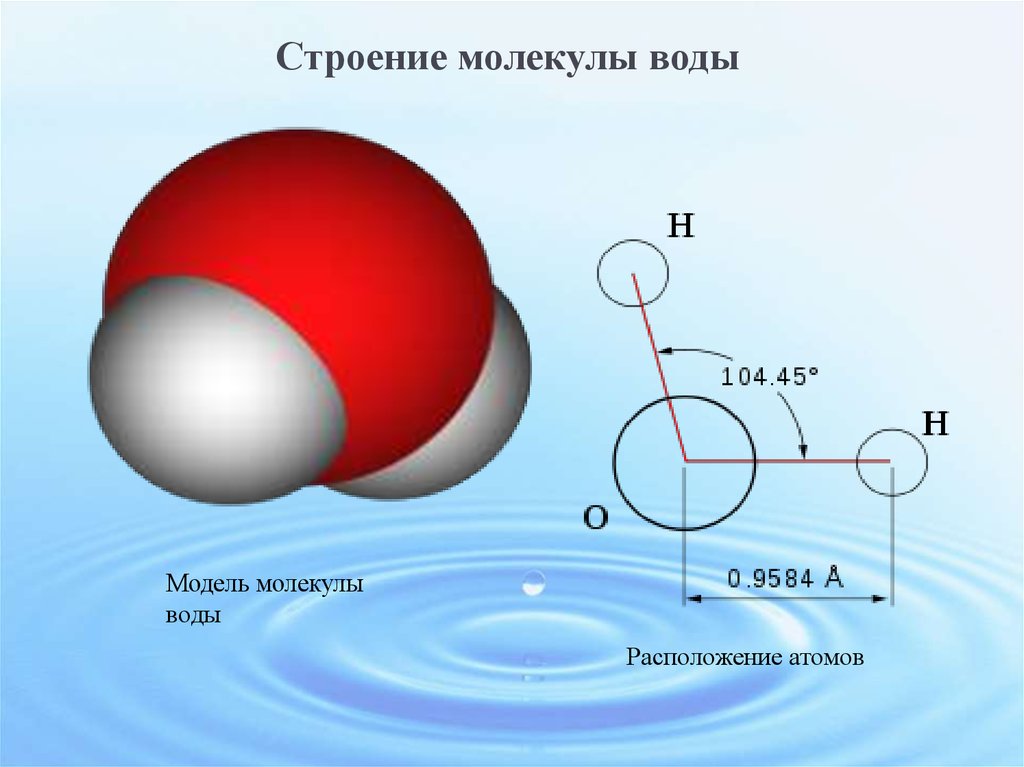 В результате этого молекула является стабильной, она удовлетворяет правилу октета – не имеет непарных электронов и не несёт чистой энергии. Электроотрицательность кислорода намного больше, чем водорода, поэтому связи между этими атомами сильно полярны. Полярность молекулы воды лежит в основе её химических свойств, важных для всего живого.
В результате этого молекула является стабильной, она удовлетворяет правилу октета – не имеет непарных электронов и не несёт чистой энергии. Электроотрицательность кислорода намного больше, чем водорода, поэтому связи между этими атомами сильно полярны. Полярность молекулы воды лежит в основе её химических свойств, важных для всего живого.
Самым выдающимся свойством воды является её способность образовывать слабые химические связи, называемые водородными. Они формируются между частично отрицательным атомом кислорода и двумя частично положительными атомами водорода. Эти связи обладают всего 5-10% силы ковалентных скреплений. Но в большом количестве они играют важную роль в построении структур белков, а значит, несут ответственность за химическую организацию живых систем.
Строение молекулы воды
Если рассмотреть молекулу воды, то можно увидеть, что её две ковалентных связи несут частичный заряд на каждом полюсе. Полюс кислорода частично отрицателен (δ –), полюсы водорода частично положительны (δ +). В общей сложности молекула воды несёт 2 отрицательных и 2 положительных заряда. Атом кислорода лежит в центре «пирамиды», атомы водорода занимают две вершины, а частично отрицательные заряды занимают две другие вершины.
В общей сложности молекула воды несёт 2 отрицательных и 2 положительных заряда. Атом кислорода лежит в центре «пирамиды», атомы водорода занимают две вершины, а частично отрицательные заряды занимают две другие вершины.
Благодаря особому строению молекулы воды, снежинки бывают только шестилучевыми, а не такими как на этом рисунке
Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Каждая молекула воды, подобно маленькому магниту, притягивает к себе еще четыре молекулы и соединяется с ними водородными связями.
Из-за большого количества водородных соединений вода, несмотря на её малую молекулярную массу, при температурах от 0°С до 100°С может сохранять жидкое агрегатное состояние, тогда как подобные ей водородные соединения (например, h3S, Nh4 ,HF) являются газами.
Строение молекулы воды
Автор: Booyabazooka, CC BY-SA 3.0
Сцепление жидкой воды отвечает и за её поверхностное натяжение. Поэтому мелкие насекомые могут ходить по воде, а вода поднимается по капиллярам почвы и по сосудам растений.
Примеры поверхностного натяжения воды
Подобные комплексы молекул существенно повышают температуры кипения и таяния воды (по сравнению с похожими молекулами) и увеличивают ее теплоемкость. Они же делают воду очень хорошим растворителем и благоприятной средой для протекания целого ряда реакций.
1. Современные представления о составе и структуре воды. Строение молекулы воды. Легкая и тяжелая вода.• Опорные даты начала исследовании воды:
1781 г. – Вода впервые была синтезирована Г.Кавендишем при сгорании водорода;1783 г. – Лавуазье предложил истинный состав воды как сложного соединения кислорода и водорода;1800 г. – А.Карлейль и У.Никольсон с помощью тока, полученного в вольтовом столбе, разложили воду на кислород и водород;1805 г. – Жозеф Луи Гей-Люссак и А.Гумбольдт, проведя совместные опыты, установили, что для образования воды необходимы 2 объема водорода и 1 объем кислорода;1842 г. – Жан Батист Дюма установил весовое соотношение водорода и кислорода в воде как 2:16;1860 г.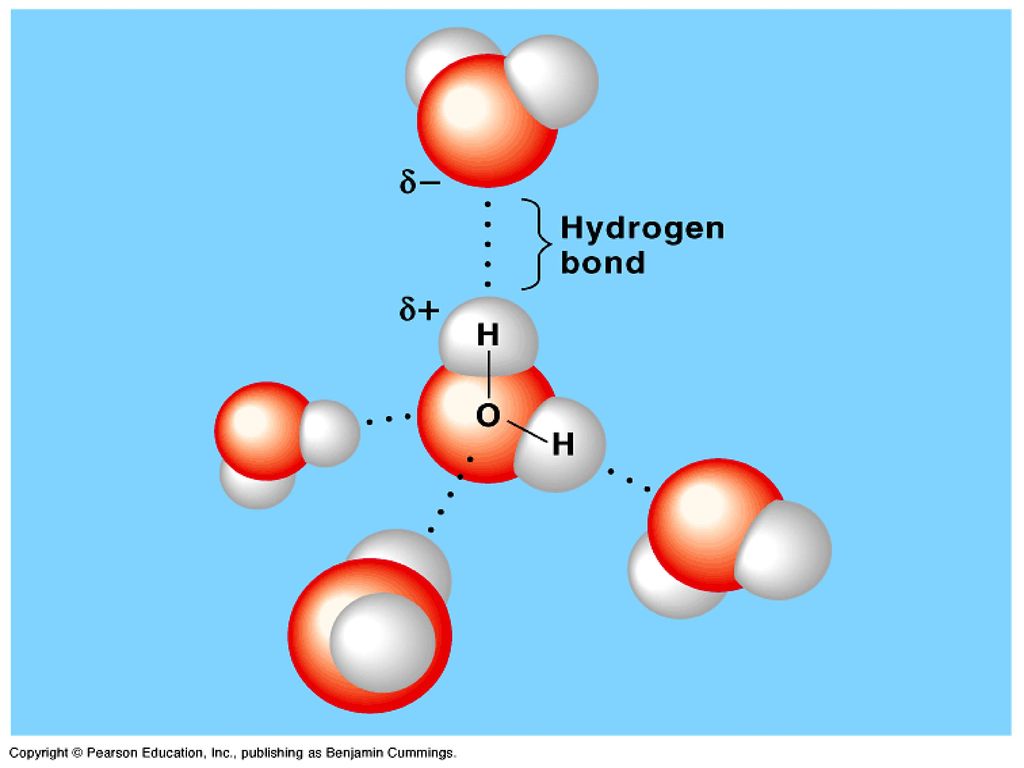 – С.Канницаро предложил точную химическую формулу воды как h3O.• К настоящему времени предложено более 100 моделей структуры воды, начиная с работ Дж. Бернала и Р. Фаулера. Мы знаем, что вода существует в жидком, газообразном и твердом виде. Но возможны и субструктуры, отличающиеся по свойствам в рамках одного и того же агрегатного состояния. Посмотрите на общую фазовую диаграмму воды: римскими цифрами показаны различные структурные модификации льда.
– С.Канницаро предложил точную химическую формулу воды как h3O.• К настоящему времени предложено более 100 моделей структуры воды, начиная с работ Дж. Бернала и Р. Фаулера. Мы знаем, что вода существует в жидком, газообразном и твердом виде. Но возможны и субструктуры, отличающиеся по свойствам в рамках одного и того же агрегатного состояния. Посмотрите на общую фазовую диаграмму воды: римскими цифрами показаны различные структурные модификации льда.
Рисунок 1 – Фазовая диаграмма воды.
В “тройной” точке на диаграмме может одновременно существовать вода во всех трех агрегатных состояниях.
В “критической” точке все свойства жидкости и пара (энергия, плотность, структура, характер движения частиц и т.п.) становятся равны. При более высоком давлении и/или температуре агрегатное состояние воды называют “сверхкритическим”.
В молекуле воды три атома: два водорода и один кислород. Между собой они соединены ковалентной связью. Молекула является двойным симметричным донором и акцептором протонов. Атом кислорода имеет две неподеленные пары электронов. Это определяет структуру воды и ее строение в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании – два водорода (рисунок 2).
Атом кислорода имеет две неподеленные пары электронов. Это определяет структуру воды и ее строение в виде равнобедренного треугольника, в вершине которого расположен атом кислорода, а в основании – два водорода (рисунок 2).
Рисунок 2 – Электронная и геометрическая модель структуры молекулы воды.
В стабильном энергетическом состоянии молекула воды имеет тетраэдрическую пространственную структуру. При изменении агрегатного состояния воды длина сторон и угол между ними меняются. Если бы мы увидели молекулу воды, то обнаружили, что она имеет сфероидальную форму с двумя выпуклостями (рисунок 3).
Рисунок 3 – Локальное распределение некомпенсированных зарядов в молекуле воды
Молекула воды полярна, т.е. один ее конец имеет частичный положительный заряд, а другой – отрицательный. Это объясняется тем, что две пары электронов в ней – общие у двух атомов водорода и атома кислорода, а две другие пары неподеленных электронов собраны с противоположной стороны кислорода. Поэтому на атомах водорода проявляются частично нескомпенсированные положительные заряды, а на кислороде – отрицательные.
Поэтому на атомах водорода проявляются частично нескомпенсированные положительные заряды, а на кислороде – отрицательные.
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар обуславливает возникновение водородных связей, что способствует ассоциации молекул воды в группы.
Обладая значительным дипольным моментом, молекулы воды также сильно взаимодействуют с полярными молекулами других веществ.
Идеально чистую воду практически невозможно получить. По факту, мы всегда будем иметь дело хоть и с очень разбавленными, но растворами.
Кроме известной нам “легкой” воды 1h316O (где надстрочный индекс – атомная масса элемента), существует еще 8 изотопологов, в которых вместо обычного водорода и кислорода содержатся их изотопы: 1HD16O (D-дейтерий или 2H), D216O, 1h317O, 1HD17O, D217O, 1h318O, 1HD18O, D218O (самая “тяжелая” вода).
В природе на 1 000 000 молекул воды в среднем приходится:
– 997 284 молекул легкой воды 1h316O;
– 311 молекул 1HD16O;
– 390 молекул 1h317O;
– 2005 молекул 1h318O.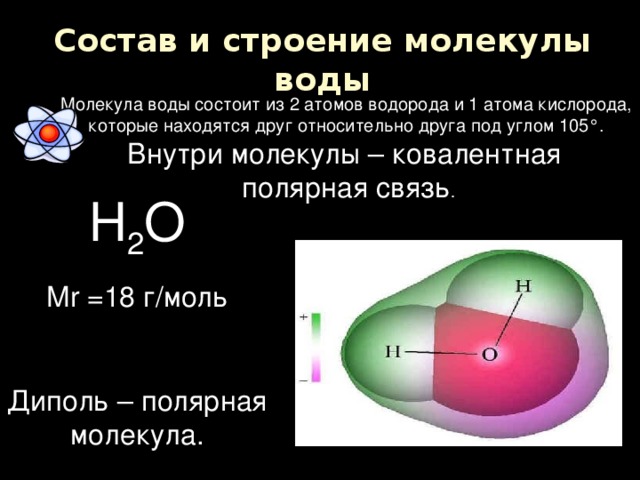
Если из глубинной океанической воды, отвечающей стандарту SMOW (Standard Mean Ocean Water) удалить все тяжелые изотопы и заменить их на 1h316O, то масса 1 л такой воды станет меньше на 250 мг, т.е. на четверть.
Взаимодействие молекулы воды с полярными молекулами и ионными соединениями
Полярность воды заставляет её притягиваться к другим полярным молекулам или ионным решёткам. Притяжение других полярных веществ называется адгезией. Вода соединяется с любым веществом, с которым она может образовать водородные связи. Полярные молекулы и ионные соединения растворяются в воде, неполярные (например, масла) нет.
Притяжение воды к веществам, имеющим электрические заряды на поверхности, отвечает за капиллярное действие. Если стеклянную трубку с узким диаметром опустить в стакан с водой, уровень жидкости в трубке поднимется выше, чем в стакане, из-за адгезии воды со стеклянной поверхностью. Чем уже будет трубка, тем сильнее электрические силы между водой и стаканом и тем выше она поднимется. Так капиллярная сила воды помогает ей преодолевать силу притяжения Земли.
Так капиллярная сила воды помогает ей преодолевать силу притяжения Земли.
Капиллярность воды и ртути
Автор: MesserWoland, CC BY-SA 3.0
Таблица 1. Некоторые свойства воды
| Свойство | Объяснение | Примеры пользы для жизни |
| Сцепление | Водородные связи удерживают молекулы воды вместе | Листья притягивают воду вверх от корней; семена набухают и прорастают. |
| Высокая удельная теплоёмкость и теплопроводность | Когда водородные связи разрываются, они поглощают тепло, а когда образуются – выделяют. Так они минимизируют температуру изменения. | Вода поддерживает постоянство температуры организмов относительно окружающей среды. Благодаря высокой теплопроводности температура равномерно распределяется в теле организма. |
| Высокая удельная температура парообразования и конденсации | Чтобы вода испарилась, должно быть разорвано много водородных связей, поэтому этот процесс происходит с затратой большого количества энергии. | Испарение воды с кожи, за счёт траты энергии, охлаждает поверхность тела. |
| Более низкая плотность льда | Благодаря водородным связям в кристалле льда молекулы воды расположены относительно далеко друг от друга. Плотность жидкой воды – 0,9982 г/см2. Плотность льда – 0,917 г/см2. | Зимой лёд закрывает водоёмы, поэтому основная их часть не замерзает и обитатели озёр, рек и т. д. не погибают. |
| Растворимость | Молекула воды притягивается к полярным соединениям, разрушая их решётки и молекулы, и превращая атомы в ионы. | Многие растворённые молекулы могут свободно перемещаться внутрь клетки, что способствует химическим реакциям. |
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.
На картинке № 2 показано образование димера воды с одной водородной связью.
Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
2. Структура воды. Водородные связи.Структура – есть конкретное пространственное расположение атомов, ионов или молекул в соответствии с особенностями их взаимодействия между собой.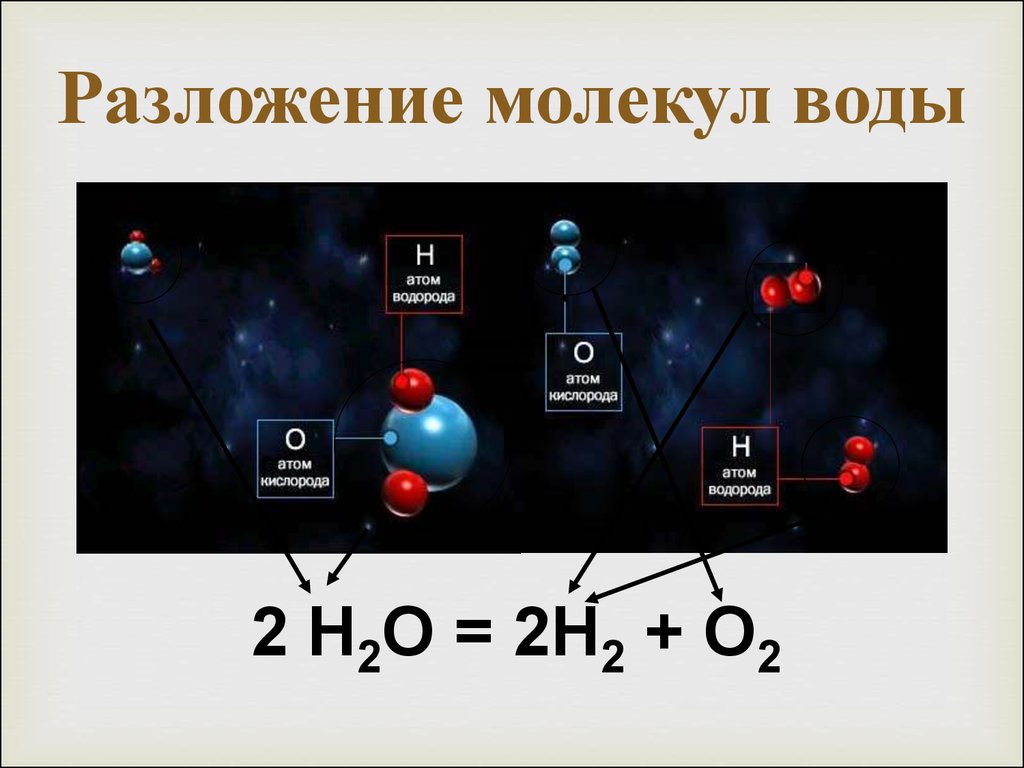
Существует несколько базовых гипотез строения воды. Две основных:
• Гипотеза Уайтинга (1883). Вода в жидком виде состоит из гидролей, а точнее из смеси моногидроля h3O, дигидроля (h3O)2, и тригидроля (h3O)3. Основной строительной единицей здесь является дигидроль. Отметим, что по этой гипотезе пар состоит преимущественно из моногидроля, а лед – из тригидроля.
• Гипотеза О.Я. Самойлова, Дж. Попла, Г.Н. Зацепиной (XX век). Вода, пар или лед состоят из простых молекул h3O, объединенных в группы или агрегаты с помощью водородных связей (Дж. Бернал, Р. Фаулер 1933).
Последователей второй гипотезы значительно больше, поэтому остановимся на ней подробнее.
Электронная конфигурация молекулы h3O позволяет ей быть одновременно и донором и акцептором электронов. Этот факт является важной предпосылкой к образованию разветвленной сети водородных связей (рисунок 4), как уже было упомянуто ранее. Лед в этом отношении совершенен.
Рисунок 4 – Образование водородных связей между молекулами воды. Сплошные линии – ковалентные связи, точечные – направленные водородные связи.
Сплошные линии – ковалентные связи, точечные – направленные водородные связи.
Расчетами установлено, что в любом объеме воды всегда найдется, по крайней мере, одна сплошная цепочка из водородных связей, пронизывающая весь объем. Если представить в виде этого объема мировой океан, то, согласно этого постулата, в нем точно найдется одна гигантская ассоциация молекул воды, опоясывающая земной шар. Известен афоризм И. Ленгмюра: “Океан – одна большая молекула”. Сегодня достоверно установлено, что из каждых 10 молекул воды 8 по прежнему окружены соседями.
В ходе современных физико-химических исследований были выявлены характерные структурные агрегаты воды, формирующиеся с помощью водородных связей.
Для формирования трехмерных структур необходимо, кроме способности молекул создавать водородные связи, выполнение еще двух условий. Этих связей должно быть не менее четырех на одну молекулу и геометрические размеры молекулы не должны противоречить оптимальным направлениям водородных связей.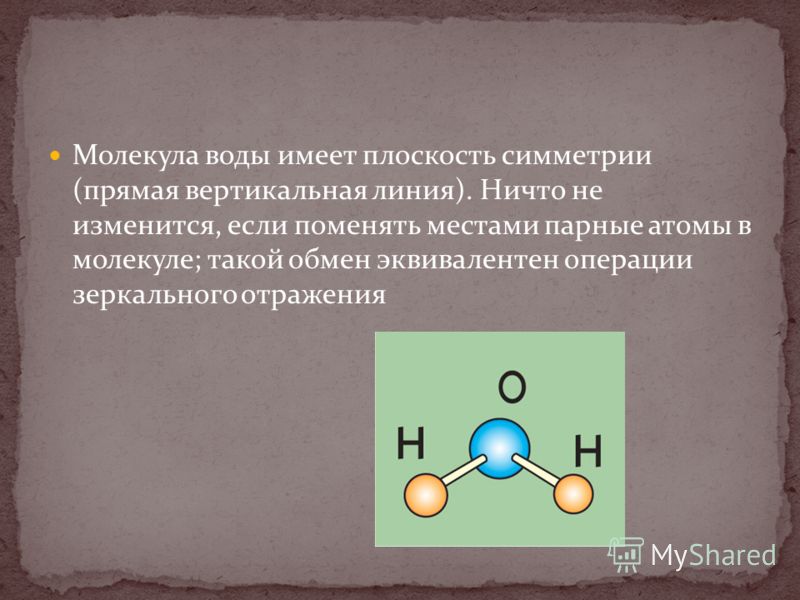 Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
Высокая удельная теплоёмкость воды помогает ей поддерживать температуру
Температура каждого вещества является показателем того, насколько быстро движутся его отдельные молекулы. В случае с водой для разрыва большого количества её водородных связей требуется много внешней энергии, это удерживает её молекулы от движения. Следовательно, вода имеет высокую теплоёмкость, определяющуюся как количество теплоты, нужное для изменения температуры 1г вещества на 1°С.
Удельная теплоёмкость измеряет степень, в которой вещество сопротивляется изменению своей температуры. Чем полярнее молекулы вещества, тем выше их удельная теплоёмкость. Теплоёмкость воды равна 4,1806 кДж, она в два раза выше, чем у большинства углеродных соединений и в 9 раз выше железа.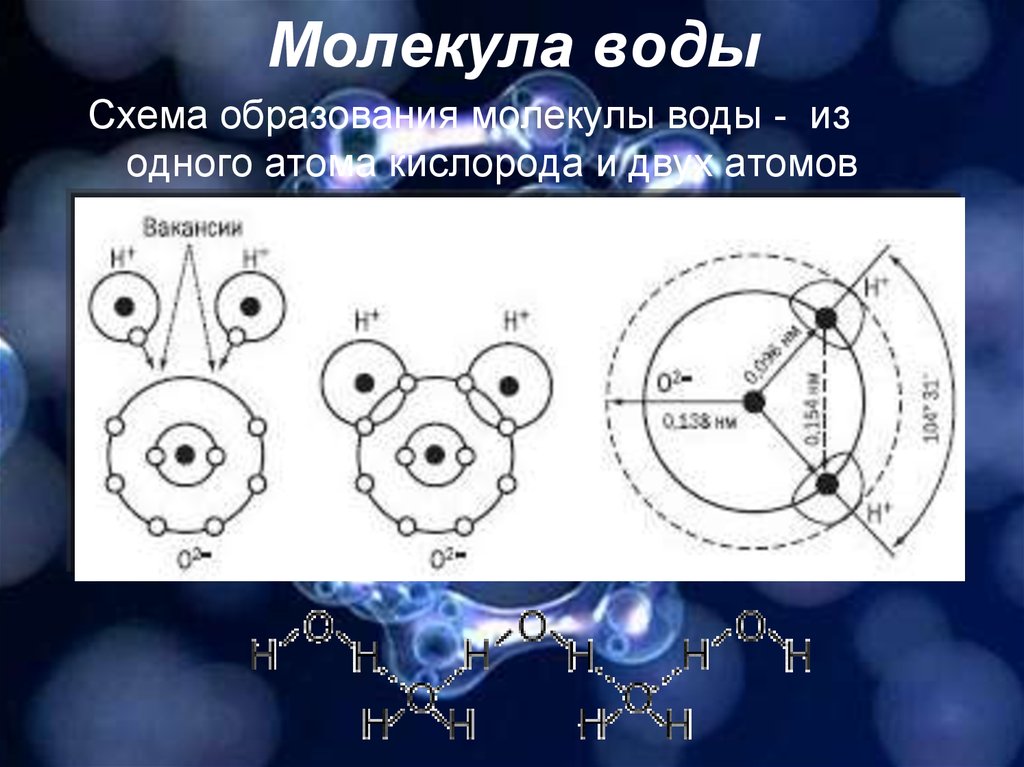 Только аммиак, обладающий большей полярностью, чем вода и формирующий сильные водородные связи, имеет более высокую удельную теплоёмкость. Тем не менее, только 20% водородных связей разрушается при нагревании воды от 0° до 100°С.
Только аммиак, обладающий большей полярностью, чем вода и формирующий сильные водородные связи, имеет более высокую удельную теплоёмкость. Тем не менее, только 20% водородных связей разрушается при нагревании воды от 0° до 100°С.
Из-за высокой теплоёмкости вода нагревается медленнее, чем любая другая смесь и сохраняет тепло дольше. Из-за высокого содержания воды в организмах они могут длительное время поддерживать постоянство своей внутренней температуры. Этому способствует не только высокая теплоёмкость воды, но и её высокая теплопроводность, равномерно распределяющая тепло по телу. Тепло, выделяющееся при химических реакциях внутри клетки, разрушает её, если в ней нет воды, поглощающей это тепло. Вода в жизни организма — играет ведущую роль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.

- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.
Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.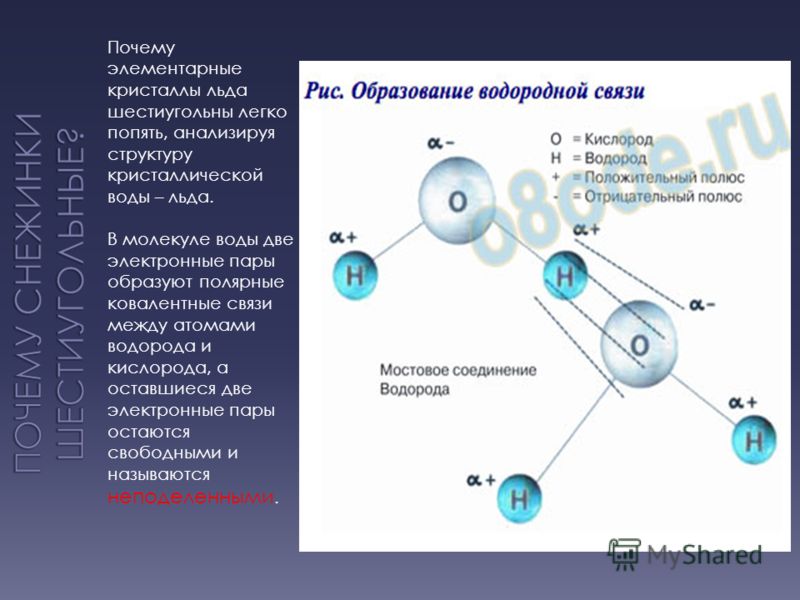
Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Вода в жизни организмов: высокая температура испарения способствует охлаждению
Удельная температура испарения определяется как количество энергии, требуемое для превращения 1г жидкости в газ. Чтобы произвести такие изменения с водой, нужно 586 Ккал энергии. Испарение воды с какой-либо поверхности охлаждает эту поверхность.
Испарение воды с какой-либо поверхности охлаждает эту поверхность.
Способ терморегуляции животных
Многие организмы используют это свойство воды для предупреждения перегрева, например, у животных и человека лишнее тепло уходит через потоотделение, многие животные в жару высовывают влажный язык, чтобы с него испарялась вода, облизывают кожу для охлаждения.
Вода в жизни организмов: меньшая плотность твёрдой воды, чем жидкой
При охлаждении вода сначала сжимается. Но происходит это только до температуры 4°С, достигнув самой большой своей возможной плотности, с дальнейшим понижением температуры, вода начинает расширяться. При низких температурах молекулы воды запираются в кристаллическую форму, образуя решётки водородных связей. Так получается лёд.
Кристаллическая решётка льда
Автор: NIMSoffice
Лёд менее плотный, чем жидкость, благодаря тому, что водородные связи в кристаллах располагают атомы относительно далеко друг от друга. Такая необычная особенность позволяет айсбергам плавать.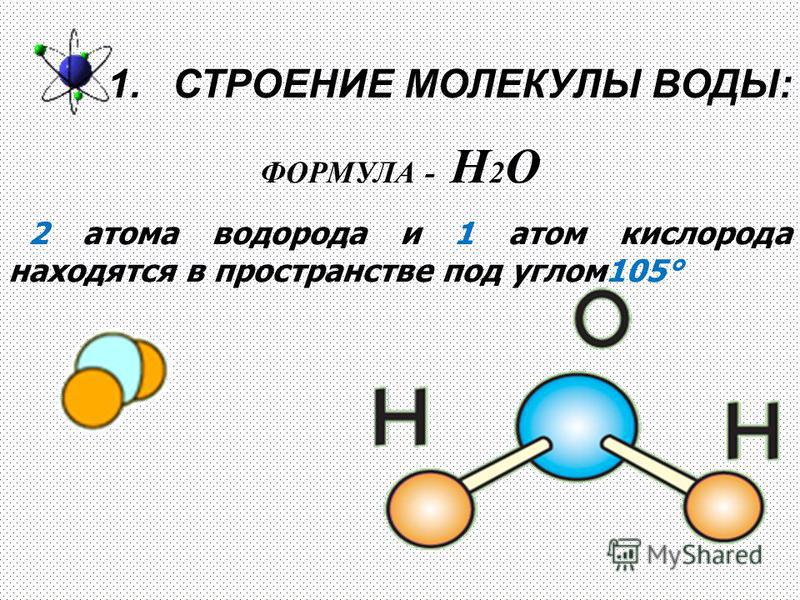 Если бы у воды не было такой способности, почти все водоёмы замерзали бы до дна и их обитатели в них не смогли бы выживать. В этом случае вода в жизни организмов выполняет защитную роль.
Если бы у воды не было такой способности, почти все водоёмы замерзали бы до дна и их обитатели в них не смогли бы выживать. В этом случае вода в жизни организмов выполняет защитную роль.
Раз при замерзании вода расширяется, то при этом она может разорвать ткани и клетки организмов. Это причина того, почему деревья на зиму прекращают сокодвижение и сбрасывают листья.
Айсберг
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды.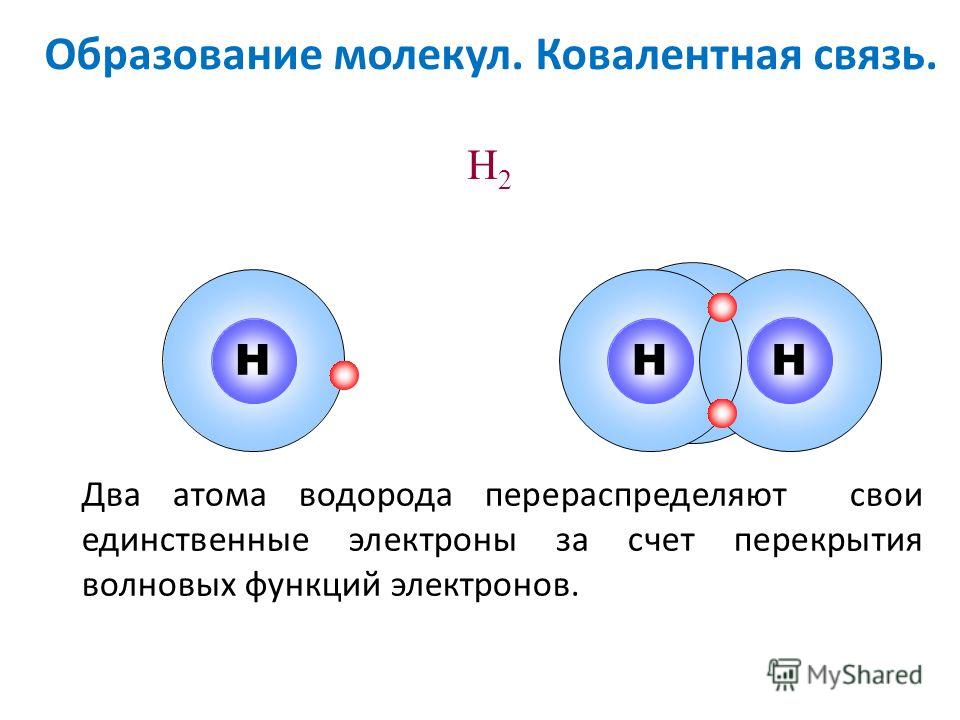 Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».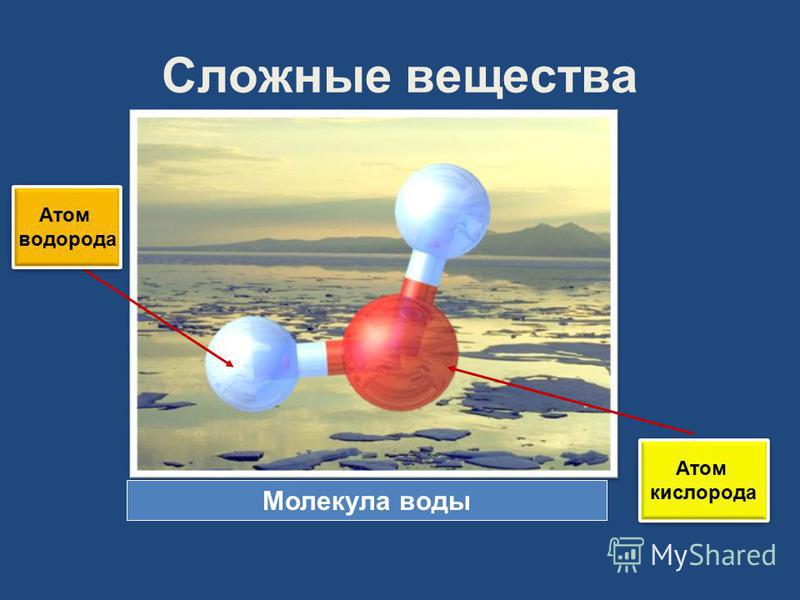
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Полярные молекулы и ионы растворимы в воде
Молекулы воды собираются вокруг любого вещества, несущего электрический заряд, это могут быть как ионы, так и полярные молекулы. Например, сахароза (столовый сахар) состоит из молекул, содержащих гидроксильные (OH) полярные группы.
Кристаллы сахара легко растворяются, потому что молекулы воды могут образовывать водородные связи с гидроксильными группами молекул сахарозы. Поэтому сахароза считается растворимой в воде. При этом воду называют растворителем, а сахар растворённым веществом.
Растворение
Когда молекула сахарозы отламывается от кристалла, молекулы воды окружают её облаком, образующим гидратационную оболочку, которая препятствует её связыванию с другими молекулами сахарозы. Гидратные оболочки образуют ионы, такие как Na + и Cl –.
Насыщение воды ионами неорганических веществ и их коллоидами называется минерализацией.
К числу выдающихся в физиологическом отношении свойств воды относится её способность растворять газы (O2, CO2 и др.). Это очень важно для тех организмов, которые живут в воде, а также для процессов всех живых клеток.
Вода в жизни организмов является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Так как вода в жидком состоянии не имеет жесткой внутренней структуры, тепловое движение молекул приводит к постоянному перемешиванию молекул водного раствора. Это явление называют диффузией. Вследствие диффузии концентрации растворенных веществ в разных частях раствора выравниваются.
Диффузия воды — осмос
Автор: Квазар Ярош
Наличие в живых организмах биологических мембран и растворённых в воде ионов приводит к появлению явления осмоса. Вследствие того что биологические мембраны является полупроницаемыми, через них не могут проходить крупные органические молекулы, но могут проходить молекулы воды. В случае, когда концентрация крупных молекул по разные стороны мембраны различна, молекулы воды начинают интенсивно перемещаться на ту сторону, где концентрация растворенных веществ выше. Вследствие этого и возникает избыток веществ по одну сторону мембраны, что можно наблюдать в виде осмотического давления.
В случае, когда концентрация крупных молекул по разные стороны мембраны различна, молекулы воды начинают интенсивно перемещаться на ту сторону, где концентрация растворенных веществ выше. Вследствие этого и возникает избыток веществ по одну сторону мембраны, что можно наблюдать в виде осмотического давления.
Осмотическое давление и несжимаемость воды – важные свойства для живых организмов. Благодаря им сохраняется объём клеток, напряжённое состояние плазматической мембраны (тургор) и происходит перемещение веществ внутри цитоплазмы. Тургорное давление воды поддерживает листья и стебли растений в упругом состоянии, определяет форму тела медуз, круглых червей. Плазмолиз – выход воды из клеток, что обусловливается содержанием ионов вне и внутри клетки. Если солей больше снаружи, тогда вода покидает клетку.
Плазмолиз — изотония — тургор
Автор: LadyofHats
В паре водородные связи на 99% разорваны. При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600о С.
При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600о С.
Расстояние между молекулами во много раз больше самих молекул. При этом сами молекулы хаотично двигаются, сталкиваются со стенками сосуда, в котором заключены, и между собой. Скорость их тем выше, чем выше температура системы.
Вода может длительное время находиться и в перегретом состоянии до 200о С. При введении пузырька воздуха в такую перегретую воду она мгновенно вскипает и ее температура падает до 100о С.
Физические и химические свойства воды. Факты о воде и аномалиях ее поведения.
Данная статья является интеллектуальной собственностью ООО “НПП Электрохимия” Любое копирование без прямой ссылки на сайт www.zctc.ru преследуется по закону. Текст статьи обработан сервисом Яндекс “Оригинальные тексты”
Вода организует неполярные молекулы
Молекулы воды всегда стремятся сформировать максимальное число возможных водородных связей. Когда неполярные молекулы, такие как масла, не формирующие водородных связей, попадают в воду, молекулы воды стараются их удалить.
Когда неполярные молекулы, такие как масла, не формирующие водородных связей, попадают в воду, молекулы воды стараются их удалить.
При этом неполярные молекулы агрегируются (слипаются вместе), чтобы свести к минимуму их разрушение водой. Они сжимаются от контакта с водой, по этой причине их называют гидрофобными (греч. гидрос, «вода» и фобос, «страх»). Гидрофобны высшие карбоновые кислоты, жиры и некоторые другие вещества.
Капли масла в воде
Напротив, полярные молекулы, легко образующие связи с водой, называют гидрофильными («водолюбивыми»). Гидрофильными веществами являются моно- и дисахариды, многие минеральные соли и кислоты, низшие спирты, низшие карбоновые кислоты и др.
Тенденция неполярных молекул к агрегации в воде называется гидрофобным исключением. Путём принуждения гидрофобных молекул к агрегации, вода заставляет их принять определённую форму. Это свойство влияет на структуру белков, ДНК и биологических мембран, оно не позволяет им слипаться. По этой причине взаимодействие неполярных молекул и воды имеет решающее значение для живых систем.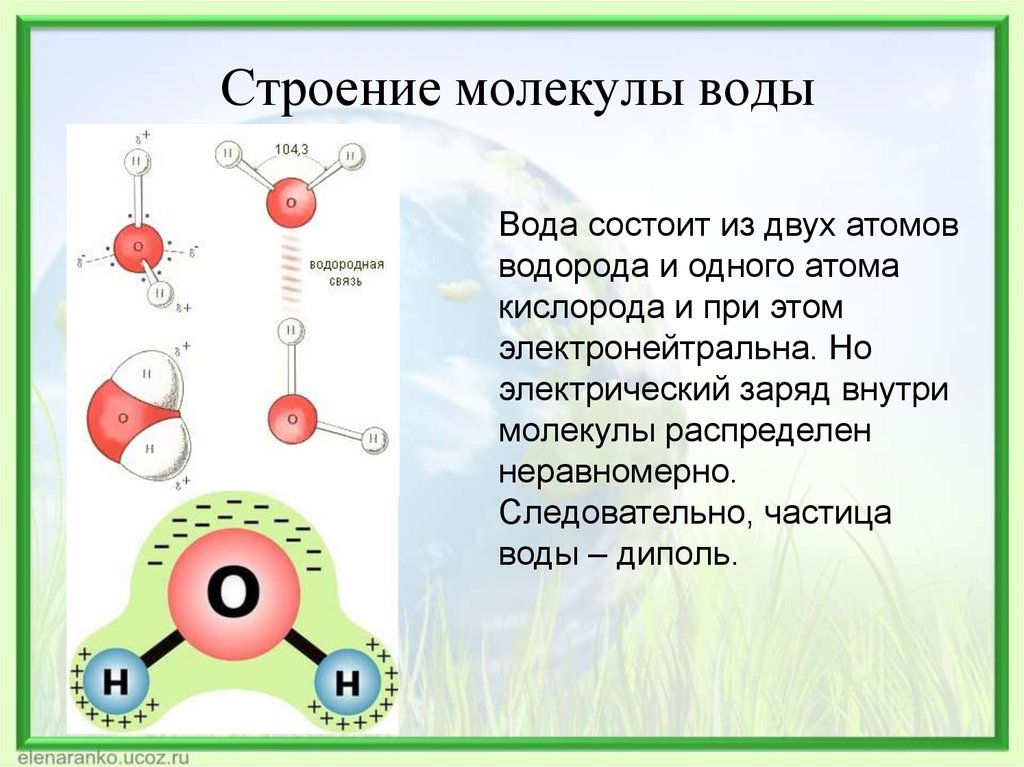
Вода способна распадаться на ионы
Вода сама может участвовать в химических реакциях – фотосинтез, гидролиз и др. Ковалентные связи молекулы воды иногда разрываются спонтанно. В чистой воде при 25°C только в одной из 550 миллионов молекул происходит подобный процесс. При этом ядро атома водорода диссоциирует от молекулы. Его положительный заряд больше не нарушается и он становится ионом водорода H +. Остальная часть диссоциированной молекулы воды, сохранившая общий электрон и ковалентную связь становится отрицательно заряженной и образует гидроксид-ион ОH-. Этот процесс спонтанного образования ионов называется ионизацией:
h3O → OH – + H +
При 25°C 1 литр воды содержит одну десятимиллионную (или 10 -7) моль ионов Н +. Моль – это вес вещества в граммах, он соответствует атомной массе всех атомов в молекуле этого вещества. В случае с H +, атомная масса иона равна 1, а моль ионов весит 1 г.
Ион водорода участвуют в определении кислотности среды (внутренней среды организма, почвы и др.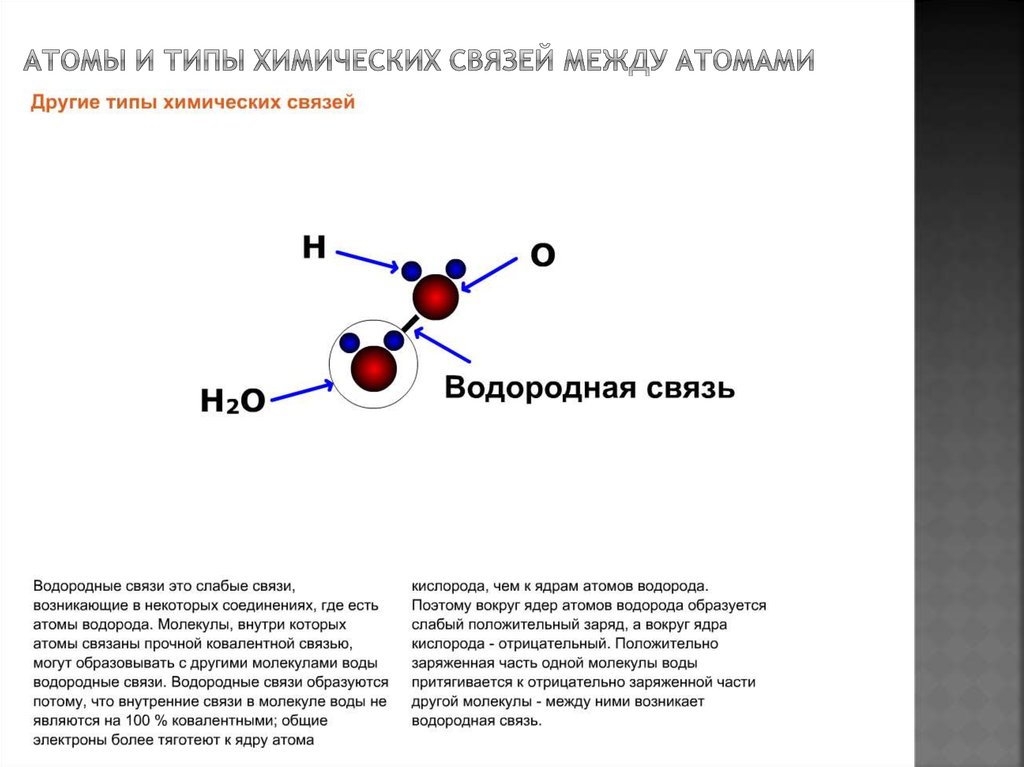 ), он же нужен в качестве переносчика энергии в процессе фотосинтеза.
), он же нужен в качестве переносчика энергии в процессе фотосинтеза.
Один моль любого вещества всегда содержит 6.02 × 10 23 молекул вещества. Поэтому молярная концентрация ионов водорода в чистой воде, представляется как [H +], 10 -7 моль /л. В действительности, H + обычно связывается с другой молекулой воды, чтобы сформировать ион гидроксония (h4O +).
Введение в современную науку о жизни», Сергей Ястребов – ЛитРес, страница 4
2. Вода
Что такое вода?
Ученые ответят: Н2O.
А Дональд Биссет:
– Алмазы на траве.
НАТАЛЬЯ ШЕРЕШЕВСКАЯ(ИЗ КНИГИ ДОНАЛЬДА БИССЕТА “ЗАБЫТЫЙ ДЕНЬ РОЖДЕНИЯ”)
Вода – одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности, и ее очень много в живых организмах – гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе – например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода – это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля – единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Воды много и в космосе – например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода – это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля – единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O). Соответственно, химическая формула воды – H2O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H – O–H. Это эквивалентно формуле H2O, которую обычно приводят в книгах.
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо “слипаются” друг с другом.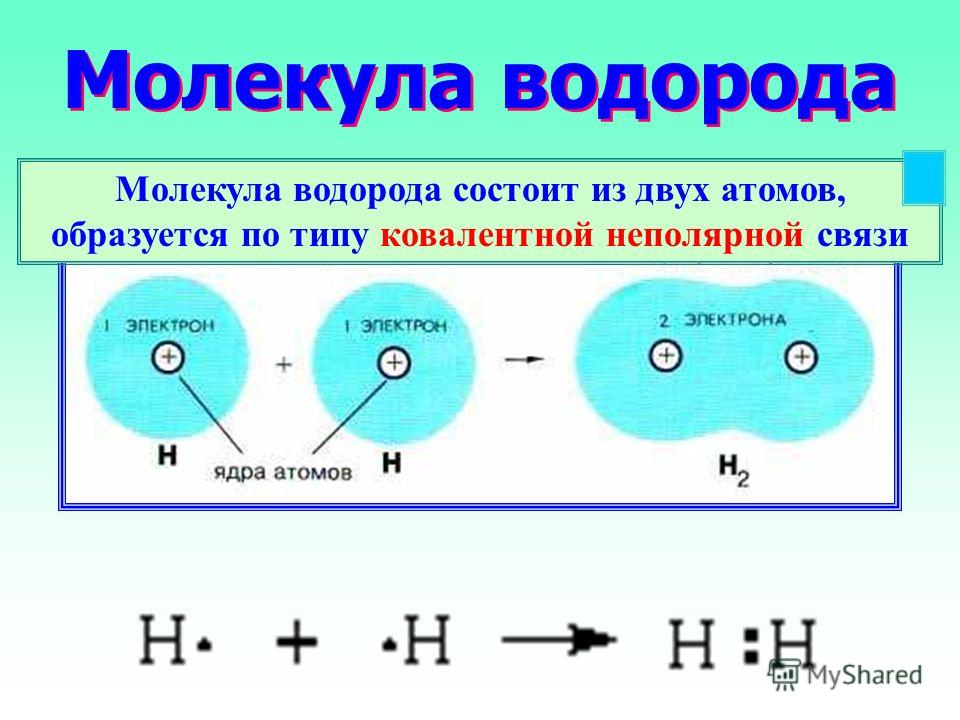 Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества – прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества – прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие “электроотрицательность”, введенное когда-то Лайнусом Полингом. Электроотрицательность – это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент – фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко.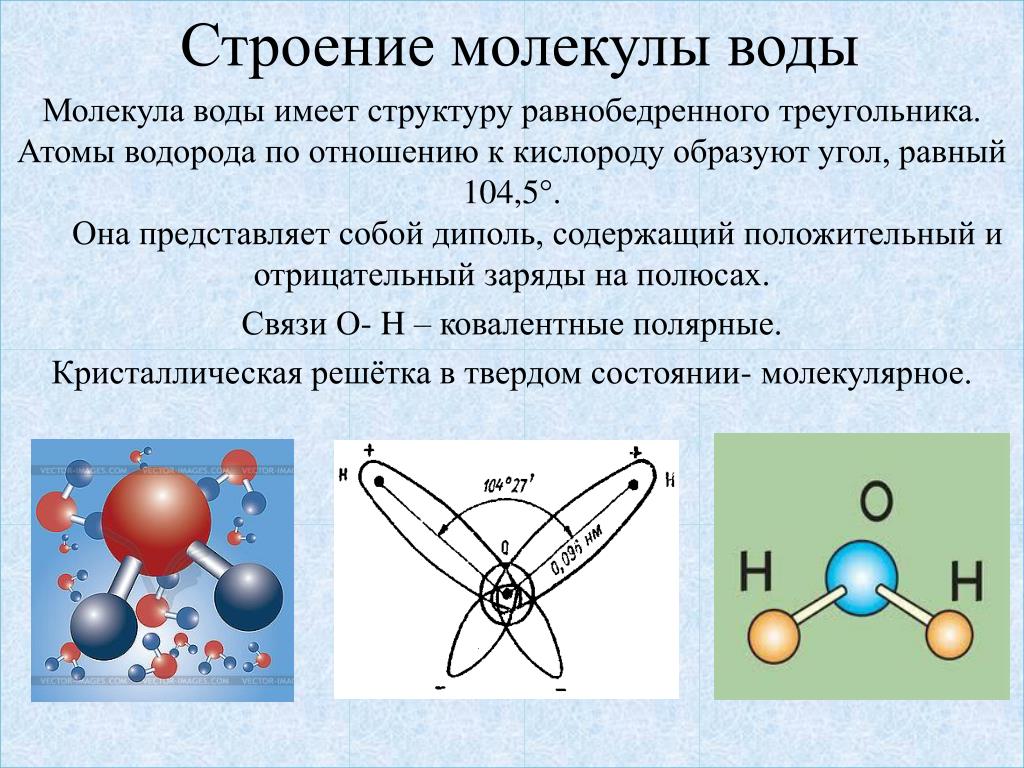 Запомним этот факт, он нам пригодится.
Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H – H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 2.1, 2.2А). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную – это случится, если один атом полностью “отберет” общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные – очень часто. Например, это широко распространенные в органических веществах связи C – O и H – O (см. главу 1).
Например, это широко распространенные в органических веществах связи C – O и H – O (см. главу 1).
Связь между водородом и кислородом в молекуле воды – это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах водорода – маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых значительно меньше единицы, принято обозначать буквой δ (“дельта”) с добавлением соответствующего знака. Как мы теперь знаем, связи кислорода с водородом или углеродом вообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде (см. рис. 2.1, 2.2Б).
А вот связь между углеродом и водородом (C – H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, – они называются водородными (см. рис. 2.2В). Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много. А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость – ее трудно нагреть и трудно остудить.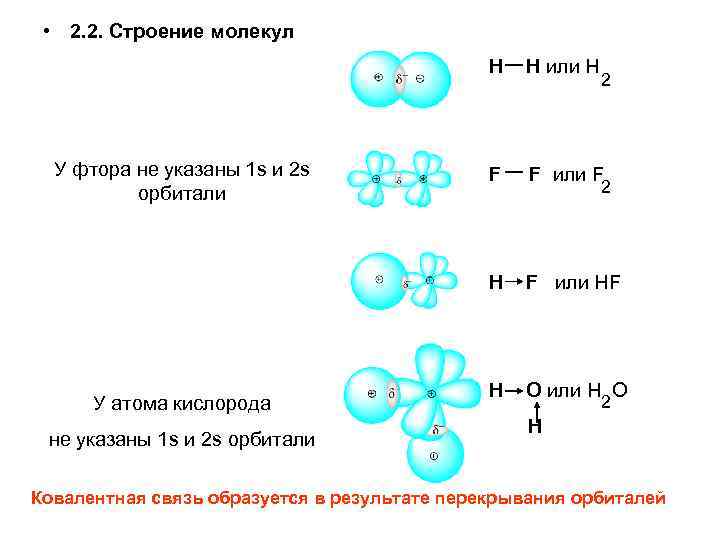 Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
“Водородная связь чем-то напоминает любовь втроем”, – писал в своем известном университетском учебнике американский биохимик Люберт Страйер{17}. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут” своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора – атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 2.3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация – процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут” своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора – атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 2.3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация – процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой – в первую очередь потому, что образуют с ней водородные связи, “цепляясь” за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными (“любящими воду”). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте – основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева{18}. Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды – тот самый процесс, который мы только что назвали гидратацией. Менделеев убедительно показал, что растворение – это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор – это, по сути, новое вещество.
К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте – основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева{18}. Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды – тот самый процесс, который мы только что назвали гидратацией. Менделеев убедительно показал, что растворение – это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор – это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи.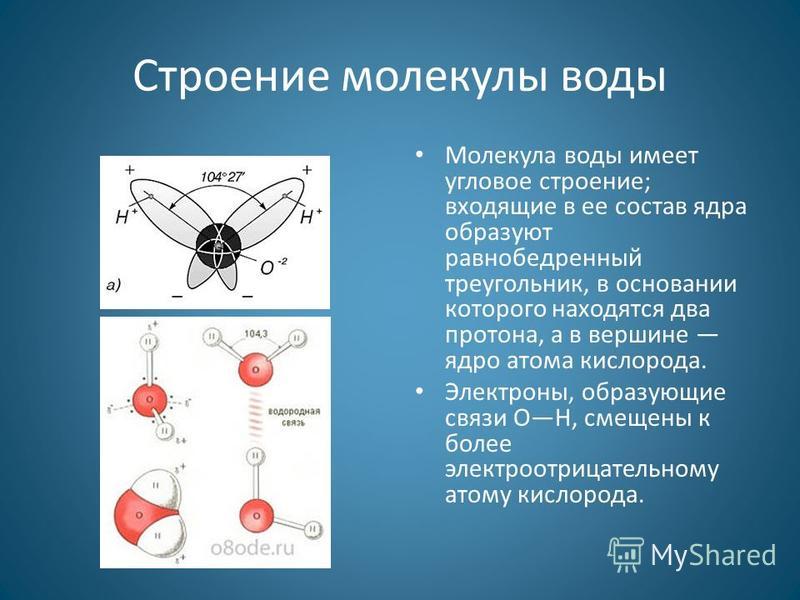 Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом{19}. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными (“боящимися воды”). Типичные гидрофобные соединения – углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться – ни при каких условиях. А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы “выталкивает” эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка. Гидрофильными бывают и некоторые бескислородные органические вещества – например, амины.
Гидрофильными бывают и некоторые бескислородные органические вещества – например, амины.
В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь – водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ – да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.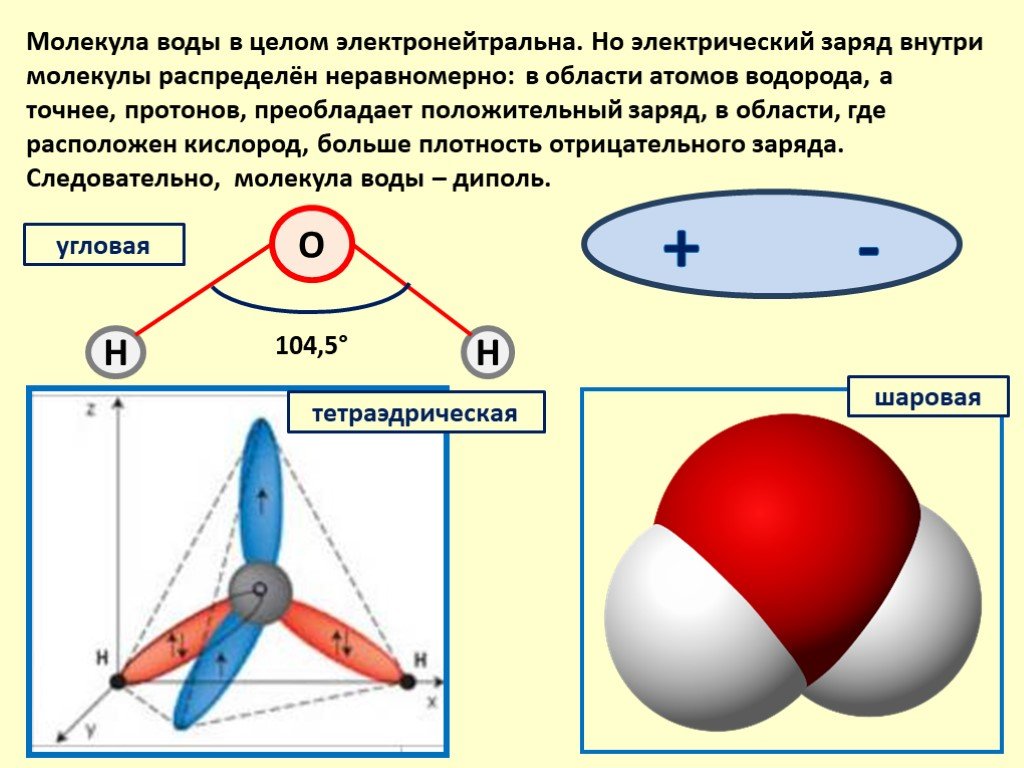 В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии{20}.
В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии{20}.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых “суперземлях” – планетах с массой, в несколько раз превосходящей массу Земли{21}. Суперземли – довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни – аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2.2Г). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать. Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода – ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать. Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода – ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, – метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают “сконструировать” живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол – одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни{22}. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни{22}. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя – сероводород, соединение водорода и серы с формулой H2S (она же H – S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио – спутнике Юпитера, который отличается невероятной геологической активностью.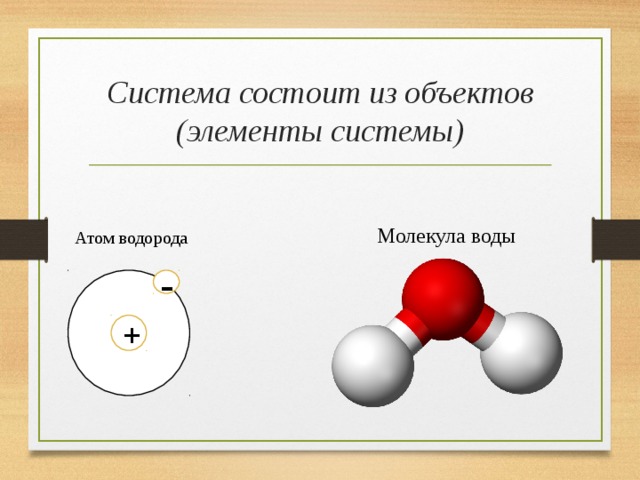 Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио – это настоящий “мир льда и пламени”{23}. Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь – на воде.
Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио – это настоящий “мир льда и пламени”{23}. Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь – на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна – Титане – есть углеводородные озера и даже моря, состоящие из метана (CH4), этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно “заточены” под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно “заточены” под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, “аш-фтор”). Водный раствор фтороводорода – очень агрессивное вещество, которое называется плавиковой кислотой (в сериале “Во все тяжкие”, главный герой которого – химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова “Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…”
“Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…”
Великий популяризатор науки Айзек Азимов – кстати говоря, биохимик по научной специальности – не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином “талассогены”, что буквально значит “производящие море”. По определению Азимова, талассоген – это вещество, способное сформировать планетарный океан. В замечательной книге “Асимметрия жизни”{24} Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены – это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. “Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли”.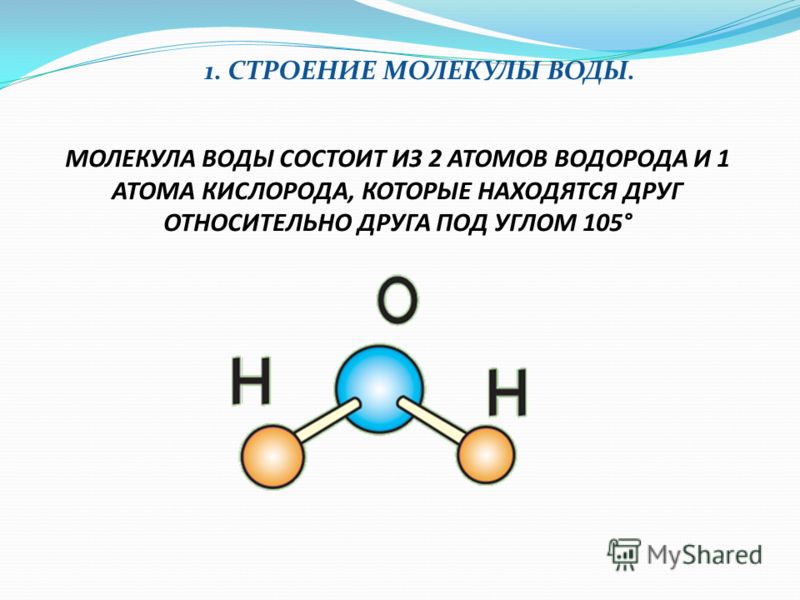 Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она – не единственная теоретически возможная. Изучая природу, всегда полезно помнить любимую мысль Станислава Лема: “Среди звезд нас ждет Неизвестное”.
3. Белки
– А вот товарищ Амперян говорит, что без белка жить нельзя, – сказал Витька, заставляя струю табачного дыма сворачиваться в смерч и ходить по комнате, огибая предметы.
– Я говорю, что жизнь – это белок, – возразил Эдик.
– Не ощущаю разницы, – сказал Витька. – Ты говоришь, что если нет белка, то нет и жизни.
АРКАДИЙ И БОРИС СТРУГАЦКИЕ.ПОНЕДЕЛЬНИК НАЧИНАЕТСЯ В СУББОТУ
В разговорах о современной биологии слово “белок” звучит очень часто. Все знают, что белки – важнейшие питательные вещества. Но одновременно это еще и сложные биохимические машины, выполняющие в организме множество самых разных функций: дыхание, пищеварение, считывание наследственной информации, сокращение мышц, защита, восприятие света, передача сигналов… проще сказать, чего белки не делают. Что же это, в конце концов, такое?
Начнем с того, что белки, или протеины, – это огромные молекулы, входящие в состав абсолютно всех современных живых организмов. История их названия, честно говоря, довольно запутанна. Сам термин “белок” (albumin) вошел в употребление еще в XVIII веке, и относился он тогда к веществам, подобным всем известному белку куриного яйца. Что касается термина “протеин” (protein), то его придумал знаменитый шведский химик Йёнс Якоб Берцелиус. Кроме этого, Берцелиус открыл несколько новых химических элементов, установил формулы ряда органических кислот, разобрался в явлении электролиза и сделал еще много другого. В частности, именно Берцелиус открыл явление изомерии и ввел само понятие “изомеры”, уже нам знакомое (см. главу 1). Да и термин “органическая химия” тоже принадлежит ему.
Что касается термина “протеин” (protein), то его придумал знаменитый шведский химик Йёнс Якоб Берцелиус. Кроме этого, Берцелиус открыл несколько новых химических элементов, установил формулы ряда органических кислот, разобрался в явлении электролиза и сделал еще много другого. В частности, именно Берцелиус открыл явление изомерии и ввел само понятие “изомеры”, уже нам знакомое (см. главу 1). Да и термин “органическая химия” тоже принадлежит ему.
Так вот, в 1838 году Берцелиус предложил назвать некоторые органические вещества “протеинами”{25}. Слово это произведено от греческого πρώτειος, “первичный”. Придумывая свой термин, Берцелиус предполагал, что “протеины” – это некие первичные строительные блоки живых организмов, и был, как мы сейчас знаем, совершенно прав.
В русском языке “белок” и “протеин” – строгие синонимы. По буквальному смыслу “протеин”, конечно, точнее, чем “белок”. Но как-то уж так сложилось, что в нашей научной литературе слово “белок” употребляется гораздо чаще, и мы будем этому следовать.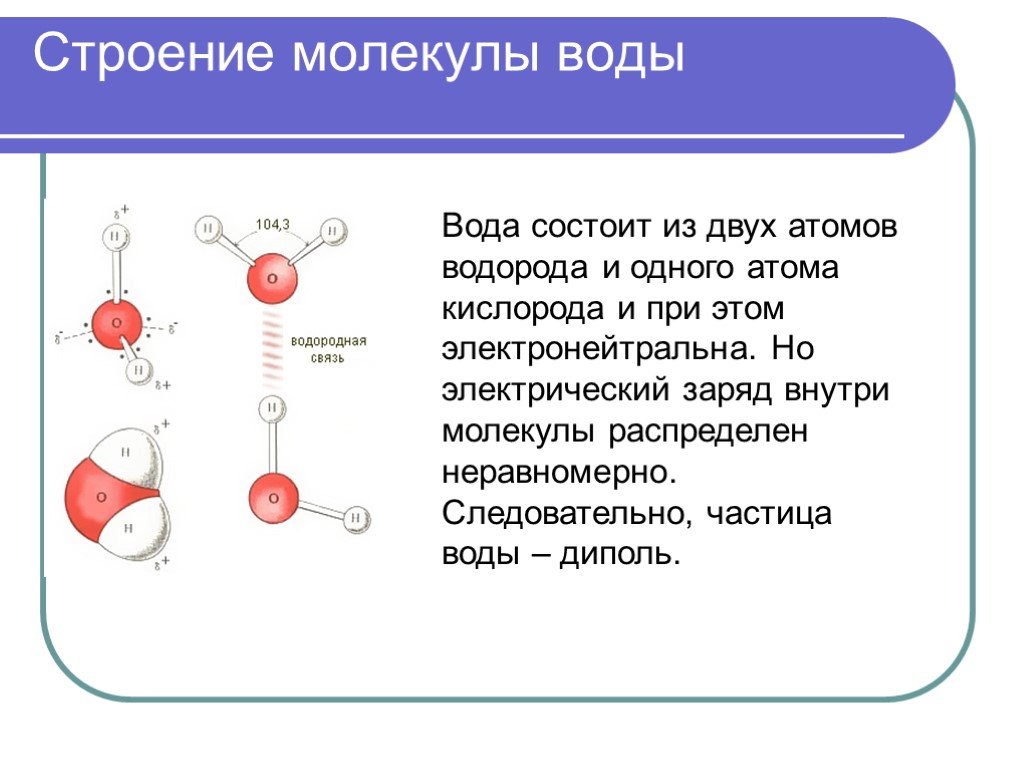 Скорее всего, дело тут просто в том, что слово “белок” проще для восприятия и привычнее на слух.
Скорее всего, дело тут просто в том, что слово “белок” проще для восприятия и привычнее на слух.
17. Страйер Л. Биохимия. – М.: Мир, 1984–1985 (2 тома).
18. Менделеев Д.И. Рассуждение о соединении спирта с водою, представленное в физико-математический факультет Императорского Санкт-Петербургского университета для получения степени доктора химии (1865).
19. Друг с другом они взаимодействуют за счет так называемых ван-дер-ваальсовых сил – электростатического притяжения нейтральных молекул, возникающего между мгновенными микрозарядами, которые неизбежно образуются из-за случайного характера движения электронов внутри этих молекул. Благодаря ван-дер-ваальсовым силам даже совершенно неполярные молекулы могут притягиваться друг к другу, хотя и слабо.
20. Inagaki F. et al. Microbial community in a sediment-hosted CO2 lake of the southern Okinawa Trough hydrothermal system // Proceedings of the National Academy of Sciences, 2006. V. 103, № 38, 14164–14169.
21. Budisa N.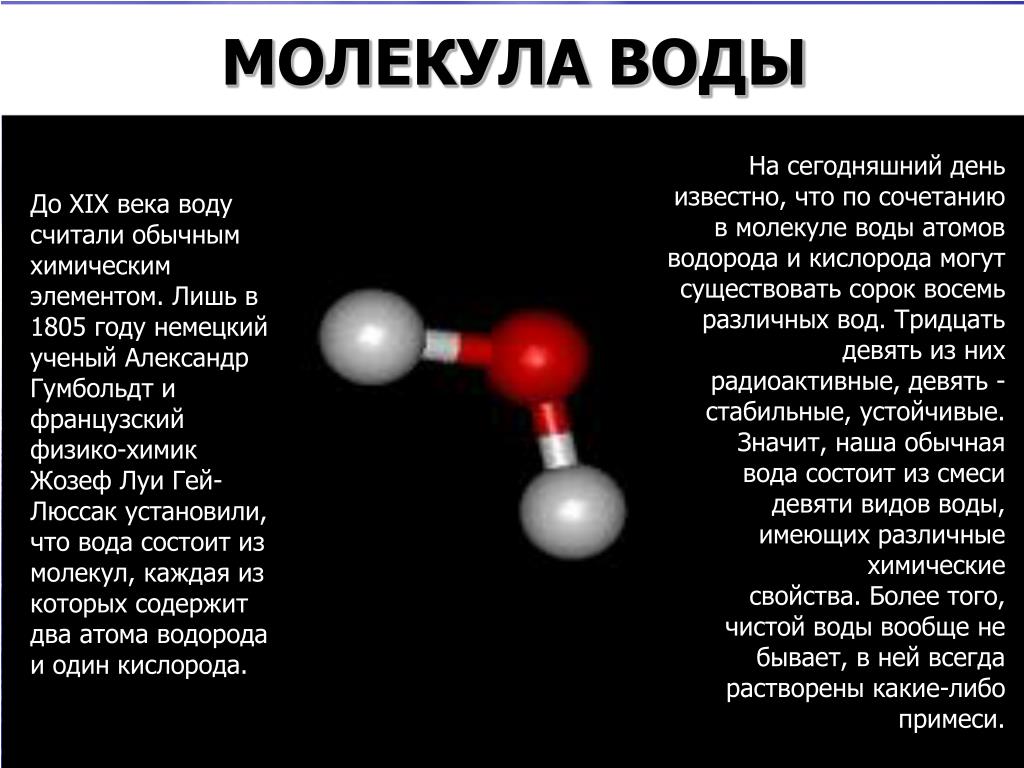 , Schulze-Makuch D. Supercritical carbon dioxide and its potential as a life-sustaining solvent in a planetary environment // Life, 2014, V. 4, № 3, 331–340.
, Schulze-Makuch D. Supercritical carbon dioxide and its potential as a life-sustaining solvent in a planetary environment // Life, 2014, V. 4, № 3, 331–340.
22. Whittet D. C. B. et al. Observational constraints on methanol production in interstellar and preplanetary ices // The Astrophysical Journal, 2011, V. 742, № 1, 1–10.
23. Schulze-Makuch D. Io: Is life possible between fire and ice // Journal of Cosmology, 2010, V. 5, 912–919.
24. Азимов А. Асимметрия жизни. От секрета научных прозрений до проблемы перенаселения. – М.: Центрполиграф, 2008.
25. Vickery H. B. The origin of the word protein // The Yale Journal of Biology and Medicine, 1950, V. 22, № 5, 387–393.
Молекулярные связи и силы — биохимия
Все ресурсы по биохимии
6 Диагностические тесты 289 практических тестов Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 3 4 Следующая →
Биохимия Помощь » Фундаментальные макромолекулы и концепции » Молекулярные связи и силы
Какое максимальное количество водородных связей может образовать одна молекула воды?
Возможные ответы:
Два
Четыре
Три
Один
Правильный ответ:
Четыре
5 9 Пояснение:
Водород может образовывать водородные связи с азотом, кислородом и фтором. Молекула воды состоит из атома кислорода, связанного с двумя атомами водорода. Каждый атом водорода может образовывать водородную связь с атомом азота, фтора или кислорода. Кроме того, кислород, который имеет две неподеленные пары электронов, может образовывать две водородные связи с атомами водорода. Это составляет четыре водородные связи на молекулу воды.
Молекула воды состоит из атома кислорода, связанного с двумя атомами водорода. Каждый атом водорода может образовывать водородную связь с атомом азота, фтора или кислорода. Кроме того, кислород, который имеет две неподеленные пары электронов, может образовывать две водородные связи с атомами водорода. Это составляет четыре водородные связи на молекулу воды.
Сообщить об ошибке
Какая молекула не образует водородных связей?
Возможные ответы:
Правильный ответ:
Пояснение:
Только азот, кислород и фтор могут образовывать водородные связи, так как эти три элемента очень электроотрицательны. Таким образом, их частичный отрицательный заряд (и наличие неподеленной пары электронов) притягивает частично положительный атом водорода. Углерод, с другой стороны, не очень электроотрицателен и поэтому не может образовывать водородные связи.
Сообщить об ошибке
Чем отличается прочность водородных связей от прочности ионных связей?
Возможные ответы:
Водородные связи так же прочны, как ионные связи.
Зависит от температуры.
Водородные связи слабее ионных.
Водородные связи прочнее ионных.
Правильный ответ:
Водородные связи слабее ионных.
Объяснение:
Сила связи измеряется в килоджоулях/моль. Водородные связи могут иметь прочность . Ионные связи могут иметь прочность . Это делает водородные связи намного слабее, чем ионные связи.
Сообщить об ошибке
A: аденин
U: урацил
C: цитозин
G: гуанин
T: тимин
Для разрыва какой из следующих пар оснований ДНК требуется больше всего энергии?
Возможные ответы:
A-U
G-A
C-T
G-C
T-A
Правильный ответ:
G-C
Пояснение:
Урацил не является основанием в ДНК, поэтому ответ A-U можно исключить. Более того, C-G и A-T являются правильными парами оснований, поэтому другие комбинации также могут быть исключены. C-G требует больше энергии для разрыва, потому что между этими основаниями есть три водородные связи, в то время как у AT есть только две водородные связи, удерживающие их вместе.
Более того, C-G и A-T являются правильными парами оснований, поэтому другие комбинации также могут быть исключены. C-G требует больше энергии для разрыва, потому что между этими основаниями есть три водородные связи, в то время как у AT есть только две водородные связи, удерживающие их вместе.
Сообщить об ошибке
Что такое хиральный центр?
Возможные ответы:
Атом, имеющий только одну двойную связь, но другие составляющие уникальны.
Атом, конфигурация которого является жесткой и не имеет свободы вращения.
Атом с несколькими изомерами.
Атом с заместителями, организованными таким образом, что молекула не может быть наложена на ее зеркальное отражение.
Атом, имеющий уникальные заместители.
Правильный ответ:
Атом с заместителями, организованными таким образом, что молекула не может быть наложена на ее зеркальное отражение.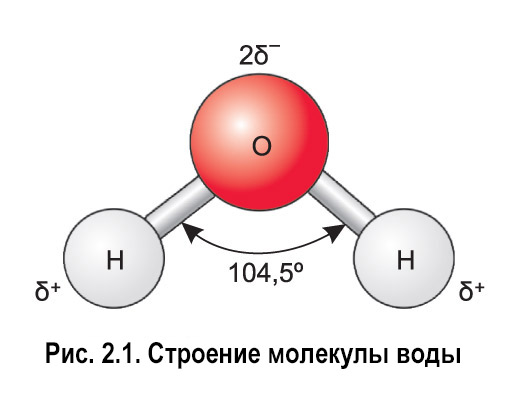
Пояснение:
Заместители хирального центра расположены особым образом, который не может быть наложен на его зеркальное отображение. Примером может служить атом углерода с четырьмя уникальными группами заместителей.
Сообщить об ошибке
Почему вода способствует образованию водородных связей?
Возможные ответы:
Все остальные ответы верны.
Вода является полярным растворителем.
Кислород электроотрицательный.
Два атома водорода ковалентно связаны.
Вода представляет собой электрический диполь.
Правильный ответ:
Все остальные ответы верны.
Пояснение:
Кислород более электроотрицателен, чем водород. Это приводит к тому, что электроны проводят больше времени с атомом кислорода, делая его отрицательно заряженным, а атомы водорода — положительно заряженными. Затем заряженная молекула воды способна образовывать водородные связи с полярными молекулами.
Затем заряженная молекула воды способна образовывать водородные связи с полярными молекулами.
Сообщить об ошибке
Какую аминокислоту вы ожидаете обнаружить в ядре белка, находящегося в водном растворе?
Возможные ответы:
Серин
Триптофан
Треонин
Аргинин
Правильный ответ: 909905 40004 Объяснение:
Белки будут вести себя подобно фосфолипидам в воде; полярные группы будут образовывать благоприятные взаимодействия на поверхности с водой, в то время как гидрофобные группы будут находиться в ядре и вдали от молекул воды. Обычно аминокислоты с неполярными остатками находятся в ядре белков. Триптофан имеет неполярную боковую цепь и, таким образом, находится в ядре белка, находящегося в водной среде.
Сообщить об ошибке
Что из следующего объясняет, почему неполярные молекулы, такие как липиды, спонтанно агрегируют в воде?
Возможные ответы:
Ионная связь; молекулы липидов образуют прочные ионные связи друг с другом, которые они не могут образовать с водой
Ковалентная связь; молекулы липидов образуют прочные ковалентные связи друг с другом, которые они не могут образовать с водой
Энтропия; молекулы воды приобретают больше степеней свободы в результате того, что неполярные молекулы образуют один большой агрегат из множества более мелких
Энтальпия; молекулы липидов поглощают огромное количество тепла, когда они связываются друг с другом, а не с водой
Водородная связь; молекулы липидов сильнее взаимодействуют друг с другом посредством водородных связей, чем с водой
Правильный ответ:
Энтропия; молекулы воды приобретают больше степеней свободы в результате того, что неполярные молекулы образуют один большой агрегат из множества более мелких
Объяснение:
В водных растворах молекулы липидов окружены решетчатым кольцом молекул воды, известным как клатратная оболочка. Это блокирует ранее свободные молекулы воды в этом состоянии, которое не является энтропийно благоприятным. Хотя неизбежно, что некоторые молекулы воды должны быть лишены свободы движения путем образования хотя бы одной клатратной оболочки, с термодинамической точки зрения идеальным сценарием является сценарий, при котором в оболочке застревает как можно меньше молекул воды. В результате липидные пузырьки в водных растворах имеют тенденцию превращаться из многих в один, поскольку это приводит к оболочке клатрата с наименьшим количеством молекул воды. При этом разрушается множество более мелких клатратных оболочек и высвобождается много молекул воды, что увеличивает энтропию системы.
Это блокирует ранее свободные молекулы воды в этом состоянии, которое не является энтропийно благоприятным. Хотя неизбежно, что некоторые молекулы воды должны быть лишены свободы движения путем образования хотя бы одной клатратной оболочки, с термодинамической точки зрения идеальным сценарием является сценарий, при котором в оболочке застревает как можно меньше молекул воды. В результате липидные пузырьки в водных растворах имеют тенденцию превращаться из многих в один, поскольку это приводит к оболочке клатрата с наименьшим количеством молекул воды. При этом разрушается множество более мелких клатратных оболочек и высвобождается много молекул воды, что увеличивает энтропию системы.
Сообщить об ошибке
Что из следующего неверно относительно гидрофобных эффектов?
Возможные ответы:
Они могут возникать в неводной среде.
Клеточные мембраны удерживаются вместе частично за счет гидрофобных эффектов.
Гидрофобные группы не связаны точно друг с другом, а удерживаются вместе из-за отталкивания от воды.
Они функционируют, потому что гидрофобные группы слипаются вместе, поэтому они не разрывают водородные связи в окружающей воде.
Как правило, только неполярные вещества проявляют гидрофобные эффекты.
Правильный ответ:
Они могут возникать в неводной среде.
Пояснение:
Для гидрофобного эффекта требуется вода. Причина, по которой гидрофобные группы имеют тенденцию группироваться, заключается в том, что при этом сеть молекул воды вокруг них остается неповрежденной. Между гидрофобными группами нет никаких других сил специального назначения. Именно неполярная природа гидрофобных групп придает им характер; молекулы воды полярны. Клеточные мембраны имеют фосфолипидный бислой с внутренними гидрофобными областями (липидными хвостами), скрепляющими мембрану.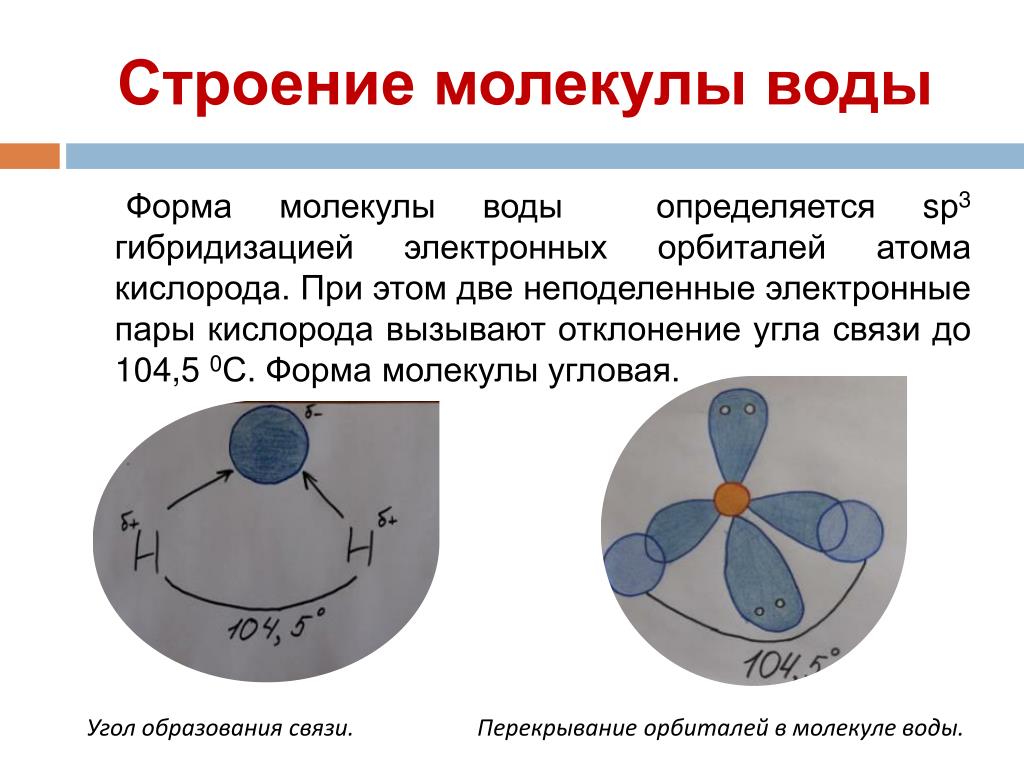
Сообщить об ошибке
Какое из следующих утверждений объясняет общее изменение энтропии при погружении небольшого количества неполярного растворенного вещества в воду?
Возможные ответы:
Энтропия увеличивается, потому что молекулы воды исключают неполярное растворенное вещество, чтобы взаимодействовать друг с другом и восстанавливать более высокое состояние беспорядка.
Энтропия уменьшается, потому что неполярное растворенное вещество имеет сродство к себе и агрегирует вместе.
Энтропия остается неизменной, потому что нет значительного взаимодействия между молекулами воды и неполярным растворителем.
Энтропия уменьшается, потому что вода должна стать более упорядоченной в сети водородных связей вокруг неполярных молекул.
Правильный ответ:
Энтропия увеличивается, потому что молекулы воды исключают неполярное растворенное вещество, чтобы взаимодействовать друг с другом и восстанавливать более высокое состояние беспорядка.
Пояснение:
Это называется гидрофобным эффектом. Хотя первоначально молекулы воды располагаются в клатратах и становятся более упорядоченными, их исключение гидрофобного/неполярного растворенного вещества обусловлено энтропией и является энергетически выгодным.
Сообщить об ошибке
← Предыдущая 1 2 3 4 Следующая →
Уведомление об авторских правах
Все ресурсы по биохимии
6 Диагностические тесты 289 практических тестов Вопрос дня Карточки Learn by Concept
Природа вблизи: вода и жизнь, какой мы ее знаем
Воскресное утро
/ Новости Си-Би-Эс
Видеооператор «Воскресное утро» Джуди Лемберг.
Жизнь, какой мы ее знаем, была бы невозможна без воды, а вода обязана своими уникальными свойствами водородным связям. Вы, возможно, помните из школьного курса естествознания, что существует несколько типов химических связей. Ионная связь образуется, когда один отрицательно заряженный атом притягивается к положительно заряженному атому, и они неравномерно делят один или несколько электронов; то есть электрон (ы) проводят больше времени ближе к тому или иному атому. Ковалентная связь образуется, когда два атома имеют общие электроны. И ионная, и ковалентная связи относительно прочны.
Водородные связи — это третий тип связи, гораздо более слабый, но не менее важный, чем первые два. Водородная связь — это слабое притяжение чего-то слегка положительного к чему-то слегка отрицательному. Молекулы воды образуются, когда два атома водорода делят электроны с одним атомом кислорода, образуя две ковалентные связи . Это становится интересным, когда мы изучаем форму молекулы воды и исследуем водородные связи, возникающие между молекулами воды. Молекулы воды имеют форму не HOH, а такую, как на следующем рисунке.
Молекулы воды имеют форму не HOH, а такую, как на следующем рисунке.
На этом рисунке показано, как атомы в молекулах воды расположены примерно на 104 градуса между водородом и кислородом в каждой молекуле.
Геологическая служба США 104 градуса имеют большое значение для придания воде ее уникальных свойств, потому что это то, что делает молекулы воды полярными — более положительными на концах водорода и более отрицательными на концах кислорода. Водородные связи возникают, когда кислородный конец одной молекулы воды притягивается к водородному концу другой молекулы воды, как показано пунктирными линиями. Водородные связи — это то, что придает воде все ее уникальные свойства. Вот почему он бывает в трех состояниях (газообразное, жидкое, твердое), почему он плавает, почему растения испаряются, почему он является отличным растворителем, отличным изолятором, хорошим хладагентом, имеет такую высокую теплоту испарения, смягчает колебания температуры. , и вообще делает возможной жизнь на Земле.
, и вообще делает возможной жизнь на Земле.
Молекулы воды слева расположены так же, как и в жидкой воде; справа, так как они находятся во льду. Обратите внимание, что между молекулами справа больше места из-за 104-градусной водородной связи.
Чтобы лучше понять разницу между молекулами воды в жидкой и твердой воде, представьте себе комнату, полную людей, которые постоянно перемещаются и находятся достаточно близко друг к другу. Теперь представьте, что кто-то подает сигнал, и каждый должен вытянуть руки под углом 104 градуса между руками и коснуться головы двух других людей. Сколько человек может поместиться в этой комнате во втором сценарии? Я не знаю точного ответа, но знаю, что это число меньше, чем в первом примере. Это показывает, почему вода обладает необычным свойством быть менее плотной в твердом состоянии, чем в жидком.
Поскольку лед плавает в озере, он изолирует находящиеся под ним организмы и не дает им замерзнуть, как, например, на этом озере в Йеллоустонском национальном парке:
Замерзшая вода в виде снега также является хорошим изолятором, позволяющим некоторым животные, чтобы пережить долгие зимы под защитным слоем снега, как показано здесь на горе Шаста:
Поскольку так много воды поглощается из почвы корнями растений и, наконец, выбрасывается в атмосферу, растения могут сами создавать дождь. Транспирация – это процесс, при котором растения поглощают воду из почвы, через свое тело и в окружающую атмосферу через поры в листьях (называемые устьицами). Это происходит потому, что молекулы воды притягиваются друг к другу из-за водородных связей и втягивают друг друга в растение за счет капиллярного действия, буквально бросая вызов гравитации.
Транспирация – это процесс, при котором растения поглощают воду из почвы, через свое тело и в окружающую атмосферу через поры в листьях (называемые устьицами). Это происходит потому, что молекулы воды притягиваются друг к другу из-за водородных связей и втягивают друг друга в растение за счет капиллярного действия, буквально бросая вызов гравитации.
Поскольку большинство растений живут в районах с достаточным количеством влаги, они не способны удерживать воду – они могут терять более 90% поглощаемой ими воды. (То же самое нельзя сказать о пустынных растениях, которые по необходимости удерживают воду.) Средний дуб или клен, покрытые листвой, имеют огромную площадь поверхности и поэтому могут терять от 3000 до 4000 галлонов воды каждый год. Капиллярное действие в растениях является причиной того, что тропические леса могут буквально создавать свои собственные осадки.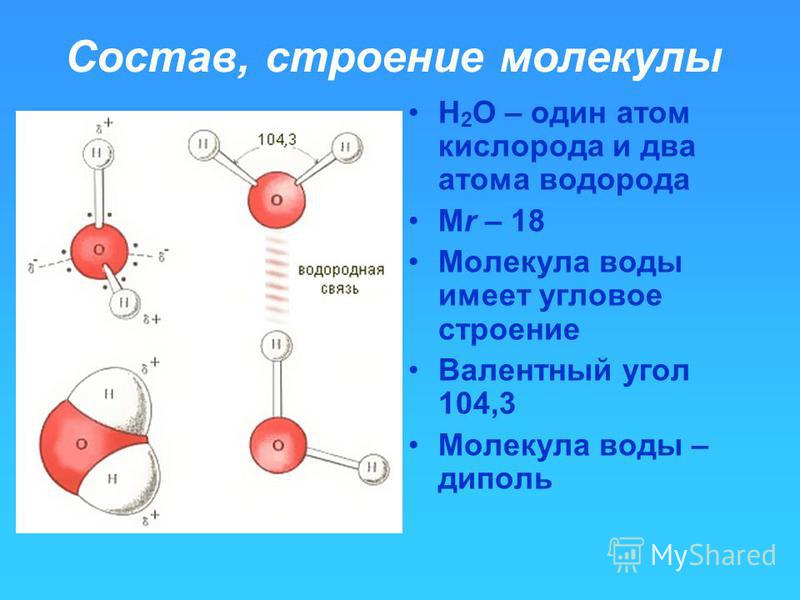 Они вытягивают из почвы столько воды, что образуются облака и идет дождь.
Они вытягивают из почвы столько воды, что образуются облака и идет дождь.
Джуди Лемберг — бывшая учительница биологии в колледже, которая сейчас снимает видео о природе.
См. также:
- Джуди Лемберг (официальный сайт)
- Канал Джуди Лемберг на YouTube
Актуальные новости
Впервые опубликовано 25 января 2019 г./ 9:30
© 2019 CBS Interactive Inc. Все права защищены.
Спасибо, что читаете CBS NEWS.
Создайте бесплатную учетную запись или войдите в систему
, чтобы получить доступ к дополнительным функциям.
Пожалуйста, введите адрес электронной почты, чтобы продолжить
Пожалуйста, введите действительный адрес электронной почты, чтобы продолжить
Структура воды и водородные связи Учебное пособие
Вода необходима для выживания жизни.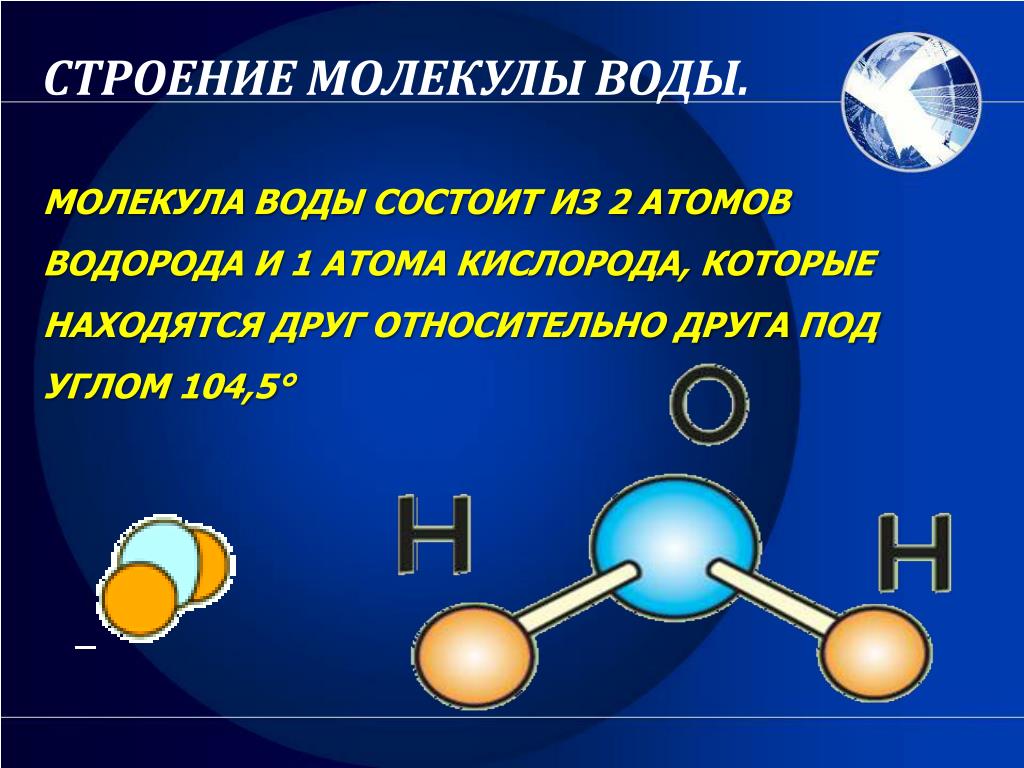 Отличительные качества воды обусловлены полярностью ее молекул, особенно ее способностью образовывать водородные связи друг с другом и с другими молекулами.
Отличительные качества воды обусловлены полярностью ее молекул, особенно ее способностью образовывать водородные связи друг с другом и с другими молекулами.
Введение:
Вода необходима для всех форм жизни. Он обладает несколькими замечательными химическими свойствами, которые делают его идеальным для жизнеобеспечения. В этой статье давайте углубимся в понимание водородных связей воды.
Растворяющие свойства воды:
Источник
Воду часто называют «универсальным растворителем» из-за ее способности растворять многие растворенные вещества. Однако некоторые масла не растворяются в воде, и это связано с тем, что вода хорошо растворяет ионы и полярные молекулы, но плохо растворяет неполярные молекулы. Молекулы воды полярны, имеют частичный положительный заряд на водороде, частичный отрицательный заряд на кислороде и скрученную общую структуру.
Когезия и адгезия воды:
- Молекулы воды могут связываться друг с другом, что называется когезией, а другие молекулы называются адгезией.

- Поверхностное натяжение вызывается когезионными силами, отвечающими за склонность поверхности жидкости сопротивляться разрыву при воздействии деформации или напряжения.
- Капли сферической формы образуются водой за счет поверхностного натяжения.
- Адгезия — это притяжение одного типа молекул к другому, и оно может быть относительно сильным для воды, особенно в сочетании с другими молекулами с положительным или отрицательным зарядом.
Удельная теплоемкость, теплота парообразования и плотность воды:
Вода обладает большой удельной теплоемкостью. Это означает, что вода может выдержать большое количество энергии, прежде чем ее температура изменится. Вода также имеет высокую теплоту парообразования, то есть теплоту, необходимую для перехода соединения из жидкого состояния в газообразное. Эффективность испарительного охлаждения (почему пот заставляет человека чувствовать себя прохладнее) и низкая плотность льда (плавающий лед) объясняются водородными связями.
Полярность молекулы воды
Молекулярная структура воды объясняет, что молекула воды состоит из двух атомов водорода, соединенных с атомом кислорода, и ее общая структура изогнута. Помимо образования связей с атомами водорода, атом кислорода несет два неподеленных электрона.
Как общие, так и неподеленные пары электронов отталкивают друг друга. Поскольку кислород более электроотрицательный (электроно-жадный), чем водород, он захватывает электроны и удерживает их подальше от атомов водорода. Это приводит к частичному отрицательному заряду на кислородном конце молекулы воды и частичному положительному заряду на водородном конце. Таким образом, вода классифицируется как полярная молекула.
Водородная связь
Водородная связь представляет собой межмолекулярную силу притяжения, при которой ковалентно связанный атом водорода притягивается к неподеленной паре электронов на атоме в соседней молекуле. Водородные связи довольно прочны по сравнению с другими дипольными взаимодействиями, и типичная водородная связь имеет примерно 5% прочности ковалентной связи.
Водородные связи в молекулах воды приводят к уникальным, но очень важным свойствам. Большинство молекулярных соединений с массой, близкой к воде, являются газами при комнатной температуре. Молекулы воды могут оставаться конденсированными в жидкости из-за сильных водородных связей. На приведенной ниже диаграмме показано, как изогнутая форма и два атома водорода на молекулу позволяют каждой молекуле воды связываться с двумя другими молекулами.
Источник
- Водородные связи воды могут разрываться и восстанавливаться, когда молекулы перемещаются из одного места в другое в жидком состоянии. Молекулы воды начинают замедляться по мере ее охлаждения.
- Когда вода превращается в лед, водородные связи становятся постоянными и создают высокоспециализированную сеть.
- Искаженная форма молекул вызывает пустоты в сети водородных связей льда.
- Лед обладает странным достоинством: в твердом состоянии он менее плотный, чем в жидком. В жидкой воде лед плавает.

Водородная связь в воде
Водородная связь представляет собой динамическое притяжение между окружающими молекулами воды, при котором один атом водорода располагается между двумя атомами кислорода в воде. В жидкой воде водородная связь возникает, когда атомы водорода одной молекулы воды притягиваются к атому кислорода соседней молекулы воды.
Источник
- Благодаря компоненту полярности молекулы воды притягиваются друг к другу.
- Положительный конец одного, атома водорода, соединяется с отрицательным концом атома кислорода. Это водородные связи, слабые связи, которые развиваются между атомом водорода с частичным положительным зарядом и более электроотрицательным атомом, например кислородом.
- Атомы водорода в водородных связях должны быть соединены с электроотрицательными атомами, такими как O, N и F.
Источник
- Молекулы воды притягиваются к другим полярным молекулам, а также к ионам. Гидрофильный относится к заряженному или полярному материалу, который взаимодействует с водой и растворяется в ней: гидро означает «вода», а фильный означает «любящий».

- Масла и жиры, например, являются неполярными соединениями, плохо взаимодействующими с водой. Они гидрофобны (фобия означает «страшный»), потому что они отделяются от него, а не растворяются в нем.
- Шкала pH измеряется от 0 до 14 и показывает, насколько кислой или щелочной является вода: кислой (pH < 7), нейтральной (pH = 7), щелочной/щелочной (pH > 7).
- Кислота – это любое вещество, реагирующее с выделением ионов водорода в водном растворе. Напротив, основание принимает ионы водорода. Чистая вода имеет рН 7 и считается «нейтральной», поскольку не имеет ни кислотных, ни основных свойств.
Заключение:
- Полярность молекулы воды важна при растворении ионных веществ при получении водных растворов.
- Водородная связь — это сила, при которой атом водорода, ковалентно связанный с мельчайшим чрезвычайно электроотрицательным атомом, притягивается к неподеленной паре электронов на атоме в соседней молекуле.
Часто задаваемые вопросы:
1.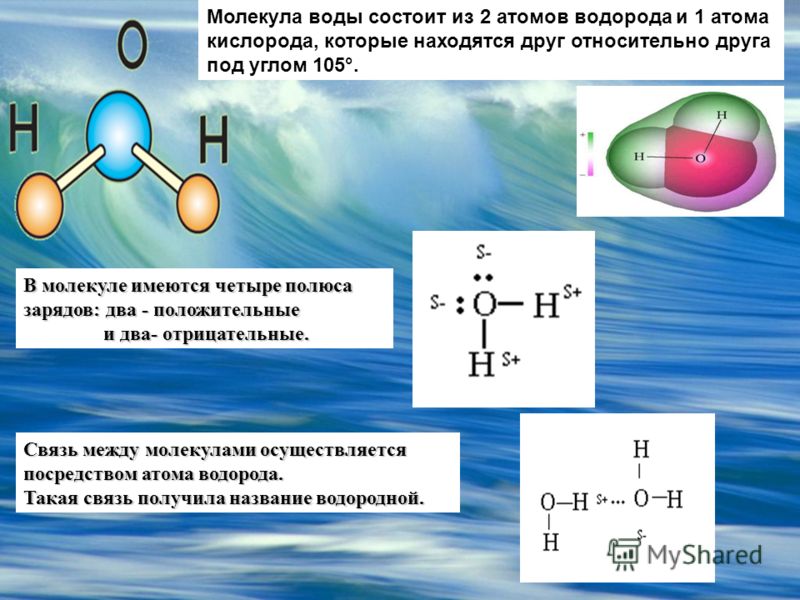 Как водородные связи влияют на структуру воды?
Как водородные связи влияют на структуру воды?
Водородные связи влияют на твердую структуру воды; по мере замерзания воды связи становятся более жесткими, что придает льду более открытую и менее плотную общую структуру. Существование водородных связей также делает молекулы воды более «липкими», или, говоря научным языком, когезивными и липкими.
2. Что произойдет, если в воде не будет водородных связей?
Без водородных связей молекулы воды двигались бы быстрее и с меньшим подводом тепла, в результате чего температура поднималась бы выше на каждую калорию подведенного тепла. Это также значительно снизит тепловую энергию, необходимую для фазовых переходов от льда к жидкости и от жидкости к пару.
3. Что вызывает образование водородных связей в воде?
В частном случае воды водородные связи развиваются между соседними атомами водорода и кислорода соседних молекул воды.
4. Какова наиболее важная роль водородных связей между молекулами воды?
Молекулы воды могут оставаться конденсированными в жидкости из-за сильных водородных связей.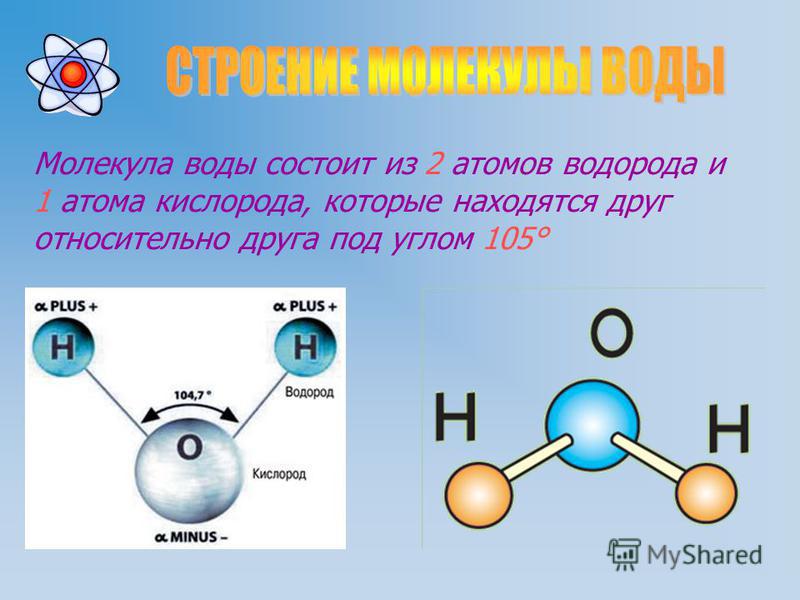
5. Какие условия необходимы для образования водородной связи?
Водородное соединение требует двух условий:
(i). Первая молекула имеет водородную связь с сильно электроотрицательным атомом (N, O, F).
(ii). Неподеленная пара электронов на мельчайшем крайне электроотрицательном атоме характеризует вторую молекулу (N, O, F).
6. Как разорвать водородные связи в воде?
Эти связи можно разорвать, просто добавив в воду другой материал или вещество.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о «Структура воды и водородные связи» ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, что это сделает учебу намного веселее! 😎
Источники:
- Вода.




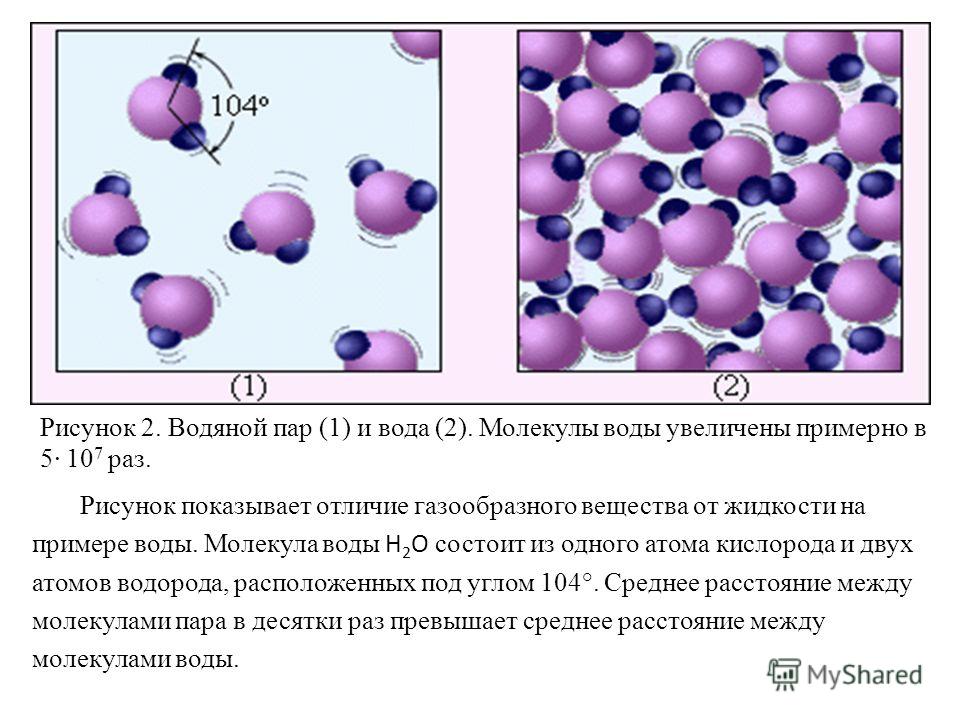 116(11), 4877–4882 (2019) внимание специалистов направлено на изучение движения молекулы углекислого газа (CO) с использованием динамического вращательного эффекта Доплера.
116(11), 4877–4882 (2019) внимание специалистов направлено на изучение движения молекулы углекислого газа (CO) с использованием динамического вращательного эффекта Доплера.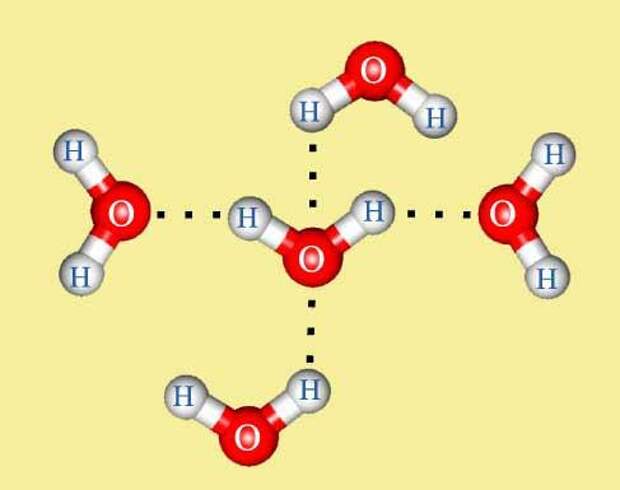
 Оже-спектр дает информацию о повороте оси молекулы за время жизни 1s-дырочного состояния (8 fs).
Оже-спектр дает информацию о повороте оси молекулы за время жизни 1s-дырочного состояния (8 fs). В качестве такого временного детектора использовался тот самый Оже-электрон, вылетевший через приблизительно 8 фемтосекунд после ионизации. Оказалось, что сверхбыстрый поворот молекулы приводит к зависящему от времени Допплеровскому сдвигу Оже-резонанса и характерной ассиметрии спектральной формы этого резонанса (см. Рисунок 3). Варьируя энергию рентгеновского фотона, а, следовательно, и скорость индуцированного вращения, удалось визуализировать динамику этого вращения».
В качестве такого временного детектора использовался тот самый Оже-электрон, вылетевший через приблизительно 8 фемтосекунд после ионизации. Оказалось, что сверхбыстрый поворот молекулы приводит к зависящему от времени Допплеровскому сдвигу Оже-резонанса и характерной ассиметрии спектральной формы этого резонанса (см. Рисунок 3). Варьируя энергию рентгеновского фотона, а, следовательно, и скорость индуцированного вращения, удалось визуализировать динамику этого вращения».
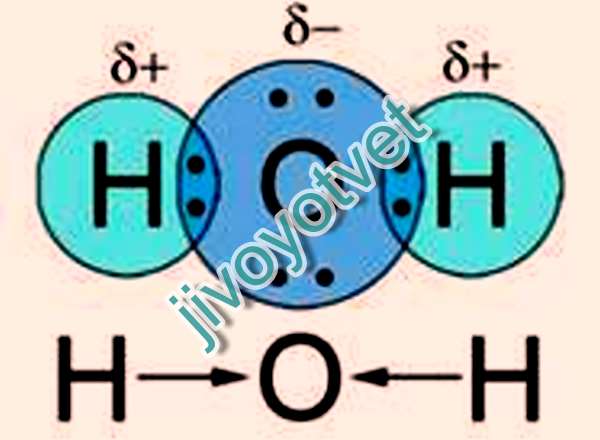

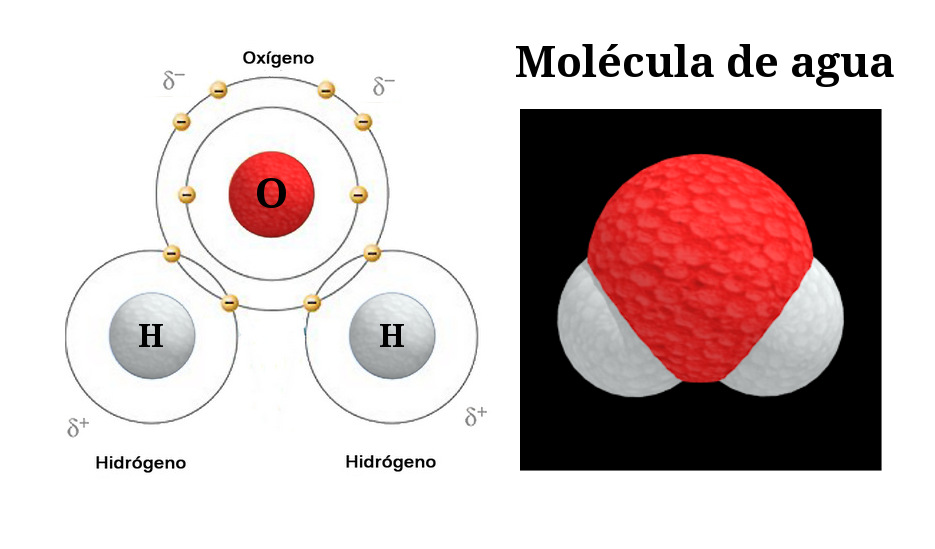 На первом этапе молекула поглощает падающий рентгеновский фотон и переходит из основного в высоковозбужденное промежуточное состояние с «дыркой» на 1s-уровне соответствующего атома. Это промежуточное состояние неустойчиво и оно распадается в конечное состояние, испустив конечный рентгеновский фотон. Очевидно, энергия испустившего фотона меньше энергии начального фотона на разницу энергии конечного и начального состояния молекул».
На первом этапе молекула поглощает падающий рентгеновский фотон и переходит из основного в высоковозбужденное промежуточное состояние с «дыркой» на 1s-уровне соответствующего атома. Это промежуточное состояние неустойчиво и оно распадается в конечное состояние, испустив конечный рентгеновский фотон. Очевидно, энергия испустившего фотона меньше энергии начального фотона на разницу энергии конечного и начального состояния молекул». Но так ли это? Если изучать резонансное неупругое рассеяние рентгеновского излучения водой, то можно увидеть эмиссионный переход, в котором электрон с занятой молекулярной орбитали 1b1 заполняет дырку, созданную падающим фотоном в глубоком 1s уровне атома кислорода. Эксперимент с жидкой водой показывает расщепление этого резонанса на два пика. В научной литературе часть ученых приписывает этот дублет двум вышеупомянутым структурным мотивам. Из этого делаются далеко идущие заключения о локальной структуре и критических свойствах воды. Чтобы пролить свет на эту фундаментальную проблему, авторы данной работы выполнили недавно PHPPИ-эксперимент с парами воды, т.е. измерили PHPPИ-спектр изолированной молекулы воды».
Но так ли это? Если изучать резонансное неупругое рассеяние рентгеновского излучения водой, то можно увидеть эмиссионный переход, в котором электрон с занятой молекулярной орбитали 1b1 заполняет дырку, созданную падающим фотоном в глубоком 1s уровне атома кислорода. Эксперимент с жидкой водой показывает расщепление этого резонанса на два пика. В научной литературе часть ученых приписывает этот дублет двум вышеупомянутым структурным мотивам. Из этого делаются далеко идущие заключения о локальной структуре и критических свойствах воды. Чтобы пролить свет на эту фундаментальную проблему, авторы данной работы выполнили недавно PHPPИ-эксперимент с парами воды, т.е. измерили PHPPИ-спектр изолированной молекулы воды». Более того, выполненные теоретические расчёты однозначно объясняют данное расщепление сверхбыстрой диссоциациeй молекулы воды в 1s-дырочном состоянии. Таким образом, данное исследование, однозначно свидетельствуя о динамической природе расщепления 1b1 резонанса, опровергает структурный механизм, тем самым свидетельствуя, что структура воды однородна».
Более того, выполненные теоретические расчёты однозначно объясняют данное расщепление сверхбыстрой диссоциациeй молекулы воды в 1s-дырочном состоянии. Таким образом, данное исследование, однозначно свидетельствуя о динамической природе расщепления 1b1 резонанса, опровергает структурный механизм, тем самым свидетельствуя, что структура воды однородна». Рис. 4) в силу малой амплитуды колебаний. Спектроскопия PHPPИ воды качественно отличается от ИК спектроскопии тем, что при возбуждении рентгеновским фотоном глубокого 1s электрона кислорода на первую незанятую молекулярную орбиту, молекула воды быстро диссоциирует. В процессе этой сверхбыстрой диссоциации возбуждённый электрон переходит обратно на 1s уровень, испуская рентгеновский фотон. Частота испущенного фотона отличается от возбуждающего фотона, так как при этом переходе заселяются более высокие колебательные уровни (см. Рис. 4). Таким образом, в отличие от ИК-спектра, PHPPИ спектр состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние (см. Рис. 4), тем дальше атомы водорода удаляются от кислорода в процессе OH колебаний и тем сильнее данное колебание “чувствует” взаимодействие с ближайшей молекулой воды, а именно водородную связь».
Рис. 4) в силу малой амплитуды колебаний. Спектроскопия PHPPИ воды качественно отличается от ИК спектроскопии тем, что при возбуждении рентгеновским фотоном глубокого 1s электрона кислорода на первую незанятую молекулярную орбиту, молекула воды быстро диссоциирует. В процессе этой сверхбыстрой диссоциации возбуждённый электрон переходит обратно на 1s уровень, испуская рентгеновский фотон. Частота испущенного фотона отличается от возбуждающего фотона, так как при этом переходе заселяются более высокие колебательные уровни (см. Рис. 4). Таким образом, в отличие от ИК-спектра, PHPPИ спектр состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние (см. Рис. 4), тем дальше атомы водорода удаляются от кислорода в процессе OH колебаний и тем сильнее данное колебание “чувствует” взаимодействие с ближайшей молекулой воды, а именно водородную связь».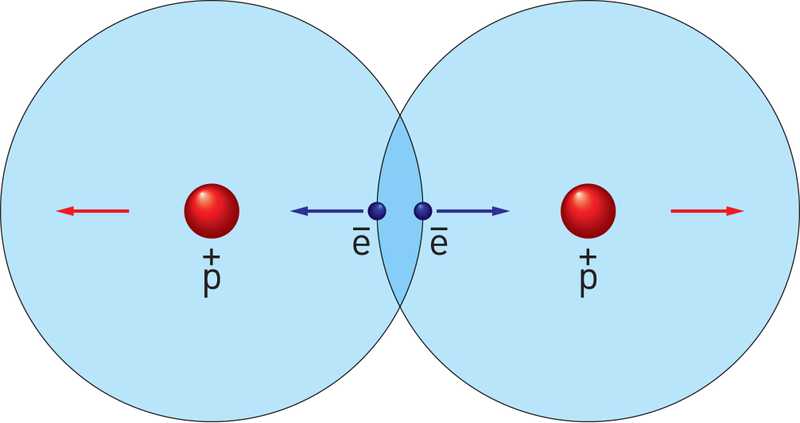 Важно отметить, что в отличие от изолированной молекулы воды с одним OH потенциалом, в жидкости имеется набор (распределение) OH потенциалов в силу флуктуирующего многообразия ближайшего окружения молекулы воды. Таким образом, вторым результатом работы является “измерение” распределения OH потенциалов в сети флуктуирующих водородных связей», — заключил физик.
Важно отметить, что в отличие от изолированной молекулы воды с одним OH потенциалом, в жидкости имеется набор (распределение) OH потенциалов в силу флуктуирующего многообразия ближайшего окружения молекулы воды. Таким образом, вторым результатом работы является “измерение” распределения OH потенциалов в сети флуктуирующих водородных связей», — заключил физик.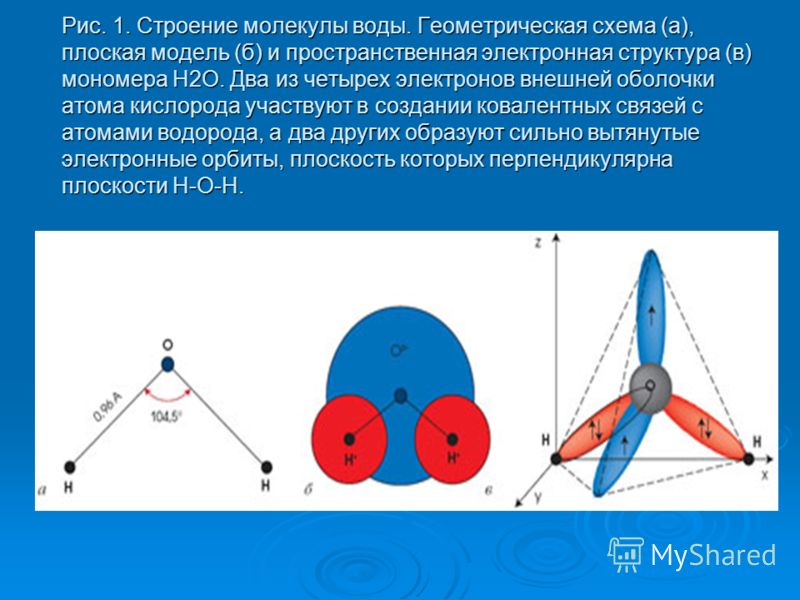 Она представлена учеными из Германии и Швейцарии (синхротрон “Swiss Light Source”).
Она представлена учеными из Германии и Швейцарии (синхротрон “Swiss Light Source”). Впервые удалось визуализировать Динамику индуцированного вращения. Экспериментальные данные, дополненные теоретическими расчетами позволили получить детальную структурную информацию о жидкой воде, и было показано, что структура воды однородна.
Впервые удалось визуализировать Динамику индуцированного вращения. Экспериментальные данные, дополненные теоретическими расчетами позволили получить детальную структурную информацию о жидкой воде, и было показано, что структура воды однородна.