Электродвижущая сила аккумулятора
Можно ли по ЭДС точно судить о степени заряженности аккумулятора?
Электродвижущей силой (ЭДС) аккумулятора называется разность его электродных потенциалов, измеренная при разомкнутой внешней цепи:
Е = φ+ – φ–
где φ+ и φ– – соответственно потенциалы положительного и отрицательного электродов при разомкнутой внешней цепи.
ЭДС батареи, состоящей из n последовательно соединённых аккумуляторов:
Еб = n · Е
В свою очередь, электродный потенциал при разомкнутой цепи в общем случае состоит из равновесного электродного потенциала, характеризующего равновесное (стационарное) состояние электрода (при отсутствии переходных процессов в электрохимической системе), и потенциала поляризации.
Этот потенциал в общем случае определяется как разность между потенциалом электрода при разряде или заряде и его потенциалом в равновесном состоянии в отсутствии тока. Однако следует отметить, что состояние аккумулятора сразу после выключения зарядного или разрядного тока не является равновесным вследствие различия концентрации электролита в порах электродов и межэлектродном пространстве.
Химическая активность реагентов, собранных в электрохимическую систему аккумулятора, и, следовательно, изменение ЭДС аккумулятора весьма незначительно зависит от температуры. При изменении температуры от –30°С до+50°С (в рабочем диапазоне для АКБ) электродвижущая сила каждого аккумулятора в батарее изменяется всего на 0,04 В и при эксплуатации аккумуляторов им можно пренебречь.
С повышением плотности электролита ЭДС повышается. При температуре +18°С и плотности 1,28 г/см3 аккумулятор (имеется в виду одна банка) обладает ЭДС равной2,12 В. Аккумуляторная батарея из шести элементов обладает ЭДС равной 12,72 В(6 ? 2,12 В = 12,72 В).
Аккумуляторная батарея из шести элементов обладает ЭДС равной 12,72 В(6 ? 2,12 В = 12,72 В).
По ЭДС нельзя точно судить о степени заряженности аккумулятора.
При эксплуатации аккумуляторных батарей путём измерения ЭДС можно обнаружить серьёзную неисправность аккумуляторной батареи (замыкание пластин в одной или нескольких банках, обрыв соединительных проводников между банками и тому подобное).
ЭДС измеряют высокоомным вольтметром (внутреннее сопротивление вольтметране менее 300 Ом/В). В ходе выполнения измерений вольтметр присоединяют к выводам аккумулятора или батареи. При этом через аккумулятор (батарею) не должен протекать зарядный или разрядный ток!
***
Электродвижущая сила (ЭДС) – скалярная физическая величина, характеризующая работу сторонних сил, то есть любых сил неэлектрического происхождения, действующих в квазистационарных цепях постоянного или переменного тока.
ЭДС так же, как и напряжение, в Международной системе единиц (СИ) измеряется в вольтах.
ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ ГЛАВА I. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА § 1. Особенности физико-химических методов анализа § 2. Области применения инструментальных методов анализа § 3. Анализ веществ высокой чистоты § 4. Повышение чувствительности и точности методов определения следов примесей § 5. Инструментальные методы титрования § 6. Применение физико-химических методов анализа для определения индивидуальных соединений § 8. Классификация инструментальных количественных методов анализа § 9. Электрохимические методы анализа § 10. Спектральные (оптические) методы анализа § 11. Хроматографические методы анализа § 12. Радиометрические методы анализа § 13. Масс-спектрометрические методы анализа § 14.  Физико-химический анализ по Н. С. Курнакову Физико-химический анализ по Н. С. Курнакову§ 15. Другие методы анализа ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Зависимость величины электродных потенциалов от концентрации (активности) § 3. Потенциометрическое титрование § 4. Потенциометрическое титрование без тока (i=0) § 5. Различные способы нахождения конечной точки потенциометрического титрования § 6. Некомпенсационный метод потенциометрического титрования § 7. Потенциометрическое титрование под током (i != 0) Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8. Измерение электродвижущей силы § 9. Установка для поляризации электродов при потенциометрическом титровании под током § 10. Некоторые приборы, применяемые в потенциометрическом титровании § 11. Электроды § 12. Кислотно-основное титрование § 13. Титрование по методу окисления — восстановления § 14.  Титрование по методу осаждения Титрование по методу осаждения§ 15. Титрование по методу комплексообразования ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0) § 16. Титрование по методу окисления — восстановления ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Удельная и эквивалентная электропроводность § 2. Кондуктометрическне методы анализа § 3. Кислотно-основное титрование § 5. Титрование, основанное на реакциях окисления — восстановления § 6. Титрование, основанное на реакциях комплексообразования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 7. Измерение электропроводности растворов § 8. Конструкции электролитических ячеек § 9. Измерения в хронокондуктометрическом титровании В. ПРАКТИЧЕСКИЕ РАБОТЫ § 10. Подготовка к определению §11. Определение индивидуальных кислот методом кондуктометрического титрования § 12. Определение индивидуальных оснований методом кондуктометрического титрования § 13.  § 14. Определение солей методом кондуктометрического титрования § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования § 16. Анализ смесей кислот методом хронокондуктометрического титрования § 17. Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрования ГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ § 1. Общие положения теории высокочастотного титрования § 2. Физические основы и погрешности метода высокочастотного титрования § 3. Физические основы метода диэлкометрического титрования § 4. Погрешности метода диэлкометрического титрования ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА § 6. Импеданс и полная проводимость ячейки § 7. Характеристические кривые ячейки § 8. Чувствительность ячейки § 9. Критерий применимости и постоянная с-ячейки ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ИНДУКТИВНОГО ТИПА § 10.  Электрическая эквивалентная схема ячейки Электрическая эквивалентная схема ячейки§ 11. Импеданс и характеристические кривые ячейки § 12. Критерий применимости и постоянная L-ячейки § 13. Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля § 14. Диаграмма соответствия для титрования по активной составляющей полной проводимости § 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости § 16. Выбор типа диаграмм Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 17. Измерительные ячейки (датчики) высокочастотного метода и области их применения § 18. Классификация аппаратуры высокочастотного метода § 19. Высокочастотные титраторы § 20. Общие правила работы с приборами для высокочастотного анализа В. ПРАКТИЧЕСКИЕ РАБОТЫ § 21. Высокочастотное титрование стандартных растворов § 22. Высокочастотное титрование растворов неизвестной концентрации ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. 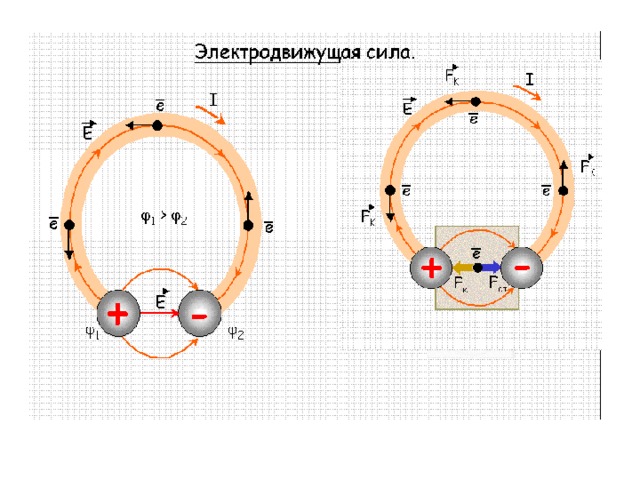 Предельный, или диффузионный, ток Предельный, или диффузионный, ток§ 2. Возникновение диффузионного тока на твердых микроэлектродах Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА § 3. Полярографы § 4. Электролитическая ячейка § 5. Электролизеры § 6. Электроды сравнения § 7. Снятие полярограммы на полярографической установке с визуальным полярографом § 8. Методы количественного полярографического анализа § 9. Правила техники безопасности при работе с металлической ртутью В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ § 10. Амальгамная полярография с накоплением § 11. Осциллографическая полярография § 12. Переменнотоковая полярография Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА § 13. Примеры полярографических определений АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 14. Особенности амперометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 15. Схема установки и применяемые электроды § 16.  Амперометрическое титрование с двумя индикаторными электродами Амперометрическое титрование с двумя индикаторными электродамиВ. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 17. Примеры амперометрического титрования ГЛАВА VI. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Сущность и классификация кулонометрических методов ПРЯМАЯ КУЛОНОМЕТРИЯ § 2. Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия) § 3. Использование прямой потенциостатической кулонометрии § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия) § 5. Использование прямой амперостатической кулонометрии КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 6. Кулонометрическое титрование при постоянной силе тока электролиза § 7. Использование амперостатического кулонометрического титрования § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода § 9. Особенности кулонометрических методов анализа Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 10.  Электроды Электроды§ 11. Электролизеры § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества § 13. Приборы, обеспечивающие стабильность потенциала рабочего электрода или силы тока электролиза, и установки для кулонометрического анализа В. ПРАКТИЧЕСКИЕ РАБОТЫ § 14. Работы, выполняемые методом прямой кулонометрии § 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА § 1. Общая характеристика метода § 2. Классификация методов эмиссионного спектрального анализа § 3. Качественный спектральный анализ § 4. Полуколичественные методы спектрального анализа § 5. Количественный спектральный анализ § 6. Основы фотографического метода эмиссионного количественного анализа § 7. Зависимость между почернением фотопластинки и интенсивностью излучения Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8.  Источники возбуждения спектров Источники возбуждения спектров§ 9. Спектральные приборы § 10. Вспомогательные приборы и принадлежности § 11. Микрофотометр МФ-2 В. ПРАКТИЧЕСКИЕ РАБОТЫ § 12. Качественный анализ при помощи стилоскопа § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области § 14. Полуколичественный анализ § 15. Количественный анализ СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ § 16. Общая характеристика метода Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени В. ПРАКТИЧЕСКИЕ РАБОТЫ § 18. Определения по методу спектрофотометрии пламени АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 19. Общая характеристика метода МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 20. Общая характеристика метода § 21. Законы поглощения света § 22. Отклонения от закона Бугера—Ламберта—Бера § 23. Качественный анализ спектрофотометрическим методом § 24.  Количественный анализ спектрофотометрическим методом Количественный анализ спектрофотометрическим методом§ 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра § 26. Определение нескольких компонентов в растворе § 27. Определение концентрации вещества в растворе дифференциальным методом § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора § 29. Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра § 31. Приборы, применяемые для колориметрического анализа § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра § 33. Нулевые растворы В. ПРАКТИЧЕСКИЕ РАБОТЫ § 34. Определение в ультрафиолетовой области спектра § 35. Определение в видимой области спектра § 36. Определение в инфракрасной области спектра СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ § 37.  Общая характеристика метода Общая характеристика метода§ 38. Кривые спектрофотометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ § 39. Установки для спектрофотометрического титрования В. ПРАКТИЧЕСКИЕ РАБОТЫ § 40. Спектрофотометрическое титрование НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА § 41. Общая характеристика методов Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений В. ПРАКТИЧЕСКИЕ РАБОТЫ § 43. Нефелометрические и турбидиметрические определения § 44. Фототурбидиметрическое и фотонефелометрическое титрование ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Классификация хроматографических методов анализа § 2. Адсорбционная хроматография § 3. Разновидности газовой хроматографии § 4. Распределительная хроматография § 5. Ионообменная хроматография § 6. Константа ионного обмена § 7. Осадочная хроматография § 8. Окислительно-восстановительная хроматография § 9.  Адсорбционно-комплексообразовательная хроматография Адсорбционно-комплексообразовательная хроматография§ 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии § 11. Аппаратура, применяемая в газовой хроматографии § 12. Приборы и материалы, применяемые в распределительной хроматографии § 13. Колонки, применяемые в ионообменной хроматографии § 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии В. ПРАКТИЧЕСКИЕ РАБОТЫ § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии § 16. Работы по методу распределительной хроматографии § 17. Работы по методу ионообменной хроматографии § 18. Работы по методу осадочной хроматографии § 19. Работы по методу окислительно-восстановительной хроматографии § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Виды радиоактивного распада § 2. Скорость распада § 3. Взаимодействие излучения с веществом § 4.  Ошибки при измерении радиоактивности Ошибки при измерении радиоактивностиБ. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ § 5. Понятия и единицы измерения § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов § 7. Классификация химических операций с радиоактивными веществами § 8. Устройство лабораторий и классификация работ § 9. Специальное оборудование для работ с радиоактивными веществами § 10. Средства индивидуальной защиты § 11. Проведение работ в химической лаборатории с радиоактивными веществами § 12. Правила работы с радиоактивными веществами В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ § 13. Ионизационные методы § 14. Сцинтилляционный метод Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ § 15. Радиометрические установки § 16. Измерение радиоактивности § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды § 18. Абсолютные и относительные измерения активности Д.  РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ§ 19. Приготовление раствора с заданной активностью § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов § 21. Практические работы, выполняемые методом прямого определения § 22. Метод радиометрического титрования § 23. Практические работы, выполняемые методом радиометрического титрования § 24. Метод изотопного разбавления § 25. Практические работы, выполняемые методом изотопного разбавления § 26. Метод активационного анализа § 27. Практические работы, выполняемые методом активационного анализа § 28. Фотонейтронный метод § 29. Практические работы, выполняемые фотонейтронным методом § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов § 32. Методы анализа, основанные на поглощении излучения § 33.  Практические работы, выполняемые по методу анализа, основанному на поглощении излучения Практические работы, выполняемые по методу анализа, основанному на поглощении излучения§ 34. Метод, основанный на отражении бетта-излучения § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения ГЛАВА X. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ § 1. Работы, выполняемые методом амперометрического титрования § 2. Работы, выполняемые полярографическим методом § 3. Работы, выполняемые фотометрическим методом § 4. Работы, выполняемые экстракционно-фотометрическим методом § 5. Работы, выполняемые спектрофотометрическим методом § 6. Работы, выполняемые флуориметрическим методом § 7. Работы, выполняемые методом потенциометрического титрования ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам § 3.  Классификация неводных растворителей по признаку их влияния на относительную силу электролитов Классификация неводных растворителей по признаку их влияния на относительную силу электролитов§ 4. Дифференцирующее действие растворителей § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности § 6. Шкала pH и константы автопротолиза неводных растворителей § 7. Абсолютная (единая) шкала кислотности растворителей § 8. Химико-аналитическое использование неводных растворителей Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ § 9. Установки, используемые при амперометрическом титровании неводных растворов § 10. Установки, используемые при потенциометрическом титровании неводных растворов § 11. Установки, используемые при кондуктометрическом титровании неводных растворов § 12. Установки, используемые при высокочастотном титровании неводных растворов § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов В. ПРАКТИЧЕСКИЕ РАБОТЫ § 14. Очистка и обезвоживание неводных растворителей § 15.  Титранты, применяемые для титрования кислот и оснований в неводных растворах Титранты, применяемые для титрования кислот и оснований в неводных растворах§ 16. Амперометрическое титрование § 17. Методы прямого потенциометрического титрования § 18. Методы косвенного потенциометрического титрования § 19. Дифференцированное потенциометрическое титрование § 20. Комбинированные методы потенциометрического титрования § 21. Хронопотенциометрическое титрование § 22. Кондуктометрическое титрование § 23. Хронокондуктометрическое титрование § 24. Спектрофотометрическое титрование |
Электродвижущая сила — определение, формула, единица измерения, разница
Мы знаем, что генератор или батарея используются для преобразования энергии из одной формы в другую. В этих устройствах один вывод заряжается положительно, а другой — отрицательно. Следовательно, электродвижущая сила – это работа, совершаемая над единицей электрического заряда.
Содержание
|
Что такое электродвижущая сила?
Электродвижущая сила определяется как электрический потенциал, создаваемый либо гальваническим элементом, либо изменением магнитного поля. ЭДС — это обычно используемая аббревиатура для обозначения электродвижущей силы.
ЭДС — это обычно используемая аббревиатура для обозначения электродвижущей силы.
Генератор или батарея используются для преобразования энергии из одной формы в другую. В этих устройствах один вывод заряжается положительно, а другой — отрицательно. Следовательно, электродвижущая сила – это работа, совершаемая над единицей электрического заряда.
Электродвижущая сила используется в электромагнитном расходомере, что является применением закона Фарадея.
Символ электродвижущей силы
Символ электродвижущей силы ε.
Подробнее: Закон Фарадея
Что такое формула электродвижущей силы?
Ниже приведена формула для электродвижущей силы:
| ε = V + Ir |
Где,
- В — напряжение ячейки
- I — ток в цепи
- Ом — внутреннее сопротивление элемента
- ε — электродвижущая сила
Что такое единица ЭДС?
Единицей измерения электродвижущей силы по стандарту является вольт.
ЭДС численно выражается как количество джоулей энергии, отдаваемой источником, деленное на каждый кулон, чтобы позволить единице электрического заряда двигаться по цепи.
\(\begin{array}{l}Вольты=\frac{Джоули}{Кулоны}\end{массив} \)
Размер электродвижущей силы
ЭДС дается как отношение работы, выполненной на единицу заряда, которая представлена следующим образом:
\(\begin{array}{l}ЭДС=\frac{Джоули}{Кулоны}\end{массив} \)
Следовательно, размерность ЭДС определяется как M 1 L 2 T -3 I -1
Разница между электродвижущей силой и разностью потенциалов
| Электродвижущая сила | Разница потенциалов |
| ЭДС определяется как работа, совершаемая на единицу заряда | Разность потенциалов определяется как энергия, которая рассеивается при прохождении единичного заряда через компоненты |
| ЭДС остается постоянной | Разность потенциалов непостоянна |
| ЭДС не зависит от сопротивления цепи | Разность потенциалов зависит от сопротивления между двумя точками во время измерения |
| За счет ЭДС возникает электрическое, магнитное и гравитационное поля | Из-за разности потенциалов индуцируется только электрическое поле |
| Обозначается E | Представлен V |
Может ли электродвижущая сила быть отрицательной?
Да, электродвижущая сила может быть отрицательной. Рассмотрим пример, когда катушка индуктивности генерирует ЭДС, противодействующую поступающей мощности. Тогда создаваемая ЭДС принимается отрицательной, так как направление потока противоположно реальной мощности. Следовательно, электродвижущая сила может быть отрицательной.
Рассмотрим пример, когда катушка индуктивности генерирует ЭДС, противодействующую поступающей мощности. Тогда создаваемая ЭДС принимается отрицательной, так как направление потока противоположно реальной мощности. Следовательно, электродвижущая сила может быть отрицательной.
В чем разница между напряжением на клеммах и ЭДС?
Ниже приведены различия между напряжением на клеммах и ЭДС:
- Напряжение на клеммах определяется как разность потенциалов на клеммах нагрузки, когда цепь включена. В то время как ЭДС определяется как максимальная разность потенциалов, которую обеспечивает батарея при отсутствии тока.
- Вольтметр используется для измерения напряжения на клеммах, тогда как потенциометр используется для измерения ЭДС.
Ниже представлено видео, объясняющее, как индуцируется ЭДС из-за движения проводника в магнитном поле
Часто задаваемые вопросы – Часто задаваемые вопросы
Определение электродвижущей силы.

Электродвижущая сила определяется как электрический потенциал, создаваемый либо электрохимической ячейкой, либо изменением магнитного поля.
Какова размерность электродвижущей силы?
Размер ЭДС указан как M 1 L 2 T -3 I -1
Какова единица ЭДС?
Единицей измерения электродвижущей силы является вольт.
Определение разницы потенциалов.
Разность потенциалов определяется как энергия, которая рассеивается при прохождении единичного заряда через компоненты.
Какое напряжение на клеммах?
Напряжение на клеммах определяется как разность потенциалов на клеммах нагрузки, когда цепь включена.
Следите за новостями BYJU’S и влюбитесь в обучение!
Измерение электродвижущей силы и разности потенциалов
Лабораторное руководство по физике Решения NCERT Класс 12 Образцы документов по физике
Электрический (электростатический) потенциал и разность электрических потенциалов
Определение. Электрический потенциал в точке электрического поля заряда (полевого заряда) определяется (или измеряется) как работа, совершаемая при перемещении единичного положительного заряда (пробного заряда) из бесконечности (т. е. из-за пределов поля) в эту точку. (при условии, что введение пробного заряда не влияет на первоначальную конфигурацию поля.)
Электрический потенциал в точке электрического поля заряда (полевого заряда) определяется (или измеряется) как работа, совершаемая при перемещении единичного положительного заряда (пробного заряда) из бесконечности (т. е. из-за пределов поля) в эту точку. (при условии, что введение пробного заряда не влияет на первоначальную конфигурацию поля.)
Обозначается символом V. Его единицей СИ является вольт. Это скаляр (будучи работой). Разность электрических потенциалов между двумя точками электрического поля полевого заряда определяется как работа, совершаемая при перемещении пробного заряда из одной точки в другую.
Электродвижущая сила и разность потенциалов клетки
- Электродвижущая сила: клетка. Он представлен символом E (или ε). Его единица — вольт. Это скалярная величина, потому что это разность потенциалов.
Он равен разности потенциалов между двумя клеммами элемента, когда элемент находится в разомкнутой цепи, т. е. не дает тока.
не дает тока.
Э.М.Ф. не зависит от
(i) Площадь пластин (электродов)
(ii) Разделение пластин
(iii) Количество электролита. - Разность потенциалов: Это разность потенциалов между двумя клеммами элемента, когда он находится в замкнутой цепи, т. е. дает ток. Он представлен символом V. Его единицей измерения является вольт.
Внутреннее сопротивление элемента
Сопротивление, оказываемое электролитом элемента потоку ионов через него, называется внутренним сопротивлением элемента. Обозначается символом r. Его единицей измерения является ом (Ом).
Внутреннее сопротивление зависит от
- площади пластин (электродов) внутри электролита.
- Разделение пластин
- Природа и концентрация электролита.
- Температура
- Использование ячейки. (Течение времени)
Связь между E.M.F., P.D. и внутреннее сопротивление ячейки
В цепи показана ячейка с э. д.с. E и внутреннее сопротивление r, подключенное к внешнему сопротивлению R. Цепь имеет полное сопротивление (R + r) и ток I в цепи определяется как
д.с. E и внутреннее сопротивление r, подключенное к внешнему сопротивлению R. Цепь имеет полное сопротивление (R + r) и ток I в цепи определяется как
Потенциометр
измерить внутреннее сопротивление ячейки, чтобы сравнить Э.Д.С. двух ячеек и разности потенциалов на резисторе.
(b) Принцип:
Он работает по принципу, согласно которому при протекании постоянного тока по проводу одинаковой толщины и материала разность потенциалов между двумя его точками прямо пропорциональна длине провода между двумя точками. Это устройство, используемое для измерения внутреннего сопротивления ячейки, для сравнения Э.Д.С. из двух первичных ячеек и т. д.
V = IR0012
(c) Конструкция:
Потенциометр состоит из длинного провода с одинаковой площадью поперечного сечения, обычно длиной от 4 до 10 м, из материала с высоким удельным сопротивлением и низким температурным коэффициентом, такого как константан или манганин. Эти провода натянуты параллельно друг другу на широкой деревянной доске сбоку в метровом масштабе. Провода соединены последовательно толстыми медными полосами. Батарея постоянной э.д.с. (выпрямитель батареи) подключается к концам P и Q провода, называемого приводной или вспомогательной ячейкой. Жокей J с чувствительным гальванометром G скользит по проволоке PQ.
Эти провода натянуты параллельно друг другу на широкой деревянной доске сбоку в метровом масштабе. Провода соединены последовательно толстыми медными полосами. Батарея постоянной э.д.с. (выпрямитель батареи) подключается к концам P и Q провода, называемого приводной или вспомогательной ячейкой. Жокей J с чувствительным гальванометром G скользит по проволоке PQ.
Примечание. Количество проводов можно увеличить, чтобы увеличить l и уменьшить k = V/l.
Меньшее значение k делает потенциометр более чувствительным и точным.
(d) Рабочий:
Полностью заряженная вспомогательная батарея B (выпрямитель батареи), имеющая постоянную и высокую ЭДС. подключен между клеммами P и Q через амперметр A и реостат (как показано на принципиальной схеме, эксперимент 5: раздел A). Это обеспечивает регулируемый градиент потенциала вдоль провода потенциометра. Положительная клемма батареи подключается к клемме P. Положительные клеммы другого элемента или элементов также подключаются к той же клемме P.
(e) Сравнение ЭДС двух ячеек:
С помощью вольтметра мы можем измерить только конечную разность потенциалов ячейки, а с помощью потенциометра мы можем определить значение ЭДС. (электродвижущая сила) данной ячейки. Для этого мы завершаем принципиальную схему, как показано на Э.Д.С. (Е) вспомогательной батареи В постоянна и больше, чем у данной ячейки. Вставьте ключ K. По проводу потенциометра PQ протекает постоянный ток I, и устанавливается градиент потенциала k = Iσ , где a — сопротивление на единицу длины провода потенциометра.
Положительные выводы ячеек Е 1 и Е 2 подключаются к нулевому выводу Р потенциометра, тогда как отрицательные выводы подключаются через двусторонний ключ к гальванометру, ячейке сопротивлений и жокею. . Когда ячейка Ех находится в цепи, при плавном скольжении жокея по проводу потенциометра PQ точка J, скажем, на расстоянии l 1 от нулевого конца, получается, где гальванометр показывает нулевое отклонение.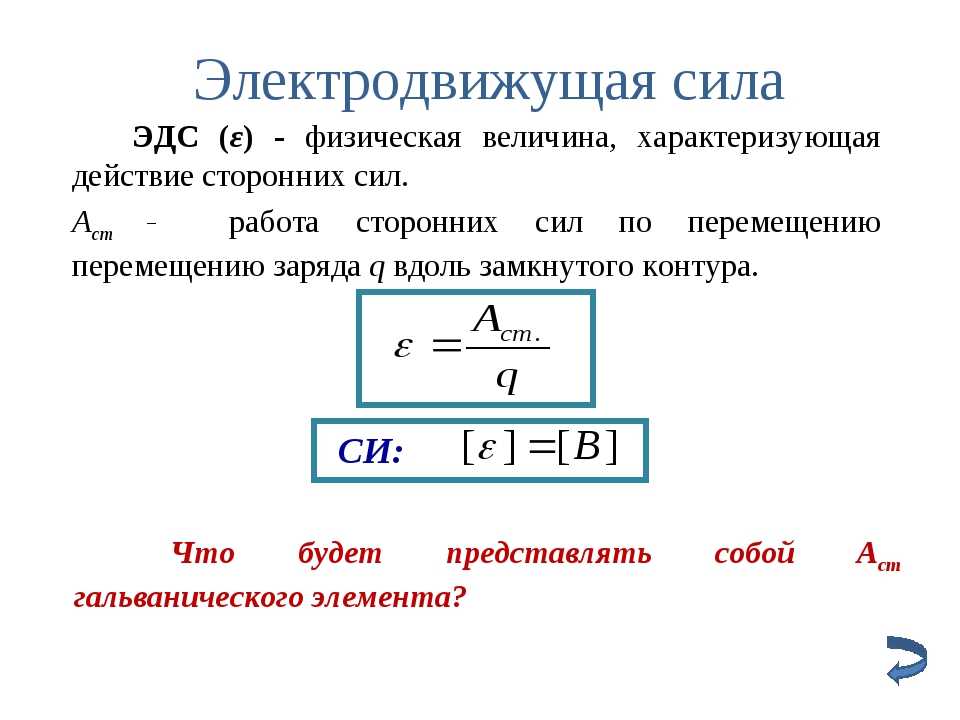 В таком случае – ve клемма ячейки E 1 и точка J на проводе потенциометра имеют одинаковый потенциал. Нулевой конец провода потенциометра и плюсовая клемма ячейки E 1 также имеют одинаковый потенциал. Следовательно, падение потенциала на длине l 1 провода потенциометра равно э.д.с. ячейки E 1 , поскольку ток из ячейки не поступает. Так как падение потенциала на проводе одинаковой площади поперечного сечения пропорционально его длине.
В таком случае – ve клемма ячейки E 1 и точка J на проводе потенциометра имеют одинаковый потенциал. Нулевой конец провода потенциометра и плюсовая клемма ячейки E 1 также имеют одинаковый потенциал. Следовательно, падение потенциала на длине l 1 провода потенциометра равно э.д.с. ячейки E 1 , поскольку ток из ячейки не поступает. Так как падение потенциала на проводе одинаковой площади поперечного сечения пропорционально его длине.
Для определения внутреннего сопротивления элемента с помощью потенциометра используемая схема показана на E — элемент, внутреннее сопротивление которого необходимо измерить. Регулировкой реостата и замыканием ключа К 1 , если l 1 является длиной провода потенциометра до точки, в которой достигается точка баланса в разомкнутой цепи, т. е. K 2 разомкнут, то
(g) Важные меры предосторожности, которые необходимо соблюдать при Эксперименты с потенциометром
- Вспомогательная батарея B, используемая для создания градиента потенциала вдоль провода потенциометра, должна быть полностью заряжена, чтобы иметь постоянную ЭДС.
 Его э.д.с. должна быть больше э.д.с. каждой сравниваемой ячейки.
Его э.д.с. должна быть больше э.д.с. каждой сравниваемой ячейки. - Положительные клеммы всех элементов должны быть подключены к клемме P, к которой подключена дополнительная батарея.
- Клемму P следует принять за ноль шкалы для измерения балансировочной длины.
- Для определения нулевой точки следует использовать чувствительный гальванометр. Его следует защитить коробкой сопротивлений (R.B.), включив последовательно, найдя примерное положение нулевой точки. Сопротивление в коробке должно быть установлено равным нулю, когда необходимо определить точное положение нулевой точки.
- Примерное положение нулевой точки необходимо вывести на середину последнего провода, поставив там жгут J и отрегулировав ток провода реостатом.
- Ток по проводу следует пропускать только при проведении наблюдений во избежание ненужного нагрева провода, вызывающего изменение сопротивления, изменяющее градиент потенциала, (k = Iσ).
- В случае, если нулевая точка на проводе потенциометра не достигается, т.




 не дает тока.
не дает тока.  Его э.д.с. должна быть больше э.д.с. каждой сравниваемой ячейки.
Его э.д.с. должна быть больше э.д.с. каждой сравниваемой ячейки.