Основные Химические формулы для решения задач.
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. | кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф. Е.) Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Пример расчета критерия U Манна-Уитни
Допустим мы хотим сравнить уровень интеллекта детей в 7 «а» и 7 «б» классе средней общеобразовательной школы.
Шаг 1. Занесем значения в таблицу.
| 7 «а» | 7 «б» | ||
| ФИО Испытуемого | Баллы IQ | ФИО Испытуемого | Баллы IQ |
| КТИ | 112 | БРИ | 121 |
| ВСИ | 105 | ДРО | 120 |
| МНИ | 109 | РНА | 134 |
| АНМ | 90 | ВРА | 119 |
| УРА | 130 | ГРА | 115 |
| ВФЫ | 117 | ДЖА | 106 |
| РКИ | 117 | ВЦК | |
| ТРИ | 125 | ЮЕР | 101 |
| ТРК | 134 | ЖЕН | 97 |
| ТНК | 109 | КОР | 117 |
Шаг 2. Расположим все значения в один ряд (2. 1) и проранжируем их (2.2).
1) и проранжируем их (2.2).
| ФИО Испытуемого | Баллы IQ (2.1) | Ранг (2.2) |
| РНА | 134 | (1+2)/2=1,5 |
| ТРК | ||
| УРА | 3 | |
| ТРИ | 125 | 4 |
| БРИ | 121 | 5 |
| ДРО | 120 | 6 |
| ВРА | 119 | 7 |
| ВФЫ | 117 | (8+9+10)/3=9 |
| РКИ | ||
| КОР | ||
| ГРА | 115 | 11 |
| КТИ | 112 | 12 |
| ТНК | 109 | (13+14)/2=13,5 |
| МНИ | ||
| ВЦК | 107 | 15 |
| ДЖА | 106 | 16 |
| ВСИ | 105 | |
| ЮЕР | 101 | 18 |
| ЖЕН | 97 | 19 |
| АНМ | 90 | 20 |
Шаг 3. Суммировать ранги значений в группе 7 «а» и в группе 7 «б»
Суммировать ранги значений в группе 7 «а» и в группе 7 «б»
Ранги 7 «а» = 1,5+3+4+9+9+12+13,5+13,5+17+20 = 102,5
Ранги 7 «б» = 1,5+5+6+7+9+11+15+16+18+19 = 107,5
Шаг 4. определить какая из ранговых сумм бОльшая.
Ранг 7 «а»< Ранг 7 «б» => ранговая сумма 7″б» больше
Шаг 5. Определить эмпирические значения критерия U Манна-Уитни по формуле:
,где — количество испытуемых в 1 группе; — количество испытуемых во 2 группе; — большая из двух ранговых сумм; — количество испытуемых в группе с бОльшей ранговой суммой.
Шаг 6. По таблице определить критические значения критерия U Манна-Уитни.
Шаг 7. Сравнить критические значения с эмпирическими.
23<47,5 <
Шаг 8. Сделать выводы.
| Расчет критерия U-Манна-Уитни | |
| Расчет критерия U-Манна-Уитни в SPSS | Пример расчета критерия U-Манна-Уитни в SPSS |
| Расчет критерия U-Манна-Уитни в Excell | Пример расчета критерия U-Манна-Уитни в Excell |
| Непараметрический критерий U-Манна-Уитни | |
Термодинамика — Темы
По мере продвижения по термодинамике у нас будет все больше и больше уравнений для вашего изучения и изучения. выучить наизусть. Я начну приводить сюда уравнения по мере того, как мы их изучаем. Лучше всего для вас, чтобы начать запоминать
их как можно скорее.В вашем браузере должен быть включен JavaScript, чтобы увидеть
формулы правильно.
выучить наизусть. Я начну приводить сюда уравнения по мере того, как мы их изучаем. Лучше всего для вас, чтобы начать запоминать
их как можно скорее.В вашем браузере должен быть включен JavaScript, чтобы увидеть
формулы правильно.
Первый закон: теплота, работа, внутренняя энергия и энтальпия
\(\ Дельта U = U _ {\ rm f} — U _ {\ rm i} \) \(\Delta U = q + w \) (уравнение первого закона)
Внутренняя Энергия, \(U\), также обозначается как \(E\) во многих книгах и в Quest.
\(w = -P_{\rm ext}\Delta V\) (должно быть постоянное давление, чтобы использовать эту формулу)
Энтальпия определяется: \(H = U + PV\), что означает, что (при постоянном давлении)
\(\Delta H = \Delta U + P\Delta V\) или переписать как \(\Delta U = \Delta H — P\Delta V\).
\(\Delta U = q + w \) при постоянном давлении становится,
\(\Delta U = q_P — P\Delta V \), что означает, что \(\Delta H = q_P\)
\(\Delta U = q + w \) при постоянном объеме становится \(\Delta U = q_V\)
Для любого вещества, не меняющего фазу, \(q = m\, c_{\rm s}\, \Delta T\).
\(q_{\rm cal} = m_{\rm воды} \cdot c_{\rm s, вода} \cdot \Delta T\) (калориметрия кофейной чашки)
\(q_{\rm cal} = m_{\rm вода} \, c_{\rm s, вода} \, \Delta T + C_{\rm hardware}\Delta T\) (бомбовая калориметрия)
Получение работы ( \(w\) ) из закона идеального газа
Работа возникает только при расширении или сжатии газов. Это означает, что вы можете выразить работу через \(\Delta n\) или через \(\Delta T\), потому что \(\Delta(PV) = \Delta(nRT)\).
\[w = -P\Delta V = -\Delta n R T\]
где \(\Delta n\) = (моль газообразных продуктов) — (моль газообразных реагентов).
Таким образом, в зависимости от того, КАК вы решили расширить свою систему и выполнить работу, вы можете рассчитать работу через
эти уравнения:
\(w = -P\Delta V\) \(w = -\Delta nRT\)
\(w = -nR\Delta T\)
\(c_V\) и \(c_P\) для газов
У вас также есть определенная разница в \(c_V\) и \(c_P\) для газов, и уравнение
\(c_P = c_V + R \)
Вы также получаете 3 разных значения для \(c_V\) и для \(c_P\) в зависимости от формы
идеальный газ у вас есть. Это лучше всего объясняется с помощью Теормы равнораспределения , которая говорит о равномерном распределении общей энергии по ВСЕМ степеням свободы. Степенями свободы являются поступательные моды (всего 3 для направлений x, y и z) и вращательные моды (вращения вокруг осей x, y и z. Отдельный атом слишком мал, чтобы иметь какую-либо значительную вращательную инерцию, и поэтому только имеет 3 режима поступательного движения. Двухатомная (или линейная) молекула может иметь инерцию вращения вокруг 2 осей. Многоатомная нелинейная молекула может иметь все 3 вращательных режима. Каждая мода свободы имеет \({1\over2}RT \) (Дж/моль).Это то, что вы суммируете, чтобы получить общий вклад движения во внутреннюю энергию идеального газа.
Это лучше всего объясняется с помощью Теормы равнораспределения , которая говорит о равномерном распределении общей энергии по ВСЕМ степеням свободы. Степенями свободы являются поступательные моды (всего 3 для направлений x, y и z) и вращательные моды (вращения вокруг осей x, y и z. Отдельный атом слишком мал, чтобы иметь какую-либо значительную вращательную инерцию, и поэтому только имеет 3 режима поступательного движения. Двухатомная (или линейная) молекула может иметь инерцию вращения вокруг 2 осей. Многоатомная нелинейная молекула может иметь все 3 вращательных режима. Каждая мода свободы имеет \({1\over2}RT \) (Дж/моль).Это то, что вы суммируете, чтобы получить общий вклад движения во внутреннюю энергию идеального газа.
| одноатомный | линейный или двухатомный | многоатомный нелинейный | |
| режимы свободы транс+гнит | 3 + 0 = 3 | 3 + 2 = 5 | 3 + 3 = 6 |
| \(c_V\) | \({3\over2}R\) | \({5\over2}R\) | \({6\over2}R\) |
| \(c_P\) | \({5\over2}R\) | \({7\over2}R\) | \({8\over2}R\) |
К вашему сведению: вибрационные моды действительно значимы только при относительно высоких температурах.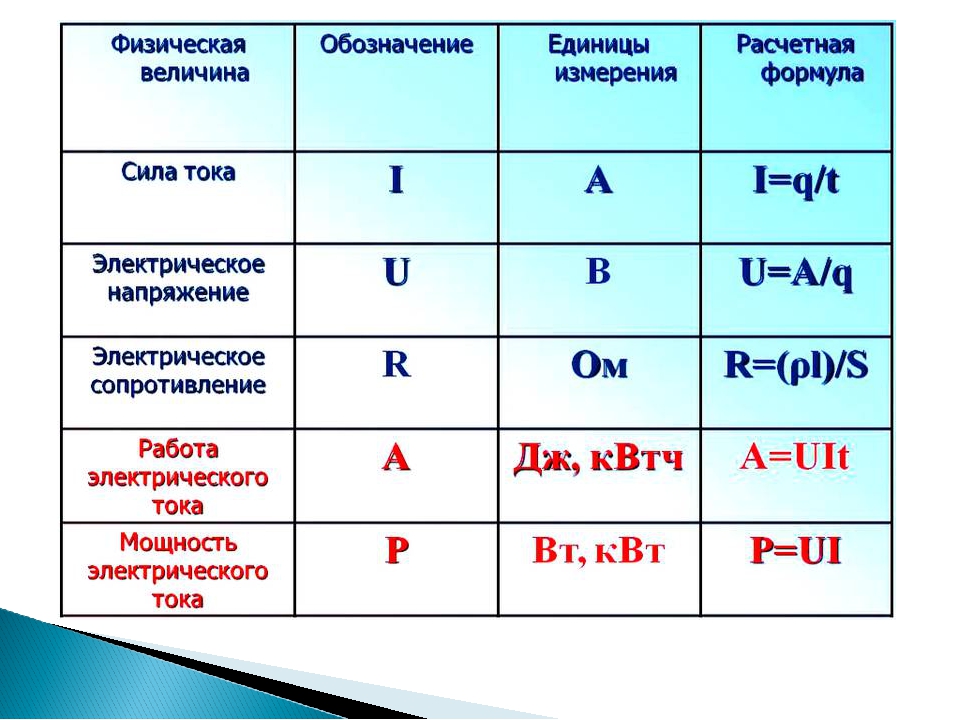 Они также сильно зависят от геометрии и сложности задействованной молекулы. Итак, по этой причине мы будем , а не количественно определять колебательные моды свободы, рассматривая газы как идеальные газы.
Они также сильно зависят от геометрии и сложности задействованной молекулы. Итак, по этой причине мы будем , а не количественно определять колебательные моды свободы, рассматривая газы как идеальные газы.
Закон Гесса (3 способа)
1. Объедините различные реакции, чтобы суммировать их с «целевой» реакцией 9\circ_{\rm f} (\rm реагентов)}\]
3. Энергии связи или энтальпии связи
Вы также можете получить хорошее приближение \(\Delta H\) путем суммирования энергий связи, также называемых энтальпиями связи. Концепция одна и та же, независимо от того, из какой книги (или источника) вы ее прочитали. Вот парочка…
Из книги Зумдаля: Он использует « D » для энергии диссоциации связи.
\[\ Delta H = \ underbrace {\ sum {D \: {\ rm (связи \; \; разорваны)}}} _ {\ rm energy \; \; требуется\стрелка вверх} — \underbrace{\sum{D\:{\rm (связи\;\;образованы)}}}_{\rm энергия\;\;высвобождается\стрелка вниз}\] 9\circ =\sum{n\Delta H_{\rm B} (\rm реагентов)} — \sum{n\Delta H_{\rm B} (\rm продуктов)}\]
Конечно, при использовании энергии связи или энтальпии вы должны разрывать только те связи, которые необходимо разорвать, и создавать связи, которые необходимо создавать. Вам не нужно разрывать все связи в молекуле, если большая часть ее структуры сохраняется после реакции.
Вам не нужно разрывать все связи в молекуле, если большая часть ее структуры сохраняется после реакции.
Изотермическое расширение
Изотермическое расширение идеального газа. Вы остаетесь на изотерме на протяжении всего расширения, что означает, что \(\Delta E = 0\) и \(q = -w\). Кроме того, внешнее давление должно постоянно соответствовать падающему давлению в системе — это приведет к обратимый процесс. Так что это действительно изотермическое обратимое расширение. P является функцией объема (\(P = nRT/V\)) и поэтому можно проинтегрировать \({\rm d}w = -nRT\;{\rm d}V/V\), чтобы получить:
\(w = -nRT \ln \left({V_2\over V_1}\right)\) \(q = nRT \ln \left({V_2\over V_1}\right)\)
Закон Бойля действует так, что \(P_1/P_2 = V_2/V_1\) и, следовательно:
\(w = -nRT \ln \left({P_1\over P_2}\right)\) \(q = nRT \ln \left({P_1\over P_2}\right)\)
9{-23}\) J/K ), который
это то же самое, что и универсальная газовая постоянная \(R\), деленная на число Авогадро,
\(N _ {\rm A}\). Легко связать количество доступных микросостояний
с доступным объемом ( \(V\) ). Например, если вы удвоите громкость, вы
удвоит количество доступных микросостояний. Исходя из этого, мы можем рассматривать состояние1
а затем state2 и мы получаем:
\[ \Delta S = nR \ln \left({V_2\over V_1}\right) \]
Легко связать количество доступных микросостояний
с доступным объемом ( \(V\) ). Например, если вы удвоите громкость, вы
удвоит количество доступных микросостояний. Исходя из этого, мы можем рассматривать состояние1
а затем state2 и мы получаем:
\[ \Delta S = nR \ln \left({V_2\over V_1}\right) \]
Эта формула очень похожа на формулу теплопередачи ( \(q\) ) при изотермическом расширения, и вы можете с полным правом сделать вывод, что: \[ \Delta S = {q_{\rm rev}\over T} \]
Теперь изменение энтропии рассчитывается через обратимый поток тепла в/из системы. деленная на температуру, при которой происходил перенос. Обратите внимание, что путь должен быть обратимым, чтобы рассчитать изменение энтропии. Необратимые изменения (большинство всех изменений) всегда имеют меньшие количества теплообмена, чем обратимый путь. То есть
\[q _ {\rm обр} = q _ {\rm обр} \]
Это приводит к так называемому неравенству Клаусса:
\[\ Delta S \ ge {q _ {\ rm unrev} \ over T} \]
Расчет энтропии при нагревании вещества
Знание того, что обратимое тепло, деленное на температуру, равно изменению энтропии, приводит к некоторым другим результатам. из этого факта:
из этого факта:
\[ \Дельта S = n \; резюме \; \ln \left({T_2\over T_1}\right) \] \[ \Дельта S = n \; с_П \; \ln \left({T_2\over T_1}\right) \]
Обратите внимание, что вы используете \(c_V\), если выполняется с постоянной громкостью, или \(c_P\), если выполняется с постоянной громкостью давление. Помните, что твердые тела и жидкости имеют по существу одинаковое значение как для \(c_V\), так и для \(c_P\), потому что объем не меняется (сильно) во время нагрева. Газы — вот где реальная разница.
Расчет изменения энтропии для фазового перехода
Помните, что тепло может течь, а температура может оставаться постоянной. как для фазовых переходов. Для фазовых переходов \(q_{\rm transition} = \Delta H_{\rm transition}\). Это означает, что вы можете получить изменение энтропии через: \[ \ Delta S _ {\ rm переход} = {\ Delta H _ {\ rm переход} \ над T _ {\ rm переход}} \]
«Переход» здесь означает испарение, или слияние, или сублимацию и т. д… и
температура при переходе – это просто точка плавления (плавления) или точка кипения (испарения).
д… и
температура при переходе – это просто точка плавления (плавления) или точка кипения (испарения).
Свободная энергия Гибба
Свободная энергия Гибба ( G ) — это еще одна функция состояния, которая определяется из трех других: \(G = H — TS\). Удерживая температуру и давление постоянными, получаем:
\[\Дельта G = \Дельта H — T\Дельта S \]
Обычно мы получаем \(\Delta X\) в приведенном выше уравнении из стандартных термодинамических данных. Таблицы, как у вас в приложении 4 в вашем учебнике. Если вы находитесь в стандартном состоянии, вы добавляете верхний индекс «°» к терминам: 9\цирк\]
Конечно, это означает, что температура в приведенном выше уравнении должна быть 25°C или 298,15 K. Вы также можете показать с помощью простого доказательства, что \(\Delta G\) (функция состояния системы) равна \(-T\Delta; S _{\rm univ}\). Итак, теперь мы можем использовать \(\Delta G\) в качестве индикатора спонтанности реакции или процесса.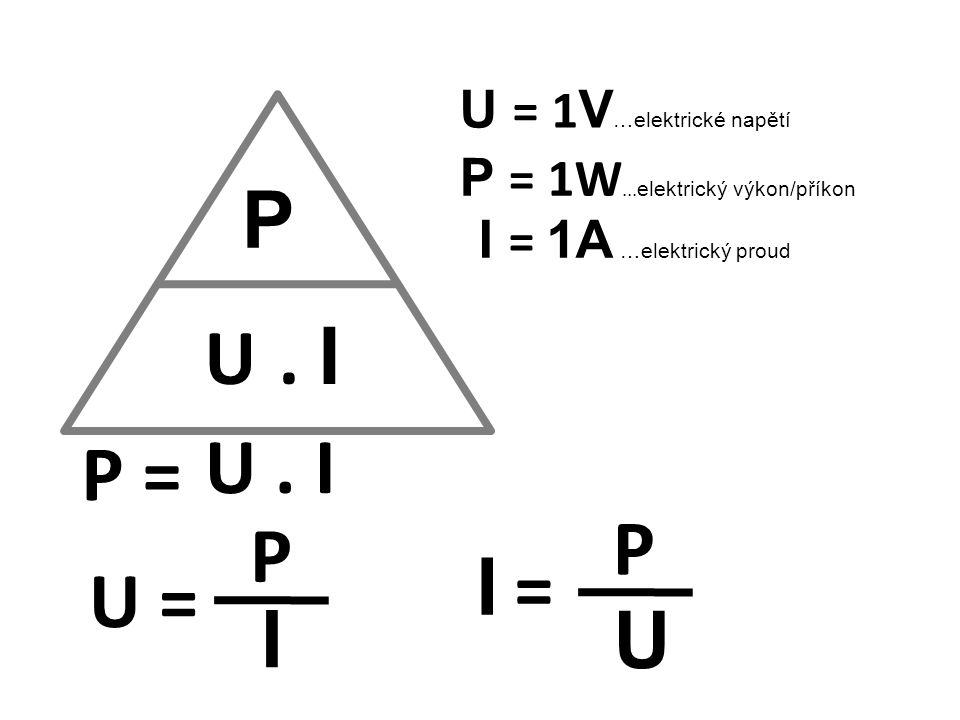
Определение термодинамического равновесия: \(\Delta G = 0\)
Кроме того, мы можем предположить, что обычные значения \(\Delta G\) (нестандартные условия) примерно равны скорректированным стандартным значениям для \(\Delta H\) и \(\Delta S\) через температуру: 9\цирк\]
Если предположить, что вы находитесь в равновесии, то \(\Delta G = 0\), и вы получите следующее:
\[\Дельта H = T \Дельта S \hskip30pt \Delta S = {\Delta H \over T} \hskip30pt Т знак равно {\ Дельта Н \ над \ Дельта S} \]
Определение, формула, пример и расчет
Что такое неуправляемая бета?
Бета – это мера рыночного риска. Безрычажная бета (или бета актива) измеряет рыночный риск компании без влияния долга.
«Отключение» бета-версии устраняет финансовые последствия кредитного плеча, тем самым изолируя риск, связанный исключительно с активами компании. Другими словами, насколько собственный капитал компании повлиял на ее профиль риска.
Ключевые выводы
- Бета с кредитным плечом (обычно называемая просто бета или бета по акциям) является мерой рыночного риска. Долг и собственный капитал учитываются при оценке профиля риска компании.
- Бета-версия без заемных средств удаляет долговой компонент, чтобы изолировать риск, связанный исключительно с активами компании.
- Высокое отношение долга к собственному капиталу обычно приводит к увеличению риска, связанного с акциями компании.
- Бета, равная 1, означает, что акции так же рискованны, как и рынок, в то время как бета больше или меньше 1 отражают пороги риска выше или ниже рыночных, соответственно.
Unlevered Beta
Понимание Unlevered Beta
Бета — это наклон коэффициента для акций, регрессировавший по отношению к эталонному рыночному индексу, такому как индекс Standard & Poor’s (S&P) 500. Ключевым фактором, определяющим бета, является левередж, который измеряет уровень долга компании по отношению к ее собственному капиталу. Коэффициент бета измеряет риск фирмы с заемным и собственным капиталом в структуре капитала по отношению к волатильности рынка. Другой тип бета-версии известен как бета-версия 9 без рычага.0098 .
Коэффициент бета измеряет риск фирмы с заемным и собственным капиталом в структуре капитала по отношению к волатильности рынка. Другой тип бета-версии известен как бета-версия 9 без рычага.0098 .
«Отключение» бета-версии устраняет любые положительные или отрицательные эффекты, полученные за счет добавления долга в структуру капитала фирмы. Сравнение бета-версий компаний без рычагов дает инвестору ясность в отношении состава риска, который он принимает на себя при покупке акций.
Безрычажная бета (актив бета) знак равно Бета-версия с кредитным плечом (бета-версия собственного капитала) ( 1 + ( 1 − ставка налога ) * Долг Беспристрастность ) \text{Бета без кредита (бета актива)} =\frac{ \text{Бета с кредитом (бета капитала)} } {\left( 1 + \frac{\left( 1-\text{ставка налога} \right)*\ text{Долг}}{\text{Собственный капитал}} \right )} Бета без заемных средств (бета активов) = (1+Собственный капитал (1 – налоговая ставка)∗Долг) Бета с заемными средствами (бета собственных средств)
Возьмем компанию, которая увеличивает свой долг, тем самым повышая отношение долга к собственному капиталу. Это приведет к тому, что больший процент прибыли будет использоваться для обслуживания этого долга, что усилит неопределенность инвесторов в отношении будущих потоков доходов. Следовательно, считается, что акции компании становятся более рискованными, но этот риск не связан с рыночным риском.
Это приведет к тому, что больший процент прибыли будет использоваться для обслуживания этого долга, что усилит неопределенность инвесторов в отношении будущих потоков доходов. Следовательно, считается, что акции компании становятся более рискованными, но этот риск не связан с рыночным риском.
Выделение и устранение долгового компонента общего риска приводит к бета-коэффициенту без использования заемных средств.
Уровень долга компании может повлиять на ее результаты, делая ее более чувствительной к изменениям цены ее акций. Обратите внимание, что анализируемая компания имеет задолженность в своей финансовой отчетности, но бета-версия без левериджа рассматривает ее так, как будто у нее нет задолженности, исключая любую задолженность из расчетов. Поскольку компании имеют различную структуру капитала и уровни долга, аналитик может рассчитать бета-версию без рычага, чтобы эффективно сравнивать их друг с другом или с рынком. Таким образом, будет учитываться только чувствительность активов (капитала) фирмы к рынку.
Чтобы «отключить» бета-версию, необходимо знать бета-версию с кредитным плечом для компании в дополнение к соотношению долга к собственному капиталу компании и ставке корпоративного налога.
Систематический риск и бета-версия
Систематический риск — это тип риска, который вызван факторами, не зависящими от компании. Этот вид риска нельзя диверсифицировать. Примеры систематического риска включают стихийные бедствия, политические выборы, инфляцию и войны. Бета используется для измерения уровня систематического риска или волатильности акции или портфеля.
Бета — это статистическая мера, которая сравнивает волатильность цены акции с волатильностью рынка в целом. Если волатильность акции, измеряемая коэффициентом бета, выше, акция считается рискованной. Если волатильность акции ниже, говорят, что акция имеет меньший риск.
Бета, равная единице, эквивалентна риску более широкого рынка. То есть компания с коэффициентом бета, равным единице, имеет тот же систематический риск, что и рынок в целом. Бета, равная двум, означает, что компания в два раза более волатильна, чем рынок в целом, а бета меньше единицы означает, что компания менее волатильна и представляет меньший риск, чем более широкий рынок.
Бета, равная двум, означает, что компания в два раза более волатильна, чем рынок в целом, а бета меньше единицы означает, что компания менее волатильна и представляет меньший риск, чем более широкий рынок.
Пример неактивной бета-версии
B U = B L ÷ [1 + ((1 — Налоговая ставка) x D/E)]
Например, расчет неучтенной бета-версии для Tesla, Inc. (по состоянию на ноябрь 2017 г.):
- бета (B L ) составляет 0,73
- Соотношение долга к собственному капиталу (D/E) составляет 2,2
- Ставка корпоративного налога составляет 35%.
Тесла B U = 0,73 ÷ [1 + ((1 – 0,35) * 2,2)] = 0,30
Бета без заемных средств почти всегда равна или ниже, чем бета с заемными средствами, учитывая, что долг чаще всего будет нулевым или положительным. (В тех редких случаях, когда долговая составляющая компании отрицательна, например, компания накапливает денежные средства, тогда бета без левериджа потенциально может быть выше, чем бета с левериджем. )
)
Если бета-версия без кредитного плеча положительна, инвесторы будут вкладывать средства в акции компании, когда ожидается рост цен. Отрицательная нелевериджная бета побудит инвесторов инвестировать в акции, когда ожидается снижение цен.
Как бета-версия без рычага может помочь инвестору?
Бета-версия без заемных средств устраняет любые положительные или отрицательные эффекты, полученные путем добавления долга в структуру капитала фирмы. Сравнение бета-версий компаний без рычагов дает инвестору ясность в отношении состава риска, который он принимает на себя при покупке акций. Поскольку компании имеют различную структуру капитала и уровни долга, инвестор может рассчитать бета-версию без кредитного плеча, чтобы эффективно сравнивать их друг с другом или с рынком. Таким образом, будет учитываться только чувствительность активов фирмы (собственного капитала) к рынку9.0003
Что такое бета?
Проще говоря, бета (ß) — это мера рыночного риска. Точнее, это мера волатильности или систематического риска ценной бумаги или портфеля по сравнению с рынком в целом. С точки зрения статистики, это наклон коэффициента для ценной бумаги (акции), регрессированный по отношению к эталонному рыночному индексу (S&P 500). Каждая из этих точек данных представляет доходность отдельной акции по сравнению с доходностью рынка в целом. Таким образом, бета эффективно описывает активность доходности ценной бумаги, когда она реагирует на колебания рынка.
С точки зрения статистики, это наклон коэффициента для ценной бумаги (акции), регрессированный по отношению к эталонному рыночному индексу (S&P 500). Каждая из этих точек данных представляет доходность отдельной акции по сравнению с доходностью рынка в целом. Таким образом, бета эффективно описывает активность доходности ценной бумаги, когда она реагирует на колебания рынка.
Что такое бета-версия с кредитным плечом?
Коэффициент бета измеряет риск фирмы с заемным и собственным капиталом в структуре капитала по отношению к волатильности рынка. Ключевым фактором, определяющим бета, является левередж, который измеряет уровень долга компании по отношению к ее собственному капиталу. Таким образом, бета публично торгуемой ценной бумаги с использованием заемных средств измеряет чувствительность тенденции этой ценной бумаги работать по отношению к рынку в целом. Бета с кредитным плечом больше положительной 1 или меньше отрицательной 1 означает, что она имеет большую волатильность, чем рынок.

