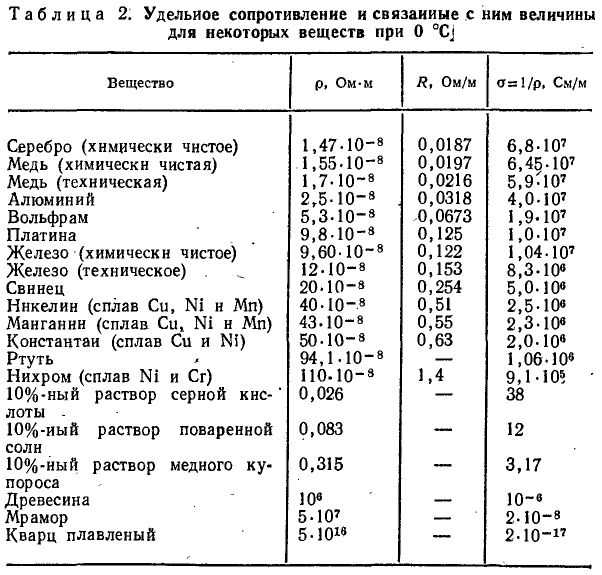
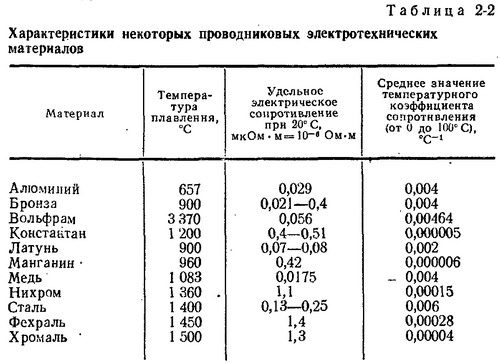
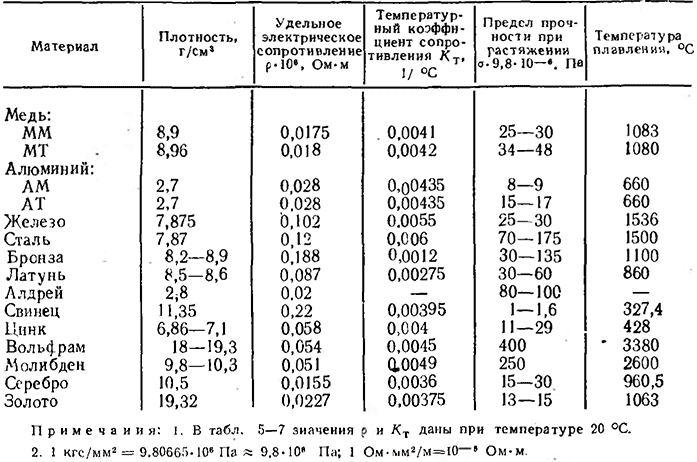
Таблица электропроводности различных сред | Эталон-Прибор
| Наименование | Формула | Концентрация, % | Температура, °С | Электропроводность, мкСм/см |
| 2-этоксиэтанол | 25 | 1,8 | ||
| N-метилацетанид | 40 | 0,07 | ||
| Адипиновая кислота | HOOC(Ch3)COOH | 25170 | 0,7; 0,2 | |
| Азотная кислота | HNO3 | 6,2 12,4 24,8 31,0 37,2 49,6 62,0 | 18 | 312000 542000 768000 782000 755000 634000 490000 |
| Ализарин | 233 | 1,45 | ||
| Алиловый спирт | Ch3•CHCh3OH | 25 | 7,0 | |
| Алюминат натрия | 25 | 7000 | ||
| Аммиак | Nh4 | 0,10 0,40 0,80 1,60 4,01 8,03 16,15 30,5 | -79 15 15 | 0,13 250 490 660 870 1100 1040 630 190 |
| Анилин | 25 | 0,024 | ||
| Антрацен | 230 | 0,0003 | ||
| Ацетальдегид (уксусный альдегид) | Ch4CHO | 15 | 1,7 | |
| Ацетамид (амид уксусной кислоты) | Ch4CONh3 | 100 | ≤ 43,0 | |
| Ацетат калия | Ch4COOK | 4,67 9,33 28 46,67 65,33 | 15 | 34700 62500 126000 112000 47900 |
| Ацетат натрия | Ch4COONa | 5 2032 | 18 | 29500 65000 56900 |
| Ацетилхлорид | Ch4COCl | 25 | 0,4 | |
| Ацетон | Ch4COCh4 | 18 25 | 0,02 0,06 | |
| Ацетонитрил | 20 | ≤ 0,02 | ||
| Ацетофенон | C6H5COCh4 | 25 | 0,006 | |
| Бензиловый эфир бензойной кислоты | 25 | ≤ 0,001 | ||
| Бензинамин | C6H5Ch3Nh3 | 25 | ||
| Бензойная кислота | 125 | 0,003 | ||
| Бензол | C6H6 | 20 | 3,8•10-8 | |
| Бензонитрил | C6H5CN | 25 | 0,02 | |
| Битумная эмульсия | 30 | 9000 | ||
| Бромбензол | C6H5Br | 25 | ≤ 1,2•10-5 | |
| Бромид кадмия | CdBr2 | 0,03 0,08 0,15 0,51 1 5 10 20 30 43 | 18
| 230 470 840 2130 3570 10900 16400 23600 26100 |
| Бромид калия | KBr | 5 10 20 30 36 | 15
| 47000 93000 191000 292000 351000 |
| Бромид ртути | HgBr2 | 0,22 0,42 | 18 | 16 26 |
| Бромводородная кислота | HBr | 5 10 15 | -80 15 | 0,008 191000 355000 494000 |
| Бутановая (масляная) кислота | C4H8O2 | 1,00 5,02 10,07 15,03 20,01 50,04 70,01 100,00 | 18
| 460 860 990 960 890 300 56 0,06 |
| Бутанол-1 | Ch4-(Ch3)3-OH | 25 | 0,009 | |
| Высокоочистная кислота | – | 0,04 | ||
| Гексан | C6h24 | 18 | – | ≤ 10-6 |
| Гидроксид бария | Ba(OH)2 | 1,25 2,5 | 18 | 25000 48000 |
| Гидроксид калия | KOH | 4,2 8,4 16,8 25,2 33,6 42,0 | 15 | 146000 272000 456000 540000 522000 421000 |
| Гидроксид лития | LiOH | 1,25 2,5 5,0 7,5 | 18 | 78100 142000 240000 300000 |
Гидроксид алюминия | 25 | 350000 | ||
| Гидроксид натрия | NaOH | 1 2 4 6 8 10 15 20 25 27,5 30 32,5 35 37,5 40 45 50 | 18 | 46500 88700 163000 224000 273000 309000 349000 328000 272000 239000 207000 180000 156000 136000 121000 97700 82000 |
| Глицерин | 25 | 0,064 | ||
| Дибромэтан | Brh3CCh3Br | 19 | ≤ 0,0002 | |
| Диметилсульфат | (Ch4)2SO4 | 0 | 0,16 | |
| Диметилформамид | 25 | 0,06. ..0,2 ..0,2 | ||
| Диоксид серы | SO2 | 35 | 0,015 | |
| Диоксан | 25 | 2…6•109 | ||
| Дихлорэтан | Clh3CCh3Cl | 25 | 0,03 | |
| Дициан | CN2 | – | ≤ 0,007 | |
| Диэтил карбонат | (C2H5)2CO3 | 25 | 0,017 | |
| Диэтил оксалат | 25 | 0,76 | ||
| Диэтил сульфат | (C2H5)SO4 | 25 | 0,26 | |
| Диэтиламин | (C2H5)2NH | -33,6 | 0,002 | |
| Диэтиловый эфир | (C2H5)2O | 25 | ≤ 3,7•10-7 | |
| Изобутиловый спирт | (Ch4)2CHCh3OH | 25 | ≤ 0,02 | |
| Иод | 110 | 0,00013 | ||
| Иодид аммония | Nh5I | 10 20 50 | 18
| 77200 160000 420000 |
| Иодид кадмия | CdI2 | 1 5 10 15 20 30 40 45 | 18
| 2120 6090 10400 14600 18600 25400 30300 31400 |
| Иодид калия | KI | 10 20 30 40 55 | 18 | 33800 68000 146000 230000 317000 423000 |
| Иодид лития | LiI | 5 10 20 25 | 18 | 29600 57300 109000 135000 |
| Иодид натрия | NaI | 5 10 20 40 | 18 | 29800 58100 114000 21000 |
Иодоводород | HI | 5 | 15 BP | 133000 0,20 |
| Карбонат калия | K2CO3 | 5 10 20 30 40 50 | 15 | 56100 104000 181000 222000 217000 147000 |
Карбонат лития | Li2CO3 | 0,20 0,63 | 18 | 3430 8850 |
| Карбонат натрия | Na2CO3 | 5 10 15 | 18 | 45100 70500 83600 |
| Квасцы | 25 | 9000 | ||
| Керосин | 25 | ≤ 0,017 | ||
| Кислород | O2 | – | ≤ 10-7 | |
| Крезол | 25 | ≤ 0,017 | ||
| Ксилол (диметилбензол) | C6h5(Ch4)2 | – | ≤ 10-9 | |
| Латекс | 25 | 5000 | ||
| Метил анилин | C6h5(Ch4)Nh3 | 25 | ≤ 2,0 | |
| Метилиодид | Ch4I | 25 | ≤ 0,02 | |
| Метиловый спирт (метанол) | Ch4OH | 25 | 0,002. ..0,007 ..0,007 | |
| Метиловый эфир азотной кислоты | 25 | 4,5 | ||
| Метиловый эфир уксусной кислоты | Ch4CO2Ch4 | 25 | 3,4 | |
| Метилтиоцианат | Ch4SC-N | 25 | 1,5 | |
| Моноэтиловый эфир серной кислоты | C2H6HSO4 | 0,53 | ||
Муравьиная кислота | HCO2H | 4,94 9,55 20,34 29,83 39,95 50,02 70,06 89,02 100 | 18 | 5500 7560 9840 10400 9840 8640 5230 1870 280 |
| Нафталин | C10H8 | 80 | 0,0004 | |
| Нитрат аммония | Nh5NO3 | 5 10 30 50 | 15 | 59000 112000 284000 363000 |
| Нитрат бария | Ba(NO3)2 | 4,2 8,4 | 18 | 2100 35000 |
Нитрат кадмия | Cd(NO3)2 | 1 5 10 20 30 40 48 | 18 | 6940 28900 51300 82700 95600 90300 75500 |
| Нитрат калия | KNO3 | 5 10 15 20 22 | 18 | 45400 83900 119000 151000 163000 |
| Нитрат кальция | Ca(NO3)2 | 6,25 12,5 25,0 37,5 50 | 18 | 49000 80000 105000 88000 47000 |
| Нитрат магния | Mg(NO3)2 | 5 10 17 | 18 | 43800 77000 11000 |
| Нитрат меди | Cu(NO3)2 | 5 10 15 20 25 35 | 15 | 36500 63500 85800 102000 109000 106000 |
| Нитрат натрия | NaNO3 | 5 10 20 30 | 18 | 43600 78200 130000 161000 |
| Нитрат свинца | Pb(NO3)2 | 5 10 15 20 25 30 | 15 | 19100 32200 42900 52100 60000 66800 |
Нитрат серебра | AgNO3 | 5 10 20 40 60 | 18 | 26000 48000 87000 157000 210000 |
| Нитрат стронция | Sr(NO3)2 | 5 10 15 20 25 35 | 15 | 30900 52700 69000 80200 86600 86100 |
| Нитробензол | C6H5NO2 | 25 | 0,0002. ..0,0004 ..0,0004 | |
| Нитрометан | Ch4NO2 | 25 | 0,22…0,66 | |
| Нитротолуол | C6h5(Ch4)NO2 | 25 | ≤ 0,2 | |
| Нонан | C9h3O | 25 | ≤ 0,017 | |
| Оксалат калия (калиевая соль щавелевой кислоты) | K2C2O4 | 5 10 | 18 | 48800 91500 |
| Оксид титана | TiO2 | 25 | 4000 | |
| Оксид цинка | ZnO2 | 25 | 2000 | |
| Оленновая кислота | 15 | ≤ 0,0002 | ||
| Ортофосфорная кислота | h4PO4 | 10 20 30 35 50 70 80 85 87 | 15 | 56600 113000 165000 186000 207000 147000 97900 78000 70900 |
| Пентан | C5h22 | 19,5 | ≤ 0,0002 | |
| Пентановая (валерьяновая) кислота | C5h20O2 | 80 | ≤ 4•10-7 | |
| Пинен | C10h26 | 23 | ≤ 0,0002 | |
| Пропанол | C3H7OH | 18 25 | 0,05 0,02 | |
| Пропанол-1 | 25 | 0,02 | ||
| Пропанол-2 | 25 | 0,004 | ||
| Пропилбромид | 25 | ≤ 0,02 | ||
| Пропиональ | Ch4-Ch3-COH | 25 | 0,85 | |
| Пропионовая кислота | C2H5CO2H | 1,00 5,01 10,08 20,02 30,03 50,09 59,99 100,00 | 18 25 | 480 930 1110 1040 820 380 85 0,07 ≤ 0,001 |
| Ртуть | Hg | 0 | 10,6•109 | |
| Сера | S | 115 130 440 | 10-6 ≤ 0,00005 0,12 | |
| Серная кислота | h3SO4 | 5 10 15 20 25 30 35 40 50 60 65 70 75 80 85 86 87 88 89 90 91 92 93 94 95 96 97 99,4 | 18 | 209000 392000 543000 653000 717000 739000 724000 680000 541000 373000 291000 216000 152000 111000 98500 99200 101000 103000 106000 108000 109000 110000 110000 107000 103000 94400 80000 8500 |
| Сероводород | h3S | ВР | 0,00001 | |
| Силикат натрия | Na2SiO3 | 25 25 25 | 26000 24000 14000 | |
| Синильная кислота | 0 | 3,3 | ||
| Соляная кислота | HCl | 5 10 20 30 40 | 15 | 395000 630000 762000 662000 515000 |
| Стеариновая кислота | Ch4(Ch3)16COOH | 80 | ≤ 4•10-7 | |
| Сульфат аммония | (Nh5)2SO4 | 5 10 20 30 31 | 15 | 55200 101000 178000 229000 232000 |
| Сульфат кадмия | CdSO4 | 0,03 0,1 0,5 1 5 10 25 36 | 18 | 274 692 2390 4160 24700 43000 42100 |
| Сульфат калия | K2SO4 | 5 10 | 18 | 45800 86000 |
| Сульфат лития | LiSO4 | 5 10 | 15 | 40000 61000 |
| Сульфат магния | MgSO4 | 5 | 15 | 26300 |
| Сульфат меди | CuSO4 | 2,5 | 18 | 10900 |
| Сульфат натрия | Na2SO4 | 5 | 18 | 40900 |
| Сульфат цинка | ZnSO4 | 5 | 18 | 19100 |
| Сульфид калия | K2S | 3,18 | 18 | 84500 |
| Сульфид натрия | Na2S | 2,02 | 18 | 61200 |
| Тиоуксусная кислота | 35 | 3,9 | ||
| Толуол | C6H5Ch4 | – | ≤ 10-8 | |
| Трибром метан | CHBr3 | 25 | ≤ 0,02 | |
| Трибромид мышьяка | AsBr3 | 35 | 1,5 | |
| Триметиламин | (Ch4)3N | -33,5 | 0,00022 | |
| Трифторуксусная кислота | CF3COOH | 25 | 0,004. ..0,08 ..0,08 | |
| Трихлор метан (хлороформ) | CHCl3 | 25 | ≤ 0,0001 | |
| Трихлорид мышьяка | AsCl3 | 25 | 1,2 | |
| Трихлоруксусная кислота | 25 | 0,003 | ||
| Трихлорэтилен | ClCH-CCl2 | 25 | Измерение невозможно | |
| Уксусная кислота | Ch4CO2H | 0,3 | 18 0 | 320 |
| Уксусный ангидрид | (Ch4CO)2O | 20 | 0,75 | |
| Фенон | 25 | ≤ 0,017 | ||
| Формалин | 25 | 4,0 | ||
| Формамид (амид муравьиной кислоты) | HCONh3 | 25 | 1,0. ..3,0 ..3,0 | |
| Фосген | COCl2 | 25 | 0,007 | |
| Фосфор | 25 | 0,4 | ||
| Фторид калия | KF | 5 | 18 | 65200 |
| Фторводородная (плавиковая) кислота | HF | 0,004 | 18 | 25 |
| Хлор (жидкость) | Cl2 | -70 | ≤ 10-10 | |
| Хлорбензол | C6H5Cl | 20 | 1,9…2,4•10-6 | |
| Хлоргидрин | 25 | 0,5 | ||
| Хлорид алюминия | AlCl2 | 25 | 250000 | |
| Хлорид аммония | Nh5Cl | 5 | 18 | 9180 |
| Хлорид бария | BaCl2 | 5 | 18 | 39000 |
| Хлорид кадмия | CdCl2 | 0,05 | 18 | 500 |
| Хлорид калия | KCl | 5 | 18 | 69000 |
| Хлорид кальция | CaCl2 | 5,0 | 18 | 64000 |
| Хлорид лития | LiCl | 2,5 | 18 | 41000 |
| Хлорид магния | MgCl2 | 5 | 18 | 68300 |
| Хлорид марганца | MnCl2 | 5 | 15 | 52600 |
| Хлорид меди | CuCl2 | 1,35 | 18 | 18700 |
| Хлорид натрия | NaCl | 5 | 18 | 67200 |
| Хлорид ртути | HgCl2 | 0,23 | 18 | 44 |
| Хлорид стронция | SrCl2 | 5 | 18 | 48300 |
| Хлорид цинка | ZnCl2 | 2,5 | 15 | 27600 |
| Хлорводород | -96 | 0,01 | ||
| Хлоруксусная кислота | 60 | 1,4 | ||
Цианид калия | KCN | 3,25 | 15 | 52700 |
| Циклогексан | C6h22 | 20 | 1,9•10-8 | |
| Циклогексанол | C6h21OH | 25 | 0,0008 | |
| Циклогексанон | C6h20O | 25 | 0,05 | |
| Щавелевая кислота | (CO2H)2 | 3. 5 5 | 18 | 51000 |
| Эпихлоргидрин | 25 | 0,034 | ||
| Этиламин | C2H5Nh3 | 0 | 0,001 | |
| Этилбензонат (этиловый эфир бензойной кислоты) | 25 | 0,001 | ||
Этилбромид | C2H5Br | 25 | 0,02 | |
Этиленгликоль | HOCh3Ch3OH | 25 | 0,01…0,5 | |
Этилендиамин | h3NCh3Ch3Nh3 | 25 | 0,09…0,2 | |
Этилиодид | C2H5I | 25 | ≤ 0,02 | |
| Этилметил кетон (бутанон-2) | 25 | 0,1 | ||
Этиловый спирт (этанол) | C2H5OH | 95 | 25 | 0,0013 |
| Этиловый эфир азотной кислоты | C2H5ONO2 | 25 | 0,53 | |
| Этиловый эфир уксусной кислоты (элилацетат) | Ch4CO2C2h3 | 25 | ≤ 0,001 | |
| Этилхлорид | C2h3Cl | 0 | ≤ 0,003 | |
Этоксибензол | C6H5OC2H5 | 25 | ≤ 0,017 |
Классификация веществ по электрическим свойствам
Все вещества в зависимости от их электрических свойств относятся к проводникам, полупроводникам и диэлектрикам. Различия между ними можно показать с помощью энергетических диаграмм, зонной теории твердых тел.
Различия между ними можно показать с помощью энергетических диаграмм, зонной теории твердых тел.
Различным атомам веществ характерны определенные энергетические состояния (уровни).
При переходе газообразного вещества в жидкость, а затем при образовании кристаллической решетки твердого тела все имеющиеся у данного типа атомов электронные уровни несколько смещаются вследствие действия соседних атомов друг на друга. Таким образом из отдельных энергетических уровней уединенных атомов в твердом теле образуется целая полоса — зона энергетических уровней. Часть этих уровней заполнена электронами в нормальном не возбужденном состоянии атома. На других уровнях электроны могут находиться только после того, как атом испытает внешнее энергетическое воздействие, при этом он возбуждается. Стремясь перейти к устойчивому состоянию атом излучает избыток энергии в момент возвращения электронов на уровни при которых энергия атома минимальна.
Энергетические диаграммы
Энергетические диаграммы диэлектриков, полупроводников и проводников различны (см. рис. а, б, в).
рис. а, б, в).
Диэлектриками будут такие материалы у которых запрещенная зона настолько велика, что электронной проводимости не наблюдается.
1-зона заполнения электронами
2-запрещенная зона
3-свободная зона
Полупроводниками будут вещества с более узкой запрещенной зоной, которая может быть преодолена за счет внешних энергетических воздействий.
Проводниками будут материалы у которых заполненная электронами зона вплотную прилегает к зоне свободных энергетических уровней или даже перекрывает ее.
Вследствие этого электроны в металле свободны, то есть могут переходить с уровней заполненной зоны на незанятые уровни свободной зоны под влиянием слабой напряженности приложенного к проводнику электрического поля.
При отсутствии в полупроводнике свободных электронов (при 0 град. Кельвина) приложенная к нему разность электрических потенциалов не вызовет тока. Если из вне будет подведена энергия, достаточная для переброса электронов через запрещенную зону то, став свободными, электроны смогут перемещаться под действием электрического поля, создавая электронную электропроводность полупроводника. В заполненной зоне, откуда ушел электрон, образовалась «электронная дырка«, а потому в полупроводнике начинается другое «эстафетное» движение электронов, заполняющих образовавшуюся дырку; причем под воздействием электрического поля дырка будет двигаться как эквивалентный положительный заряд. С повышением температуры число свободных электронов в полупроводнике возрастает. Энергию необходимую для перехода электронов в свободное состояние или для образования дырки может доставить не только тепловое движение но и другие источники энергии (свет, поток ядерных частиц, электрические и магнитные поля, механические воздействия и т.д.).
В заполненной зоне, откуда ушел электрон, образовалась «электронная дырка«, а потому в полупроводнике начинается другое «эстафетное» движение электронов, заполняющих образовавшуюся дырку; причем под воздействием электрического поля дырка будет двигаться как эквивалентный положительный заряд. С повышением температуры число свободных электронов в полупроводнике возрастает. Энергию необходимую для перехода электронов в свободное состояние или для образования дырки может доставить не только тепловое движение но и другие источники энергии (свет, поток ядерных частиц, электрические и магнитные поля, механические воздействия и т.д.).
Электрические свойства определяются условиями взаимодействия атомов вещества и не являются непременной особенностью данного атома. Например углерод в виде алмаза является диэлектриком, а в виде графита обладает большой проводимостью. Дефекты и примеси в кристаллической решетке очень сильно влияют на электрические свойства твердых тел.
Классификация проводниковых материалов
Проводниками электрического тока могут быть твердые тела, жидкости, а при соответствующих условиях и газы. Важнейшими практическими применяемыми в электротехнике твердыми проводниковыми материалами являются металлы и их сплавы. Из металлических проводниковых материалов можно выделить: металлы высокой проводимости, имеющие удельное сопротивление при нормальной температуре не более 0,05 мкОм·м и сплавы высокого сопротивления — более 0,3 мкОм·м. Металлы высокой проводимости используются для проводов, обмоток электрических машин и т.д. Металлы и сплавы высокого сопротивления применяют для изготовления резисторов, электронагревательных приборов и т.д.
К жидким проводникам относятся расплавленные металлы и различные электролиты. Для большинства металлов температура плавления высока.
Механизм прохождения тока в металлах обусловлен движением (дрейфом) свободных электронов под воздействием электрического поля. Поэтому металлы называют проводниками с электронной электропроводностью или проводниками первого рода. Проводниками второго рода — электролитами являются растворы кислот, щелочей и солей. Прохождение тока через эти вещества связано с переносом вместе с электрическими зарядами ионов, вследствие чего состав электролита постепенно изменяется, а на электродах выделяются продукты электролиза. Ионные кристаллы в расплавленном состоянии также являются проводниками второго рода.
Проводниками второго рода — электролитами являются растворы кислот, щелочей и солей. Прохождение тока через эти вещества связано с переносом вместе с электрическими зарядами ионов, вследствие чего состав электролита постепенно изменяется, а на электродах выделяются продукты электролиза. Ионные кристаллы в расплавленном состоянии также являются проводниками второго рода.
Все газы и пары в том числе, и пары кристаллов при низких напряженностях электрического поля не являются проводниками. Если напряженность поля превзойдет некоторое критическое значение, обеспечивающее начало ударной фотоионизации, то газ может стать проводником с электронной и ионной электропроводностью. Сильно ионизированный газ при равенстве числа электронов числу положительно заряженных ионов в единице объема представляет собой особую проводящую среду — плазма.
Основные свойства проводников
Классическая электронная теория металлов представляет твердый проводник в виде системы состоящей из узлов кристаллической ионной решетки внутри которой находится электронный газ из свободных электронов. От каждого атома металла в свободное состояние переходит 1-2 электрона. При столкновении электронов с узлами кристаллической решетки энергия, накопленная при ускорении электронов в электрическом поле, передается металлической основе проводника. Вследствие чего он нагревается. Электронная теория металлов дает возможность аналитически описать и объяснить основные законы электропроводности и потерь электрической энергии в металлах.
От каждого атома металла в свободное состояние переходит 1-2 электрона. При столкновении электронов с узлами кристаллической решетки энергия, накопленная при ускорении электронов в электрическом поле, передается металлической основе проводника. Вследствие чего он нагревается. Электронная теория металлов дает возможность аналитически описать и объяснить основные законы электропроводности и потерь электрической энергии в металлах.
Опыты подтвердили гипотезу о электронном газе в металлах, а именно:
1)При длительном пропускании электрического тока через цепь, состоящую из одних металлических проводников не наблюдается проникновение атомов одного металла в другой.
2)При нагреве металлов до высоких температур скорость теплового движения свободных электронов увеличивается и наиболее быстрые из них могут вылетать из металла преодолевая силы поверхностного потенциального барьера.
3)В момент неожиданной остановки быстро двигавшегося проводника происходит смещение электронного газа по закону инерции в направлении движения. Смещение электронов приводит к появлению разности потенциалов на концах заторможенного проводника и стрелка подключенного к ним измерительного прибора отклоняется по шкале
Смещение электронов приводит к появлению разности потенциалов на концах заторможенного проводника и стрелка подключенного к ним измерительного прибора отклоняется по шкале
4)Исследуя поведение металлических проводников в магнитном поле установили, что вследствие искривления траектории электронов в металлической пластине, помещенной в поперечное магнитное поле, появляется ЭДС и изменяется электрическое сопротивление проводника.
Представляя металл как систему, в которой положительные ионы скрепляются посредствам свободно движущихся электронов, легко понять природу всех основных свойств металлов: пластичность, ковкость, теплопроводность, электропроводность.
К важнейшим параметрам, характеризующим свойства проводниковых материалов относятся: удельная проводимость γ или обратная ей величина — удельное сопротивление ρ, температурный коэффициент удельного сопротивления , коэффициент теплопроводности, контактная разность потенциалов и термоэлектродвижущая сила (термо ЭДС) ε, предел прочности при растяжении и относительное удлинение перед разрывом .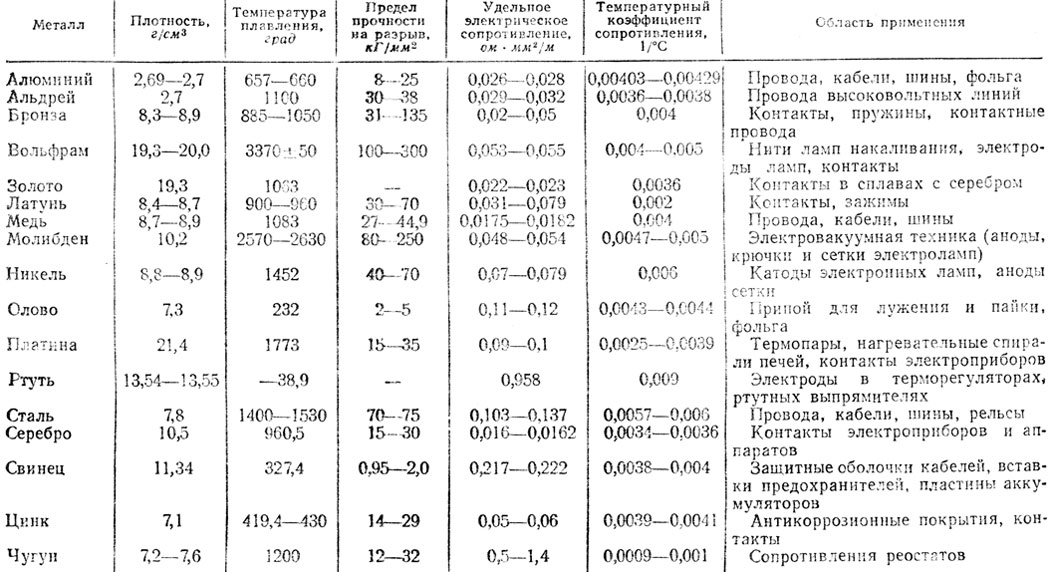
Удельная проводимость металлических проводников согласно классической теории металлов может быть выражена:
где
е — заряд электрона;
n0 — число свободных электронов в единице объема металла;
λ — средняя длина свободного пробега электрона между двумя соударениями с узлами решетки;
m — масса электрона;
υT— средняя скорость теплового движения свободного электрона в металле.
| Таблица 3-20 | |||
|---|---|---|---|
| Напряжение искрового пробоя Uз в воздухе при различных давлениях р и расстояниях d между электродами | |||
| pd, МПа | р, Па | d, м | Uз,кВ |
| 34500 | 830 | ||
| 813 | |||
| 785 | |||
| 20700 | 528 | ||
| 515 | |||
| 502 | |||
| 487 | |||
| 473 | |||
| 3330 | 95 | ||
| 90 | |||
| 87 | |||
| 87 | |||
| 84 | |||
| 82 | |||
| 81 | |||
Для разных металлов скорости хаотического теплового движения электронов (при определенной температуры) примерно одинаковы. Незначительно различаются также и концентрация свободных электронов nо. Поэтому значение удельной проводимости в основном зависит от средней длины пробега электронов в данном проводнике , которая в свою очередь определяется структурой проводникового материала. Все чистые металлы с наиболее правильной кристаллической решеткой характеризуются наименьшими значениями коэффициента удельного сопротивления.
Незначительно различаются также и концентрация свободных электронов nо. Поэтому значение удельной проводимости в основном зависит от средней длины пробега электронов в данном проводнике , которая в свою очередь определяется структурой проводникового материала. Все чистые металлы с наиболее правильной кристаллической решеткой характеризуются наименьшими значениями коэффициента удельного сопротивления.
Рассеивание движения электронов происходит в местах дефектов кристаллической решетки. Число носителей заряда (концентрация свободных электронов) в металлическом проводнике при повышении температуры практически остается неизменным. Однако вследствие усилений колебаний узлов кристаллической решетки, с ростом температуры появляется все больше и больше препятствий на пути направленного движения свободных электронов под действием электрического поля, то есть уменьшается средняя длина свободного пробега электрона, уменьшается подвижность электронов и как следствие этого уменьшается удельная проводимость металлов и увеличивается их удельное сопротивление. Иными словами температурный коэффициент удельного сопротивления металлов положителен.
Иными словами температурный коэффициент удельного сопротивления металлов положителен.
Коэффициент в учитывает увеличение числа свободных ионов в твердом теле при возрастании температуры. Для большинства ионных кристаллов коэффициент в близок к 100000 К.
Примеси и нарушения правильной структуры металлов увеличивают их удельное сопротивление. Значительное возрастание r наблюдается при сплавлении двух металлов в том случае если они образуют друг с другом твердый раствор. То есть при затвердевании совместно кристаллизуются и атомы одного металла входят в кристаллическую решетку другого. При некотором соотношении между компонентами в сплаве r имеет максимальное значение. Такое изменение r, от содержания компонентов сплава, можно объяснить тем, что вследствие более сложной структуры сплава по сравнению с чистыми металлами, его уже нельзя рассматривать как классический металл, то есть изменение удельной проводимости сплава зависит не только от изменения подвижности носителей заряда но и в некоторых случаях от частичного возрастания концентрации носителей заряда при повышении температуры. Сплав у которого уменьшение подвижности с ростом температуры компенсируется возрастанием концентрации носителей заряда будет иметь нулевой температурный коэффициент удельного сопротивления.
Сплав у которого уменьшение подвижности с ростом температуры компенсируется возрастанием концентрации носителей заряда будет иметь нулевой температурный коэффициент удельного сопротивления.
Теплопроводностью называется процесс передачи теплоты вследствие хаотического движения молекул или атомов. Количество теплоты переданной слоем вещества площади S при поддерживании на его плоскостях разности температур T2-T1 за время t:
где
-толщина слоя вещества.
Коэффициентом теплопроводности называется величина, измеряемая количеством теплоты переданной в единицу времени через слой единичной толщины при разности температур поверхностного слоя в 1 °C, если площадь поверхностного слоя равна 1. За передачу теплоты через металл в основном ответственны те же свободные электроны, которые определяют и электропроводность металла. Очевидно, что при прочих равных условиях, чем больше удельная электрическая проводимость металла, тем больше должен быть и его коэффициент теплопроводности.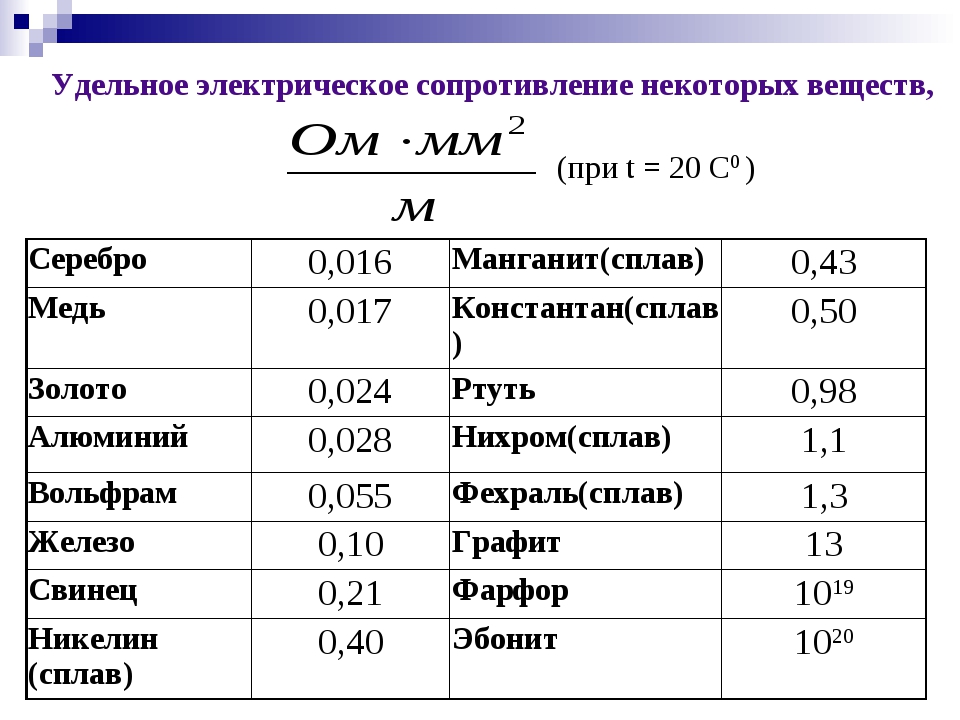
При соприкосновении двух различных металлических проводников между ними возникает контактная разность потенциалов. Причина появления этой разности заключается в различии значений работы выхода электронов из различных металлов, а так же в том, что концентрация электронов, а значит и давление электронного газа, в разных металлах и сплавах является неодинаковыми. Согласно электронной теории металлов следует, что контактная разность потенциалов между металлами А и В равна
где
UA и UB — потенциалы соприкасающихся металлов
n0 — концентрация электронов в них
Если температуры спаев одинаковы, то сумма разности потенциалов в замкнутой цепи равна нулю. Если же один из спаев имеет температуру t1, а другой t2, то между спаями возникает термо-эдс.
где
χ — коэффициент постоянный для данной пары проводников, характеризующий возникающую термо-эдс.
Провод составленный из двух изолированных друг от друга различных металлов или сплавов (термопар) применяют для измерения температур. В термопарах используются проводники, имеющие большой и стабильный коэффициент термо-эдс.
В термопарах используются проводники, имеющие большой и стабильный коэффициент термо-эдс.
Для обмоток измерительных приборов и резисторов стремятся применять проводниковые материалы и сплавы с возможно меньшим коэффициентом термо-эдс, чтобы избежать ошибки в измерениях.
Таблица значений электропроводности для распространенных материалов
На этой странице вы можете найти значения электропроводности для распространенных материалов в единицах СИ (См/м).
Примечание: все значения взяты при комнатной температуре (приблизительно 20°C или 68°F).
| Значения электропроводности для различных материалов | |
|---|---|
| Воздух | 1 ×10 900 23 -15 |
| Алюминий | 37,7 ×10 6 |
| Отожженная медь | 58 ×10 6 |
| 3E6″> 31,3 × 10 6 | |
| Кадмий | 13,8 × 10 6 |
| Кальций | 29,8×10 6 |
| Углерод — аморфный | 1,25×10 3 900 24 |
| Углерод-алмаз | 1 ×10 -13 |
| Углерод-графит (параллельно плоскости основания) | 2 ×10 5 |
| Углерод-графит (перпендикулярно плоскости основания) | 900 94 3,3 ×10 2|
| Углеродистая сталь ( 1010) | 6,99 × 10 6 |
| Хром | 7,74 × 10 6 |
| 16 × 10 6 | |
| Константан | 2,04 × 10 6 |
| Медь | 6E6″> 59,6 ×10 6 |
| Вода деионизированная | 4,2 ×10 90 023 -5 |
| Питьевая вода | 0,0005 — 0,05 |
| Плавленый кварц | 1,3 × 10 -18 |
| Арсенид галлия (GaAs) | 1 × 10 -8 |
| Галинстан | 9 0172 3,46 ×10 6|
| Галлий | 7,1 × 10 6 |
| Германий | 2,17 |
| Стекло | 1 × 10 9002 3 -11 |
| Золото | 41,1 × 10 6 |
| Электротехническое зерно сталь | 2,17 ×10 6 |
| Эбонит | 1 ×10 -14 |
| Индий 9 0021 | 6E6″> 11,6 × 10 6 |
| Иридий | 19,7 × 10 6 |
| Железо | 9,93 × 10 6 |
| Свинец 9002 1 | 4,55 × 10 6 |
| Литий | 10,8 × 10 6 |
| Магний | 22,6 × 10 6 |
| Марганец | 6,94 × 10 5 |
| Манганин | 2,07 × 10 6 |
| Ртуть | 1,02 ×10 6 |
| Молибден | 18,7 ×10 6 |
| Нихром | 6,7 × 10 5 |
| Никель | 14,3 × 10 6 |
| Ниобий | 93E6″> 6,93 × 10 6 |
| Осмий | 10,9 × 10 6 | Палладий | 9,5 × 10 6 |
| ПЭТ | 1 ×10 -21 |
| Платина | 9,43 ×10 6 |
| Калий 90 021 | 13,9 × 10 6 |
| Рений | 5,42 × 10 6 |
| Родий | 21,1 × 10 6 |
| Рубидий | 7,79 × 10 6 |
| Рутений | 14,1 × 10 6 |
| Морская вода | 4,5–5,5 |
| Кремний | 4,35 ×10 -4 |
| Серебро | 63 × 10 6 |
| Натрий | 21 ×10 6 |
| Нержавеющая сталь сталь | 45E6″> 1,45 ×10 6 |
| Стронций | 7,62 ×10 6 |
| S сера | 1 ×10 -16 |
| Вода для плавательных бассейнов | 0,25 |
| Тантал | 7,61 × 10 6 |
| Технеций | 6,7 × 10 6 |
| Тефлон (ПТФЭ) | 1 ×10 -25 |
| Таллий | 6,17 × 10 6 |
| Торий | 6,53 × 10 6 |
| T in | 9,17 × 10 6 |
| Титан | 2,38 × 10 6 |
| Вольфрам | 17,9 ×10 6 |
| Древесина – влажная | 1 ×10 90 023 -4 |
| Древесина — сушка в печи | 1 ×10 -16 |
| Цинк | 9E6″> 16,9 × 10 6 |
Примечание: значения электропроводности в этой таблице являются приблизительными и могут варьироваться в зависимости от таких факторов, как температура, давление и наличие примесей в материалах.
Электрическая проводимость элементов периодической таблицы
Цели обучения
В этой статье автор объяснил электропроводность элементов периодической таблицы и тенденции проводимости периодической таблицы . После прочтения этой статьи вы изучите следующие темы.
- Периодическая таблица электропроводности
- Тенденция проводимости Периодическая таблица
- Периодическая таблица электричества
Содержание
Электропроводность – это способность вещества проводить электрический ток благодаря наличию свободных электронов без изменения состава вещества.
Определение электропроводности
В химии электропроводность — это мера способности вещества проводить электричество. Обычно его выражают через коэффициент проводимости вещества, который является величиной, обратной величине его удельного электрического сопротивления. Коэффициент проводимости является мерой легкости, с которой вещество пропускает через себя электрический заряд.
На электрическую проводимость вещества могут влиять различные факторы, такие как его температура, давление и химический состав.
Электропроводность является важным свойством многих материалов и часто используется для их классификации и характеристики.
Материалы, хорошо проводящие электричество, такие как металлы, используются в конструкции электрических проводов и других компонентов электрических цепей, в то время как материалы, которые плохо проводят электричество, такие как изоляторы, используются для защиты людей от поражения электрическим током и для предотвратить нежелательный поток электричества в цепях.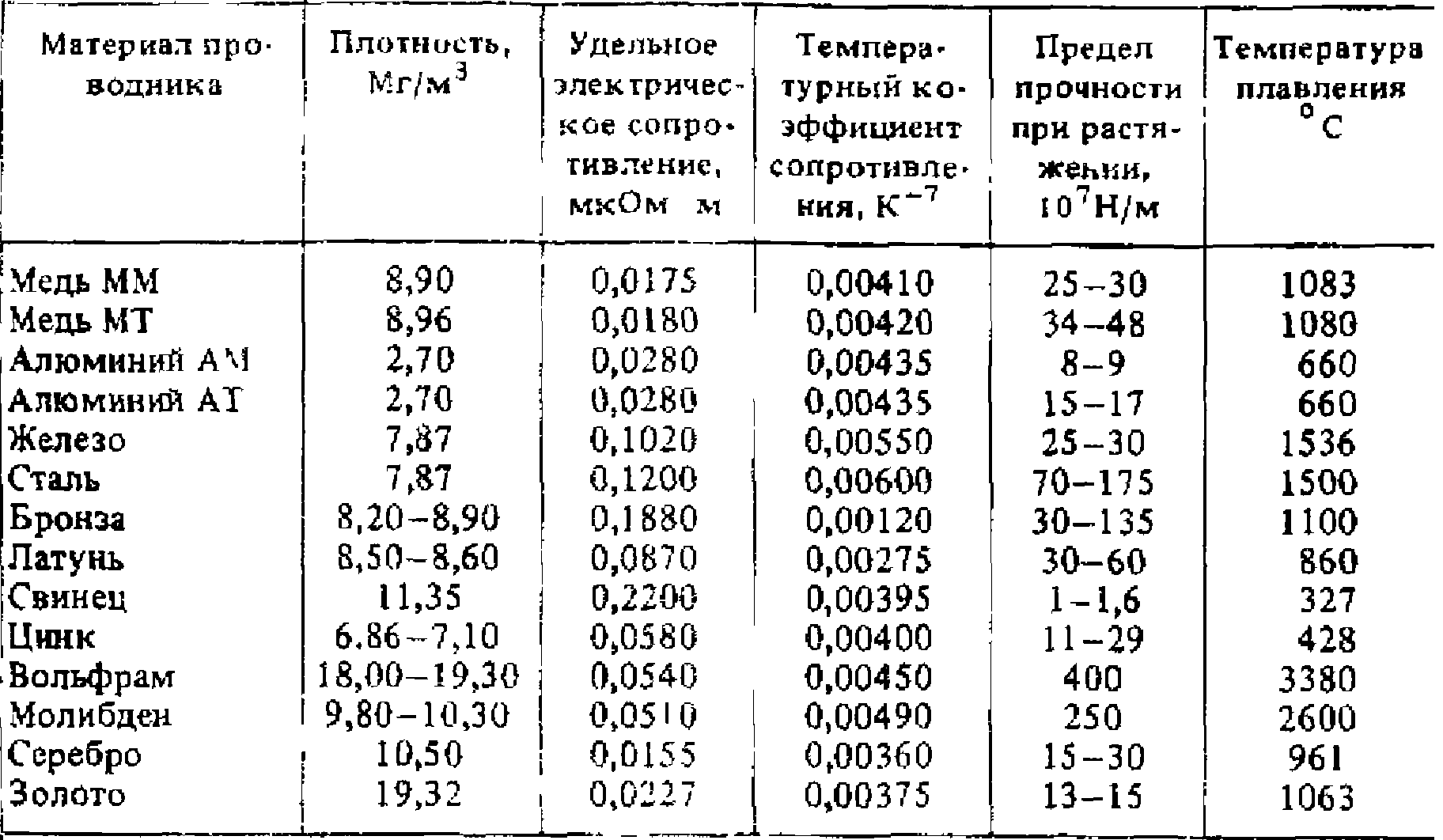
Элементы, принадлежащие к следующим классам, обычно проводят электричество:
- Металлы: Большинство металлов, таких как медь, алюминий, серебро и золото, являются хорошими проводниками электричества.
- Полуметаллы: Некоторые полуметаллы, также известные как металлоиды, такие как кремний и германий, также могут проводить электричество, но не так хорошо, как металлы.
- Электролиты: Некоторые элементы, такие как натрий, калий и кальций, являются электролитами и могут проводить электричество, когда они растворены в воде или других растворителях.
Обычно, когда мы говорим об электропроводности, первыми на ум приходят металлы. Металлы считаются хорошими проводниками электричества из-за наличия в них свободных электронов.
Однако существуют некоторые элементы, кроме металлов, обладающие электропроводностью. Ниже приведены детали элементов, которые могут проводить электричество.
Ниже приведены детали элементов, которые могут проводить электричество.
Читайте также
Как найти электропроводность элементов?
Что такое электрохимия
Какие группы периодической таблицы являются хорошими проводниками электричества ?Элементы, которые обычно являются хорошими проводниками электричества, принадлежат к следующим группам периодической таблицы:
- Группа 1: Щелочные металлы, такие как литий, натрий и калий, обладают высокой электропроводностью.
- Группа 2: Щелочноземельные металлы, такие как бериллий, магний и кальций, также являются хорошими проводниками.
- Группы 3-12: Переходные металлы, к которым относятся такие элементы, как медь, серебро и золото, обычно являются хорошими проводниками электричества.
- Группа 13: Элементы группы 13, включая алюминий, галлий и индий, также являются хорошими проводниками.

- Группа 14: Элементы группы 14, к которым относятся кремний и германий, являются полуметаллами и не такими хорошими проводниками, как металлы, но они все же могут до некоторой степени проводить электричество.
Существует тесная связь между свободными электронами и электропроводностью. Свойство электропроводности в основном связано с наличием относительно большого количества электронов на самой внешней оболочке элементов. Более того, эти электроны должны чувствовать себя легко для движения в своей решетке.
Периодическая таблица тренда электропроводности- Элементы групп I-A и II-A уменьшают свою электропроводность сверху вниз в группе.
- Элементы группы I-B, т. е. Cu, Ag, Au, называются чеканными металлами. Они имеют более высокие значения электропроводности,
- Элементы группы VI-A и VII-A, то есть члены семейства кислорода и галогена, обладают очень низкой электропроводностью.

Элементы ряда переходных металлов демонстрируют резкие изменения электропроводности.
Однако, когда мы идем слева направо в периодической таблице, это указывает на интересную корреляцию. Это находится между электрической проводимостью переходных элементов и способностью валентного электрона образовывать ковалентные связи внутри элементов.
Причины высокой электропроводности групп I-A, II-A и III-AАтомы этих элементов содержат ряд свободных валентных электронов. Следовательно, они обладают способностью перемещаться в кристаллической структуре. Они не могут обеспечить электронную конфигурацию с закрытой оболочкой даже при взаимном совместном использовании. По этой причине они показывают электропроводность.
Причины низкой проводимости элементов группы V-A, VI-A и VII-A В этих элементах движение валентных электронов обычно ограничено, так как они спариваются для достижения близкой конфигурации оболочки. Они образуют ковалентные молекулы. Величина электропроводности этих элементов очень низкая.
Они образуют ковалентные молекулы. Величина электропроводности этих элементов очень низкая.
Элементы группы IV-A, т.е. C, Si, Ge, Sn, Pb, имеют промежуточный характер в отношении электропроводности.
- Углерод в форме алмаза не является проводником, потому что все его валентные электроны связаны тетраэдрически и не могут свободно двигаться.
- Углерод в виде графита проявляет свойство электропроводности. В любом случае он демонстрирует анизотропное поведение. Электрический ток может проходить параллельно листам. На самом деле свободно удерживаемые электроны доступны параллельно листам для электропроводности.
- Низкие элементы группы IV-A, такие как Sn и Pb, также плохо проводят электричество. Их электропроводность очень близка к элементам группы I-A.
Проводящие элементы — это элементы, способные проводить электрический ток. Эти элементы будут передавать электрический заряд из одного места в другое. Итак, это элементы, которые являются проводящими.
Эти элементы будут передавать электрический заряд из одного места в другое. Итак, это элементы, которые являются проводящими.
Электропроводность увеличивается вниз по группе из-за увеличения размера числа электронов атомов. Кроме того, с увеличением размера атома электроны испытывают меньшее ядерное притяжение и имеют тенденцию становиться слабо связанными. Поэтому электрическая проводимость увеличивается вниз по группе.
Почему металлы обладают электропроводностью?Атомы металлов имеют больший атомный размер. Металлы имеют свободно присоединенные электроны на самых внешних оболочках. Следовательно, эти электроны переносят электрический ток и, следовательно, металлы являются проводящими.
Что делает металл проводящим? Металлы являются хорошими проводниками электричества, потому что они имеют высокую концентрацию свободных электронов, которые могут свободно перемещаться через структуру решетки металла.