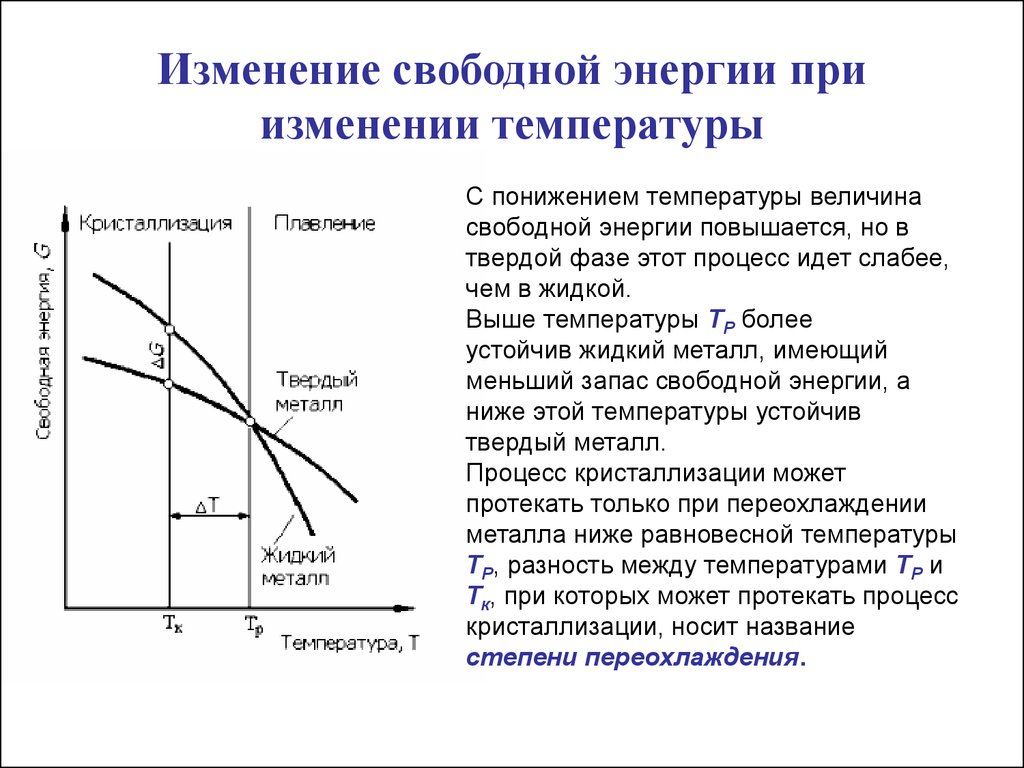
Свободная энергия — Энергетика и промышленность России — № 10 (14) октябрь 2001 года — WWW.EPRUSSIA.RU
Свободная энергия — Энергетика и промышленность России — № 10 (14) октябрь 2001 года — WWW.EPRUSSIA.RU — информационный портал энергетикаhttp://www.eprussia.ru/epr/14/695.htm
Газета «Энергетика и промышленность России» | № 10 (14) октябрь 2001 года
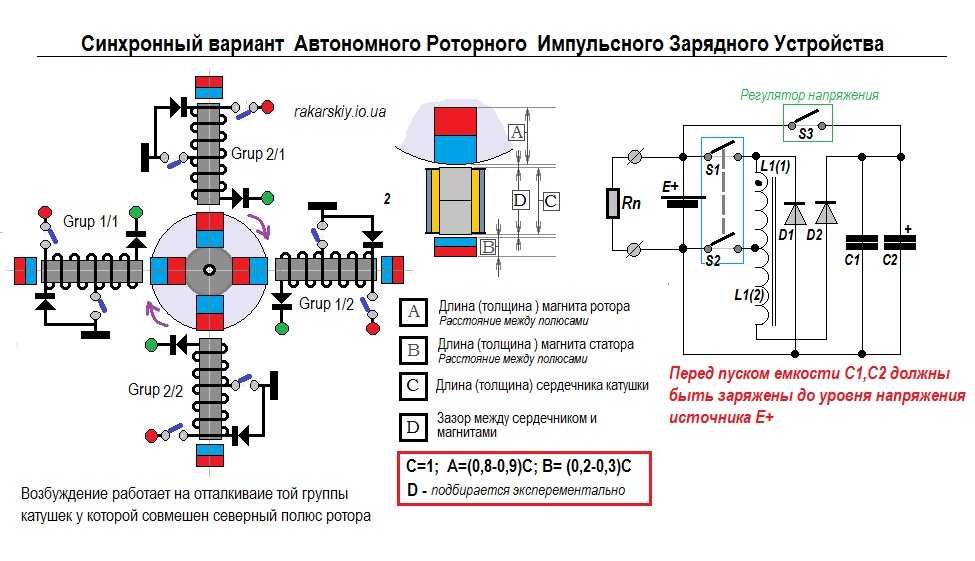
Концепция физического вакуума как источника энергии находит все больше сторонников. Усилиями научных группировок, заинтересованных в сохранении примитивного материализма, великая идея свободного извлечения мощности была искажена до такой степени, что тот, кто начинал говорить о ней, попадал в разряд сумасшедших. Считалось, что мощность (работа в единицу времени ) может быть только результатом преобразования структуры материи, то есть распада, синтеза или изменения энергетического уровня соответствующего количества материи. В любом случае вещество (дрова, нефтепродукты или ядерные материалы) служило топливом, независимо от способа его преобразования. Ряд концепций не рассматривал поля (электромагнитное, гравитационное и другие) как вид материи. Поэтому часто вопрос «вечного двигателя» формулировался, как преобразование энергии поля в мощность и работу. Тем не менее, физический вакуум способен быть источником мощности и при отсутствии в нем каких-либо полей.
Ряд концепций не рассматривал поля (электромагнитное, гравитационное и другие) как вид материи. Поэтому часто вопрос «вечного двигателя» формулировался, как преобразование энергии поля в мощность и работу. Тем не менее, физический вакуум способен быть источником мощности и при отсутствии в нем каких-либо полей.
По понятным соображениям, гипотезы и даже успешные эксперименты, касающиеся преобразования нематериального вида энергии в энергию материального объекта или непосредственно в работу, не принимались к рассмотрению в физике, что вполне оправдано. Физика занимается изучением физического мира, то есть измеримых и осязаемых вещей. Расширение категории «физическое явление» происходит с появлением новых методов измерений. До некоторых пор электрическая энергия не признавалась материальной, но постепенно люди смогли отказаться от труб, по которым к газовой лампе подводился газ — материальный источник мощности, в пользу проводов электрического освещения. В скором времени возможно будет отказаться и от проводов, признав способность самого пространства быть источником энергии при правильно организованном процессе.
Рассмотрим, что сегодня подразумевается под термином «свободная энергия»
Энергия в общем смысле означает «способность системы тел совершать работу». Энергия замкнутой системы постоянна. Конкретное устройство может выглядеть как «вечный двигатель», но не вызывать недоумения, поскольку известен способ «втекания» энергии в систему. Например, солнечная батарея отдает мощность, получаемую от внешнего источника. Ограничив рассмотрение системы чисто геометрически, как в большинстве случаев и понимается «замкнутость», получим систему, в которой мощность только выделяется. Итак, если создан процесс, топология которого выше трех измерений, то приток энергии в систему совершается свободно с точки зрения наблюдателя, без затрат мощности от внешнего материального «генератора». Другими словами, «вечный двигатель» вполне оправдывает свое название, поскольку при его описании требуются понятия «время», «вечность», «причинность» и другие категории, которые более относятся к философии и религии, но не к современной физике.
Идея действительно стоит того, чтобы работать над ее реализацией. Профессор Г. Липсон в книге «Великие эксперименты в физике», изд. «Мир», 1973, пишет: « Джоуль был человеком весьма практического склада ума, и его увлекала идея создать вечный источник энергии».
«Практичность» генераторов свободной энергии очевидна для потребителей, но не для производителей энергии, распределяющих ее централизованно и под контролем. В этом основная причина отсутствия на рынке технологий альтернативных бестопливных энергосистем.
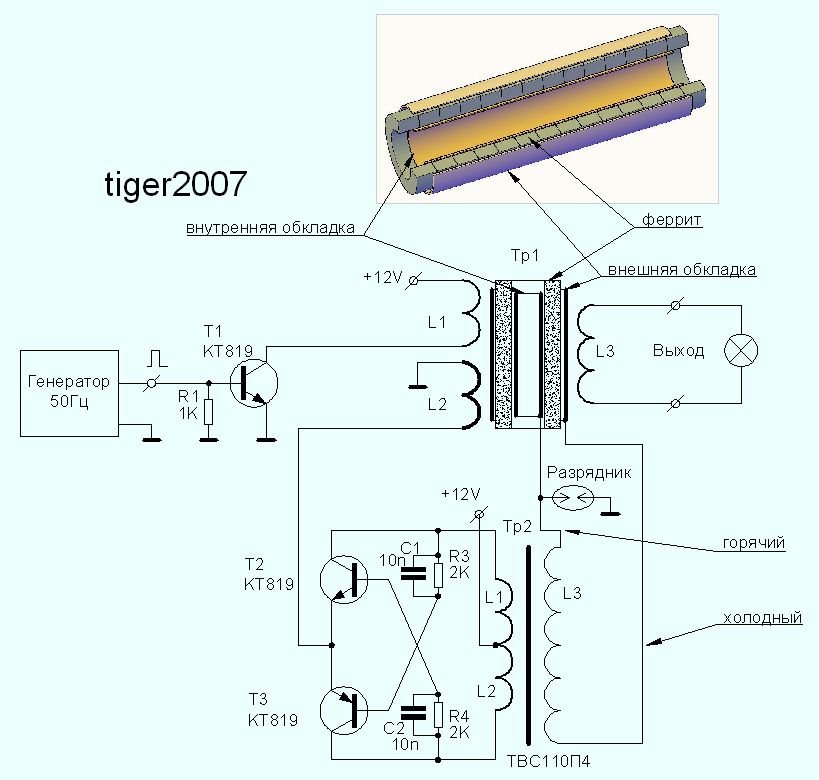
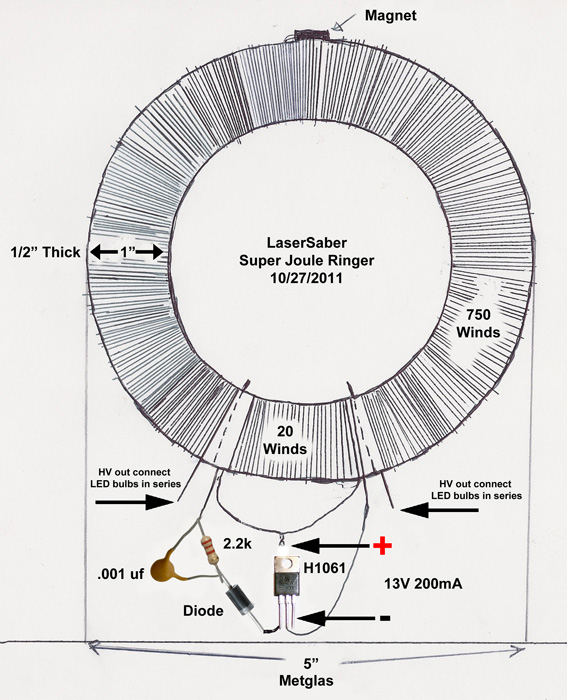
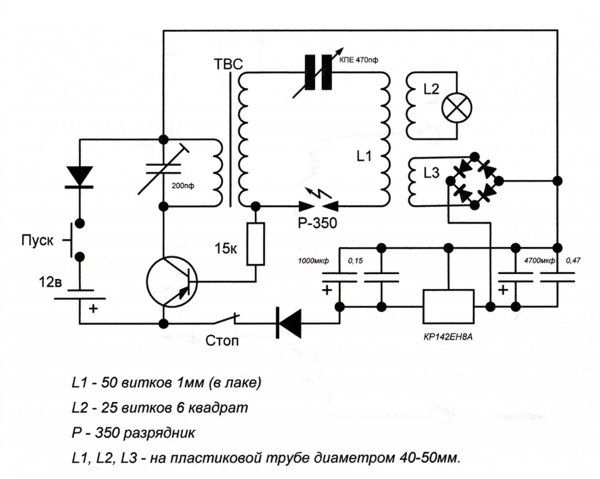
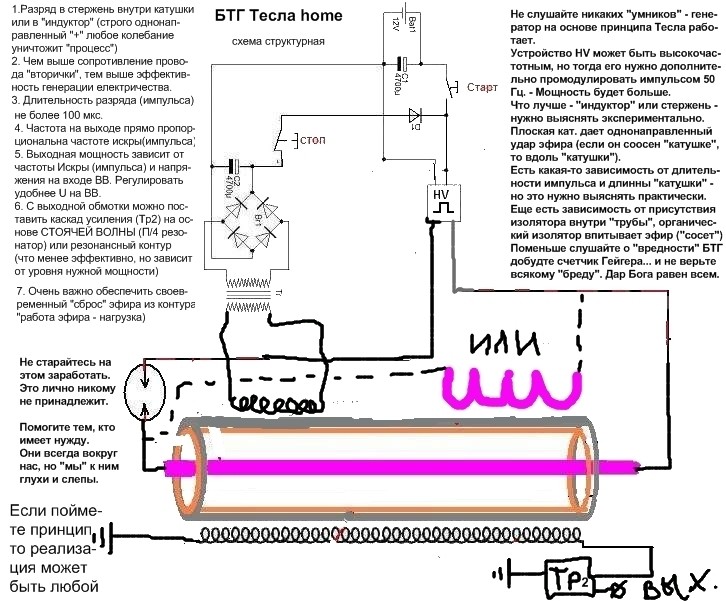
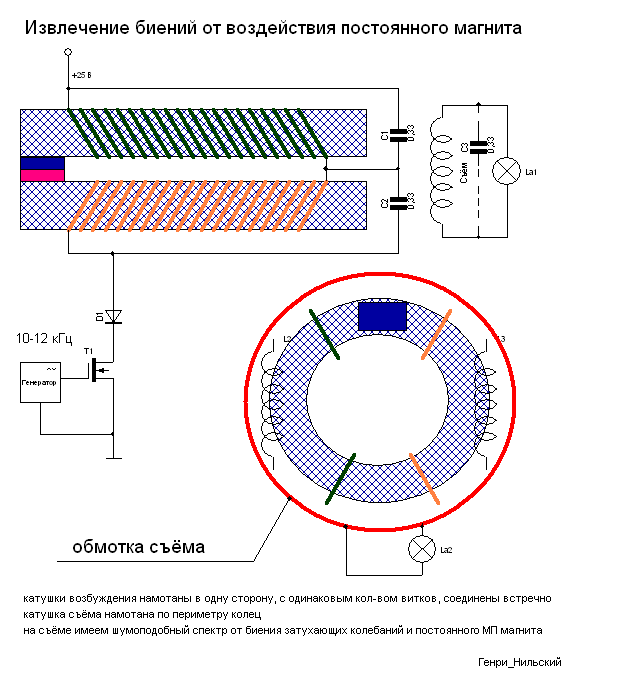
Рассмотрим ряд способов генерации свободной мощности, описания которых встречались в открытой прессе. Исследования Николы Тесла известны большинству современных ученых и инженеров далеко не в полной мере. В работах по развитию беспроводной связи Тесла использовал плоские спиральные катушки в качестве вторичной обмотки трансформатора. Магнитное поле такой катушки является радиальным и лежит в плоскости катушки. Автор данной статьи провел в 1995 году ряд экспериментов с плоскими спиральными катушками.
Другое изобретение Тесла — резонансный трансформатор. Сегодня электротехника описывает работу трансформатора с принудительными колебаниями, а радиотехника рассматривает работу систем в режиме резонанса. Тесла ставил вопрос преобразования мощности в трансформаторе таким образом, что коэффициент полезного действия резонансного трансформатора был более единицы. Работая с токами высокой частоты и высокого напряжения, Тесла использовал в качестве нагрузки однопроводные терминалы, то есть лампы и моторы с одним проводником, подсоединенным к источнику быстропеременного электрического поля. Такой терминал не потребляет мощность из первичного источника, поскольку он использует изменение напряженности поля в точке подключения к проводнику, причем данная точка должна быть одним из максимумов стоячей волны.
В 1934 году в Буффало, США, Тесла демонстрировал автомобиль с электромотором, источником мощности которого был генератор неизвестной конструкции.
Тесла принадлежит термин «свободные вибрации», который описывает синусоидальные колебания в электрической цепи, возбуждаемые коротким несинусоидальным импульсом. При резонансной ситуации, мощность свободных вибраций превышает мощность, затрачиваемую на их возбуждение.
Наблюдаемые во время грозы стоячие волны электрического поля привели Тесла к выводу о возможности создания системы для обеспечения электроэнергией удаленных от генератора потребителей энергии без использования проводов. В большинстве ссылок на Тесла данная идея и его эксперименты в этой области интерпретируют упрощенно, как передачу энергии направленным излучением радиоволн.
Также читайте в номере № 10 (14) октябрь 2001 года:
- Ульяновские лидеры
Ни один регион не был подвергнут такой суровой критике на прошедшем селекторном совещании РАО «ЕЭС России», как Ульяновская область.
 На области висит рекордный долг перед энергетиками.
«Я хочу обратить внимание участников на то, что в Уль…
На области висит рекордный долг перед энергетиками.
«Я хочу обратить внимание участников на то, что в Уль… - Германия: RWE Trading получила генеральную лицензию
16 августа 2001 года компания RWE Trading GmbH стала первой торговой компанией, которой Федеральный банковский наблюдательный орган (Bonn) предоставил, согласно Немецкому банковскому акту, лицензию как учреждению, предоставляющему банковские и финан…
- Про кадры решили всё
Внеочередное собрание акционеров ОАО «Завод «Нижегородский теплоход» приняло решение о досрочном прекращении полномочий генерального директора В. Елисеева в связи с его переходом на другую работу. По словам помощника генерального дирек…
- ЕБРР говорит с губернатором
Делегация экспертов Европейского банка реконструкции и развития во главе с руководителем представительства в Москве Драгицей Пилипович-Чаффи провела в Липецке встречи с губернатором области Олегом Королевым и руководством завода холод.

- Мексика: Платформа Brutus начала добычу
Компания Shell Exploration & Production (SEPCo) объявила о начале добычи нефти и газа от полностью принадлежащей ей платформы на предварительно натянутых опорах (TLP)Brutus, расположенной в Green Canyon блоке 158 в Мексиканском заливе на глубине 2985 футов. Brutus является …
Смотрите и читайте нас в
- — Выберите область поиска —
- — Выберите область поиска —
- Искать в новостях
- Икать в газете
- Искать в каталоге
Что такое свободная энергия и насколько это реально
Свободная энергия — концепция поиска новых источников энергии. В настоящее время идея объединила в том числе фальсификаторов или явно невежественных изобретателей вечных двигателей. Под свободной энергией понимается энергия не требующая последующих затрат на топливо или другие энергоносители. К таким источникам можно отнести ветрогенератор, солнечные батареи, гидроэлектростанции, и т. д.
В настоящее время идея объединила в том числе фальсификаторов или явно невежественных изобретателей вечных двигателей. Под свободной энергией понимается энергия не требующая последующих затрат на топливо или другие энергоносители. К таким источникам можно отнести ветрогенератор, солнечные батареи, гидроэлектростанции, и т. д.
Судя по обилию видеороликов и комментариев к ним на ютубе, тема так называемой «Свободной энергии» многим уже набила оскомину и продолжает будоражить умы. Что совсем неудивительно, ведь стремление к познанию нового является для разумного человека вполне естественным. Однако далеко не каждый человек, увидев впервые что-то необычное и новое, оказывается в состоянии правильно истолковать увиденное. По этой причине многие сразу начинают клеймить изобретателей-новаторов, называя их обманщиками, шарлатанами, мошенниками. Но стоит ли судить так однозначно? Давайте поразмыслим над этим.
Первый закон термодинамики невозможно нарушить
Первый закон термодинамики сообщает нам, что энергия не может быть создана или уничтожена, она может только переходить из одного вида в другой. Это значит, что если устройства «Свободной энергии», в том виде, в каком они представлены на ютубе, реальны, то они попросту преобразуют энергию каких-то необычных внешних источников. На Земле этими источниками могут быть: гравитационное поле Земли, магнитное поле Земли, электрическое поле Земли и заряд молекул воздуха (статическое электричество), сила Архимеда, наконец.
Это значит, что если устройства «Свободной энергии», в том виде, в каком они представлены на ютубе, реальны, то они попросту преобразуют энергию каких-то необычных внешних источников. На Земле этими источниками могут быть: гравитационное поле Земли, магнитное поле Земли, электрическое поле Земли и заряд молекул воздуха (статическое электричество), сила Архимеда, наконец.
Поскольку прямого подключения к окружающей среде проводом, словно к батарейке, осуществить нельзя, то речь может идти об индукции (электростатической, магнитной) или о гравитационном взаимодействии, которые используются в устройствах для передачи энергии к потребителю.
От неустойчивого равновесия — к движению
Если между источником энергии и ее приемником нет разности потенциалов (температурных, гравитационных, электрических или магнитных), то никакого взаимодействия быть в принципе не может, ибо нет причин для взаимодействия когда объекты пребывают в устойчивом равновесии друг с другом.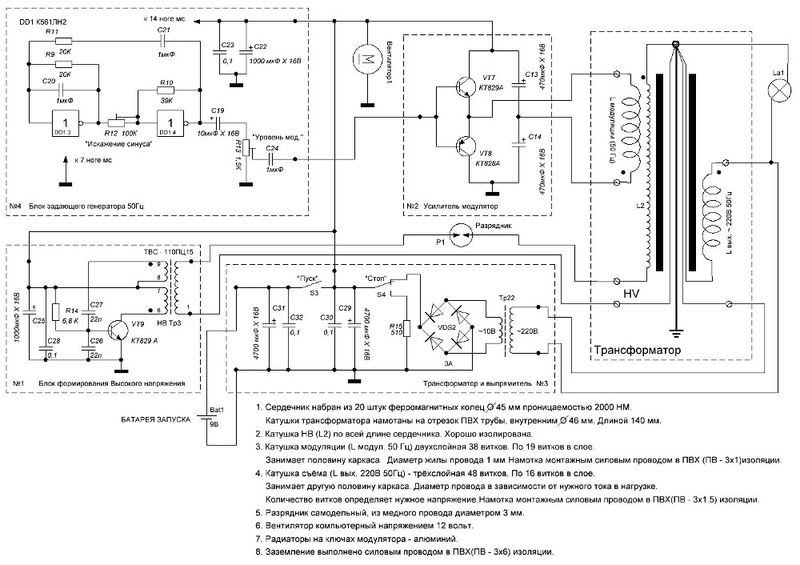 Значит, если взаимодействие все же происходит, то проявление разности потенциалов начинает иметь место, когда устройство «свободной энергии» включено.
Значит, если взаимодействие все же происходит, то проявление разности потенциалов начинает иметь место, когда устройство «свободной энергии» включено.
В таком случае устройству во время своей работы достаточно всего лишь нарушить некий баланс по отношению к объектам вокруг него, и тогда взаимодействие начнется. Можно сказать, что устройство выступает неким своеобразным катализатором, запускающим процесс движения в системе, которая пребывала до этого в неустойчивом равновесии. Стоило чуть-чуть подтолкнуть, и процесс пошел…
Немного усилили напряженность электрического поля в определенной области пространства — и движение ионов в одном из направлений резко стало превалировать. Подтолкнули кирпич, лежащий на краю крыши дома — и он полетел вниз, преобразовывая потенциальную энергию в кинетическую, которая без инициирующего толчка так и осталась бы потенциальной. Усилили напряженность магнитного поля в определенном месте — множество «магнитиков» повернулись куда нужно. И так далее. В этих трех примерах мы можем наблюдать «инициирующее действие» на внешний объект, энергию которого логично называть в контексте данной статьи «Свободной энергией».
В этих трех примерах мы можем наблюдать «инициирующее действие» на внешний объект, энергию которого логично называть в контексте данной статьи «Свободной энергией».
Резонанс, резонанс, резонанс
Получается, что когда речь заходит о явлении резонанса, то резонанс выступает не более чем инструментом, режимом эффективной работы с наименьшим сопротивлением системы. Осциллятор с оптимальной периодичностью выводит носитель «свободной энергии» из равновесия, циклически запуская процессы. Таким образом, в резонансе как таковом, нет ничего волшебного.
Примеры «свободной энергии» в повседневной жизни
Компрессор холодильника не совершает работы по охлаждению продуктов, он только инициирует перенос тепловой энергии от продуктов в камере на заднюю стенку холодильника. Подобным образом работает комнатный кондиционер или тепловой насос.
Бензиновый двигатель внутреннего сгорания не является источником энергии сгорания топлива, он только создает условия, чтобы это сгорание произошло, а энергия добывается из химической реакции, которая инициируется системой зажигания.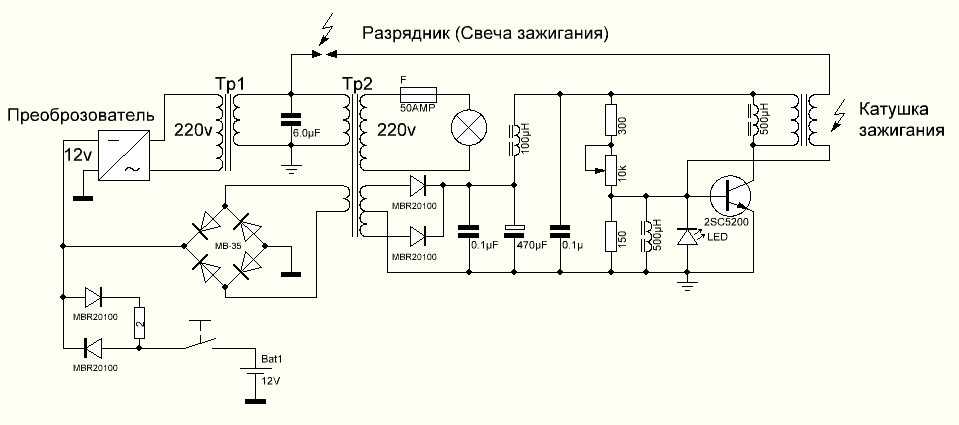 И хотя сначала двигатель запускается электрическим стартером, мы никогда не скажем, что стартер приводит автомобиль в движение.
И хотя сначала двигатель запускается электрическим стартером, мы никогда не скажем, что стартер приводит автомобиль в движение.
Солнечная батарея не вырабатывает энергию, она преобразует энергию фотонов солнечного излучения, которое попадает на фотоэлементы, если батарею правильно сориентировать. Инициатором можно считать трекер — электромеханическое устройство, поворачивающее солнечную батарею вслед за движением Солнца. Мы никогда не скажем, что трекер является источником энергии солнечной панели.
В комментариях Вы можете привести и свои примеры, где еще энергия источника служит для запуска более мощного процесса извлечения или переноса энергии.
Ранее ЭлектроВести писали,что арендная схема обогащает вовсе не покупателей солнечных панелей, выяснила журналистка Booomberg. А нашумевший закон об обязательном наличии панелей на новых домах в Калифорнии привел к росту акций именно такой хитрой компании — Sunrun.
По материалам: electrik.info.
Gibbs (бесплатно) Энергия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1951
Цели обучения
- Получить общее представление об энергии Гиббса и ее общем использовании в химии.

- Понять, как энергия Гиббса относится к свойствам реакций
- Понять, как энергия Гиббса относится к свойствам равновесия
- Понять, как энергия Гиббса относится к электрохимическим свойствам
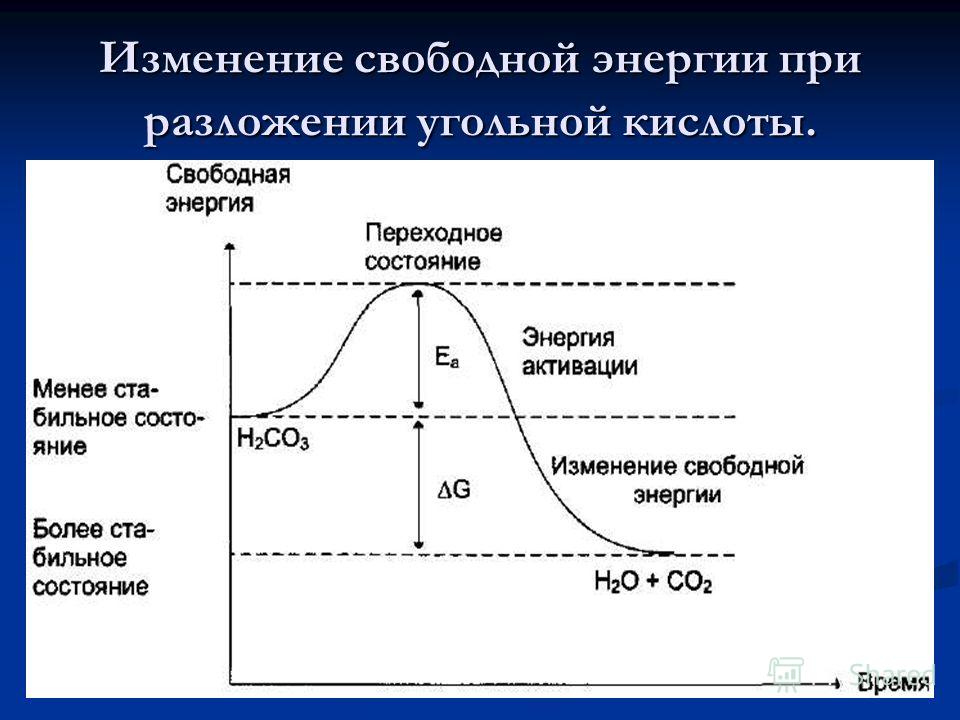
Свободная энергия Гиббса, обозначаемая \(G\), объединяет энтальпию и энтропию в одно значение. Изменение свободной энергии \(\Delta G\) равно сумме энтальпии плюс произведение температуры и энтропии системы. \( \Delta G\) может предсказать направление химической реакции при двух условиях:
- постоянная температура и
- постоянное давление.
Если \(ΔG\) положительное, то реакция несамопроизвольная (т.е. для протекания реакции необходим подвод внешней энергии), а если отрицательное, то самопроизвольная (происходит без подвода внешней энергии) .
Введение
Энергия Гиббса была разработана в 1870-х годах Джозией Уиллардом Гиббсом. Первоначально он назвал эту энергию «доступной энергией» в системе. В опубликованной в 1873 году статье «Графические методы в термодинамике жидкостей» изложено, как его уравнение может предсказывать поведение систем при их объединении. Эта величина представляет собой энергию, связанную с химической реакцией, которая может быть использована для совершения работы, и представляет собой сумму ее энтальпии (H) и произведения температуры и энтропии (S) системы. Это количество определяется следующим образом: 93\))
В опубликованной в 1873 году статье «Графические методы в термодинамике жидкостей» изложено, как его уравнение может предсказывать поведение систем при их объединении. Эта величина представляет собой энергию, связанную с химической реакцией, которая может быть использована для совершения работы, и представляет собой сумму ее энтальпии (H) и произведения температуры и энтропии (S) системы. Это количество определяется следующим образом: 93\))
Энергия Гиббса в реакциях
Спонтанная — это реакция, которая считается естественной, потому что это реакция, которая происходит сама по себе без какого-либо внешнего воздействия на нее. Несамопроизвольный — требует постоянной внешней энергии, чтобы процесс продолжался, и как только вы остановите внешнее действие, процесс прекратится. При решении уравнения, если изменение G отрицательно, то оно спонтанное. Если изменение G положительное, то оно несамопроизвольное. Символ, который обычно используется для обозначения СВОБОДНОЙ ЭНЕРГИИ, — это G. Его можно более правильно рассматривать как «стандартное изменение свободной энергии» 9.0038
Если изменение G положительное, то оно несамопроизвольное. Символ, который обычно используется для обозначения СВОБОДНОЙ ЭНЕРГИИ, — это G. Его можно более правильно рассматривать как «стандартное изменение свободной энергии» 9.0038
В химических реакциях, связанных с изменением термодинамических величин, часто встречается вариант этого уравнения:
\[ \underset{\text {изменение свободной энергии} }{\Delta G } = \underset{ \text {change в энтальпии}}{ \Delta H } — \underset{\text {(температура) изменение энтропии}}{T \Delta S} \label{1.3} \]
Пример 1.1
Рассчитайте ∆G при 290 K для следующая реакция:
\[\ce{2NO(г) + O2(г) \rightarrow 2NO2(г)} \nonumber \]
Дано
- ∆H = -120 кДж
- ∆S = -150 ДжК -1
Решение
Теперь все, что вам нужно сделать, это подставить все указанные числа в уравнение 3 выше. Не забудьте разделить \(\Дельта S\) на 1000 \(Дж/кДж\), так что после умножения на температуру \(Т\) она будет иметь те же единицы \(кДж\), что и \(\ Дельта Н\).
\[\Delta S = -150 \cancel{J}/K \left( \dfrac{1\; kJ}{1000\;\cancel{J}} \right) = -0,15\; кДж/К \номер\]
и подставляя в уравнение 3:
\[\begin{align*} ∆G &= -120\; кДж — (290 \;\cancel{K})(-0,150\; кДж/\cancel{K}) \\[4pt] &= -120 \;kJ + 43 \;kJ \\[4pt] &= — 77\; kJ \end{align*} \]
Упражнение 1.1: Процесс Габера
Какова \(\Delta G\) образование аммиака из газообразного азота и водорода.
\[\ce{N_2 + 3H_2 \rightleftharpoons 2NH_3} \nonumber \]
Стандартные образования свободной энергии: NH 3 =-16,45 H 2 =0 N 2 =0
9{-1} \номер \]Поскольку изменение энтропии химической реакции не поддается прямому измерению, энтропия обычно не используется в качестве критерия. Чтобы обойти эту трудность, мы можем использовать \(G\). Знак ΔG указывает направление химической реакции и определяет, является ли реакция самопроизвольной или нет.
- \( \Delta G < 0 \): реакция идет самопроизвольно в указанном направлении (т.
 е. реакция экзэргоническая )
е. реакция экзэргоническая ) - \( \Delta G =0 \): система находится в равновесии и нет чистых изменений ни в прямом, ни в обратном направлении.
- \( \Delta G > 0 \): реакция не самопроизвольная и процесс протекает самопроизвольно в резервном направлении. Чтобы запустить такую реакцию, нам нужно иметь свободную энергию (т.е. реакция эндергоническая )
Факторы, влияющие на \( \Delta G \) реакции (предположим, что \( \Delta H \) и \( \Delta S \) не зависят от температуры):
| \(\Delta H\) | \(\Дельта S\) | \(\Дельта G\) | Пример |
|---|---|---|---|
| + | + | при низкой температуре: + , при высокой температуре: — | 2HgO(тв) -> 2Hg (ж) + O 2 (г) |
| + | — | при всех температурах: + | 3O 2 (г) -> 2O 3 (г) |
| — | + | при всех температурах: — | 2H 2 O 2 (л) -> 2H 2 O (л) + O 2 (г) |
| — | — | при низкой температуре: — , при высокой температуре: + | NH 3 (г) + HCl (г) -> NH 4 Cl (т) |
Примечание:
- \( \Delta G \) зависит только от разности свободных энергий продуктов и реагентов (или конечного состояния и начального состояния).
 \( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]
\( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]Примечание
- Если \( \left | \Delta H \right | >> \left | T\Delta S \right |\): реакция энтальпийная
- Если \( \Delta H \) << \( T\Delta S \): реакция управляется энтропией
Свободная энергия образования при стандартном состоянии
- Парциальное давление любого газа, участвующего в реакции, составляет 0,1 МПа.
- Концентрация всех водных растворов составляет 1 М. 9оС\). Будет ли реакция происходить самопроизвольно?
\[NH_{3(g)} + HCl_{(g)} \rightarrow NH_4Cl_{(s)} \nonumber \]
дано для реакции
- \(\Delta{H} = -176.0 \ ;кДж\)
- \(\Дельта{S} = -284,8\;Дж/К\)
Решение
вычислить \(\Delta{G}\) по формуле
\[\Delta{G} = \Delta{H} — T\Delta{S} \nonumber \]
но сначала нам нужно для преобразования единиц измерения \(\Delta{S}\) в кДж/К (или преобразования \(\Delta{H}\) в Дж) и температуры в Кельвин 9оС = 298\;К\)
Определение энергии Гиббса может быть использовано напрямую \;kJ — (298 \cancel{K}) (-0,284,8\; kJ/\cancel{K}) \nonumber \]
\[\Delta{G} = -176,0 \;kJ — (-84,9 \; кДж) \номер \]
\[\Delta{G} = -91,1 \;кДж \номер \]
Да, эта реакция протекает самопроизвольно при комнатной температуре, так как \(\Delta{G}\) отрицательна .

Энергия Гиббса в равновесии 9o \label{1.25} \]
Несколько замечаний о «свободной» энергии Гиббса
- Свободная энергия не обязательно является «свободной» : Название «свободная энергия» для G привело к такой путанице, что многие ученые теперь будем называть ее просто энергией Гиббса. «Свободная» часть старого названия отражает происхождение термодинамики от паровой машины с ее интересом к преобразованию тепла в работу: ΔG — это максимальное количество энергии, которое может быть «высвобождено» из системы для выполнения полезной работы. Под «полезной» мы подразумеваем работу, отличную от той, которая связана с расширением системы. Чаще всего это электрическая работа (перемещение электрического заряда через разность потенциалов), но возможны и другие формы работы (осмотическая работа, увеличение площади поверхности).
- Свободная энергия не является энергией : Гораздо более серьезная трудность с функцией Гиббса, особенно в контексте химии, заключается в том, что, хотя G имеет единицы измерения энергии (джоули, или в его интенсивной форме, Дж моль –1 ), ему не хватает одного из самых важных атрибутов энергии, заключающегося в том, что он не сохраняется.
 Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения.
Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения. - Свободная энергия даже не «реальна» : G отличается от термодинамических величин H и S еще одним существенным образом: она не имеет физической реальности как свойство материи, тогда как H и S могут быть связаны с количеством и распределением энергии в совокупности молекул (например, третий закон термодинамики).
 Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
Ссылки
- Чанг, Рэймонд. Физическая химия для биологических наук . Сансалито, Калифорния: Университетские науки, 2005. .
- Аткинс, Питер и де Паула, Хулио. Физическая химия для наук о жизни . Нью-Йорк, штат Нью-Йорк: WH Freeman and Company, 2006. Стр. 153–163, 286. .
- Страйер, Люберт. Биохимия (третье издание) . Нью-Йорк, штат Нью-Йорк: WH Фриман и компания, 1988. стр. 181-184.
Gibbs (Free) Energy распространяется в соответствии с лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Стивен Лоуэр, Кэти Доан, Хан Ле и Хан Ле.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- автор @ Кэти Доан
- автор @ Хан Ле
- автор @ Стивен Лоуэр
- Энергия Гиббса
- Свободная энергия Гиббса
Свободная энергия Гиббса
Свободная энергия Гиббса
Движущие силы и свободная энергия Гиббса Влияние температуры на свободную энергию Реакция Свободные энергии реакции в стандартном состоянии Интерпретация свободной энергии реакции в стандартном состоянии Данные Связь между свободной энергией и константы равновесия Температурная зависимость констант равновесия Связь между свободной энергией и клеткой Потенциалы Движущие силы и свободная энергия Гиббса
Некоторые реакции являются спонтанными, потому что они испускают энергия в виде тепла ( H < 0).
 Другие носят спонтанный характер, поскольку приводят к увеличению
беспорядок системы ( S > 0). Расчеты H и S можно использовать для исследования движущей силы конкретной реакции.
Другие носят спонтанный характер, поскольку приводят к увеличению
беспорядок системы ( S > 0). Расчеты H и S можно использовать для исследования движущей силы конкретной реакции.Практическая задача 5: Вычислите H и S для после реакции и решить, в каком направлении каждый из этих факторов будет управлять реакция.
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Нажмите здесь, чтобы проверить ответ на практическое задание 5.
Нажмите здесь, чтобы увидеть решение для выполнения задачи 5.
Что происходит, когда одна из потенциальных движущих сил химического реакция благоприятна, а другая нет? Мы можем ответить на этот вопрос, определив новый величина, известная как свободной энергии Гиббса ( G ) системы, которая отражает равновесие между этими силами.

Свободная энергия Гиббса системы в любой момент времени определяется как энтальпия системы минус произведение температуры на энтропию система.
G = H — TS
Свободная энергия Гиббса системы является функцией состояния, поскольку она определяется в терминах термодинамических свойств, которые являются функциями состояния. Изменение в Следовательно, свободная энергия Гиббса системы, возникающая при реакции, равна изменение энтальпии системы минус изменение произведения температуры раз больше энтропии системы.
Г = H — ( TS )
Если реакция протекает при постоянной температуре, это уравнение может быть написано следующим образом.
Г = H — TS
Изменение свободной энергии системы, происходящее при реакции можно измерить при любом наборе условий.
 Если данные собираются в рамках
в стандартных условиях результатом является свободная энергия реакции в стандартном состоянии ( G или ).
Если данные собираются в рамках
в стандартных условиях результатом является свободная энергия реакции в стандартном состоянии ( G или ).Г или = H o — TS o
Красота уравнения, определяющего свободную энергию системы, заключается в его способность определять относительную важность энтальпийных и энтропийных составляющих как движущих сил сил, стоящих за конкретной реакцией. Изменение свободной энергии системы, происходит во время реакции, измеряет баланс между двумя движущими силами, которые определить, является ли реакция самопроизвольной. Как мы видели, энтальпия и энтропия термины имеют разные соглашения о знаках.
Благоприятный Неблагоприятный H или < 0 H или > 0 С или > 0 С или < 0 Следовательно, член энтропии вычитается из члена энтальпии, когда расчет G o для реакции.

Из-за способа определения свободной энергии системы G o отрицательно для любой реакции, для которой H o является отрицательной, а S o положительной. G o поэтому отрицательно для любого реакция, которой благоприятствуют как энтальпийные, так и энтропийные условия. Таким образом, мы можем заключить что любая реакция, для которой G o отрицательный, должен быть благоприятным или спонтанным.
Благоприятные или спонтанные реакции : Г или < 0 И наоборот, G o является положительным для любой реакции, для которой H o является положительным и S или отрицательно. Любая реакция, для которой G o положительный, поэтому неблагоприятный.

Неблагоприятные или неспонтанные реакции : Г или > 0 Реакции классифицируются как экзотермические ( H < 0) или эндотермические ( H > 0) на зависимости от того, выделяют они или поглощают тепло. Реакции также можно классифицировать как экзэргонический ( G < 0) или эндергонический ( G > 0) на зависит от того, уменьшается или увеличивается свободная энергия системы в ходе реакции.
Когда реакции благоприятствуют как энтальпия ( H o < 0), так и энтропия ( S o > 0), нет необходимости вычислять значение G o , чтобы решить, должна ли реакция продолжить. То же самое можно сказать и о реакциях, не одобренных ни тем, ни другим. энтальпия ( Н или > 0) ни энтропия ( S o < 0).
 Расчеты свободной энергии становятся важными для реакций, протекающих только в одной из
эти факторы.
Расчеты свободной энергии становятся важными для реакций, протекающих только в одной из
эти факторы.Практическая задача 6: Вычислите H и S для следующая реакция:
NH 4 NO 3 ( s ) + H 2 O( l ) НХ 4 + ( aq ) + NO 3 — ( aq )
Используйте результаты этого расчета, чтобы определить значение G o для этого реакция при 25 o С, и объясните, почему NH 4 NO 3 самопроизвольно растворяется в воде при комнатной температуре.
Нажмите здесь, чтобы проверить ответ на практическое задание 6.
Нажмите здесь, чтобы увидеть решение к задаче 6.

Влияние температуры на свободную энергию Реакция
Баланс между вкладами энтальпийные и энтропийные члены к свободной энергии реакции зависят от температуры при которой протекает реакция.
Практическая задача 7: Используйте значения H и S , рассчитанные на практике Задача 5, чтобы предсказать, будет ли следующая реакция самопроизвольной при 25°C:
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Нажмите здесь, чтобы проверить ответ на практическое задание 7.
Нажмите здесь, чтобы увидеть решение практиковать задачу 7.

Уравнение, используемое для определения свободной энергии, предполагает, что член энтропии станет более важным по мере повышения температуры.
Г или = Н o — ТС o
Поскольку энтропийный член неблагоприятен, реакция должны стать менее благоприятными по мере повышения температуры.
Практическая задача 8: Предскажите, будет ли следующая реакция все еще идет самопроизвольно при 500°С:
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Предположим, что значения H o и S , используемые в практической задаче 7, все еще действительны при эта температура.

Нажмите здесь, чтобы проверить ответ на практическое задание 8.
Нажмите здесь, чтобы увидеть решение для выполнения задачи 8.
Свободные энергии реакции в стандартном состоянии
G o для реакции можно рассчитать из табличных данных о свободной энергии в стандартном состоянии. С на шкале свободной энергии нет абсолютного нуля, проще всего свести такие данные в таблицы в плане свободные энергии образования в стандартном состоянии , G f o . Как и следовало ожидать, свободная энергия образования вещества в стандартном состоянии равна разница между свободной энергией вещества и свободными энергиями его элементов в их термодинамически наиболее стабильных состояниях при 1 атм, все измерения проводились при стандартные условия.

Интерпретация свободной энергии стандартного состояния Данные реакции
Теперь мы готовы задать очевидный вопрос: что говорит нам значение G o о следующей реакции?
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г 3) Г или = -32,96 кДж По определению, значение G o для реакции измеряет разницу между свободные энергии реагентов и продуктов , когда все компоненты реакции присутствует в стандартных условиях .
Г или поэтому описывает эту реакцию только тогда, когда все три компонента присутствуют при 1 атм.
 давление.
давление.Знак из G o указывает нам направление, в котором реакция должна сместиться к прийти к равновесию. Тот факт, что G o дает отрицательный результат на эту реакцию при 25 o C, означает, что система в стандартных условиях при этой температуре должна была бы перейти в правильно, превращая некоторые реагенты в продукты, прежде чем он сможет достичь равновесия. Величина из G или для реакции говорит нам, насколько далеко стандартное состояние от равновесие. Чем больше значение G o , тем дальше должна пройти реакция, чтобы добраться до от стандартных условий к равновесию.
Предположим, например, что мы начинаем со следующей реакции при стандартные условия, как показано на рисунке ниже.
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Значение G в этот момент времени будет равно свободной энергии стандартного состояния для этой реакции G o .

Когда Q р = 1: Г = Г или По мере того, как реакция постепенно сдвигается вправо, превращая N 2 и H 2 в NH 3 значение Гс для реакции уменьшится. Если бы мы могли найти каким-то образом обуздать стремление этой реакции прийти к равновесию, мы могли бы получить реакция на работу. Поэтому говорят, что свободная энергия реакции в любой момент времени быть мерой энергии, доступной для выполнения работы.
Связь между свободной энергией и Константы равновесия
Когда реакция выходит из стандартного состояния из-за изменения соотношения концентраций продуктов к реагентам, мы должны описать систему в с точки зрения нестандартных свободных энергий реакции.
 Разница между G o и G для реакции составляет
важный. Есть только одно значение G o для реакции при данной температуре, но есть
бесконечное число возможных значений G .
Разница между G o и G для реакции составляет
важный. Есть только одно значение G o для реакции при данной температуре, но есть
бесконечное число возможных значений G .На рисунке ниже показано соотношение между G для следующих реакции и логарифм по основанию e отношения реакции для реакция между N 2 и H 2 с образованием NH 3 .
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Данные в левой части рисунка соответствуют относительно небольшим значениям Q p . Поэтому они описывают системы, в которых гораздо больше реагент, чем продукт. Знак G для этих систем отрицательный, а величина G большая. Система следовательно, относительно далеко от равновесия, и реакция должна сместиться вправо достичь равновесия.

Данные в крайней правой части рисунка описывают системы, в которых больше продукт, чем реагент. Знак G теперь положительный, а звездная величина G умеренно велика. знак G говорит нам что реакция должна сместиться влево, чтобы достичь равновесия. Величина G говорит нам, что мы не так же далеко, чтобы достичь равновесия.
Точки, в которых прямая на рисунке выше пересекает горизонтальная и обратная оси этой диаграммы особенно важны. Прямая линия пересекает вертикальную ось, когда коэффициент реакции системы равен 1. Это Таким образом, точка описывает условия стандартного состояния, и значение G в этот момент равно к свободной энергии реакции в стандартном состоянии, G o .
Когда Q р = 1 : Г = Г или Точка, в которой прямая линия пересекает горизонтальную ось, описывает система, для которой G равен нулю.
 Поскольку за реакцией нет движущей силы, система должна
находиться в равновесии.
Поскольку за реакцией нет движущей силы, система должна
находиться в равновесии.Когда Q p = K p : Г = 0 Зависимость свободной энергии реакции в любой момент времени ( G ) и Свободная энергия реакции в стандартном состоянии ( G o ) описывается следующим уравнением.
Г = Г o + РТ ln Q
В этом уравнении R – постоянная идеального газа в единицах Дж/моль-K, Т это температура в кельвинах, ln представляет собой логарифм по основанию e , а Q — коэффициент реакции в этот момент времени.

Как мы видели, движущая сила химической реакции равна нулю ( G = 0), когда реакция находится в равновесии ( Q = K ).
0 = Г или + RT ln K
Таким образом, мы можем решить это уравнение для связи между G или и K .
Г или = — RT ln K
Это уравнение позволяет вычислить константу равновесия для любого реакции из свободной энергии реакции в стандартном состоянии или наоборот.
Ключ к пониманию связи между G o и K признает, что величина G o говорит нам, насколько далеко стандартное состояние от равновесие. Чем меньше значение G o , тем ближе стандартное состояние к равновесию. Чем больше значение G o , тем дальше должна пройти реакция, чтобы достичь равновесия.
 Соотношение между G o и константой равновесия химической реакции выглядит следующим образом:
иллюстрируется данными в таблице ниже.
Соотношение между G o и константой равновесия химической реакции выглядит следующим образом:
иллюстрируется данными в таблице ниже.Значения G o и K для общих реакций при 25 o C
Реакция G или (кДж) К 2 SO 3 ( г ) 2 SO 2 ( г ) + O 2 ( г ) 141,7 1,4 x 10 -25 Н 2 О( л ) H + ( водный раствор ) + OH — ( водный раствор ) 79,9 1,0 x 10 -14 AgCl( s ) + H 2 O Ag + ( водный раствор ) + Cl — ( водный раствор ) 55,6 1,8 x 10 -10 HOAc( водн.  ) + H 2 O
) + H 2 OH + ( водный раствор ) + OAc — ( водный раствор ) 27,1 1,8 x 10 -5 Н 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г ) -32,9 5,8 x 10 5 HCl( водный ) + H 2 О H + ( водный раствор ) + Cl — ( водный раствор ) -34,2 1 x 10 6 Cu 2+ ( водный раствор ) + 4 NH 3 ( водный раствор ) Cu(NH 3 ) 4 2+ ( водный ) -76,0 2,1 x 10 13 Zn( с ) + Cu 2+ ( водный раствор ) Zn 2+ ( водн.  ) + Cu( с )
) + Cu( с )-211,8 1,4 х 10 37 Практическая задача 9: Используйте значение G o , полученное в Выполните задачу 7, чтобы вычислить константу равновесия для следующей реакции при 25С:
N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г )
Нажмите здесь, чтобы проверить ответ на практическое задание 9.
Нажмите здесь, чтобы увидеть решение к задаче 9.
Константу равновесия реакции можно выразить двумя способами: K c и К р .
 Мы можем записать константы равновесия в терминах
парциальные давления реагентов и продуктов, либо по их концентрациям в
единицы моль на литр.
Мы можем записать константы равновесия в терминах
парциальные давления реагентов и продуктов, либо по их концентрациям в
единицы моль на литр.Для газофазных реакций константа равновесия получено из G или основан на парциальных давлениях газов ( K p ). Для реакций в растворе, константа равновесия, полученная в результате расчета, основана на концентрации ( К c ).
Практическая задача 10: Используйте следующее данные о свободной энергии пласта в стандартном состоянии для расчета диссоциации кислоты константа равновесия ( K a ) для муравьиной кислоты:
Соединение G f o (кДж/моль)
HCO 2 ( водный ) -372,3
Х + ( водный ) 0,00
HCO 2 — ( aq ) -351,0
Нажмите здесь, чтобы проверить ответ на практическое задание 10.

Нажмите здесь, чтобы увидеть решение для выполнения задачи 10.
Температурная зависимость равновесия Константы
Константы равновесия не являются строго постоянными, поскольку они изменяются с температура. Теперь мы готовы понять, почему.
Свободная энергия реакции в стандартном состоянии является мерой того, насколько далеко стандартное состояние из равновесия.
Г или = — RT ln K
Но величина G o зависит от температуры реакции.
Г или = H o — TS o
В результате константа равновесия должна зависеть от температуры Реакция.
Хорошим примером этого явления является реакция, в которой NO 2 димеризуется с образованием N 2 O 4 .

2 NO 2 ( г ) N 2 O 4 ( г )
Энтальпии этой реакции способствует образование новой связи, которая делает систему более стабильной. Реакция не благоприятствует энтропии, потому что она приводит к уменьшение беспорядка в системе.
NO 2 – коричневый газ и N 2 O 4 бесцветный. Таким образом, мы можем отслеживать степень димеризации NO 2 с образованием N 2 O 4 . исследуя интенсивность коричневого цвета в запаянной трубке с этим газом. Что должно происходят в равновесии между NO 2 и N 2 O 4 как температура снижена?
В качестве аргумента предположим, что существенного изменения нет в любой H или или S или так как система охлаждается. Вклад в свободную энергию реакции от энтальпийный член поэтому постоянен, но вклад энтропийного члена становится меньше при понижении температуры.

Г или = H o — TS o
чистый эффект — сдвиг равновесия вправо. На рисунке ниже показано, что происходит с интенсивностью коричневого цвета, когда запаянная пробирка, содержащая NO 2 газ погружают в жидкий азот. Резко уменьшилось количество NO 2 в трубке при охлаждении до -196 o C.
Практическая задача 11: Использование значения H o и S или для следующую реакцию при 25°C, чтобы оценить константу равновесия для этой реакции при температура кипящей воды (100°С), льда (0°С), бани с сухим льдом и ацетоном (-78°С) и жидкий азот (-196С):
2 NO 2 ( г ) N 2 O 4 ( г )
Нажмите здесь, чтобы проверить ответ на практическое задание 11.

Нажмите здесь, чтобы увидеть решение для выполнения задачи 11.
Связь между свободной энергией и клеткой Возможности
Значение G для реакции в любой момент времени говорит нам о двух вещах. Знак G говорит нам, в чем направление, в котором реакция должна сместиться, чтобы достичь равновесия. Величина G говорит нам, как далеко реакция находится в состоянии равновесия в этот момент.
Потенциал гальванического элемента является мерой того, насколько далеко окислительно-восстановительная реакция идет из равновесия. Уравнение Нернста описывает связь между потенциалом клетки в любой момент времени и стандартным состоянием клетки потенциал.
Преобразуем это уравнение следующим образом.



 На области висит рекордный долг перед энергетиками.
«Я хочу обратить внимание участников на то, что в Уль…
На области висит рекордный долг перед энергетиками.
«Я хочу обратить внимание участников на то, что в Уль…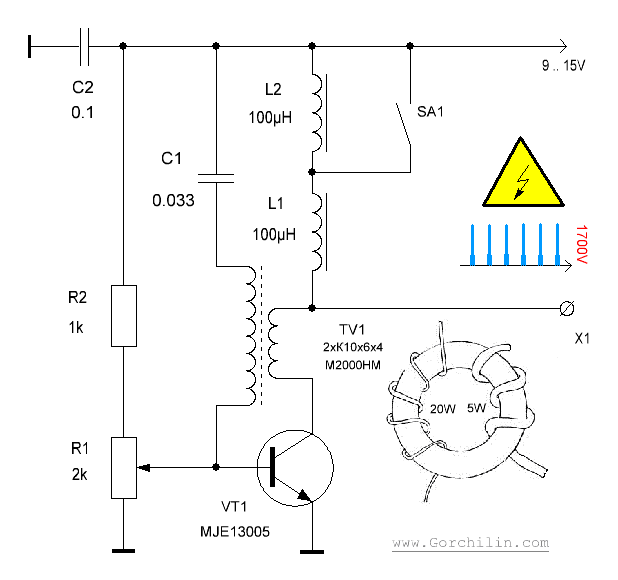
 е. реакция экзэргоническая )
е. реакция экзэргоническая ) \( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]
\( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]
 Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения.
Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения. Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
 Другие носят спонтанный характер, поскольку приводят к увеличению
беспорядок системы ( S > 0). Расчеты H и S можно использовать для исследования движущей силы конкретной реакции.
Другие носят спонтанный характер, поскольку приводят к увеличению
беспорядок системы ( S > 0). Расчеты H и S можно использовать для исследования движущей силы конкретной реакции.
 Если данные собираются в рамках
в стандартных условиях результатом является свободная энергия реакции в стандартном состоянии ( G или ).
Если данные собираются в рамках
в стандартных условиях результатом является свободная энергия реакции в стандартном состоянии ( G или ).

 Расчеты свободной энергии становятся важными для реакций, протекающих только в одной из
эти факторы.
Расчеты свободной энергии становятся важными для реакций, протекающих только в одной из
эти факторы.

 давление.
давление.
 Разница между G o и G для реакции составляет
важный. Есть только одно значение G o для реакции при данной температуре, но есть
бесконечное число возможных значений G .
Разница между G o и G для реакции составляет
важный. Есть только одно значение G o для реакции при данной температуре, но есть
бесконечное число возможных значений G .
 Поскольку за реакцией нет движущей силы, система должна
находиться в равновесии.
Поскольку за реакцией нет движущей силы, система должна
находиться в равновесии.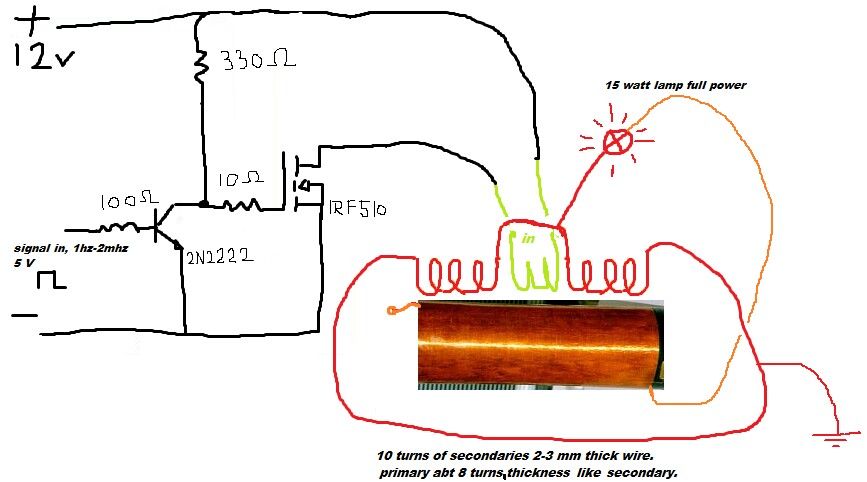
 Соотношение между G o и константой равновесия химической реакции выглядит следующим образом:
иллюстрируется данными в таблице ниже.
Соотношение между G o и константой равновесия химической реакции выглядит следующим образом:
иллюстрируется данными в таблице ниже. ) + H 2 O
) + H 2 O ) + Cu( с )
) + Cu( с ) Мы можем записать константы равновесия в терминах
парциальные давления реагентов и продуктов, либо по их концентрациям в
единицы моль на литр.
Мы можем записать константы равновесия в терминах
парциальные давления реагентов и продуктов, либо по их концентрациям в
единицы моль на литр.