Что такое свободная энергия и её понятие
Для многих людей понятие что такое свободная энергия — это «модное слово», которое не имеет четкого смысла.
Как таковое, оно относится к множеству изобретений, которые делают то, что не понято и поэтому является тайной. Для других это означает «вечный двигатель» и поэтому отклоняется без должного рассмотрения. Эта статья посвящена выяснению понятия, что такое свободная энергия, как она работает и как она может быть применена в вашей повседневной жизни….для света, тепла или движения.
Понятие концепции
Начнем с того, что «свободная энергия» относится к идее системы, которая может генерировать энергию, беря её из безграничного источника.
Если она генерируется без ограничения из нефти, солнца и ветра, и на самом деле может продолжать производиться в течение двадцати четырех часов, семь дней в неделю, в течение бесконечного количества времени, не беспокоясь что когда-либо иссякнет.
«Свободная», в этом смысле, не относится к свободной генерации энергии, монетарно говоря, несмотря на то, что человеческая раса имеет более чем достаточный потенциал и технологии, чтобы это произошло.
В самом простом смысле, что такое свободная энергия — любая, которая предоставляется миром природы.
Это могут быть источники энергии, с которыми знакомы, такие как солнечные батареи или ветряные генераторы, но также можно включать удивительные технологии как автомобиль работает на воде, бензин из воздуха, зарядное устройство с питанием от магнитов или магнитный хранитель, система отопления работающая от тепла Земли, жидкое биотопливо. Самые лучшие системы свободной энергии поставляют её без какой-либо цены потребителю, без вредных воздействий к окружающей среде, и на весьма низких ценах при обслуживании и деятельности оборудования.
На этом сайте не представлены футуристические технологии или невозможные изобретения, нарушающие законы физики. Здесь говорится о технологиях, которые используют природные источники энергии в окружающей среде и преобразуют их в полезные формы для тепла, света и движущейся силы.
На самом деле, существует термодинамика открытых систем Гельмгольца и Гиббса — отличное место, чтобы начать понимать эту чисто фундаментальную науку.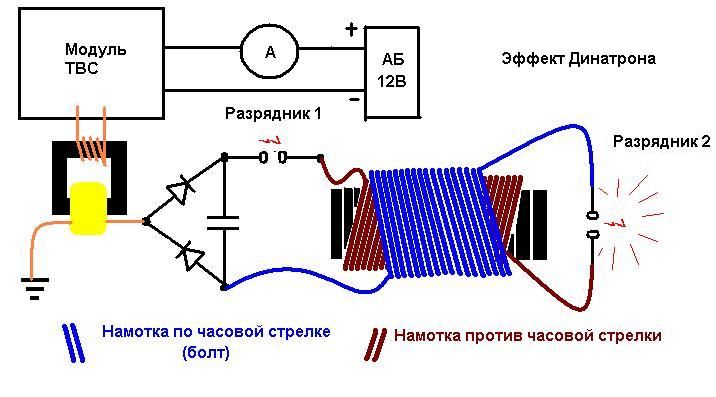
Поиск свободных источников
Хорошим примером является способ обогрева дома от Земли. В умеренном климате Земля является резервуаром постоянной температуры. Эта температура составляет около 13º C. Зимой к этому резервуару тепла можно получить доступ и сконцентрироваться с помощью геотермальной тепловой насосной системы и использовать для отопления дома примерно на 1/3 стоимости работы электрической или газовой печи. В дополнение к этому, если дом утеплен, стоимость отопления дома может быть дополнительно снижена еще на 60%. Только с помощью этих двух простых технологий, доступных сегодня, стоимость отопления дома зимой может быть снижена на 87%. То есть всего 13% от стоимости отопления того же дома с печью на невозобновляемых источниках энергии. Летом, цены кондиционирования воздуха подобно низки, используя такой же тепловой насос в обратном направлении. Такие новые источники энергии уже применяются.
Преимущество энергии 87% из года в год. Вот что такое свободная энергия, которую можно получить прямо сейчас! За счет сохранения тепла с лучшей изоляцией, как подземный дом, и с помощью первичной природной энергии, включая тепло, уже присутствующее в земле, то можно резко снизить спрос на ресурсы для отопления и не оставлять свой “углеродный след”.
Таким образом, свободная энергия — это любая, которую мы можем использовать бесплатно (без учета фундаментальных теорий Гельмгольца и Гиббса)
Если мы научимся “сначала экономить и использовать природную энергию», то небольшое количество, которое все еще требуется для наших нужд, будет легче вырабатываться возобновляемыми источниками энергии, такими как ветер, солнце, гидро и биотопливо. Даже если мы по-прежнему используем углеродное топливо для снабжения оставшейся части, наши затраты значительно снизятся и наш углеродный след значительно уменьшится.
Если бы все страны мира имели доступ к неограниченному производству энергии, последствия были бы грандиозными. Возьмем, к примеру нищету: многие регионы мира страдают от нехватки электроэнергии. Свободная энергия трансформировала бы все аспекты человечества, включая всю мировую экономику, значительная часть которой в настоящее время зависит от нефти.
Итак, есть ли такая машина? Ответ неоднозначный: есть несколько примеров использования различных типов технологий и научного понимания.
Использование технологий
Сейчас обсуждается широкий спектр технологий прошлого, которые до сих пор не интегрированы в рыночную экономику и не доступны для повседневного использования. Существуют технологии в настоящем, которые доступны прямо сейчас, которые могут значительно снизить наши затраты. И, наконец, есть технологии, которые могут стать доступными в будущем и которые могут радикально изменить наш мир к лучшему. Интересна философия использования и экономика использования свободной энергии везде, где это возможно. Довольно часто использование природных энергетических систем стоит больше вначале, но гораздо меньше с течением времени. Мы должны начать думать об общих затратах на использование системы, включая затраты на срок службы продукта. Когда общая экономика системы понята, системы свободной энергии являются наиболее экономически эффективными.
Важны вопросы, связанные с балансированием личной свободы с социальной ответственностью. Общество не может обеспечить индивиду права и свободы, если индивид не желает взамен обеспечить обществу ответственное поведение. Поступление неограниченного количества дешевой, чистой энергии может крайне дестабилизировать нецивилизованное общество. Эти изменения открывают беспрецедентные возможности как для экономических потрясений, так и для быстрых инноваций.
Поступление неограниченного количества дешевой, чистой энергии может крайне дестабилизировать нецивилизованное общество. Эти изменения открывают беспрецедентные возможности как для экономических потрясений, так и для быстрых инноваций.
Если обсуждаются простые технологии, которые уже находятся в общественном достоянии и наглядно демонстрируют какой автомобиль экономичный и выгоден прямо сейчас. Общественность должна потребовать немедленного предоставления таких транспортных средств.
Этот мир нуждается в более справедливом распределении ресурсов среди развивающихся стран и в способности обеспечивать более чистые при меньших затратах. В дополнение к этому, мы все должны научиться лучше управлять окружающей средой. Но это также означает более эффективное использование наших энергетических ресурсов и использование большего количества свободной энергии, вырабатываемой на местном уровне, что, конечно же, способствует использованию возобновляемых источников.
Проблема в том, что, когда огромные изменения в технологии происходят быстро, они могут быть очень разрушительными для общества. Необходимо ценить стабильность и порядок в мире, и поэтому если начнет применяться свободная энергия повсеместно необходимо будет сгладить этот переход.
Необходимо ценить стабильность и порядок в мире, и поэтому если начнет применяться свободная энергия повсеместно необходимо будет сгладить этот переход.
энергетика в России и в мире
Водород на пути к потребителюВодородная энергетика уже несколько лет считается наиболее перспективным направлением, которое должно заменить традиционную генерацию, прежде всего,…
Несмотря на резкие скачки цен на основные энергоресурсы в 2022 году, а также по-прежнему актуальную в мире «зелёную» повестку, газ и уголь пока не…
9 января 2023 в 02:12 Гидроэнергетика неиспользованных возможностейСейчас в мире одновременно строятся и проектируются тысячи новых гидроэлектростанций (ГЭС). В середине прошлого десятилетия на разных этапах находилось.
Генеральный секретарь Организации объединённых наций Антониу Гутерриш, комментируя доклад, подготовленный экспертами ООН по климату, обрушился с гневной…
28 октября 2021 в 01:14 Зажечь Солнце на Земле1,3 Мегаджоуля (МДж) энергии удалось получить учёным Ливерморской национальной лаборатории Лоуренса (Калифорния, США) в ходе эксперимента по зажиганию…
Одна из ключевых трудностей на пути развития водородной энергетики – недостаток чистой воды. Как ранее писал «Переток», для производства одной тонны…
25 августа 2021 в 16:33 Тотальный либерализм минус резервы
Недельные перебои с энергоснабжением на фоне аномальных морозов, затронувшие на пике в феврале до четверти населения Техаса.
Несмотря на пандемию и общее падение энергопотребления, объём солнечной генерации в мире вырос в прошлом году на 16%, причём, по данным Международного…
7 мая 2021 в 12:00 Скажи правду, Netflix!Более 3,5 тыс. человек подписались под петицией, созданной Канадским энергетическим центром против мультфильма «Семейка Бигфутов» от Netflix. Один из …
2 апреля 2021 в 17:54 Снежный ком безуглеродной металлургииПока российские металлурги ищут пути бумажного «озеленения» своей продукции при экспорте в ЕС и дискутируют со спецпредставителем президента Анатолием…
Минэнерго США анонсировало выделение $35 млн на развитие 11 проектов, связанных с подводными гидрокинетическими и речными системами (Submarine Hydrokinetic. ..
..
Управление валютного контролёра при Минфине США опубликовало постановление, согласно которому американские банки с капиталом свыше $100 млрд не вправе…
Загрузить другие публикации
Химическая энергия | Определение и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Содержание
- Введение
Викторина!
Популярная викторина: 13 вещей, которые нужно знать о фотосинтезе
Краткие факты
- Связанный контент
Читать Далее
- Что дает фотосинтез?
Викторины
- Энергия и ископаемое топливо
- Популярная викторина: 13 вещей, которые нужно знать о фотосинтезе
Что такое свободная энергия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 96640
Свободная энергия — составная функция, уравновешивающая влияние энергии и энтропии. Чтобы сначала дать определение «свободной» энергии, мы рассмотрим происхождение этого термина, какие определения его несут и какие конкретные определения мы, как химики, выберем для ссылки:
Чтобы сначала дать определение «свободной» энергии, мы рассмотрим происхождение этого термина, какие определения его несут и какие конкретные определения мы, как химики, выберем для ссылки:
- Ископаемое топливо, глобальное потепление и обычные споры в популярной науке заставили людей взывать к поиску чистой и возобновляемой «бесплатной» энергии (без сомнения, имея в виду долгосрочные денежные затраты). Самое доблестное дело; совершенно не обращайте внимания на это здесь. Забудьте, что вы вообще читали это определение. Мы даже начнем с перечисления в 1. снова!
- Если система изотермическая и закрытая, с постоянным давлением, она описывается энергией Гиббса, известной также под множеством прозвищ, таких как «свободная энергия», «свободная энергия Гиббса», «функция Гиббса» и «свободная энтальпия». «. Поскольку этот модуль находится в разделе «Энергия Гиббса», мы сосредоточимся на этой энергии; Гельмгольц будет кратко упомянут.
- Если система изотермическая и замкнутая, с постоянным объемом, она описывается энергией Гельмгольца, известной также под ненужным количеством псевдонимов, таких как «функция Гельмгольца», «работа выхода», «свободная энергия Гельмгольца» и наш любимый , «свободная энергия».
 Он будет упомянут вскользь.
Он будет упомянут вскользь. - Наличие двух энергий, называемых «свободной энергией», похоже на наличие двух братьев по имени Джек. Точнее, это были бы братьев-близнецов ; Энергии Гиббса и Гельмгольца описывают ситуации с уравнениями, которые легко спутать друг с другом. Неудивительно, что IUPAC (Международный союз теоретической и прикладной химии) официально именует их как Gibbs Energy и Helmholtz Energy соответственно. Это не должно быть сюрпризом, потому что именно так они изначально назывались! Просто имейте в виду, что в некоторых устаревших или несложных текстах все еще могут использоваться упомянутые выше псевдонимы (под видом, скажем, названия модуля).
Энергия Гиббса
Энергия Гиббса названа в честь Джозайи Уильяма Гиббса, американского физика конца 19 -го века, который значительно продвинул термодинамику; его работа теперь служит основой для этой отрасли науки. Можно сказать, что эта энергия представляет собой наибольшую работу (кроме работы расширения), которую система может совершить над своим окружением, когда она работает при постоянном давлении и температуре.
Во-первых, моделирование энергии Гиббса с помощью уравнения:
\[G = U + PV — TS\]
Где:
- \(U\)= внутренняя энергия
- \(TS\) = абсолютная температура x конечная энтропия
- \(PV\) = давление x объем
Конечно, мы знаем, что \(U + PV\) также можно определить как:
\[U + PV = H\]
Где:
- \(H\) — энтальпия
Что приводит нас к форме связи энергии Гиббса с энтальпией:
\[G = H — TS\]
также государственная функция. Изменение в G просто:
\[\Delta{G} = \Delta{H} — T\Delta{S}\]
Как было получено это уравнение
Мы начнем с уравнения для полного изменения энтропии Вселенной. Наша цель — свести его к практичной форме, как пещерный человек, превращающий громоздкий каменный блок в полезный ручной инструмент!
\[\Delta{S_{вселенная}} = \Delta{S_{система}} + \Delta{S_{окружение}}\]
С уравнением с переменными такого масштаба трудно работать.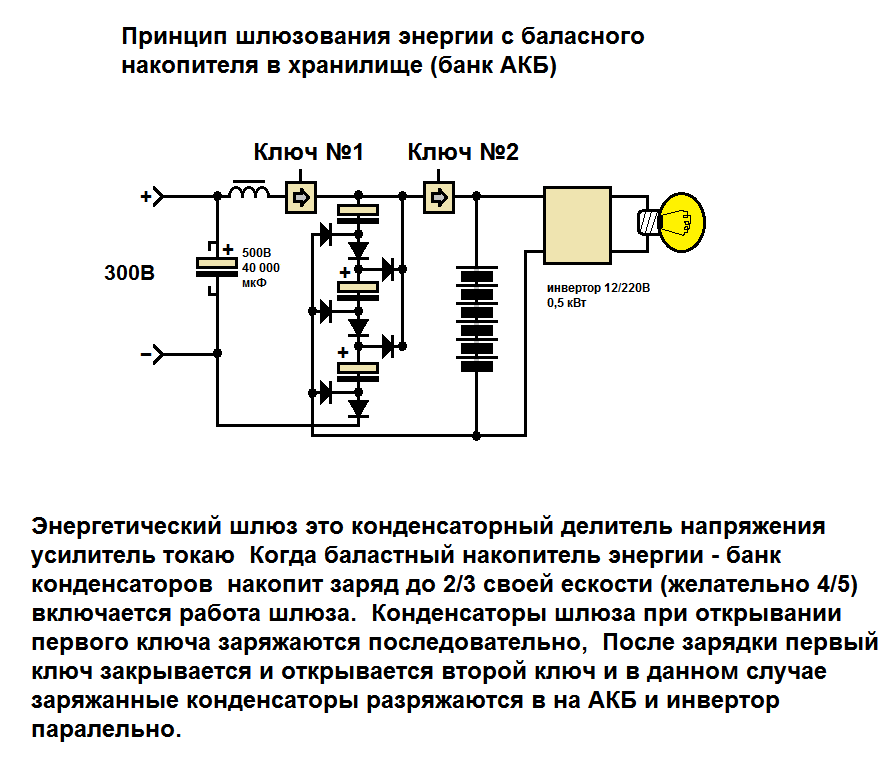 Мы хотим избавиться от неопределенности и переписать более целенаправленное уравнение. Рассмотрим случай, когда температура и давление постоянны. Вот так:
Мы хотим избавиться от неопределенности и переписать более целенаправленное уравнение. Рассмотрим случай, когда температура и давление постоянны. Вот так:
- \(\Delta{S_{окружение}}\) можно переписать как \(\dfrac{\Delta{H}}{T} \).
Тепло, q p , которым система воздействует на окружающую среду, является отрицательным значением \[(Delta{H}\) для системы. Поскольку \(-q_p = -\Delta{H}_{sys}\), изменение энтропии окружения будет равно \(\Delta{S}_{окружение} = \Delta{H_{sys }}/Т\).
- Уравнение принимает вид \[\Delta{S_{univ}} = \Delta{S_{sys}} + (-\Delta{H_{surr}}/T)\]
Простая замена.
- Уравнение становится \[T\Delta{S_{univ}} = \Delta{H_{surr}} — T\Delta{S_{sys}}\]
Умножьте обе части на T.
- С могучими способностями того, кто открывает что-то, чтобы назвать это, мы устанавливаем \[-T\Delta{S_{univ}}\] равным большому большому \[\ Delta{G}\] для всемогущего Гиббса.
 Наконец, мы приходим к уравнению \[\Delta{G} = \Delta{H} — T\Delta{S}\].
Наконец, мы приходим к уравнению \[\Delta{G} = \Delta{H} — T\Delta{S}\].
Обоснование уравнения
В качестве короткого примечания, позвольте сказать, что название «свободная энергия», кроме того, что его путают с другой точно названной энергией, также является в некоторой степени неправильным. Многочисленные значения слова «бесплатно» могут создать впечатление, что энергия может передаваться бесплатно; на самом деле слово «бесплатно» использовалось для обозначения того, какую стоимость система может платить бесплатно в форме преобразования энергии в работу. \(\Delta{G}\) полезен, потому что он может сказать нам, как будет действовать система, когда нам предоставляется только информация о ней.
\[\Delta{G} < 0\]
указывает на спонтанное * изменение.
\[\Delta{G} > 0\]
указывает на отсутствие спонтанности.
\[\Delta{G} = 0\]
указывает на равновесную систему.
Энергия Гиббса достигает минимального значения при достижении равновесия. Здесь он представлен в виде графика, где x представляет степень того, насколько далеко зашла реакция. Минимум функции должен быть гладким, так как \(G\) должна быть дифференцируемой (ее первая производная должна существовать в минимуме).
Здесь он представлен в виде графика, где x представляет степень того, насколько далеко зашла реакция. Минимум функции должен быть гладким, так как \(G\) должна быть дифференцируемой (ее первая производная должна существовать в минимуме).
Было кратко упомянуто, что \[\Delta{G}\] — это энергия, которую можно преобразовать в работу. Определение самоочевидно из уравнения.
Посмотрите на \[\Delta{G} = \Delta{H} — T\Delta{S}\]. Напомним, что \(\Delta{H}\) — это полная энергия, которую можно превратить в тепло. \[T\Delta{S}\] — это энергия, которую невозможно преобразовать в работу. Путем переупорядочения уравнения энергии Гиббса:
\[\Delta{H} = \Delta{G} — T\Delta{S}\]
Выражается словами:
энергия, которую можно превратить в тепло = \[\Delta{G}\] — энергия, которая не может совершать работу. Это позволяет нам увидеть, что \(\Delta{G}\) ДОЛЖНА быть свободной энергией для выполнения работы.
Почему постоянная температура и давление? Так уж получилось, что эти факторы регулярно встречаются в лаборатории, что делает это уравнение практичным в использовании, а также полезным для химиков. Примером энергии Гиббса в реальном мире является окисление глюкозы; \[\Delta{G}\] в этом случае равно 2870 кДж, или 686 Калорий. Для живых клеток это первичная энергетическая реакция.
Примером энергии Гиббса в реальном мире является окисление глюкозы; \[\Delta{G}\] в этом случае равно 2870 кДж, или 686 Калорий. Для живых клеток это первичная энергетическая реакция.
Свободная энергия Гельмгольца
Свободная энергия Гельмгольца считается термодинамическим потенциалом, который рассчитывает «полезную» работу, которую можно получить из замкнутой термодинамической системы при постоянной температуре и объеме. Для такой системы отрицательная разница в энергии Гельмгольца равна максимальному количеству работы, извлекаемой из термодинамического процесса, в котором и температура, и объем остаются постоянными. В этих условиях она минимизируется и поддерживается постоянной в равновесии. Свободная энергия Гельмгольца была первоначально разработана Германом фон Гельмотцем и обычно обозначается буквой 9.0189 А , или буква F . В физике буква F в основном используется для обозначения энергии Гельмгольца, которую часто называют функцией Гельмгольца или простым термином «свободная энергия». — термодинамический потенциал, найденный в системе постоянных частиц с постоянной температурой и постоянным объемом, определяемый формулой:
— термодинамический потенциал, найденный в системе постоянных частиц с постоянной температурой и постоянным объемом, определяемый формулой:
\[ΔA = ΔE – TΔS\]
- A = свободная энергия Гельмгольца в джоулях
- E = энергия системы в джоулях
- T = Абсолютная температура в Кельвинах
- S = Энтропия в Джоулях/Кельвинах
Таким образом, свободная энергия Гельмгольца также является мерой способности изотермическо-изохорной замкнутой системы совершать работу. Если какое-либо внешнее поле отсутствует, формула свободной энергии Гельмгольца принимает вид:
\[ΔA = ΔU –TΔS\]
- A = свободная энергия Гельмгольца в Джоулях
- U = внутренняя энергия в джоулях
- T = Абсолютная температура в Кельвинах
- S = Энтропия в Джоулях/Кельвинах
Можно сказать, что внутренняя энергия (U) представляет собой количество энергии, необходимой для создания системы при несуществующих изменениях температуры (T) или объема (V). Однако если система создана в среде с температурой T, то часть энергии может быть захвачена за счет самопроизвольного теплообмена между средой и системой. Величина этой спонтанной передачи энергии равна TΔS, где S — конечная энтропия системы. В этом случае вам не нужно вкладывать столько энергии. Обратите внимание, что если более неупорядоченно, что приводит к более высокой энтропии, создается конечное состояние, при котором для создания системы требуется меньше работы. Свободная энергия Гельмгольца становится мерой суммы энергии, которую вы должны вложить для создания системы, если принять во внимание спонтанную передачу энергии системой из окружающей среды.
Однако если система создана в среде с температурой T, то часть энергии может быть захвачена за счет самопроизвольного теплообмена между средой и системой. Величина этой спонтанной передачи энергии равна TΔS, где S — конечная энтропия системы. В этом случае вам не нужно вкладывать столько энергии. Обратите внимание, что если более неупорядоченно, что приводит к более высокой энтропии, создается конечное состояние, при котором для создания системы требуется меньше работы. Свободная энергия Гельмгольца становится мерой суммы энергии, которую вы должны вложить для создания системы, если принять во внимание спонтанную передачу энергии системой из окружающей среды.
Свободная энергия Гельмгольца обычно используется в физике и обозначается буквой F , а в химии используется G , свободная энергия Гиббса.
Связь энергии Гельмгольца с энергией Гиббса
Энергия Гельмгольца определяется уравнением: PV\]
Энергия Гельмгольца используется, когда невозможно поддерживать постоянное давление.




 Он будет упомянут вскользь.
Он будет упомянут вскользь. Наконец, мы приходим к уравнению \[\Delta{G} = \Delta{H} — T\Delta{S}\].
Наконец, мы приходим к уравнению \[\Delta{G} = \Delta{H} — T\Delta{S}\].