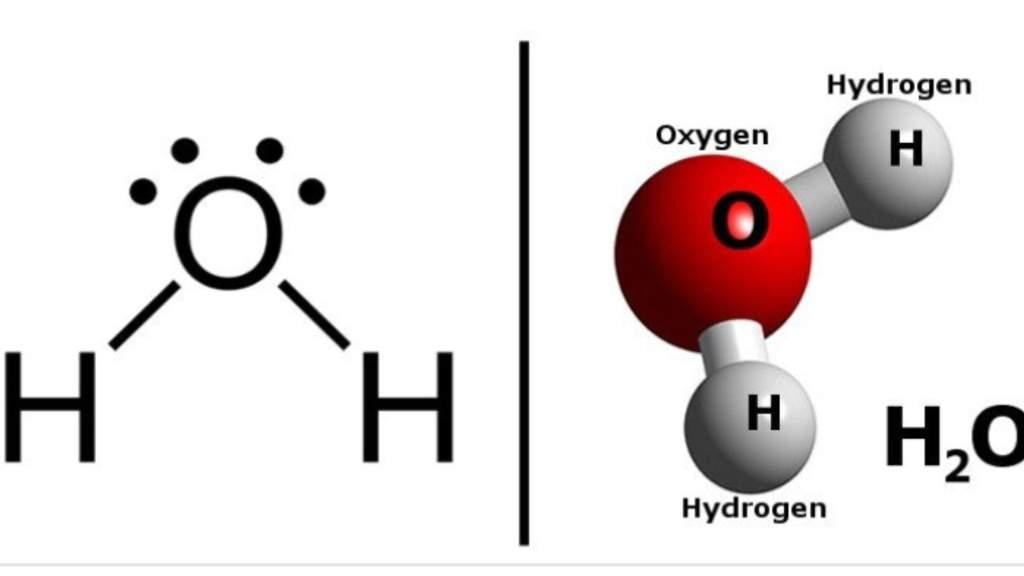
Структура воды и ее свойства
Рубрики
Поиск
Популярные
Насколько вода необходима живым существам, известно, пожалуй, каждому. Она служит основным элементом организма человека, обеспечивающим нормальное функционирование всех органов и терморегуляцию, участвует в большинстве химических реакций, происходящих в клетках, является транспортером питательных веществ, кислорода, помогает усваивать питательные вещества и выполняет ряд других полезных функций.
Наука не дает точных рекомендаций по поводу того, сколько воды необходимо выпивать человеку в сутки, однако бесспорным является тот факт, что употреблять можно исключительно очищенный питьевой ресурс, не несущий вреда организму. Чтобы разобраться в том, что такое чистая вода, следует изучить структурную формулу и ее основные свойства.
Структурная формула молекулы воды
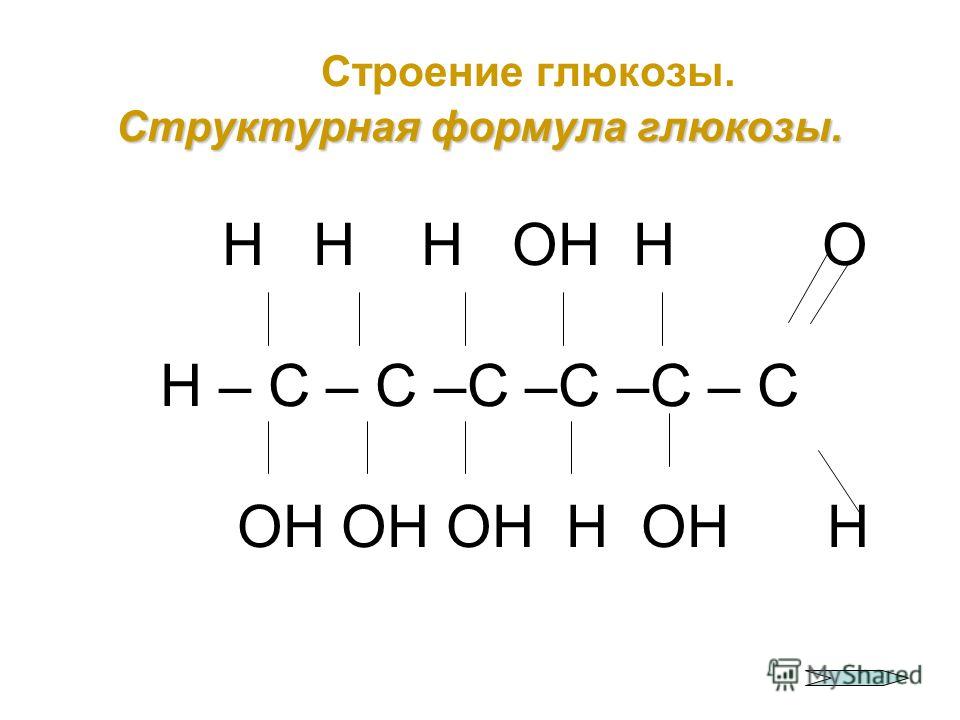
С точки зрения химии, молекула воды довольно проста: состоит она из двух атомов водорода и одного атома кислорода, соответственно, структурная формула записывается как h3O. Каждый из атомов водорода соединяется с кислородом одной ковалентной связью, поэтому формулу еще можно отобразить как H-O-H. Структура Н2О представляет собой особую взаимозависимость молекул с высокой диэлектрической проницаемостью, с которой может соревноваться лишь ряд кислот цианистого водорода. Для примера, показатель проницаемости Н2О — 81, в то время, как у большинства других тел этот показатель колеблется в пределах 2-3. Эта химическая субстанция способна лучшим образом растворять другие вещества, окислять практически любые горные породы и оказывать разрушительное воздействие на металл.
Каждый из атомов водорода соединяется с кислородом одной ковалентной связью, поэтому формулу еще можно отобразить как H-O-H. Структура Н2О представляет собой особую взаимозависимость молекул с высокой диэлектрической проницаемостью, с которой может соревноваться лишь ряд кислот цианистого водорода. Для примера, показатель проницаемости Н2О — 81, в то время, как у большинства других тел этот показатель колеблется в пределах 2-3. Эта химическая субстанция способна лучшим образом растворять другие вещества, окислять практически любые горные породы и оказывать разрушительное воздействие на металл.
Вода уникальна своими свойствами, молекулы обладают способностью хорошо «слипаться» друг с другом, что является объяснением многих ее характеристик. Например, одним из важных свойств является высокая теплопроводность и температура кипения. Чтобы испарить один литр Н2О, потребуется намного больше времени, чем на испарение многих других жидких составов.
Свойства структуры воды
В естественном состоянии Н2О представляет собой прозрачную субстанцию без запаха, цвета и вкуса. Причем благодаря водородной связи она остается жидкой в широком диапазоне температур. В твердом состоянии она преобразуется в лед, а в газообразном становится паром. Структурная функция воды может быть следующих видов:
Причем благодаря водородной связи она остается жидкой в широком диапазоне температур. В твердом состоянии она преобразуется в лед, а в газообразном становится паром. Структурная функция воды может быть следующих видов:
- наполняющая — Н2О наполняет все клетки организма человека влагой. От уровня ее нехватки в организме могут наблюдаться такие явления, как сильное чувство жажды, сморщивание кожных покровов, пересушивание слизистых оболочек. При глобальном обезвоживании у человека могут наступить расстройства психики, галлюцинации и даже смертельный исход;
- растворяющая — чтобы обеспечить доставку питательных веществ в клетки организма, вода растворяет их в себе. Также она способствует выведению продуктов жизнедеятельности из организма естественным путем, обеспечивает правильный обмен веществ;
- транспортная — благодаря свойству высокого натяжения Н2О может проникать в самые тонкие капилляры, обеспечивая питание организму;
- в качестве терморегулятора — поддерживает нормальную температуру тела, обладая свойствами испарения и теплоемкости.

Все вышеприведенные функции в полной мере проявляются в чистом ресурсе, поэтому крайне важно следить за качеством потребляемой жидкости, периодически проводить лабораторные исследования и в случае обнаружения плохих показателей использовать дополнительные фильтры. А вы уже успели заказать фильтрующую установку? Не стоит откладывать это решение на потом, о здоровье своем и близких нужно позаботиться уже сегодня!
Презентация на тему: «H + O + H H O H ЭЛЕКТРОННАЯ ФОРМУЛА Вода
1
2
H + O + H H O H ЭЛЕКТРОННАЯ ФОРМУЛА Вода — это соединение с полярной ковалентной связью, которая образуется при спаривании электронов атомов водорода и кислорода.
3 Электроотрицательность атомов водорода и кислорода разная, следовательно связи O-H сильно поляризованы Н О Н На атомах возникают высокие заряды, на атоме кислорода частичный отрицательный, на атоме водорода частичный положительный.
4
В пространстве молекула воды имеет угловую форму, угол связей H-O-H составляет 104, 27 Угловые молекулы воды полярные, их называют диполями.
5
Физические свойства- жидкость, без цвета, запаха, вкуса, t кипения- 100, t замерзания-0 наибольшую плотность вода имеет при t =+4 C, при t выше и ниже этой, плотность воды уменьшается. Вода плохо проводит теплоту и электричество. Химические свойства воды также зависят от строения. Полярность связей O-H способствует взаимодействию воды с активными Me (щелочными и щелочноземельными) при обычных условиях, с металлами средней активности при нагревании.
6 Тема: Оценка качества воды. Цель: Определить практическим путем плотность, прозрачность, запах, наличие примесей в различных образцах воды. План работы: 1. Используя ареометр, определить плотность различных образцов воды (дистиллированной, водопроводной и речной). 1. Дистиллированная 2. Водопроводная 3. Речная
7 ρ (дистиллированной)=1, г/мл ρ (водопроводной)= 1,005 г/мл ρ (речной/Н 2 О) = 1, 01 г/мл
8
Три цилиндра ставим на печатный текст и в каждый поочередно вливаем исследуемую воду, следим, чтобы можно было читать через воду напечатанный текст. Отмечаем высоту столбика, когда исчезает видимость шрифта. Дистиллированная Н 2 О – 25 см; водопроводная H 2 O – 22 см; речная Н 2 О – 16см. Определяем долю или степень прозрачности: ω% (прозрачности) водопроводной воды = 22 : 25 * 100% = 88% ω% (прозрачности) речной воды = 16:25 * 100% = 64 %
Отмечаем высоту столбика, когда исчезает видимость шрифта. Дистиллированная Н 2 О – 25 см; водопроводная H 2 O – 22 см; речная Н 2 О – 16см. Определяем долю или степень прозрачности: ω% (прозрачности) водопроводной воды = 22 : 25 * 100% = 88% ω% (прозрачности) речной воды = 16:25 * 100% = 64 %
9
В коническую колбу объемом 250 мл наливаем исследуемую воду до 2/3 её объема. Сильно встряхиваем колбу в закрытом состоянии. Затем открываем и определяем интенсивность запаха. Результаты определяем по таблице 8 (практическая работа 3) учебник О.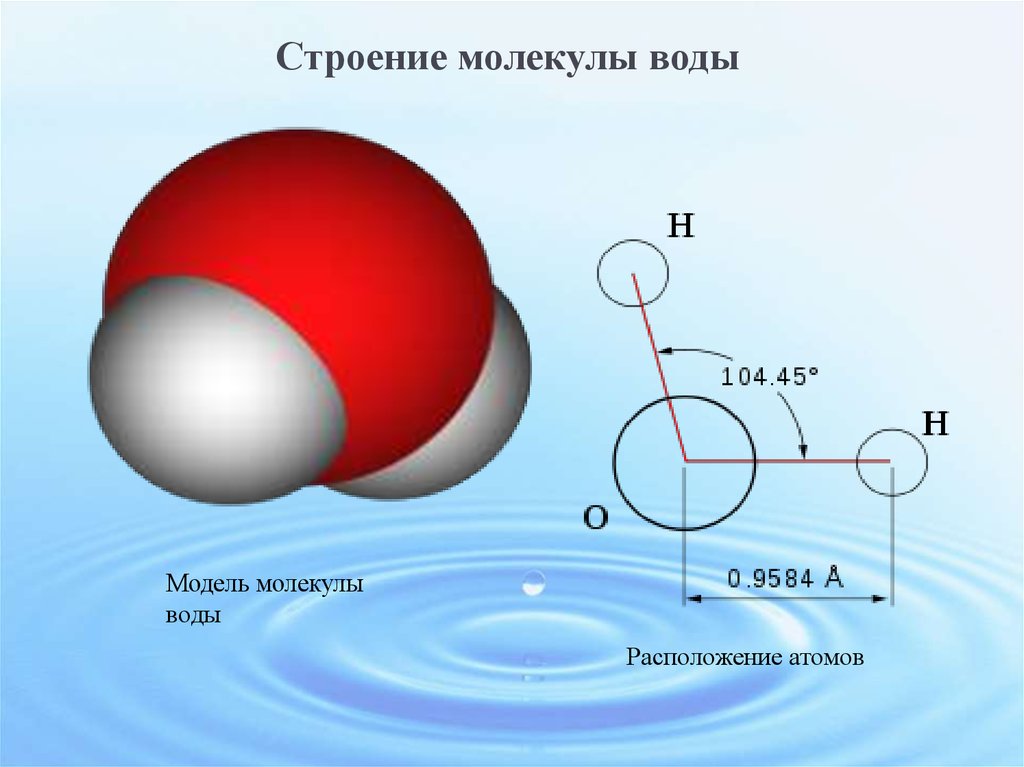
10
К 10 мл исследуемого образца речной воды добавляем 1 каплю азотной кислоты, затем добавляем 3 капли перекиси водорода и приливаем 0,5 мл раствора роданида аммония. Наблюдаем образование слабого розового окрашивания. Вывод: следовательно в данной образце воды концентрация ионов железа более 2 мг/л.![]()
11 Вопросы теста: 1. Какую форму в пространстве имеют молекулы воды? 2. Почему молекулы воды в пространстве имеют угловую форму? 3. Почему вода – универсальный растворитель на нашей планете? 4. Что такое гидратация? 5. При какой температуре плотность воды самая оптимальная?
12
1. Угловую 2. Потому что в образовании связей участвуют два неспаренных ρ- электрона атома кислорода 3. Потому что молекулы воды полярные 4. -//- 5. при температуре 4 °С
Угловую 2. Потому что в образовании связей участвуют два неспаренных ρ- электрона атома кислорода 3. Потому что молекулы воды полярные 4. -//- 5. при температуре 4 °С
13 Ребята ответственно отнеслись к выполнению работы, работали с дополнительной литературой. Работали дружно, сообща.
14
1. О.С. Габриелян. Учебник химии 8, 9 класс, «Дрофа», В.А. Крицман, В.В. Станцо. Энциклопедический словарь юного химика, Москва «Педагогика», 1985 В.А.Крицман. Книга для чтения по неорганической химии, Москва «Просвещение», 1980 Интернет- источник (slovari yandex. ru; ru wikipedia. Org/wiki)
О.С. Габриелян. Учебник химии 8, 9 класс, «Дрофа», В.А. Крицман, В.В. Станцо. Энциклопедический словарь юного химика, Москва «Педагогика», 1985 В.А.Крицман. Книга для чтения по неорганической химии, Москва «Просвещение», 1980 Интернет- источник (slovari yandex. ru; ru wikipedia. Org/wiki)
Химическая формула – определение, типы и примеры
Химическая формула Определение
Химическая формула – это обозначение, используемое учеными для обозначения числа и типа атомов, присутствующих в молекуле, с использованием атомных символов и числовых индексов. Химическая формула — это простое письменное представление существующей трехмерной молекулы. Химическая формула описывает вещество с точностью до атомов, из которых оно состоит. Существует три основных типа химических формул: 9эмпирическая формула 0005 , молекулярная формула и структурная формула .
Каждая из этих химических формул дает немного отличающуюся информацию о составе вещества, ключи к разгадке его трехмерной формы и тому, как оно будет взаимодействовать с другими молекулами, атомами и ионами.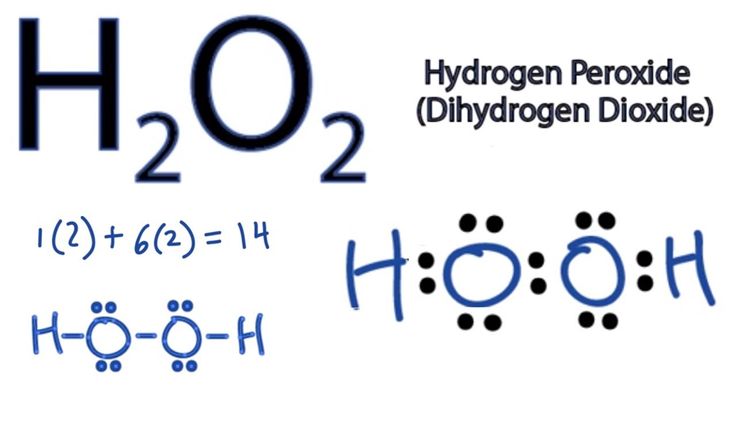 В химической формуле буквы представляют атомный символ каждого атома. Нижний индекс (нижний) представляет номер каждого атома, а верхний индекс (верхний) представляет заряд данного атома. А Коэффициент перед химической формулой представляет столько единиц молекулы. Каждый из различных типов химических формул читается немного по-разному.
В химической формуле буквы представляют атомный символ каждого атома. Нижний индекс (нижний) представляет номер каждого атома, а верхний индекс (верхний) представляет заряд данного атома. А Коэффициент перед химической формулой представляет столько единиц молекулы. Каждый из различных типов химических формул читается немного по-разному.
Типы химической формулы
Эмпирическая формула
Эмпирическая химическая формула представляет собой относительное количество атомов каждого элемента в соединении. Некоторые соединения, такие как вода, имеют одинаковую эмпирическую и молекулярную формулу, потому что они малы и имеют одинаковое соотношение атомов в молекулах и число атомов в молекуле. Эмпирическая и молекулярная формула воды выглядит так:
H 2 O
Эмпирическая формула определяется массой каждого атома в молекуле. Следовательно, для немного большей молекулы, такой как перекись водорода, эмпирическая формула показывает только соотношение атомов. В этом случае:
В этом случае:
HO:
Однако эта эмпирическая химическая формула показывает только основную основу молекулы. На самом деле две молекулы HO: объединяются, образуя молекулу перекиси водорода.
Молекулярная формула
Молекулярная формула показывает фактическое количество атомов в каждой молекуле. Таким образом, молекулярная формула перекиси водорода выглядит следующим образом:
H 2 O 2
Как видите, это несколько запутывает реальную структуру перекиси водорода. В то время как эмпирическая химическая формула дает представление о том, что молекула имеет два атома кислорода, связанных вместе в середине, молекулярная формула совсем не проясняет этого. Однако молекулярная формула часто используется для описания молекул просто потому, что это удобно, и большинство молекул можно найти после того, как будет определена их формула.
Структурная формула
Структурная формула молекулы представляет собой химическую формулу с более художественным уклоном.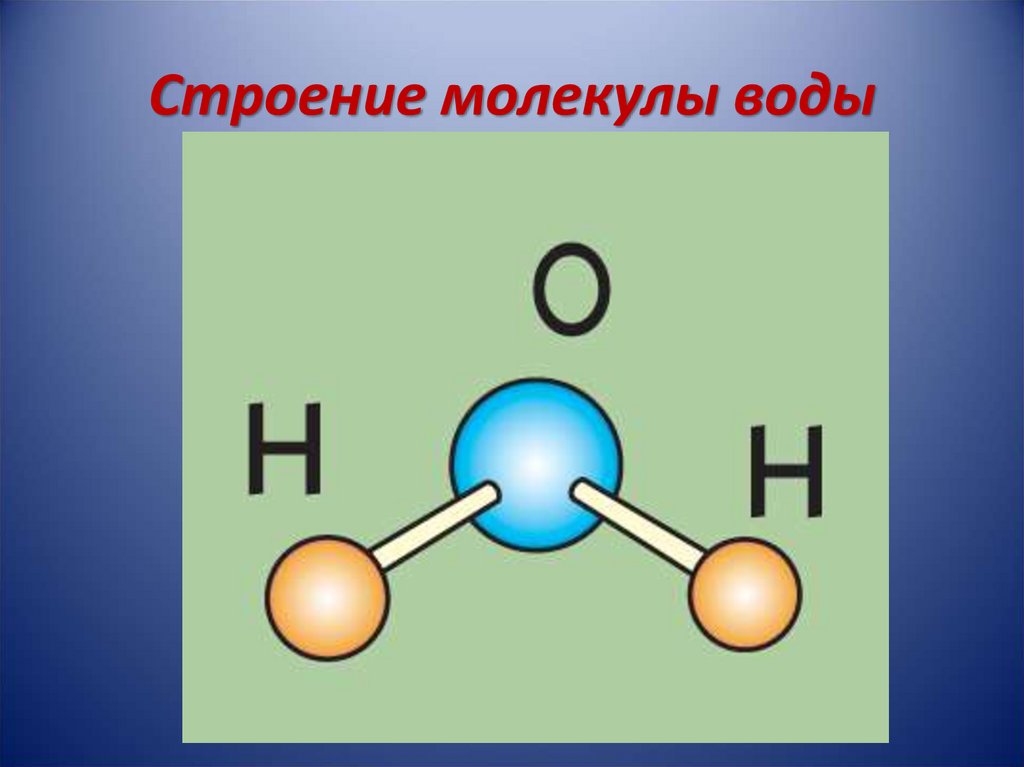 В этих химических формулах показаны фактические связи между молекулами. Это помогает читателю понять, как связаны различные атомы и, следовательно, как молекула функционирует в пространстве. Есть много различных структурных химических формул, которые следует учитывать.
В этих химических формулах показаны фактические связи между молекулами. Это помогает читателю понять, как связаны различные атомы и, следовательно, как молекула функционирует в пространстве. Есть много различных структурных химических формул, которые следует учитывать.
Самый простой метод, метод электронных точек , использует двоеточие и точки для обозначения связей между атомами. Каждое двоеточие представляет собой пару электронов, разделенных между атомами по обе стороны от двоеточия. Эта формула более точно представляет фактическое расположение атомов в молекуле. В случае воды формула электронной точки будет выглядеть так:
H:O:H
Другая химическая формула, формула линия связи , также показывает связи между атомами. Вместо того, чтобы показывать каждый общий электрон, линия используется для обозначения электронных пар, общих для атомов. Вода в формуле линии связи выглядит так:
H-O-H
Ученые придумали гораздо более совершенную формулу и представление молекул, включая трехмерные шаростержневые модели , заполняющие пространство модели и даже модели, учитывающие электронную плотность моделируемых атомов. Эти продвинутые модели учитывают не только присутствующие атомы и их количество, но и углы, размеры и расстояния между атомами внутри молекулы. Модель воды в виде шара и стержня, показанная ниже, даже показывает полярность молекулы , поскольку большой атом кислорода имеет тенденцию притягивать наибольшее количество электронов.
Эти продвинутые модели учитывают не только присутствующие атомы и их количество, но и углы, размеры и расстояния между атомами внутри молекулы. Модель воды в виде шара и стержня, показанная ниже, даже показывает полярность молекулы , поскольку большой атом кислорода имеет тенденцию притягивать наибольшее количество электронов.
Молекулярная масса из химической формулы
Одним из важных навыков, полученных из химической формулы, является вычисление молекулярная масса . Молекулярная масса молекулы представляет собой сумму всех различных атомов внутри. Каждое вещество имеет определенную молекулярную массу, определяемую его особым составом.
Чтобы определить молекулярную массу вещества, рассмотрите химическую формулу. Формула легко отображает каждый присутствующий атом. Обязательно умножьте на количество атомов каждой молекулы. Нижние индексы на каждом атоме будут указывать, сколько их. Некоторые большие молекулы с несколькими похожими группами будут показывать группы примерно так, как в примере ниже:
C(OH) 4
В данном случае имеется четыре группы (OH), а не 4 атома водорода. Обязательно учитывайте это при расчете молекулярной массы. Молекулярную массу можно использовать для идентификации веществ, правильного взвешивания веществ для экспериментов и выполнения ряда расчетов, связанных с энергией, участвующей в химических реакциях. Ученые часто используют химическую формулу как хранилище большей части этой информации, не объясняя основы химии в каждой статье.
Обязательно учитывайте это при расчете молекулярной массы. Молекулярную массу можно использовать для идентификации веществ, правильного взвешивания веществ для экспериментов и выполнения ряда расчетов, связанных с энергией, участвующей в химических реакциях. Ученые часто используют химическую формулу как хранилище большей части этой информации, не объясняя основы химии в каждой статье.
Викторина
Ссылки
- Мур, Дж. Т. (2010). Основы химии для чайников . Индианаполис: Wiley Publishing, Inc.
- Нельсон, Д.Л., и Кокс, М.М. (2008). Основы биохимии. Нью-Йорк: WH Фримен и компания.
- Зильберберг, М.С. (2009). Химия: молекулярная природа материи и изменений (5-е изд.). Бостон: Высшее образование McGraw-Hill.
3.2 Определение эмпирических и молекулярных формул – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Вычислять процентный состав соединения
- Определите эмпирическую формулу соединения
- Определите молекулярную формулу соединения
В предыдущем разделе обсуждалась взаимосвязь между объемной массой вещества и числом содержащихся в нем атомов или молекул (молей). Зная химическую формулу вещества, можно определить количество вещества (молей) по его массе и наоборот. Но что, если химическая формула вещества неизвестна? В этом разделе те же самые принципы будут применяться для получения химических формул неизвестных веществ из экспериментальных измерений массы.
Зная химическую формулу вещества, можно определить количество вещества (молей) по его массе и наоборот. Но что, если химическая формула вещества неизвестна? В этом разделе те же самые принципы будут применяться для получения химических формул неизвестных веществ из экспериментальных измерений массы.
Процентный состав
Элементарный состав соединения определяет его химическую принадлежность, и химические формулы являются наиболее кратким способом представления этого элементного состава. Когда формула соединения неизвестна, измерение массы каждого из составляющих его элементов часто является первым шагом в процессе экспериментального определения формулы. Результаты этих измерений позволяют рассчитать процентный состав соединения, определяемый как массовая доля каждого элемента в соединении. Например, рассмотрим газообразное соединение, состоящее исключительно из углерода и водорода. Процентный состав этого соединения можно представить следующим образом:
%H=масса соединения Hmass×100%%H=масса соединения Hmass×100%
%C=масса Cмасса соединения×100%%C=масса Cмасса соединения×100%
Если анализ образца этого газа массой 10,0 г показал, что он содержит 2,5 г H и 7,5 г C, процентный состав будет рассчитан как 25% H и 75% C:
%H=2,5 г · 20,0 г соединения × 100 % = 25 % %H = 2,5 г · 20,0 г соединения × 100 % = 25 %
%C=7,5 г C10,0 г соединения×100%=75%%C=7,5 г C10,0 г соединения×100%=75%
Пример 3,9
Расчет процентного состава
Анализ образца жидкого соединения, состоящего из углерода, водорода и азота, массой 12,04 г показал, что в нем содержится 7,34 г С, 1,85 г Н и 2,85 г N. Каков процентный состав этого соединения?
Каков процентный состав этого соединения?
Раствор
Чтобы рассчитать процентный состав, разделите экспериментально полученную массу каждого элемента на общую массу соединения, а затем переведите в процентное соотношение:
%C=7,34 г C12,04 г соединения×100 %=61,0 %%H=1,85 г h22,04 г соединения×100 %=15,4 %%N=2,85 г N12,04 г соединения×100 %=23,7 %%C= 7,34 г C12,04 г соединения × 100% = 61,0%% H = 1,85 г h22,04 г соединения × 100% = 15,4%% N = 2,85 г N12,04 г соединения × 100% = 23,7%
Результаты анализа показывают, что соединение представляет собой 61,0% С, 15,4% Н и 23,7% N по массе.
Проверьте свои знания
Образец газообразного соединения массой 24,81 г, содержащий только углерод, кислород и хлор, содержит 3,01 г углерода, 4,00 г кислорода и 17,81 г хлора. Каков процентный состав этого соединения?
Отвечать:
12,1% C, 16,1% O, 71,79% Cl
Определение процентного состава по молекулярным или эмпирическим формулам
Процентный состав также полезен для оценки относительного содержания данного элемента в различных соединениях известных формул.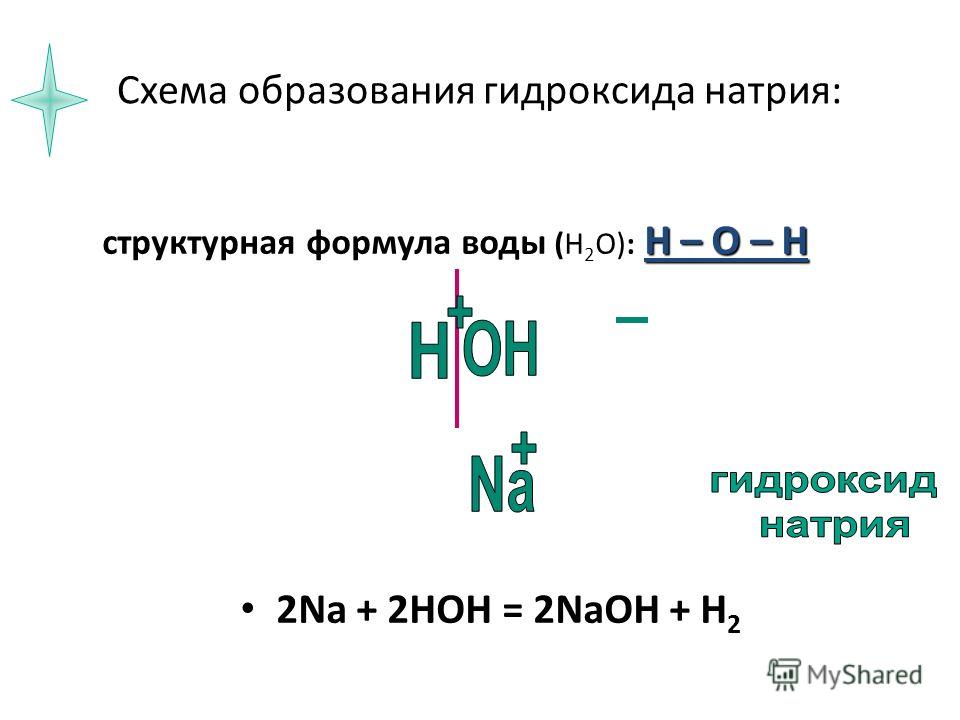 В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевина (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,01 а.е.м. и три атома H с общей массой (3 × × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формула массы аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав:
В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевина (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,01 а.е.м. и три атома H с общей массой (3 × × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формула массы аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав:
%N=14,01 а.е.м. N17,03 а.е.Nh4×100%=82,27%%H=3,024 а.е. 03amuNh4×100%=17,76%
Такой же подход можно применить к паре молекул, дюжине молекул или молю молекул и т. д. Последнее количество наиболее удобно и будет просто включать использование молярных масс вместо атомных и формульных масс, как показано в примере. 3.10. Пока молекулярная или эмпирическая формула рассматриваемого соединения известна, процентный состав может быть получен из атомных или молярных масс элементов соединения.
д. Последнее количество наиболее удобно и будет просто включать использование молярных масс вместо атомных и формульных масс, как показано в примере. 3.10. Пока молекулярная или эмпирическая формула рассматриваемого соединения известна, процентный состав может быть получен из атомных или молярных масс элементов соединения.
Пример 3.10
Определение процентного состава по молекулярной формуле
Аспирин представляет собой соединение с молекулярной формулой C 9 H 8 O 4 . Каков его процентный состав?
Раствор
Для расчета процентного состава необходимы массы C, H и O в известной массе C 9 H 8 O 4 . Удобно считать 1 моль C 9 H 8 O 4 и используйте его молярную массу (180,159 г/моль, определяемую по химической формуле), чтобы рассчитать процентное содержание каждого из его элементов:
%C=9моль C×молярная масса Cмолярная массаC9H8O4×100=9×12,01г/моль180,159г/моль×100=108,09г/моль180,159г/моль×100%C=60,00%C%C=9мольC× молярная масса Cмолярная массаC9H8O4×100=9×12,01 г/моль180,159 г/моль×100=108,09 г/моль180,159 г/моль×100%C=60,00%C
%H=8моль H×молярная масса Hмолярная массаC9H8O4×100 =8×1,008 г/моль180,159 г/моль×100=8,064 г/моль180,159 г/моль×100%H=4,476%H%H=8моль H×молярная масса Hмолярная массаC9H8O4×100=8×1,008 г/моль180,159 г/моль×100=8,064 г/моль180,159 г/моль×100%H=4,476%H
%O=4моль O×молярная масса Oмолярная массаC9H8O4×100=4× 16,00 г/моль180,159 г/моль×100=64,00 г/моль180,159 г/моль×100%O=35,52%%O=4моль O×молярная масса Oмолярная массаC9H8O4×100=4×16,00 г/моль180,159 г/моль× 100=64,00 г/моль 180,159 г/моль×100%O=35,52%
Обратите внимание, что эти проценты в сумме составляют 100,00% при соответствующем округлении.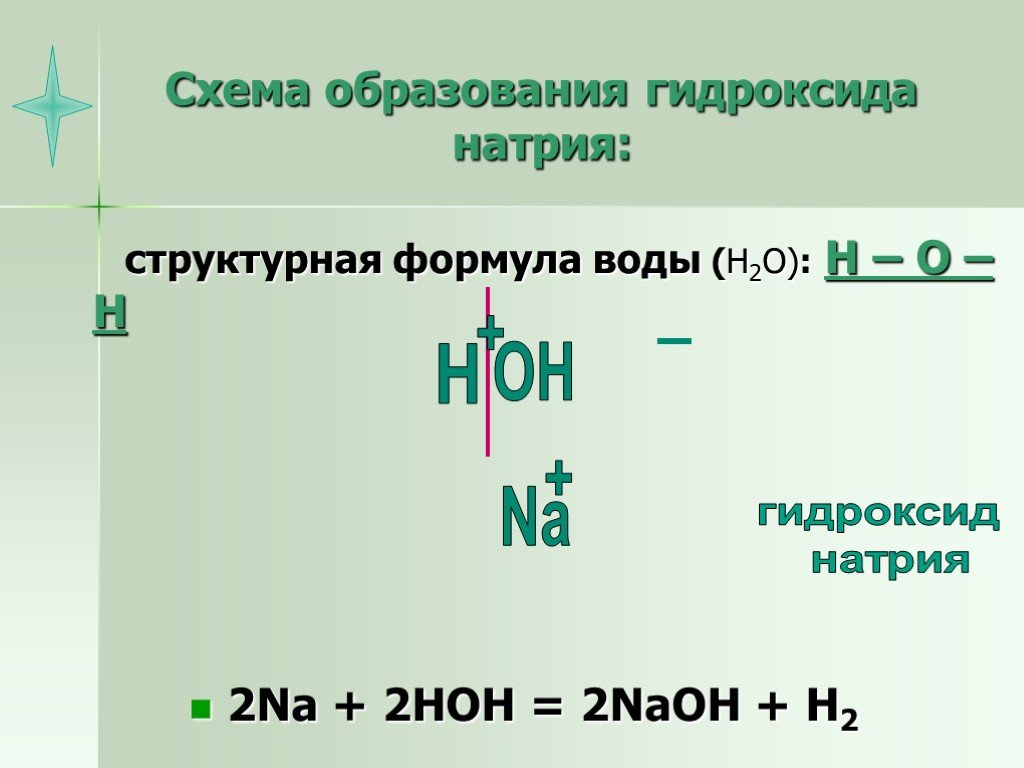
Проверьте свои знания
До трех значащих цифр чему равна массовая доля железа в соединении Fe 2 О 3 ?
Отвечать:
69,9% Fe
Определение эмпирических формул
Как упоминалось ранее, наиболее распространенный подход к определению химической формулы соединения состоит в том, чтобы сначала измерить массы составляющих его элементов. Однако имейте в виду, что химические формулы представляют собой относительные числа , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, касающиеся массы, должны использоваться для получения соответствующего количества атомов в соединении. Это достигается с помощью молярных масс для преобразования массы каждого элемента в число молей. Эти молярные количества используются для расчета целочисленных отношений, которые можно использовать для получения эмпирической формулы вещества. Рассмотрим образец соединения, который содержит 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях):
Рассмотрим образец соединения, который содержит 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях):
1,71 г C×1 моль C12,01 г C=0,142 моль C0,287 г H×1 моль h2,008 г H=0,284 моль h2,71 г C×1 моль C12,01 г C=0,142 моль C0,287 г H×1 моль h2,008 г H= 0,284 моль H
Таким образом, это соединение может быть представлено формулой C 0,142 H 0,284 . По соглашению, формулы содержат целые индексы, что можно получить, разделив каждый индекс на меньший индекс:
C0.1420.142H0.2840.142илиCh3C0.1420.142H0.2840.142илиCh3
(Напомним, что нижние индексы «1» не записываются, а скорее предполагаются, если нет другого числа.)
Эмпирическая формула для этого соединения, таким образом, CH 2 . Это может быть или не быть молекулярная формула соединения ; однако для принятия такого решения необходима дополнительная информация (как обсуждается далее в этом разделе).
Рассмотрим в качестве другого примера образец соединения, в котором определено содержание 5,31 г Cl и 8,40 г O. Следование тому же подходу дает предварительную эмпирическую формулу:
Следование тому же подходу дает предварительную эмпирическую формулу:
Cl0,150O0,525=Cl0,1500,150O0,5250,150=ClO3,5Cl0,150O0,525=Cl0,1500,150O0,5250,150=ClO3,5
В этом случае деление на наименьший нижний индекс по-прежнему оставляет нам десятичный нижний индекс в эмпирической формуле. Чтобы преобразовать это в целое число, умножьте каждый из нижних индексов на два, сохранив то же соотношение атомов и получив окончательную эмпирическую формулу Cl 2 O 7 .
Таким образом, эмпирические формулы выводятся из экспериментально измеренных масс элементов с помощью:
- Определение числа молей каждого элемента по его массе
- Деление молярного количества каждого элемента на наименьшее молярное количество, чтобы получить индексы для предварительной эмпирической формулы
- Умножение всех коэффициентов на целое число, если необходимо, чтобы получить наименьшее целочисленное отношение индексов
На рис.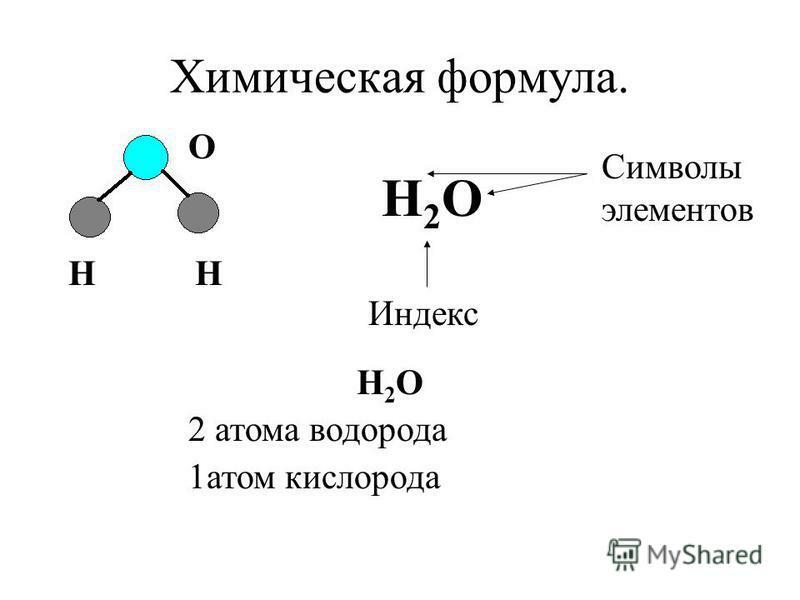 3.11 эта процедура показана в виде блок-схемы для вещества, содержащего элементы A и X.
3.11 эта процедура показана в виде блок-схемы для вещества, содержащего элементы A и X.
Рисунок 3.11 Эмпирическая формула соединения может быть получена из масс всех элементов в образце.
Пример 3.11
Определение эмпирической формулы соединения по массам его элементов
Образец черного минерала гематита (рис. 3.12), оксида железа, встречающегося во многих железных рудах, содержит 34,97 г железа и 15,03 г кислорода. Какова эмпирическая формула гематита?
Рисунок 3.12 Гематит — это оксид железа, используемый в ювелирных изделиях. (кредит: Мауро Катеб)
Решение
Эта задача дает массу в граммах каждого элемента. Начните с поиска родинок каждого:
34,97 г Fe(моль Fe55,85г)=0,6261моль Fe15,03г O(моль O16,00г)=0,9394моль O34,97г Fe(моль Fe55,85г)=0,6261моль Fe15,03г O(моль O16,00г) = 0,9394 моль O
Затем вычислите молярное отношение железа к кислороду, разделив его на меньшее число молей: 1,500 моль O
Отношение 1,000 моль железа к 1,500 моль кислорода (Fe 1 O 1,5 ). Наконец, умножьте это отношение на два, чтобы получить наименьшие возможные целые числовые индексы, сохраняя при этом правильное соотношение железа и кислорода:
Наконец, умножьте это отношение на два, чтобы получить наименьшие возможные целые числовые индексы, сохраняя при этом правильное соотношение железа и кислорода:
2(Fe1O1.5)=Fe2O32(Fe1O1.5)=Fe2O3
Эмпирическая формула Fe 2 O 3 .
Проверьте свои знания
Какова эмпирическая формула соединения, если образец содержит 0,130 г азота и 0,370 г кислорода?
Отвечать:
Н 2 О 5
Получение эмпирических формул из процентного состава
Наконец, что касается вывода эмпирических формул, рассмотрите случаи, когда доступен процентный состав соединения, а не абсолютные массы составляющих его элементов. В таких случаях процентный состав можно использовать для расчета массы элементов, присутствующих в любой удобной массе соединения; затем эти массы можно использовать для вывода эмпирической формулы обычным способом.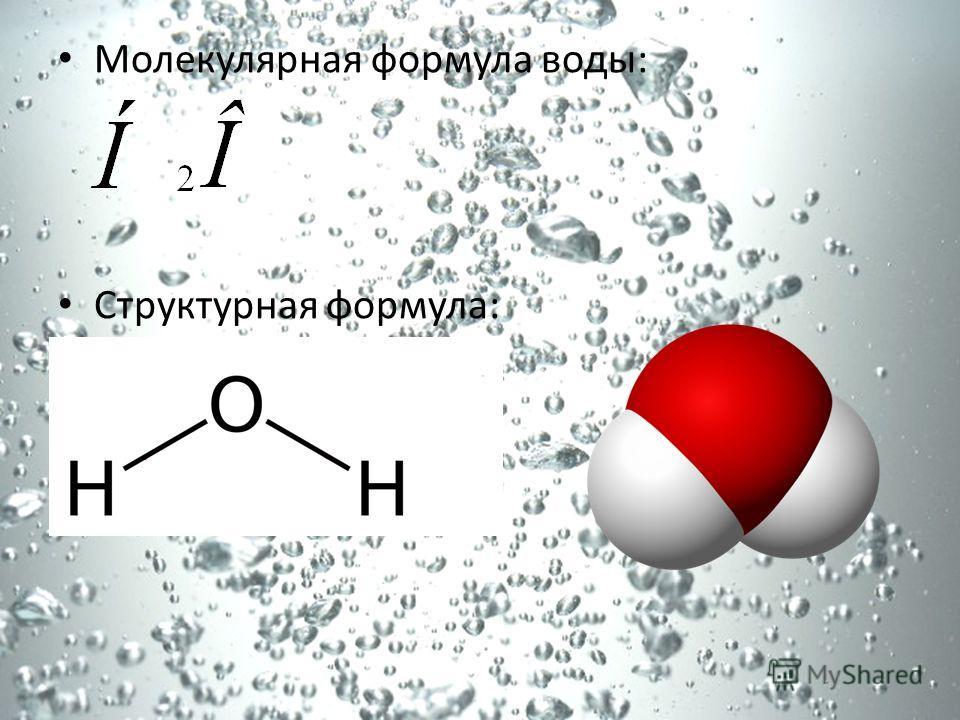
Пример 3.12
Определение эмпирической формулы из процентного состава
При бактериальном брожении зерна с образованием этанола образуется газ с процентным составом 27,29 % С и 72,71 % О (рис. 3.13). Какова эмпирическая формула этого газа?
Рисунок 3.13 Оксид углерода удаляется из этих бродильных чанов через большие медные трубы наверху. (кредит: «Dual Freq»/Wikimedia Commons)
Решение
Поскольку шкала для процентов равна 100, удобнее всего вычислять массу элементов, присутствующих в образце массой 100 г. Расчет «наиболее удобен», потому что, согласно определению процентного состава, масса данного элемента в граммах численно эквивалентна массовой доле элемента. Эта числовая эквивалентность является результатом определения единицы «процент», название которой происходит от латинской фразы per centum , означающей «на сто».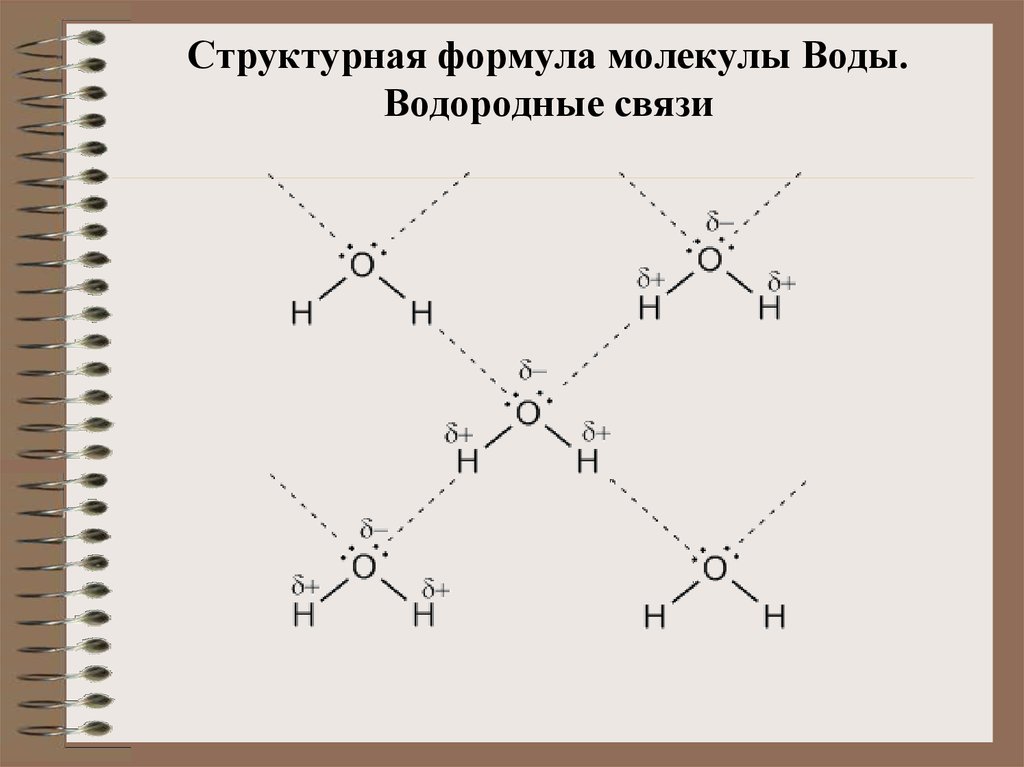 Принимая во внимание это определение, предоставленные массовые проценты могут быть более удобными выражены в виде дробей:
Принимая во внимание это определение, предоставленные массовые проценты могут быть более удобными выражены в виде дробей:
27,29%C=27,29г C100г соединения72,71%O=72,71г O100г соединения27,29%C=27,29г C100г соединения72,71%O=72,71г O100г соединения
Молярные количества углерода и кислорода в 100- г образца рассчитываются путем деления массы каждого элемента на его молярную массу:
27,29 г C (моль C12,01 г) = 2,272 моль C72,71 г O (моль O 16,00 г) = 4,544 моль O 27,29 г C (моль C 12,01 г) )=2,272 моль C72,71 г O(моль O16,00 г)=4,544 моль O
Коэффициенты для предварительной эмпирической формулы получают путем деления каждого молярного количества на меньшее из двух:
2,272 моль C2,272 = 14,544 моль O2,272 = 22,272 моль C2,272 = 14,544 моль O2,272 = 2
Поскольку полученное соотношение составляет один углерод к двум атомам кислорода, эмпирическая формула CO 2 .
Проверьте свои знания
Какова эмпирическая формула соединения, содержащего 40,0 % С, 6,71 % Н и 53,28 % О?
Отвечать:
СН 2 О
Вывод молекулярных формул
Напомним, что эмпирические формулы — это символы, представляющие относительные номеров элементов соединения.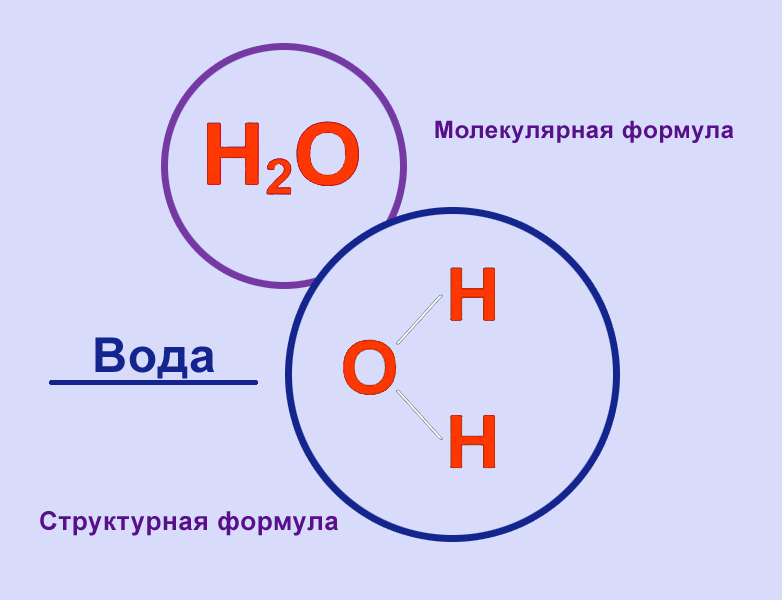 Определение абсолютного числа атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной или молярной массы. Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярную массу, например, часто получают из масс-спектра соединения (см. обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить рядом экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Определение абсолютного числа атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной или молярной массы. Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярную массу, например, часто получают из масс-спектра соединения (см. обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить рядом экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Молекулярные формулы получают путем сравнения молекулярной или молярной массы соединения с массой его эмпирической формулы. Как следует из названия, масса эмпирической формулы представляет собой сумму средних атомных масс всех атомов, представленных в эмпирической формуле. Если молекулярная (или молярная) масса вещества известна, ее можно разделить на массу эмпирической формулы, чтобы получить количество эмпирических формульных единиц на молекулу ( n ):
молекулярная или молярная масса(аму оргмоль)эмпирическая формула масса(аму оргмоль)=nформула единиц/молекуламолекулярная или молярная масса(аму оргмоль)эмпирическая формула масса(аму оргмоль)=nформула единиц/молекула
Молекулярная формула затем получается путем умножения каждого нижнего индекса в эмпирической формуле на n , как показано общей эмпирической формулой A x B y :
(AxBy)n=AnxBny(AxBy)n=AnxBny
Например, рассмотрим ковалентное соединение, эмпирическая формула которого определена как CH 2 O. Масса эмпирической формулы для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это указывает на то, что молекулы этого соединения содержат в шесть раз больше атомов, чем представлено в эмпирической формуле:
Масса эмпирической формулы для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это указывает на то, что молекулы этого соединения содержат в шесть раз больше атомов, чем представлено в эмпирической формуле:
180 а.е.м./молекула30 а.е.м. формульная единица = 6 формульных единиц/молекула180 а.е.м./молекула30 а.е.м. формульная единица = 6 формульных единиц/молекула
Молекулы этого соединения затем представлены молекулярными формулами, индексы которых в шесть раз больше, чем в эмпирической формуле:
(Ч3О)6=С6х22О6(Ч3О)6=С6х22О6
Обратите внимание, что этот же подход можно использовать, когда используется молярная масса (г/моль) вместо молекулярной массы (а.е.м.). В этом случае рассматривается один моль эмпирических формульных единиц и молекул, а не единичных единиц и молекул.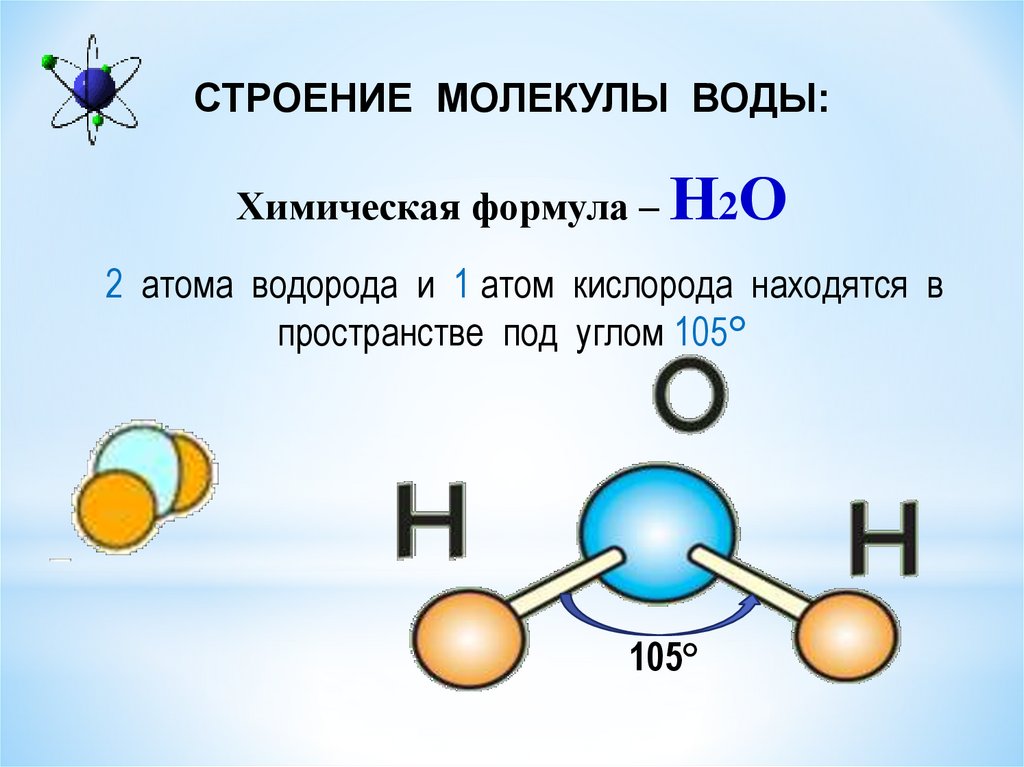
Пример 3.13
Определение молекулярной формулы никотина
Никотин, алкалоид растений семейства пасленовых, вызывающий привыкание к сигаретам, содержит 74,02 % С, 8,710 % Н и 17,27 % N. Если 40,57 г никотина содержат 0,2500 моль никотина, какова его молекулярная формула? ?
Раствор
Определение молекулярной формулы по предоставленным данным потребует сравнения массы эмпирической формулы соединения с его молярной массой. В качестве первого шага используйте процентный состав для получения эмпирической формулы соединения. Предположим, что 100-граммовый образец никотина дает следующие молярные количества его элементов:
(74,02 г C)(1 моль C12,01 г C)=6,163 моль C(8,710 г H)(1 моль ч2,008 г H)=8,641 моль H(17,27 г N)(1 моль N14,01 г N)=1,233 моль N (74,02 г C)(1 моль C12,01 г C)=6,163 моль C(8,710 г H)(1 моль ч2,008 г H)=8,641 моль H(17,27 г N)(1 моль N14,01 г N)=1,233 моль N
Затем рассчитайте молярные соотношения этих элементов относительно наименее распространенного элемента, N.