Биология для студентов — 13. Вода. Строение, свойства. Роль воды в клетке и организме
Из неорганических веществ, входящих в состав клетки, важнейшим является вода. Количество ее составляет от 60 до 95% общей массы клетки. Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того, что она входит в их состав, для многих организмов это еще и среда обитания.
Роль воды в клетке определяется ее уникальными химическими и физическими свойствами, связанными главным образом с малыми размерами молекул, с полярностью ее молекул и с их способностью образовывать друг с другом водородные связи.
Вода как компонент биологических систем выполняет следующие важнейшие функции:
- Вода—универсальный растворитель для полярных веществ, например солей, Сахаров, спиртов, кислот и др. Вещества, хорошо растворимые в воде, называются гидрофильными. Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно; соответственно возрастае реакционная способность вещества.

- Неполярные вещества вода не растворяет и не смешивается с ними, поскольку не может образовывать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными. Гидрофобные молекулы или их части отталкиваются водой, а в ее присутствии притягиваются друг к другу. Такие взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеинов вых кислот и ряда субклеточных структур.
- Вода обладает высокой удельной теплоемкостью. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода отличается
- Вода характеризуется высокой теплотой парообразования, т.
 е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма.
е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма. - Для воды характерно исключительно высокое поверхностное натяжение. Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в растениях
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
- У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
- Вода — составная часть смазывающих жидкостей (синовиальной — в суставах позвоночных, плевральной — в плевральной полости, перикардиальной — в околосердечной сумке) и слизей (облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей).

Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр.
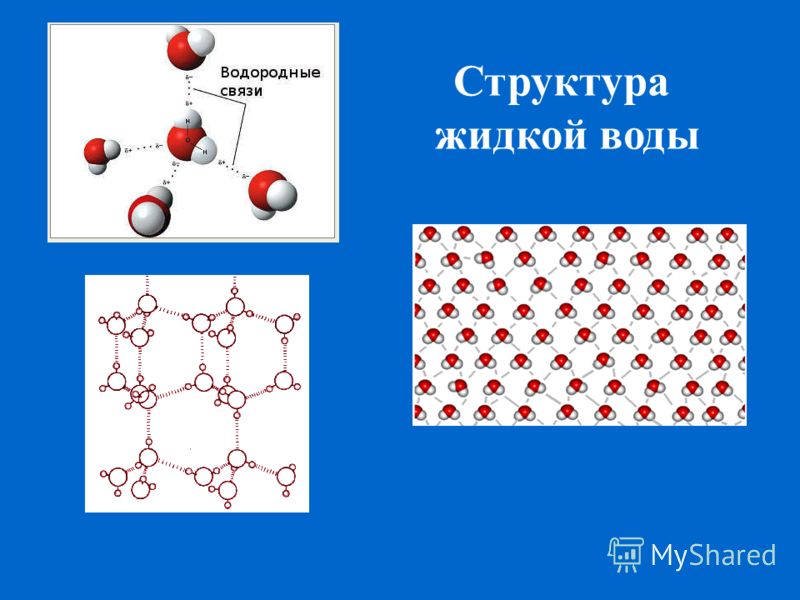
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь.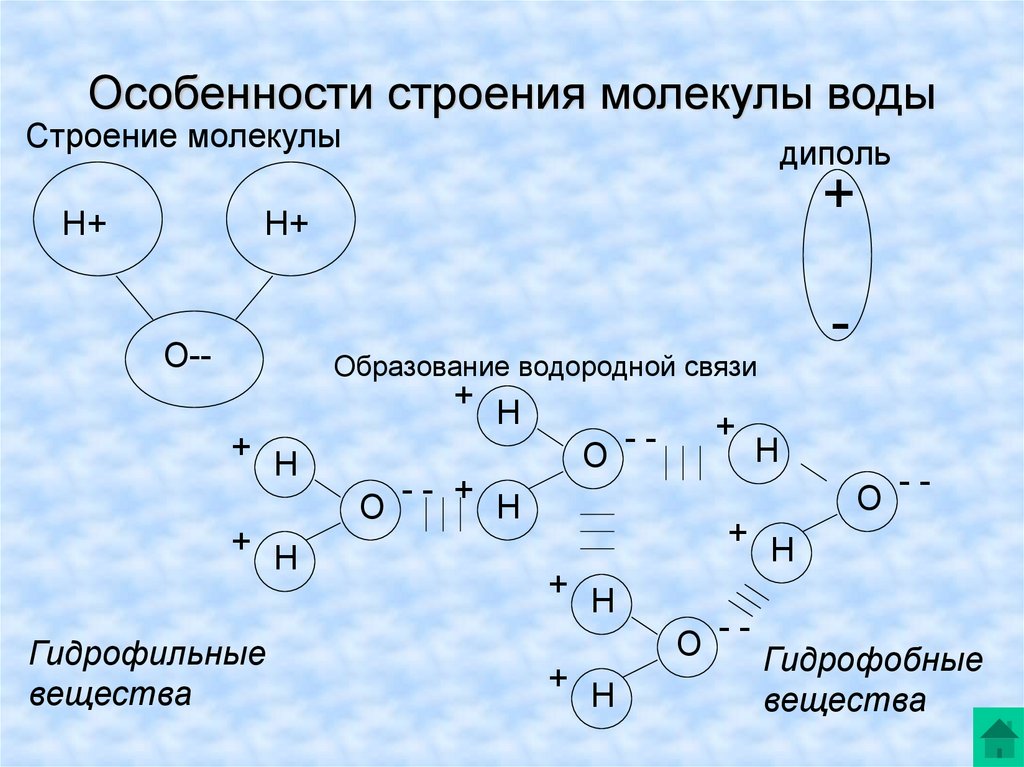 Всё это приводит к неоднородности в структуре воды.
Всё это приводит к неоднородности в структуре воды.
Когда в 20-е годы определили структуру льда, оказалось, что молекулы воды в кристаллическом состоянии образуют трёхмерную непрерывную сетку, в которой каждая молекула имеет четырёх ближайших соседей, расположенных в вершинах правильного тетраэдра. В 1933 году Дж. Бернал и П. Фаулер предположили, что подобная сетка существует и в жидкой воде.
В 1951 году Дж. Попл создал модель непрерывной сетки. Попл представлял воду как случайную тетраэдрическую сетку, связи между молекулами в которой искривлены и имеют различную длину.
Помимо модели Попла, возникли две группы „смешанных“ моделей: кластерные и клатратные. В первой группе вода представала в виде кластеров измолекул, связанных водородными связями, которые плавали в море молекул, в таких связях, не участвующих. Модели второй группы рассматривали воду как непрерывную сетку водородных связей, которая содержит пустоты; в них размещаются молекулы, не образующие связей с молекулами каркаса.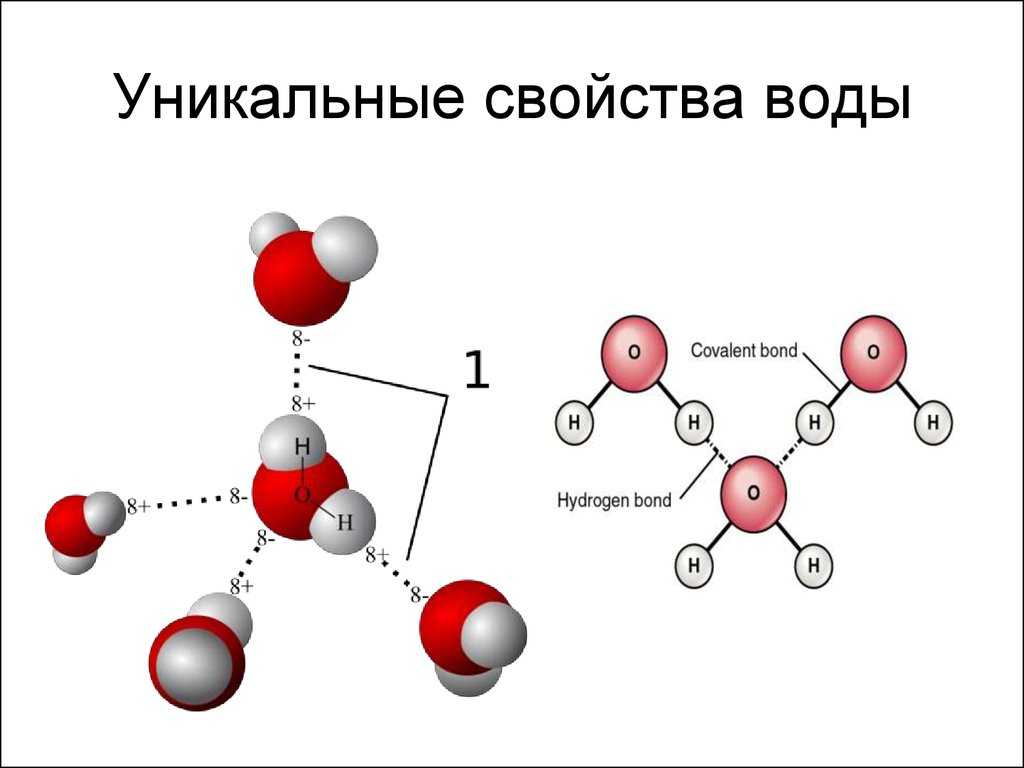
В 1999 г. известный российский исследователь воды С.В. Зенин защитил в Институте медико-биологических проблем РАН докторскую диссертацию, посвященную кластерной теории, которая явилась существенным этапом в продвижении этого направления исследований, сложность которых усиливается тем, что они находятся на стыке трех наук: физики, химии и биологии. Им на основании данных, полученных тремя физико-химическими методами: рефрактометрии (С.В. Зенин, Б.В. Тяглов, 1994), высокоэффективной жидкостной хроматографии (С.В. Зенин с соавт., 1998) и протонного магнитного резонанса (С.В. Зенин, 1993) построена и доказана
Сейчас наукой доказано, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.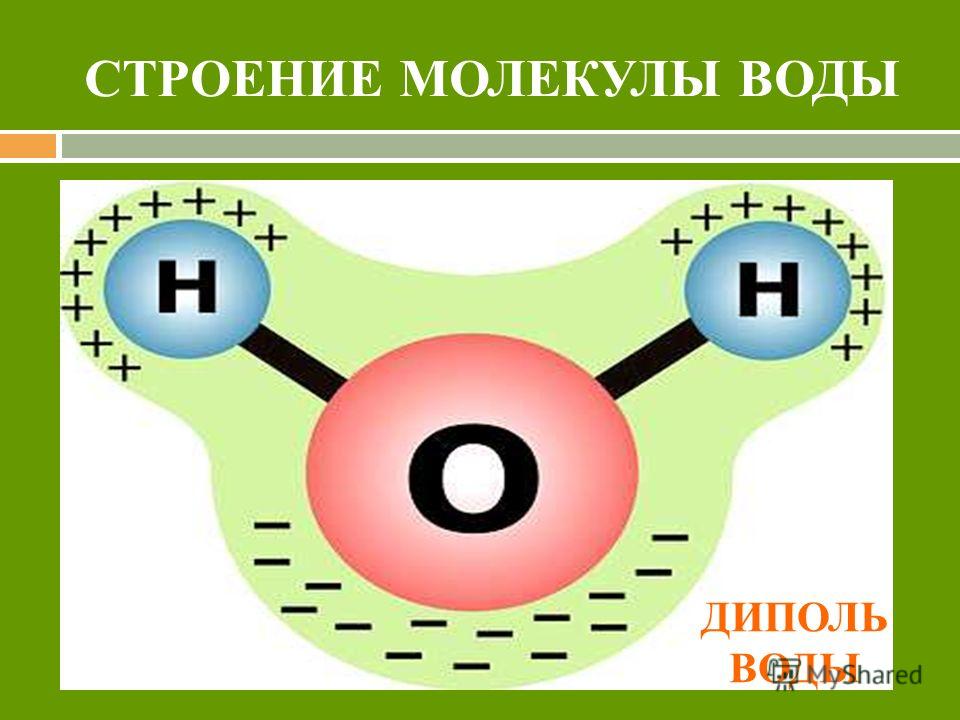
Структурной единицей такой воды является кластер, состоящий из клатратов, природа которых обусловлена дальними кулоновскими силами. В структуре кластров закодирована информация о взаимодействиях, имевших место с данными молекулами воды. В водных кластерах за счёт взаимодействия между ковалентными и водородными связями между атомами кислорода и атомами водорода может происходить миграция протона (Н+) по эстафетному механизму, приводящие к делокализации протона в пределах кластера.
Вода, состоящая из множества кластеров различных типов, образует иерархическую пространственную жидкокристаллическую структуру, которая может воспринимать и хранить огромные объемы информации.
Строение и свойства воды » Ремонт Строительство Интерьер
Вода является средой, в которой происходит разделение минералов при флотации. Все основные процессы прилипания минеральных частиц к пузырькам, все физико-химические свойства поверхностей частиц и применяемых реагентов не могут не находиться в теснейшей зависимости от свойств воды.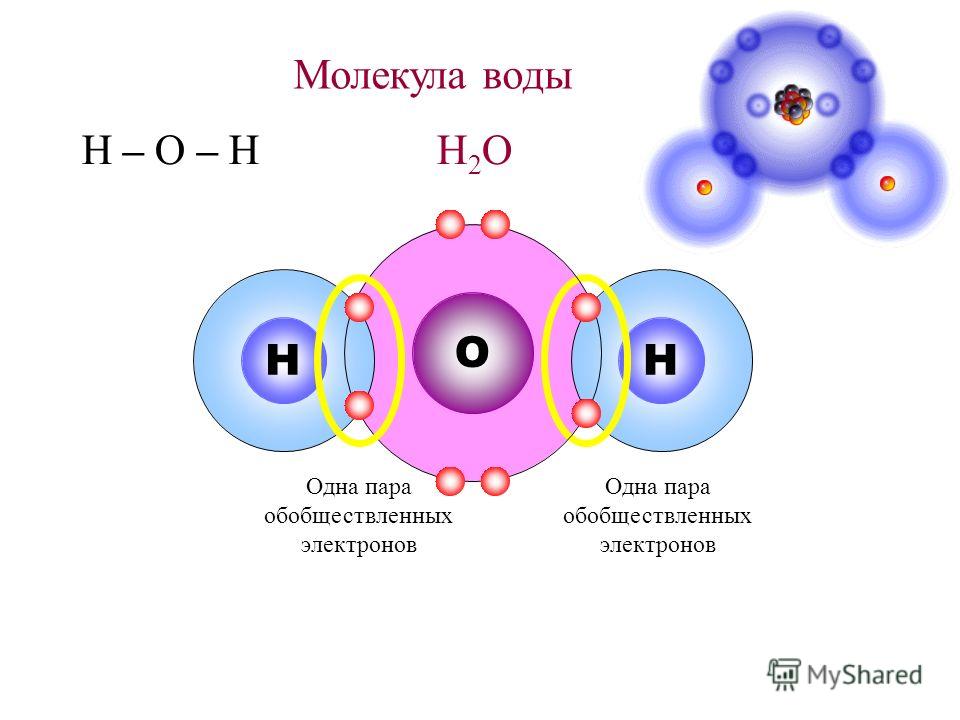
Следует отметить, что учет свойств воды при анализе флотационных явлений до нашей работы практически отсутствовал и в теоретической и в учебной литературе.
Строение воды. Спектроскопическими исследованиями установлена схема строения отдельной молекулы воды (рис. 3). Однако, по данным квантовой механики, структура молекулы воды является гораздо более сложной (рис. 4). Связь атомов водорода с атомом, кислорода создается в том направлении, в котором возможно наибольшее перекрывание электронных облаков, наибольшее увеличение плотности электрического заряда. Два электрона атома кислорода образуют два электронных облака в виде «восьмерки»; электроны водорода образуют сферические облака, перекрывающие эти «восьмерки».
Очень важно иметь в виду, что вода состоит из отдельных, связанных один с другим ионов, имеющих различные заряды.
Упрощенно считают, что вода состоит из H+ и ОН’-ионов. Более детальным анализ приводит к иному выводу. Поскольку ион Н очень мал, сильно деформирует ионную оболочку растворителя и даже входит внутрь этой оболочки, можно считать, что в растворах присутствует ион гидроксония, образующийся по следующей реакции:
Поскольку ион Н очень мал, сильно деформирует ионную оболочку растворителя и даже входит внутрь этой оболочки, можно считать, что в растворах присутствует ион гидроксония, образующийся по следующей реакции:
Ионы h4O+ и ОН- отличаются высокой подвижностью.
Современная теория жидкого состояния отличается от прежних, основанных на аналогии между жидким и газообразным состоянием, тем, что сближает жидкое состояние при температурах, не слишком далеких от точки кристаллизации, с твердым (кристаллическим) состоянием.
Являясь фазой, промежуточной между твердой и газообразной, жидкость, в частности вода, имеет непрерывный ряд переходных свойств. В области высоких температур эти свойства примыкают к свойствам газов, в области низких температур и малых удельных объемов — к свойствам твердых тел.
По Берналу и Фаулеру, при обычных температурах и давлениях молекулы воды «упакованы» в тетраэдры (рис. 5). Ho эти тетраэдры связываются различно в зависимости от температуры. Так, при температуре от 4 до 150° имеется «кварцеподобная» структура; при температуре от 0 до 4° и в переохлажденной воде эта структура переходит в «тридимитную» (как у льда). Лед, существующий в интервале температур от 0 до -8°, имеет четкую тридимитную структуру. Каждый атом кислорода окружен тетраэдрически четырьмя другими атомами кислорода.
Так, при температуре от 4 до 150° имеется «кварцеподобная» структура; при температуре от 0 до 4° и в переохлажденной воде эта структура переходит в «тридимитную» (как у льда). Лед, существующий в интервале температур от 0 до -8°, имеет четкую тридимитную структуру. Каждый атом кислорода окружен тетраэдрически четырьмя другими атомами кислорода.
Гидратация ионов. Псевдокристаллическая структура воды в случае отсутствия каких-либо внешних электрических воздействий распространяется на ее малые объемы, содержащие десятки и сотни молекул. Предполагается, что при этом структуры очень неустойчивы. Ввиду непрерывного перераспределения молекул каждая их группа существует в течение очень короткого отрезка времени.
Ho такое состояние воды, т. е. полное отсутствие в ней каких-либо посторонних ионов и молекул, является предельно идеализированным. Наличие же в воде какого-либо иона приводит к мгновенному образованию вокруг него уплотненной атмосферы диполей воды, к гидратации иона.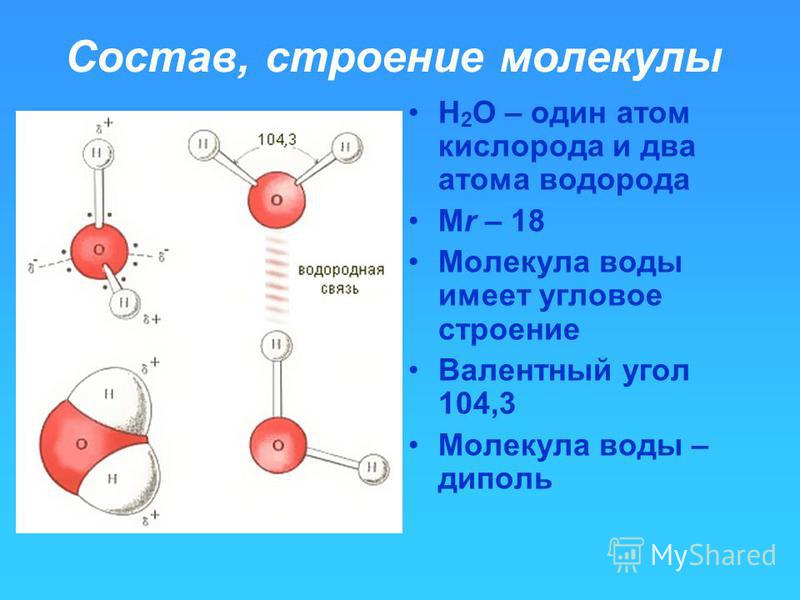
Образование гидратных оболочек по существу означает, что энергия связи между ионом и диполями воды больше, чем в случае взаимопритяжения этих диполей. Энергия гидратации иона увеличивается при переходе к ионам высшей валентности, а в пределах рядов одной валентности при уменьшении ионного радиуса (поскольку в этих случаях увеличивается плотность заряда на поверхности иона) (табл. 4).
В общем случае энергия гидратации иона H характеризуется уравнением:
где е — заряд иона;
r — радиус иона;
D — диэлектрическая постоянная среды.
Энергия гидратации отдельных ионов приведена в табл. 4.
Имеется ряд методов расчета гидратации ионов. В общих чертах установлено, что поливалентные катионы гидратируются чаше всего шестью — восемью молекулами воды; анионы обычно гидратированы значительно слабее.
При растворении минералов суммарная энергия гидратации превосходит энергию решетки минералов и переводит составляющие ее ионы в раствор.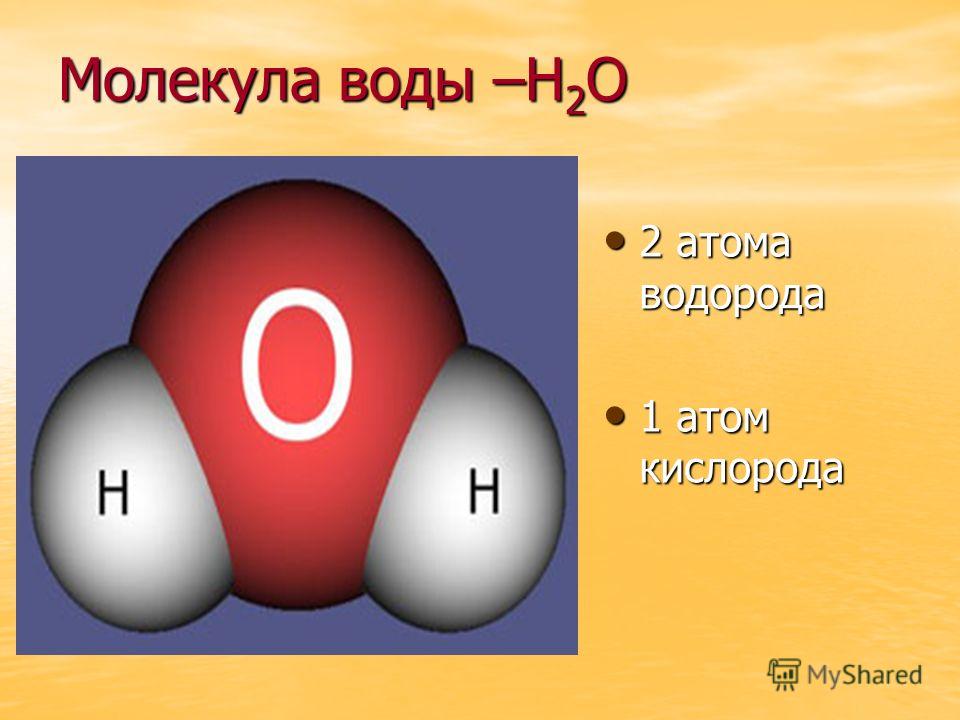
Для дальнейшего рассмотрения процесса прилипания минеральных частиц к пузырькам важно отметить диффузное строение гидратных оболочек. Молекулы воды, наиболее близкие к иону, строго ориентированы в пространстве. По мере удаления от иона правильность ориентации уменьшается. Причина этого заключается не только в ослаблении действия силового поля иона, но и в тепловом движении молекул воды, препятствующем их ориентации. На известном расстоянии от иона степень ориентации молекул воды не отличается от той, которая существует у остальной массы воды. Таким образом, периферическая часть гидратных слоев постепенно переходит в неизмененную воду.
Формирование гидратных оболочек вокруг молекул целиком определяется их полярностью. Полярные молекулы гидратируются наиболее значительно, аполярные — крайне слабо. Молекулы, имеющие в составе полярную и аполярную группы, в отдельных своих частях гидратируются различно.
За последние годы проведены исследования (особенно Самойловым), значительно развивающие и в то же время усложняющие указанные представления. Согласно этим исследованиям, явление гидратации ионов в водных растворах нельзя рассматривать, основываясь на представлении о связывании ионами какого-либо числа молекул воды. Гораздо более правильно расценивать гидратацию по влиянию ионов на тепловое движение ближайших к ним молекул воды. Это тепловое движение складывается из двух видов: а) колебаний молекул воды около некоторых временных положений равновесия; б) так называемого трансляционного движения — скачкообразного перемещения молекул из одного положения равновесия в другое. Установлено, что ионы различно влияют на вязкость воды: небольшие одно- и многозарядные ионы увеличивают вязкость, большие однозарядные — снижают ее. Следовательно, ионы различно действуют на трансляционное движение ближайших к ним молекул воды. В первом случае ионы (Mg2+. Ca2+ и др.) ослабляют это движение, во втором (К+, Cl- и др.) — усиливают. Самойлов полагает, что в последнем случае подвижность молекул воды вблизи ионов увеличивается по сравнению с подвижностью в чистой воде.
Согласно этим исследованиям, явление гидратации ионов в водных растворах нельзя рассматривать, основываясь на представлении о связывании ионами какого-либо числа молекул воды. Гораздо более правильно расценивать гидратацию по влиянию ионов на тепловое движение ближайших к ним молекул воды. Это тепловое движение складывается из двух видов: а) колебаний молекул воды около некоторых временных положений равновесия; б) так называемого трансляционного движения — скачкообразного перемещения молекул из одного положения равновесия в другое. Установлено, что ионы различно влияют на вязкость воды: небольшие одно- и многозарядные ионы увеличивают вязкость, большие однозарядные — снижают ее. Следовательно, ионы различно действуют на трансляционное движение ближайших к ним молекул воды. В первом случае ионы (Mg2+. Ca2+ и др.) ослабляют это движение, во втором (К+, Cl- и др.) — усиливают. Самойлов полагает, что в последнем случае подвижность молекул воды вблизи ионов увеличивается по сравнению с подвижностью в чистой воде.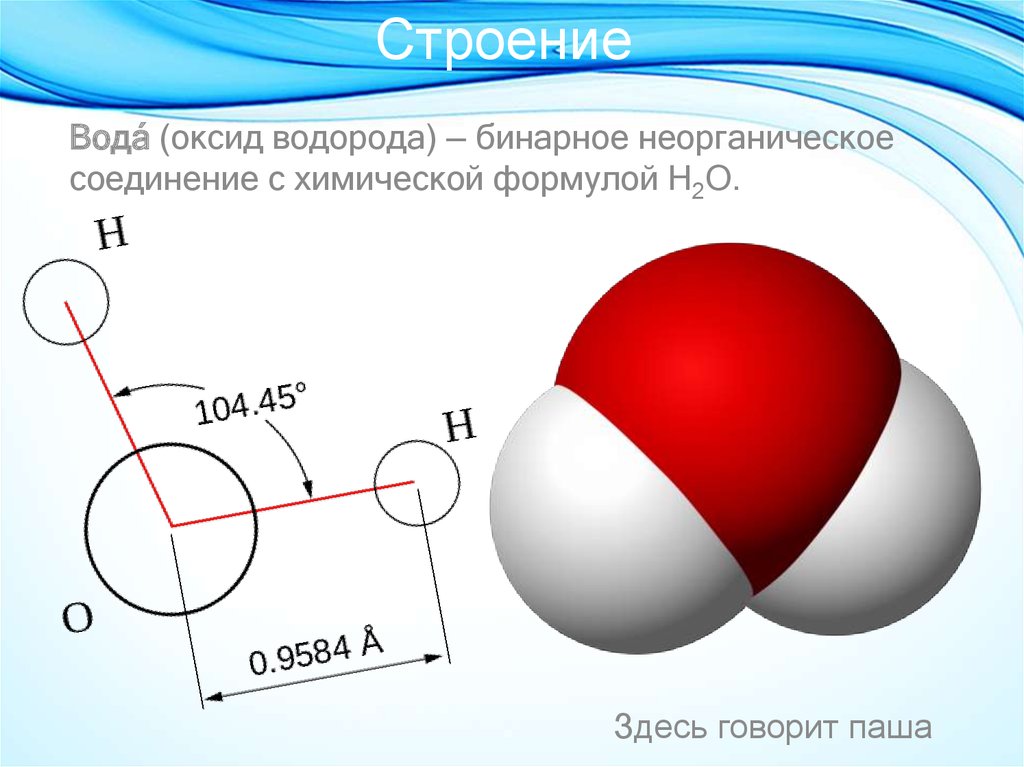
Гидратация является экзотермическим процессом. При формировании внутренних слоев гидратных оболочек выделяется большее количество тепла, а при формировании наружных слоев — все меньшее и меньшее. При повышении температуры гидратация уменьшается. Это объясняется тем, что вращательное тепловое движение молекул воды препятствует их ориентации. Связь гидратации с температурой свидетельствует о неточности имеющегося в большинстве работ допущения изотермичности процессов смачивания. Снижение гидратации поверхностей минералов с повышением температуры обусловливает улучшение флотируемости минералов при более высоких температурах. Однако в последнем случае также изменяется целый ряд факторов — растворимость минералов, их взаимодействие с реагентами и т. п., что также влияет на флотируемость минералов. Влияние температуры на флотацию должно всегда рассматриваться с учетом конкретных условий.
Гидратные слои вследствие упорядоченности в них диполей воды обладают целым рядом аномальных свойств, которые распространяются на большие толщины этих слоев (до сотен и тысяч ангстремов). При рассмотрении флотационных явлений надо учитывать, что с возрастанием правильности и устойчивости ориентации диполей воды она теряет свои растворяющие свойства, так как растворяющая способность воды находится в тесной связи с гидратированностью растворенных ионов. Если диполи воды уже поляризованы, то гидратация ими новых ионов затрудняется. Точно так же в поляризованной воде ухудшаются условия диффузии ионов. Как следствие этих свойств Гуревич, а затем Никифоров установили, что именно гидратная оболочка уменьшает адсорбцию веществ на твердой поверхности, в частности на поверхности кварца.
При рассмотрении флотационных явлений надо учитывать, что с возрастанием правильности и устойчивости ориентации диполей воды она теряет свои растворяющие свойства, так как растворяющая способность воды находится в тесной связи с гидратированностью растворенных ионов. Если диполи воды уже поляризованы, то гидратация ими новых ионов затрудняется. Точно так же в поляризованной воде ухудшаются условия диффузии ионов. Как следствие этих свойств Гуревич, а затем Никифоров установили, что именно гидратная оболочка уменьшает адсорбцию веществ на твердой поверхности, в частности на поверхности кварца.
Растворимость минералов в воде определяет ее ионный состав. В общем минералы растворяются за счет преодоления энергией гидратации энергии кристаллической решетки. По мере расходования молекул воды на образование гидратных оболочек вокруг оторвавшихся от кристалла ионов растворение замедляется; обратный же процесс выделения ионов в кристаллы с увеличением концентрации возрастает
Скорость растворения зависит от природы минерала, температуры пульпы, интенсивности ее перемешивания и удельной поверхности минеральных частиц, а также от ионного состава воды.
Интенсивность перемешивания определяет удаление перешедших в раствор ионов от поверхности частицы. Удельная поверхность частиц определяет площадь их контакта с водой и, следовательно, количество ионов, переходящих в раствор в единицу времени.
Перемешивание и удельная поверхность частиц не влияют на собственно растворимость (как это ошибочно указывается в некоторых теоретических работах). Равновесная концентрация не зависит от перемешивания пульпы или удельной поверхности частиц, но они влияют на время, необходимое для достижения нужной концентрации.
Температура пульпы и размеры частиц, наоборот, определяют не только кинетику растворения, но и равновесную концентрацию растворенного вещества. В подавляющем большинстве случаев растворимость минералов в воде возрастает с повышением температуры, поскольку при этом усиливаются колебательные движения частиц в кристаллической решетке и ослабляются силы притяжения между нонами (что облегчает разрушение решетки водой).
Согласно известному в физической химии уравнению, устойчивость закрепление на поверхности частицы атомов и ионов зависит от радиуса кривизны ее поверхности:
где р’ — упругость пара частицы;
р — упругость пара в растворе;
r — радиус частицы;
о — поверхностное натяжение частицы;
M — молекулярный вес;
b — плотность жидкости.
Из этого уравнения видно, что чем мельче частицы, тем больше упругость их пара и, следовательно, растворимость. Заметное увеличение растворимости отмечается лишь при высокой степени измельчения минералов. Так, например, частицы гипса размером в 2u имеют растворимость, равную 15,3 мг/л воды, а при размере в 0,3 и 18,2. Растворимость частиц барита размером в 1,8 и равна 2,29 мг/л, а частиц размером 0,1 u равна 4,15 мг/л. Влияние повышения растворимости минералов с уменьшением размеров их частиц должно учитываться только при установлении поведения тонкодисперсных шламов.
Для характеристики растворов и химических реакций в воде большое значение имеет ионное равновесие и произведение растворимости. Протекание химической реакции в растворе возможно только в том случае, если при столкновении ионов могут образовываться молекулы, в которых силы сцепления между атомами достаточны для того, чтобы противостоять силам гидратации. Обязательным условием осуществления реакции в растворе является удаление ионов из раствора в виде малодиссоциированных молекул труднорастворимого вещества (выпадающего из раствора в осадок) или газа. Количественные расчеты, позволяющие определить возможность протекания реакции, основаны на расчете произведения растворимости. Общим положением для насыщенного раствора малорастворимого вещества сильного электролита является постоянство произведения молярных концентраций ионов. Для того чтобы реакция протекала в данном направлении, необходимо, чтобы уменьшилось произведение растворимости. Это положение широко используется при определении возможности взаимодействия реагентов с минералами.
Количественные расчеты, позволяющие определить возможность протекания реакции, основаны на расчете произведения растворимости. Общим положением для насыщенного раствора малорастворимого вещества сильного электролита является постоянство произведения молярных концентраций ионов. Для того чтобы реакция протекала в данном направлении, необходимо, чтобы уменьшилось произведение растворимости. Это положение широко используется при определении возможности взаимодействия реагентов с минералами.
Однако далеко не всегда оно используется правильно, так как часто понятие «произведение растворимости» подменяется понятием «растворимость продуктов реакции», что далеко не одно и то же.
Растворимость отдельных минералов в воде в значительной степени зависит от того, какой минеральный комплекс имеется в наличии в данном случае. Если в растворе имеются ионы, близкие к ионам данного минерала, то растворимость этого минерала снижается. Наоборот, присутствие «посторонних» ионов увеличивает растворимость минералов.
Примеси, содержащиеся в воде. В результате контакта с минералами в воде имеются различные примеси — коллоидные взвеси и ионы. Химический состав природных вод весьма сложен и различен. По Алекину, химические примеси в воде делятся на следующие группы: а) растворенные газы; б) главнейшие ионы; в) биогенные вещества; г) микроэлементы; д) органические вещества. Наиболее существенными ионами природных вод являются ионы: хлоридные Cl-, сульфатные SO42-, гидрокарбонатные НСО3-, карбонатные CO3-, натрия Na+, калия K+, кальция Ca2+, магния Mg2+, водорода H+, железа Fe2+, Fe3+.
Для флотационной характеристики воды известное значение имеет так называемая «жесткость», т. е. содержание в воде суммы многозарядных катионов, измеряемая так называемыми миллиграмм-эквивалентами (мг*экв). 1 мг*экв жесткости соответствует содержанию 20,04 мг/л Ca и 12,16 мг/л Mg. Градации воды по жесткости приведены в табл. 5.
Соли жесткости влияют на взаимодействие минералов с реагентами и в ряде случаев связывают реагенты в нерастворимые соединения.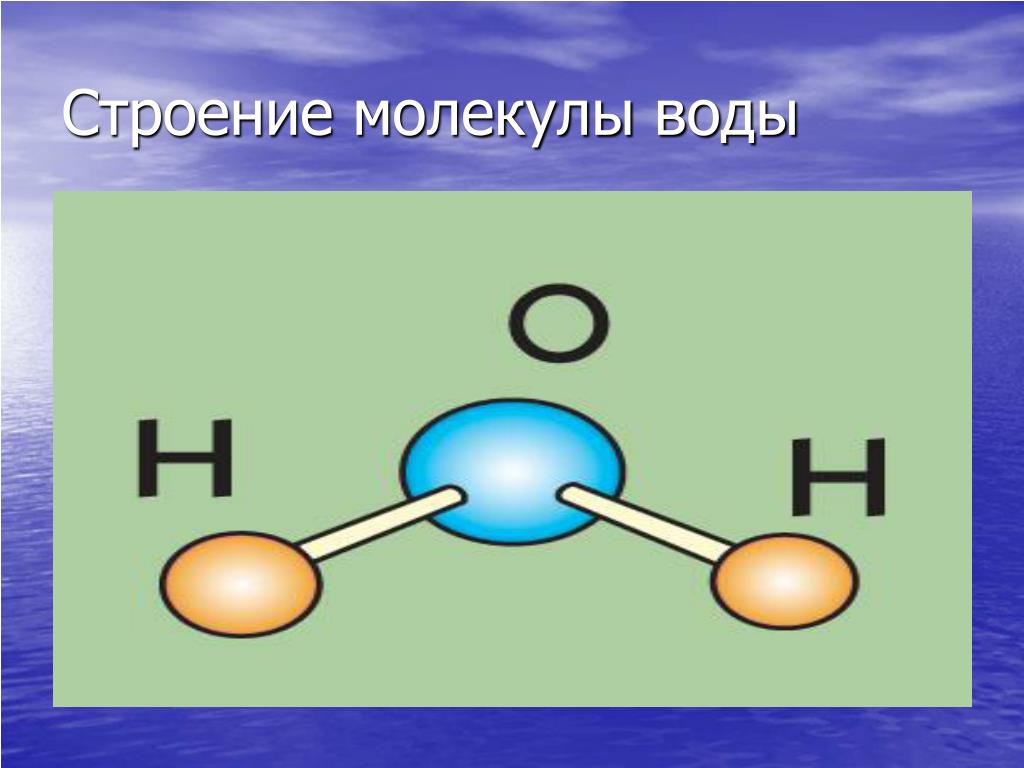 Действие отдельных катионов может быть при этом весьма специфичным. Растворимость минералов различна и часто бывает значительной. К настоящему времени не накоплены данные, позволяющие точно учесть растворение минералов, происходящее в каждом конкретном случае. Имеющиеся данные о растворимости минералов относятся к чистой воде. Как было отмечено выше, растворимость минерала при наличии в воде других растворенных веществ изменяется весьма существенно. Так, присутствие в воде 10 г/л хлористого магния увеличивает растворимость барита в 14 раз. Сильное влияние на растворимость минералов оказывает pH среды, присутствие растворенных газов и т. п.
Действие отдельных катионов может быть при этом весьма специфичным. Растворимость минералов различна и часто бывает значительной. К настоящему времени не накоплены данные, позволяющие точно учесть растворение минералов, происходящее в каждом конкретном случае. Имеющиеся данные о растворимости минералов относятся к чистой воде. Как было отмечено выше, растворимость минерала при наличии в воде других растворенных веществ изменяется весьма существенно. Так, присутствие в воде 10 г/л хлористого магния увеличивает растворимость барита в 14 раз. Сильное влияние на растворимость минералов оказывает pH среды, присутствие растворенных газов и т. п.
Вторичные процессы изменения минералов обычно приводят к значительному повышению их растворимости. При выветривании полевых шпатов образуются хорошо растворимые соли, способствующие насыщению раствора ионами НСО3-, Ca2+, Mg2+ и K+, а также производными кремневой кислоты. В результата окисления сульфидов тяжелых металлов получаются сульфаты металлов или серная кислота, что сильно способствует увеличению растворения минералов.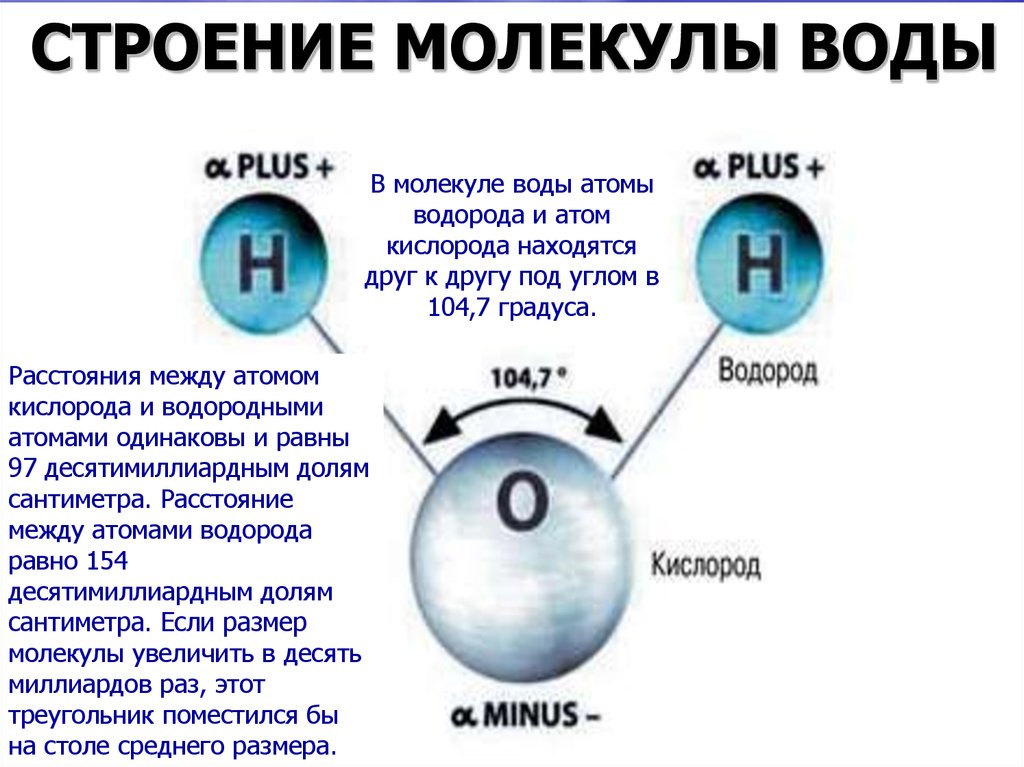 Для иллюстрации высокой растворимости минералов, кажущихся на первый взгляд нерастворимыми, в табл. 6 приведены данные Эйгелеса.
Для иллюстрации высокой растворимости минералов, кажущихся на первый взгляд нерастворимыми, в табл. 6 приведены данные Эйгелеса.
Данные таблицы показывают, что количество ионов, переходящее в раствор, очень велико и соизмеримо с расходом реагентов-регуляторов, специально добавляемых к пульпе при флотации.
Влияние ионного состава воды обязательно должно учитываться при анализе действия реагентов при флотации.
Эти ионы, названные Эйгелесом «неизбежными», могут изменять флотационные свойства минералов. Так, если совершенно чистый кварц не взаимодействует с собирателями типа жирных кислот, то присутствие в воде ничтожно малых количеств ионов кальция, магния, меди, железа и др. резко активирует это взаимодействие. Ионы меди, переходящие в воду при растворении медных минералов, активируют флотацию сфалерита ксантогенатом и т. п.
Вода, что такое вода? О науке, химии и структуре
Вода имеет химическую формулу h3O, состоящую из двух атомов водорода и одного атома кислорода. В науке его часто называют универсальным растворителем. Вода — единственное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях: твердом; жидкость и газ. Вода может принимать разные формы; твердое состояние воды обычно называют льдом или аморфной твердой водой; газообразное состояние известно как водяной пар или пар; а общую жидкую фазу обычно называют просто водой.
В науке его часто называют универсальным растворителем. Вода — единственное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях: твердом; жидкость и газ. Вода может принимать разные формы; твердое состояние воды обычно называют льдом или аморфной твердой водой; газообразное состояние известно как водяной пар или пар; а общую жидкую фазу обычно называют просто водой.
Важной особенностью воды является ее полярная природа. Молекула воды образует угол с атомами водорода на концах и кислородом в вершине. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Молекула с такой разностью зарядов называется диполем. Различия зарядов заставляют молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям) и к другим полярным молекулам. Это притяжение известно как водородная связь и объясняет многие свойства воды. Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше тепловой энергии, чтобы разорвать водородные связи между молекулами. Водородная связь также придает воде необычное поведение при замерзании. При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше тепловой энергии, чтобы разорвать водородные связи между молекулами. Водородная связь также придает воде необычное поведение при замерзании. При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
Вода также является хорошим растворителем благодаря своей полярности. Когда ионное или полярное соединение входит в воду, оно окружено молекулами воды. Относительно небольшой размер молекул воды обычно позволяет многим молекулам воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным дипольным концам.
Обычно ионные и полярные вещества, такие как кислоты, спирты и соли, относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, — нет. Неполярные молекулы остаются вместе в воде, потому что молекулам воды энергетически выгоднее связываться водородными связями друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; хлорид натрия, NaCl, разделяется на катионы Na+ и анионы Cl-, каждый из которых окружен молекулами воды. Затем ионы легко переходят из своей кристаллической решетки в раствор. Примером неионогенного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (ОН-группами) и позволяют ему уноситься в раствор.
Относительно небольшой размер молекул воды обычно позволяет многим молекулам воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным дипольным концам.
Обычно ионные и полярные вещества, такие как кислоты, спирты и соли, относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, — нет. Неполярные молекулы остаются вместе в воде, потому что молекулам воды энергетически выгоднее связываться водородными связями друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; хлорид натрия, NaCl, разделяется на катионы Na+ и анионы Cl-, каждый из которых окружен молекулами воды. Затем ионы легко переходят из своей кристаллической решетки в раствор. Примером неионогенного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (ОН-группами) и позволяют ему уноситься в раствор.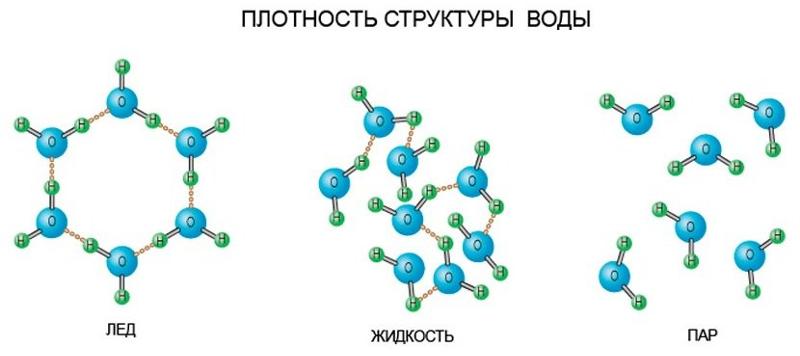 Растворяющие свойства воды жизненно важны в биологии, поскольку многие биохимические реакции протекают только в водных растворах (например, реакции в цитоплазме и крови).
Растворяющие свойства воды жизненно важны в биологии, поскольку многие биохимические реакции протекают только в водных растворах (например, реакции в цитоплазме и крови).
Официальное химическое название (IUPAC)
вода
Ссылки
http://en.wikipedia.org/wiki/Water_%28molecule%29
http://www.dhmo.org/
нажмите на изображение воды выше, чтобы взаимодействовать
с 3D-моделью
Водное сооружение
(откроется новое окно браузера)
Обновление Карла Харрисона
(Молекула месяца для
январь 2006 г.
)
Все изображения на этом веб-сайте доступны с лицензией Creative Commons Attribution, поэтому их можно использовать до тех пор, пока вместе с изображением указано авторство © Karl Harrison 3DChem.com. Изображения и иллюстрации в высоком разрешении предоставляются по запросу.
Структура молекулы воды
Вода — основа жизни на Земле. Он повсюду вокруг нас и покрывает почти три четверти поверхности Земли. В известных стихотворениях, таких как «Иней древнего мореплавателя», говорится о его важности для обеспечения нашей жизни. Вода составляет более половины человеческого тела.
В известных стихотворениях, таких как «Иней древнего мореплавателя», говорится о его важности для обеспечения нашей жизни. Вода составляет более половины человеческого тела.
По своей сути это живительное соединение, которое мы легко находим в любом месте, представляет собой особую молекулу с уникальной структурой. Структура молекулы воды — одна из первых структур, о которых мы узнаем. Это просто, но увлекательно. Вода обладает как обычными, так и некоторыми необычными свойствами, но все эти свойства можно объяснить, если посмотреть на строение молекул воды.
Как устроена молекула воды?Вода — это один из двух оксидов, образующихся при взаимодействии водорода с кислородом, второй — перекись водорода. h3O — это соединение, которое образуется при взаимодействии водорода с кислородом. Наиболее распространенным способом образования воды является сжигание.
Структура молекулы воды состоит из трех атомов, двух атомов водорода и одного кислорода.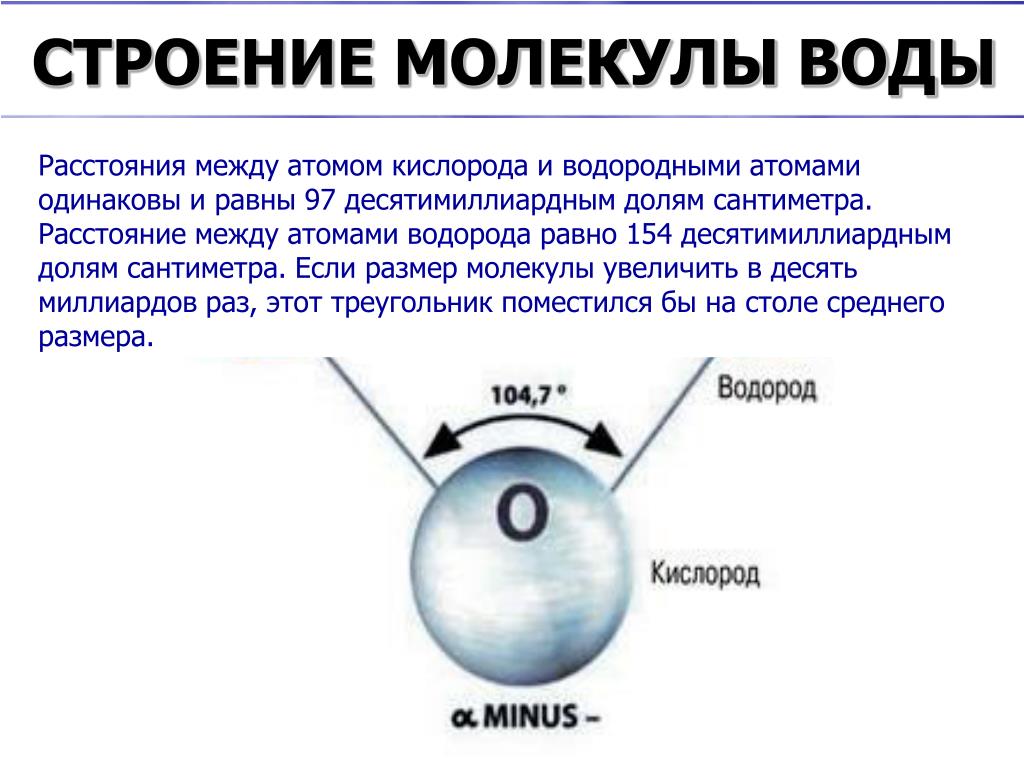 Связи, которые образуются между атомом водорода и атомом кислорода, носят полярный характер из-за высокой электроотрицательности кислорода. Высокая электроотрицательность означает, что молекула кислорода имеет врожденную тенденцию сильно притягивать общую пару электронов, когда она находится в ковалентной связи.
Связи, которые образуются между атомом водорода и атомом кислорода, носят полярный характер из-за высокой электроотрицательности кислорода. Высокая электроотрицательность означает, что молекула кислорода имеет врожденную тенденцию сильно притягивать общую пару электронов, когда она находится в ковалентной связи.
Сначала нам нужно увидеть тип связи, которую образуют водород и кислород, чтобы понять это. Водород имеет валентность 1, поэтому ему требуется еще 1 электрон, чтобы заполнить заполненную оболочку и стать стабильным. С другой стороны, кислород имеет 6 валентных электронов на внешней оболочке и, следовательно, имеет валентность 2, поскольку для достижения заполненной оболочки и достижения стабильности требуется 8 электронов.
Следовательно, кислород связывается с двумя атомами водорода. Атомы водорода делят свои электроны с кислородом, создавая заполненные оболочки для всех трех атомов. Это приводит к ковалентной связи. Ковалентная связь — это связь, в которой электроны принадлежат двум атомам, связанным друг с другом.
Структура молекулы воды состоит из двух атомов водорода, связанных с одним атомом кислорода. Атомы водорода и кислорода связаны ковалентной связью, созданной за счет общей пары электронов. Атом кислорода имеет более высокую электроотрицательность по сравнению с атомом водорода, а это означает, что электроны в ковалентной связи больше притягиваются к атому кислорода, чем к атому водорода.
Это создает дисбаланс заряда этих молекул. Из-за того, что электроны находятся дальше от атома водорода, оба атома водорода в структуре молекулы воды приобретают частичный положительный заряд, обозначаемый +. Это означает, что атомы водорода теперь ведут себя как положительно заряженные атомы.
Аналогично, поскольку электронные пары находятся ближе к атому кислорода, атом кислорода приобретает частичный отрицательный заряд – на нем. Тенденция атома кислорода изменяется от нейтрального к поведению отрицательно заряженного атома.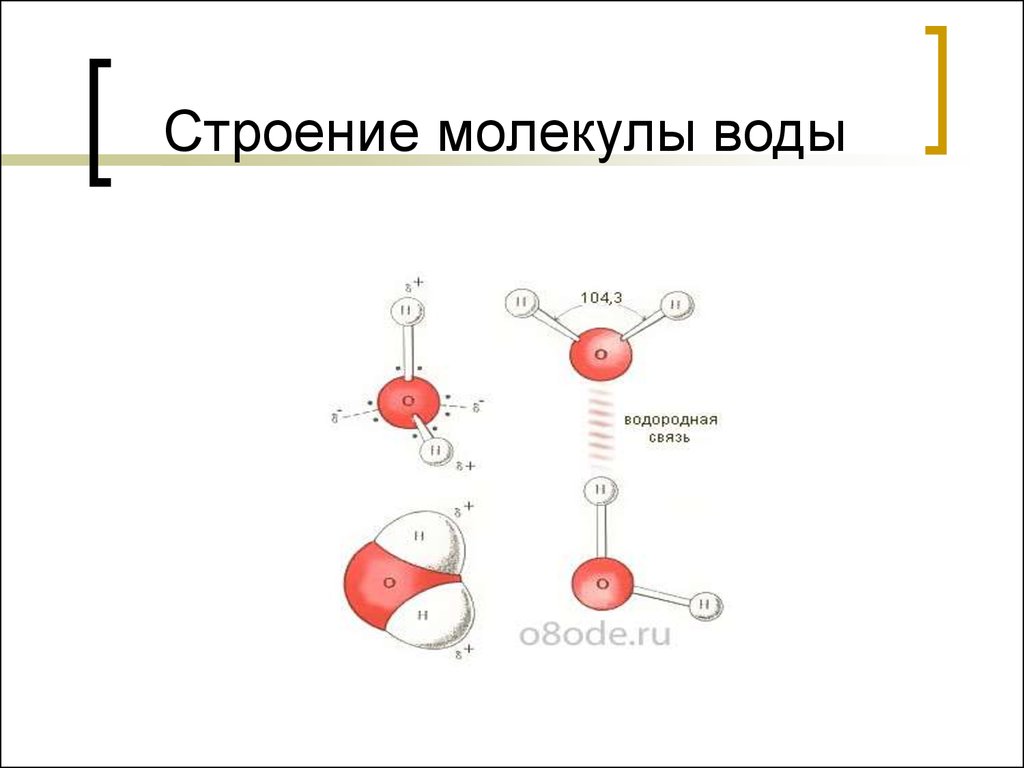 Эти частичные заряды, возникающие на атомах, придают форму молекуле воды.
Эти частичные заряды, возникающие на атомах, придают форму молекуле воды.
Предполагалось, что идеальной формой молекулы воды будет линейная молекула с кислородом в центре, окруженная атомом водорода с обеих сторон, но эта форма имеет небольшие вариации. Общеизвестно, что подобное и подобное отталкиваются, а противоположности притягиваются. Точно так же частичные положительные заряды атомов водорода отталкивают их друг от друга. А частичный отрицательный заряд на атоме кислорода притягивает атомы водорода к атому кислорода.
Дополнительное влияние оказывают две неподеленные пары электронов, которые есть у атома кислорода. После образования двух ковалентных связей с атомами водорода в валентной оболочке кислорода остается четыре электрона, образующих две неподеленные пары электронов. Эти неподеленные пары электронов отталкивают друг друга.
Отталкивание этих неподеленных пар больше, чем отталкивание между атомами водорода из-за их частичных зарядов.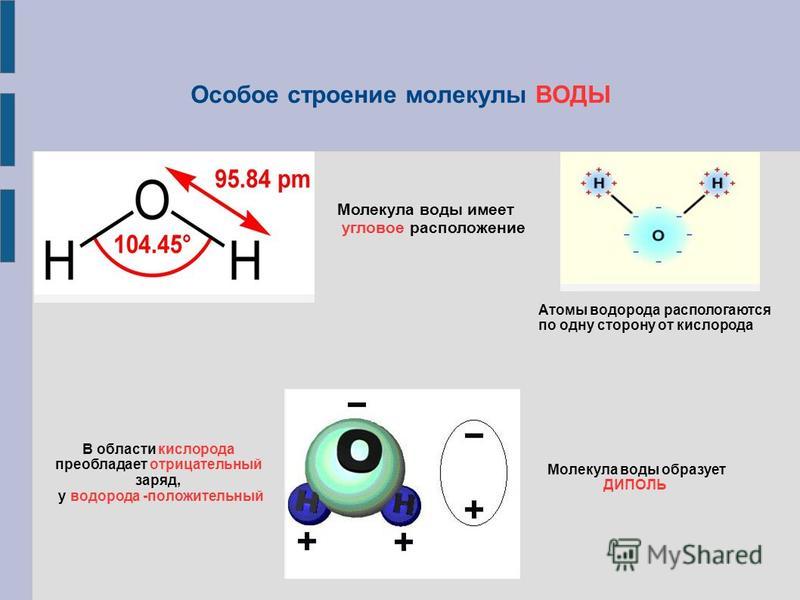 В результате связь H–O–H проталкивается внутрь, создавая изогнутую форму. Угол между связью H–O–H составляет 105 градусов, что является отклонением от идеальных 180 градусов.
В результате связь H–O–H проталкивается внутрь, создавая изогнутую форму. Угол между связью H–O–H составляет 105 градусов, что является отклонением от идеальных 180 градусов.
Изогнутая форма гарантирует, что связи O–H не компенсируют друг друга, поскольку обе они полярны. Это делает всю структуру молекул воды полярной по своей природе. Когда молекула воды рассматривается как единое целое, отрицательной полярностью молекулы является атом кислорода, тогда как положительной полярностью молекулы является общая область, окруженная двумя атомами водорода.
Поверхностное нат И причина этого в особом строении молекул воды. Атом кислорода имеет две неподеленные пары электронов, которые позволяют образовывать водородные связи с водородом других молекул воды. Водородные связи — это особые связи, образующиеся между водородом и кислородом, фтором, хлором и другими сильно электроотрицательными атомами. Водородная связь — это не настоящая химическая связь, а скорее диполь-дипольное взаимодействие, которое заставляет молекулы воды иметь высокое сродство друг к другу, что приводит к высокому поверхностному натяжению.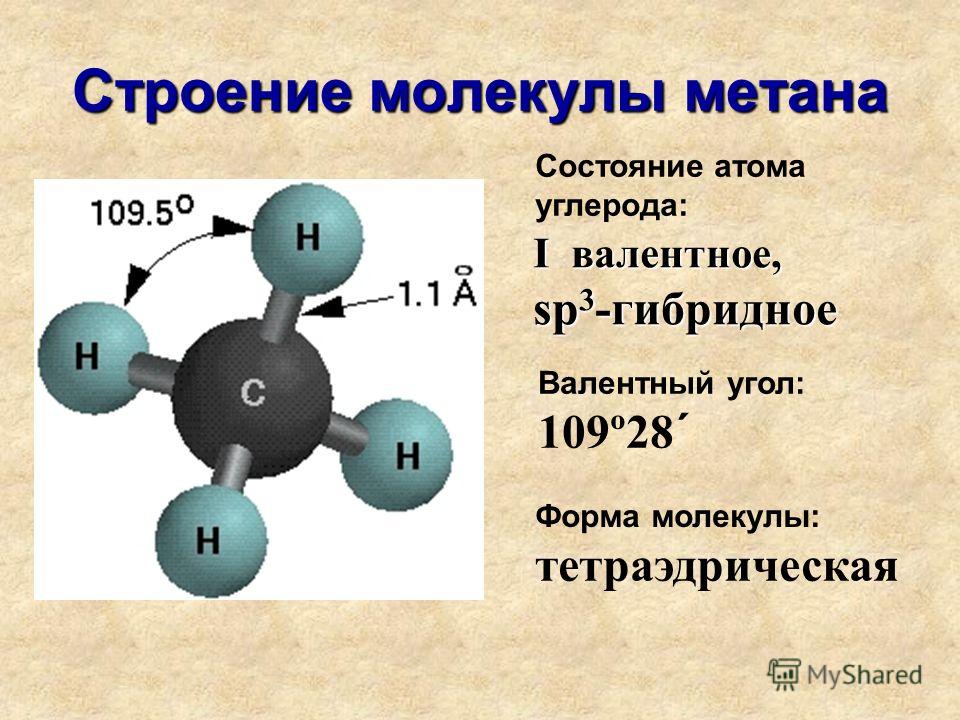



 е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма.
е. способностью молекул уносить с собой значительное количество тепла при одновременном охлаждении организма.