Как структурированная вода ViloVit (Япония) лечит организм человека
Структурированная вода несет в себе биологическую активность за счёт особой молекулярной структуры. Чем стабильнее сформирована молекулярная структура, тем полезнее и эффективней будет её потребление.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Молекула воды имеет полярную химическую связь т.к. кислород притягивает к себе отрицательно заряженные электроны, а атомы водорода — положительно заряженные электроны. В результате молекула имеет два полюса, что во многом определяет ее необычные свойства.

Молекулы воды способны соединяться между собой благодаря положительно заряженным атомам водорода, которые притягиваются к отрицательно заряженному кислороду, такая молекулярная связь называется водородная.
Водородная связь образует как случайные соединения(ассоциаты), не имеющие упорядоченной структуры, так и кластеры, в которых ассоциаты имеют определенную структуру. По прочности водородная связь примерно в 15 — 20 раз слабее ковалентной связи. Поэтому ассоциаты молекул воды не стабильны и коротко живущие, они постоянно разделяются и образуютновые соединения. Считается, что из-за таких свойств, вода является самым универсальным растворителем.
Интересным фактом является то, что отдельные молекулы воды, не связанные в ассоциаты, присутствуют в самой структуре воды лишь в виде 1%. В основном вода – это совокупность беспорядочных ассоциатов и кластеров «водяных кристаллов», где количество связанных молекул может достигать сотен и даже тысяч единиц.
Кластеры воды имеют стабильную структуру подобно клеточной воде
Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единое целое, но сохраняющих внутри него индивидуальное поведение. Их жизнь быстротечна, и потому они с трудом поддаются изучению. Уникальность воды заключается в том, что она представляет собой сложную и динамически меняющуюся структуру кластеров и ассоциатов.

Кластеры – это группы молекул, объединенные водородными связями, которые имеют стабильную структуру. Группируясь, молекулы воды создают различные пространственные и плоскостные структуры. Базовой структурой кластера считается группа из шести молекул, объединенных в кольцо. Такой тип структуры имеют лёд, снег, талая вода, и клеточная вода всех живых тканей.
К примеру, в обычной воде кластеры состоят из макромолекулярных групп, образованных из 15-17 молекул и более сотен молекул. Такая вода менее подвижна, плохо растворяет химические вещества, плохо проникает через мембрану клеток, что ухудшает клеточный метаболизм (обмен веществ) и приводит к дополнительным энергозатратам, т.к. каждый организм структурирует воду под себя.
Изменения структуры воды в природе
Вода самое аномальное из всех известных в природе веществ. Её структура легко может изменяться под внешним воздействием: при помощи давления, температуры, магнитного поля, электрического поля и т. д.
При изменении температуры структура воды меняет свое состояние: Пар, жидкость, лед.

Объяснение такого изменения в том, что молекулы воды совершают колебания с определенной частотой. При нагреве воды до 100 градусов, амплитуда колебания молекул становится такой силы, что притяжение молекул воды друг к другу становится не в состоянии удерживать их вместе, в результате структура кластера распадается. При охлаждении амплитуда колебаний уменьшается, и структура становится более прочной.
Газообразное состояние. При температуре выше +100°С вода преобразуется в газообразное состояние. В газообразном состоянии водородная связь между молекулами воды почти полностью отсутствует. На этом примере мы можем увидеть, как легко разрываются водородные связи между молекулами превращаясь в пар.
Жидкое состояние. При температуре от 0 до 100°С вода находиться в жидком состоянии. В жидком состоянии водородные связи –легко образующие, спонтанные, быстро разделяются и объединяются вновь с другими молекулами. Всё это приводит к неоднородности в структуре воды. Но так же есть и более устойчивые долгоживущие соединения — кластеры.
Согласно недавним научным исследованиям Японским институтом воды, в обычной питьевой воде находится случайных ассоциатов — 70% (деструктурированная вода) и кластеров — 30% (структурированная вода).
Твердое состояние. При температуре ниже 0 вода переходит в твердое состояние «Лед». В твердом состоянии водородные связи молекул воды образуют крепкую, непрерывную кристаллическую сетку, в которой каждая молекула имеет четырёх ближайших соседей, которые соединены между собой прямыми одинаковыми водородными связями в сетчатый каркас с пустотами в нем. Это объясняет почему плотность льда меньше плотности воды.
Самый наглядный пример структурированной воды — талая вода. Она образуется, когда происходит оттаивание льда при температуре 0 °С. При плавлении кристаллической решетки льда разрушается только 17% от общих водородных связей. Поэтому свойственна льду связь каждой молекулы воды с четырьмя соседними молекулами при оттаивании в значительной степени сохраняется, но при каждом повышении температуры, разрушение происходит активнее. А после кипячения воды ее структура разрушается.
Этим можно объяснить полезность воды из горных источников. Она зарождается у кромки таяния снега и льда, то имеет специфическую структуру, где связи между молекулами упорядочены, а молекулы объединены в кластеры.
Роль структурированной воды в организме человека
Человек состоит на большую часть из воды, поэтому вода является самым важным элементом в организме. Подробнее о клеточной воде и ее функциях.
Вода в организме человека также структурирована. Она похожа на структуру кристаллической решетки льда, но по-своему уникальна. Обычная вода состоит из макромолекулярных групп — кластеров, образованных из 15-17 молекул и более. В организме клеточная и межклеточная вода имеет кластеры из 5-7 молекул воды, ее называют низкомолекулярной водой.

Благодаря такой структуре, вода обладает хорошей проникающей способностью в клетки, быстро циркулирует и способствует нормальному протеканию всех биохимических реакций, что существенно повышает эффективность и синхронность работы всех систем организма.
При потреблении обычных водопроводных или газированных вод либо напитков, где структура воды всегда разрушена и состоит из макромолекулярных кластеров, организм структурирует воду по типу своей внутренней структуры, затрачивая при этом клеточную энергию. Именно затрата жизненной энергии на структурирование воды является главной причиной «синдрома хронической усталости».
Чем полезна структурированная вода
Структурированная вода, имеющая структуру близкую к внутренней жидкости организма легко усваивается организмом, не тратиться дополнительная клеточная энергия на преобразование в низкомолекулярную. Биологическое действие на организм связано с тем, что каналы мембран клеток имеют регулярную структуру схожую со структурой преобразованной воды, в результате молекулы структурированной воды пропускаются с повышенной скоростью. Кстати, таким же эффектом объясняется польза от потребления различных фруктов и овощей в связи с тем, что, межклеточная жидкость растений, имеет аналогичную структуру.
Вывод: Клеточная вода любого живого организма имеет упорядоченную структуру (структурированная), а употребление структурированной воды не требует затрат дополнительной энергии на ее преобразование. Высвободившийся энергетический потенциал организм использует на собственное восстановление, тем самым укрепляется иммунитет, регенерация тканей. Существенно повышается порог интеллектуальных и стрессовых перегрузок.
Вода с «живой» структурой без труда проникает через мембраны клеток, где приносит каждой клетке витамины и питательные вещества, вымывает токсины и шлаки из организма, а также усиливает действие натуральных лекарственных препаратов.
Как обычно структурируют воду в домашних условиях
Вода структурируется, а точнее обретает особую регулярную структуру при воздействии некоторых факторов, от которых зависят способы ее приготовления и жизненный цикл регулярной структуры. Например,
- при замораживании-оттаивании воды (талая вода, где сохраняются “ледяные” кластеры)
- при воздействии электрического поля (электролиз)
- при воздействии постоянного магнитного поля (магниты)
- при химических воздействиях (магниевый стержень ViloVit)
- при механических воздействиях, происходит незначительное изменение структуры (встряхивание, перемешивание, течение в различных режимах)
Полученная структурированная вода становиться активной и несет полезные свойства для всего организма.
Структурированная вода двойного воздействия магниевым стержнем ViloVit

При контакте магниевого стержня ViloVit с простой водой, в процессе естественной реакции вода становиться низкомолекулярной и структурированной по принципу двойного воздействия:
1. Химическая реакция магния и воды, выделяющая ценный водород им же и обогащаясь, становится простыми словами живой водой.
2. Воздействие давлением из-за выделяемого водорода, обогащённая вода обретает особую регулярную структуру, подобную клеточной воде – структурируется.
Магниевый стержень взаимодействуя с водой, выделяет молекулярный водород в большом количестве, повышая давление в закрытой емкости. Избыток выделенного молекулярного водорода из-за давления начинает растворяться в воде. Активно изменяется система межмолекулярных взаимодействий, в том числе и структура воды.
В результате Вы без особого труда получаете стабильную низкомолекулярную структурированную воду в любом удобном для Вас месте. Необходимо всего лишь опустить магниевый стержень ViloVit в емкость с водой и прибор для структуризации воды сделает все сам.
Узнать о продуктах VILOVIT
Заказать продукты VILOVIT
Почитать полезные статьи
Строение молекулы водяного пара – атомы воды
Молекула — водяной пар
Cтраница 1
Молекулы водяного пара, попав на такое вещество, удерживаются на них силами сцепления. Как только на такую пылинку осядут пары воды, сразу образуется капелька достаточно больших размеров. Давление паров около нее будет лишь очень мало отличаться от давления паров у плоской поверхности, и капелька будет расти при очень малом пересыщении. [1]
Молекулы водяного пара при перемещении под влиянием градиента упругости через толщу ограждения, попадая в сферу действия молекулярных сил материала ограждения, сорбируются на поверхности зерен или пор и образуют газовую или жидкостную пленку тех или иных размеров, отличающуюся по свойствам от обычной свободной воды. Если водяной пар по обеим поверхностям ограждения длительное время сохраняет свою температуру и давление, то по всей толще ограждающей конструкции установится равновесное состояние. Количество сорбирующегося водяного пара в каждом сечении при этом зависит от температуры пара и его давления в этом сечении. [2]
Молекула водяного пара имеет три колебательных степени свободы, из которых две относятся к растяжению связей и одна — к изменению угла связи. Колебательная составляющая теплоемкости для каждой температуры вычислена ниже для основного волнового числа, равного 3700 см 1, относящегося к растяжению связи О — Н, и волнового числа 600cM — 1, относящегося к изменению угла связи. [3]
Молекула водяного пара Н20 сильно полярна, молекула окиси углерода СО обладает слабой полярностью. В расчетах диффузии полярность ю молекулы СО можно пренебречь, поэтому выше данная молекула отнесена к неполярным. [5]
Адсорбируя молекулы водяного пара, эти ядра покрываются мономолекулярной пленкой воды, уподобляясь, таким образом, водяным капелькам достаточно крупного размера. Особенно активно действуют в этом отношении электрически заряженные ядра конденсации ( атмосферные ионы) и гигроскопические растворимые в воде ядра. [6]
Сколько молекул водяного пара находится в сосуде. [7]
Количество молекул водяного пара, адсорбированных из воздуха частицами материала, характеризует его гигроскопическую влажность. Последняя определяется из доведенной до воздушно-сухого состояния навески, т.е. высушенной при комнатных условиях. [8]
Цеолиты адсорбируют молекулы водяного пара, двуокиси углерода, сероводорода, аммиака и др. Синтетический цеолит марки СаА — 5 является также сорбентом окиси углерода. [9]
Оценим прочность молекул водяного пара. Величина АН для той же реакции ( 2) составляет — 221 2 ккал, откуда свободная энергия образования молекул Н30 из элементов AF — 206 8 жал / моль. В данном случае поправка TAS невелика по сравнению с теплотой диссоциации, и значение AF близко к АН. [10]
Во влажном воздухе молекулы водяного пара захватывают электроны, образуя утяжеленные ионы. Подвижность связанного электрона резко уменьшается, и его ионизирующая способность пропадает. Поэтому с увеличением влажности электрическая прочность промежутка увеличивается, так как количество связанных электронов становится больше. [11]
Херцберга, в молекуле водяного пара равно 0 0956 нм. [13]
Они предположили, что молекула водяного пара разрушается на поверхности углерода на атом водорода и гидроксильный радикал, которые быстро хемосорбируются на соседних углеродных центрах. Далее, водородный атом хемосор-бированного радикала гидроксила, соединяясь с атомом водорода на соседнем центре углерода, покидает поверхность в виде молекулы водорода. [14]
Они предположили, что молекула водяного пара разлагается на поверхности угля на атом водорода и гидроксильный радикал, которые быстро хемосор-бируются на смежных участках поверхности. Вслед за этим атом водорода на хемосорбированном гидроксильном радикале присоединяет атом водорода на смежном участке поверхности угля и удаляется с поверхности в виде молекулы водорода. [15]
Страницы: 1 2 3 4
Вода, её состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы(IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
В состав молекулы воды входят два атома водорода и один атом кислорода, атомы связаны ковалентной полярной связью, валентный угол составляет 104,5о.
Говорят, молекула воды является диполем. Н · + · О · + · Н ® Н ·· О ·· Н.
Вода – бесцветная летучая жидкость, в толстом слое – голубая, без запаха, плотность – 1г/см3(при 40С), tпл. = 00С, tкип. = 1000С.
вода является хорошим растворителем.
Химические свойства:
При пропускании через подкисленный раствор электрического тока вода разлагается на простые вещества: кислород и водород: 2Н2О ?
2Н2 + О2.
Вода вступает во взаимодействие со щелочными и щелочноземельными металлами при обычных условиях, при этом в молекуле воды один атом водорода замещается на атом металла и образуются щёлочь и водород. Реакция протекает с выделением большого количества теплоты.
2Na + 2h3O = 2NaOH + h3
При взаимодействии основныхоксидов с водой образуется щёлочь. Например, при взаимодействии оксида кальция (негашёной извести) с водой образуется гидроксид кальция (гашёная известь): CaO + h3O = Ca(OH)2.
Кислотныеоксиды растворяются в воде с образованием кислот, например, оксид серы(IV) при растворении в воде образует сернистую кислоту: SO2 + h3O = h3SO3.
Загрязнителями природных вод являются ядовитые отходы, которые в течение многих лет захоранивались в шахтах и скважинах и продолжают захораниваться сейчас, подземные хранилищанефти и продуктов её переработки, пестициды, применяемые в сельском хозяйстве.
Главным и постоянным загрязнителем природных вод являются сточные воды, которые текут из городов, с заводов, шахт, сельских ферм. Они образуются разными путями, но в общем-то у все у них один и тот же путь – в ближайшую реку или озеро или море.
Органическиезагрязнители из сточных вод способны вызвать цепную реакцию, которая лишает воду нормального содержания кислорода, быть ядовитыми для организмов, живущих в воде и способствовать развитию менее желательных видов и захвату ими господствующего положения.
Азот и фосфор, содержащиеся в сточных водах вызывают бурный рост микроскопических водных растений, что приводит к явлению «цветения» воды и постепенному заболачиванию водоёма. Борьба с загрязнением воды – это комплекс методов очистки сточных вод до такой степени, чтобы их сбрасывание в природные воды не вызывало проблем.
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВОДЫ
Сточные воды подлежат очистке перед сбросом их в природные водные источники. Сначала они проходят через систему решёток и сеток, затем попадают в песколовку, затем в отстойник – первичная очистка – очистка от различных размеров нерастворимых примесей.
Вторичная очистка – удаление растворённых примесей – это биохимическая очистка, при этом используются микроорганизмы и бактерии, разрушающие органические вещества. Третичная очистка сточных вод проводится для удаления из неё соединений азота и фосфора.
Соединения фосфора удаляют путём осаждения их солями железа, алюминия и известью. Соединения азота удаляют с помощью специальных штаммов микроорганизмов. Последним этапом в очистке сточных вод является её хлорирование.
Очистка природных вод (для бытовых нужд).
В 1872 году было обнаружено, что фильтрование воды через слой песка является хорошим способом её очистки и делает её относительно безопасной для питья. Песчаные фильтры также эффективны для удаления из воды болезнетворных микроорганизмов (холеры, брюшного тифа, дизентерии).
Уже в начале 20-го века в практику было введено химическое «обеззараживание» воды посредством хлора или его соединений. При очистке природных вод используют аэрацию (для удаления запаха), активированный уголь(для обесцвечивания воды и улучшения её вкуса), алюминиевые и железные квасцы (для удаления взвешенных в воде частиц), фильтрование через песчаный фильтр (для удаления из воды бактерий, вирусов и других микроорганизмов), хлорирование (для полного обеззараживания воды).
альтернативой хлорированию является озонирование воды, но при озонировании не остаётся следов свободного озона и потребитель не может быть уверен в полном уничтожении бактерий и вирусов в воде.
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВОДЫ
Вода состоит из 11,19% водорода и 88,81% кислорода (соответственно атомному весу водорода 1,008), причем по объему — водорода в 2,00285 раза больше, чем кислорода. Воду Н2О следует считать водородным соединением кислорода, т. е. гидридом, хотя формально ее можно называть и окислом водорода.
Аномалии воды.Как физическое тело вода обнаруживает много особенностей — аномалий, отличающих ее от всех других тел.
Наиболее важны следующие аномалии.
1. Плотность воды при повышении температуры от 0 до 4° увеличивается. При 4° плотность становится наибольшей и уменьшается только при дальнейшем повышении температуры.
2. При замерзании вода резко увеличивает свой объем (почти на 10%). Плотность пресного льда равна 0,91 г/смг. Плотность большинства других тел, кроме висмута и галлия, увеличивается при переходе из жидкого состояния в твердое.
Вода обладает большой удельной теплоемкостью. Плавление льда сопровождается увеличением удельной теплоемкости с 0,49 до 1,009 кал при 0°. Затем теплоемкость воды до температуры 40° уменьшается и только после этого начинает увеличиваться.
По кинетической же теории теплоемкость с повышением температуры должна непрерывно увеличиваться. В связи с этим за единицу тепла — калорию — принимают количество тепла, которое нагревает 1 г чистой воды на 1° в интервале либо от 14°,5 до 15°,5 (15-градусная калория, равная 4,124 абс.
джоуля], либо от 19°,5 до 20°,5 (20-градусная калория, равная 4,181 абс. джоуля).
4. Температура замерзания воды понижается при увеличении давления примерно на 1° на каждые 130 атм и достигает минимума (—22°) при давлении 2115 атм.
5. Температура кипения воды равна 100°. Но так как молекула воды построена из атомов водорода, кипящего при —253°, и кислорода, кипящего при —180° (при давлении в 1 атм), то температура кипения воды должна была бы лежать в пределах от —100 до —150°.
Лед обладает исключительно большой теплотой плавления, равной 79,4 калорий на грамм, т. е. вода и лед при 0° отличаются по содержанию скрытой энергии почти на 80 калорий.
7. Скрытая теплота парообразования также очень велика (539 калорий на грамм при температуре 100°).
Ее зависимость от температ Теплоемкость насыщенного пара при температурах до 500° отрицательная. Пар при увеличении давления остается в газообразном состоянии (прозрачным), а при уменьшении давления конденсируется, образуя туман.
Диэлектрическая постоянная воды а = 81 (при 20°). У большинства других тел она находится в пределах от 2 до 3.
10. Коэффициент преломления света в воде тг = 1,3. Между тем как, согласно волновой теории света, он должен был бы быть равным я = -/7= 9.
Все эти аномалии объясняются строением молекулы и особенностями структуры воды. Установлено, что в молекуле воды (Н2О) ядра атомов водорода и кислорода образуют равнобедренный треугольник с углом при вершине, равным приблизительно 103—106°.
Электронная оболочка представляет собой сферу с радиусом, равным 1,38 X 10~8см. Ее центр совпадает с центром инерции и лежит на высоте треугольника ядра ближе к вершине, занятой кислородом. Электрические связи, удерживающие составные части молекулы, очень велики.
Диссоциация (разложение) молекулы водяного пара на кислород и водород начинается только при температуре порядка 1400°, но и при температуре 3092° разрушается не более 13% молекул.
Молекулы воды обладают, кроме того, большим результирующим электрическим моментом, т. е. создают в электрическом поле сильную поляризацию.
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВОДЫ
Этим объясняется большая диэлектрическая постоянная воды. Структура самой воды, т. е. собрания водяных молекул, также сложна.
Тяжелая вода.Представления о строении воды еще больше усложнились с открытием изотопов кислорода и водорода. Тяжелая вода, представляющая изотопную разновидность воды, в которой водород частично или полностью заменен тяжелым водородом (D-дейтерий), значительно отличается от обыкновенной воды по физическим свойствам.
Сравнительные данные физических характеристик обыкновенной и тяжелой воды приведены в табл. 11.
Таблица 11
| Физические характеристики | Вода Н3О | Тяжелая вода D2O |
| Плотность при 25° (г/сл*3) …. | 0 ,89704 | 1,10469 |
| Температура плавления ……………. „ кипения …………………………… | 0° 100° | +3^82 101°42 |
| „ наибольшей плот ности ……………………………………. | 3°98 | 11°4 |
| Диэлектрическая постоянная . . | 80,5 | |
| Показатель преломления …. Молекулярный вес …………………… | 1 ,33300 18 | 1 ,32844 20,3 |
Существует также тяжелокислородная вода, >в которой обыкновенный кислород заменен его тяжелыми изотопами О17 или О18.
Существует, наконец, сверхтяжелая вода, в которой водород заменен радиоактивным изотопом — тритием.
Предыдущая1234567Следующая
Дата добавления: 2015-01-02; просмотров: 472;
ПОСМОТРЕТЬ ЕЩЕ:
Строение молекулы воды
Вода — драгоценный дар природы, котрую академик Карпинский назвал живой кровью, которая создает жизнь там, где ее не было.
«Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов» (В.И.Вернадский).
Формула воды — Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е.
состоит из 1 атома кислорода и 2-х атомов водорода.
1). Молекула воды асимметрична, образует равнобедренный треугольник.
2). Молекула воды обладает полярностью, поэтому является электрическим диполем.
3). Молекулярная структура воды: вода находится в трех состояниях и осуществляет фазовые переходы.
Гидроль (пар) — состоит из одиночных молекул Н2О, поэтому водородные связи не реализуются; (Н2О)
Дигидроль (жидкость) — строение как у льда, а пустоты заполнены одиночными молекулами; (2Н2О) Тригидроль (лёд) — упорядоченное строение, гексагональная система с прочными водородными связями, имеет наибольший объем.
(3Н2О)
4) Водородные связи в 10 раз прочнее, чем связи межмолекулярного взаимодействия.
5) В 1932 г. Юри и Осборн открыли, что водород и кислород имеют природные изотопы, т.е. вода имеет переменный изотопный состав и
атомы вещества с разной молекулярной массой.
Н=1 – Н20 — протий — «легкая, живая вода», талая вода;
Н=2 — D2O — дейтерий — «тяжелая, мертвая вода», содержащая соли тяжелых металлов;
Н=3 — Т2О — тритий — «сверхтяжелая вода», образующаяся при термоядерных реакциях.
Химически чистая вода состоит по весу из 11,19% водорода и 88,81 % кислорода.
Физические свойства воды
1).
Молекулы воды осуществляют переходы из одного состояния в другое (фазовые переходы). Переходы сопровождаются выделением или поглощением энергии (скрытая теплота парообразования).
Испарение — из жидкости в пар — поглощение тепла.
Конденсация — из пара в жидкость — выделение тепла.
Замерзание — из жидкости в лед — выделение тепла.
Таяние — из льда в жидкость — поглощение тепла.
Возгонка — из льда в пар (испарение с поверхности льда)- поглощение тепла.
Сублимация — из пара в лед (конденсация в твердую фазу), например, иней — выделение тепла.
При увеличении температуры воды скрытая теплота парообразования уменьшается.
2). При нормальном давлении температура плавления льда и замерзания воды равна 0°С. При повышении давления лед плавится при отрицательных температурах.
3).
С увеличением солености понижается температура замерзания воды. Следует помнить, что при увеличении солености на 10%о температура замерзания воды понижается на 0,54°С.
4).
Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно.
5). В диапазоне температуры воды от 0 до 4°С плотность воды не уменьшается, а увеличивается. Это аномальное свойство воды, вследствие которого образуется лед и водоемы не промерзают, потому что при температуре воды менее 4°С пресная вода становится менее плотной.
6). Аномальное изменение плотности приводит к аномальному изменению объёма воды.
С увеличением температуры от 0 до 4°С объём химически чистой воды уменьшается; лишь при дальнейшем увеличении температуры объём увеличивается.
Объём льда всегда больше объема воды. Примеры в природе — морозное выветривание, образование наледей, бугров бучения и т.д.
7). Высокая удельная теплоемкость воды (ср). ср при 15°С = 4190 Дж/кгС0.
ср минимальна при температуре равной 33°, увеличивается при увеличении и уменьшении температуры.
Высокая ср и очень высокая удельная температура плавления и испарения, что ведет к регулированию тепловых процессов на всей планете.
8). Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы.
Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед — водоемы от промерзания.
9).
Вязкость воды невелика, поэтому вода подвижна. При увеличении температуры вязкость уменьшается, поэтому в холодное время года вязкость воды больше, чем в теплое.
10). Очень высокое поверхностное натяжение. Поэтому происходит:
• размыв фунтов водой;
• очень большая разрушительная деятельность дождевых капель;
• перемещение воды по порам и капиллярам в земной коре.
11).
Свет частично поглощается и преломляется, поэтому проникает лишь на небольшую глубину. Именно здесь протекает фотосинтез.
12). Вода хорошо проводит звук (в 4-5 раз больше, чем в воздухе).
Строение молекулы воды
Скорость звука увеличивается при повышении температуры воды, солености и давления.
13). Низкая электропроводность, которая увеличивается при повышении минерализации количества ионов хлора и калия.
Химические свойства воды
1). Вода — слабый электролит.
2).
Вода — универсальный растворитель. В зависимости от размера частиц образуются чистые и коллоидные
растворы.
Природные воды содержат 45 главных химических элементов. Все вещества, входящие в состав воды делятся на 6 групп:
• Растворимые газы (О2, N2, СО2, ионы Н).
Растворимость зависит от их природы, давления, температуры и минерализации.
• Главнейшие ионы. Их восемь: четыре положительных (катионы) и четыре отрицательных (анионы).
Катионы — Na, Ca, Mg, К;
Анионы — С1 (хлорит), SO4 (сульфат), СО3 (карбонат), НСО3 (гидрокарбонат).
• Биогенные вещества — N2, P, Si;
• Микроэлементы — Вr, Сu, В и т.д.; тяжелые металлы — Li, Ba, Fe, Ni, Zn, Co, Pb, Hg, Ra;
• Органические вещества — углеводороды, белки, липиды, гуминовые вещества идр.;
• Загрязнители — нефтепродукты, ядохимикаты, удобрения, ПАВ, Pb, Hg, Zn.
Совокупность проявления химических и некоторых физических свойств определяет качество воды.
1. Строение молекулы воды
Строение молекулы воды
К.х.н. О.В. Мосин
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав.
Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода h3O (формула воды). В молекуле воды главное действующее лицо — атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис.
Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°.
Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный. Поэтому и вся молекула воды тоже попадает в отряд «химических полярников» — веществ, молекулы которых представляют собой электрические диполи.
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО).
Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см.
Г.Грей «Электроны и химическая связь»,М., изд-во «Мир», 1967, с.155-62 и G.L.Miessier, D.A.Tarr, «Inorganic Chemistry», Prantice Hall Int.Inc., 1991, p.153-57).
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей.
Взаимодействие (перекрывание) 1sатомной орбитали водорода, 2sи 2рzатомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.
Рис. Перекрывание 2s(а), 2px- (б) и 2pя(в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие выводы.
Молекула Н2О диамагнитна.
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи ОН, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
Принципиальным отличием метода молекулярных орбиталей от метода валентных связей является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
4. Метод молекулярных связей (в отличие от метода валентных связей) позволяет оценить разницу в энергиях молекулярных орбиталей. В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2.
Это связано с различной природой орбиталей — 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием атомной орбитали водорода и кислорода и не является локализованной. Локализация электронов на 1b2 молекулярной орбитали приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный — вблизи атомов водорода.
Таким образом, молекула Н2О оказывается полярной (дипольный момент μ = l. q = 1.84D). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол НО- Н должен быть близким к 90о.
Однако из эксперимента следует, что этот угол равен 104.5о. Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла НО- Н. В приближении метода валентных связей увеличение угла НО- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к другим двухатомным молекулам Н2S, h3Se и h3Te диаграммы молекулярных орбиталей изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ.
Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей nsи nруменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э.
Вклады nратомных орбиталей атомов халькогенов в энергию молекулярной орбитали уменьшаются, и соответственно понижается локализация электронов на атомах и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы НЭ- Н в молекулах халькогенов. Именно так, с точки зрения теории молекулярных орбиталей, объясняется понижение устойчивости молекул h3S, h3Sе, h3Te по сравнению с молекулой Н2О.
К.х.н.
О.В. Мосин
Загадка молекулярной структуры воды
Международная группа учёных разбиралась, как происходит вращение молекулы воды и каковы ее критические свойства и локальная структура
Международная группа учёных разбиралась, как происходит вращение молекулы воды и каковы ее критические свойства и локальная структура.
Как двигается молекула в поле рентгеновского излучения и какова структура жидкостей — всё это нужно для понимания механизмов взаимодействия излучения с веществом и структурой сложных молекулярных систем.
Так, наблюдая за молекулярным движением, ученые используют динамический вращательный эффект Доплера. Наличие изолированных колебательных состояний в Оже-переходах дает уникальный способ изучения индуцированного молекулярного вращения.
Теоретические предсказания подтверждаются на практике. При помощи современных синхротронов и экспериментальной методики есть возможность изучать сверхбыстрое молекулярное вращение во льду, в газообразном и жидком состоянии воды. Применяя Оже-спектроскопию и рентгеновскую фотоионизацию, специалисты рассматривают поведение молекул воды при высоких энергиях фотонов.

Название изображения
Фарис Хафизович Гельмуханов – доктор физ-мат. наук, ведущий научный сотрудник, профессор Института нанотехнологий, спектроскопии и квантовой химии Сибирского федерального университета (г. Красноярск), приглашенный исследователь, профессор отделения теоретической химии и биологии Королевского технологического института в Стокгольме (Швеция). Выпускник Новосибирского государственного университета, бывший сотрудник Института автоматики и электрометрии (г. Новосибирск) – рассказал об актуальных исследованиях по изучению атомных связей в молекуле воды, которые проходили в сотрудничестве с зарубежными специалистами, использующими новейшее оборудование.
Ряд исследований международной команды ученых представлен несколькими значимыми публикациями. Например, в статье, опубликованной в Proceedings of the National Academy of Sciences of the United States of America, vol. 116(11), 4877–4882 (2019) внимание специалистов направлено на изучение движения молекулы углекислого газа (CO) с использованием динамического вращательного эффекта Доплера.
Фарис Гельмуханов пояснил, как меняется молекулярная ориентация, в частности, как возникает индуцированная отдача молекулярного вращения и каковы отличительные особенности Оже-спектров молекулы:
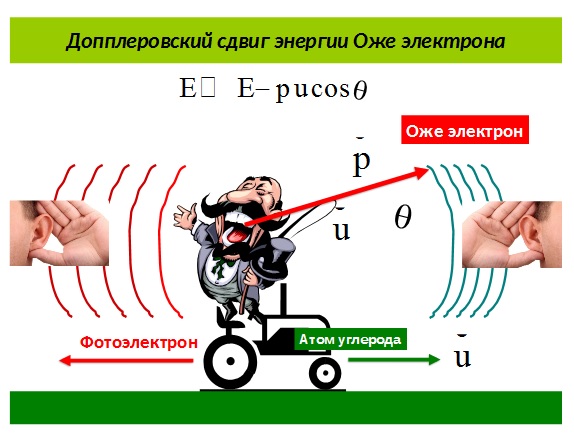
Рис.1
«Эффект Допплера имеет место для любых волн – звуковых волн, волн на воде, фотонов, электронов и так далее. Эффект Допплера мы наблюдаем и в повседневной жизни: если машина скорой помощи с включённой сиреной приближается к вам, вы слышите высокую частоту. Как только автомобиль проедет мимо – вы слышите низкий звук (см. Рис. 1).
Поскольку молекулы двигаются, эффект Допплера можно наблюдать и по характерному сдвигу частоты или энергии испущенного фотона или электрона. Важно отметить, что эффект Допплера можно наблюдать как при поступательном движении молекул, так и при их вращении (вращательный эффект Допплера). Однако длительное время считалось невозможным обнаружить вращения в рентгеновских спектрах в силу сверхбыстрого характера рентгеновского процесса, длительность которого была слишком короткой по сравнению с периодом медленных молекулярных вращений. Тем самым делая невозможным “увидеть” вращение молекулы».
Профессор выделяет два ключевых момента исследованного явления: «Первый момент заключается в переводе молекулы в состояние сверхбыстрого вращения. Для этого исследователи ионизовали молекулу CO фотонами большой энергии (около 10 кэВ). Подобно снаряду, вылетевший из атома углерода быстрый фотоэлектрон, сообщил этому атому момент импульса. В результате этой отдачи, молекуле была сообщена большая скорость вращения с характерной вращательной температурой, близкой к температуре на поверхности солнца (10 000 K)».
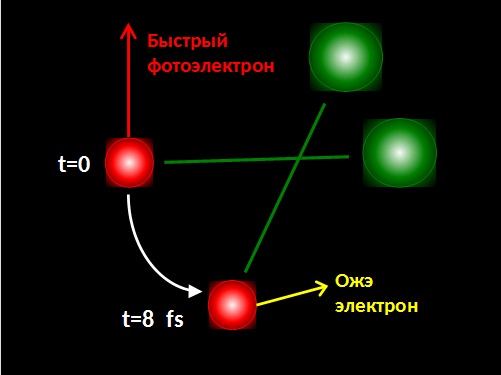
Рис. 2. Быстрый фотоэлектрон при вылете из атома углерода (красный шарик) толкает за счет отдачи и приводит к сверхбыстрому вращению молекулы CO. Через 8 fs влетает Оже-электрон. Оже-спектр дает информацию о повороте оси молекулы за время жизни 1s-дырочного состояния (8 fs).
«Следует отметить, что фотоэлектрон с той же самой вероятностью влетает в противоположную сторону. Тем самым у нас будут молекулы сверхбыстрого вращения в противоположную сторону. Mы детектировали это вращение, измеряя энергию испущенного Оже-электрона (см. Рис. 2).
Вращение молекулы сдвигает энергию Оже-электрона в сторону увеличения или уменьшения. Это зависит от направления вращения. Taк как у нас половина молекулы крутится в одну сторону, а другая половина в противоположную сторону, то Оже-резонанс расщепляется на два пика (см. Рис. 3a), – поясняет профессор Гельмуханов и продолжает далее –
Нo молекула, благодаря этому сверхбыстрому вращению, могла успеть повернуться на заметный угол за короткое время (порядка 8 фемтосекунд) рентгеновского процесса (см. Рис. 2)».
Второй ключевой момент работы, по словам Фариса Гельмуханова, заключается «в детектировании этого угла поворота. В качестве такого временного детектора использовался тот самый Оже-электрон, вылетевший через приблизительно 8 фемтосекунд после ионизации. Оказалось, что сверхбыстрый поворот молекулы приводит к зависящему от времени Допплеровскому сдвигу Оже-резонанса и характерной ассиметрии спектральной формы этого резонанса (см. Рисунок 3). Варьируя энергию рентгеновского фотона, а, следовательно, и скорость индуцированного вращения, удалось визуализировать динамику этого вращения».
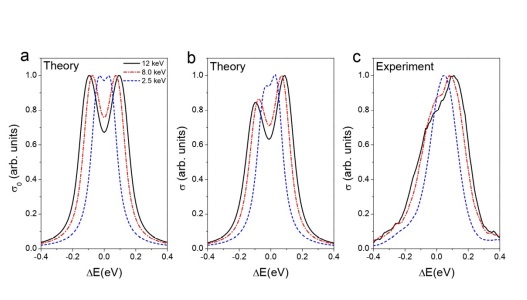
Рис.3. a) вращательный эффект Допплера приводит к расщеплению Оже-резонанса на два пика с одинаковой интенсивностью; b) теория предсказывает, что проворот оси молекулы за время жизни ионизованного состояния молекулы CO приводит к ассиметрии дуплета c) экспериментальный спектр
В этой работе по изучению Динамического эффекта Допплера воды участвовали теоретики и экспериментаторы. Группу теоретиков возглавил профессор Фарис Гельмуханов. Эксперимент был выполнен на синхротроне SOLEIL (Париж, Франция).
Следующий этап исследований был посвящен изучению локальной структуры жидкой воды. Pезультаты этой работы опубликованы в престижном журнале Proceedings of the National Academy of Sciences of the United States of America, vol. 116 (10) 4058-4063 (2019).
По словам Фариса Гельмуханова, «общепринято, что вода состоит из молекул Н2О, объединенных в группы так называемыми водородными связями (ВС). Hе связанные в кластеры молекулы воды присутствуют в ней лишь в небольшом количестве. Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединения. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F».
Суть исследований помог понять профессор Гельмуханов: «Существует две модели жидкой воды. Большинство экспериментальных данных указывает на то, что вода является однородной, c плотностью 1г\см3. Несмотря на это, многие ученые думают, что вода есть флуктуирующая смесь кластеров двух типов, в одном их которых молекулы связаны друг с другом водородной связью как во льду, а в другом связи нарушены. Благодаря чему эти кластеры более плотные. Наши недавние теоретические и экспериментальные исследования показали, что жидкая вода все-таки является однородной».
Как сообщил Фарис Гельмуханов, «было проведено два типа экспериментов: во-первых, измерение рентгеновских спектров поглощения (RSP) газообразной воды, жидкой воды и льда в широком диапазоне энергии. Измерение RSP вдали от порога ионизации 1S электрона атома кислорода в воде было необходимо, чтобы откалибровать по интенсивности RSP паров воды, жидкой воды и льда (в этой области RSP всех трёх фаз воды строго совпадают). Измерение RSP до порога ионизации позволило нам количественно сравнить вероятность перехода 1S электрона на первую незанятую молекулярную орбиталь. Сравнение вероятности этого перехода в газе, жидкой воде и во льду было ключевым моментом нашего эксперимента. Из этого сравнения мы извлекли такой фундаментальный параметр жидкой воды, как среднее число водородных связей, приходящееся на одну молекулу. Это число оказалось равным 3.5, что близко к числу водородных связей во льду (=4). Тем самым мы показали, что локальная структура воды очень близка к структуре льда. Данный эксперимент был выполнен на пучке жестких рентгеновских фотонов «ID20» синхротрона (European Synchrotron Radiation Facility, в Гренобле, (Франция)).
Во втором случае измерялся спектр резонансного неупругого рассеяния рентгеновского излучения (PHPPИ)) газообразной и жидкой водой. Для этого использовался спектрометр SAXES на пучке рентгеновских фотонов “ADRESS” синхротрона “Swiss Light Source” в Швейцарии.
Что представляет собой PHPPИ метод? Как объяснил профессор, «резонансноe неупругоe рассеяниe рентгеновского излучения (PHPPИ) может приблизительно рассматриваться как 2-этапный процесс. На первом этапе молекула поглощает падающий рентгеновский фотон и переходит из основного в высоковозбужденное промежуточное состояние с «дыркой» на 1s-уровне соответствующего атома. Это промежуточное состояние неустойчиво и оно распадается в конечное состояние, испустив конечный рентгеновский фотон. Очевидно, энергия испустившего фотона меньше энергии начального фотона на разницу энергии конечного и начального состояния молекул».
Далее, экспериментальный материал был детально проанализирован теоретиками при помощи соответствующих расчетов и опубликован в престижном международном журнале Nature Communications 10: 1013 (2019). Здесь акцент ставится на прочности водородной связи в жидкой воде, а в основе лежат показания, снятые при помощи метода резононсного рассеяния рентгеновского излучения (PHPPИ)).
Фарис Гельмуханов подробно прокомментировал основные положения этого исследования:«Mногие ученые считают, что вода есть флуктуирующая смесь кластеров двух типов (лёгкая и тяжёлая фракции), в одном из которых молекулы связаны друг с другом, как во льду, а в другом связи нарушены, благодаря чему эти кластеры более плотные. Но так ли это? Если изучать резонансное неупругое рассеяние рентгеновского излучения (RNRRI) водой, то можно увидеть эмиссионный переход, в котором электрон с занятой молекулярной орбитали 1b1 заполняет дырку, созданную падающим фотоном в глубоком 1s уровне атома кислорода. Эксперимент с жидкой водой показывает расщепление этого резонанса на два пика. В научной литературе часть ученых приписывает этот дублет двум вышеупомянутым структурным мотивам. Из этого делаются далеко идущие заключения о локальной структуре и критических свойствах воды. Чтобы пролить свет на эту фундаментальную проблему, авторы данной работы выполнили недавно RNRRI эксперимент с парами воды, т.е. измерили RNRRI спектр изолированной молекулы воды».
Как заверил профессор Гельмуханов, «эксперименты привели к неожиданному результату и показали, что точно такое же расщепление присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе, где очевидно водородная связь отсутствует и вопрос о легкой и тяжелой фракциях не возникает. Более того, выполненные теоретические расчёты однозначно объясняют данное расщепление сверхбыстрой диссоциациeй молекулы воды в 1s-дырочном состоянии. Таким образом, данное исследование, однозначно свидетельствуя о динамической природе расщепления 1b1 резонанса, опровергает структурный механизм, тем самым свидетельствуя, что структура воды однородна».

Рис. 4. Левая панель показывает распределение молекул воды в жидкой фазе. Средняя врезка показывает процесс неупругого рассеяния молекулой воды, а правый рисунок показывает колебательную d-структуру в PHPPИ спектре.
Вторым не менее важным результатом данной работы, по словам российского ученого, является «извлечение из эксперимента более детальной структурной информации, а именно, как влияет водороднaя связь (ВС) на силу OH связи. Колебательная инфракрасная (ИК) спектроскопия является общепринятым инструментом для исследования ВС в жидкостях. Однако в жидкостях ИК-спектроскопия исследует лишь наиболее интенсивный переход в первое колебательное состояние, которое “слабо чувствует” межмолекулярное взаимодействие (см. Рис. 4) в силу малой амплитуды колебаний. Спектроскопия RNRRI воды качественно отличается от ИК спектроскопии тем, что при возбуждении рентгеновским фотоном глубокого 1s электрона кислорода на первую незанятую молекулярную орбиту, молекула воды быстро диссоциирует. В процессе этой сверхбыстрой диссоциации возбуждённый электрон переходит обратно на 1s уровень, испуская рентгеновский фотон. Частота испущенного фотона отличается от возбуждающего фотона, так как при этом переходе заселяются более высокие колебательные уровни (см. Рис. 4). Таким образом, в отличие от ИК-спектра, RNRRI спектр состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние (см. Рис. 4), тем дальше атомы водорода удаляются от кислорода в процессе OH колебаний и тем сильнее данное колебание “чувствует” взаимодействие с ближайшей молекулой воды, а именно водородную связь».
Итак, «PHPPИ даёт уникальную возможность исследовать ВС, а именно, извлечь из экспериментального спектра количественную информацию o влиянии соседних молекул через ВС на потенциал взаимодействия OH связи. Важно отметить, что в отличие от изолированной молекулы воды с одним OH потенциалом, в жидкости имеется набор (распределение) OH потенциалов в силу флуктуирующего многообразия ближайшего окружения молекулы воды. Таким образом, вторым результатом работы является “измерение” распределения OH потенциалов в сети флуктуирующих водородных связей», — заключил физик.
В этой многоаспектной работе по изучению структуры жидкой воды участвовало две группы: теоретики и экспериментаторы. Группу теоретиков возглавлял профессор Фарис Гельмуханов. Сюда вошли специалисты из разных научных учреждений, в частности, из Королевского технологического института (Стокгольм), Стокгольмского университета и российские ученые Сибирского федерального университета (доктор Сергей Полютов и аспирантка Нина Игнатова).
Руководителем экспериментальной группы был профессор Александр Фёxлиш (Alexander Föhlisch) из Института методов и приборов для исследования синхротронного излучения (Берлинский центр материалов и энергии имени Гельмгольца, Берлин, Германия). Она представлена учеными из Германии и Швейцарии (синхротрон “Swiss Light Source”).
Важно, что вторая практическая работа, выводы которой обнародованы в Proceedings of the National Academy of Sciences of the United States of America, vol. 116 (10) 4058-4063 (2019) выполнена на двух синхротронах: это Европейская установка синхротронного излучения “European Synchrotron Radiation Facility”, в Гренобле, (Франция) и “Swiss Light Source” в Швейцарии. По замечанию профессора Гельмуханова, “Swiss Light Source «уникальный спектрометр, который обладает в настоящее время лучшим в мире пo спектральному разрешению. Поэтому мы измеряем на нем, чтобы увидеть в PHPPИ спектре колебательную структуру воды в жидкой фазе , связанную с колебаниями OH связи в молекуле воды».
Итогом длительной работы ученых стало обнаружение нового физического эффекта – Динамического вращательного эффекта Допплера, а также детальное исследование роли структуры и ядерной динамики на рентеновские спектры паров воды, жидкой воды и льда. Впервые удалось визуализировать Динамику индуцированного вращения. Экспериментальные данные, дополненные теоретическими расчетами позволили получить детальную структурную информацию о жидкой воде, и было показано, что структура воды однородна.
2.1. Вода как вещество, ее молекулярная структура и изотопный состав
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине (рис. 1).
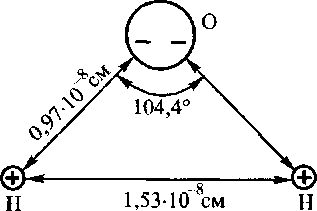
Рис. l. Строение молекулы воды
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд. В свою очередь, оба атома водорода, лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды – величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т.е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Каждая молекула воды, обладающая двумя положительными и двумя отрицательными зарядами, способна образовать четыре так называемые водородные связи, т.е. соединения положительно заряженного ядра водорода (протона), химически связанного в одной молекуле, с отрицательно заряженным атомом кислорода, принадлежащим другой молекуле.
Наиболее упрощенное представление о молекулярной структуре воды заключается в следующем. Водяной пар состоит преимущественно из мономерных (одиночных) молекул воды, т.е. водородные связи практически не реализуются. В твердом состоянии (лед) строение воды в высокой степени упорядочено. В кристаллах льда молекулы воды составляют гексагональную систему с прочными водородными связями. Такая структура весьма рыхлая и, как иногда говорят, «ажурная». Вода в жидком состоянии занимает промежуточное положение между паром и льдом. В такой воде сохраняются элементы «льдоподобного» молекулярного каркаса, а его пустоты частично заполняются одиночными молекулами. Поэтому «упаковка» молекул в воде, находящейся в жидком состоянии, более плотная, чем у льда, и плавление льда приводит не к уменьшению, а к «аномальному» увеличению плотности воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде. При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул. В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения химически чистой воды, при температуре выше 4 °С – тепловое расширение, поэтому вода обладает «аномальным» свойством – наибольшей плотностью не при температуре плавления, а при 4 °С.
Присущие воде водородные связи примерно в десять раз прочнее связей, обусловленных межмолекулярными взаимодействиями, которые характерны для большинства других жидкостей. Поэтому для преодоления этих связей при плавлении, нагревании и испарении воды необходимо гораздо больше энергии, чем в случае других жидкостей. Это определят ряд «аномалий» тепловых свойств воды.
Водород и кислород имеют несколько природных изотопов: 1Н («обычный» водород), 2Н, или D («тяжелый» водород, или дейтерий), 3Н, или Т (радиоактивный «сверхтяжелый» водород, или тритий), 16О, 17О, 18О. Поэтому и сама вода имеет переменный изотопный состав. Природная вода — это смесь вод разного изотопного состава. Наиболее распространена вода, состоящая из изотопов 1Н и 16О, доля других изотопных видов воды ничтожна — менее 0,27 %. Одна из главных причин, приводящих к различию изотопного состава природных вод – процесс испарения. В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, и в результате конденсации — более легкими. Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода (3Н) и «тяжелого» кислорода (18O) меньше, чем океанические воды.
Воду с изотопным составом 1Н216О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2Н20 (или D2О). Вода с изотопным составом 4Н2О (или Т2О) – так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13–20 кг. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
Структура молекулы воды
С современной позиции форма молекулы воды Н2О может быть представлена в виде электронного облака. Атом кислорода расположен в его центре, а два атома водорода с положительными зарядами – в противоположных углах нижней грани условного куба. Угол между электронными орбиталями равен 105. Расстояние между атомами О и Н равно ~0,1нм.
Молекула воды очень устойчива, т.к. атомы О и Н связаны друг с другом ковалентной связью (О-Н). В то же время, водород одной молекулы воды притягивается к отрицательному заряду кислорода другой молекулы с помощью водородной связи. Ковалентные связи прочные, а водородные легко рвутся, т.к. расстояние между Н и О в этой связи в 3 раза больше, чем в ковалентной.
Наличие водородной связи объясняет многие аномальные свойства воды, в том числе и ее очень высокую растворяющую способность, что играет огромную роль в геохимических процессах.
Особенностью структуры молекулы льда являются повышенные межатомные расстояния, что делает эту структуру как бы «рыхлой».
Аномальные свойства воды
Аномальные свойства воды | Сравнительная характеристика | |
1 | Теплоемкость (уд. теплоемкость 4,19Дж) | Наиболее высокая среди всех твердых и жидких веществ, за исключением NH3 |
2 | Скрытая теплота плавления (0,3 кДж/г) | Наиболее высокая, за исключением NH3 |
3 | Скрытая теплота испарения (2,3 кДж/г) | Наиболее высокая из всех веществ |
4 | Тепловое расширение (температура максимальной плотности для воды 4С) | Температура максимальной плотности уменьшается при повышении солености. С понижением температуры до 0С или с повышением до 100С плотность уменьшается |
5 | Поверхностное натяжение | Наиболее высокая из всех жидкостей |
6 | Растворяющая способность | Вода обладает наиболее высокой диэлектрической проницаемостью, что позволяет растворять большинство веществ и в больших количествах, чем в других жидкостях |
7 | Диэлектрическая постоянная | Наиболее высокая из всех жидкостей |
8 | Электролитическая диссоциация | Очень мала (нейтральное вещество, но все жидкости содержат ионы Н+ и ОН—) |
9 | Теплопроводность | Наиболее высокая из всех жидкостей |
10 | Плотность | С увеличением солености воды плотность увеличивается |
Важное свойство воды – уменьшение вязкости с повышением давления, что приводит к увеличению ее подвижности в глубинных горизонтах земной коры, где давление превышает 500 и 1000 атмосфер.
Природные воды – это сложные многокомпонентные растворы, в которых присутствуют минеральные вещества, органические вещества, радиоактивные компоненты, газ, микроорганизмы. В настоящее время в составе воды обнаружено до 85 (из 105) элементов таблицы Менделеева.
В жидком состоянии происходит электролитическая диссоциация воды: Н2ОН++ОН—. Она увеличивается с повышением температуры.
Концентрация Н+ и ОН— в воде определяют кислотность или щелочность воды. Обычно используется водородный показатель для определения кислотности среды. Он представляет отрицательный логарифм концентрации водородных ионов: рН = -lg(Н+).
В нейтральной среде рН=7, в этом случае [Н+]=[ОН—]=10-7. В щелочной среде [Н+]<[ОН—] и рН>7, в кислотной среде [Н+]>[ОН—] и рН<7.
Диапазон изменения рН в природных водах очень широк – от 1 (воды кислых термальных источников) до 9 (воды щелочных почв). Величина рН морской воды обычно равна 8, речных вод – 7, дождевых вод – 6. Однако антропогенные процессы изменяют значения рН многих природных вод («кислотные» дожди, рудничные воды и т.д.).
Условно в гидросфере выделяют морские (океанические) воды и воды континентальные.
8
уникальные свойства жидкости связаны с пирамидной структурой молекул
Мы редко задумываемся о том, к чему привыкли. Наверное, поэтому мы не думаем о том, насколько уникальна и необычна вода. По сравнению со всеми прочими жидкостями она невероятно аномальна и ведет себя совершенно иначе.
Ученые уверены, что они раскрыли причину удивительных аномалий воды — все дело в уникальной структуре и расположении ее молекул.
Аномальная плотность воды

Один из самых нехарактерных для жидкостей аспектов воды — ее уникальная плотность. Типично, остальные жидкости по мере их охлаждения становятся более плотными, однако максимальная плотность воды достигается при температуре приблизительно 4 градусов Цельсия.
При температуре ниже 4 градусов Цельсия вода начинает терять плотность, именно поэтому, замерзая при 0 градусов Цельсия, лед остается на поверхности воды, а не тонет, потому что у льда меньшая плотность. Именно поэтому замерзание воды происходит сверху вниз, а не наоборот.
Поверхностное натяжение и другие аномальные свойства

Но это еще не все. У воды очень высокое поверхностное натяжение, выше — только у ртути. Именно это поверхностное натяжение позволяет насекомым и водным паукам “прыгать” по поверхности воды, не погружаясь.
В довершение ко всему, вода закипает при необычно (для других жидкостей) высокой температуре. Если продолжить выделять уникальные характеристики воды в сравнении с другими жидкостями, то стоит отметить и тот факт, что вода является отличным растворителем для огромного количества химических веществ.
Молекулярное строение воды
Чтобы подробнее изучить некоторые из этих причудливых свойств, ученые обратились за ответами к молекулярной структуре воды. При комнатной температуре и в твердом состоянии (лед), у воды уникальная пирамидальная молекулярная композиция, это означает, что каждая молекула воды соединена с четырьмя другими в форме, слегка напоминающей пирамиду. Казалось бы, в этом нет ничего уникального — молекулярные композиции многих веществ образуют еще более сложные структуры. Однако «пирамидки» из молекул воды не так просты, как кажутся. Именно они и обеспечивают уникальное поведение воды.
Если бы структура была беспорядочной?
В 2018 году исследователи из двух университетов, Бристоля и Токио, использовали компьютерное моделирование и с помощью суперкомпьютера сумели внести изменения в этой пирамидальной структуре молекул воды.
Внося эти корректировки, они могли заставить воду вести себя иначе, больше похоже на другие жидкости. Например, они смогли сделать лед более плотным, чем жидкая вода, в результате лед шел ко дну.
Это молекулярное изменение повлияло на все необычные свойства воды, что привело ученых к выводу: аномальные свойства воды — прямой результат ее специфической молекулярной структуры.
Уникальная упорядоченность молекулярной структуры воды
Однако пирамидальная структура воды — это еще не все. Ученые обнаружили, что четыре из таких “пирамидок” могут организоваться таким способом, чтобы между ними была одна общая вершина — одна молекула воды, разделенная четырьмя молекулярными структурами. Именно эта сложная упорядоченность и позволяет воде обладать такими уникальными для жидкости свойствами.
Свойства воды в ответе за жизнь на Земле

Если бы вода не была такой уникальной субстанцией, жизнь на земле могла бы и не появиться, ну или выглядела бы совсем иначе. Если бы вода не была таким уникальным растворителем, то человеческий организм не мог бы оптимально обеспечить попадание необходимых питательных веществ в клетки и ткани. Кто знает, что бы могло течь по нашим венам, вместо крови?
Даже более низкая плотность льда способствует развитию жизни, ведь если бы лед оказывался на дне, погибли бы почти все пресноводные обитатели. Нельзя утверждать, что будь вода обычной жидкостью, жизнь не появилась бы. Однако без уникального молекулярного расположения воды жизнь на Земле эволюционировала бы совершенно иначе.
Молекулярная структура воды в ответе и за рельеф
Уникальные свойства воды обусловили формирование рельефа Земли. Из-за более низкой плотности льда, он расширяется. Вода в жидкой форме просачивается в самые мелкие трещины в каменной породе, а замерзая, лет расширяет эти трещины, разламывая камни. В результате замерзания и оттаивания большого количества воды во время ледниковых периодов были сформированы самые красивые и самые драматичные пейзажи на нашей планете.
Нашли нарушение? Пожаловаться на содержание
Семинар 4. Особенности молекулярного строения жидкостей
Семинар 4
Особенности молекулярного строения жидкостей
1) Особенности молекулярного течения жидкостей. Время оседлой жизни. Энергия активации.
2) Свойства поверхностного слоя жидкости. Поверхностное натяжение. Зависимость поверхностного натяжения жидкостей от температуры.
3) Методы определения поверхностного натяжения. Метод отрыва кольца.
4) Смачивание и несмачивание. Мениск. Краевой угол.
5) Гидрофобные и гидрофильные жидкости. Идеальное смачивание.
6) Изменение давления под искривленной поверхностью. Формула Лапласа.
7) Капиллярные явления. Высота поднятия жидкости в капилляре. Формула Жюрена.
8) Испарение жидкости. Скорость испарения.
9) Кипение жидкости Точка кипения. Удельная теплота парообразования. Зависимость температуры кипения от давления.
1) Особенности молекулярного течения жидкостей. Время оседлой жизни. Энергия активации.
Особенности молекулярного строения жидкостей: •Обычные жидкости изотропны, структурно они являются аморфными телами. • Для внутреннего строения жидкостей характерен ближний порядок в расположении молекул (упорядоченное расположение ближайших частиц). •Расстояния между молекулами невелики, силы взаимодействия значительны •жидкости мало сжимаемы и обладают большой плотностью •принимают форму сосуда, в котором находятся. Такой характер свойств жидкостей связан с особенностями теплового движения их молекул. По теории Я. И. Френкеля молекулы жидкости колеблются около положений равновесия, однако эти положения равновесия не являются постоянными.
Среднее время «оседлой жизни» молекулы называют временем релаксации т. С повышением температуры и понижением давления время релаксации сильно уменьшается, что обусловливает большую подвижность молекул жидкости и меньшую ее вязкость.
Энергия активации— минимальное количество энергии, которое потребуется сообщить системе, чтобы произошла реакция.
2) Свойства поверхностного слоя жидкости. Поверхностное натяжение. Зависимость поверхностного натяжения жидкостей от температуры.
 Измеряется в Дж/м2.
Измеряется в Дж/м2.
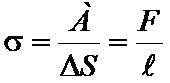 где
A-работа,
затраченная на создание некоторой
поверхности жидкости при постоянной
температуре
S-площадь
поверхности
F-сила
поверхностного натяжения
L-длина
отрезка, на который действует эта сила
где
A-работа,
затраченная на создание некоторой
поверхности жидкости при постоянной
температуре
S-площадь
поверхности
F-сила
поверхностного натяжения
L-длина
отрезка, на который действует эта сила
Поверхностное натяжение зависит от природы жидкости, т.е. от сил притяжения между молекулами данной жидкости и от температуры (с увеличением температуры поверхностное натяжение уменьшается).
С увеличением температуры величина поверхностного натяжения уменьшается и равна нулю при критической температуре.
3) Методы определения поверхностного натяжения. Метод отрыва кольца.
1.Статистические методы- поверхностное натяжение определяется у сформировавшейся поверхности, находящейся в равновесии.
•Метод поднятия в капилляре- Основан на определении высоты столба жидкости h в капилляре радиуса r при полном смачивании;
 =
= 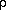 ghr/2,
ghr/2,
 —
плотность жидкости;
—
плотность жидкости;
g — ускорение свободного падения
•Метод Вильгельми- Измеряется усилие, возникающее в процессе отрыва стеклянной пластины от поверхности жидкости
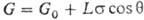 ,
,
где G0— вес сухой пластины, L- периметр сечения
• Метод вращающейся капли
Сущностью метода является измерение диаметра капли жидкости, вращающейся в более тяжелой жидкости. Капля жидкости плотностью r1помещается в трубку с более тяжелой (плотность r2) жидкостью. При вращении трубки с угловой скоростью w капля вытягивается вдоль оси, принимая приближенно форму цилиндра радиуса r. Расчетное ур-ние: |
2.Динамические методы- связаны с разрушением поверхностного слоя.
• Метод Дю Нуи (метод отрыва кольца).
Платиновое
кольцо поднимают из жидкости, смачивающей
его, усилие отрыва и есть сила поверхностного
натяжения и может быть пересчитано в
поверхностную энергию.
Для отрыва
проволочного кольца радиусом R от пов-сти
жидкости требуется сила 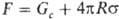
• Сталагмометрический, или метод счета капель
Метод основан на определении объема капли, вытекающей из капилляра с известным радиусом
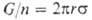 (ур-ние
Тейта),
(ур-ние
Тейта),
где G-общий вес n капель, оторвавшихся под действием силы тяжести от среза капиллярной трубки радиусом r.
• Метод максимального давления пузырька (метод Ребиндера)
При выдавливании пузырька в жидкость через калиброванный капилляр радиусом г перед моментом отрыва давление
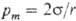
• Метод осциллирующей струи
• Метод стоячих волн
• Метод
бегущих волн 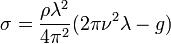 ,
,
где:
σ — поверхностное натяжение;
ρ — плотность жидкости;
λ — длина волны;
ν — вынуждающая частота;
g — ускорение свободного падения.
4) Смачивание и несмачивание. Мениск. Краевой угол.
Смачивание наблюдается в том случае, когда силы взаимодействия между молекулами жидкости и твердого тела больше, чем силы взаимодействия между молекулами самой жидкости (вода и стекло).
Сма́чивание — это поверхностное явление, заключающееся во взаимодействии жидкости с поверхностью твёрдого тела или другой жидкости.
Несмачивание наблюдается в том случае, когда силы взаимодействия между молекулами самой жидкости больше чем силы взаимодействия между молекулами жидкости и твёрдого тела (парафин и вода).
Изогнутую поверхность жидкости называют мениском.
Краевой угол-угол между смачиваемой поверхностью и касательной к поверхности жидкости.
5) Гидрофобные и гидрофильные жидкости. Идеальное смачивание.
Гидрофильность- характеристика интенсивности молекулярного взаимодействия вещества с водой, способность хорошо впитывать воду, а также высокая смачиваемость поверхностей водой.
Гидрофобность-это физическое свойство молекулы, которая «стремится» избежать контакта с водой.
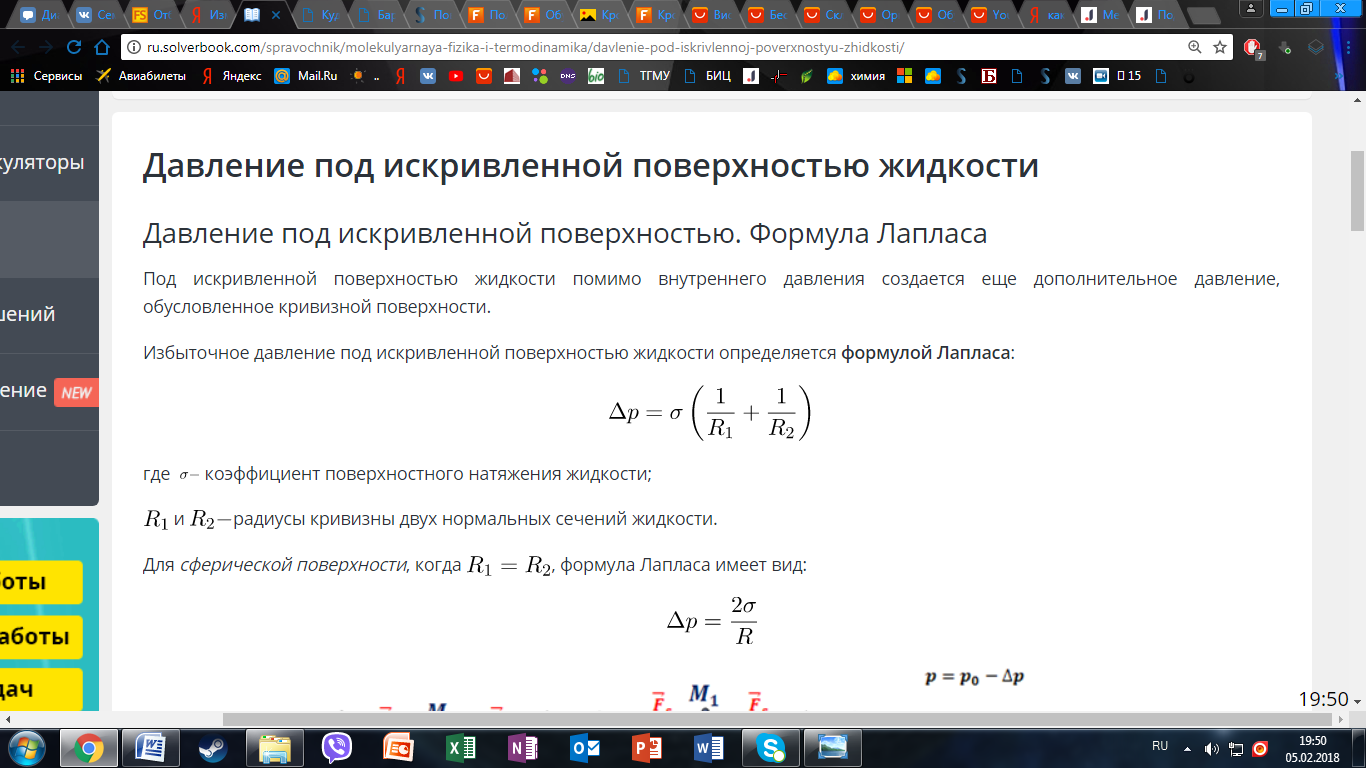
6) Изменение давления под искривленной поверхностью. Формула Лапласа.
Под искривленной поверхностью жидкости помимо внутреннего давления создается еще дополнительное давление, обусловленное кривизной поверхности.
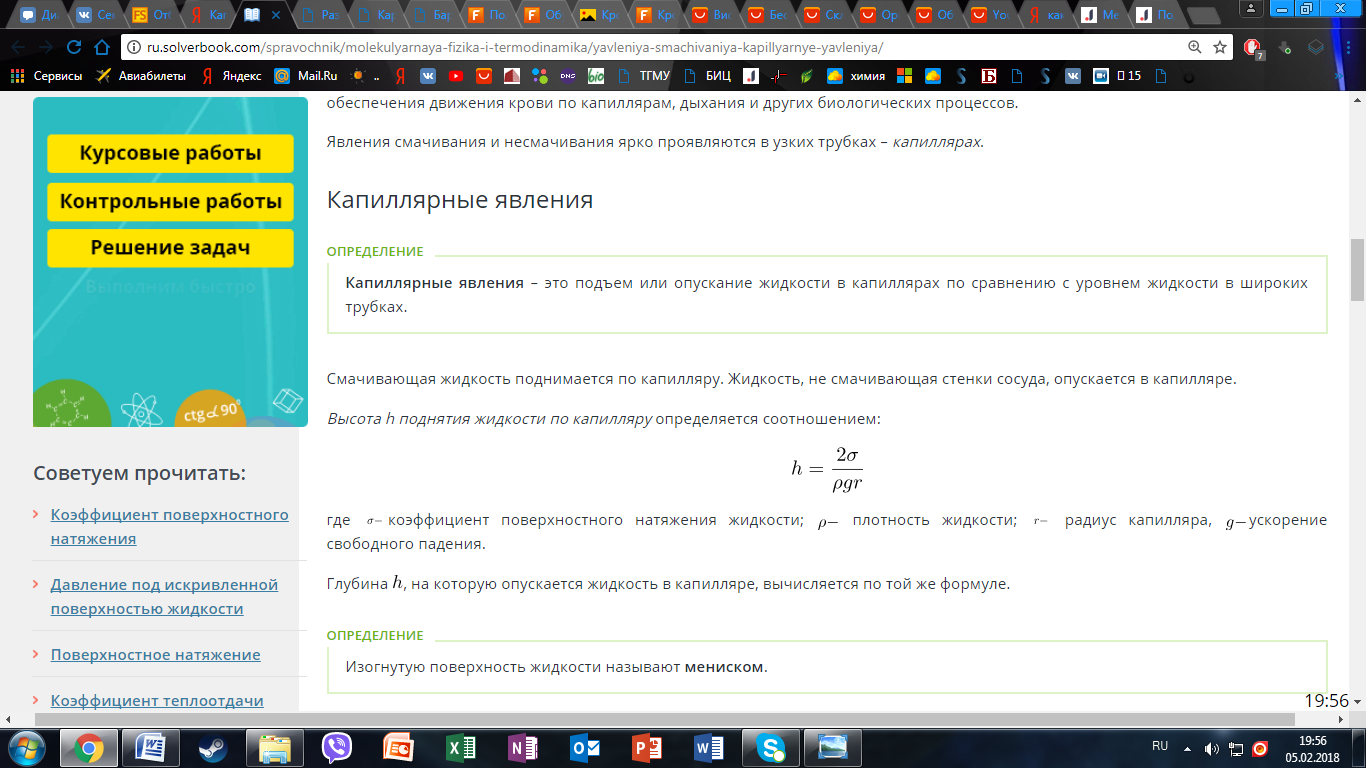
7) Капиллярные явления. Высота поднятия жидкости в капилляре. Формула Жюрена.
Капиллярные явления – это подъем или опускание жидкости в капиллярах по сравнению с уровнем жидкости в широких трубках.
Формула Жюрена- формула, определяющая высоту поднятия жидкости в капиллярах:
Формула
имеет следующий вид: 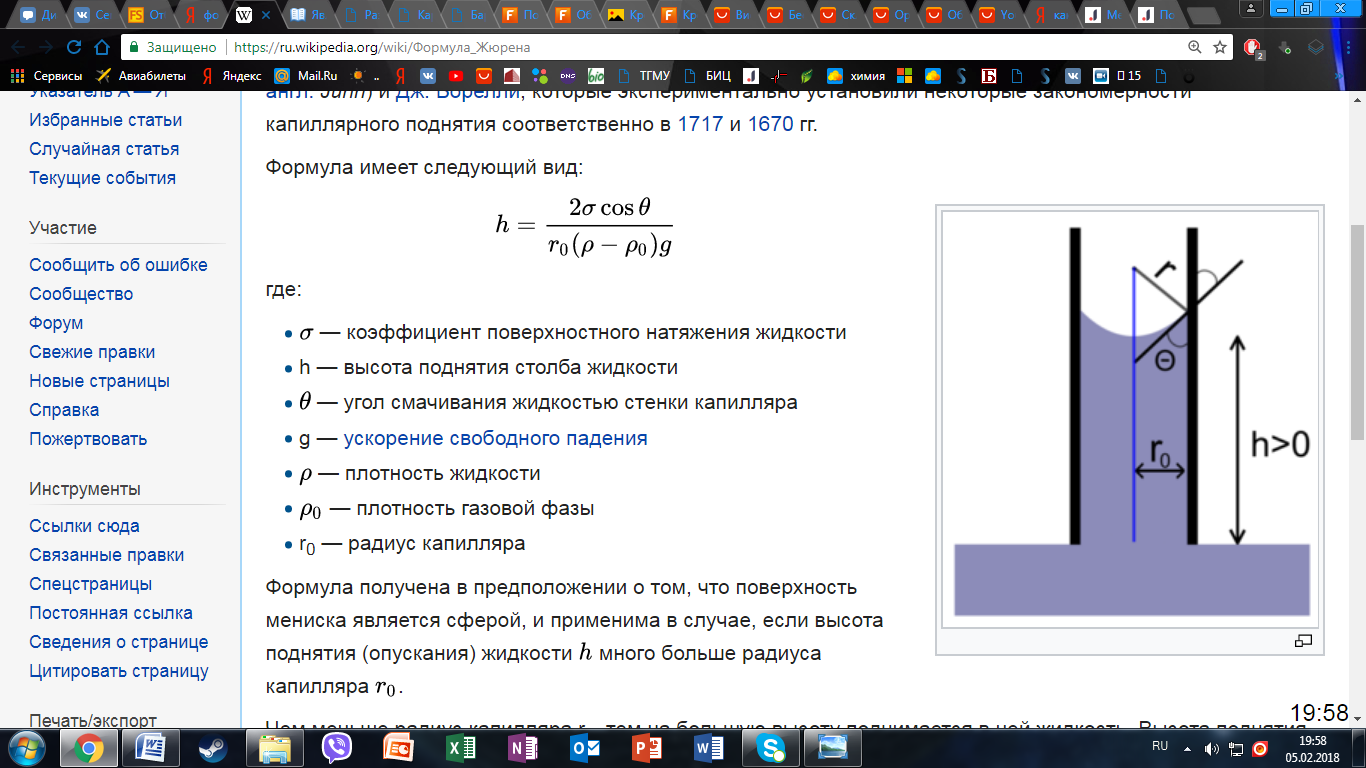
8) Испарение жидкости. Скорость испарения.
Испарение жидкости— фазовый переход жидкого состояния в газообразное.
Скорость испарения— количество жидкости , испаряющейся со свободной поверхности в единицу времени.
9) Кипение жидкости. Точка кипения. Удельная теплота парообразования. Зависимость температуры кипения от давления.
Кипение жидкости— интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
Точка кипения— точка, при которой жидкость кипит.
Удельная теплота парообразования— физическая величина, показывающая , какое количество теплоты необходимо для обращения жидкости в пар при данной температуре и без ее изменения.
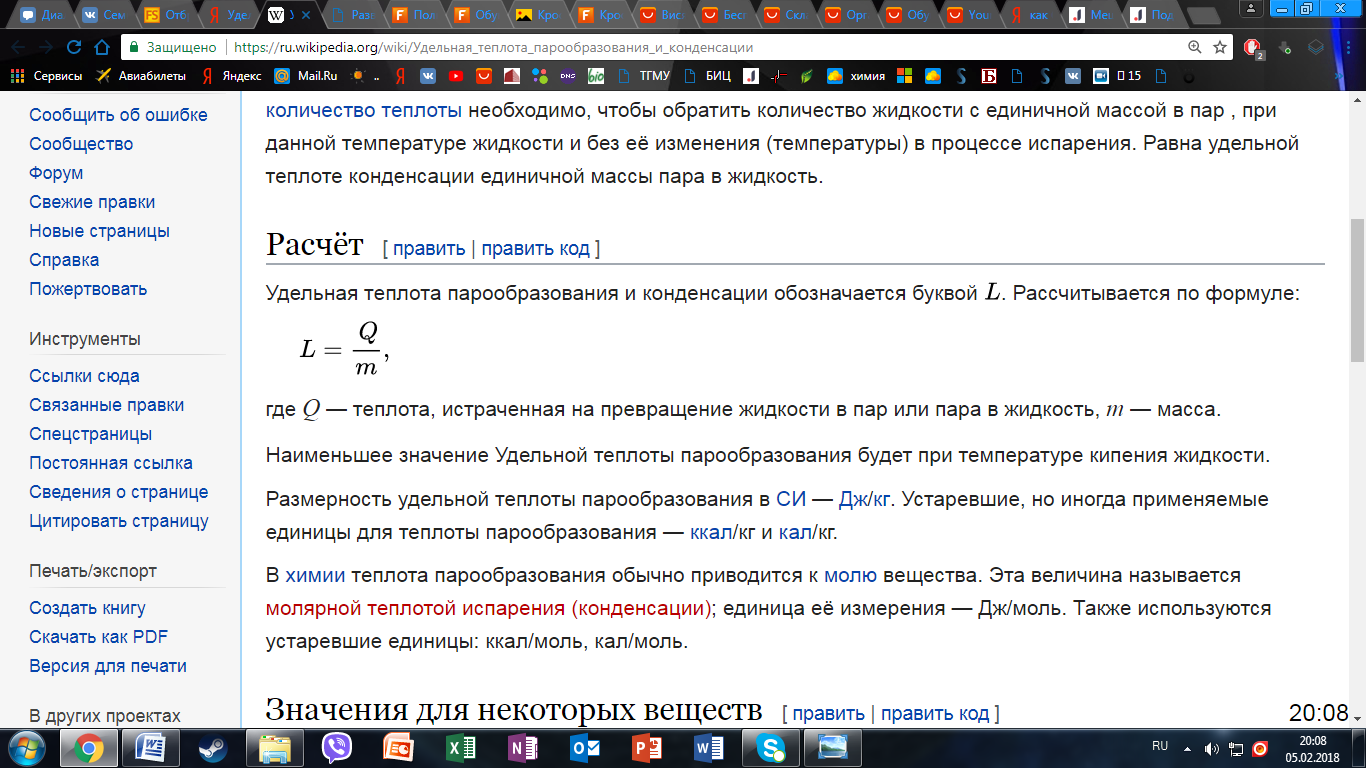
С увеличением температуры удельная теплота понижается; при критической температуре она равна нулю.
Предел тякучести характеризует напряжение , при котором деформации продолжают расти без повышения нагрузки.

