Вода (water)
Вода бесцветная жидкость без запаха и вкуса, регистрационный номер CAS 7732-18-5 молекулярная формула H2O молекулярная масса 18, 0149пл.1.000г/см3. ( анг.water, синонимы монооксид дигидрогена, оксид дигидрогена)
На территории России расположено 120 тыс. рек и 2 млн озёр. Больше совокупные объёмы воды только у Бразилии и то за счёт величайшей реки мира Амазонки. На территории Российской Федерации находится более четверти мировых запасов пресной воды, из которых 23% приходятся на озеро Байкал. Вода представляет собой полезный и жизненно необходимый ресурс. По мере резкого ухудшения качества поверхностных, подземных и атмосферных вод и связанного с этим снижения уровня здоровья населения всего мира в настоящее время происходит всё более широкое использования пресной воды чистых и целебных природных источников, а также вод, специально очищенных от технических и антропогенных загрязнений в расфасованном (бутилированном) виде.
Воду для лабораторных целей (дистиллированную воду) готовят обычно путем перегонки(дистилляции), дополнительной очистки ее от CO2 и других примесей. Для ответственных физико-химических и аналитических исследований пользуются , как правило дважды перегнанной водой (бидистиллатом).
Вода так же образуется при сгорании водорода:
2H2+O2→2H2O
При поджигании смеси 2 объемов водорода с 1 объемом кислорода соединение газов происходит почти мгновенно и сопровождается сильным взрывом, поэтому такую смесь называют гремучим газом.
- Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкость не уменьшается, как у большинства других веществ, а возрастает. При нагревании воды от 0 до 4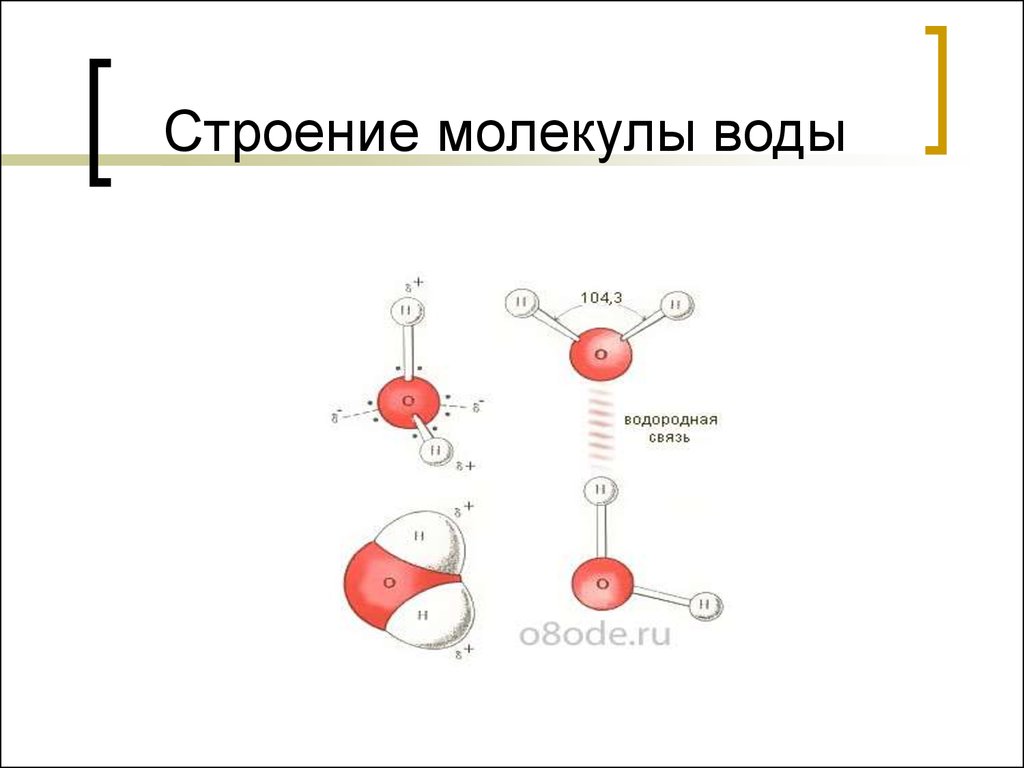 Большое значение в жизни природы имеет тот факт, что вода обладает аномально высокой теплоемкостью(4,18 Дж/(г∙К)). Поэтому в ночное время, а так же при переходе от лета к зиме вода остывает медленно, а днем, или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
Большое значение в жизни природы имеет тот факт, что вода обладает аномально высокой теплоемкостью(4,18 Дж/(г∙К)). Поэтому в ночное время, а так же при переходе от лета к зиме вода остывает медленно, а днем, или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
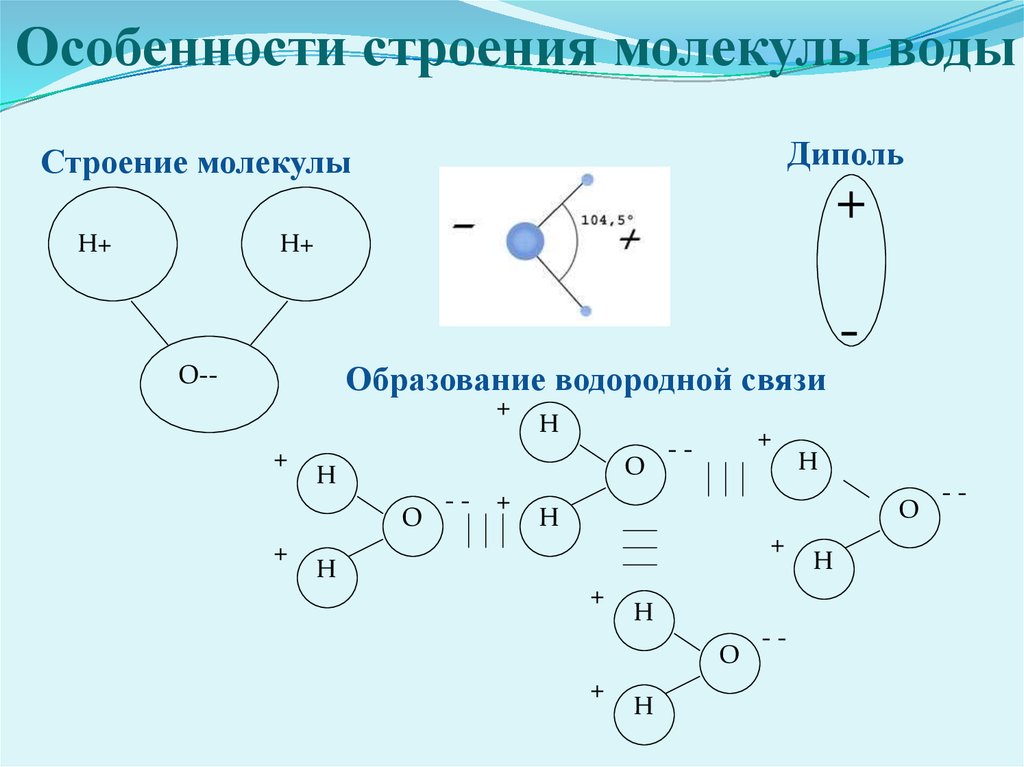
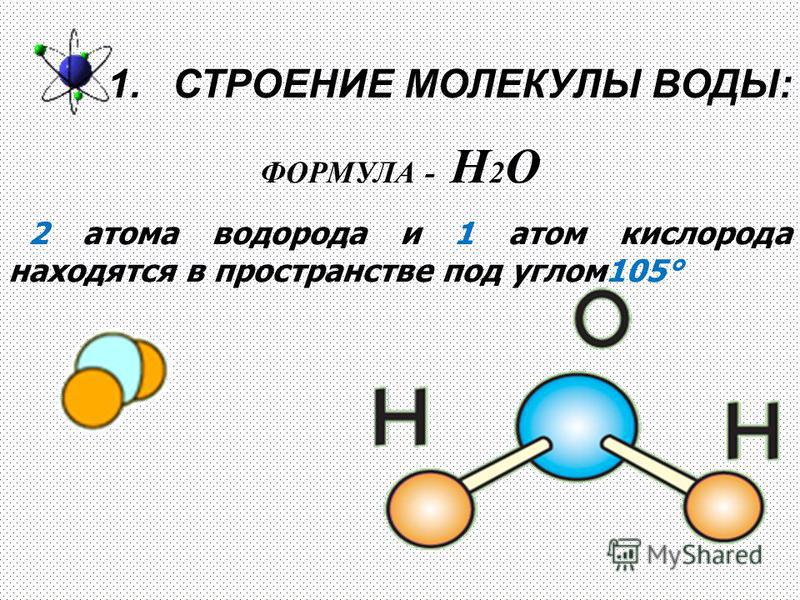
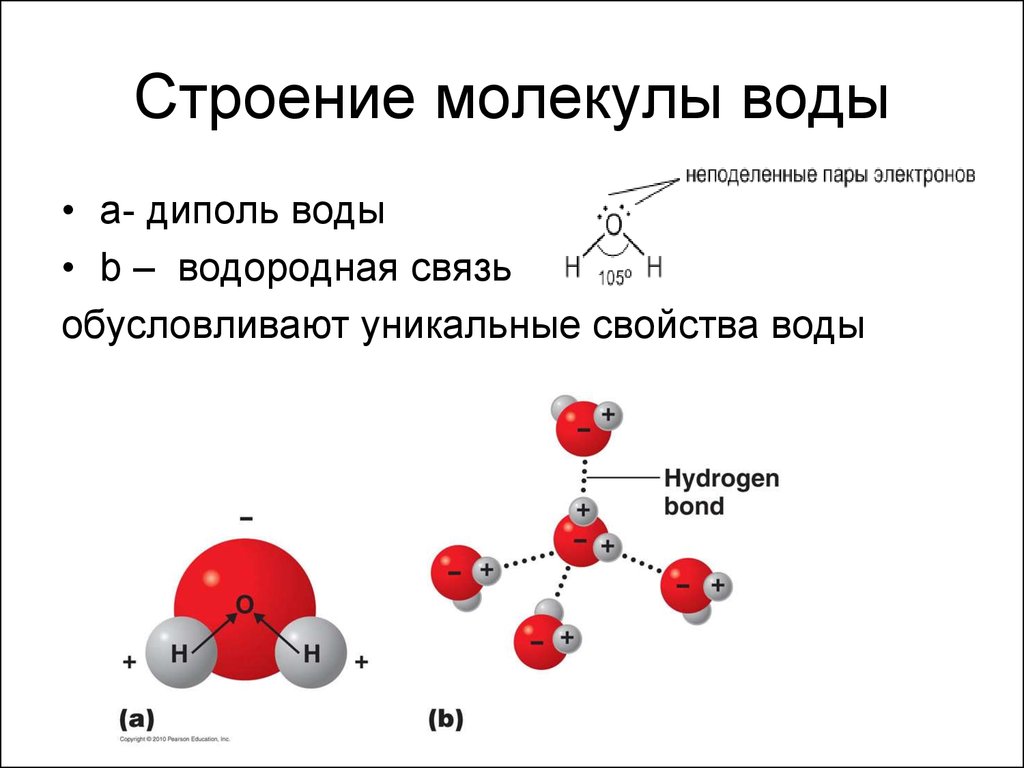
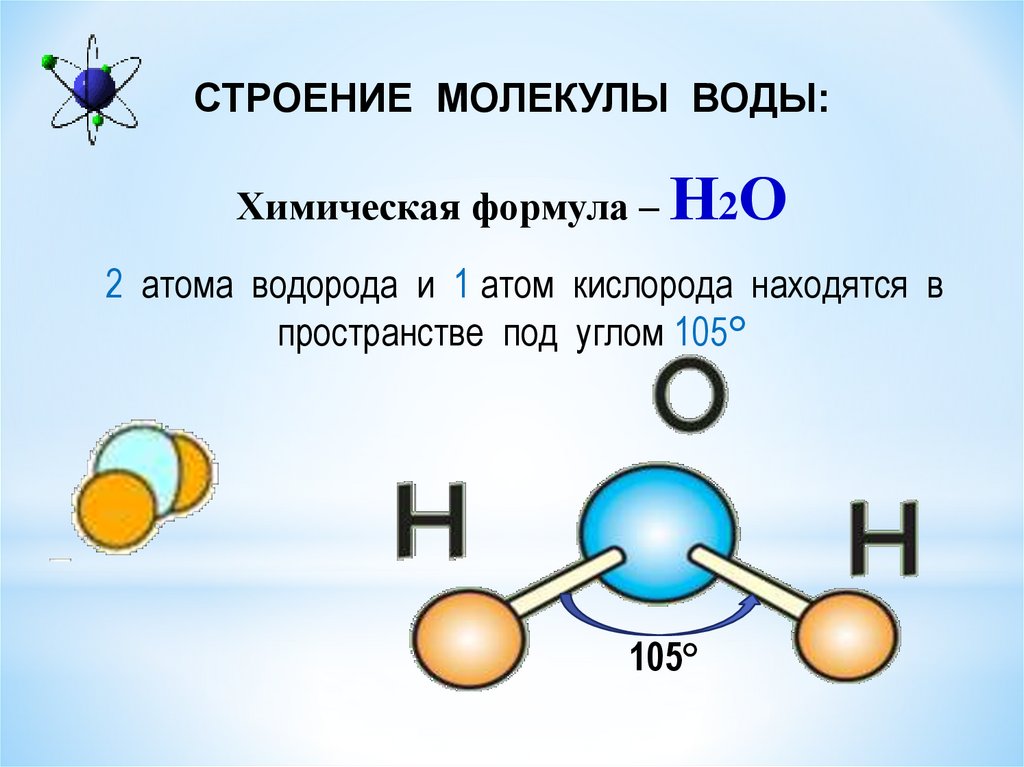
- Строение молекулы воды.
Молекула воды имеет угловое строение; входящие в ее состав ядра, образуют равнобедренный треугольник, в основании, которого находятся два протона, а в вершине—ядро атома кислорода. Межъядерные расстояния О—Н близки к 0.1 нм, расстояние между ядрами атомов, водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слей атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О–Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Молекулярная -масса парообразной воды равна 18 и отвечает ее простейшей формуле.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает. По мере нагревания воды, обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды.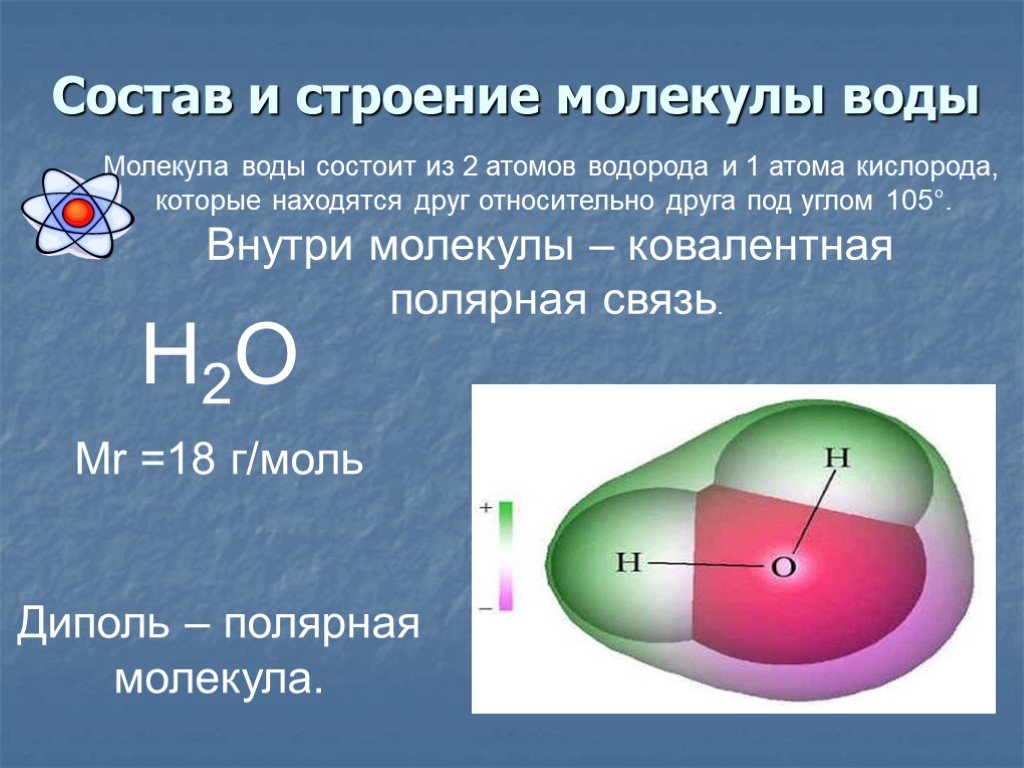
Изотопы воды
Химические свойства воды
Анализ воды, определение pH (Ph питьевой воды)
Ионы воды
Вкус и запах питьевой воды
Анализ дистиллированной воды
Анализ воды очищенной
Полный химический анализ воды
Анализ сточных вод для предприятий
Анализ котловой воды
4.
 2 Химия воды | Межмолекулярные силы
2 Химия воды | Межмолекулярные силыПредыдущий 4.1 Межмолекулярные и межатомные силы | Следующий 4.3 Краткое содержание главы |
4.2 Химия воды (ESBMR)
Видео: 23R8
Микроскопическая структура воды (ESBMS)
Во многих отношениях вода ведет себя совсем иначе, чем другие соединения. Эти свойства
непосредственно связано с микроскопической структурой воды, а точнее с
9{\text{25}}\) молекул
вода.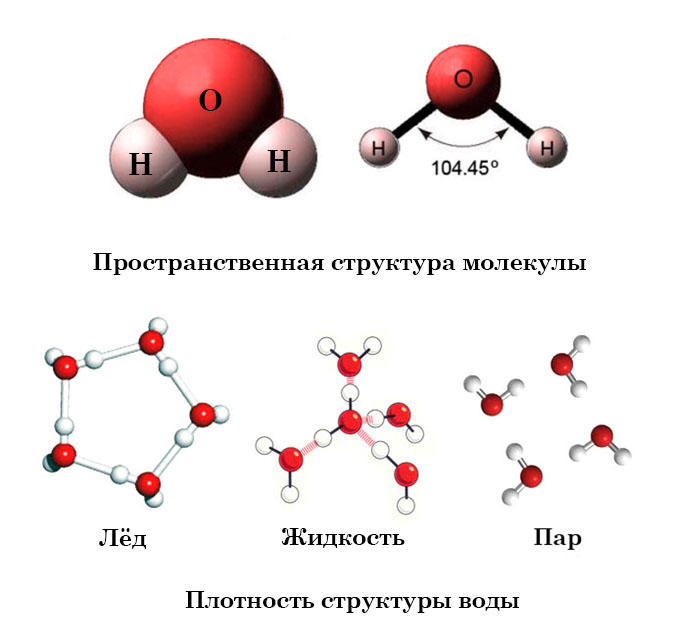 Это очень много молекул воды!
Это очень много молекул воды!
 Водородные связи представляют собой
гораздо более сильный тип межмолекулярных сил, чем те, которые обнаруживаются во многих других веществах,
и это влияет на свойства воды. Рисунок 4.8:
Межмолекулярные и ковалентные связи (межатомные силы) в воде. Обратите внимание, что
диаграмма слева показывает только
Водородные связи представляют собой
гораздо более сильный тип межмолекулярных сил, чем те, которые обнаруживаются во многих других веществах,
и это влияет на свойства воды. Рисунок 4.8:
Межмолекулярные и ковалентные связи (межатомные силы) в воде. Обратите внимание, что
диаграмма слева показывает только Уникальные свойства воды (ЭСБМТ)
Теперь мы рассмотрим некоторые свойства воды.
Удельная теплоемкость
- Удельная теплоемкость

Вода имеет высокую удельную теплоемкость, что означает, что необходимо поглощать много энергии. водой до изменения ее температуры.
Вероятно, вы наблюдали это явление, если кипятили воду в кастрюле. на плите. Металл кастрюли очень быстро нагревается и может обжечься. ваши пальцы, если вы прикоснетесь к ней, в то время как вода может занять несколько минут до того, как его температура повысится даже незначительно. Как мы можем это объяснить с точки зрения водородной связи? Помните, что повышение температуры вещества означает, что его частицы будут двигаться быстрее.

Поглощение инфракрасного излучения
Вода способна поглощать инфракрасное излучение (тепло) солнца. Как результат при этом океаны и другие водоемы действуют как резервуары тепла, а способны помочь смягчить климат Земли.
Это высокая удельная теплоемкость воды и ее способность поглощать инфракрасное излучение, которое позволяет воде регулировать климат.
 Города, расположенные близко к морю, часто имеют менее экстремальные температуры, чем
внутренние города из-за способности океанов поглощать тепло.
Города, расположенные близко к морю, часто имеют менее экстремальные температуры, чем
внутренние города из-за способности океанов поглощать тепло.Температура плавления и кипения
Температура плавления воды равна \(\text{0}\) \(\text{℃}\), а ее кипение точка равна \(\text{100}\) \(\text{℃}\) (при стандартном давлении или \(\text{0,987}\) \(\text{атм}\)). Эта большая разница между температура плавления и кипения очень важны, потому что это означает, что вода может существовать в жидком состоянии в широком диапазоне температур.
 (Этот
диапазон температур велик только в окружающем нас мире, если мы посмотрим на
космос и вселенная, то это очень узкий температурный диапазон.)
(Этот
диапазон температур велик только в окружающем нас мире, если мы посмотрим на
космос и вселенная, то это очень узкий температурный диапазон.)Когда точка кипения воды измеряется на уровне моря (например, в городах как Кейптаун и Дурбан), часто очень близко к \(\text{100}\) \(\text{℃}\), так как атмосферное давление почти такое же, как стандартное давление. Если вы измерите точка кипения воды в городе на большей высоте (напр. Йоханнесбург или Полокване) у него будет чуть более низкая температура кипения. точка.

В классе \(\text{10}\) вы изучали кривую нагревания и охлаждения воды. Это дано ниже.
Рисунок 4.9: Кривые нагрева и охлаждения воды.Высокая теплота парообразования
- Теплота парообразования
Теплота парообразования – это энергия, необходимая для изменения данного количества вещества в газ.
Прочность водородных связей между молекулами воды также означает, что она имеет высокую теплоту парообразования.
 {-1}$}\).
{-1}$}\).Для жизни на Земле очень важно, чтобы вода имела высокую температуру испарение. Можете ли вы представить, какая проблема была бы, если бы тепло воды испарения было намного меньше? Вся вода, из которой состоят клетки наши тела испарились бы, и большая часть воды на Земле исчезла бы. больше не сможет существовать в виде жидкости!
Менее плотная твердая фаза
Другое необычное свойство воды состоит в том, что ее твердая фаза (лед) на меньше плотный , чем его жидкая фаза. Вы можете наблюдать это, если вы положить лед в стакан с водой.
 Лед не опускается на дно
стекло, но плавает поверх жидкости. Это явление также связано
водородные связи между молекулами воды. В то время как другие материалы
сокращаются, когда они затвердевают, вода расширяется. Способность льда плавать
поскольку он затвердевает, это очень важный фактор в окружающей среде. Если лед
затонуло, то со временем все пруды, озера и даже океаны замерзнут
твердеет, как только температура падает ниже точки замерзания, делая жизнь такой, какой мы
знать это невозможно на Земле. Летом только верхние несколько метров
океан бы растаял. Вместо этого, когда глубокий водоем охлаждается,
Плавающий лед изолирует жидкую воду внизу, предотвращая ее
замерзая и позволяя жизни существовать под замерзшей поверхностью.
Лед не опускается на дно
стекло, но плавает поверх жидкости. Это явление также связано
водородные связи между молекулами воды. В то время как другие материалы
сокращаются, когда они затвердевают, вода расширяется. Способность льда плавать
поскольку он затвердевает, это очень важный фактор в окружающей среде. Если лед
затонуло, то со временем все пруды, озера и даже океаны замерзнут
твердеет, как только температура падает ниже точки замерзания, делая жизнь такой, какой мы
знать это невозможно на Земле. Летом только верхние несколько метров
океан бы растаял. Вместо этого, когда глубокий водоем охлаждается,
Плавающий лед изолирует жидкую воду внизу, предотвращая ее
замерзая и позволяя жизни существовать под замерзшей поверхностью.
Антарктида, «замороженный континент», имеет один из самые большие и глубокие пресноводные озера мира. И это озеро спрятан подо \(\text{4}\) \(\text{км}\) льда! Озеро Восток это \(\text{200}\) \(\text{км}\) длинный и \(\text{50}\) \(\text{км}\) шириной. Толстый ледниковый покров льда действует как изолятор, препятствующий замерзанию воды.
Теперь должно быть ясно, что вода представляет собой удивительное соединение, и что без ее уникального свойства, жизнь на Земле определенно была бы невозможна.
Рабочий пример 4: Свойства воды
Объясните, почему вода нагревается долго, а кастрюля, которую вы
при нагревании быстро нагревается.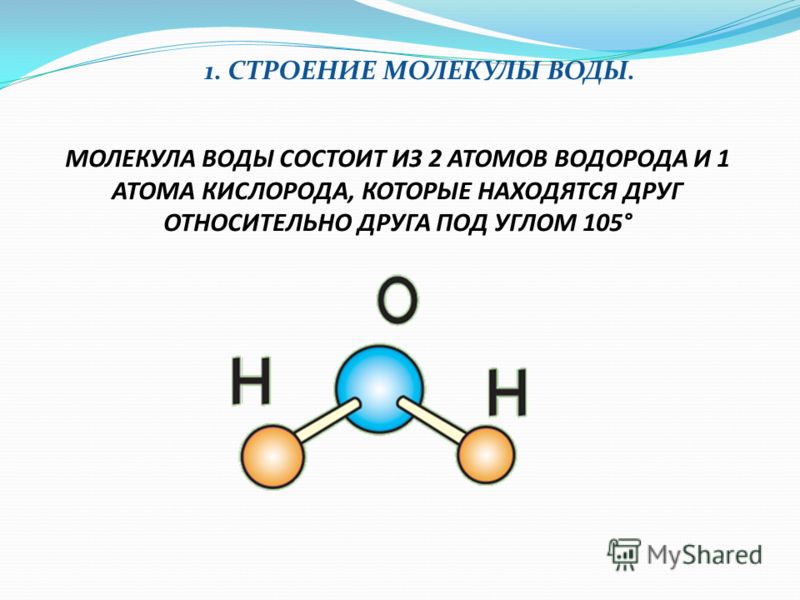
Решите, какое свойство применимо здесь
Нас спрашивают, почему вода нагревается дольше, чем кастрюля, которую вы используете. нагревают его. Свойство, которое применимо здесь, — это высокая удельная тепло воды. Остальные свойства воды здесь не применимы, так как мы сравнивают горшок с водой, и горшок не меняет фазу.
Напишите окончательный ответ
Вода имеет высокую удельную теплоемкость, в то время как металл, из которого сделана
нет. Металлическая кастрюля требует меньше энергии, чтобы нагреться, и поэтому нагревается сильнее.
Быстрее. Вода требует много энергии, чтобы изменить свою температуру, поэтому она
нагревается дольше.
В эту главу включен эксперимент по неформальной оценке. Этот эксперимент очень похоже на межмолекулярные силы. В этом эксперименте учащиеся сосредоточиться на свойствах воды. Это хороший эксперимент, который поможет учащиеся знакомятся со свойствами воды.
При работе с горелками Бунзена учащиеся должны убедиться, что свободная одежда заправлена. прочь и длинные волосы завязаны назад. Как всегда с химическими экспериментами, вы должны откройте все окна, чтобы помещение хорошо проветривалось. В конце экспериментом убедитесь, что все горелки Бунзена выключены.
Если учащиеся оставят стакан с водой на горелке Бунзена на долгое время, и вода
начинает кипеть или наблюдается пар, затем убедитесь, что учащиеся не прикасаются
стакан, как они будут гореть сами.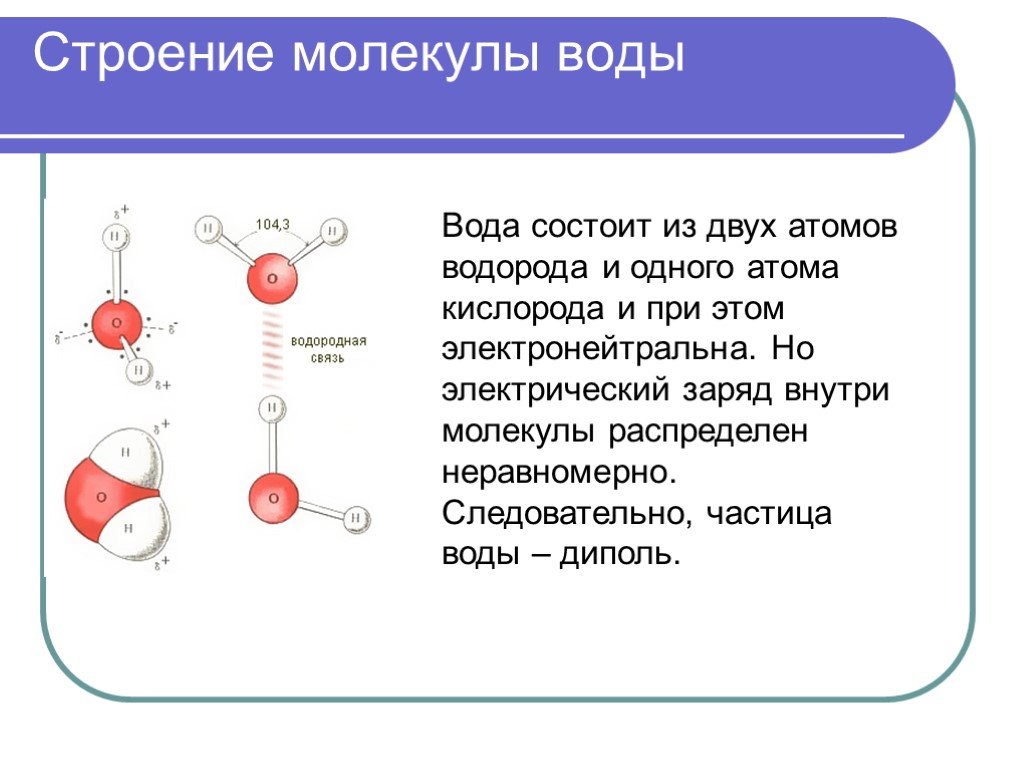
Свойства воды
Цель
Исследовать свойства воды.
Аппарат
- вода
- лед
- мензурки
- четыреххлористый углерод, масло, этанол
- различные твердые вещества (например, хлорид натрия, хлорид калия, хлорид калия марганцовка, йод)
Метод
Налейте в стакан примерно \(\text{100}\) \(\text{мл}\) воды стакан.

Поставьте стакан на подставку и нагрейте его над горелкой Бунзена. около минуты.
По истечении этого времени осторожно коснитесь стенки стакана (Сделайте обязательно слегка коснитесь стекла, потому что оно будет очень жарко и может обжечь вас!). Затем проверьте температуру воды.
Обратите внимание, что происходит, когда вы кладете лед в воду.

Аккуратно слейте воду и четыреххлористый углерод в пробирка. Какие вещества всплывают на поверхность? Попробуйте добавить Сначала вода, затем четыреххлористый углерод. то наоборот. Повторите с маслом и этанолом.
Растворять различные твердые вещества в воде. Наблюдайте, как большая часть каждого твердого вещества (если оно есть) растворяется.

Результаты
Запишите все свои результаты в следующую таблицу.
Недвижимость | Наблюдение |
Температура | |
Лед в воде | |
Четыреххлористый углерод и вода | |
Нефть и вода | |
Этанол и вода | |
Растворимость |
Заключение
Вы должны обнаружить, что стеклянный стакан нагревается быстрее, чем вода.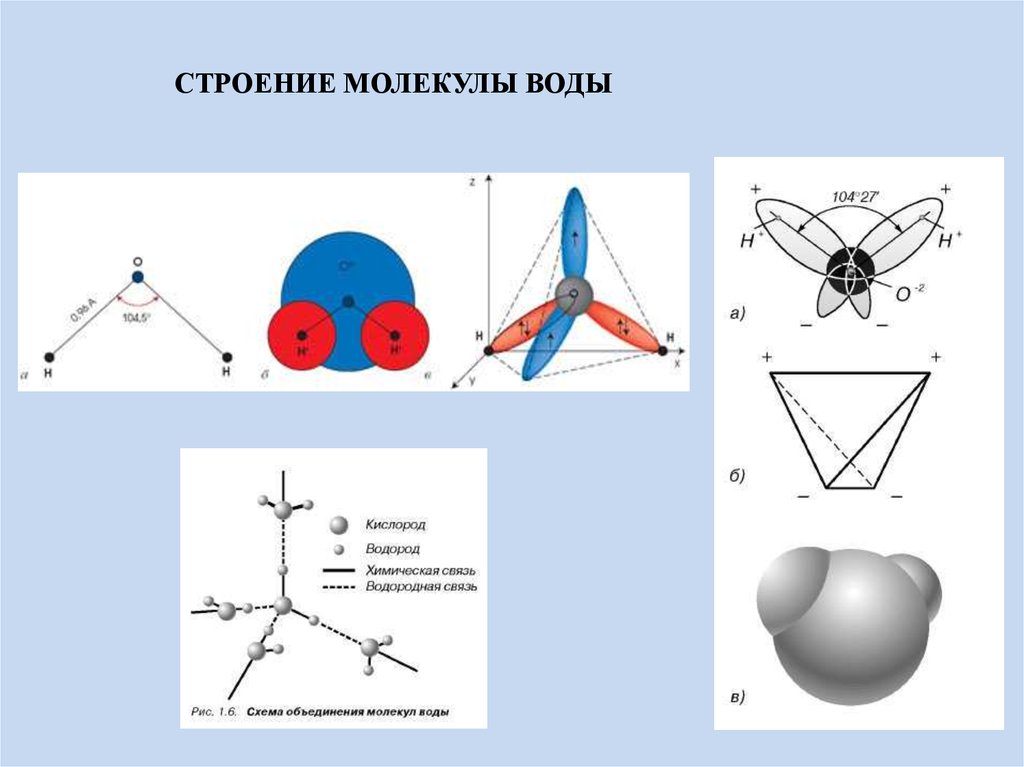 Ты
следует также обнаружить, что вода в жидкой фазе более плотная, чем в
твердая фаза. Вода плавает на одних жидкостях, а другие жидкости плавают на
вода. Вода является хорошим растворителем для полярных и ионных веществ.
Ты
следует также обнаружить, что вода в жидкой фазе более плотная, чем в
твердая фаза. Вода плавает на одних жидкостях, а другие жидкости плавают на
вода. Вода является хорошим растворителем для полярных и ионных веществ.
Как люди использовали свойства воды
Проведите небольшое исследование: сумки для воды на автомобилях, глиняные горшки и графины для воды и безопасные или «прохладные» помещения для хранения продуктов в прохладном месте. Узнайте, какие группы людей использовать эти вещи и как свойства воды помогают в каждом случае.
Свойства воды
Учебник Упражнение 4.3
Какое свойство кубиков льда позволяет им плавать в вода?
Кубики льда менее плотны, чем жидкая вода.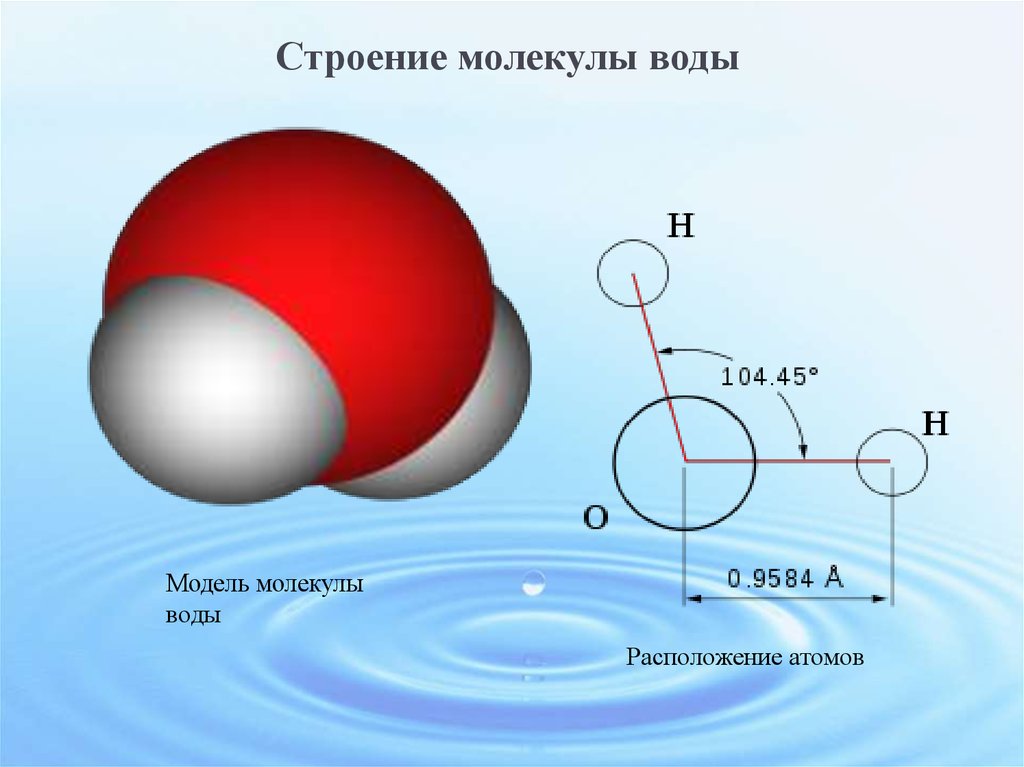 Вода имеет
менее плотная твердая фаза, чем твердая вода.
Вода имеет
менее плотная твердая фаза, чем твердая вода.
Кратко опишите, как это свойство влияет на выживания водных организмов зимой.
Если лед не плавал поверх воды, то все водоемы замерзнут снизу вверх. Это означало бы, что водная жизнь не будет способны пережить холодные зимы, для них не будет среды обитания.
Какие свойства воды позволяют ей оставаться в жидком состоянии
фазы в широком диапазоне температур? Объясните, почему это
имеет важное значение для жизни на Земле.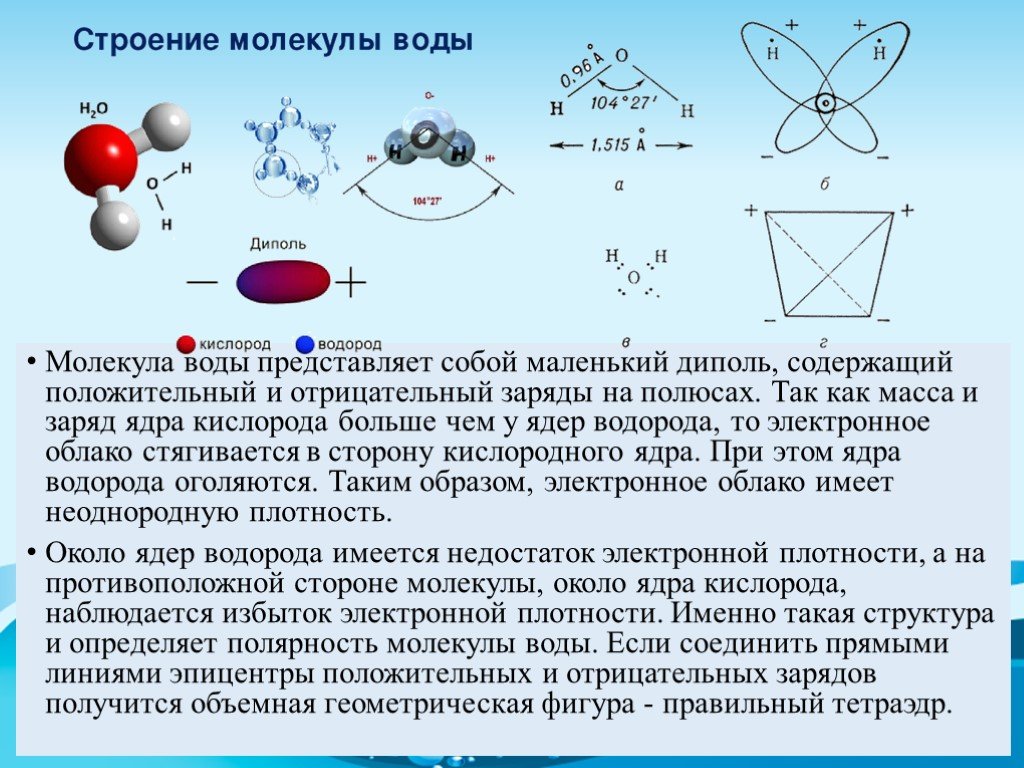
Высокая температура кипения и низкая температура плавления. Вода имеет сильную
водородные связи между молекулами. Эти облигации требуют
много энергии, прежде чем они сломаются. Это ведет к
вода с более высокой температурой кипения, чем если бы
только более слабые диполь-дипольные силы. Вода также имеет высокую
удельная теплоемкость. Если бы у воды не было такого большого диапазона
в котором это жидкость, водоемы замерзнут
быстрее, уничтожая в них жизнь. Также, если
температура кипения воды была ниже, чем у всей воды
может испариться в жаркий день, что повлечет за собой всю жизнь
умереть.
Какое свойство воды позволяет океанам действовать как тепло? резервуары? Какое влияние это оказывает на Землю климат?
Вода способна поглощать инфракрасное излучение (тепло) от солнце. Эта тепловая энергия хранится в океанах. Без этот эффект, тепло от солнца вызовет дневные температуры на Земле станут невыносимыми горячий.
Предыдущий 4.1 Межмолекулярные и межатомные силы | Оглавление | Следующий 4. |
Молекулы воды приобретают гексагональную структуру в наноразмерных пространствах
В статье, опубликованной в Physics Review Letters , Национальные лаборатории Ок-Риджа представляют данные о квантовом состоянии воды, в котором атомы водорода молекулы занимают шесть основных состояний вокруг кислорода одновременно. В результате их классически изогнутая линейная форма трансформируется в шестиугольную структуру с двойной вершиной и практически нулевым дипольным моментом.
Фаза воздействия водорода квантовое туннелирование — вызвано тесным удержанием отдельных молекул воды в пространствах, которые могут соперничать с их размерами. В этом эксперименте молекулы воды ограничены пространствами решетки драгоценного камня берилла, размер которых составляет 5 ангстрем — это примерно ширина 5 атомов. Команда использовала рассеяние нейтронов высокой и низкой энергии, чтобы определить положение атомов водорода.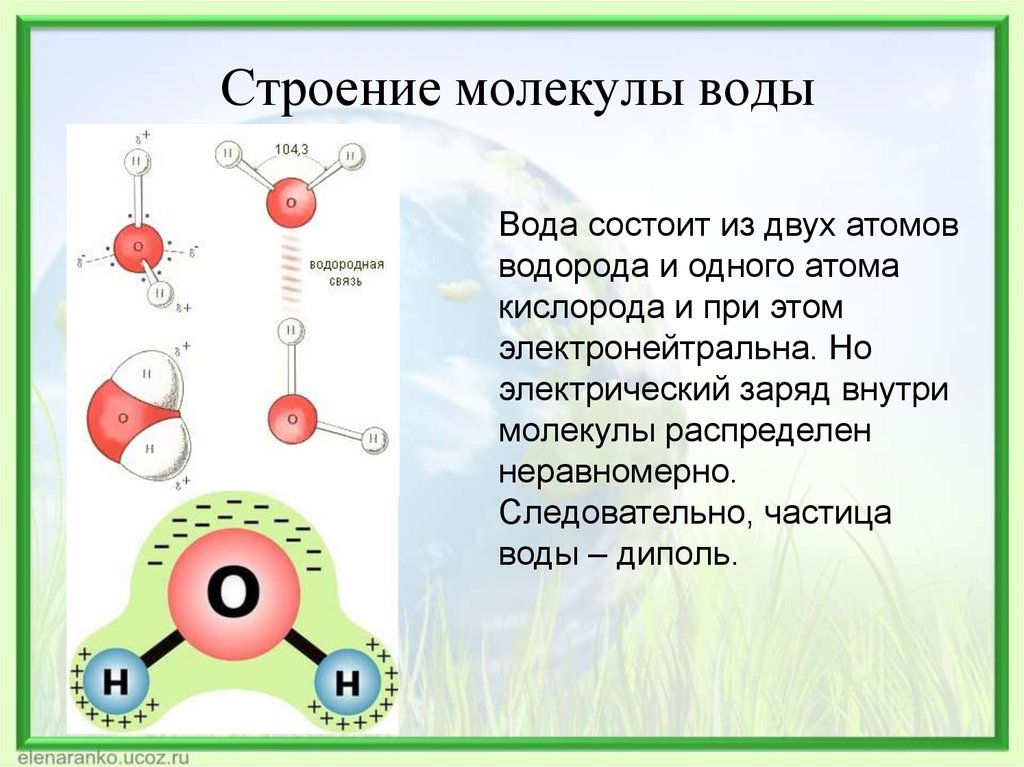 Эксперименты проводились с источником нейтронов расщепления в ORNL и на нейтронной установке в лаборатории Резерфорда Эпплтона в Великобритании.0007
Эксперименты проводились с источником нейтронов расщепления в ORNL и на нейтронной установке в лаборатории Резерфорда Эпплтона в Великобритании.0007
Отчет включает в себя компьютерное моделирование этого нового квантового состояния, которое будет полезно для исследования поведения воды в тесных пространствах, от наноскопических трещин в горных породах до углеродных нанотрубочек и других искусственных наноструктур. Это может привести к новым открытиям в области доставки лекарств в отдельные клетки с помощью наноигл. Из-за нейтральной полярности этих новых молекул вода должна вести себя с окружающей средой совсем иначе, чем в классических системах.
Квантовое туннелирование
Квантовое туннелирование (КТ) описывает способность частицы преодолевать энергетические барьеры, которые, согласно классической физике, иначе были бы невозможны. Это лучше всего объяснить, описывая электрон как волну. В отличие от частиц, абсолютное положение волны определить невозможно; скорее, ее положение может быть выражено как вероятность того, что она существует «здесь» или «там», и, в свою очередь, волна одновременно занимает более одного места.
Также, в отличие от материи, волновые частицы могут распространяться через барьеры, энергетически непроницаемые для материи. Таким образом, хотя квантово-волновая частица может существовать в нескольких положениях, она существует в одном положении, когда наблюдается как частица материи. В свою очередь, наблюдение частицы по ту сторону энергетического барьера становится вероятностью.
Квантовое туннелирование, являющееся причиной многих явлений, широко используется в технологии. Например, по мере того, как транзисторы продолжают экспоненциально уменьшаться, а их барьеры становятся тоньше в соответствии с законом Мура, электроны будут все чаще просачиваться между барьерами транзистора в закрытом состоянии. Ученые могут попытаться минимизировать этот эффект или использовать его, изменяя толщину энергетических барьеров для контролируемого QT.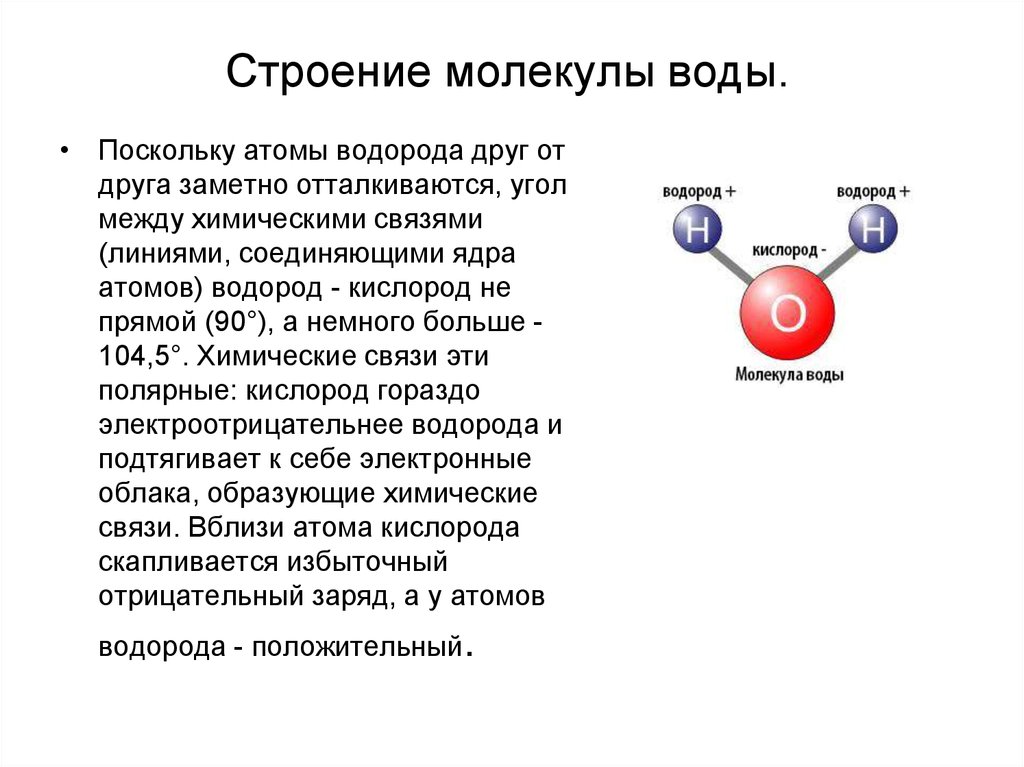
Кроме того, сканирующие туннельные микроскопы используют QT, вводя смещение напряжения, которое заставляет электроны туннелировать от исследуемых атомов к металлическому сканирующему наконечнику. Это генерирует ток, который можно обнаружить для атомной визуализации.
Тем не менее, QT может привести к широкому спектру неожиданных молекулярных конфигураций, даже тех, которые не являются классически и энергетически неблагоприятными. Атомы водорода воды, захваченные в кристаллических каналах берилла, расходятся или «делокализуются» от центрального кислорода, уменьшая энергетический барьер между каждой конфигурацией примерно до 50 мэВ. В свою очередь, два водорода могут легче туннелировать через шесть отдельных основных состояний. Поскольку вероятность занятия каждого пространства одинакова, молекула принимает форму симметричного шестиугольника, причем каждое пространство занято одновременно.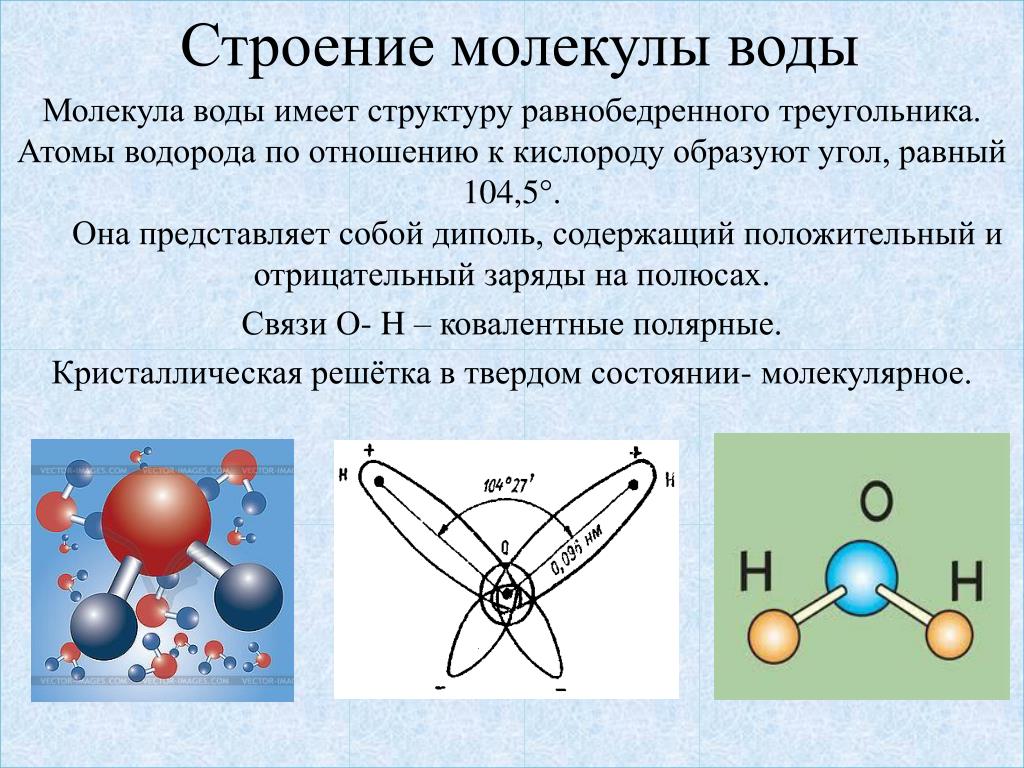



 Города, расположенные близко к морю, часто имеют менее экстремальные температуры, чем
внутренние города из-за способности океанов поглощать тепло.
Города, расположенные близко к морю, часто имеют менее экстремальные температуры, чем
внутренние города из-за способности океанов поглощать тепло.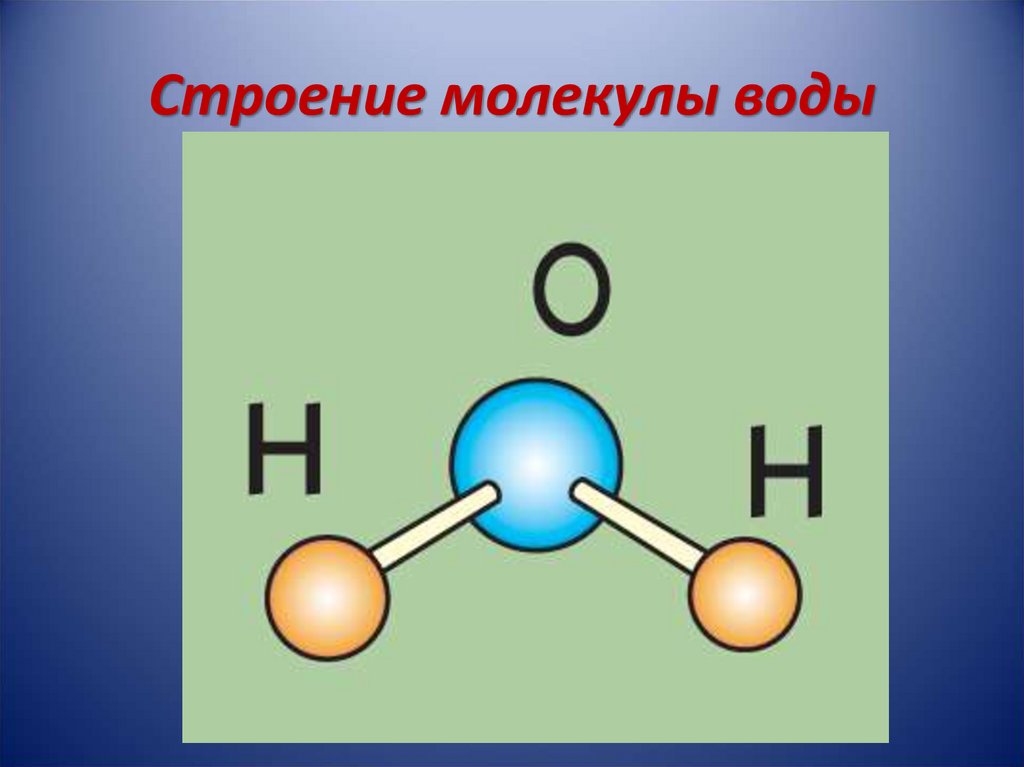 (Этот
диапазон температур велик только в окружающем нас мире, если мы посмотрим на
космос и вселенная, то это очень узкий температурный диапазон.)
(Этот
диапазон температур велик только в окружающем нас мире, если мы посмотрим на
космос и вселенная, то это очень узкий температурный диапазон.)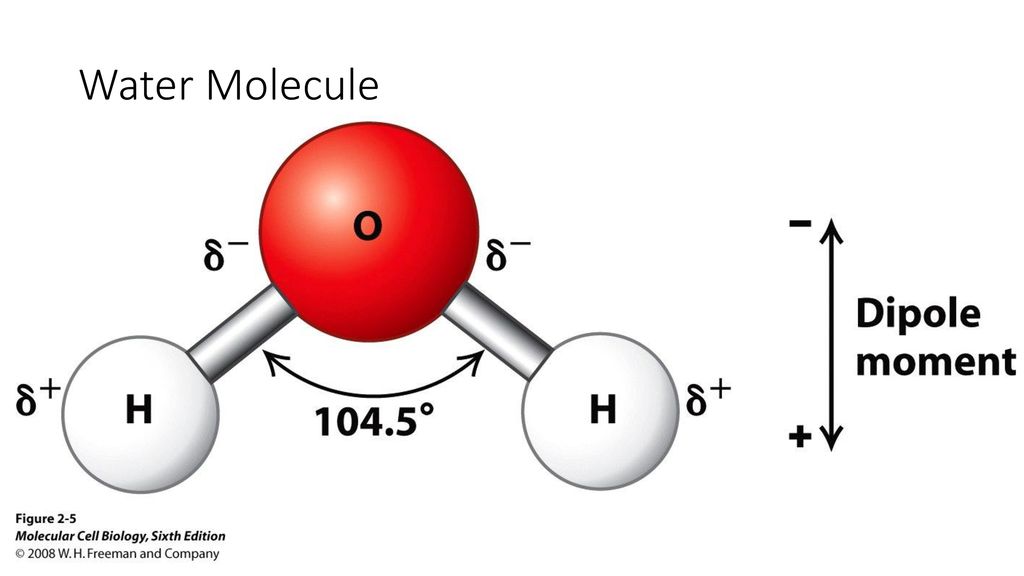
 {-1}$}\).
{-1}$}\).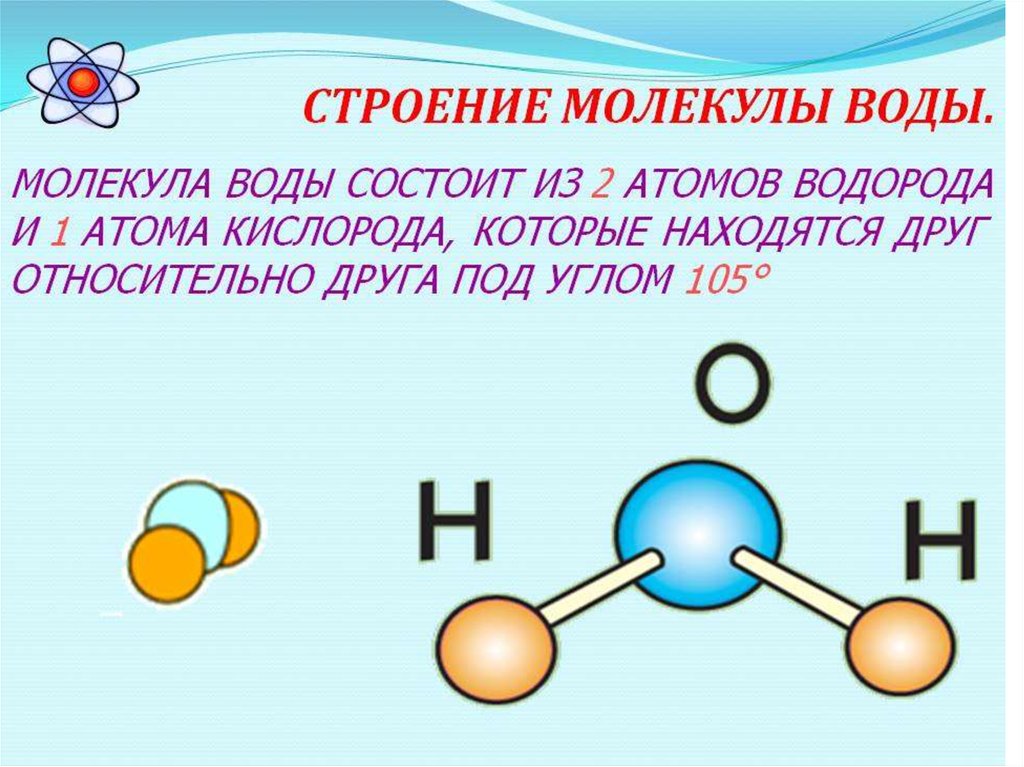 Лед не опускается на дно
стекло, но плавает поверх жидкости. Это явление также связано
водородные связи между молекулами воды. В то время как другие материалы
сокращаются, когда они затвердевают, вода расширяется. Способность льда плавать
поскольку он затвердевает, это очень важный фактор в окружающей среде. Если лед
затонуло, то со временем все пруды, озера и даже океаны замерзнут
твердеет, как только температура падает ниже точки замерзания, делая жизнь такой, какой мы
знать это невозможно на Земле. Летом только верхние несколько метров
океан бы растаял. Вместо этого, когда глубокий водоем охлаждается,
Плавающий лед изолирует жидкую воду внизу, предотвращая ее
замерзая и позволяя жизни существовать под замерзшей поверхностью.
Лед не опускается на дно
стекло, но плавает поверх жидкости. Это явление также связано
водородные связи между молекулами воды. В то время как другие материалы
сокращаются, когда они затвердевают, вода расширяется. Способность льда плавать
поскольку он затвердевает, это очень важный фактор в окружающей среде. Если лед
затонуло, то со временем все пруды, озера и даже океаны замерзнут
твердеет, как только температура падает ниже точки замерзания, делая жизнь такой, какой мы
знать это невозможно на Земле. Летом только верхние несколько метров
океан бы растаял. Вместо этого, когда глубокий водоем охлаждается,
Плавающий лед изолирует жидкую воду внизу, предотвращая ее
замерзая и позволяя жизни существовать под замерзшей поверхностью.

 3 Краткое содержание главы
3 Краткое содержание главы