Вода: строение и свойства | CHEMEGE.RU
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой.
 Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4.
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др. ).
).
Понравилось это:
Нравится Загрузка…
Вода и ее химические свойства
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
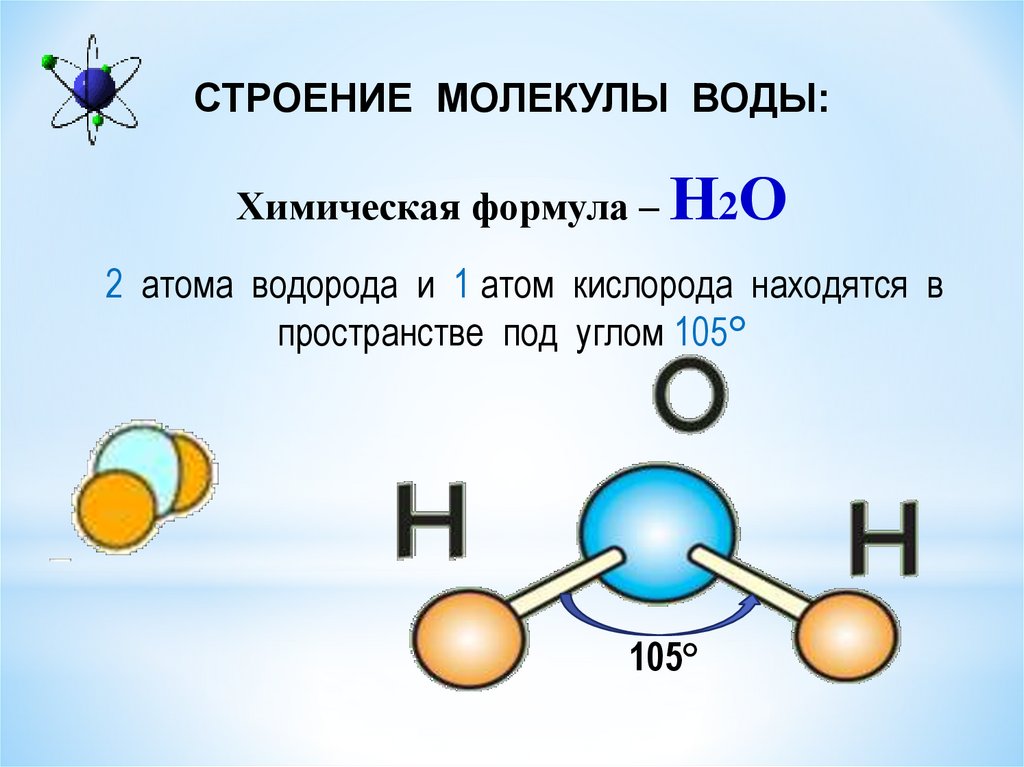
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма. Угол между центром атома кислорода и ядрами водородов составляет 104,50. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Угол между центром атома кислорода и ядрами водородов составляет 104,50. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
-
Биохимические свойства воды.

Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.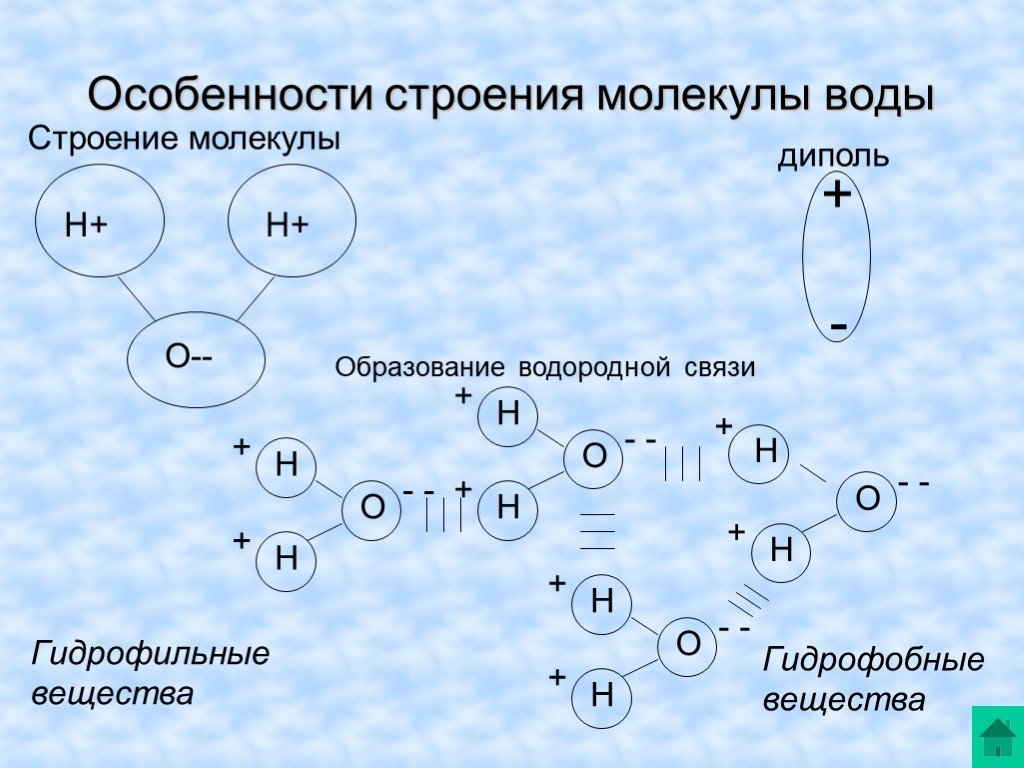
- Вода-растворитель
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
2) Мало растворимые: (гипс, сульфат свинца (PbSO4), бензол (C6
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.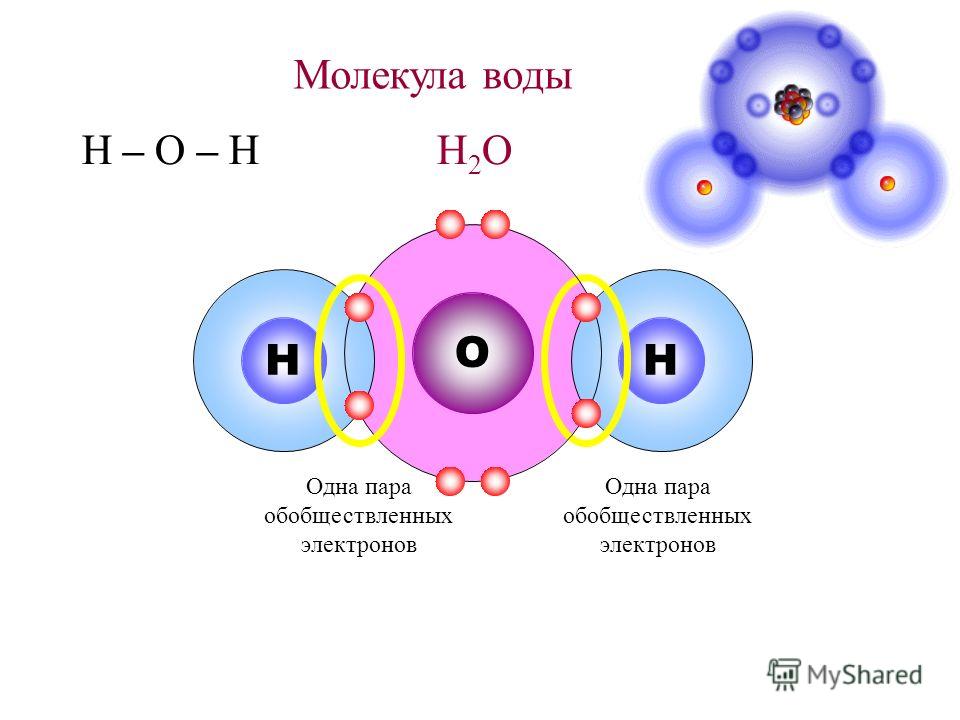
- Вода — активное химическое вещество.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан).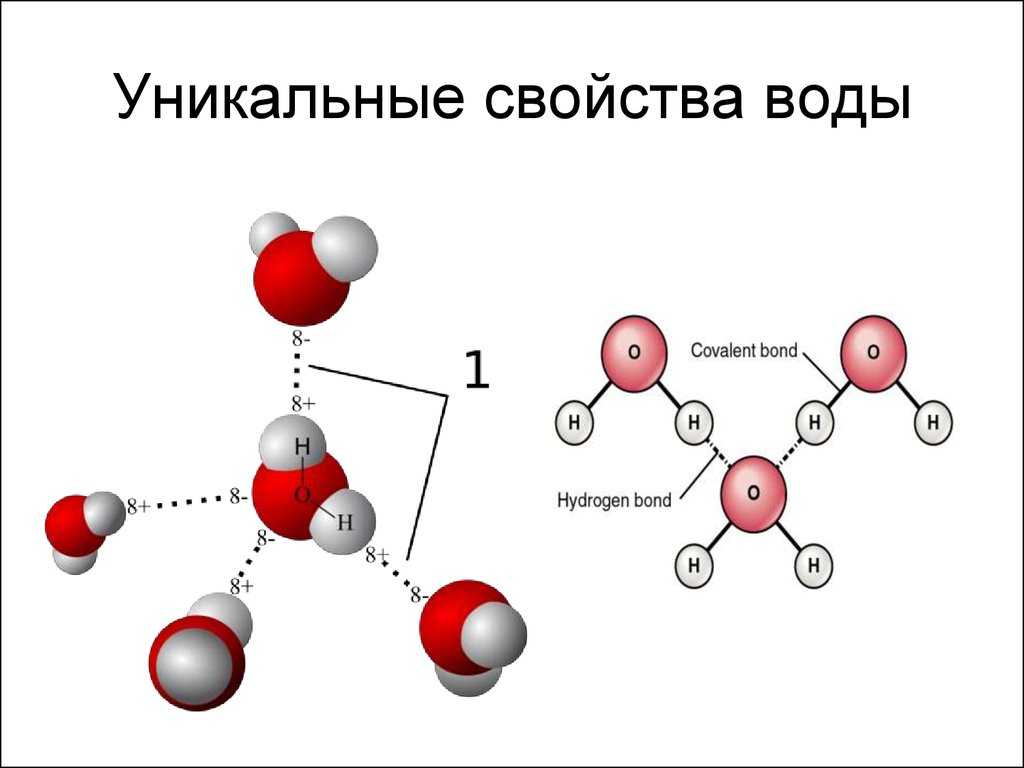 Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
CH4 + 2H2O → 4H2 + CO2(при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
SO2+H2O → H2SO3 — сернистая кислота
SO3+H2O → H2SO4 — серная кислота
CO2+H2O → H2CO3 — угольная кислота
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.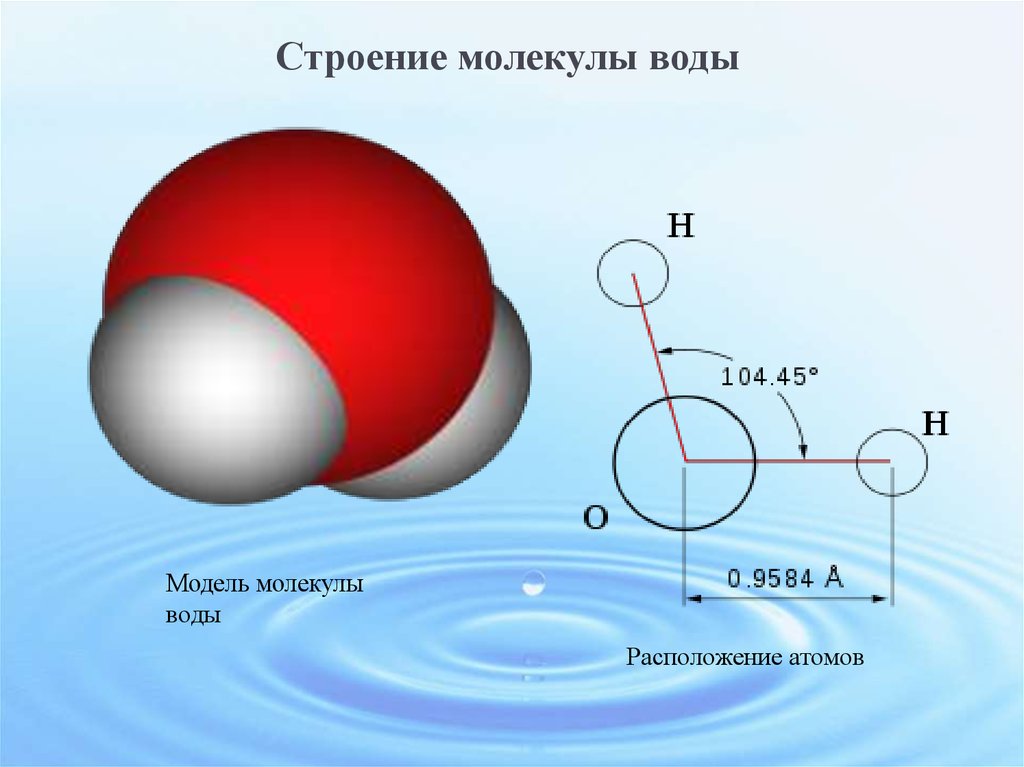
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO2 — это газ. Если струю газообразного оксида углерода (IV) CO2 направить в воду, то часть его раствориться в ней. В этом растворе произойдет химическая реакция соединения и образуется вещество — угольная кислота H2CO3. Собирая углекислый газ над водой, ученый Джозеф Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус.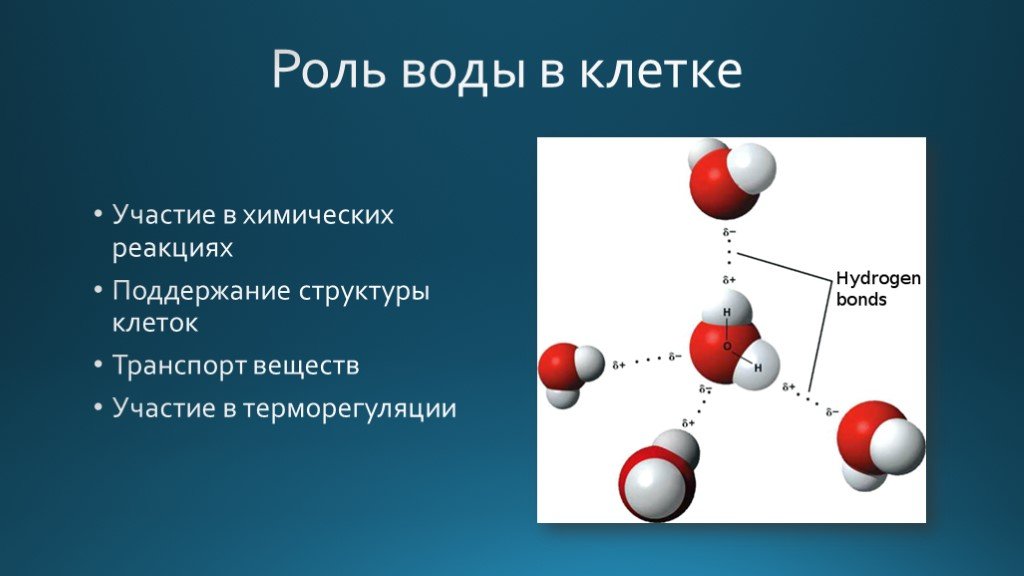 По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
H2SO4 + H2O → H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O → NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.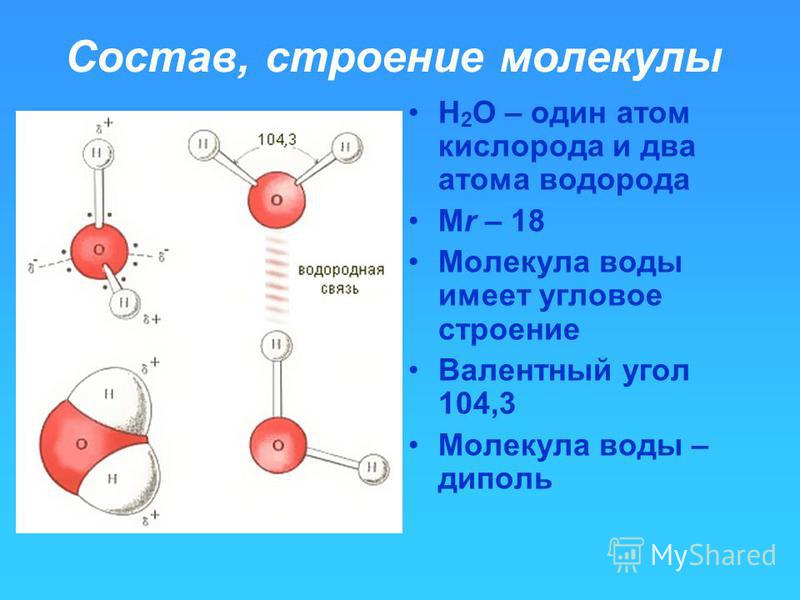
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O → (C6H10O5)n + 6n O2 (при действии света)
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.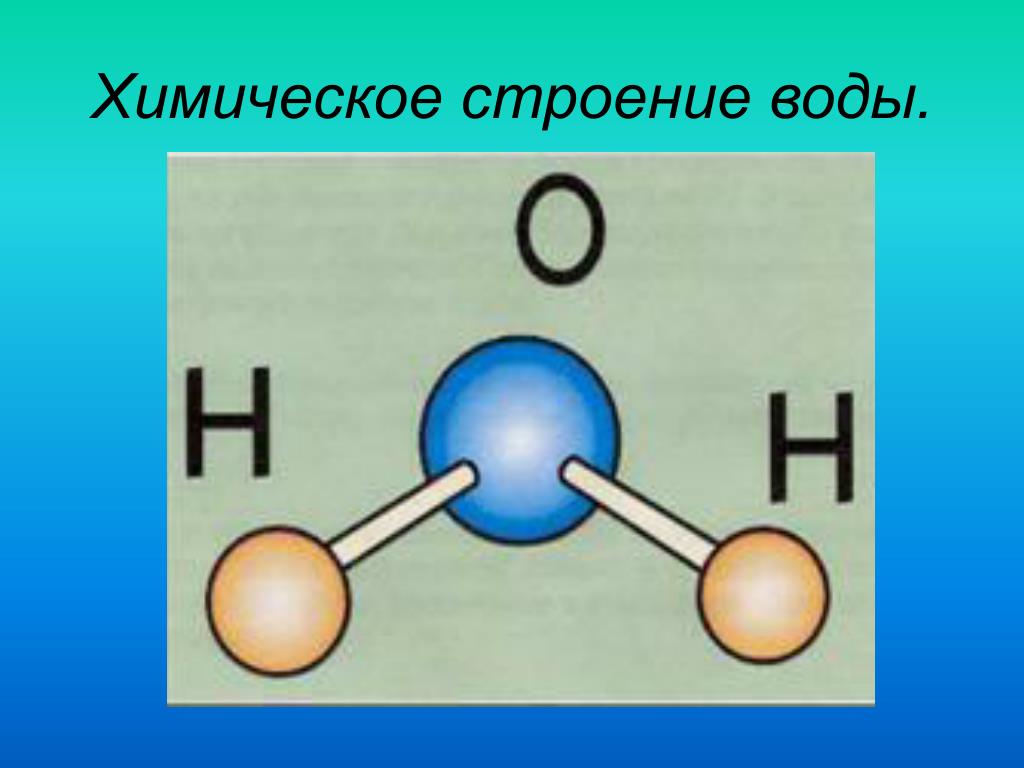
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Анод 2H2O → O2 + 4H+ + 4e–
Катод 4H+ + 4e– → 2H2.
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
- Минерализация воды
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества). Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм3). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
-
Жесткость воды.

Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca2+ и магния Mg2+ (так называемых солей жесткости).
Из-за разного объема различных примесей в воде, она делится на два типа-жесткую и мягкую. Соли попадают в воду из-за того, что часть дождевых вод превращаются в грунтовую воду. Они протекают в недрах Земли, соприкасаются с минералами кальция и магния, вымывая из них мелкие частички. В воде, насыщенной углекислотой, карбонаты калия и магния растворяются, так как превращаются в кислые соли. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обуславливают временную жесткость. При кипячении такой воды гидрокарбонаты разлагаются и выпадают в осадок. Но также существует постоянная жесткость, обуславливая присутствием в природной воде растворимых хлоридов и сульфатом кальция и магния. Жесткость воды количественно выражают числом ммоль эквивалентов (ммоль/экв) ионов кальция Ca2+ и магния Mg2+.
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca2+ и Mg2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2CaCO3 ↓ + H2O + CO2↑
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
- Теория Льюиса
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.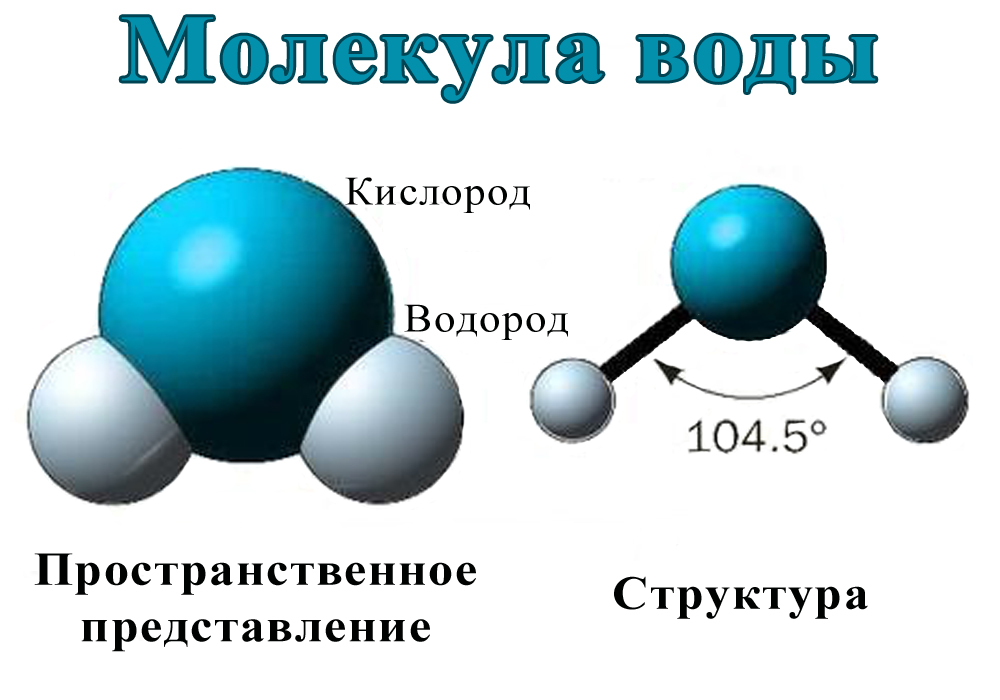
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.
Литература:
- Репетитор по химии / под. Ред. А. С. Егорова. –изд. 58-е- Ростов н/Д: Феникс, 2018
-
Пособие по химии для поступающих в вузы.
 — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
- https://www.syl.ru/article/172000/new_voda-i-ee-svoystva-fizicheskie-i-himicheskie-struktura-vodyi
- http://www.hemi.nsu.ru/ucheb175.htm
- https://ru.wikipedia.org
- https://obrazovaka.ru/himiya/elektroliz-vody-shema-processa.html
- http://www.cawater-info.net/bk/12–7.htm
Вода, что такое вода? О науке, химии и структуре
Вода имеет химическую формулу h3O, состоящую из двух атомов водорода и одного атома кислорода. В науке его часто называют универсальным растворителем. Вода — единственное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях: твердом; жидкость и газ. Вода может принимать разные формы; твердое состояние воды обычно называют льдом или аморфной твердой водой; газообразное состояние известно как водяной пар или пар; а общую жидкую фазу обычно называют просто водой.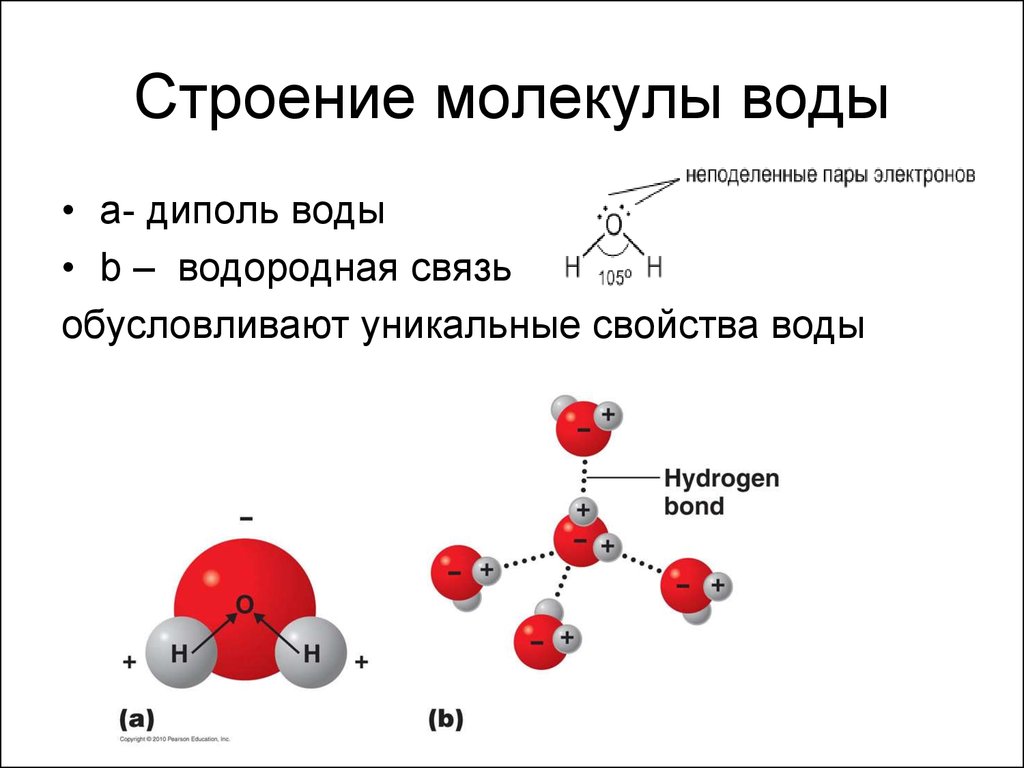
Важной особенностью воды является ее полярная природа. Молекула воды образует угол с атомами водорода на концах и кислородом в вершине. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Молекула с такой разностью зарядов называется диполем. Различия зарядов заставляют молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям) и к другим полярным молекулам. Это притяжение известно как водородная связь и объясняет многие свойства воды. Хотя водородная связь представляет собой относительно слабое притяжение по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Одним из таких свойств является относительно высокая температура плавления и кипения; требуется больше тепловой энергии, чтобы разорвать водородные связи между молекулами. Водородная связь также придает воде необычное поведение при замерзании. При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
При охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, перестраиваясь для минимизации своей энергии, образуют гексагональную кристаллическую структуру льда, которая на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. . Другими словами, вода расширяется при замерзании, тогда как практически все другие материалы сжимаются при затвердевании.
Вода также является хорошим растворителем благодаря своей полярности. Когда ионное или полярное соединение входит в воду, оно окружено молекулами воды. Относительно небольшой размер молекул воды обычно позволяет многим молекулам воды окружать одну молекулу растворенного вещества. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным дипольным концам.
Обычно ионные и полярные вещества, такие как кислоты, спирты и соли, относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, — нет. Неполярные молекулы остаются вместе в воде, потому что молекулам воды энергетически выгоднее связываться водородными связями друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; хлорид натрия, NaCl, разделяется на катионы Na+ и анионы Cl-, каждый из которых окружен молекулами воды. Затем ионы легко переходят из своей кристаллической решетки в раствор. Примером неионогенного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (ОН-группами) и позволяют ему уноситься в раствор.
Растворяющие свойства воды жизненно важны в биологии, поскольку многие биохимические реакции протекают только в водных растворах (например, реакции в цитоплазме и крови).
Неполярные молекулы остаются вместе в воде, потому что молекулам воды энергетически выгоднее связываться водородными связями друг с другом, чем участвовать в ван-дер-ваальсовых взаимодействиях с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; хлорид натрия, NaCl, разделяется на катионы Na+ и анионы Cl-, каждый из которых окружен молекулами воды. Затем ионы легко переходят из своей кристаллической решетки в раствор. Примером неионогенного растворенного вещества является столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (ОН-группами) и позволяют ему уноситься в раствор.
Растворяющие свойства воды жизненно важны в биологии, поскольку многие биохимические реакции протекают только в водных растворах (например, реакции в цитоплазме и крови).
Официальное химическое название (IUPAC)
вода
Ссылки
http://en.wikipedia.org/wiki/Water_%28molecule%29
http://www.dhmo.org/
нажмите на изображение воды выше, чтобы взаимодействовать
с 3D-моделью
Водное сооружение
(откроется новое окно браузера)
Обновление Карла Харрисона
(Молекула месяца для
январь 2006 г.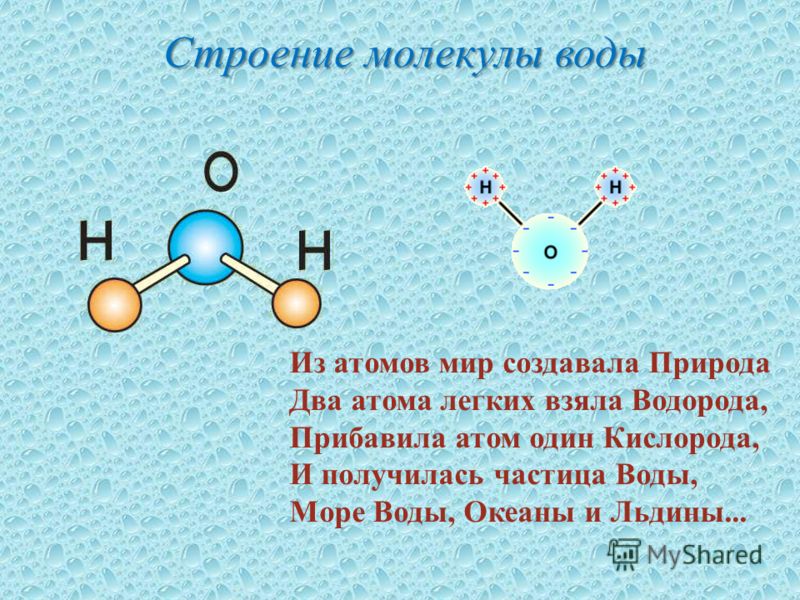 )
)
Все изображения на этом веб-сайте доступны с лицензией Creative Commons Attribution, поэтому их можно использовать до тех пор, пока вместе с изображением указано авторство © Karl Harrison 3DChem.com. Изображения и иллюстрации в высоком разрешении предоставляются по запросу.
Химическая формула воды – структура, свойства, использование, примерные вопросы
Водород (H) обладает уникальными свойствами, которые не похожи на какой-либо другой компонент на нашей планете, около 66% массы нашей Вселенной состоит из этого уникальный компонент. Он является как электроположительным, так и электроотрицательным, поскольку структурирует частицы водорода (H + ), а также частицы гидрида (H – 9).0034). Соединения водорода являются основными окислителями для некоторых синтетических веществ в воздухе и связаны с образцами многочисленных семейств веществ. Водород используется для производства аммиака (NH 3 ).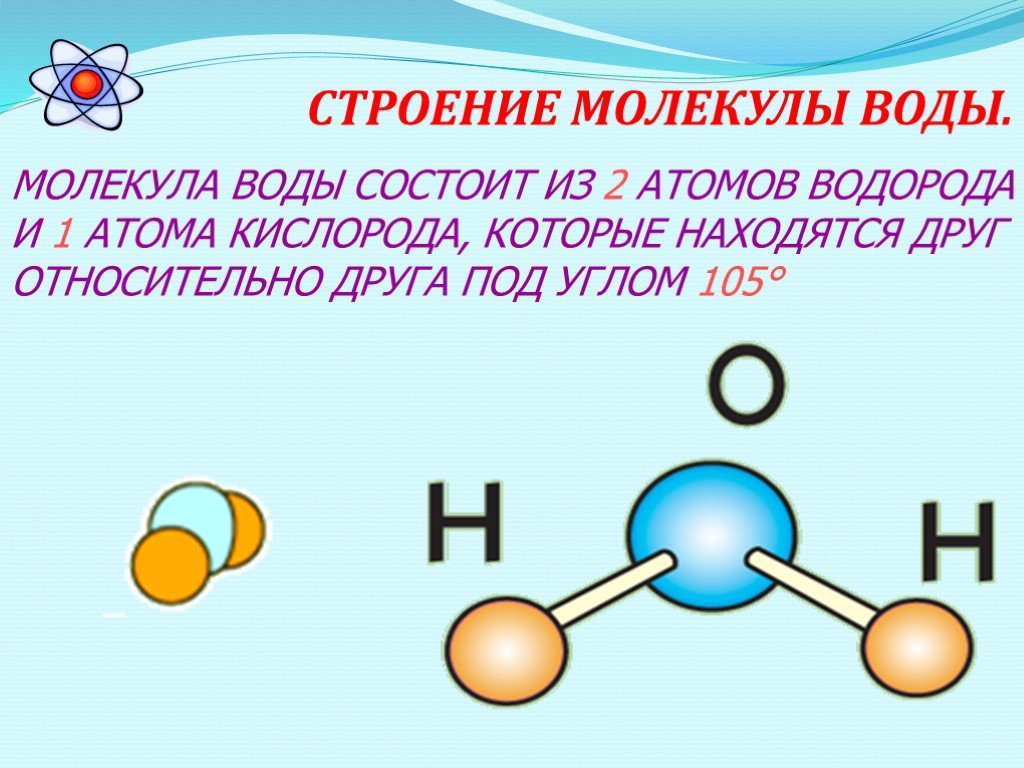
Кислород (O) — химический элемент с атомным номером 8 в периодической таблице. Это очень реакционноспособный неметалл и окислитель, который легко образует оксиды с большинством элементов, а также с другими соединениями.
Вода — самое важное соединение в нашей жизни, необходимое для выживания жизни на нашей планете. В воде содержится два водорода (H) атома и один кислород (O) атома. Между атомами водорода (H) и кислорода (O) существует ковалентная связь. Его называют универсальным растворителем. Это очень полезно в нашей жизни, без которого мы не можем жить.
Химическая формула воды: H 2 O . Его химическое название — монооксид дигидрогена. Его получают
2H 2 + O 2 ⇒ 2H 2 O
Вода содержит один атом кислорода и два атома водорода.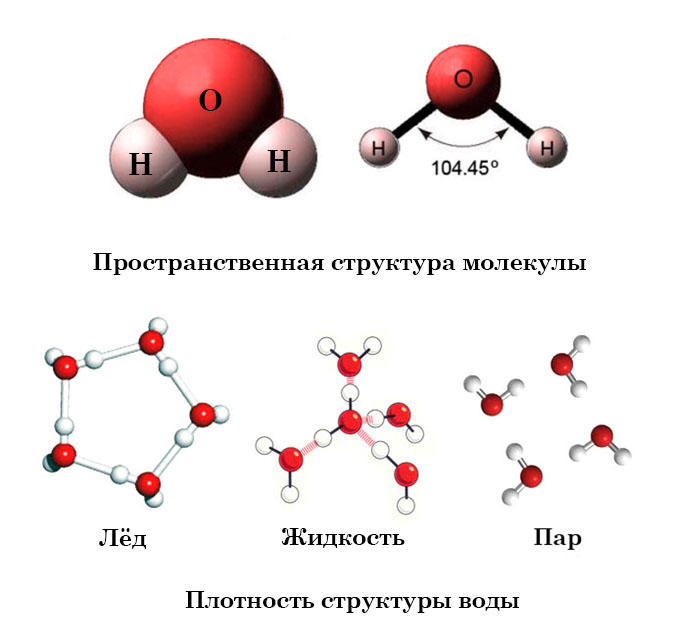 Он имеет ковалентную связь, удерживающую его атомы. Он имеет угловую решетчатую структуру . Вода имеет изогнутую форму или форму V .
Он имеет ковалентную связь, удерживающую его атомы. Он имеет угловую решетчатую структуру . Вода имеет изогнутую форму или форму V .
Физические свойства воды
Некоторые из физических свойств воды:
- Это бесцветная жидкость без запаха и вкуса.
- Молекулярная масса воды 18,01528 г/моль.
- Плотность воды 997 кг/м 3 при 25°С.
- Температура кипения 100°C.
- Температура плавления воды 0°C.
- Может растворять практически любое вещество, поэтому известен как Универсальный Растворитель.
Химические свойства воды
- Вода по своей природе не является ни кислотной, ни щелочной, поэтому она действует и как кислота, и как основание. Так что у него есть способность принимать и отдавать протоны. Когда вода реагирует с соляной кислотой (HCl), мы получаем гидроксоний (H 3 O + ) и хлор (Cl).

H 2 O (л) + HCl (водн.) ⇌ H 3 O + + Cl – .
- Вода может сильно реагировать с ионами солей. Когда вода реагирует с тетрахлоридом кремния (SiCl 4 ), мы получаем диоксид кремния (SiO 2 ) и соляную кислоту (HCl).
SiCl 4 + 2H 2 O → SiO 2 + 4HCl.
- Вода также может реагировать с металлами с высокой электроположительностью, такими как натрий. Получаем Гидроксид натрия (NaOH) и Водород (H 2 ).
H 2 O + Na → 2NaOH + H 2 .
Использование воды
Вода имеет множество применений, некоторые из которых перечислены ниже:
- Она может использоваться для прямых и косвенных целей.

- Используется для питья, приготовления пищи, стирки и купания.
- Используется при обработке древесины для производства бумаги.
- Используется для производства электроэнергии.
- Используется в сельском хозяйстве и ирригации.
- Используется в производстве стали для автомобилей.
- Обладает сильной склонностью к увлажнению.
- Используется в качестве лабораторного реактива.
Часто задаваемые вопросы о воде и ее свойствах
Вопрос 1: Является ли вода полярной или неполярной?
Ответ:
Вода полярна по своей природе, потому что в воде существует разница электроотрицательностей между атомами H и O. Имеет изогнутую форму. Он также не является проводником электричества.
Вопрос 2: Вода имеет ковалентную или ионную связь?
Ответ:
Вода имеет ковалентную связь.
Вода имеет ковалентную связь между водородом и кислородом, которая образует V-образную форму. Это нелинейная молекула.
Вопрос 3: Что происходит, когда вода реагирует с аммиаком?
Answer:
When water reacts with ammonia, we get Ammonium ion (NH + 4 ) and Hydroxide ion (OH – )
H 2 O (l) + NH 3 (водн.) ⇌ NH + 4 + OH –
Вопрос 4: Что происходит, когда вода реагирует с углекислым газом?
Ответ:
При взаимодействии воды с Углекислым газом (CO 2 ), мы получаем Угольную кислоту (H 2 CO 8 3 ).
H 2 O + CO 2 ⟶ H 2 CO 3
Примеры реакций с двумя металлами из 5?
Ответ:
Когда вода реагирует с металлами, мы получаем оксид металла и газообразный водород.


 Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид: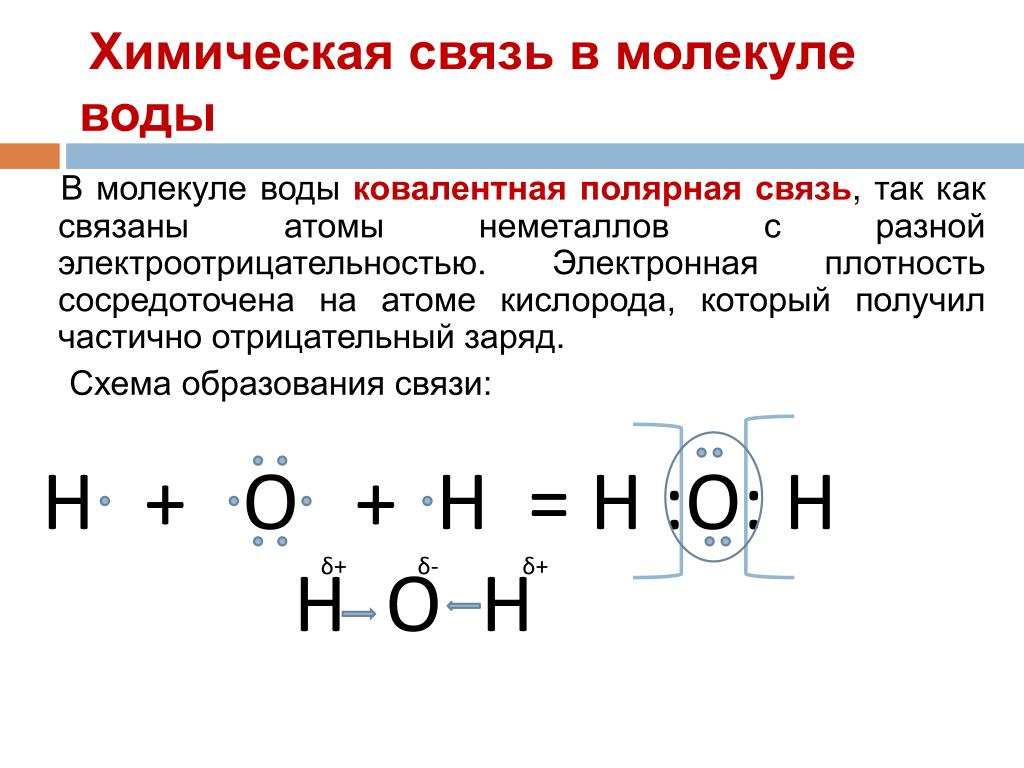
 — 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018
— 4-е изд., испр. и доп. — М.: РИА «Новая волна»: Издатель Умеренков, 2018

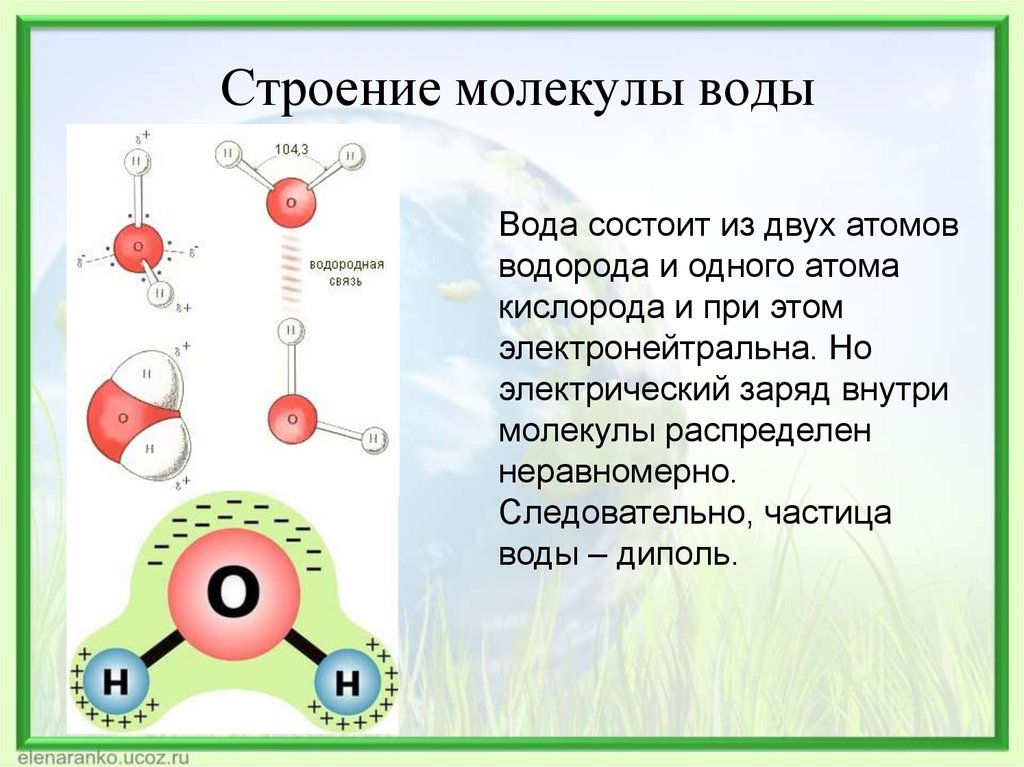
 Вода имеет ковалентную связь между водородом и кислородом, которая образует V-образную форму. Это нелинейная молекула.
Вода имеет ковалентную связь между водородом и кислородом, которая образует V-образную форму. Это нелинейная молекула.